初中化学用语(全)
化学用语集锦
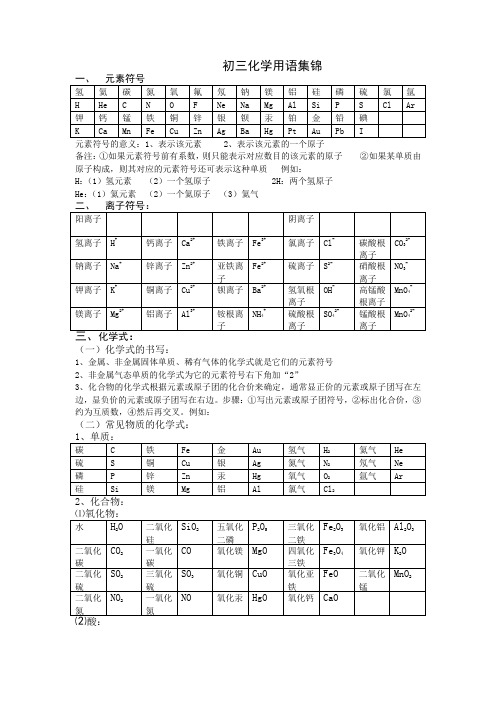
初三化学用语集锦元素符号的意义:1、表示该元素 2、表示该元素的一个原子备注:①如果元素符号前有系数,则只能表示对应数目的该元素的原子②如果某单质由原子构成,则其对应的元素符号还可表示这种单质例如:H:(1)氢元素(2)一个氢原子 2H:两个氢原子He:(1)氦元素(2)一个氦原子(3)氦气(一)化学式的书写:1、金属、非金属固体单质、稀有气体的化学式就是它们的元素符号2、非金属气态单质的化学式为它的元素符号右下角加“2”3、化合物的化学式根据元素或原子团的化合价来确定,通常显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。
步骤:①写出元素或原子团符号,②标出化合价,③约为互质数,④然后再交叉。
例如:(二)常见物质的化学式:其他:过氧化氢 H2O2甲烷 CH4乙醇 C2H5OH 醋酸CH3COOH 葡萄糖C6H12O6尿素 CO(NH2)2O附录一、常见物质的颜色1、固体的颜色2、溶液中离子的颜色3、沉淀的颜色二、火焰的颜色三、离子的共存离子能否共存取决于两种离子相遇后能否生成水、气体或沉淀,如能生成上述物质则离子不能共存。
常见的有:1、H+和OH-会反应会生成H2O2、NH4+和OH-生成NH3和H2O3、H+和CO32-会生成H2CO3,分解后生成H2O和CO2气体4、Ca2+和CO32-会生成CaCO3沉淀,Cu2+、Fe3+与OH-会生成Cu(OH)2、Fe(OH)3沉淀,Ag+与Cl-生成AgCl沉淀,Ba2+与SO42-、CO32-生成BaSO4和BaCO3沉淀。
初中全部化学方程式方程式:4H2O+3Fe 高温Fe3O4+4H2式量: 72 168 232 8描述:赤热的铁跟水蒸气反应生成四氧化三铁和氢气。
方程式:4FeS2+11O2 高温2Fe2O3+8SO2式量: 480 352 320 512描述:燃烧硫铁矿(主要成分是FeS2)生成Fe2O3和SO2方程式:C+O2 点燃CO2式量: 12 32 44 描述:碳在氧气中充分燃烧方程式:S+O2 点燃SO2式量: 32 32 64 描述:硫粉在空气中燃烧方程式:4P+5O2 点燃2P2O5式量: 124 160 284 描述:红磷在空气中燃烧方程式:3Fe+2O2 点燃Fe3O4式量: 168 64 232 描述:铁在氧气中燃烧方程式:2C2H2+5O2 点燃4CO2+2H2O式量: 52 160 176 36 描述:方程式:CH4+2O2 点燃CO2+2H2O式量: 16 64 44 36 描述:甲烷在空气中燃烧方程式:2H2+O2 点燃2H2O式量: 4 32 36 描述:氢气中空气中燃烧方程式:2Mg+O2 点燃2MgO式量: 48 32 80 描述:镁在空气中燃烧方程式:2Cu+O2 △2CuO式量: 127 32 159 描述:铜在空气中受热方程式:4Al+3O2 △2Al2O3式量: 108 96 204 描述:铝在空气中燃烧方程式:2KClO3 △2KCl+3O2↑式量: 245 149 96描述:加热氯酸钾方程式:2KClO3MnO2△2KCl+3O2↑式量: 245 149 96描述:加热氯酸钾(有少量的二氧化锰)方程式:2KMnO4 △K2MnO4+MnO2+O2↑式量: 316 197 87 32 描述:加热高锰酸钾方程式:NH4HCO3 △NH3↑+H2O+CO2↑式量: 79 17 18 44 描述:方程式:Cu2(OH)2CO3 △2CuO+CO2↑+H2O式量: 221 159 44 18描述:加热碱式碳酸铜方程式:2HgO △2Hg+O2↑式量: 434 402 32 描述:方程式:2H2O 电解2H2↑+2O2↑式量: 36 4 64描述:水在直流电的作用下分解方程式:Zn+H2SO4 ZnSO4+H2↑式量: 65 98 161 2描述:锌和稀硫酸方程式:Mg+H2SO4 MgSO4+H2↑式量: 24 98 120 2描述:镁和稀硫酸方程式:Zn+2HCl ZnCl2+H2↑式量: 65 73 136 2描述:锌和稀盐酸方程式:Fe+2HCl FeCl2+H2↑式量: 56 73 127 2描述:铁和稀盐酸方程式:ZnO+2HCl ZnCl2+H2O 式量: 81 73 136 18描述:方程式:8Al+3Fe3O4 点燃9Fe+4Al2O3式量: 216 696 504 408 描述:方程式:Al2O3+3H2SO4 Al2(SO4)3+3H2O 式量: 102 294 342 54描述:方程式:CuO+H2 △Cu+H2O式量: 79.5 2 63.5 18描述:氢气还原氧化铜方程式:CuSO4+2NaOH Na2SO4+Cu(OH)2↓式量: 159.5 80 142 97.5描述:方程式:Fe3O4+4CO 高温3Fe+4CO2式量: 232 112 168 176描述:一氧化碳还原四氧化三铁方程式:Fe2(SO4)3+6NaOH 2Fe(OH)3↓+3Na2SO4式量: 400 240 214 426 描述:方程式:MnO2+4HCl △MnCl2+2H2O+Cl2↑式量: 87 146 126 36 71 描述:方程式:2C2H6+7O2 点燃4CO2+6H2O式量: 60 224 176 108描述:方程式:Cu+4HNO3 Cu(NO3)2+2NO2↑+2H2O 式量: 63.5 252 187.5 92 36描述:方程式:Zn+CuSO4 ZnSO4+Cu式量: 65 159.5 161 63.5描述:方程式:2Al+3H2SO4 Al2(SO4)3+3H2↑式量: 54 294 342 6描述:铝和稀硫酸方程式:C2H4+3O2 点燃2CO2+2H2O式量: 28 96 88 36描述:方程式:2Na+2H2O 2NaOH+H2↑式量: 46 36 80 2描述:方程式:CO2+C 高温2CO式量: 44 12 56 描述:方程式:CuO+CO △Cu+CO2式量: 79.5 28 63.5 44 描述:一氧化碳还原氧化铜方程式:2CO+O2 点燃2CO2式量: 56 32 88 描述:一氧化碳在氧气中燃烧方程式:2CuO+C △2Cu+CO2↑式量: 159 12 127 44 描述:木炭还原氧化铜方程式:2Fe2O3+3C 高温4Fe+3CO2↑式量: 320 36 224 132 描述:焦炭还原氧化铁方程式:CO2+H2O H2CO3 式量: 44 18 62描述:二氧化碳溶解于水方程式:H2CO3 H2O+CO2↑式量: 62 18 44描述:碳酸不稳定而分解方程式:CaCO3 高温CaO+CO2↑式量: 100 56 44描述:高温煅烧石灰石方程式:CaCO3+CO2+H2O Ca(HCO3)2式量: 100 44 18 162描述:方程式:Ca(HCO3)2 CaCO3↓+H2O+CO2↑式量: 162 100 18 44描述:方程式:CaCO3+2HCl CaCl2+H2CO3式量: 100 73 111 62描述:方程式:CaCO3+2HCl CaCl2+H2O+CO2↑式量: 100 73 111 18 44描述:大理石与稀盐酸反应方程式:C+H2O 高温CO+H2↑式量: 12 18 28 2描述:方程式:Na2CO3+2HCl 2NaCl2+H2O+CO2↑式量: 106 73 188 18 44 描述:碳酸钠与稀盐酸反应方程式:C2H5OH+3O2 点燃2CO2+3H2O式量: 46 96 88 54 描述:酒精在空气中燃烧方程式:2CH3OH+3O2 点燃2CO2+4H2O式量: 64 96 88 72 描述:方程式:Fe+H2SO4 FeSO4+H2↑式量: 56 98 152 2描述:方程式:Fe+CuSO4 FeSO4+Cu 式量: 56 159.5 152 63.5描述:方程式:Fe2O3+6HCl 2FeCl3+3H2O式量: 160 219 325 54描述:方程式:Cu(OH)2+2HCl CuCl2+2H2O式量: 97.5 73 134.5 36描述:方程式:AgNO3+HCl AgCl↓+HNO3式量: 170 36.5 143.5 63描述:方程式:Fe2O3+3H2SO4 Fe2(SO4)3+3H2O 式量: 160 294 400 54描述:方程式:Cu(OH)2+H2SO4 CuSO4+2H2O式量: 97.5 98 159.5 36描述:方程式:BaCl2+H2SO4 BaSO4↓+2HCl式量: 208 98 233 73描述:方程式:ZnO+2HNO3 Zn(NO3)2+H2O式量: 81 126 189 18描述:方程式:Mg(OH)2+2HNO3 Mg(NO3)2+2H2O 式量: 58 126 148 36描述:方程式:CuO+H2SO4 CuSO4+H2O式量: 79.5 98 159.5 18描述:方程式:NaOH+HCl NaCl+H2O式量: 40 36.5 58.5 18描述:方程式:2NaOH+CO2 Na2CO3+H2O式量: 80 44 106 18描述:方程式:2NaOH+SO2 Na2SO3+H2O式量: 80 64 126 18描述:方程式:2NaOH+H2SO4 Na2SO4+2H2O式量: 80 98 142 36描述:方程式:NaOH+HNO3 NaNO3+H2O式量: 40 63 85 18描述:方程式:2NaOH+CuSO4 Cu(OH)2↓+Na2SO4 式量: 80 159.5 97.5 142描述:方程式:3NaOH+FeCl3 Fe(OH)3↓+3NaCl式量: 120 162.5 107 175.5描述:方程式:CaO+H2O Ca(OH)2式量: 56 18 74描述:生石灰(CaO)溶于水生成熟石灰Ca(OH)2方程式:Ca(OH)2+SO3 CaSO4+H2O式量: 74 80 136 18描述:方程式:Ca(OH)2+CO2 CaCO3↓+H2O式量: 74 44 100 18描述:方程式:Ca(OH)2+Na2CO3 CaCO3↓+2NaOH 式量: 74 106 100 80描述:方程式:2NaOH+SO3 Na2SO4+H2O式量: 80 80 142 18描述:方程式:Zn+CuSO4 ZnSO4+Cu式量: 65 159.5 161 63.5描述:方程式:Hg(NO3)2+Cu Cu(NO3)2+Hg式量: 325 63.5 187.5 201描述:方程式:NaOH+NH4NO3 NaNO3+NH3↑+H2O 式量: 40 80 85 17 18。
化学用语汇总范文

化学用语汇总范文下面是一些化学用语的汇总:1. 元素(Element):指的是一种由相同类型的原子组成的物质,例如氧气(O2)。
3. 分子(Molecule):由两个或更多原子通过共享或连接的化学键结合而成的化合物。
4. 原子(Atom):由质子(正电荷)和中子(中性)构成核心,围绕核心运动的带有电子(负电荷)的基本粒子。
5. 化学键(Chemical bond):将原子结合在一起的力量。
常见的化学键包括共价键、离子键和金属键。
6. 共价键(Covalent bond):通过共享电子对而形成的化学键,常见于非金属元素之间。
7. 离子键(Ionic bond):由正负电荷之间的吸引力形成的化学键,常见于金属和非金属元素之间。
8. 金属键(Metallic bond):由金属原子之间的电子云形成的化学键,常见于金属元素之间。
9. 反应(Reaction):化学物质之间发生的变化,包括反应物转化为产物和能量的转化。
10. 催化剂(Catalyst):可以加速化学反应速率的物质,但本身在反应过程中不被消耗。
11. 中和反应(Neutralization reaction):酸和碱反应生成盐和水的化学反应。
12. 氧化还原反应(Redox reaction):涉及电子转移的化学反应,包括氧化剂和还原剂的反应。
13. 酸(Acid):以释放氢离子(H+)为特征的化合物,常常具有酸性和呈酸味。
14. 碱(Base):以释放氢氧根离子(OH-)为特征的化合物,常常具有碱性和呈苦味。
15.pH值:用来表示溶液酸碱性的指标。
pH值小于7表示酸性,大于7表示碱性,等于7表示中性。
16. 摩尔质量(Molar mass):一个化学物质的摩尔质量是以克/摩尔(g/mol)来表示的,等于该物质的质量除以摩尔数。
17. 摩尔数(Mole):化学反应中物质的计量单位,表示化学物质的数量。
18. 反应速率(Reaction rate):化学反应中物质转化的速度。
初中化学用语(全)
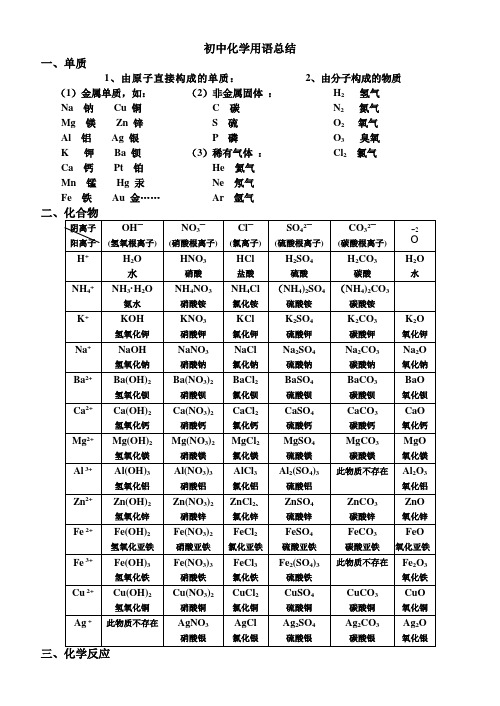
初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg 汞Fe 铁Au 金……(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+2、红磷燃烧: 五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧: 二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+ 4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧: 氧化铝氧气铝点燃−−→−+ 322O Al 2O 34Al 点燃+7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+8、氢气的燃烧: 水氧气氢气点燃−−→−+ O H 2O 2H 222点燃+ 9、木炭燃烧: 二氧化碳氧气碳点燃−−→−+ 22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+ 11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+12、二氧化碳溶于水:碳酸水二氧化碳→+13、生石灰遇水反应:氢氧化钙水氧化钙→+(二)、分解反应:“一变多”1、氧化汞加热分解: 氧气汞氧化汞加热+−−→− ↑+2O Hg 2Og H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 23、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→−4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→− ↑+↑222O H 2O2H 通电6、碳酸分解: 二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→− ↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→− ↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+ 金属活动顺序:3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+ 9、 铝与稀硫酸反应:氢气硫酸铝稀硫酸铝+→+10、铁与稀硫酸反应:氢气硫酸亚铁稀硫酸铁+→+11、铝与硫酸铜反应:铜硫酸铝硫酸铜铝+→+12、铁与硫酸铜反应:铜硫酸亚铁硫酸铜铁+→+13、铁与氯化铜反应:铜氯化亚铁氯化铜铁+→+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银硝酸钾硝酸银氯化钾+→+2、盐酸与硝酸银反应:氯化银硝酸硝酸银盐酸+→+3、氧化铜与硫酸反应:水硫酸铜硫酸氧化铜+→+4、氧化镁与硫酸反应:水硫酸镁硫酸氧化镁+→+5、氧化铁与盐酸反应:水氯化铁盐酸氧化铁+→+6、盐酸与氢氧化钠反应:水氯化钠氢氧化钠盐酸+→+7、硫酸与氢氧化钠反应:水硫酸钠氢氧化钠硫酸+→+ 8、硝酸与氢氧化铜反应:水硝酸铜氢氧化铜硝酸+→+9、氯化钡与硫酸反应:水硫酸钡硫酸氯化钡+→+ 9、氯化钡与碳酸钠反应:氯化钠碳酸钡碳酸钠氯化钡+→+10、氢氧化钠硫酸铜反应:硫酸铜氢氧化铜硫酸铜氢氧化钠+→+11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应: 1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯22dP t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁:二氧化碳铁一氧化碳氧化铁高温+−−→−+ 232CO 32Fe COO e F ++高温6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+ 2CO u C COCuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+(NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O + NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+。
初中化学必背知识点打印版

初中化学必背知识点打印版一、化学用语。
1. 元素符号。
- 前20号元素:氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)、氖(Ne)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、氩(Ar)、钾(K)、钙(Ca)。
- 常见金属元素:铁(Fe)、铜(Cu)、锌(Zn)、银(Ag)、金(Au)、汞(Hg)等。
2. 化学式。
- 单质化学式。
- 金属单质:用元素符号表示,如铁(Fe)、铜(Cu)等。
- 固态非金属单质:一般用元素符号表示,如碳(C)、硫(S)等;但碘(I₂)除外。
- 稀有气体:用元素符号表示,如氦气(He)、氖气(Ne)等。
- 气态非金属单质:在元素符号右下角写上表示分子中所含原子数的数字,如氢气(H₂)、氧气(O₂)、氮气(N₂)等。
- 化合物化学式。
- 书写原则:正价在前,负价在后,根据化合物中正负化合价代数和为零的原则确定原子个数比。
- 例如:水(H₂O),其中氢元素化合价为 + 1,氧元素化合价为 - 2;氯化钠(NaCl),钠元素化合价为+1,氯元素化合价为 - 1。
3. 化学方程式。
- 书写原则。
- 一是必须以客观事实为基础;二是要遵守质量守恒定律,等号两边各原子的种类和数目必须相等。
- 例如:- 镁在空气中燃烧:2Mg + O₂{点燃}{===}2MgO。
- 实验室制取氧气:- 加热高锰酸钾:2KMnO₄{}{===}K₂MnO₄+MnO₂+O₂↑。
- 过氧化氢分解:2H₂O₂{MnO_2}{===}2H₂O+O₂↑。
- 化学方程式的意义。
- 质的方面:表示反应物、生成物和反应条件。
如氢气和氧气在点燃条件下反应生成水。
- 量的方面:- 宏观上:表示反应物、生成物之间的质量比。
在2H₂+O₂{点燃}{===}2H₂O中,氢气、氧气和水的质量比为4:32:36 = 1:8:9。
- 微观上:表示反应物、生成物之间的粒子个数比。
化学常见用语

(一)化学用语1.元素符号:氢H 氦He锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P硫S 氯Cl 氩Ar钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 锡Sn 铅Pb (氢H)铜Cu 汞Hg 银Ag 铂Pt 金Au2.化学式:气体:氧气O2氢气H2氮气N2氯气Cl2二氧化碳CO2二氧化硫SO2一氧化碳CO 二氧化氮NO2甲烷CH4氨气NH3氯化氢HCl固体:白色:五氧化二磷P2O 5氧化镁MgO 氯酸钾KClO3碳酸钙CaCO3硫酸钡BaSO4氯化银AgCl 生石灰CaO 熟石灰Ca(OH) 2黑色:木炭C 氧化铜CuO 四氧化三铁Fe3O4二氧化锰MnO2蓝色:胆矾CuSO4 . 5H2O 氢氧化铜Cu(OH) 2绿色:碱式碳酸铜Cu2 (OH) 2CO3红褐色:氧化铁(铁锈)Fe2O3氢氧化铁Fe(OH) 3常见的酸:硫酸H2SO4盐酸HCl 硝酸HNO3碳酸H2CO3常见的碱:氢氧化钠(烧碱,火碱,苛性钠)NaOH 熟石灰Ca(OH) 2常见的盐:氯化钠NaCl 氯化钡BaCl2硝酸银AgNO3碳酸钠(纯碱)Na2CO3氯化铁FeCl33.离子符号:氢离子H+钠离子Na+镁离子Mg2+氯离子Cl--离子Ag+钙离子Ca2+钡离子Ba2+硫离子S2--硝酸根离子NO3--氢氧根离子OH-- 硫酸根离子SO42--碳酸根离子CO32--4.化学方程式:化合反应:木炭充分燃烧:木炭不完全燃烧:硫的燃烧:磷的燃烧:铁丝燃烧:镁条燃烧:氢气燃烧:一氧化碳燃烧:碳还原二氧化碳:二氧化碳与水反应分解反应:加热氯酸钾:加热高锰酸钾:加热碱式碳酸铜:电解水:煅烧石灰石:氢氧化铁受热分解:碳酸分解:氧化汞受热分解:置换反应:锌和稀硫酸反应,镁和稀硫酸反应:铁和稀盐酸反应:木炭还原氧化铜:氢气还原氧化铜:锌和硫酸铜溶液反应:复分解反应:二氧化碳通入澄清石灰水:实验室制取二氧化碳:碳酸钠与盐酸反应:其他反应类型:甲烷燃烧:一氧化碳还原氧化铜:炼铁的原理:(一)化学用语1.元素符号:氢_______ 氦_______锂Li 铍Be 硼B 碳______ 氮______ 氧_____ 氟F 氖_______钠____镁____铝___ 硅_______ 磷_______ 硫_______ 氯______ 氩_______钾______ 钙______ 钠______ 镁______ 铝______ 锌_______ 铁_______锡Sn 铅Pb (氢_______)铜_______ 汞_______ 银_______ 铂Pt 金Au2.化学式:A.气体:氧气_______ 氢气_______ 氮气_______ 氯气_______ 二氧化碳_______ 二氧化硫_______ 一氧化碳_______ 二氧化氮_______甲烷_______ 氨气_______ 氯化氢_______B.常见物质颜色:____色:五氧化二磷_______ 氧化镁_______ 氯酸钾_______ 碳酸钙_______ 硫酸钡_______ 氯化银_______ 生石灰_______ 熟石灰_______镁_______、铝_______、纯铁_______、水银_______、白磷_______、碳酸钙_______、碳酸钡___________色:木炭_______ 氧化铜_______ 四氧化三铁_______ 二氧化锰_______无色:水、金刚石、许多无色溶液、大多数气体。
100个化学用语

100个化学用语1. 元素 (element)2. 化合物 (compound)3. 分子 (molecule)4. 原子 (atom)5. 反应 (reaction)6. 酸 (acid)7. 碱 (base)8. 盐 (salt)9. 溶液 (solution)10. 晶体 (crystal)11. 气体 (gas)12. 液体 (liquid)13. 固体 (solid)14. 离子 (ion)15. 化学键 (chemical bond)16. 反应速率 (reaction rate)17. 摩尔质量 (molar mass)18. 摩尔浓度 (molar concentration)19. 反应平衡 (chemical equilibrium)20. 离子化 (ionization)21. 电离度 (ionization degree)22. 化学式 (chemical formula)23. 反应机制 (reaction mechanism)24. 化学平衡 (chemical balance)25. 比较分析 (comparative analysis)26. 氧化还原反应 (redox reaction)27. 酸碱中和反应 (acid-base neutralization reaction)28. 氧化剂 (oxidizing agent)29. 还原剂 (reducing agent)30. 晶体结构 (crystal structure)31. 电子亲和力 (electron affinity)32. 电离能 (ionization energy)33. 共价键 (covalent bond)34. 极性 (polarity)35. 热力学 (thermodynamics)36. 核化学 (nuclear chemistry)37. 催化剂 (catalyst)38. 光催化 (photocatalysis)39. 量子力学 (quantum mechanics)40. 电子结构 (electronic structure)41. 有机化合物 (organic compound)42. 无机化合物 (inorganic compound)43. 生物化学 (biochemistry)44. 放射性 (radioactive)45. 电解质 (electrolyte)46. 晶体缺陷 (crystal defect)47. 热分析 (thermal analysis)48. 光谱学 (spectroscopy)49. 核磁共振 (nuclear magnetic resonance)50. 红外光谱 (infrared spectroscopy)51. 质谱 (mass spectrometry)52. 光电子能谱 (photoelectron spectroscopy)53. 光谱分析 (spectral analysis)54. 电化学 (electrochemistry)55. 电导率 (conductivity)56. 比色法 (colorimetry)57. 密度 (density)58. 粘度 (viscosity)59. 热容 (heat capacity)60. 摩尔吸光度 (molar absorptivity)61. 晶体学 (crystallography)62. 热力学循环 (thermodynamic cycle)63. 化学动力学 (chemical kinetics)64. 反应速度常数 (rate constant)65. 反应活化能 (activation energy)66. 催化作用 (catalysis)67. 氧化态 (oxidation state)68. 还原态 (reduction state)69. 链式反应 (chain reaction)70. 增溶剂 (cosolvent)71. 电解 (electrolysis)72. 电解槽 (electrolytic cell)73. 化学计量 (stoichiometry)74. 氧化数 (oxidation number)75. 比例法 (proportional method)76. 酸碱指示剂 (acid-base indicator)77. 沉淀 (precipitate)78. 污染物 (pollutant)79. 溶解度 (solubility)80. 毒性 (toxicity)81. 晶体生长 (crystal growth)82. 光催化剂 (photocatalyst)83. 酸碱滴定 (acid-base titration)84. 沸点 (boiling point)85. 熔点 (melting point)86. 比热容 (specific heat capacity)87. 催化剂活性 (catalyst activity)88. 化学反应平衡常数 (chemical equilibrium constant)89. 氧化物 (oxide)90. 电子云 (electron cloud)91. 分子轨道 (molecular orbital)92. 电子转移 (electron transfer)93. 能带 (band)94. 离子晶体 (ionic crystal)95. 配位化合物 (coordination compound)96. 可燃性 (flammability)97. 气液平衡 (gas-liquid equilibrium)98. 表面张力 (surface tension)99. 热解 (pyrolysis)100. 溶剂 (solvent)。
初中化学用语汇总

初中化学用语汇总1. 原子:构成分子的最小粒子。
2. 元素:由同种原子组成的物质。
4. 分子:由两个及以上原子组成的不带电荷的粒子。
6. 原子量:一个原子质量单位。
8. 周期表:元素根据其原子核结构的排列方式排列的表格。
9. 金属:具有良好的导电性和热传导性质的物质。
11. 金属元素:处于周期表左侧的元素。
16. 原子核:由质子和中子组成的原子中心部分。
17. 共价键:由电子对共享形成的键。
18. 离子键:带正电荷和负电荷之间的相互作用。
21. 化学键:元素通过共享或转移电子形成的化学物质的力。
22. 化学式:用元素符号表示化合物的组成。
23. 反应物:在化学反应中参与反应的物质。
25. 化学反应:物质之间的化学相互作用。
26. 酸:会释放出氢离子的物质。
28. 盐:由阳离子和阴离子组成的离子化合物。
30. 溶解:由固体或气体转变为液体。
31. 溶质:溶解在溶剂中的物质。
34. 沉淀:在溶液中形成的固体颗粒。
36. 电离:在溶液中将电解质分解为离子。
39. 化学平衡:反应物和生成物在化学反应中达到平衡状态。
40. 配位化合物:由中心金属离子和其它分子和离子中的原子和分子共价结合而成的化合物。
41. 化学式计算:根据化学式计算元素的质量。
42. 摩尔质量:化学式中一个摩尔的质量。
43. 密度:单位体积内的物质质量。
44. 燃烧:化合物与氧气彻底反应的化学反应。
46. 温度:温度代表了物体内部分子的平均运动速度。
47. 热力学系统:研究热和压力与化学反应之间的关系。
48. 热能:热能是物体或系统储存的能量。
49. 热动力学:热的能量学,研究物质内部热运动的规律。
50. 热量:由于温度差异而流动的能量。
51. 热容:物质单位质量的温度变化时吸收或释放的热量。
52. 热传导:热能通过物质的传递。
53. 热平衡:两个物体之间热能的交换达到相同的温度。
54. 热力学第一性原理:能量守恒。
55. 内能:热力学系统内分子内部相互作用引起的能量总和。
初中化学用语全

初中化学用语总结一、单质1、由原子直接组成的单质:2、由分子组成的物质( 1)金属单质,如:(2)非金属固体:H2氢气Na 钠Cu铜C碳N2氮气Mg镁Zn锌S硫O2氧气Al 铝Ag银P磷O3臭氧K钾Ba钡(3)罕有气体:Cl 2氯气Ca钙Pt铂He氦气Mn锰Hg汞Ne氖气Fe铁AuAr氩气金二、化合物阴离——Cl —2—2—OH NO3 SO4 3CO 子阳离( 氢氧根离( 硝酸根离( 氯离( 硫酸根离( 碳酸根离子子)子)子)子)子)H+H2O HNO3HCl H2 SO4H2 CO3H2 O 水硝酸盐酸硫酸碳酸水NH4+NH3·H2O NH4NO3NH4Cl(NH4)2SO4(NH4)2CO3氨水硝酸铵氯化铵硫酸铵碳酸铵+ KOH KNO KCl K SO K2 CO K2 O K3 24 3氢氧化钾硝酸钾氯化钾硫酸钾碳酸钾氧化钾+ NaOH NaNO NaCl NaSO NaCO NaO Na3 24 2 3 2氢氧化钠硝酸钠氯化钠硫酸钠碳酸钠氧化钠Ba2+ Ca2+2+ MgAl 3+Ba(OH)2Ba(NO3) 2BaCl2BaSO4BaCO3BaO 氢氧化钡硝酸钡氯化钡硫酸钡碳酸钡氧化钡Ca(OH)2Ca(NO3) 2CaCl2CaSO4CaCO3CaO 氢氧化钙硝酸钙氯化钙硫酸钙碳酸钙氧化钙Mg(OH)2Mg(NO3) 2MgCl2MgSO4MgCO3MgO 氢氧化镁硝酸镁氯化镁硫酸镁碳酸镁氧化镁Al(OH) 3 Al(NO3) 3 AlCl 3 Al 2(SO4 ) 3 此物质不存Al 2O3在氢氧化铝硝酸铝氯化铝硫酸铝氧化铝Zn2+ Fe 2+ Fe 3+ Cu2+Zn(OH)2Zn(NO3) 2ZnCl2、ZnSO4ZnCO3ZnO 氢氧化锌硝酸锌氯化锌硫酸锌碳酸锌氧化锌Fe(OH)2Fe(NO3) 2FeCl2FeSO4FeCO3FeO 氢氧化亚硝酸亚铁氯化亚硫酸亚铁碳酸亚铁氧化亚铁铁铁3 Fe(NO3) 3 FeCl3 Fe2(SO4 ) 3此物质不存Fe2O3Fe(OH)在氢氧化铁硝酸铁氯化铁硫酸铁氧化铁Cu(OH) Cu(NO)2CuCl CuSO CuCO CuO2 3 2 4 3氢氧化铜硝酸铜氯化铜硫酸铜碳酸铜氧化铜Ag+此物质不AgNO3AgCl Ag2SO4Ag2CO3Ag2O存在硝酸银氯化银硫酸银碳酸银氧化银三、化学反响(一)、化合反响:“多变一”1、氯化氢和氨气反响:氯化氢氨气氯化铵2、红磷焚烧:磷氧气点燃五氧化二磷点燃3、硫的焚烧:硫氧气二氧化硫4、铁在氧气中焚烧:铁氧气点燃四氧化三铁点燃5、镁的焚烧:镁氧气氧化镁点燃6、铝的焚烧:铝氧气氧化铝7、铜在空气中加热:铜氧气加热氧化铜8、氢气的焚烧:氢气氧气点燃水HCl NH 3 NH 4 Cl 4P 5O点燃2P O52 2S O2点燃SO23Fe 2O点燃Fe O42 32Mg点燃O 2 2Mg O 4Al 3O2点燃2Al 2O3 2Cu O2△2CuO2H 2 O2点燃2H2O9、木炭焚烧:点燃C O 2点燃CO2 碳氧气二氧化碳10、碳在不足量氧气中焚烧:碳氧气点燃一氧化碳2C O2点燃2CO11、一氧化碳的焚烧:一氧化碳氧气点燃二氧化碳2CO O 2点燃2CO212、二氧化碳溶于水:二氧化碳水碳酸13、生石灰遇水反响:氧化钙水氢氧化钙(二)、分解反响:“一变多”1、氧化汞加热分解:2、过氧化氢催化分解:加热△氧化汞汞氧气 2 H gO 2 Hg O 2过氧化氢二氧化锰水氧气2H 2O2Mn2O2H 2 O O23、高锰酸钾加热分解:4、氯酸钾与二氧化锰混淆加热:5、电解水:通电通电水氧气氢气2H2O2H2O26、碳酸分解:碳酸水二氧化碳7、碱式碳酸铜(孔雀石)热分解:8、电解熔融氧化铝制铝:通电2A l 2 O3通电4Al 3O2 氧化铝铝氧气9、碳酸钙高温分解:高温CaCO3高温CaO CO 2 碳酸钙氧化钙二氧化碳(三)、置换反响:“单质 +化合物—化合物+单质A+BC—AC+B”1、氢气复原氧化铜:氢气氧化铜加热水铜2、碳复原氧化铜:碳氧化铜高温二氧化碳铜金属活动次序:3、镁与稀盐酸反响:镁盐酸氯化镁氢气4、铝与稀盐酸反响:铝盐酸氯化铝氢气5、锌与稀盐酸反响:锌盐酸氯化锌氢气6、铁与稀盐酸反响:铁盐酸氯化亚铁氢气7、镁与稀硫酸反响:镁稀硫酸硫酸镁氢气8、锌与稀硫酸反响:锌稀硫酸硫酸锌氢气9、铝与稀硫酸反响:铝稀硫酸硫酸铝氢气10、铁与稀硫酸反响:铁稀硫酸硫酸亚铁氢气11、铝与硫酸铜反响:铝硫酸铜硫酸铝铜12、铁与硫酸铜反响:铁硫酸铜硫酸亚铁铜13、铁与氯化铜反响:铁氯化铜氯化亚铁铜(四)、复分解反响:1、氯化钾与硝酸银反响:氯化钾硝酸银硝酸钾氯化银2、盐酸与硝酸银反响:盐酸硝酸银硝酸氯化银3、氧化铜与硫酸反响:氧化铜硫酸硫酸铜水4、氧化镁与硫酸反响:氧化镁硫酸硫酸镁水5、氧化铁与盐酸反响:氧化铁盐酸氯化铁水6、盐酸与氢氧化钠反响:盐酸氢氧化钠氯化钠水7、硫酸与氢氧化钠反响 : 硫酸氢氧化钠硫酸钠水8、硝酸与氢氧化铜反响 :9、氯化钡与硫酸反响:氯化钡硫酸硫酸钡水9、氯化钡与碳酸钠反响 :10、氢氧化钠硫酸铜反响:氢氧化钠硫酸铜氢氧化铜硫酸铜11、氢氧化钙与氯化铁反响:氢氧化钙氯化铁氢氧化铁氯化钙(五)、其余反响:1、汽车尾气催化变换:2、二氧化碳与氢氧化钙反响(澄清石灰水变污浊):3、大理石与盐酸反响:4、甲烷(天然气的主要成分)焚烧:5、一氧化碳复原氧化铁:6、一氧化碳复原氧化铜:10、碳酸氢铵与氢氧化钙混淆:碳酸氢铵氢氧化钙碳酸钙水氨气11、硫酸铵与氢氧化钠溶液混淆加热:硫酸铵氢氧化钠△硫酸钠水氨气(NH4) 2SO4+2NaOH Na 2SO4+ H2O+ NH3·H2O 7、葡萄糖在酶作用下的反响:葡萄糖氧气酶二氧化碳水。
(完整版)初三化学全册必背知识点(精华)

初中化学全册必背知识点一、化学用语1、常见元素及原子团的名称和符号非金属: O氧 H氢 N氮 Cl氯 C碳 P磷 S硫金属: K钾 Ca钙 Na钠 Mg镁 Al铝 Zn锌 Fe铁 Cu铜 Hg汞 Ag银 Mn锰 Ba钡原子团(根):氢氧根硝酸根碳酸根硫酸根铵根OH- NO3- CO32- SO4 2- NH4+2、(1) 常见元素化合价口诀:一价氯氢钾钠银,二价氧钙钡镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2) 常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铵根。
4、必须熟记的制取物质的化学方程式(1)实验室制取氧气一: 2KMnO4===K2MnO4+MnO2+O2↑(2)实验室制取氧气二: 2H2O2 ===2H2O+O2↑(3) 实验室制取氧气三: 2KClO3===2KCl+3O2↑(4)实验室制法CO2: CaCO3+2HCl==CaCl2+H2O+CO2↑(5)实验室制取氢气: Zn+H2SO4==ZnSO4+H2↑ Zn + 2HCl= ZnCl2 +H2↑(6)电解水制取氢气: 2H2O===2H2↑+O2↑(7)湿法炼铜术(铁置换出铜):Fe+CuSO4==FeSO4+Cu (Fe与盐、酸反应都生成的是+2价亚铁离子)(8)炼铁原理: 3CO+Fe2O3===2Fe+3CO2 (Fe2O3与酸反应生成的是+3价铁离子)(9)熟灰水[Ca(OH)2 ]的制取方法:CaO+H2O==Ca(OH)2(10)生石灰(氧化钙)制取方法:CaCO3 ===CaO+CO2↑二.金属活动性顺序:金属活动性由强至弱: K Ca Na Mg Al , Zn Fe Sn Pb (H) ,Cu Hg Ag Pt Au 。
(按5个一句顺序背诵)钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金。
三、常见物质的颜色、状态1、黑色固体:炭粉、铁粉、CuO、MnO2、Fe3O42、红色固体:Cu、Fe2O3、红磷▲硫磺:淡黄色▲绿色:碱式碳酸铜(铜锈,俗称铜绿)3、溶液的颜色:含Cu2+的溶液呈蓝色(如CuSO4溶液);含Fe2+的溶液呈浅绿色(如FeCl2溶液);含Fe3+的溶液呈棕黄色(如FeCl3溶液),其余溶液一般为无色。
化学用语汇总

一、物质的化学名称、俗名和化学式汞(水银)Hg 硫(硫磺)S 氧化钙(生石灰)CaO 固体二氧化碳(干冰)CO2氧化铁(铁锈的主要成分)Fe2 O 3 碳酸钙(大理石、石灰石的主要成分)CaCO3碱式碳酸铜(铜绿)Cu2 (OH)2 CO3氯化钠(食盐)NaCl 甲烷(沼气)CH4乙醇(酒精)C2 H5 OH 乙酸(醋酸)CH3 COOH碳酸钠(纯碱)Na2 CO3 硫酸铜晶体(蓝矾、胆矾)CuSO4·5H2O氢氧化钠(烧碱、火碱、苛性钠)NaOH 氢氧化钙(熟石灰、消石灰)Ca(OH)2水煤气:氢气和一氧化碳的混合物爆鸣气:氢气和氧气的混合物二、物质的化学式A 单质:由同种(或一种)元素组成的纯净物。
1、金属单质钡钾钙钠镁铝锌铁锡铅(氢)铜汞银铂金Ba K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au2、非金属单质氢气H2 氧气O2氮气N2氯气Cl2氟气(F2)溴(Br2 ) 碘(I2)碳C 硅Si 磷P 硫S 臭氧(O3)3、稀有气体氦气He 氖气Ne 氩气ArB 化合物:由不同种元素组成的纯净物。
(一)有机物:含碳元素的化合物(除CO、CO2和CO32-的化合物)甲烷 CH4 乙醇C2H5OH 甲醇 CH3OH 乙酸 CH3 COOH 乙炔 C2 H2尿素CO(NH2)2(二)氧化物:由两种元素组成,其中一种是氧元素的化合物。
1、非金属氧化物(大部分非金属氧化物通常是酸性氧化物,跟水化合成同价的含氧酸)水一氧化碳二氧化碳二氧化硅五氧化二磷二氧化硫三氧化硫H2 O CO CO2 SiO2 P2 O5 SO2 SO32、金属氧化物氧化钡氧化钾氧化钙氧化钠氧化镁氧化铝氧化锌BaO K2 O CaO Na2 O MgO Al2 O3 ZnO 氧化铁氧化亚铁四氧化三铁氧化铜氧化亚铜氧化汞氧化银二氧化锰Fe2 O3 FeO Fe3 O4 CuO Cu2 O HgO Ag2 O MnO2(三)酸:名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”硫酸盐酸硝酸磷酸氢硫酸碳酸亚硫酸H2 SO4 HCl HNO3 H3 PO4 H2 S H2 CO3 H2 SO3(四)碱:由金属离子和氢氧根离子构成,碱的名称通常有“氢氧化某”化学式的最后面是“OH”(五)盐:由金属离子和酸根离子构成碱 1、碳酸盐 2、硫酸盐 3、硝酸盐 4.氯化物 5.亚硫酸盐氢氧化钾碳酸钾硫酸钾硝酸钾氯化钾亚硫酸钾KOH K2 CO3 K2SO4 KNO3 KCl K2SO3氢氧化钠碳酸钠硫酸钠硝酸钠氯化钠亚硫酸钠NaOH Na2 CO3 Na2SO4 NaNO3 NaCl Na2SO3碳酸银硫酸银硝酸银氯化银Ag2 CO3 Ag2 SO4 AgNO3 AgCl氨水碳酸铵硫酸铵硝酸铵氯化铵NH3 ·H2 O NH4)2 CO3(NH4)2SO4 NH4 NO3 NH4 Cl氢氧化钙碳酸钙硫酸钙硝酸钙氯化钙亚硫酸钙Ca(OH)2 CaCO3 CaSO4 Ca(NO3)2 CaCl2 CaSO3氢氧化钡碳酸钡硫酸钡硝酸钡氯化钡Ba(OH)2 BaCO3 BaSO4 Ba(NO3 )2 BaCl2氢氧化镁碳酸镁硫酸镁硝酸镁氯化镁Mg(OH)2 MgCO3 MgSO4 Mg(NO3 )2 MgCl2氢氧化铜碳酸铜硫酸铜硝酸铜氯化铜Cu(OH)2 CuCO3 CuSO4 Cu(NO3 )2 CuCl2氢氧化锌碳酸锌硫酸锌硝酸锌氯化锌Zn(OH)2 ZnCO3 ZnSO4 Zn(NO3 )2 ZnCl2硝酸汞氯化亚铜Hg(NO3)2 CuCl氢氧化亚铁碳酸亚铁硫酸亚铁硝酸亚铁氯化亚铁Fe(OH)2 FeCO3 FeSO4 Fe(NO3 )2 FeCl2氢氧化铁硫酸铁硝酸铁氯化铁Fe(OH)3 Fe2(SO4)3 Fe(NO3 )3 FeCl3氢氧化铝硫酸铝硝酸铝氯化铝Al(OH)3 Al2(SO4)3 Al(NO3 )3 AlCl36、酸式盐(多元酸里的氢部分被金属取代,H夹在中间)碳酸氢钠NaHCO3,碳酸氢钙Ca(HCO3 )2磷酸二氢钠NaH2 PO4磷酸二氢钾KH2 PO4硫酸氢钠NaHSO4,硫酸氢钾KHSO47、碱式盐(化学式的中间有“OH”):碱式碳酸铜Cu2(OH)2 CO38、其他盐高锰酸钾KMnO4 锰酸钾K2MnO4 氯酸钾KClO3硫化钠Na2 S碘酸钾 KIO3亚硝酸钠NaNO2硫化钾K2S初中化学方程式一、化合反应1、木炭在氧气中燃烧(氧气充足):C+O2CO22、木炭在氧气中燃烧(氧气不充足):2C+ O2 2CO3、铁丝在氧气中燃烧:3Fe+2O2Fe3O44、氢气在空气中燃烧:2H2+O22H2O5、硫在空气中燃烧: S+O2SO26、磷在空气中燃烧:4P+5O22P2O57、镁带在空气中燃烧:2 Mg+O22MgO 8、铜在空气中加热: 2Cu+O2 2CuO9、一氧化碳在空气中燃烧:2CO+ O2 2CO2 10、铝与氧气反应形成保护膜:4Al+3O2===2Al2O311、二氧化碳与水的反应:CO2+H2O=== H2CO3 12、二氧化硫与水的化合:SO2+H2O=== H2SO3 (亚硫酸)13、生石灰与水化合:CaO+H2O===C a(O H)2(放热)二、分解反应14、加热氯酸钾和二氧化锰的混合物:2KClO32KCl+3O2↑15、加热高锰酸钾制氧气:2KMnO4K2MnO4+MnO2+O2↑实验室制取氧气MnO216、用过氧化氢制氧气:2H2O2 2H2O+O2↑17、高温煅烧石灰石:CaCO3 CaO+CO2↑18、碳酸不稳定分解:H2CO3 === H2O+CO2↑ 19、电解水:2H2O 2H2↑+O2↑三、置换反应20、锌和稀硫酸反应(实验室制取氢气):Zn+H2SO4===ZnSO4+H2↑21、铁和稀硫酸:Fe+H2SO4===FeSO4+H2↑22、镁和稀硫酸:Mg+H2SO4===MgSO4+H2↑23、铝和稀硫酸:2Al+3H2SO4===Al2(SO4)3+3H2↑24、锌和稀盐酸反应:Zn+2HCl===ZnCl2+H2↑25、铁和稀盐酸:Fe+2HCl===FeCl2+H2↑26、镁和稀盐酸:Mg+2HCl===MgCl2+H2↑27、铝和稀盐酸:2Al+6HCl===2AlCl3+3H2↑28、氢气还原氧化铜:H2+CuO Cu+H2O29、木炭还原氧化铜:C+2CuO2Cu+CO2↑30、铁和蓝色硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu31、铜与硝酸银溶液反应:Cu+2AgNO3===2Ag+Cu(NO3)2四、复分解反应32、用石灰石与稀盐酸制取二氧化碳:CaCO3+2HCl===CaCl2+H2O+CO2↑(实验室制取二氧化碳)33、稀盐酸和碳酸钠反应:2HCl+Na2CO3===2NaCl+H2O+CO2↑34、稀盐酸和碳酸氢钠反应:HCl+NaHCO3===NaCl+H2O+CO2↑35、稀盐酸和碳酸钾(草木灰的成分):2HCl+K2CO3===2KCl+H2O+CO2↑36、稀盐酸和氢氧化钠:HCl+NaOH===NaCl+H2O37、稀盐酸和氢氧化钙:2HCl+Ca(OH)2===CaCl2+2H2O38、氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3===AlCl3+3H2O39、稀硫酸和氢氧化钠:H2SO4+2NaOH===Na2SO4+2H2O40、硫酸和氢氧化钙:H2SO4+Ca(OH)2===CaSO4+2H2O41、稀盐酸除铁锈:6HCl+Fe2O3===2FeCl3+3H2O42、氧化铜与稀盐酸反应:2HCl+CuO===CuCl2+H2O43、稀硫酸除铁锈:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O44、硫酸和硝酸钡:H2SO4+Ba(NO3)2===BaSO4↓+2HNO345、硫酸和碳酸钾:H2SO4+K2CO3===K2SO4+H2O+CO2↑↓+2KNO346、硝酸钡和碳酸钾:Ba(NO3)2+K2CO3=== BaCO347、氢氧化钠与硫酸铜溶液:CuSO4+2NaOH===Cu(OH)2↓(蓝色)+Na2SO448、氢氧化钠与氯化铁溶液:3NaOH+FeCl3===Fe(OH)3↓(红褐色)+3NaCl49、碳酸钠与石灰水:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH50.硝酸银溶液与盐酸: AgNO3 + HCl ===AgNO3↓+HNO351、硝酸铵与氢氧化钠:NH4NO3 + NaOH = NaNO3 + NH3 ↑ + H2O五、其他类型反应52、二氧化碳与澄清石灰水的反应:CO2+Ca(OH)2===CaCO3↓+H2O53、苛性钠在空气中变质:2NaOH+CO2===H2O+Na2CO354、苛性钠吸收二氧化硫气体:2NaOH+SO2===H2O+Na2SO3 (亚硫酸钠)55、烧碱溶液和三氧化硫反应:2NaOH+SO3===H2O+Na2SO456、一氧化碳还原氧化铜:CO+CuO Cu+CO257、一氧化碳还原氧化铁:3CO+Fe2O3 2Fe+3CO258、一氧化碳还原四氧化三铁:4CO+Fe3O4 3Fe+4CO259、甲烷在空气中燃烧:CH4+2O2CO2+2H2O60、酒精在空气中燃烧:C2H5OH+3O22CO2+3H2O一、化合反应1、木炭在氧气中燃烧(氧气充足):2、木炭在氧气中燃烧(氧气不充足):3、铁丝在氧气中燃烧:4、氢气在空气中燃烧:5、硫在空气中燃烧:6、磷在空气中燃烧:7、镁带在空气中燃烧:8、铜在空气中加热:9、一氧化碳在空气中燃烧:10、铝与氧气反应形成保护膜:11、二氧化碳与水的反应:12、二氧化硫与水的化合:13、生石灰与水化合:二、分解反应141516、用过氧化氢制氧气:氧气17、高温煅烧石灰石:18、碳酸不稳定分解:19、电解水:三、置换反应20、锌和稀硫酸反应(实验室制取氢气):21、铁和稀硫酸:22、镁和稀硫酸:23、铝和稀硫酸:24、锌和稀盐酸反应:25、铁和稀盐酸:26、镁和稀盐酸27、铝和稀盐酸:28、氢气还原氧化铜:29、木炭还原氧化铜:30、铁和蓝色硫酸铜溶液反应:31、铜与硝酸银溶液反应:四、复分解反应32、用石灰石与稀盐酸制取二氧化碳:(实验室制取二氧化碳)33、稀盐酸和碳酸钠反应:34、稀盐酸和碳酸氢钠反应:35、稀盐酸和碳酸钾(草木灰的成分):36、稀盐酸和氢氧化钠:37、稀盐酸和氢氧化钙:38、氢氧化铝药物治疗胃酸过多:39、稀硫酸和氢氧化钠:40、硫酸和氢氧化钙:41、稀盐酸除铁锈:42、氧化铜与稀盐酸反应:43、稀硫酸除铁锈:44、硫酸和硝酸钡:45、硫酸和碳酸钾:46、硝酸钡和碳酸钾47、氢氧化钠与硫酸铜溶液:48、氢氧化钠与氯化铁溶液:49、碳酸钠与石灰水:50.硝酸银溶液与盐酸:51.硝酸铵与氢氧化钠:五、其他类型反应52、二氧化碳与澄清石灰水的反应:53、苛性钠在空气中变质54、苛性钠吸收二氧化硫气体:55、烧碱溶液和三氧化硫反应:56、一氧化碳还原氧化铜57一氧化碳还原氧化铁:58、一氧化碳还原四氧化三铁:59、甲烷在空气中燃烧60、酒精在空气中燃烧:。
初中化学用语

-1 O PO4
+1 NH4
七、1-20 号元素的原子结构示意图:
八、化学式: 单质:氢气 H2 化合物: 氧化物: 一氧化碳 二氧化锰 氧化镁 酸:盐酸 HCl NaOH CO MnO2 二氧化碳 三氧化二铁 CaO H2SO4 CO2 Fe2O3 五氧化二磷 四氧化三铁 Al2O3 碳酸 P2O5 Fe3O4 二氧化硫 SO2 氧气 O2 氮气 N2 氯气 Cl2 氖气 Ne 碳 C 铜 Cu 铁 Fe
钠离子 氟离子
Na+ F—
锌离子 Zn2+ 氮离子 N3—
硫酸根离子 硝酸根离子
CO32— OH—
【高锰酸根离子 MnO4—】 【碳酸氢根离子 HCO3—】
三、写出下列符号的意义: O O2
-
氧元素;一个氧原子
2O
2 个氧原子
2O2
2 个氧分子
氧气这种物质;氧气由氧元素组成;一个氧分子,一个氧分子由 2 个氧原子构成
氢氧化铜(蓝色) Cu(OH)2 氯化铝 氯化亚铁 氯化银 碳酸钾 AlCl3 FeCl2 AgCl K2CO3 Na2SO4 ZnSO4 Zn(NO3)2 Cu(NO3)2 氯化锌 ZnCl2
氯化镁 氯化铁 氯化铜 碳酸钠 硫酸铁
MgCl2 FeCl3 CuCl2 Na2CO3
(盐酸盐) 碳酸钡 硫酸镁 硫酸钡 硝酸钡 硝酸钙 BaCO3 MgSO4 BaSO4 Ba(NO3)2 Ca(NO3)2
周四化学测验答案
初中化学用语
一、常见的元素符号: 氢 H 锰 Mn 氦 He 钡 Ba 锂 Li 碘 I 铍 Be 铁 Fe 硼,碳 B C 铜 银 Cu Ag 氮 氧 氟 氖。 N O F Ne 汞 锌 铂 金 Hg Zn Pt Au 钠 镁 铝 硅 磷,硫 氯 氩 钾 钙 。 Na Mg Al Si P S Cl Ar K Ca
初中化学常用词组大全

初中化学常用词组大全
1. 溶解:固体在液体中消失,称为溶解,如糖溶于水中。
2. 水溶性:物质在水中溶解的能力,称为水溶性。
3. 不溶性:物质不能在水中完全溶解,称为不溶性。
4. 沸点:液态物质在给定的压力下从液体变为气体的温度,称为沸点。
5. 密度:物体单位体积的质量。
6. 酸性:具有酸性的物质的水溶液有酸味、能腐蚀金属并使植物染色。
7. 碱性:具有碱性的物质的水溶液有苦味、具有腐蚀性并容易吸收水分。
8. 中性:不呈酸性或碱性的状态。
9. 化学反应:物质经过变化生成新物质的过程。
10. 氧化:物质失去电子或氢原子的过程。
11. 还原:物质获得电子或氢原子的过程。
12. 合成反应:多个物质反应生成新物质的过程。
13. 分解反应:化合物分解成两个或更多的物质的反应。
14. 烷烃:由碳和氢组成的一类物质,包括甲烷、乙烷等。
15. 烯烃:由碳和氢组成的一类物质,分子中有一个或多个碳
双键,包括乙烯、丙烯等。
16. 炔烃:由碳和氢组成的一类物质,分子中有三条及以上的碳—碳三键,包括乙炔、丙炔等。
17. 离子:原子或单原子离子失去或获得电子形成的带电粒子。
18. 离子键:由正负离子间的静电相互作用形成的化学键。
19. 共价键:两个原子通过共用它们的价电子对形成的化学键。
20. 化合价:化学元素与其他化学元素化合时所能借出的电子
数或能接受的电子数的最大值。
21. 分子式:化合物分子中各元素原子的种类、数目与相对位
置表达式。
初中化学用语归纳

51.铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 =ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3高温 4Fe + 3CO2↑七、酸、碱、盐56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl =CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH =Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl =2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH (4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 =AgCl↓ + NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
初中化学用语

初中化学用语一、元素符号元素符号就像是化学世界里每个元素的小名片。
比如说氧元素,它的符号是“O”,这小小的字母可代表着咱们呼吸离不开的氧气哦。
还有氢元素“H”,这可是组成水的重要元素呢。
记忆元素符号的时候呀,就像认识新朋友,多和它们打打交道就熟悉啦。
咱们可以编一些小口诀来记,像“氧是O,氮是N,镁的符号Mg真迷人”,这样俏皮的口诀,是不是让元素符号的记忆变得轻松又好玩啦?而且元素符号可是写化学方程式的基础呢,就像盖房子的小砖块,缺了它们可不行。
二、化学式化学式呢,就像是元素们组合在一起的小家庭的名字。
像水的化学式是H₂O,这表示一个水分子是由两个氢原子和一个氧原子组成的。
你看,这就像一个小家庭里有两个氢宝宝和一个氧妈妈。
二氧化碳的化学式是CO₂,这就告诉我们一个二氧化碳分子里有一个碳原子和两个氧原子。
在写化学式的时候呀,我们要遵循一定的规则,化合价就是这个规则里很重要的一部分呢。
就像在这个化学小家庭里,每个元素都有自己的地位和价值,这个价值就体现在化合价上啦。
如果化合价搞错了,那这个化学式可就写错啦,就像给人家小家庭乱起名字一样,可不行哦。
三、化学方程式化学方程式可算是化学用语里的大明星啦。
它就像一个故事,讲述了化学反应是怎么发生的。
比如说氢气和氧气反应生成水的化学方程式2H₂+O₂=2H₂O。
这个方程式就像在说,两个氢气小家庭和一个氧气小家庭在一起发生了奇妙的变化,最后变成了两个水小家庭。
在化学方程式里,等号左边的是反应物,就像故事的开头;等号右边的是生成物,那就是故事的结尾啦。
而且化学方程式要遵循质量守恒定律呢,就像在这个故事里,原子的种类和数目可不能变,就像参加派对的人数不能突然变多或者变少一样。
我们在写化学方程式的时候,要先把反应物和生成物的化学式写对,然后再根据质量守恒定律去配平。
这就像搭积木一样,要一块一块地搭好,让两边的原子数目相等,这样化学方程式才是正确的呢。
四、离子符号离子符号也很有意思哦。
初中化学用语(全)

初中化学用语总结一、单质1 、由原子直接构成的单质:2、由分子构成的物质( 1)金属单质,如:( 2)非金属固体:H2 氢气Na 钠Cu 铜 C 碳N 2 氮气Mg 镁Zn 锌S 硫O2 氧气Al 铝Ag 银P 磷O3 臭氧K 钾Ba 钡( 3)稀有气体:Cl2 氯气Ca 钙Pt 铂He 氦气Mn 锰Hg 汞Ne 氖气Fe 铁Au 金Ar 氩气二、化合物阴离子———2— 2 —OH NO 3 Cl SO4 CO3 2阳离子(氢氧根离子 )(硝酸根离子 ) (氯离子 )(硫酸根离子 )(碳酸根离子 ) OH+H 2O HNO 3HCl H2SO4 H 2CO3 H2O 水硝酸盐酸硫酸碳酸水+NH3 ·H2O NH 4NO3 NH 4Cl( NH4)2SO4( NH4 )2CO3NH 4氨水硝酸铵氯化铵硫酸铵碳酸铵K+KOH KNO 3 KCl K 2SO4K 2CO3 K2O 氢氧化钾硝酸钾氯化钾硫酸钾碳酸钾氧化钾Na +NaOH NaNO 3NaCl Na2SO4 Na2CO3 Na2O 氢氧化钠硝酸钠氯化钠硫酸钠碳酸钠氧化钠Ba2+Ba(OH) 2Ba(NO 3) 2BaCl 2BaSO4 BaCO 3BaO 氢氧化钡硝酸钡氯化钡硫酸钡碳酸钡氧化钡2+Ca(OH) 2Ca(NO 3) 2CaCl 2CaSO4 CaCO3 CaO Ca氢氧化钙硝酸钙氯化钙硫酸钙碳酸钙氧化钙Mg 2+Mg(OH) 2 Mg(NO 3)2 MgCl 2 MgSO 4MgCO 3MgO 氢氧化镁硝酸镁氯化镁硫酸镁碳酸镁氧化镁3+Al(OH) 3 Al(NO 3)3 AlCl 3 Al 2(SO4)3 此物质不存在Al 2O3Al氢氧化铝硝酸铝氯化铝硫酸铝氧化铝Zn 2+Zn(OH) 2 Zn(NO 3) 2 ZnCl2、ZnSO 4 ZnCO 3 ZnO氢氧化锌 硝酸锌 氯化锌 硫酸锌 碳酸锌 氧化锌Fe 2+ Fe(OH) 2 Fe(NO 3)2 FeCl2 FeSO4FeCO3FeO 氢氧化亚铁 硝酸亚铁 氯化亚铁 硫酸亚铁 碳酸亚铁 氧化亚铁Fe 3+ Fe(OH) 3Fe(NO 3)3 FeCl3 Fe2 (SO4) 3 此物质不存在Fe2O3氢氧化铁硝酸铁 氯化铁 硫酸铁 氧化铁Cu 2+ Cu(OH) 2 Cu(NO 3)2 CuCl 2 CuSO4 CuCO 3 CuO氢氧化铜 硝酸铜 氯化铜 硫酸铜 碳酸铜 氧化铜 Ag +此物质不存在 AgNO 3 AgCl Ag 2 SO4 Ag 2CO3 Ag2O硝酸银 氯化银 硫酸银 碳酸银 氧化银三、化学反应一、( 1) 3 个碳原子;( 2) 2 个硫酸根离子;( 3)臭氧分子( 4)人体中含量最多的物质;( 5)氧化铝中铝元素的化合价;( 6)空气中含量最多的元素;(7)氯离子;( 8)氧化镁2 个氮原子;(10)碳酸根离子。
九年级化学化学用语-知识总结

九年级化学必须掌握的化学用语一、元素符号氢钠锌钡氦镁铁锰锂----铝锡碘铍----硅铅硼----磷氢----碳硫铜氮氯汞氧氩银氟钾铂氖钙金二、离子符号氢离子氧离子氟离子钠离子镁离子铝离子硫离子氯离子钾离子钙离子锌离子铜离子硝酸根离子氢氧根离子铁离子亚铁离子银离子钡离子汞离子硫酸根离子碳酸根离子铵根离子氯酸根离子高锰酸根离子锰酸根离子三、化合价+1+2K 、Na 、H 、AgCa 、Mg 、Ba 、Zn+1、+2+2、+3+3+4-1-2Cu Fe Al Si F O 口诀:钾钠氢银+1价;钙镁钡锌+2价。
铜1、2,铁2、3;还有铝3硅4为正价。
氟-1,氧-2;碳氮磷硫氯锰等,化合价在化合物里寻。
寻的方法:用“正负化合价的代数和=O ”列方程,用固定化合价找未知化合价原子团的化合价与对应的离子带电数值相同,正负一致。
※写出下列原子团的化合价:SO4:,CO3:,OH:NO3:,NH4:,MnO4(高锰酸根),MnO4(锰酸根),ClO3四、化学式特殊:氧气O2、氢气H2、氮气N2、臭氧O3单质碳-60C60氯气Cl2碘I2等其它:全部用元素符号表示。
如铁Fe、氩气Ar等氧化物:氧化钠氧化钾氧化镁氧化钙氧化铝氧化锌氧化铜氧化铁氧化亚铁四氧化三铁氧化汞氧化钡二氧化锰水二氧化碳一氧化碳二氧化氮二氧化硅五氧化二磷二氧化硫过氧化氢酸:盐酸硫酸硝酸碳酸化碱:氢氧化钠氢氧化钾氢氧化钙合氢氧化镁氢氧化钡氢氧化铜物盐:硫酸钠硫酸钾硫酸钙硫酸镁硫酸铜硫酸铁硫酸亚铁硫酸锌硫酸钡氯化亚铁氯化银氯化钡氯化钠氯化钾氯化钙氯化镁氯化铝氯化锌氯化铜氯化铁硝酸钠硝酸钾硝酸钙硝酸镁硝酸铜硝酸锌硝酸钡硝酸银氯酸钾高锰酸钾锰酸钾碳酸氢铵硝酸铵硫酸铵氯化铵温馨提示:以上物质的化学式要用化合价的知识“推”哟!!※特殊的化合物:(要记牢哈!!)双氧水H2O2甲烷CH4酒精C2H5OH醋酸CH3COOH尿素CO(NH2)2五、化学方程式(一)化合反应1、木炭的燃烧完全燃烧不完全燃烧2、硫的燃烧3、磷的燃烧4、铁丝在氧气中燃烧5、氢气的燃烧6、镁条的燃烧7、一氧化碳的燃烧8、氧化钙和水的反应9、铜和氧气加热10、铝和氧气反应11、二氧化碳和水的反应(二)分解反应1、过氧化氢和二氧化锰反应2、氯酸钾和二氧化锰加热3、高锰酸钾加热4、水通电5、碳酸钙高温6、碳酸分解(三)置换反应1、氢气和氧化铜加热2、木炭和氧化铜高温3、木炭和氧化铁高温4、锌和稀盐酸反应5、锌和稀硫酸反应6、铁和稀盐酸反应7、铁和稀硫酸反应8、镁和稀盐酸反应9、镁和稀硫酸反应10、铁和硫酸铜反应11、铝和硫酸铜反应12、铜和硝酸银反应(四)复分解反应1、盐酸和氢氧化钠反应2、盐酸和氢氧化钙反应3、盐酸和碳酸钙反应4、盐酸和碳酸钠反应5、盐酸和碳酸氢钠反应6、盐酸和硝酸银反应7、盐酸和铁锈反应7、硫酸和氢氧化钠反应8、硫酸和氢氧化钙反应9、硫酸和氯化钡反应10、硫酸和铁锈反应11、碳酸钠和氢氧化钙反应12、硫酸铜和氢氧化钠反应(五)特殊反应1、甲烷燃烧2、酒精燃烧3、一氧化碳和氧化铜高温4、一氧化碳和氧化铁高温5、二氧化碳和石灰水(氢氧化钙)6、二氧化碳和氢氧化钠〔六〕两个顺序1、1-20号元素(每五种一组);;2、金属活动顺序K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au 注意金属活动顺序的应用哟!你知道吗?。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学用语总结一、单质1、由原子直接构成的单质:2、由分子构成的物质(1)金属单质,如:Na 钠Cu 铜Mg 镁Zn 锌Al 铝Ag 银K 钾Ba 钡Ca 钙Pt 铂Mn 锰Hg汞Fe 铁Au金(2)非金属固体:C 碳S 硫P 磷(3)稀有气体:He 氦气Ne 氖气Ar 氩气H2氢气N2氮气O2 氧气O3臭氧Cl2氯气二、化合物三、化学反应一、(1)3个碳原子;(2)2个硫酸根离子;(3)臭氧分子;(4)人体中含量最多的物质;(5)氧化铝中铝元素的化合价;(6)空气中含量最多的元素;(7)氯离子;(8)氧化镁;(9)2个氮原子;(10)碳酸根离子。
(11)n个水分子_______二、①2N2;②5Na ;③3个铝离子;④氧化钙中钙元素为+2价⑤盐酸⑥三个磷原子⑦二个亚铁离子⑧铁锈的主要成分⑨天然气的主要成分是(1)2个汞原子;(2) 氧化铝中铝元素显+3价;(3)2个硝酸根离子;(4) 4个镁离子;(5)石灰浆的主要成分;(6)铁在氧气中燃烧的产物;(7)地壳中含量第二位的元素是;(8)导致温室效应的气体主要是。
三、(1)氧元素;(2)四氧化三铁;(3)氢氧化钾;(4)3N ;(5)CO32-;(6)氯化钡的化学式_______;四、写化学式(1) 最轻的气体是;(2) 在空气中体积分数最大的气体是_______;(3)绿色植物进行光合作用吸收的气体是_______;放出的气体是_______;(4)2个磷原子;(5)氢氧根离子;(6)生活中常做调味品的盐;(7)最简单的有机物。
(一)、化合反应:“多变一”1、氯化氢和氨气反应:氯化铵氨气氯化氢−→−+ Cl NH NH HCl 43===+2、红磷燃烧 :五氧化二磷氧气磷点燃−−→−+ 522O P 2O 5P 4点燃+ 3、硫的燃烧:二氧化硫氧气硫点燃−−→−+ 22SO O S 点燃+4、铁在氧气中燃烧:四氧化三铁点燃氧气铁−−→−+ 432O e F O 2e F 3点燃+5、镁的燃烧: 氧化镁氧气镁点燃−−→−+ O Mg 2O 2Mg 2点燃+ 6、铝的燃烧:氧化铝氧气铝点燃−−→−+322O Al 2O 34Al 点燃+ 7、铜在空气中加热:氧化铜氧气铜加热−−→−+ O Cu 2O Cu 22△+8、氢气的燃烧: 水氧气氢气点燃−−→−+O H 2O 2H 222点燃+9、木炭燃烧:二氧化碳氧气碳点燃−−→−+22CO O C 点燃+ 10、碳在不足量氧气中燃烧:一氧化碳氧气碳点燃−−→−+ CO 2O C 22点燃+11、一氧化碳的燃烧:二氧化碳氧气一氧化碳点燃−−→−+ 22CO 2O CO 2点燃+12、二氧化碳溶于水:碳酸水二氧化碳→+ 13、生石灰遇水反应:氢氧化钙水氧化钙→+(二)、分解反应:“一变多” 1、氧化汞加热分解:氧气汞氧化汞加热+−−→−↑+2O Hg 2Og H 2△2、过氧化氢催化分解:氧气水过氧化氢二氧化锰+−−−−→− ↑+22O Mn 22O O H 2O 2H 23、高锰酸钾加热分解:氧气二氧化锰锰酸钾高锰酸钾加热++−−→−4、氯酸钾与二氧化锰混合加热:5、电解水: 氢气氧气水通电+−−→−↑+↑222O H 2O2H 通电6、碳酸分解:二氧化碳水碳酸+→7、碱式碳酸铜(孔雀石)热分解:水二氧化碳氧化铜碱式碳酸铜加热++−−→−8、电解熔融氧化铝制铝:氧气铝氧化铝通电+−−→−↑+232O 3Al 4O l A 2通电9、碳酸钙高温分解: 二氧化碳氧化钙碳酸钙高温+−−→−↑+23CO O a C aCO C 高温(三)、置换反应:“单质+化合物 — 化合物+单质 A+BC — AC+B ”1、 氢气还原氧化铜:铜水氧化铜氢气加热+−−→−+ 2、 碳还原氧化铜:铜二氧化碳氧化铜碳高温+−−→−+金属活动顺序:3、 镁与稀盐酸反应:氢气氯化镁盐酸镁+→+4、 铝与稀盐酸反应:氢气氯化铝盐酸铝+→+5、 锌与稀盐酸反应:氢气氯化锌盐酸锌+→+6、 铁与稀盐酸反应:氢气氯化亚铁盐酸铁+→+7、 镁与稀硫酸反应:氢气硫酸镁稀硫酸镁+→+8、 锌与稀硫酸反应:氢气硫酸锌稀硫酸锌+→+9、铝与稀硫酸反应:氢气+铝+→稀硫酸硫酸铝10、铁与稀硫酸反应:氢气→铁++硫酸亚铁稀硫酸11、铝与硫酸铜反应:铜铝++→硫酸铝硫酸铜12、铁与硫酸铜反应:铜+→硫酸亚铁硫酸铜铁+13、铁与氯化铜反应:铜氯化亚铁→+氯化铜铁+(四)、复分解反应:1、氯化钾与硝酸银反应:氯化银→氯化钾++硝酸钾硝酸银2、盐酸与硝酸银反应:氯化银盐酸++→硝酸硝酸银3、氧化铜与硫酸反应:水+→硫酸铜硫酸氧化铜+4、氧化镁与硫酸反应:水硫酸镁+→氧化镁+硫酸5、氧化铁与盐酸反应:水+→氯化铁盐酸氧化铁+6、盐酸与氢氧化钠反应:水+→氢氧化钠氯化钠盐酸+7、硫酸与氢氧化钠反应:水→+硫酸+硫酸钠氢氧化钠8、硝酸与氢氧化铜反应:→+硝酸+水硝酸铜氢氧化铜9、氯化钡与硫酸反应:水+→氯化钡+硫酸硫酸钡9、氯化钡与碳酸钠反应:→氯化钡++碳酸钡氯化钠碳酸钠10、氢氧化钠硫酸铜反应:硫酸铜→+硫酸铜氢氧化钠+氢氧化铜11、氢氧化钙与氯化铁反应:氯化钙氢氧化铁氯化铁氢氧化钙+→+(五)、其他反应: 1、汽车尾气催化转换:氮气二氧化碳一氧化氮一氧化碳+−−→−+铂、钯22dP t P N CO 2NO2CO 2++,2、二氧化碳与氢氧化钙反应(澄清石灰水变浑浊):水碳酸钙氢氧化钙二氧化碳+→+3、大理石与盐酸反应:二氧化碳水氯化钙盐酸碳酸钙++→+4、甲烷(天然气的主要成分)燃烧:水二氧化碳氧气甲烷点燃+−→−+O H 2CO O 2CH 2224++点燃5、一氧化碳还原氧化铁:二氧化碳铁一氧化碳氧化铁高温+−−→−+232CO 32Fe COO e F ++高温6、一氧化碳还原氧化铜:二氧化碳铜一氧化碳氧化铜加热+−−→−+2CO u C COCuO ++加热10、碳酸氢铵与氢氧化钙混合:氨气水碳酸钙氢氧化钙碳酸氢铵++→+11、硫酸铵与氢氧化钠溶液混合加热:氨气水硫酸钠氢氧化钠硫酸铵△++−→−+ (NH 4)2SO 4+2NaOH Na 2SO 4+ H 2O+NH 3·H 2O7、葡萄糖在酶作用下的反应:水二氧化碳氧气葡萄糖酶+−→−+一、物质的学名、俗名及化学式⑴金刚石、石墨:C⑵水银、汞:Hg(3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2(5)盐酸、氢氯酸:HCl(6)亚硫酸:H2SO3(7)氢硫酸:H2S(8)熟石灰、消石灰:Ca(OH)2(9)苛性钠、火碱、烧碱:NaOH(10)纯碱:Na2CO3碳酸钠晶体、纯碱晶体:Na2CO3⋅10H2O(11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打)(12)胆矾、蓝矾、硫酸铜晶体:CuSO4⋅5H2O(13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质)(14)甲醇:CH3OH 有毒、失明、死亡(15)酒精、乙醇:C2H5OH(16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性(17)氨气:NH3(碱性气体)(18)氨水、一水合氨:NH3 H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱)(19)亚硝酸钠:NaNO2(工业用盐、有毒)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+ 的溶液呈棕黄色,其余溶液一般不无色。
(高锰酸钾溶液为紫红色)5、沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、BaSO4(也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:其余碱。
6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色)(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。
酒精为有特殊气体的液体。
7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)三、物质的溶解性1、盐的溶解性含有钾、钠、硝酸根、铵根的物质都溶于水含Cl的化合物只有AgCl不溶于水,其他都溶于水;含SO42-的化合物只有BaSO4不溶于水,其他都溶于水。
含CO32-的物质只有K2CO3、Na2CO3、(NH4)2CO3溶于水,其他都不溶于水2、碱的溶解性溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠和氨水,其他碱不溶于水。
难溶性碱中Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀,其他难溶性碱为白色。
(包括Fe(OH)2)注意:沉淀物中AgCl 和BaSO4不溶于稀硝酸,其他沉淀物能溶于酸。
如:Mg(OH)2 CaCO3 BaCO3 Ag2 CO3等3、大部分酸及酸性氧化物能溶于水,(酸性氧化物+水→酸)大部分碱性氧化物不溶于水,能溶的有:氧化钡、氧化钾、氧化钙、氧化钠(碱性氧化物+水→碱)四、化学之最1、地壳中含量最多的金属元素是铝。
2、地壳中含量最多的非金属元素是氧。
3、空气中含量最多的物质是氮气。
4、天然存在最硬的物质是金刚石。
5、最简单的有机物是甲烷。
6、金属活动顺序表中活动性最强的金属是钾。
7、相对分子质量最小的氧化物是水。
最简单的有机化合物CH48、相同条件下密度最小的气体是氢气。
9、导电性最强的金属是银。
10、相对原子质量最小的原子是氢。
11、熔点最小的金属是汞。
12、人体中含量最多的元素是氧。
13、组成化合物种类最多的元素是碳。
14、日常生活中应用最广泛的金属是铁。
15、最早利用天然气的是中国;【此课件下载可自行编辑修改,供参考,感谢你的支持!】。
