Western-blot常见问题解答
蛋白Western blot电泳——试验中常见问题及解答

蛋白质电泳与western blot1Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测。
对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。
该文主要通过以下几个方面来详细地介绍一下Western Blot技术。
(1)原理(2)分类①放射自显影②底物化学发光ECL ③底物荧光ECF ④底物DAB呈色(3)主要试剂(4)主要程序(5)实验常见的问题指南 1. 参考书推荐 2. 针对样品的常见问题 3. 抗体 4. 滤纸、胶和膜的问题 5. Marker 的相关疑问 6. 染色的选择7. 参照的疑问8. 缓冲液配方的常见问题 9. 条件的摸索10. 方法的介绍 11. 结果分析(1)原理:与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术也广泛应用于检测蛋白水平的表达。
(2)分类①放射自显影②底物化学发光ECL ③底物荧光ECF ④底物DAB呈色现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。
只要买现成的试剂盒就行,操作也比较简单,原理如下(二抗用HRP标记):反应底物为过氧化物+鲁米诺,如遇到HRP,即发光,可使胶片曝光,就可洗出条带。
(3)主要试剂1、(以利于溶解双丙稀酰胺)的去离子水配制含有29%(w/v)丙稀酰胺和1%(w/v)N,N’-亚甲双丙烯酰胺储存液丙稀酰胺29g,N,N-亚甲叉双丙稀酰胺1g,加H2O至100ml。
(完整版)westernblot问题汇总

(完整版)westernblot问题汇总WesternBlot问题解答1.凝胶肿胀或卷曲:注意转膜之前,切割下来的凝胶一定要在转膜缓冲液中浸泡平衡5-10分钟,要含有20%的甲醇。
2.条带歪斜、或漂移因为转膜仪使用时间太长,两块板之间的海绵由于长期使用变得很薄。
当按照阴极-海棉-滤纸-胶-膜-滤纸-海绵依次放好后两块板不能压紧,因而在胶和膜之间可能存在潜在的间隙,电转移时蛋白从胶和膜之间的空隙中流走,形成如图所示的形状。
使用十几张普通的草纸垫在两块海棉之间,条带就可以变得非常的漂亮。
另外,转膜时转膜液一定要浸没凝胶和膜,否则也可能出现上述情况。
3.单个或多个白点:转膜时在膜与胶之间有气泡。
做三明治时一定要逐层压紧,赶尽气泡。
同时转膜液要提前配置好,加好甲醇,保证转膜前夜体内气泡排净。
气泡存在的局部会抵抗蛋白转膜,降低转膜效率。
4、转膜缓冲液过热:缓冲液离子强度太低,或电压及电流过高。
按照上述方式配液,同时转膜过程中注意降温。
我在冰水混合物中转膜,效果很好。
5背景过高!1)封闭不全,我用5%-10%的光明脱脂奶粉,效果还可以,现在做基本上没什么背景。
如果你觉得不够可以加点BSA,1%吧。
2)一抗或者是封闭液与膜蛋白的交叉反应。
这种情况通常可以通过加入TWEEN-20或多次洗膜加以解决。
如果问题不能解决,那么降低一抗浓度,或更换封闭液种类可能解决3)一抗二抗中某些不纯的物质也可以造成背景。
4)抗体浓度太高,或孵育时间太常都可能遇到这种情况。
那么可以适当降低一抗二抗的浓度,或是用提高温度的方式来代替杂交时间的延长;另外,少量多次得洗膜效果要优于多量而长时间得洗膜效果。
5)曝光时间的控制。
通常我们线曝光一分钟试试,条带清晰背景也强,可以缩短曝光时间,或者过一段时间等荧光减弱以后再发光,一般也可以发出比较好的条带。
如果背景强于条带,那么肯定是前面默默个原因的一种,这是可以将膜在TBST中漂洗以下再发光,有时会有比较好的效果(仅限于国外较好的试剂盒,国产的不行,洗一下啥也没了!)这个时候可以洗膜,洗膜后重新发光。
Western Blotting 各种问题及解决办法

可能原因 1.抗体浓度过高 2.封闭液选择不当
3.封闭不完全
背景高且均一
4.抗体与封闭液中其他蛋 白发生交叉反应 5.清洗不充分 6.曝光时间过长
7.膜出问题
8.缓冲液污染或长菌 1.抗体浓度过高 2.封闭液选择不当
3.封闭不完全
背景高,且以斑点形式存 在
4.抗体与封闭液中其他蛋 白发生交叉反应
11.剥膜造成影响
12.膜上抗原降解 13.转好的膜存放时间过长 1. 抗体浓度过高 2.SDS造成非特异性结合 3. 二抗试剂的非特异结合 4.一抗特异性差 1.抗体浓度过高 2.上样量过高 抗体浓度过高
转膜不完全
பைடு நூலகம்
可能采取的措施 降低抗体(一抗/二抗)浓度 比较不同封闭液 根据不同的体系优化封闭液 提高封闭物浓度 优化封闭时间和(或)温度,室温下至少1小时或4℃过夜 在封闭液中添加终浓度0.05%的Tween-20 用含终浓度0.05%的Tween-20的封闭液稀释抗体 更换封闭液 avidin-biotin系统避免使用奶粉,奶粉中含有biotin 检测交叉反应:封闭一张干净的不含蛋白的膜,抗体孵育后检测 增加清洗次数及清洗液体积 如果之前未添加Tween-20,可添加Tween-20至终浓度0.05% 缩短曝光时间 确保转膜前,已根据厂商指导将膜彻底浸润 更换新膜 确保膜始终有足够的液体覆盖,避免干掉 避免徒手操作,应配戴手套,使用镊子 每一步孵育都应确保充分 重新配制缓冲液 降低抗体(一抗/二抗)浓度 比较不同封闭液 根据不同的体系优化封闭液 提高封闭物浓度 优化封闭时间和(或)温度,室温下至少1小时或4℃过夜 在封闭液中添加终浓度0.05%的Tween-20 用含终浓度0.05%的Tween-20的封闭液稀释抗体 更换封闭液 avidin-biotin系统避免使用奶粉,奶粉中含有biotin 检测交叉反应:封闭一张干净的不含蛋白的膜,抗体孵育后检测 确保转膜前,已根据厂商建议将膜彻底浸润 避免徒手操作,应配戴手套,使用镊子 更换新膜 确保膜始终有足够的液体覆盖,避免干掉 每一步孵育都应确保充分 膜过多时,应避免相互堆叠 操作时应小心,对膜造成的损伤会产生非特异性反应 使用新的缓冲液 用前过滤 确保转膜仪、杂交仪等仪器清洁无污染 确保转膜后膜上没有残留的胶 转膜结束后,染胶以确定转膜效率 转膜时胶与膜应充分接触 确保转膜时滤纸与膜装配正确 按厂商指导将膜充分浸润
western-blot过程中常见问题及解决对策

解决对策
两块玻璃板之间灌胶,胶总是不平
玻璃没有洗干净,应该洗得很干净
过硫酸铵和TEMED加量相对较多
加完试剂后应摇匀
总是漏胶
避免玻璃边缘(与胶条接触处)破损
将两块玻璃板摆放对齐,底部处于同一平面
膜上有明显气泡
操作时将气泡完全排除
靠膜一侧的滤纸应铺平
特异性低
优化一抗
提高一抗和二抗的稀释度
降低SDS-PAGE中蛋白的上样量
背景高优化封闭液ຫໍສະໝຸດ 优化洗涤缓冲液,增加洗涤次数
减少曝光时间
信号低
优化一抗
浓缩样品
选择更高灵敏度的发光液,如enlight等。
Western Blot 常见问题汇总

样品制备:变性条件——SDS LB直接裂解:用常温或者高温预热过(预热更有利于阻止蛋白水解或者磷酸酶去磷酸化,但容易遗忘,LB久煮某些性质会改变)的1*SDS LB(或者略高1.5*)直接加到细胞或者组织上并煮样。
通常6孔板细胞80%以上密度,需200ul,其他按平板面积比类推。
通常条件下,SDS LB都是过量的(因此不一定要严格参考SDS LB稀释比);如果SDS LB不够,样品核酸、蛋白浓度过高时,煮样后会发现tip吸不上来,非常粘、一砣一砣的,很容易堵住tip。
这时候常规做法有两种,1. 再煮5min。
常规煮样时间3-5min,样品过浓时就煮10min;2.如果10min煮样后,仍然吸不起来,才适当增加SDS LB,继续煮;也可以对样品进行超声。
煮样时间若过长,蛋白会凝固,此时以失去继续WB的意义,请丢弃(判断标准:出现明显的蛋白沉淀和水分层)此方法的缺点,SDS LB煮过的样品如果用来做IP,需要特殊方法,因此,这种制备方法制备的样品有使用局限。
非变性裂解法(不讨论诸如核抽提、亚细胞器分离等等了,其实类似)裂解细胞请尽量冰上操作,减缓酶解作用。
俺前boss nature文章上的裂解液配方是:20mM Tris/HCl, pH7.6, 100mM NaCl, 20mM KCl, 1.5mM MgCl2, 0.5% NP-40 and protease inhibitors (20μg/ml leupeptin, 10μg/ml pepstatin A and 10 μg/ml aprotinin)(此裂解液可用于抽提核蛋白),其中蛋白酶抑制剂很复杂也很贵,其实用0.5mM PMSF替代这三种就好了;如果还要做磷酸化蛋白,加1mM Na3VO4(现加现用),10 mM NaF, 1 mM Na3VO4, 50 mM beta-GP。
此方法的优点:NaCl浓度略低于生理状态,保证裂解细胞的方式较为温和,便于随后的IP等试验。
westernblot技术原理及常见问题分析

隔绝空气
ddH2O
0.1%SDS:<8%
异丁醇:>8%
灌制浓缩胶
插入梳子
浓缩胶 分离胶
样品
加样槽
蛋白质分 子的迁移 方向
电泳之后凝胶染色扫胶
1 2 3M
DNR BIS910凝胶
成像系统
注意: 做western blot通常用预 染maker!
转膜
• 要将电泳后分离的蛋白质从凝胶中转移到固 相载体(例如NC膜)上,通常有两种方法: 毛细管印迹法和电泳印迹法。
Western blot 技术原理及 常见问题分析
Western Blot简介及原理 Western Blot一般流程 Western Blot常见问题分析
Western Blot 简介:
• 印迹法(blotting)是指将样品转移到固相载体上,而后利用 相应的探测反应来检测样品的一种方法。
凝胶浓度与蛋白分离范围
凝胶浓度(%) 15 10 7.5 5.0
线性分离范围(KD) 12-43 16-68 36-94 57-212
SDS-PAGE浓缩胶(5% Acrylamide)及分离胶配方 表:/thread-20726-1-1.html
灌制分离胶
融,提取过程防止蛋白降解
转膜及抗体检测
凝胶肿胀或卷曲? 条带歪斜或漂移? 单个或多个白点?
转膜缓冲液过热?
可将凝胶在转膜之前放到转膜缓冲液 中浸泡5-10min
电转仪长期使用导致海绵变薄,“三 明治”结构不紧凑导致。可在两块海 绵之间垫上少许普通的草纸
确保膜和凝胶之间没有气泡 缓冲液中离子浓度太低,电流或电压
优点:方便、便宜,直接成像 缺点:有毒、灵敏度较低、背景高、反应慢、线性窄、不易保存、 不能重新剥离检测
Westernblot发光检测中常见的问题及解决方法

Western blot显色的方法主要有以下几种:一、放射自显影,二、底物化学发光ECL,三、底物荧光ECF,四、底物DAB呈色。现常用的有底物化学发光ECL和底物DAB呈色。大部分Western blot显色底物是化学发光底物,发表文章通常也是用底物化学发光ECL。
条带内无显影的白点与转膜和显影的操作有关。转膜前尽量将膜平衡,并注意胶和膜之间避免气泡,显影时膜与X光片间也应避免气泡。
散在小圆斑是牛奶封闭液中的杂质颗粒导致的,解决此类问题可提前配置好封闭液于4度保存,使用时勿混匀,仅用上层。
Western blot发光检测中常见问题及解决办法
现象
原因
解决办法
信号弱或无
背景较高。背景深是在Western blot发光检测中最常见的问题,造成背景深的原因很多。第一,封闭的问题,封闭条件一般为5%牛奶或BAS室温封闭2-4h,但最好4度过夜;实际上牛奶对于多数抗体来说效果不错,但二抗与牛奶可能有交叉反应,因此洗涤很重要。另外BSA蛋白单一,可降低因牛奶其他成分引起的背景。第二,TBST洗脱不彻底也会导致背景深,适当增加洗脱时间、次数、用量可以减轻背景颜色。第三,条带背景深也与曝光时间有关,曝光时间超过半小时出现背景是很正常的,所以可以的话建议曝光1-10min。英格恩公司生产的Westernblot发光试剂EnlightTM含独特的发光增强剂和精准的发光底物,比普通发光试剂灵敏度更高、更稳定,而且发光时间长,背景更低。第四,抗原-抗体浓度/HRP过高时,直接或间接结合在膜上,洗脱不掉等原因,考虑降低抗体浓度或蛋白上样量。
Western blot常见14个问题解决
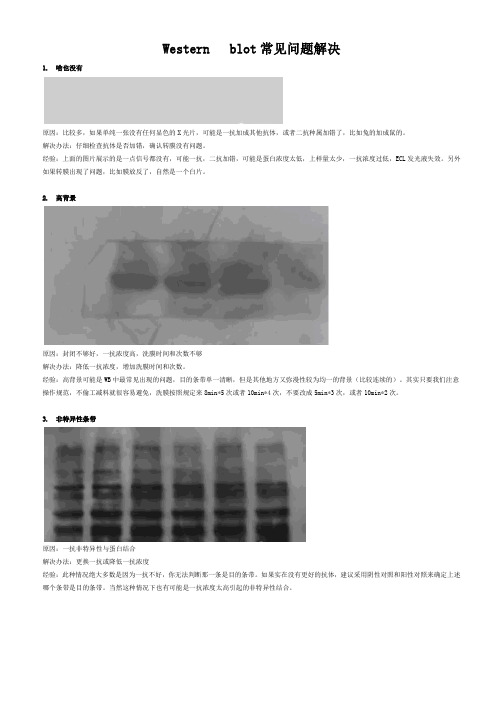
Western blot常见问题解决1. 啥也没有原因:比较多,如果单纯一张没有任何显色的X光片,可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠的。
解决办法:仔细检查抗体是否加错,确认转膜没有问题。
经验:上面的图片展示的是一点信号都没有,可能一抗,二抗加错,可能是蛋白浓度太低,上样量太少,一抗浓度过低,ECL发光液失效。
另外如果转膜出现了问题,比如膜放反了,自然是一个白片。
2. 高背景原因:封闭不够好,一抗浓度高,洗膜时间和次数不够解决办法:降低一抗浓度,增加洗膜时间和次数。
经验:高背景可能是WB中最常见出现的问题,目的条带单一清晰,但是其他地方又弥漫性较为均一的背景(比较连续的)。
其实只要我们注意操作规范,不偷工减料就很容易避免,洗膜按照规定来8min*5次或者10min*4次,不要改成5min*3次,或者10min*2次。
3. 非特异性条带原因:一抗非特异性与蛋白结合解决办法:更换一抗或降低一抗浓度经验:此种情况绝大多数是因为一抗不好,你无法判断那一条是目的条带。
如果实在没有更好的抗体,建议采用阴性对照和阳性对照来确定上述哪个条带是目的条带。
当然这种情况下也有可能是一抗浓度太高引起的非特异性结合。
4. 条带中出现边缘规则的白圈原因:电转中膜和胶之间存在气泡。
解决办法:转膜前去掉膜和胶之间的气泡经验:我们常常将电转液倒入一个盘子里,倒入的液体不能太多也不能太少,最好的高度是与放上第一层滤纸齐平,然后往滤纸上浇点转膜液,把电泳胶用清水清洗下,将电泳胶平铺到滤纸上,仔细检查滤纸与胶之间是否有气泡,可以左右前后观察,不同方向观察之后确认无气泡,然后再往胶上面浇点电转液,用两只手的拇指和食指轻轻夹住PVDF膜的两侧,使膜成U型,然后将U型的底部接触胶的中间,慢慢往两边放下膜,这样一般气泡很少。
然后上层滤纸同样用U型的放置方法,用玻璃棒稍微贴实下,然后盖上海绵。
注意不要来回赶气泡,这样反而会带入气泡。
WesternBlot蛋白免疫印迹原理及常见问题(FAQ)

WesternBlot蛋白免疫印迹原理及常见问题(FAQ)1. Western blot结果中的背景为什么较高?可能的原因及建议1.膜封闭不够——延长封闭的时间;选择更加适合的封闭液。
2.一抗稀释度不适宜——对抗体进行滴度测试,选择最适宜的抗体稀释度。
3.一抗孵育的温度偏高——建议4℃结合过夜。
4.膜在实验过程中干过——实验过程中要注意保持膜的湿润。
5.检测时曝光时间过长——减少曝光时间。
2. Western blot结果中杂带较多可能的原因及建议1.目的蛋白有多个修饰位点(磷酸化位点、糖基化位点、乙酰化位点等),本身可以呈现多条带。
2.查阅文献或进行生物信息学分析,获得蛋白序列的修饰位点信息,通过去修饰确定蛋白实际大小。
3.目的蛋白有其它剪切本——查阅文献或生物信息学分析可能性。
4.样本处理过程中目的蛋白发生降解——加入蛋白酶抑制剂;样本处理时在冰上操作。
5.上样量过高,太敏感——适当减少上样量。
6.一抗特异性不高——重新选择或制备高特异性的抗体。
7.一抗不纯——纯化抗体8.一抗或者二抗浓度偏高——降低抗体浓度。
3. Western blot结果中无信号或显示信号弱可能的原因及建议1.检测样本不表达目的蛋白——选择表达量高的细胞作为阳性对照,用于确定检测样本是否为阴性。
2.检测样本低表达目的蛋白——提高上样量,裂解液中注意加入蛋白酶抑制剂。
3.转移不完全或过转移——可以用丽春红染膜并结合染胶(考马斯亮蓝)后确定条带是否转至膜上或转移过头;适当调整转膜的时间和电流。
4.抗体不能识别测试种属的相关蛋白——购买抗体前应当认真阅读抗体说明书,确定其是否能够交叉识别测试种属的对应蛋白。
5.一抗孵育时间不足——建议4℃结合过夜。
6.二抗与一抗不匹配——选择针对一抗来源的种属的抗体。
7.洗膜过度——洗膜时间不宜过长,加入的去垢剂不宜过强或过多,建议使用0.1%的弱去垢剂Tween-20。
4. 其它现象:1.膜上多处出现黑点或黑斑——抗体与封闭试剂发生非特异性的结合。
Western Blot常见问题及处理

Western Blot常见问题及处理Western印迹要想做的好,每个步骤都不能马虎,细节决定成败!做的过程中自己要多总结,用心去体会,失败不可怕,可怕的是不去总结经验和教训,成功都是从不断的失败中得来的。
注意事项:未聚合的丙烯酰胺具有神经毒性,操作时应该戴手套防护.梳子插入浓缩胶时,应确保没有气泡,可将梳子稍微倾斜插入以减少气泡的产生,梳子拔出来时应该小心,不要破坏加样孔,如有加样孔上的凝胶歪斜可用针头插入加样孔中纠正但要避免针头刺入胶内.加水液封时用100ul的枪,缓慢均匀的加,以免产生胶不均匀.电泳槽内加入电泳缓冲液冲洗清除黏附在凝胶底部的气泡和未聚合的丙烯酰胺,同时建议低电压短时间的预电泳,清除凝胶内的杂质,疏通凝胶孔径以保证电泳过程中电泳的畅通(恒压10-20V,20-30min) .加样前样品应先离心,尤其是长时间放置的样品,以减少蛋白质带的拖尾现象为避免边缘效应,可在未加样的孔中加入等量的样品缓冲液样品缓冲液中煮沸的样品可在-20℃存放数月,但是反复冻融会使蛋白质降解为减少蛋白质条带的扩散,上样后应尽快进行电泳,电泳结束后也应直接或者转印.上样时,小心不要使样品溢出而污染相临加样孔取出凝胶后应注意分清上下,可用刀片切去凝胶的一角作为标记(如左上角)转膜时也应用同样的方法对pvdf膜做上标记(如左上角)以分清正反面和上下关系.否则一旦弄错先后顺序会很麻烦的。
转膜前1-2个小时-20°预冷转膜液,特别是新鲜配的转膜液。
预冷后转膜效果较好。
转膜液可以重复利用,每次用的时候再加点甲醇就可以了。
转膜时,一定要将三明治各层之间的气泡赶干净,否则转膜时产热量会很大,很影响转膜效率。
离心管装满水放-20°冻好,放在转膜液中降温。
转膜完,可以通过预染marker看看转膜的情况。
有没有转过了穿到膜后的滤纸上,或者还有部分残留在胶上。
以便下次调整转膜时间和电压。
二抗浓度不宜太高否则会导致背景过高.常见问题:1.电泳中常出现的一些现象:●︶条带呈笑脸状原因:凝胶不均匀冷却,中间冷却不好; 电泳系统温度偏高。
Western Blot常见问题及解决方法

Western Blot(蛋白质印迹)技术是生物医学研究中常用的蛋白质分析技术之一,可以用于检测蛋白质样品中的特定抗原。
然而,在进行Western Blot实验时,可能会遇到一些问题,下面列举了一些常见问题及解决方法:1.电泳条带不清晰或无条带:解决方法:•检查样品质量,确保待检测样品是可用的,无降解或污染。
•调整电泳参数,如电压、电流和时间等,以优化电泳效果。
•更换抗体,确认抗体的特异性,避免非特异性结合。
2.膜上背景过重:解决方法:•在抗体孵育之前,使用封闭剂封闭膜上的非特异性位点,减少抗体非特异性结合。
•减少一抗和二抗的浓度,减轻非特异性结合。
•增加洗涤次数和时间,以清除未结合的抗体和蛋白质。
3.目的蛋白信号弱或无:解决方法:•调整一抗和二抗的浓度,提高特异性结合的信号强度。
•选择更灵敏的显色方法,如化学发光法等。
•在转膜前,优化样品处理,如提取、纯化和浓缩等步骤。
4.非特异性条带:解决方法:•检查抗体特异性,确认抗体的特异性,更换抗体以减少非特异性结合。
•检查样品处理步骤,避免样品中的杂蛋白干扰。
•增加洗涤次数和时间,以清除未结合的抗体和非特异性结合的蛋白质。
5.显影后膜上条带处变为黄色或白色:解决方法:•可能是由于曝光时间过长或显影液浓度过高导致的,可以降低曝光时间和减少显影液浓度来解决问题。
•在膜清洗时使用甲醇或乙醇等有机溶剂,清除膜上的多余抗体和显色剂。
6.条带内无显影的白点:解决方法:•在转膜前检查是否存在气泡,气泡会影响转膜效果和条带形成。
•增加转膜时间和电流,以促进蛋白质的转移。
•检查显影液是否过期或存在质量问题。
7.存在散在小圆斑:解决方法:•这可能是由于封闭液中的杂质颗粒导致的,可以通过过滤封闭液来清除杂质。
•检查一抗和二抗是否含有杂质抗体或存在抗体污染的情况,更换抗体可以解决问题。
•检查显色液是否存在问题,如过期或存在杂质等,更换显色液可以解决问题。
8.条带变形或不均匀:解决方法:•检查电泳胶的质量和制备过程是否存在问题。
蛋白Westernblot电泳——试验中常见问题及解答

蛋白Westernblot电泳——试验中常见问题及解答蛋白质电泳与western blot1Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测。
对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。
该文主要通过以下几个方面来详细地介绍一下Western Blot技术。
(1)原理(2)分类①放射自显影②底物化学发光ECL ③底物荧光ECF ④底物DAB呈色(3)主要试剂(4)主要程序(5)实验常见的问题指南 1. 参考书推荐 2. 针对样品的常见问题3. 抗体 4. 滤纸、胶和膜的问题 5. Marker 的相关疑问 6. 染色的选择7. 参照的疑问8. 缓冲液配方的常见问题9. 条件的摸索10. 方法的介绍11. 结果分析(1)原理:与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术也广泛应用于检测蛋白水平的表达。
(2)分类①放射自显影②底物化学发光ECL ③底物荧光ECF ④底物DAB呈色现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。
只要买现成的试剂盒就行,操作也比较简单,原理如下(二抗用HRP 标记):反应底物为过氧化物+鲁米诺,如遇到HRP,即发光,可使胶片曝光,就可洗出条带。
(3)主要试剂1、(以利于溶解双丙稀酰胺)的去离子水配制含有29%(w/v)丙稀酰胺和1%(w/v)N,N’-亚甲双丙烯酰胺储存液丙稀酰胺29g,N,N-亚甲叉双丙稀酰胺1g,加H2O至100ml。
westernblot实验步骤中常见问题和处理方法

westernblot实验步骤中常见问题和处理方法Western blot 结果中背景较高 (high background):膜封闭不够/封闭液(blocking buffer)不适合:延长封闭时间,增加封闭液的浓度;尝试不同种类的封闭液,对比结果后选出效果最佳的。
洗膜不够彻底:增长洗涤时间;增加洗涤剂的浓度。
一抗/二抗(primary/secondary antibodies) 稀释度不适宜:对抗体进行滴度测试(titre test),选择最适宜的抗体稀释度。
一抗是多克隆抗体 (polyclonal antibody): 特异性降低,可能与其他蛋白结合,建议换用单克隆抗体(monoclonal antibody)。
膜在实验过程中干过: 实验过程中要切记保持膜的湿润。
检测时曝光时间过长: 减少曝光时间。
Western blot 结果中杂带较多 (multiple/non-specific bands):目的蛋白有多个修饰位点(磷酸化位点(phosphorylation site)、糖基化位点(glycosylation site)、乙酰化位点(acetylation site) 等),本身可以呈现多条带。
样本处理过程中目的蛋白发生降解(protein degradation): 加入蛋白酶抑制剂 (protease inhibitor);样本处理时在冰上操作; 避免/减少样本的冻融循环(free-and-thaw cycle)。
样本处理过程中目的蛋白发生聚集(protein aggregation):增加DTT的浓度;增长加热的时间。
上样量(sample loading)/ 样本浓度过高:适当减少上样量/样本浓度。
一抗是多克隆抗体 (polyclonal antibody): 特异性降低,可能与其他蛋白结合,建议换用单克隆抗体(monoclonal antibody)。
一抗/二抗不纯:纯化抗体;购买高纯度抗体。
western常见问题及解决方法

#
#
细胞和组织的处理
• 问题三.液氮研磨后离心样本不能分层 • 研磨的时候不充分,会形成絮状的液态
物质,如有手动匀浆器可以再进行处理
注意:
• 裂解时抑制剂的添加非常重要,做一般 的蛋白加入PMSF即可,个别蛋白需要 加Aprotinin, Leupeptin ,做磷酸化 的蛋白需要加入磷酸酶抑制剂 (cocktail)
#
电转
• 膜的选择还要考虑到目的蛋白分子 量的大小,如果目的蛋白分子量为 20KD以下,最好用0.22微米的膜, 大于20KD可以选择0.45微米的膜。
#
电转
• 问题二.电转时膜、滤纸、胶大小有何讲究?
如果是用的是半干转,顺序为:阴极-》滤纸 -》胶-》膜-》滤纸。滤纸的长宽分别比胶 小1-2mm,而膜的长宽分别比胶大1-2mm。
#
细胞和组织的处理
• 问题四.提取的蛋白样本如何保存最合适? 解答:温度越低越好 1、液氮 2、-80度冰箱 3、-30度冰箱 4、加入loading buffer煮后保存于-20度。
#
实验流程
蛋白提取 √ SDS凝胶配制
电泳 电转 封闭及一抗 显色
#
SDS凝胶配制
• 问题一.胶凝的效果不好是什么原因? 1、AP时间过长,重新配制AP 2、可以适当多加入TEMED 3、室温低 4、混合不均匀
#
电泳
• 问题二.跑电泳的时候配的胶总是“缩” 是什么原因呢?是有的成分不对吗? 胶里的水分被蒸发了。过夜时拿保鲜膜 包起来,在里面加点水保持湿度就可以 了。 也可能母液(30%聚丙烯酰胺)有问题, 你可以重新配制一份观察
Western blot发光检测中常见的问题及解决方法

Western blot发光检测中常见的问题及解决方法免疫印迹试验(Western blot)是分子生物学、生物化学和免疫遗传学中常用的一种实验方法,被广泛应用于蛋白表达水平的研究、抗体活性检测和早期疾病诊断等多个方面。
其中较为简单也为大家所普遍接受的Western blot显色方法为底物化学发光法ECL,文章根据发光检测中常见的几种问题现象与各位生物人一起探讨。
众所周知,Western blot的原理是蛋白质在电力场的作用下,由大到小的进行排列,利用电泳进行分离和富集。
拥有抗原表位的蛋白质分子被抗体(一抗)特异性识别并与之结合。
在此基础上,酶或荧光标记的二抗识别并结合一抗,通过与底物反应显色来观察目的蛋白。
Western blot显色的方法主要有以下几种:一、放射自显影,二、底物化学发光ECL,三、底物荧光ECF,四、底物DAB呈色。
现常用的有底物化学发光ECL和底物DAB呈色。
大部分Western blot显色底物是化学发光底物,发表文章通常也是用底物化学发光ECL。
ECL法检测辣根过氧化物酶的原理是辣根过氧化物酶在H2O2存在下,氧化化学发光物质鲁米诺(lumino,氨基苯二酰一肼)并发光,在化学增强剂存在下光强度可以增大1000倍,通过将印记放在照相底片上感光就可以检测辣根过氧化物酶的存在。
ECL法操作简便,应用现成的试剂盒,按照说明,将两种显色底物等体积混合后将其覆盖在膜表面使其均匀,用玻璃胶片把膜包起来,马上在暗室中将X光片覆盖在膜的上面,显影、定影(或用荧光检测仪检测)。
ECL 法具有灵敏度高,线性范围广等特点。
图1 ECL检测原理图Western blot发光检测受多种因素影响,主要包括:抗原含量,抗体敏感度,底物敏感度,显影和定影效率,等。
现根据检测中几种常见的现象问题进行分析:1.目的蛋白信号弱或无。
在Western blot发光检测中常见的问题之一就是目的蛋白信号弱或无。
首先考虑是否转膜不充分/过转,如果是,则要优化转膜条件;其次,在转膜合适的前提下考虑是否抗体-抗原敏感性过低,也可能是底物HRP或底物活性降低,可以通过加大上样量/提高抗体浓度/使用敏感底物/延长压片时间解决。
Western Blot实验常见问题的解决以及内参的选择

W estern Blot实验中为什么检测无信号?(白板)大概总结为一下几类原因:(1)样品中目的蛋白丰度很低,低于实验的检测下限(2)一抗不识别检测物种的蛋白,同时若有阳性参照的话提供阳性对照蛋白,若阳性对照正常则说明抗体及实验参照没有问题,可能是样本中目的蛋白含量比较低。
(3)蛋白降解(4)待测样品的确为阴性;(5)一抗失效;(6)抗原量不足,每泳道蛋白上样量不低于0.1ugWestern Blot实验中为什么检测的结果分子量大小与实际不符?(1)蛋白存在翻译后修饰—比如蛋白的磷酸化,糖基化等,这些都会增加蛋白的分子量大小。
(2)蛋白存在翻译后剪切—比如很多蛋白首先被合成为前体形式,然后通过剪切获得生物学活性(3)剪接变异体—相同的基因,经过选择性剪接会产生不同分子量大小的蛋白。
(4)相对电荷—氨基酸的组成(带电或不带电)(5)蛋白形成多聚体—比如蛋白二聚体。
为什么wb的结果与QPCR结果趋势不一样?(1)WB反映的是蛋白水平的结果,qpcr反映的是基因水平的结果。
理论上蛋白水平与基因水平是一致的,但是mRNA的高低不代表其表达蛋白的高低。
也有一些基因可能在组织样品中没有正常翻译(或发生泛素化修饰,修饰水平不一致),这样即使qpcr检测结果有表达,但是若蛋白没有正常翻译的话,WB则检测不到目的条带。
为什么检测结果有很多杂带?(1)可能是样品本身体内表达的蛋白具有多种修饰形式如糖基化、磷酸化、乙酰化等;(2)蛋白降解,导致蛋白分子量降低;(3)蛋白形成多聚体形式;为什么WB检测的背景比较高?(1)可能抗体浓度浓度较高,(2)抗原量较大。
(3)一张膜中有的目的条带较弱,为了能让较弱条带显示出来,曝光时间较长转膜后蛋白少或者没有可能原因(1)转膜板放置出问题(2)凝胶与膜接触不好(3)目的蛋白被其他高丰度蛋白掩盖,如白蛋白, IgG等Western Blot实验中为什么选择内参?内参即是内部参照(Internal Control),对于哺乳动物细胞表达来说一般是指由管家基因编码表达的蛋白(Housekeeping Proteins),它们在各组织和细胞中的表达相对恒定,在检测蛋白的表达水平变化时常用它来做参照物。
western-blot常见问题及解答

常见问题及解答:1、两快玻璃板之间灌胶,胶为什么总是不平1) 你的玻璃洗干净没有应该要洗得非常干净!2) 过硫酸铵和TEMED的加量不合适,加量相对较多,凝胶凝固过快也会胶不平,最多按照分子克隆加倍3) 加完试剂以后没有很好的摇匀,导致有些部位的聚合剂浓度过高,聚合相对较快造成胶不平;4) 稍微注意手法,均匀加入5) 灌胶后应该用水或者正丁醇压胶面或用20%的乙醇封顶(没有毒性可以除气泡,使用效果极好)。
战友小新723认为:“第一天灌胶后,用乙醇直接压,待乙醇挥发完毕后,上面加一层水,第二天电泳用,效果很好。
不用正丁醇,乙醇比正丁醇效果要好多了”。
6) 边缘胶是不容易聚合完全的,灌完胶后要立即加无水正丁醇覆盖,浓度越低的胶越不要使用双蒸水压顶,另外还可以在压顶试剂如正丁醇中添加少许AP来增加边缘胶的凝聚强度7) 温度也是影响胶聚合的重要因素,我们有些同学为了让胶更快的凝固而把胶放到50度的温箱,由于受热不均匀,造成胶聚合不均匀。
【2、胶为什么总是漏1)每次电泳完后,洗净玻璃、胶条和其它附件,下次用之前,用75%酒精擦拭玻璃和胶条,能有效防漏,且利于剥胶。
2)避免玻璃边缘(与胶条接触处)破损很重要,尤其是下面和胶条接触的地方3)关键是找一块很平的桌面,使两块玻璃底面非常齐就行了4)胶条一定要干,跑完电泳后,胶条就放在实验台上晾着。
5)下面的胶条注意不要老化,如果有裂纹的话用保鲜膜垫在上面,也可以有效防止漏胶,或者反过来用6)玻璃在使用过程中容易造成小的缺口,从而导致封条无法完全密封,装好架子后,在玻璃底边上抹上一层薄薄的凡士林就好了,两边多点(容易从两边漏)这样就不会漏了,就算是用了很久的很多小缺口的玻璃都没有问题,然后转移到电泳槽的时候,去掉封条,把底上的凡士林擦干就OK了(注意,一定要擦干净,尤其是少量进入了两隔玻璃之间空腔的,赢伟凡士林不导电,会影响第2相的效果的7)你可以在海绵垫下再垫一些纸,使得它与玻璃贴的更紧密。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Western Blot详解-常见的问题指南实验常见的问题指南《抗体技术实验指南》和Antibodies(a laboratory manual,wrote by Ed Harlow ,david lane)两本书不错。
2. 针对样品的常见问题B. 做线粒体膜UCP2蛋白的Western Blot (以下简写成Western Blot),提取线粒体后冻存(未加蛋白酶抑制剂),用的博士德的一抗,开始还有点痕迹,现在越来越差,上样量已加到120μg,换了个santa cloz的一抗仍不行。
是什么原因?蛋白酶抑制剂单加PMSF行吗?解答:怀疑是样品问题,可能是:1,样品不能反复冻融;2,样品未加蛋白酶抑制剂。
同时,建议检查Western Blot过程,提高一抗浓度。
对于加蛋白酶抑制剂来说,一般加PMSF就可以了,最好能多加几中种蛋白酶抑制剂。
F. 如果目标蛋白是膜蛋白或是胞浆蛋白,操作需要注意什么?解答:如果是膜蛋白和胞浆蛋白,所用的去垢剂就要温和得多,这时最好加上NaF去抑制磷酸化酶的活性。
G. 我的样品的蛋白含量很低,每微升不到1微克,但是在转膜时经常会发现只有一部分蛋白转到了膜上,就是在转膜后染胶发现有的孔所有的蛋白条带都在,只是颜色变淡了,有什么办法可以解决?解答:你可以加大上样量,没有问题,还有转移时你可以用减少电流延长时间,多加5-10%甲醇。
H. 想分离的蛋白是分子量260kd的,SDS-PAGE电泳的分离胶浓度多大合适?积层胶的浓度又该用多少?这么大分子量的蛋白容易作Western Blot吗?解答:260kd的蛋白不好做,分离胶用6%,Stacking Gel 3.5%。
I. 如果上样量超载,要用什么方法来增加上样量?如果需要加大上样量使原来弱的条带能看清楚。
解答:可以浓缩样品,也可以根据你的目标分子量透析掉一部分小分子蛋白。
一般地,超载30%是不会有问题的。
如果已经超了不少了,而且小分子量的也要,可以考虑加大胶的厚度,可以试试1.5mm的comb。
M. 还有一问题,一般一次上样的蛋白总量是多少,跟目的蛋白的表达量有关系吗?解答:Western Blot一般上样30-100微克不等,结果跟目的蛋白的丰度、上样量、一二抗的量和抚育时间都有关系,也与显色时间长短有关。
开始摸条件时,为了拿到阳性结果,各个步骤都可以量多一点时间长一点,当然背景也就出来了。
要拿到好的结果,如果抗体好的话比较容易,抗体不好的话就需要反复地试了,当然有的不适合Western Blot的怎样做也不行。
所以拿到好的结果不容易。
N. 做组织样品的western的时候,处理样品有什么诀窍吗?还有,您用过大牛血清做封闭剂吗?浓度如何?效果是不是比BSA好一点?解答:必须进行研磨、匀浆、超声处理,蛋白质溶解度会更好,离心要充分,膜蛋白需用更剧烈的方法抽提,低丰度膜蛋白可能还要分步抽提(超速离心)。
还有一点就是组织中的蛋白酶活性更强,需要注意抑制蛋白酶的活性(加入PMSF和蛋白酶抑制剂cocktail),封闭剂一般5%脱脂奶粉较常用。
如果一抗为多克隆">克隆抗体,使用BSA也是不错的选择。
O. 您是否可以介绍一下大分子量蛋白200KD,在做western要注意什么呢?解答:做200kd蛋白的Western Blot时要注意,分离胶最好选择>7%的;剥胶时要小心;转移时间需要相应延长;要做分子量参照(否则出现杂带不知道如何分析)。
Q. 我要检测的目的蛋白是分子量大概为42kd的膜蛋白,膜蛋白提取可不可以不用到超速离心机,有没有直接用低温高速离心机就可以的提到膜蛋白的方法,42kd的蛋白分子量算不算大?解答:如是需要提取膜蛋白,(而不是只需要提取膜蛋白),可以用Ripa buffer提取膜蛋白和胞浆蛋白,用这个做Western Blot就可以了。
如果是非要只提取膜蛋白就要用到超速离心机。
42kd 不算大,也不算小,所以,可以按照一般的转移方法实施。
R. 蛋白的上样量有没有什么具体的要求?解答:上样量要根据实验的要求来定,如果要求是定量和半定量的Western Blot 则上样量要均等,如果只是要定性,则没有太大的关系,尽量多上就行了,但是不要超过0.3μg/mm2。
3. 抗体U. 同一公司的另外抗体用这个稀释度做出来效果很好,所以没做预试,怕费时间,用什么样的稀释度比较好呢?解答:一抗当然可以过夜,如果你想所短Western Blot时间的话,可以增高一抗的孵育温度,我们实验室一般37度,两小时就足够了;至于一抗和二抗得稀释度,你可以一抗1:1500;二抗1:20000试试。
另外建议你4. 滤纸、胶和膜的问题X. NC膜\ PVDF膜\ 尼龙膜怎样鉴别?解答:就结合能力而言:尼龙膜结合DNA和RNA能力可达480-600μg/cm2,可结合短至10bp的核酸片段;硝酸纤维素膜结合DNA和RNA能力可达80-100μg/cm2,对于200bp的核酸片段结合能力不强;PVDF膜结合DNA和RNA能力可达125-300μg/cm2。
硝酸纤维素膜依靠疏水性相互作用结合DNA,结合不牢固;PVDF 膜结合牢固,耐高温,特别适合于蛋白印迹。
Y. 在做Western Blot时,PBDF膜用甲醇浸泡的目的?解答:PVDF膜用甲醇泡的目的是为了活化PVDF膜上面的正电基团,使它更容易跟带负电的蛋白质结合,做小分子的蛋白转移时多加甲醇也是这个目的。
AA. 转膜后经丽春红染色的条带,为什么大蛋白分子的一端(即点样空的一侧)的转膜好象不是很好,为什么?解答:这是正常的,大分子的蛋白转移的慢,你延长转移时间和电流,大分子一端就会好的多,但是小分子的就有可能会变淡。
DD. 做HSP WESTEN定量,同样的抗体免疫组化能做出,而WESTEN却不能?解答:这多半是抗体的问题,要看抗体的说明,是否能做Western Blot和IHC。
II. 膜、滤纸、胶大小有何讲究?解答:如果是用的是半干转,顺序为:阴极-》滤纸-》胶-》膜-》滤纸。
滤纸的长宽分别比胶小1-2mm,而膜的长宽分别比胶大1-2mm。
绝对禁忌:上下两层滤纸因为过大而相互接触,这样会短路,电流不会通过胶和滤纸。
JJ. 蛋白质的分子量跨度很大,如要分离小21KD,中至66KD,大至170KD,可以一次做好吗?解答:这么广的分布不好转移,一般建议:21kd和66kd可以一起转,12%SDS-PAge,湿转36V ,3-5hrs 就可以了,可以根据你实验室的经验调节;170kd 用7%SDS-page,48V 10hrs-16hrs。
KK. 不能很好地将大分子量蛋白转移到膜上,转移效率低怎么样解决?解答:可以考虑:转移缓冲液中加入20%甲醇(是指终浓度)(优化的转移缓冲液,可以参考《蛋白质技术手册》),因为甲醇可降低蛋白质洗脱效率,但可增加蛋白质和NC膜的结合能力,甲醇可以防止凝胶变形,甲醇对高分子量蛋白质可延长转移时间;转移缓冲液加入终浓度0.1%SDS,也是为了增加转移效率;用优质的转移膜,或使用小孔径的NC膜(0.2微米);使用戊二醛交联;低浓度胶,如低至6%。
太大时还可以考虑用琼脂糖胶;提高转移电压/电流;增加转移时间。
PVDF转移膜:PVDF是一种高强度、耐腐蚀的物质,通常是用来制造水管的。
PVDF膜可以结合蛋白质,而且可以分离小片段的蛋白质,最初是将它用于蛋白质的序列测定,因为硝酸纤维素膜在Edman试剂中会降解,所以就寻找了PDVF作为替代品,虽然PDVF膜结合蛋白的效率没有硝酸纤维素膜高,但由于它的稳定、耐腐蚀使它成为蛋白测序理想的用品,一直沿用至今。
PVDF膜与硝酸纤维素膜一样,可以进行各种染色和化学发光检测,也有很广的适用范围。
这种PVDF膜,灵敏度、分辨率和蛋白亲和力在精细工艺下比常规的膜都要高,非常适合于低分子量蛋白的检测。
但PVDF膜在使用之前必需用纯甲醇进行浸泡饱和1-5秒钟。
离子交换型转移膜:硝酸纤维素和PVDF膜是靠疏水作用结合蛋白的,还有一类膜是根据离子交换的方式结合生物大分子的。
由DEAE(二乙氨乙基)修饰的纤维素制成的DEAE阴离子交换膜同样可以作为蛋白质印迹的固相支持物。
DEAE可以有效的结合阴离子基团,包括那些高于其等电点的蛋白质。
在pH10以下,DEAE基团都能带电荷,在低离子强度的转移液中结合蛋白分子。
其最适的pH环境为5-7。
DEAE膜可以用于蛋白多糖、病毒、酶以及血红蛋白的研究。
这种0.45μm孔径的DEAE膜,除了可以做Western Blotting外,还可以用于核酸结合研究。
5. Marker的相关疑问用80V进行SDS-PAGE电泳,用恒压10V45min转印的。
前几次做Western Blot时没有进行丽春红染色,但尽管用了此方法也仅能看到marker有一条大约是30KD的条带出现。
再就是把70KD和130KD两个目的蛋白同时在一块胶上进行分析,用培养基样品进行分析6. 染色的选择OO. Western Blot哪种染色好?解答:(1)阴离子染料是最常用的,特别是氨基黑,脱色快,背景低检测极限可达到1.5μg,考马虽然与氨基黑有相同的灵敏度,但脱色慢,背景高。
丽春红S和快绿在检测后容易从蛋白质中除去,以便进行随后的氨基酸分析7. 参照的疑问SS. 转膜时采用电流是否比电压准确,是否根据0.8mA/cm2,一般1小时左右?解答:不是的,半干法推荐用恒流,一般根据目的蛋白的大小来确定电流和时间。
8. 缓冲液配方的常见问题UU. 转膜后的脱脂奶粉封闭时,所用的防沫剂A是什么?还有Tris-HCl是不是就是用Tris和盐酸配出来的呢?解答:转膜后的脱脂奶粉封闭液是5%的TBST脱脂奶粉。
Tris-HCl就是Tris盐用HCl调ph值,配置而成。
VV. 准备做大鼠脑子的Western Blot,蛋白质位于细胞核中,请问此蛋白质的提取液及操作方法是?每一步都必须要低温吗?这种蛋白质是磷酸化的蛋白质,操作时如何防止去磷酸化的发生?解答:可以用提取总蛋白的buffer提核蛋白,可以加NaF防止去磷酸化。
XX. 最近作了两次Western Blot,不但没阳性结果,显色背景都没有,电泳和转膜都染过,有条带。
底片和显色液及DAB显色液均试过,没问题。
1、检测GAD--分子量67kd,提取液有蔗糖,其余同三去污裂解液。
蔗糖不会有影响把?样本--20度放置一周内测。
2、一抗放置2年,可能效价不高!用的是1:100。
如果是一抗的原因,不会背景都没有把?3、第一次有不均匀背景,因为一抗过夜时密封袋不均匀。
后两次无背景显色。
4、封闭液用的是含15%脱脂奶粉TBST,漂洗液用的是含1%BSA的TBST液,TWEEN-20为0.1%,不会是封闭液的问题吧?解答:可以在下面几个问题上找找原因。
