醚和环氧化合物 (3)优秀课件
合集下载
有机化学课件--醚和环氧化合物

烃基名称用“二…基”来表示, “二”字和“基”字可以
省略 2024/3/12
有机化学课件
2. 系统命名法 当烃基命名复杂时,醚可当作烃氧基衍生物来命名
OCH3
CH3O
CH3
2-甲氧基戊烷 CH3O CH2CH=CH2 3-甲氧基-1-丙烯
(甲基烯丙醚)
对甲氧基甲苯
O
环戊氧基苯
2024/3/12
有机化学课件
2. 环氧乙烷的制法
(1)烯烃与过氧化物反应
O
C6H5C O OH
C6H5CH=CH2
CHCl3
O
C6H5CH
CH2
H
H
CH3CO3H, C6H6
H
O
CC
25℃
C6H5
C6H5
C6H5
H C6H5
2024/3/12
有机化学课件
注意:如果烯烃有顺反异构,用过氧酸氧化后,取 代基的相对位置不变,再如:
环氧化合物与氢化锂铝的反应
O
CH3CH2CH
CH2
LiAlH4
Li O
CH3CH2CH
CH2
H AlH3
2024/3/12
OLi
CH3CH2CHCH3
H2O
OH
CH3CH2CHCH3
环氧化合物与格氏试剂的反应
O
CH3CH
CH2
(1) C6H5MgBr, Et2O
(2) H3O
有机化学课件
OH
CH3CHCH2C6H5
H3C
Br-
C
CHCH3
H3C
Br
(CH3)2CCHCH3
OH
2024/3/12
[课件]大学有机化学 醚和环氧化合物PPT
![[课件]大学有机化学 醚和环氧化合物PPT](https://img.taocdn.com/s3/m/18db71dd04a1b0717fd5dd5e.png)
第八章 醚和环氧化合物
第一节 醚 (三、醚的化学性质)
醚键断裂反应属于亲核取代反应, 通常伯烷基醚易按SN2机制进行, 叔 烷基醚易按SN1机制进行。
C H 3 O C H (H C )2 H C 3 H
H-I
SN2 C H 3 C H C H - O H + I - C H C H 3 2 3
H C H 3 + O C H (H C )2 H C 3 H
9 0 %
1 0 %
2-甲基环氧乙烷
2-氯-1-丙醇
1-氯-2-丙醇
上页
下页
首页
第八章 醚和环氧化合物
第二节 环氧化合物 (二、开环反应)
(二) 碱催化开环反应
环氧化合物在强碱作用下, 环 被打开,生成相应的加成产物。
O H, H O 2 N H 3 O C H O H 3 C H O N a 3 H C C H 2 2 O HO H H C C H 2 2 O HN H 2 乙 二 醇 2 -氨 基 乙 醇
1-甲氧基-2-丙醇
OC H C H M g B r 3 2
5 ℃ C H - C H 2 2 2
H O 2 C H C H C H C H O C H C H C H C H O H 3 2 2 2 3 2 2 2 1 丁 醇 ( 8 2 % )
烃 氧 负 离 子 中 间 体
上页
下页
首页
第八章 醚和环氧化合物
I
-
上页
下页
首页
第八章 醚和环氧化合物
第一节 醚 (三、醚的化学性质)
(三) 过氧化物的生成
烷基醚在空气中久置,α-碳上的氢可 被氧化, 生成醚的过氧化物。
+ O C H C H O C H C H C H C H O C H C H 2 3 2 2 3 3 2 3 O O H
醚和环氧化合物(3)

整理课件
9
(1)铁羊盐的形成
醚链中氧原子上的孤电子对可作为一种路易斯 碱,接受强酸中的质子形成铁羊 盐而溶于强酸。
C 2 H 5 O 2 H 5 C 浓 H H 2 2 O S4O [C 2 H 5O H C 2 H 5] + H4 -SO
由于氧对孤电子对的吸引较强,因此醚的氧只 能与强酸的质子形成 铁羊盐,用水稀释,铁羊盐
O C 2H 5
HI △
OH + C 2H 5I
二苯基醚的醚键很稳定,通常不易与HX发 生醚键的断裂反应。
整理课件
13
(三) 醚的过氧化物的形成
醚对氧化剂是稳定的,但在空气中久置,会
慢慢发生自动氧化,α碳上的氢可被氧化生
成过氧化物。
CH3CH2OCH2CH3
O2 CH3CH-OCH2CH3 O OH
整理课件
19
第二节 环氧化物
一个氧原子与相邻的两个碳原子相连构成 的三元环醚,不稳定,性质特殊,在有机 化学中特称为环氧化物(epoxides)。
整理课件
20
一 环氧化合物的结构和命名
C
C
O
整理课件
21
普通命名法:根据相应的烯烃称为氧化 某烯。
O
O
O
C2HC2H C2HCH 3 CC H 2HC(3 )2 CH
(ethyl methyl ether)
O
(二)苯(基)醚 (phenyl ether)
O CH2CH3
苯乙醚 (ethyl phenyl ether)
整理课件
6
烃基结构比较复杂的醚,以烃为母体,烃氧基 为取代基来命名。
CH3CH2 CH CH3
CH3 CCH3 OCH3
有机化学PPT08ether第八章 醚和环氧化合物课件

4
南京医科大学康达学院 博学至精 明德醚较稳定,其稳定性仅次于烷烃。醚不能与
强碱、稀酸、氧化剂、还原剂或活泼金属反应。 在一定条件下可发生反应,反应与醚氧原子上的 孤电子对有关。
(锌一锌)样醚样锌锌酮的样酮样银质锌酮铜银子酮样银化铜酮银铜洋:银洋铜锌洋铜 盐样的形酮成 银 铜
C H 3O C H 3+H I
C H 3I + C H 3O H H I C H 3 I + H 2 O
较小的烃基生成卤代烃,较大的烃基生成醇(芳基则生成酚);
O C H 3 + H I O H + C H 3 I
南京医科大学康达学院化学教研室 有机化学
7
南京医科大学康达学院 博学至精 明德至善
1
O
H 3C H C C H C H 3
32
2,3-二甲基 环氧乙烷
1
O
2-乙基环
H2C CHCH2CH3 氧乙烷
32
南京医科大学康达学院化学教研室 有机化学
11
南京医科大学康达学院 博学至精 明德至善
二、环氧化合物的开环反应
(一) 酸催化开环反应
在稀酸条件下,环氧化合物的环 被打开,生成相应的加成产物。
甲乙醚 苯甲醚 南京医科大学康达学院化学教研室 有机化学
2
南京医科大学康达学院 博学至精 明德至善
b、复杂:用系统命名法,将醚键所连接的2个烃基 中碳链较长的烃基作母体,称“某烃氧基某烃”。
C H 3C H 2C H 2C H C H 3 OCH3
HOCH2CH2 OC2H5
2-甲氧基戊烷
2-乙氧基乙醇
醚键断裂反应属于亲核取代反应, 通常伯烷基醚 易按SN2机制进行, 叔烷基醚易按SN1机制进行。
醇和酚醚和环氧化合物PPT课件
NaCN+Q+X-
Na+X-
水 相
介 面
Q+CN- +RX
RCN+Q+X-
有 机 相
相转移催化剂不断地将CN-从水相送到有机相,然后又将X-从有机相 送到水相。
N aC N
Q +C N - +R X
R C N+Q +X -
水 相 介 面 有 机 相
-
催化剂油溶性高,它的正离子在 水相中的浓度很低,只在介面处 交换负离子
15-冠-5 15-Crown-5
O
O
O
O
O
O
18-冠-6 18-Crown-6
OO
OO
OO
Crown
18-Crown-6
-
25
冠醚的制备
Williamson醚合成法
O H Cl
O
O
+
O
O
O H Cl
KO H
O H +
O
N aO H
O H C l
C l
C. J. Pederson, 1960s
-
H
R ' C OR
R ' C OR
H
O O H
提示:醚类试剂(乙醚、THF等)久置使用时要当心
• 先用淀粉-KI(2%的醋酸溶液)试验 • 蒸馏时勿蒸干 • 可用还原剂处理除去过氧化物(如FeSO4,LiAlH4,Na等)
-
18
2. 醚键氧的碱性
R O R' + HCl R O R ' + H2SO 4
1
H O C H 3
8第八章醚和环氧化合物PPT课件

6
1961年Pederson发现了冠醚及其特异性质,1967年发 表在J. Am. Chem. Soc.89,7017-36 是历史上的经典之 作,被引用达1400次!
Pederson发现冠醚具有识别络合不同金属离子 能力(冠醚依据环的大小可以选择性络合Li+、Na+、 K+、Mg2+、NH4+ 等离子)。
二 醚的物理性质 物态:甲醚和甲乙醚是气体,其它醚多为无色液体, 有特殊气味。低级醚易挥发。 沸点:醚与醇不同,分子间不会形成氢键缔合,因 此沸点比同分子量醇低。 溶解性:醚键中氧原子可以与水形成氢键,因此, 低级醚在水中溶解度与分子量接近的醇相近。
三 醚的化学性质
R–O–R′ 官能团: –O– 醚键 醚的分子极性很小,化学性质不活泼。
结束语
感谢参与本课程,也感激大家对我们工作的支 持与积极的参与。课程后会发放课程满意度评 估表,如果对我们课程或者工作有什么建议和
意见,也请写在上边
16
谢谢聆听
THANK YOU FOR LISTENING 演讲者:XX 时间:202X.XX.XX
17
HX使醚键断裂的能力:HI>HBr>>HCl
CH3–O–C2H5 + HI
CH3–I + HO–C2H5 HI C2H5I
10
芳基烷基醚断裂, 生成卤代烃和酚。这是因为芳基碳一氧键 结合得特别牢固(有P–π共轭)
O CH3
OH
+ HI
+ CH3I
–O– + HI
×
11
3 形成过氧化物 (α-H被氧化)
02
概况三
点击此处输入 相关文本内容
03
2
1961年Pederson发现了冠醚及其特异性质,1967年发 表在J. Am. Chem. Soc.89,7017-36 是历史上的经典之 作,被引用达1400次!
Pederson发现冠醚具有识别络合不同金属离子 能力(冠醚依据环的大小可以选择性络合Li+、Na+、 K+、Mg2+、NH4+ 等离子)。
二 醚的物理性质 物态:甲醚和甲乙醚是气体,其它醚多为无色液体, 有特殊气味。低级醚易挥发。 沸点:醚与醇不同,分子间不会形成氢键缔合,因 此沸点比同分子量醇低。 溶解性:醚键中氧原子可以与水形成氢键,因此, 低级醚在水中溶解度与分子量接近的醇相近。
三 醚的化学性质
R–O–R′ 官能团: –O– 醚键 醚的分子极性很小,化学性质不活泼。
结束语
感谢参与本课程,也感激大家对我们工作的支 持与积极的参与。课程后会发放课程满意度评 估表,如果对我们课程或者工作有什么建议和
意见,也请写在上边
16
谢谢聆听
THANK YOU FOR LISTENING 演讲者:XX 时间:202X.XX.XX
17
HX使醚键断裂的能力:HI>HBr>>HCl
CH3–O–C2H5 + HI
CH3–I + HO–C2H5 HI C2H5I
10
芳基烷基醚断裂, 生成卤代烃和酚。这是因为芳基碳一氧键 结合得特别牢固(有P–π共轭)
O CH3
OH
+ HI
+ CH3I
–O– + HI
×
11
3 形成过氧化物 (α-H被氧化)
02
概况三
点击此处输入 相关文本内容
03
2
大学有机化学醚和环氧化合物PPT课件

大学有机化学醚和环氧化 合物ppt课件
• 有机化学醚的介绍 • 环氧化合物的介绍 • 醚和环氧化合物的比较 • 有机化学醚和环氧化合物的实际应用 • 有机化学醚和环氧化合物的未来发展
01
有机化学醚的介绍
醚的定义和结构
醚的定义
醚是一类由醇或酚与卤素或硫酸反 应生成的化合物,其结构通式为RO-R',其中R和R'为烃基。
醚和环氧化合物的应用比较
醚的应用
醚在工业上主要用于溶剂、麻醉剂、农药等。
环氧化合物的应用
环氧化合物主要用于合成树脂、聚合物、涂料等高分子材料。
应用比较
醚和环氧化合物的应用领域不同,醚主要用于化学试剂、农药等; 而环氧化合物主要用于高分子材料合成。
04
有机化学醚和环氧化合物的实际应用
醚在医药领域的应用
THANKS
感谢观看
一些醚类化合物具有杀虫、杀 菌或除草活性,可以直接用作 农药,如杀螨醚、苯氧威等。
醚类化合物还可以作为农药的 增效剂,与其他农药混合使用, 以提高防治效果并减少农药的 使用量。
环氧化合物在材料科学领域的应用
环氧化合物可以通过聚合反应制备高 分子材料,如环氧树脂、环氧橡胶等, 这些材料具有优异的力学性能、电绝 缘性能和耐腐蚀性能。
醚和环氧化合物的性质比较
醚的性质
醚是较为稳定的化合物,对酸、 碱都有较好的稳定性。醚的沸点 较低,容易挥发。
环氧化合物的性质
环氧化合物对酸、碱都敏感,容 易发生开环反应。环氧化合物的 沸点较高,不易挥发。
性质比较
醚和环氧化合物的性质差异较大, 醚较为稳定,沸点低;而环氧化 合物对酸、碱敏感,沸点较高。
详细描述
环氧化合物具有多种化学性质,包括亲核性、亲电性、开环反应等。在一定条件下,环氧化合物可以 与多种试剂发生反应,如醇、酚、胺等。其中,开环反应是环氧化合物最重要的反应类型之一,可以 通过与氢离子、金属离子等反应打开环氧环。
• 有机化学醚的介绍 • 环氧化合物的介绍 • 醚和环氧化合物的比较 • 有机化学醚和环氧化合物的实际应用 • 有机化学醚和环氧化合物的未来发展
01
有机化学醚的介绍
醚的定义和结构
醚的定义
醚是一类由醇或酚与卤素或硫酸反 应生成的化合物,其结构通式为RO-R',其中R和R'为烃基。
醚和环氧化合物的应用比较
醚的应用
醚在工业上主要用于溶剂、麻醉剂、农药等。
环氧化合物的应用
环氧化合物主要用于合成树脂、聚合物、涂料等高分子材料。
应用比较
醚和环氧化合物的应用领域不同,醚主要用于化学试剂、农药等; 而环氧化合物主要用于高分子材料合成。
04
有机化学醚和环氧化合物的实际应用
醚在医药领域的应用
THANKS
感谢观看
一些醚类化合物具有杀虫、杀 菌或除草活性,可以直接用作 农药,如杀螨醚、苯氧威等。
醚类化合物还可以作为农药的 增效剂,与其他农药混合使用, 以提高防治效果并减少农药的 使用量。
环氧化合物在材料科学领域的应用
环氧化合物可以通过聚合反应制备高 分子材料,如环氧树脂、环氧橡胶等, 这些材料具有优异的力学性能、电绝 缘性能和耐腐蚀性能。
醚和环氧化合物的性质比较
醚的性质
醚是较为稳定的化合物,对酸、 碱都有较好的稳定性。醚的沸点 较低,容易挥发。
环氧化合物的性质
环氧化合物对酸、碱都敏感,容 易发生开环反应。环氧化合物的 沸点较高,不易挥发。
性质比较
醚和环氧化合物的性质差异较大, 醚较为稳定,沸点低;而环氧化 合物对酸、碱敏感,沸点较高。
详细描述
环氧化合物具有多种化学性质,包括亲核性、亲电性、开环反应等。在一定条件下,环氧化合物可以 与多种试剂发生反应,如醇、酚、胺等。其中,开环反应是环氧化合物最重要的反应类型之一,可以 通过与氢离子、金属离子等反应打开环氧环。
《醚和环氧》课件

威廉姆逊合成法
醇盐与卤代烃在碱的作用下发 生取代反应,生成醚。
酚烷基化
酚与卤代烃在酸性条件下发生 烷基化反应,生成醚。
烯烃与卤代烃反应
烯烃与卤代烃在酸性条件下发 生取代反应,生成醚。
醚的反应类型
醚的裂解
醚在酸性条件下发生裂 解,生成醇或烷烃。
醚的氧化
醚在氧化剂的作用下发 生氧化,生成过氧化物
。
醚的烷基化
环氧的还原
环氧可以通过还原剂如氢气、金属催化剂等还原成醇或烃,其还原产物取决于还原剂和反应条件。
醚和环氧的加成反应比较
醚的加成
醚在加成反应中通常作为溶剂或反应介质,其本身不参与加成反应。
环氧的加成
环氧可以与水、醇、氨等发生加成反应,生成相应的加成产物。
06
醚和环氧的实际应用
醚在工业生产中的应用
醚和环氧在其他领域的应用
醚在化学反应中的应用
醚类化合物可以作为反应溶剂和反应物参与 各种化学反应,如烷基化、酰基化、酯化等 。醚类化合物在有机合成中具有重要的地位 ,为化学工业提供丰富的化合物原料。
环氧在建筑领域的应用
环氧树脂在建筑领域中主要用于地坪涂装、 混凝土加固和粘接材料等方面。其优良的耐 久性和装饰性能使环氧树脂成为现代建筑中 不可或缺的材料之一。
THANKS
感谢观看
醚在酸性条件下发生烷 基化反应,生成新的醚
。
醚的水解
醚在碱性条件下发生水 解,生成醇。
醚在有机合成中的应用
01
02
03
作为溶剂
醚类化合物常用作有机合 成中的溶剂,如乙醚、四 氢呋喃等。
作为反应介质
醚类化合物可以作为有机 合成中的反应介质,如醇 与卤代烃的取代反应、酚 烷基化等。
第十章醚和环氧化合物优秀课件

第十章醚和环氧化合 物
主要学习内容
掌握醚的分类及其命名法。 掌握氢键对沸点、水溶性等物理性质的影响。 理解醚的结构特点。 掌握醚和环氧化合物的化学性质 理解醚和环氧化合物的制备方法
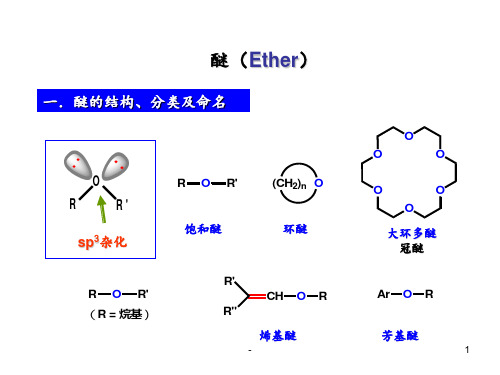
一.醚(Ether)和环氧化合物的分类及命名
分类
O
R
R'
sp3杂化
R O R'
(CH2)n O
饱和醚
环醚
R O R' (R = 烷基)
饱和醚
R' CH O R
R"
烯基醚
O
O
O
O
O
O
大环多醚 冠醚
Ar O R
芳基醚
命名
➢ 普通命名法:
➢ 系统命名法:复杂醚,将烃氧基作为取代基
C H 3 C H 2O C H 2 C H 3
对称醚 乙醚(二乙基醚)
C H 3 C H 3 CO C H 2 C H 3
C H 3
小
C H3 3o 很大
CH3 OH +
CH3
I C CH3
如何解释以上
CH3
反应取向?
醚键开裂机理(亲核取代反应机理)
• 伯烷基醚按SN2 机理:甲基醚优先得到碘甲烷
C H 3 C H 3 O H
C H 3 IH
C H 3 C H 3 O H
I
HC H 3 SN2
SN2,位阻 影响为主
C H 3 C H 3 I +H O H
乙二醇二甲醚
丙三醇-1-甲醚
1, 2-二甲氧基乙烷
3-甲氧基-1, 2-丙二醇
1,2-dimethoxyethane 3-methoxypropane-1,2-diol
主要学习内容
掌握醚的分类及其命名法。 掌握氢键对沸点、水溶性等物理性质的影响。 理解醚的结构特点。 掌握醚和环氧化合物的化学性质 理解醚和环氧化合物的制备方法
一.醚(Ether)和环氧化合物的分类及命名
分类
O
R
R'
sp3杂化
R O R'
(CH2)n O
饱和醚
环醚
R O R' (R = 烷基)
饱和醚
R' CH O R
R"
烯基醚
O
O
O
O
O
O
大环多醚 冠醚
Ar O R
芳基醚
命名
➢ 普通命名法:
➢ 系统命名法:复杂醚,将烃氧基作为取代基
C H 3 C H 2O C H 2 C H 3
对称醚 乙醚(二乙基醚)
C H 3 C H 3 CO C H 2 C H 3
C H 3
小
C H3 3o 很大
CH3 OH +
CH3
I C CH3
如何解释以上
CH3
反应取向?
醚键开裂机理(亲核取代反应机理)
• 伯烷基醚按SN2 机理:甲基醚优先得到碘甲烷
C H 3 C H 3 O H
C H 3 IH
C H 3 C H 3 O H
I
HC H 3 SN2
SN2,位阻 影响为主
C H 3 C H 3 I +H O H
乙二醇二甲醚
丙三醇-1-甲醚
1, 2-二甲氧基乙烷
3-甲氧基-1, 2-丙二醇
1,2-dimethoxyethane 3-methoxypropane-1,2-diol
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
影响反应的因素: X与–OH的距离愈小,愈易反应; 环张力愈小,愈易反应。
13
10.3.2 Williamson合成法
(3) 立体专一性反应——邻基参与作用
14
10.3.3 不饱和烃与醇的反应
该反应是可逆反应,可利用异丁烯与醇反应生成的叔丁基醚保护醇羟基。
15
10.4 醚的物理性质和波谱性质
较好的 离去基
18
10.5.1 钅羊盐的生成
Brönsted碱
碱性,pkb ≈ 17.5
Lewis碱
钅羊 盐 Oxonium salt
酸碱复合物
19
10.5.2 酸催化醚键断裂
过量
例:
20
醚键开裂机理
SN2机理
位阻影 响为主
SN1机理
中间体稳 定性为主
21
芳基醚的反应,醚键总在脂肪烃基一边断裂,生成 卤代烷和酚
CH3CH2CH2CONa
CH3CH2CH2COCH2CH CH2
CH3
CH3
CH3
或
O
CH3CCH3 + CH3CH2CH2MgBr
10.3.2 Williamson合成法
(1) 醇钠与RX的SN2反应合成醚 剧毒 无毒
12
10.3.2 Williamson合成法
(2) 合成环醚
反应速率与环的大小 相关:反应速率依次减小
•反应取向:在取代基少的一端开环,具有SN2性质。 •立体化学:反式开环
27
10.5.4 环氧化合物与Grignard试剂的反应
该反应属于碱催化下的开环反应
按SN2机理进 行,优先在取 代基较少的碳 原子上
苯基烯丙基醚及其类似物在加热的条件下,发生分子内重排生成邻烯丙基 苯酚(或其它取代苯酚)的反应,称为Claisen重排。
(1) 醇钠与RX的SN2反应合成醚
RONa + R'X
ROR'
应用:制备混合醚。注意:R‘X为伯卤代。
例:以叔丁醇和甲醇为原料合成:
CH3
CH3
Na
解: CH3 C OH
CH3
CH3 CH3 C ONa
CH3
CH3 C OCH3 CH3
CH3OH + HI
CH3I + H2O
CH3
CH3
CH3 C ONa + CH3I
IR: C–O
1200 ~ 1050cm-1
16
10.4 醚的物理性质和波谱性质
1H NMR:
δ 3.4 ~ 4.0
17
10.5 醚和环氧化合物的化学性质 醚在中性、碱性和弱酸性
条件下稳定,常用作溶剂。
a碳有亲电性, 但难亲核取代
δ+
a碳有亲电性, 可亲核取代
C上连有氧, H易被氧化
氧有碱性, 可与酸结合
单醚: “二”+“烃基 + 醚”
单醚命名为二烃基醚,其中“二”字和“基”字有时可省 略,但不饱和醚习惯上保留“二”字。
(二)乙(基)醚 乙醚
二苯(基)醚
4
10.1 醚和环氧化合物的命名
混醚: “烃基” + “烃基” + “醚”
“优先”的烃基放在后面 芳基放在前面
甲乙醚 乙基乙烯基醚
甲基叔丁醚
苯甲醚
18-冠-6 冠醚的合成:
15-冠-5
二环己烷并-18-冠-6
32
10.6.1 冠醚
冠醚形状及性质:
33
10.6.2 相转移催化反应
溴化三丁基十六烷基铵
34
原理:
产物进 入水相
参与反应
水溶性反应物 进入有机相
界面
发生离子交换
35
本章内容总结:
1.Williamson合成醚的方法 2.醚和环氧化合物的性质 a.烊盐的生成 b.酸催化醚键断裂 c.环氧化合物的酸碱开环反应 d.环氧与格氏试剂的反应 e. Claisen重排 f. 醚中的过氧化物
CH3 C OCH3
CH3
CH3
10
例:从4C或4C以下原料合成
CH3 CH3CH2CH2C O
CH3
CH2CH
CH2
O CH3CH2CH2COH CH3OH
H
O
1. 2CH3MgI , Et2O
CH3CH2CH2COCH3
2. H2O
CH3 Na
CH3 CH2 CH CH2Cl
CH3
CH3CH2CH2COH
2
10.1 醚和环氧化合物的命名
醚 (Ether)
单醚:
混醚:
环醚:
水
醇
乙醚 (diethyl ether)
甲基叔丁醚 (tert-butyl methyl ether)
四氢呋喃(THF)
环氧化合物: (Epoxide)
1,4-二氧六环
二烷
环氧乙烷
(ethylene oxide)
3
10.1 醚和环氧化合物的命名
醚和环氧化合物 (3)优秀课件
第十章 醚和环氧化合物
醚和环氧化合物 —— 水分子中的两个氢原子都被烃基取代的化合物称为醚。脂环
烃的环上碳原子被一个或多个氧原子取代后所形成的化合物,称为环醚;其 中三元环醚称为环氧化合物 。
醚和环氧化合物的分类、命名、制法和物理性质 醚键的断裂 环氧化合物的开环
氧杂环丁烷
氧杂环戊烷 (四氢呋喃)
1,4–二氧杂环己烷
(1,4–二氧六环)
7
10.2 醚和环氧化合物的结构
10.2.1 醚的结构
10.2.2 环氧化合物的结构
O: sp3 杂化
O
R
R'
sp3杂化
8
10.3 醚和环氧化合物的制法
10.3.1 醚和环氧化合物的工业合成
9
10.3.2 Williamson合成法
OCH3
NaI, AlCl3 70-80℃,100%
OC2H5
KI,H3PO4 95%
OH + CH3I
OH +
C2H5I
22
10.5.3 环氧化合物的开环反应
2-取代乙醇 工业制备乙二醇
23
酸性下开环
•反应取向:在取代基多的一端开环,具有SN1性质。 •立体化学: 反式开环。
实例
24
碱性条件下的环氧开环
•反应取向:在取代基少的一端开环,具有SN2性质。 •立体化学:反式开环
位阻小有利
25
不对称环氧化物开环比较
•反应取向:在取代基少的一端开环,具有SN2性质。 •立体化学:反式开环
对比:酸性条件下机理:
•反应取向:在取代基多的一端开环,具有SN1性质。
•立体化学: 反式开环。
27
碱性条件下机理:
5
10.1 醚和环氧化合物的命名
结构复杂的醚: 较大的烃基作为母体,烃氧基作为取代基 。 2–甲氧基戊烷
1–乙氧基–4–甲基苯
β,β’ –二甲氧基乙醚
二甘醇二甲醚
6
10.1 醚和环氧化合物的命名
环氧化合物: 环氧某烃
环氧乙烷
1,2–环氧丙烷
环醚: 按杂环化合物命名。
3–氯–1,2–环氧丙烷 环氧氯丙烷
O H3C
R CH3
OH
H3C
CH3
R
29
10.5.5 Claisen重排——机理
第一次 重排
互变 异构
六员环过渡态
I
邻位产物
第二次 重排
互变 异构
I
六员环过渡态
对位产物
30
10.5.6 过氧化物的生成 醚的过氧化物受热易爆炸!
机理:
链引发
链增长
31
10.6 冠醚 相转移催化反应
10.6.1 冠醚
13
10.3.2 Williamson合成法
(3) 立体专一性反应——邻基参与作用
14
10.3.3 不饱和烃与醇的反应
该反应是可逆反应,可利用异丁烯与醇反应生成的叔丁基醚保护醇羟基。
15
10.4 醚的物理性质和波谱性质
较好的 离去基
18
10.5.1 钅羊盐的生成
Brönsted碱
碱性,pkb ≈ 17.5
Lewis碱
钅羊 盐 Oxonium salt
酸碱复合物
19
10.5.2 酸催化醚键断裂
过量
例:
20
醚键开裂机理
SN2机理
位阻影 响为主
SN1机理
中间体稳 定性为主
21
芳基醚的反应,醚键总在脂肪烃基一边断裂,生成 卤代烷和酚
CH3CH2CH2CONa
CH3CH2CH2COCH2CH CH2
CH3
CH3
CH3
或
O
CH3CCH3 + CH3CH2CH2MgBr
10.3.2 Williamson合成法
(1) 醇钠与RX的SN2反应合成醚 剧毒 无毒
12
10.3.2 Williamson合成法
(2) 合成环醚
反应速率与环的大小 相关:反应速率依次减小
•反应取向:在取代基少的一端开环,具有SN2性质。 •立体化学:反式开环
27
10.5.4 环氧化合物与Grignard试剂的反应
该反应属于碱催化下的开环反应
按SN2机理进 行,优先在取 代基较少的碳 原子上
苯基烯丙基醚及其类似物在加热的条件下,发生分子内重排生成邻烯丙基 苯酚(或其它取代苯酚)的反应,称为Claisen重排。
(1) 醇钠与RX的SN2反应合成醚
RONa + R'X
ROR'
应用:制备混合醚。注意:R‘X为伯卤代。
例:以叔丁醇和甲醇为原料合成:
CH3
CH3
Na
解: CH3 C OH
CH3
CH3 CH3 C ONa
CH3
CH3 C OCH3 CH3
CH3OH + HI
CH3I + H2O
CH3
CH3
CH3 C ONa + CH3I
IR: C–O
1200 ~ 1050cm-1
16
10.4 醚的物理性质和波谱性质
1H NMR:
δ 3.4 ~ 4.0
17
10.5 醚和环氧化合物的化学性质 醚在中性、碱性和弱酸性
条件下稳定,常用作溶剂。
a碳有亲电性, 但难亲核取代
δ+
a碳有亲电性, 可亲核取代
C上连有氧, H易被氧化
氧有碱性, 可与酸结合
单醚: “二”+“烃基 + 醚”
单醚命名为二烃基醚,其中“二”字和“基”字有时可省 略,但不饱和醚习惯上保留“二”字。
(二)乙(基)醚 乙醚
二苯(基)醚
4
10.1 醚和环氧化合物的命名
混醚: “烃基” + “烃基” + “醚”
“优先”的烃基放在后面 芳基放在前面
甲乙醚 乙基乙烯基醚
甲基叔丁醚
苯甲醚
18-冠-6 冠醚的合成:
15-冠-5
二环己烷并-18-冠-6
32
10.6.1 冠醚
冠醚形状及性质:
33
10.6.2 相转移催化反应
溴化三丁基十六烷基铵
34
原理:
产物进 入水相
参与反应
水溶性反应物 进入有机相
界面
发生离子交换
35
本章内容总结:
1.Williamson合成醚的方法 2.醚和环氧化合物的性质 a.烊盐的生成 b.酸催化醚键断裂 c.环氧化合物的酸碱开环反应 d.环氧与格氏试剂的反应 e. Claisen重排 f. 醚中的过氧化物
CH3 C OCH3
CH3
CH3
10
例:从4C或4C以下原料合成
CH3 CH3CH2CH2C O
CH3
CH2CH
CH2
O CH3CH2CH2COH CH3OH
H
O
1. 2CH3MgI , Et2O
CH3CH2CH2COCH3
2. H2O
CH3 Na
CH3 CH2 CH CH2Cl
CH3
CH3CH2CH2COH
2
10.1 醚和环氧化合物的命名
醚 (Ether)
单醚:
混醚:
环醚:
水
醇
乙醚 (diethyl ether)
甲基叔丁醚 (tert-butyl methyl ether)
四氢呋喃(THF)
环氧化合物: (Epoxide)
1,4-二氧六环
二烷
环氧乙烷
(ethylene oxide)
3
10.1 醚和环氧化合物的命名
醚和环氧化合物 (3)优秀课件
第十章 醚和环氧化合物
醚和环氧化合物 —— 水分子中的两个氢原子都被烃基取代的化合物称为醚。脂环
烃的环上碳原子被一个或多个氧原子取代后所形成的化合物,称为环醚;其 中三元环醚称为环氧化合物 。
醚和环氧化合物的分类、命名、制法和物理性质 醚键的断裂 环氧化合物的开环
氧杂环丁烷
氧杂环戊烷 (四氢呋喃)
1,4–二氧杂环己烷
(1,4–二氧六环)
7
10.2 醚和环氧化合物的结构
10.2.1 醚的结构
10.2.2 环氧化合物的结构
O: sp3 杂化
O
R
R'
sp3杂化
8
10.3 醚和环氧化合物的制法
10.3.1 醚和环氧化合物的工业合成
9
10.3.2 Williamson合成法
OCH3
NaI, AlCl3 70-80℃,100%
OC2H5
KI,H3PO4 95%
OH + CH3I
OH +
C2H5I
22
10.5.3 环氧化合物的开环反应
2-取代乙醇 工业制备乙二醇
23
酸性下开环
•反应取向:在取代基多的一端开环,具有SN1性质。 •立体化学: 反式开环。
实例
24
碱性条件下的环氧开环
•反应取向:在取代基少的一端开环,具有SN2性质。 •立体化学:反式开环
位阻小有利
25
不对称环氧化物开环比较
•反应取向:在取代基少的一端开环,具有SN2性质。 •立体化学:反式开环
对比:酸性条件下机理:
•反应取向:在取代基多的一端开环,具有SN1性质。
•立体化学: 反式开环。
27
碱性条件下机理:
5
10.1 醚和环氧化合物的命名
结构复杂的醚: 较大的烃基作为母体,烃氧基作为取代基 。 2–甲氧基戊烷
1–乙氧基–4–甲基苯
β,β’ –二甲氧基乙醚
二甘醇二甲醚
6
10.1 醚和环氧化合物的命名
环氧化合物: 环氧某烃
环氧乙烷
1,2–环氧丙烷
环醚: 按杂环化合物命名。
3–氯–1,2–环氧丙烷 环氧氯丙烷
O H3C
R CH3
OH
H3C
CH3
R
29
10.5.5 Claisen重排——机理
第一次 重排
互变 异构
六员环过渡态
I
邻位产物
第二次 重排
互变 异构
I
六员环过渡态
对位产物
30
10.5.6 过氧化物的生成 醚的过氧化物受热易爆炸!
机理:
链引发
链增长
31
10.6 冠醚 相转移催化反应
10.6.1 冠醚
