四川大学考研复试化工热力学核心试题
四川大学考研复试化工热力学核心试题

第5章 非均相体系热力学性质计算一、是否题1. 在一定温度T (但T <T c )下,纯物质的饱和蒸汽压只可以从诸如Antoine 等蒸汽压方程求得,而不能从已知常数的状态方程(如PR 方程)求出,因为状态方程有三个未知数(P 、V 、T )中,只给定了温度T ,不可能唯一地确定P 和V 。
(错,因为纯物质的饱和蒸汽压代表了汽液平衡时的压力。
由相律知,纯物质汽液平衡状态时自由度为1,若已知T ,其蒸汽压就确定下来了。
已知常数的状态方程中,虽然有P 、V 、T 三个变量,但有状态方程和汽液平衡准则两个方程,所以,就能计算出一定温度下的蒸汽压。
)2. 混合物汽液相图中的泡点曲线表示的是饱和汽相,而露点曲线表示的是饱和液相。
(错正好反了)3. 在一定压力下,组成相同的混合物的露点温度和泡点温度不可能相同。
(错,在共沸点时相同)4. 一定压力下,纯物质的泡点温度和露点温度是相同的,且等于沸点。
(对)5. 由(1),(2)两组分组成的二元混合物,在一定T 、P 下达到汽液平衡,液相和汽相组成分别为11,y x ,若体系加入10 mol 的组分(1),在相同T 、P 下使体系重新达到汽液平衡,此时汽、液相的组成分别为'1'1,y x ,则1'1x x >和1'1y y >。
(错,二元汽液平衡系统的自由度是2,在T ,P 给定的条件下,系统的状态就确定下来了。
)6. 在(1)-(2)的体系的汽液平衡中,若(1)是轻组分,(2)是重组分,则11x y >,22x y <。
(错,若系统存在共沸点,就可以出现相反的情况)7. 在(1)-(2)的体系的汽液平衡中,若(1)是轻组分,(2)是重组分,若温度一定,则体系的压力,随着1x 的增大而增大。
(错,理由同6) 8. 纯物质的汽液平衡常数K 等于1。
(对,因为111==y x )9. 理想系统的汽液平衡K i 等于1。
化工热力学考试试题

化工热力学考试试题一、选择题(每题 3 分,共 30 分)1、纯物质临界点时,对比温度 Tr()。
A = 0B > 1C = 1D < 12、下列关于热力学第二定律的说法中,错误的是()。
A 热不可能自发地、不付代价地从低温物体传向高温物体B 不可能从单一热源取热使之完全变为有用功,而不产生其他影响C 第二类永动机是不可能制造成功的D 功可以全部转化为热,而热不能全部转化为功3、对于理想气体,焓只是温度的函数,这是因为理想气体的()。
A 内能只是温度的函数B 压力与体积无关C 比热是常数D 膨胀系数为 14、真实气体在()条件下,其行为接近于理想气体。
A 高温高压B 高温低压C 低温高压D 低温低压5、混合物中组分 i 的逸度系数与纯组分 i 的逸度系数的关系是()。
A 相等B 大于C 小于D 不确定6、以下哪个热力学性质不是状态函数()。
A 焓B 功C 熵D 内能7、节流膨胀过程()。
A 等焓B 等熵C 等温D 等压8、对于一个封闭系统,经历一个绝热可逆过程后,系统的熵()。
A 增加B 不变C 减少D 不确定9、克拉佩龙方程适用于()。
A 任何纯物质的两相平衡B 纯物质的气液平衡C 纯物质的固液平衡D 纯物质的气固平衡10、下列哪个方程不是立方型状态方程()。
A RedlichKwong 方程B PengRobinson 方程C Virial 方程D SoaveRedlichKwong 方程二、填空题(每题 3 分,共 30 分)1、热力学第一定律的数学表达式为_____。
2、纯物质的饱和蒸汽压随温度的升高而_____。
3、混合物的超额性质是指混合物的性质与_____性质的差值。
4、对应态原理是指在相同的对比状态下,物质的各种性质表现出_____的行为。
5、压缩因子 Z 表示实际气体与理想气体的_____偏差。
6、吉布斯函数判据适用于_____过程。
7、麦克斯韦关系式共有_____个。
8、活度系数表示实际溶液与_____溶液的偏差。
四川大学化工考研884复试面试热力学面试答案

1、一钢瓶中装有高压甲烷气体,已知甲烷的温度和压力,如何确定钢瓶中甲烷的质量?
2、简要叙述研究真实流体P/V/T性质的几种方法。
3、简要回答节流膨胀的热力学特征,并举例说明节流膨胀的具体应用。
4、举例说明相平衡实验数据在分离装置设计中的应用。
5、实验测定气液相平衡数据时,为什么要对实验数据进行热力学一致性检验?如何检验?
6、对一化工过程进行热力学分析,发现熵产生等于零,该过程的特征试什么?
7、在研究开发高分子合金时,需要寻找溶剂增溶剂,能使两种或两种以上不互溶的高分子混合形成溶液,
如何从化工热力学基本理论出发,判断一种增溶剂的效果?
8、化学位是溶液热力学的重要概念,简要说明该性质在相平衡研究中的具体应用。
9、气液相平衡的研究方法主要分为活度系数法和状态方程法,如果要计算高压气液相平衡,应该选择哪
种方法?为什么?
10、一位学者发表了关于THF DMAEMA H2O体系在一定温度和压力下的摩尔焓同组成之间的研究报导,如
果你怀疑该研究结果的真实性,应该如何检验?
11、在对分离过程进行能量分析时,需要计算分离过程的可逆功,从稳定流动系统热力学第一定律出发,
简要说明分离过程可逆功的计算方法。
化工热力学试卷及答案

化工热力学试卷及答案【篇一:化工热力学复习题及答案】否题1. 孤立体系的热力学能和熵都是一定值。
(错。
?u?0,?h?0,但?s,?g 和?a不一定等于0,如一体积等于2v的绝热刚性容器,被一理想的隔板一分为二,左侧状?u?0,?t?0,p的理想气体,态是t,右侧是t温度的真空。
当隔板抽去后,由于q=w=0,?h?0,故体系将在t,2v,0.5p状态下达到平衡,?s??rln?0.5p??rln2,?g??h?t?s??rtln2,?a??u?t?s??rtln 2)封闭体系的体积为一常数。
(错)理想气体的焓和热容仅是温度的函数。
(对)理想气体的熵和吉氏函数仅是温度的函数。
(错。
还与压力或摩尔体积有关。
)封闭体系的1mol气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相等,t22. 3. 4. 5.初态和终态的温度分别为t1和t2,则该过程的?u?cvdt;同样,对于初、终态压力相t1t2?等的过程有?h?cpdt。
(对。
状态函数的变化仅决定于初、终态与途径无关。
)t1?6. 自变量与独立变量是一致的,从属变量与函数是一致的。
(错。
有时可能不一致)三、填空题1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态。
2. 单相区的纯物质和定组成混合物的自由度数目分别是。
3. 6。
4. 333。
5. 普适气体常数r3 mol-1 k-1=83.14bar cm3 mol-1 k-1=j mol-1 k-1 =mol-1 k-1。
第2章P-V-T关系和状态方程一、是否题1. 纯物质由蒸汽变成液体,必须经过冷凝的相变化过程。
(错。
可以通过超临界流体区。
)2. 当压力大于临界压力时,纯物质就以液态存在。
(错。
若温度也大于临界温度时,则是超临界流体。
)3. 纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸汽的摩尔体积随着温度的升高而减小。
(对。
则纯物质的p-v相图上的饱和汽体系和饱和液体系曲线可知。
四川大学化工综合复试真题

2018年1.基本与2011年初试分析题相同(3问,每问5分,共15分)(1)如阀门关闭,A点与B点的压强是否相同,为什么?(2)如阀门开启,开启时A点与关闭时A点的压强是否相同?为什么?(3)阀门开启时,若管路等径,A,B两点流速是否相同,为什么。
2.某精馏塔分离两个组分,进料中含轻组分36%,饱和液体进料,塔顶馏出液组成93%,塔顶馏出液中轻组分占进料中轻组分的96%。
(1)求塔底组成;(5分)(2)若为气液混合进料,求塔底出口组成;(5分)(3)分析分别气液混合物进料,增大回流比,增加进料流量时理论塔板数的变化。
(5分)3.反应A+B→C+D为对反应物A,B的二级反应。
某同学进行实验时将B一次加入,然后逐渐加入A,发现反应基本为关于A的一级反应,分析该同学实验过程的错误所在,并提出改正建议。
(10分)4.在实验室中使用平推流实验器进行实验,测得某反应转化率为75%时需耗时12分钟。
现在将此实验应用于工厂,转化率仍为75%,流量为2L/min,求需内径为1.5cm,长2m 的直管多少根。
(5分)5.常温常压下,某气相一级反应A→B,原料进料速率为10mol/min,反应常数为k=100/min。
(1)求全混流下转化率为0.5时反应时间;(5分)(2)求全混流下转化率为0.6时的反应器体积;(5分)(3)求平推流下转化率为0.7时的反应器体积。
(5分)6.Periodic table is a very important agreement of chemical, write out five mental elements and its Chinese name, corresponding symbols. (5分)7.Unit operation is element process of chemical engineering, please write five unit operation and its Chinese name. (5分)8.Choose the most excel answer(原文为纯英文)(4分)(1)下面哪个与石油,天然气为当今主要能量来源A. wind,B. solar,C. coal(2)下面哪个氧化性最强A nitrogen,B,helium C. oxygen ,D. hydrogen(3)下面哪个不是伯努利方程里的能量A .Pressure potential energy B. gravity potential energy C momentum energy D electric(4)下面哪个单元操作不是传质操作A absorptionB heat transferC rectificationD drying 9.一段专业英语翻译,大致内容为催化剂的组成,结构及分类。
川大化学学院复试参考题目题
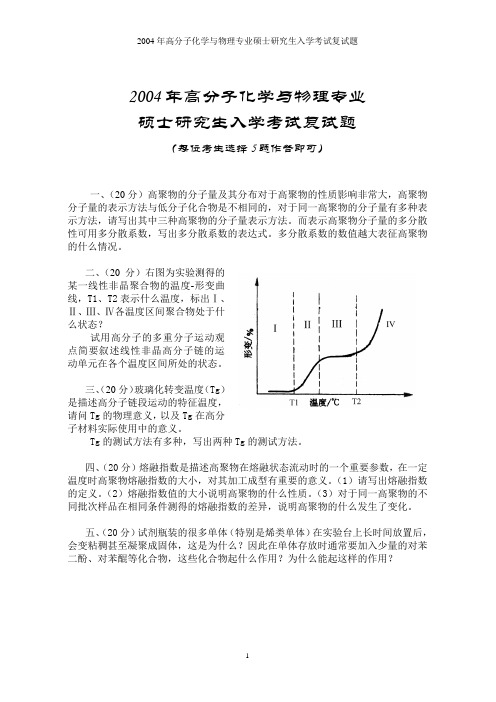
2004年高分子化学与物理专业硕士研究生入学考试复试题(每位考生选择5题作答即可)一、(20分)高聚物的分子量及其分布对于高聚物的性质影响非常大,高聚物分子量的表示方法与低分子化合物是不相同的,对于同一高聚物的分子量有多种表示方法,请写出其中三种高聚物的分子量表示方法。
而表示高聚物分子量的多分散性可用多分散系数,写出多分散系数的表达式。
多分散系数的数值越大表征高聚物的什么情况。
二、(20分)右图为实验测得的某一线性非晶聚合物的温度-形变曲线,T1、T2表示什么温度,标出Ⅰ、Ⅱ、Ⅲ、Ⅳ各温度区间聚合物处于什么状态?试用高分子的多重分子运动观点简要叙述线性非晶高分子链的运动单元在各个温度区间所处的状态。
三、(20分)玻璃化转变温度(Tg)是描述高分子链段运动的特征温度,请问Tg的物理意义,以及Tg在高分子材料实际使用中的意义。
Tg的测试方法有多种,写出两种Tg的测试方法。
四、(20分)熔融指数是描述高聚物在熔融状态流动时的一个重要参数,在一定温度时高聚物熔融指数的大小,对其加工成型有重要的意义。
(1)请写出熔融指数的定义。
(2)熔融指数值的大小说明高聚物的什么性质。
(3)对于同一高聚物的不同批次样品在相同条件测得的熔融指数的差异,说明高聚物的什么发生了变化。
五、(20分)试剂瓶装的很多单体(特别是烯类单体)在实验台上长时间放置后,会变粘稠甚至凝聚成固体,这是为什么?因此在单体存放时通常要加入少量的对苯二酚、对苯醌等化合物,这些化合物起什么作用?为什么能起这样的作用?六、(20分)聚合反应用的单体在使用前都要经过精制处理,如重结晶、蒸馏等。
(1)简述减压蒸馏的原理;(2)画出减压蒸馏装置的示意图。
七、(20分)如果一个同学在减压蒸馏操作的过程中先加热,当蒸馏瓶中单体的温度已经比较高时,发现蒸馏系统内的压力并未降低,于是迅速降低蒸馏系统内部的压力。
请你预测会发生什么情况?怎样做才是正确的?减压蒸馏操作的过程中还有那些需要注意的事项。
川大化工热力学习题解答(化学工业出版社)

(1)水吸收的能量最多有百分之几转化为功? (2)假定加热温度不变,求加热过程热损耗。
6-5
6-5
6-5
6-7
空气 qm1=42000 kg/h
PL1=1 atm TL1=38 ℃
Q
烟道气 qm2=45000 kg/h
PH2=1 atm TH2=?
PH2=1 atm TH2=200 ℃
PH1=1 atm TH1=318 ℃
7-19
7-19
7-19
7-19
(2)略
思路完全一致,注意f1id 应使用亨利定律规则。
7-20
7-200
7-20
7-20
7-20
THE END
Thanks !
• 朗肯循环
P2=14 MPa
T2=540℃
P4=0.007 MPa
5-12
5-12
5-12
Review of Ch.5
• 蒸汽压缩制冷循环
2’
蒸汽冷凝放热 饱和蒸汽压缩
饱和液体膨胀
液体汽化吸热
5-13
• 某蒸汽制冷循环用氨为工质,冷凝压力为1.2MPa,蒸发 压力为0.14MPa。工质进压缩机为饱和蒸汽,进节流阀 为饱和液体,压缩机等熵效率为0.8,制冷量为13940 kJ/h。求: (1)制冷系数 (2)氨循环速率 (3)压缩机功率 (4)冷凝器放热量 (5)逆卡洛循环制冷系数
• EOS
• Then
3-4
• 试选用合适的普遍化关联法计算1kmol 1,3丁二烯从2.53Mpa、127℃压缩到12.67Mpa、 227℃时的焓、熵和体积变化。
• 分析:先判断普压还是普维法,接着计算 剩余性质,最后用三步法求得焓等变化。 (注意是求1KMOL丁二烯的变化)
化工热力学试卷题库与答案.doc

一.选择题(每题 2 分,共 10 分)1. 纯物质的第二 virial 系数B( A )A 仅是温度的函数B 是 T和 P的函数C 是 T和 V的函数D 是任何两强度性质的函数温度下的过冷纯液体的压力P(A。
参考 P- V图上的亚临界等温线。
)A. > P s TB. < P s TC. = P s T3. 二元气体混合物的摩尔分数=,在一定的下,0.9381, ? 0.8812,则此时混1 2y1 T,P合物的逸度系数为。
( C)A B C D4. 某流体在稳流装置中经历了一个不可逆绝热过程,装置所产生的功为24kJ ,则流体的熵变(A)A. 大于零B.小于零C.等于零D.可正可负5. Henry规则(C)A 仅适用于溶剂组分B仅适用于溶质组分C 适用于稀溶液的溶质组分D 阶段适用于稀溶液的溶剂二、填空题(每题 2 分,共 10 分)1. 液态水常压下从25℃加热至 50℃,其等压平均热容为 mol, 则此过程的焓变为()J/mol 。
2. 封闭体系中的1mol 理想气体 ( 已知C P ig ) ,按下列途径由T1、 P1 和 V1可逆地变化至 P2,则,等温过程的W= 1 ,U= 0 ,H= 0 。
RT ln P1, Q= RT ln PP2 P23. 正丁烷的偏心因子ω=,临界压力为p c=,则在 Tr =时的蒸汽压为() MPa。
4. 温度为 T 的热源与温度为T0 的环境之间进行变温热量传递,其等于热容为Cp,则 ExQExQT(1T)C p dT T0的计算式为 (T0 )。
5. 指出下列物系的自由度数目, (1) 水的三相点0 ,(2) 液体水与水蒸汽处于汽液平衡状态 1三、简答题:(共 30 分)1.填表( 6 分)偏摩尔性质 ( M i ) 溶液性质 ( M) 关系式(M x i M i)ln f i x i ln f ln f x i ln f ?i x iln i ln ln x i ln ?iln i G E RT G E RT x i ln i2.有人提出了一定温度下二元液体混合物的偏摩尔体积的模型是V1V1 (1 ax2 ), V2V2 (1 bx1 ) ,其中V1,V2为纯组分的摩尔体积,a,b 为常数,问所提出的模型是否有问题(8 分)解:由 Gibbs-Duhem 方程得, a x2V2b , a,b 不可能是常数,故提出的模型有问题。
四川大学化工热力学复试资料—useful sentences for Presentation

all of us. 7. There’s an important point to be made here.
1. As you can see, the figures speak for themselves.
2. Here is a graph showing ... 3. This diagram focuses on ... 4. The next diagram illustrates...
3. Length
1. I shall only take …minutes of your time. 2. I plan to be brief.
This should only last …minutes. 3. It will last 15 minutes. 4. My presentation (talk, speech) will last 15
with... 8. Step one is to... After that we'll... And our
final step is to... 9. Just to give you a brief overview.
5. Main parts
进入正题
1. I'd like to introduce the first point … 2. Now I'll go over the first point … 3. Now I'll review the first point … 4. Now I'm going to consider the first point … 5. It's time to discuss the first point …
四川大学化工考研884复试面试化工原理面试题库答案

1.用化工原理解释“开水不响,响水不开”的现象。
水中能溶有少量空气,容器壁的表面小空穴中也吸附着空气,这些小气泡起气化核的作用。
水对空气的溶解度及器壁对空气的吸附量随温度的升高而减少,当水被加热时,气泡首先在受热面的器壁上生成。
气泡生成之后,由于水继续被加热,在受热面附近形成过热水层,它将不断地向小气泡内蒸发水蒸汽,使泡内的压强(空气压与蒸汽压之和)不断增大,结果使气泡的体积不断膨胀,气泡所受的浮力也随之增大,当气泡所受的浮力大于气泡与壁间的附着力时,气泡便离开器壁开始上浮。
在沸腾前,窗口里各水层的温度不同,受热面附近水层的温度较高,水面附近的温度较低。
气泡在上升过程中不仅泡内空气压强P。
随水温的降低而降低,泡内有一部分水蒸汽凝结成饱和蒸汽,压强亦在减小,而外界压强基本不变,此时,泡外压强大于内压强,于是上浮的气泡在上升过程中体积将缩小,当水温接近沸点时,有大量的气泡涌现,接连不断地上升,并迅速地由大变小,使水剧烈振荡,产生"嗡,嗡"的响声,这就是"响水不开"的道理。
对水继续加热,由于对流和气泡不断地将热能带至中、上层 ,使整个溶器的水温趋于一致,此时,气泡脱离器壁上浮,其内部的饱和水蒸汽将不会凝结,饱和蒸汽压趋于一个稳定值。
气泡在上浮过程中,液体对气泡的静压强随着水的深度变小而减小,因此气泡壁所受的外压强与其内压强相比也在逐渐减小,气泡液--气分界面上的力学平衡遭破坏,气泡迅速膨胀加速上浮,直至水面释出蒸汽和空气,水开始沸腾了,也就是人们常说的"水开了",由于此时气泡上升至水面破裂,对水的振荡减弱,几乎听不到"嗡嗡声",这就是"开水不响"的原因。
2.试举例说明分子动量扩散、热量扩散和质量扩散现象,并阐述三个过程的物理本质和共性特征。
动量传递——在垂直于实际流体流动方向上,动量由高速度区向低速度区的转移。
热力学复试试题答案

一简答题(每题6分)1. 常用的状态方程有那些(不用写具体方程形式)?状态方程的作用是什么? 答:常用的状态方程有理想气体状态方程和真实气体状态方程,真实气体状态包括维里方程、立方型方程(Redlich-Kwong 方程、Soave-RK 方程和Peng-Robinson 方程)和多参数状态方程(BWR 方程,Martin-Hou 方程)。
状态方程处了可以直接计算PVT 的数据外,还用来计算热力学性质焓和熵以及相平衡计算等。
2. 已知某种气体在(T 0, P 0)下为理想气体,其焓值为H 0,在(T , P )时为真实气体,其剩余焓为H R , 试写出它在(T , P )时的焓的表达式。
答:⎰++=++=TT R ig P R ig H dT C H H H H H 000∆T 0, P 0T, PT, P理想气体真实气体理想气体H 0H R3. 计算汽液平衡的两种方法是什么?常分别用在什么情况下?答:计算汽液平衡的两种方法有状态方程法和活度系数法,状态方程法常用在中、高压汽液平衡的计算,活度系数法常用在低压汽液平衡的计算。
4. 写出热力学第一定律和热力学第二定律的数学表达式,并用两个定律来简单分析“能量不仅有数量大小而且有质量之分”这句话。
答:热力学第一定律的表达式为:W Q E E U p k +=++∆∆∆(或稳流体系的表达式s W Q z g u H +=++∆∆∆221),热力学第二定律的表达式为:0≥孤立S ∆。
热力学第一定律说明,能量有各种形式,它们之间可以相互转化,但能量是守恒的,热力学第一定律只揭示了能量大小和守恒的规律,但没有说明能量之间相互转化的规律,能量有不同的品质,高级能量转变为低级能量时,能量的数量没有变化,但做功能力降低了。
5. 简单画出纯物质的T —S 图(包括饱和液体线、饱和蒸汽线、临界点、等压线和等焓线,并标出等压线和等焓线的相对大小)。
(5分)答:S TH 1H 2H 3P 1P 2P 3临界点饱和液体线饱和汽体图只H 1 > H 2> H 3 , P 1 > P 2> P 3二、在相平衡的计算中,要用到理想气体的混合物、理想的气体混合物(也称为气体理想溶液)和理想溶液三种理想模型,(1)它们的特征是什么(从分子之间的作用力进行描述)?(2)用那些性质直接表示了真实混合物与这三种理想混合物模型之间的不同?(3) 一般什么条件下真实混合物用理想混合物模型代替?(20分)答:(1)理想气体的混合物指的是所有气体分子之间的作用力为零,分子本身不占体积,理想的气体混合物指的是同种分子之间以及不同分子之间都有作用力,且同种分子之间的作用力与异种分子之间的作用力相等;理想溶液指的是各个组分的分子之间的作用力相对,分子体积相同,理想溶液有两个模型,一个是以Lewis-Randall 定则为基础的理想溶液模型,一个是以Henry 定律为基础的理想溶液模型。
四川大学化工热力学复试资料—化工热力学部分答案

1.什么是混合规则?其主要用途是什么?答:用纯物质的参数和混合物的组成来表示混合物参数的数学关系式称为混合规则。
一个EOS 可以使用不同的混合规则,一个混合规则也可以用于不同的EOS 。
(1)常用的混合规则常用的混合规则是二次型混合规则:其中,Q m 表示混合物的物性参数;y i 、y j 分别表示混合物中 i 组分和 j 组分的摩尔分数;Q ij 当下标相同时表示纯组分的物性参数,当下标不相同时表示相互作用项(或交叉项)。
二次型混合规则一般应用于非极性和弱极性混合物。
(2)混合物的第二Virial 系数 当用二项Virial EOS 计算真实流体混合物的PVT 性质时混合物的第二Virial 系数B m 用下面的混合规则进行计算其中y 表示混合物中各组分的摩尔分数。
B ij 表示i 和j 之间的相互作用,i 和j 相同,表示同类分子作用,i 和j 不同表示异类分子作用。
(3)具有两个参数a 和b 的Cubic EOSvan der Waals EOS ,RK EOS ,SRK EOS ,PR EOS 用于混合物时,混合物的参数am 和bm 可用下式计算 其中,交叉系数计算公式为或式中,δij 是两组分相互作用参数2.什么是混合规则?它在处理真实流体混合物时起到什么作用? 同上回答3.写出稳流体系的熵平衡方程,并举例说明该方程的具体应用。
并说明如何用熵产生S G 判断过程的自发性。
答:稳流体系的熵平衡方程 具体应用见课本例题 热力学第二定律可知: S G >0--不可逆过程 S G =0--可逆过程可判断过程进行的方向S G <0--不可能过程3.在T-S 图上画出流体经节流膨胀和对外做功绝热膨胀时的状态变化,并比较两种膨胀的降温程度大小。
∑∑=i j ijj i m Q y y Q ∑∑=i jij j i m B y y B RT PB 1Z m +=ij i j j i m a x x a ∑∑=i i i m b x b ∑=jjii ij ij a a )1(a δ-=j j ii ij ij a a a δ=Gjjσ,jS TQ S =-∆∑节流膨胀与做外功的绝热膨胀的比较如下。
[化工热力学]考试题(卷)(附答案解析)
![[化工热力学]考试题(卷)(附答案解析)](https://img.taocdn.com/s3/m/30f08b13dd36a32d73758187.png)
西南科技大学网络教育学院(2017)/(2018)学年第2 学期试题单〈A 卷〉课程名称:化工热力学专业班级:命题教师:蒋琪英学生姓名:学号:成绩:考试时间:月日一、单选题( 每题2分,共15题,共30分,下列各小题备选答案中,只有一个符合题意的答案。
多选、错选、不选均不得分)1.对于化工热力学的核心问题,以下表达最正确的是()。
A.热力学性质的计算、物性参数的测量B.能量的合理利用、过程方向性和限度C.用能过程的经济性D.相平衡或过程的方向与限度2.纯物质p—V图临界等问线上临界点的特性是()。
A.22()0,()0T T T Tc cp pV V==∂∂==∂∂B.22()0,()0T T T Tc cp pV V==∂∂=<∂∂C.22()0,()0T T T Tc cp pV V==∂∂>>∂∂D.22()0,()0T T T Tc cp pV V==∂∂>=∂∂3. T温度下的过热蒸汽的压力p()。
A.>p S(T)B.< p S(T)C.= p S(T)D.不能判断4.(/)(/)(/)T s pp v T p S T等于()。
A. (/)T S VB. (/)V p TC. (/)S V TD. -(/)V p T5. 根据偏摩尔性质的定义和特征,下列选项正确的是()。
A.ˆlnln(),ln ln()ii i i iif y f y y y B.ˆˆln ln(),ln ln()i i i y f y f C .ˆˆlnln(),ln ln()i i i i if y fy yD.ˆˆlnln(),ln ln()ii i iy f y fy 6. 关于理想溶液的物理特征说法中,不正确的是()。
A.混合时没有熵变,即ΔS=0B.分子结构相似,大小一样,分子间的作用力相同C.混合时没有热效应D.混合时没有体积效应7. 关于Henry 定律,正确的是()。
2010四川大学考研复试

一、化学反应工程1 、什么是反应速率,什么是反应速率方程?写出定义式,单位。
2 、写出测定一个全混流反应器的停留时间的测定方法和计算步骤。
3 、什么是放热反应的定态操作?写出其定态操作条件。
4 、在一定温度下一级不可逆反应,一个间歇反应器中反应30min 时,其转化率是50%,在化工中,一个釜式反应器中,要求转化率达到70%时,求平均停留时间。
二、化工热力学1、状态方程有哪些类型,举例并找一代表说明。
2、二组分溶液,若已知一组分的逸度和组分含量,如何求另一组分的逸度?3、低压下,由气液相平衡关系测得{P ,y ,x ,T },如何由提供的这些数据算出活度系数。
4、真实溶液在反应器中,经过绝热变化后,熵变S G =-13000J ,判断此过程的可能性。
三、化工原理用泵从敞口池里输送液体到化工厂,流量180吨/年,化工厂与敞口池水平面垂直高度差为18m ,管路长180m(包括当量长度),化工厂出口压力不低于5105.1⨯ Pa(表压),选用两种规格的管道分别是mm 5.4159⨯Φ,mm 4108⨯Φ,流体密度31000m kg ,粘度s Pa ⋅001.0,25.0Re3614.0=λ泵的效率为65%, 计算用两种管道输送液体需要做多少外功?计算用两种管道输送时泵的实际功率和它们的差值。
假设管道能够使用八年,每年使用7200h ,设备费用大直径比小直径多花35万元,请问选择哪个管路比较合理。
四、化学过程工艺学从矿渣中分离提纯一些有用的物质出来五、翻译题包括英翻汉(三个小题),和一个汉翻英(一个小题)。
面试问题1、化学工艺和化学工程的区别?2、质量作用定律在什么情况下用摩尔浓度,什么情况下用活度?举一个理想溶液和非理想溶液的例子。
3、在什么情况下用活度和逸度?4、精馏塔底还是塔顶端温度高,怎样是塔釜底温度升高?5、原油怎么分离,塔顶,塔底产品是什么,原油是牛顿还是非牛顿流体?什么是牛顿流体?举一个牛顿流体和非牛顿流体的例子。
川大化工热力学习题解答(化学工业出版社)

精品PPT
2-4*
• 计算结果
RK
RK with kij
GC
150
150
150
278.6
278.6
278.6
1152.289 1152.289 1152.289
Temperature C
Pressure bar
Velocity m/s
Mole Flow kmol/hr
N2
13027.183 13037.884 12977.616
.
=
.
∗
+
.
=
.
= ( + +
+
)
解该方程
(fāngchéng)
0
精品PPT
4-11
• 对于出口(chū kǒu)气体可假设其服从理想气体状态方
程:
•
精品PPT
4-3
• 解:
•
能量(néngliàng)衡算:
•
•
泵做功:
•
•
焓变:
•
•
换热器热负荷:
4.7 Kw
精品PPT
4-3
• 思考:
•
本题能否(nénɡ fǒu)查附表来求得焓值?
计算焓变?
精品PPT
4-11
C3H8
绝热可逆压缩
(yā suō)
=
P1= 1 atm
T1= 60 ℃
Initial V:derived from Ideal gas equation
精品PPT
Equation of State
2021级硕士研究生化工热力学试卷

2021级硕士研究生化工热力学试卷2021级硕士研究生化工热力学试卷一、概念题(30分)请解释如下概念:(每小题5分) 1. (分)逸度、(分)逸度系数 2.过量(过剩)函数 3. 正则系综 4. 偏摩尔量 5. 预测型模型 6. 位能函数二、问答题(20分,每小题10分)1. 2.试简评立方型状态方程,并与多参数状态方程进行比较。
什么是Gibbs-Duhem方程,请简要推导之,并说明其用途。
三、公式推导(10分)设一混合物服从范德华方程,导出熵S的表达式。
(提示:(?S?P)T?()V ) ?V?T四、计算题(40分,每小题10分)1. A和B二元气体混合物中A的摩尔组成为0.2,在总压为50 bar和373.15 K时A和B的分逸度系数分别是0.65和0.90 , 试求A和B的分逸度以及混合物的逸度。
2.二元体系相对挥发度的定义为??y1x2。
A和B二元体系在1.0 bar和300 Kx1y2条件下达到汽液相平衡。
已知在300K下,A和B的饱和蒸汽压分别是0.8 bar和1.5 bar,并假定此相平衡体系的气相可视为理想气体,液相可视为理想溶液,求相对挥发度?。
如果系统压力变成0.9 bar, 请讨论此相平衡体系会发生哪些变化。
3. 323.15 K 时A和B二元体系的过量自由焓由下式给出:E Gm/RT?0.5xAxB 纯A和纯B的饱和蒸汽压(单位:bar)为40504050和lnPBs?12.12?, 此处温度T的单位为K。
试确TT定323.15 K下,该体系是否形成恒沸混合物,如是请确定恒沸组成。
如需要可自行加上合理假设。
lnPAs?11.92?感谢您的阅读,祝您生活愉快。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
———————————————————————————————— 作者:
———————————————————————————————— 日期:
第5章非均相体系热力学性质计算
一、是否题
1.在一定温度T(但T<Tc)下,纯物质的饱和蒸汽压只可以从诸如Antoine等蒸汽压方程求得,而不能从已知常数的状态方程(如PR方程)求出,因为状态方程有三个未知数(P、V、T)中,只给定了温度T,不可能唯一地确定P和V。(错,因为纯物质的饱和蒸汽压代表了汽液平衡时的压力。由相律知,纯物质汽液平衡状态时自由度为1,若已知T,其蒸汽压就确定下来了。已知常数的状态方程中,虽然有P、V、T三个变量,但有状态方程和汽液平衡准则两个方程,所以,就能计算出一定温度下的蒸汽压。)
5.若用EOS+ 法来处理300K时的甲烷(1)-正戊烷(2)体系的汽液平衡时,主要困难是 饱和蒸气压太高,不易简化;(EOS+γ法对于高压体系需矫正)。
6.EOS法则计算混合物的汽液平衡时,需要输入的主要物性数据是 ,通常如何得到相互作用参数的值?_从混合物的实验数据拟合得到。
7.由Wilson方程计算常数减压下的汽液平衡时,需要输入的数据是Antoine常数Ai,Bi,Ci;Rackett方程常数α,β;能量参数 ,Wilson方程的能量参数是如何得到的?能从混合物的有关数据(如相平衡)得到。
6.在(1)-(2)的体系的汽液平衡中,若(1)是轻组分,(2)是重组分,则 , 。(错,若系统存在共沸点,就可以出现相反的情况)
7.在(1)-(2)的体系的汽液平衡中,若(1)是轻组分,(2)是重组分,若温度一定,则体系的压力,随着 的增大而增大。(错,理由同6)
8.纯物质的汽液平衡常数K等于1。(对,因为 )
2.说出下列汽液平衡关系适用的条件
(1) ______无限制条件__________;
(2) ______无限制条件____________;
(3) _________低压条件下的非理想液相__________。
3.丙酮(1)-甲醇(2)二元体系在98.66KPa时,恒沸组成x1=y1=0.796,恒沸温度为327.6K,已知此温度下的 kPa则van Laar方程常数是
21.A-B形成的共沸物,在共沸点时有 。(对)
22.二元溶液的Gibbs-Duhem方程可以表示成 (对)
二、选择题
1.欲找到活度系数与组成的关系,已有下列二元体系的活度系数表达式, 为常数,请决定每一组的可接受性。(D)
A
B
C
D
2.下列二元混合物模型中,指出不对称归一化条件的活度系数。(B)
A
B
(a)在 ℃时的 ;
(b)在 MPa时的( 是沸点温度)。
解:(a)
(b)
2.用PR方程计算甲烷(1)-乙烷(2)-丙烷(3)-丁烷(4)-丙烯(5)等摩尔液体混合物在P=3MPa下的泡点温度和气相组成(用软件计算)。
解:
3.一个由丙烷(1)-异丁烷(2)-正丁烷(3)的混合气体, , , ,若要求在一个30℃的冷凝器中完全冷凝后以液相流出,问冷凝器的最小操作压力为多少?(用软件计算)
16.能满足热力学一致性的汽液平衡数据就是高质量的数据。(错)
17.活度系数与所采用的归一化有关,但超额性质则与归一化无关。(错)
18.逸度系数也有归一化问题。(错)
19.EOS法既可以计算混合物的汽液平衡,也能计算纯物质的汽液平衡。(对)
20.EOS+ 法既可以计算混合物的汽液平衡,也能计算纯物质的汽液平衡。(错)
C
D
3.二元气体混合物的摩尔分数y1=0.3,在一定的T,P下, ,则此时混合物的逸度系数为。(C)
A 0.9097
B0.89827
C0.8979
D 0.9092
三、填空题
1.指出下列物系的自由度数目,(1)水的三相点0,(2)液体水与水蒸汽处于汽液平衡状态1,(3)甲醇和水的二元汽液平衡状态2,(4)戊醇和水的二元汽-液-液三相平衡状态1。
8.对于一个具有UCST和LCST的体系,当 和 时,溶液是均相(相态), >0(>0,<0,=0);当 和 时,溶液是液液平衡
9.(相态), <0(>0,<0,=0); 和 称上(下)临界溶解温度,此时 =0(>0,<0,=0)。
四、计算题
1.试用PR方程计算水的饱和热力学性质,并与附录C-1的有关数据比较(用软件计算)。
2.混合物汽液相图中的泡点曲线表示的是饱和汽相,而露点曲线表示的是饱和液相。(错正好反了)
3.在一定压力下,组成相同的混合物的露点温度和泡点温度不可能相同。(错,在共沸点相同)
4.一定压力下,纯物质的泡点温度和露点温度是相同的,且等于沸点。(对)
5.由(1),(2)两组分组成的二元混合物,在一定T、P下达到汽液平衡,液相和汽相组成分别为 ,若体系加入10mol的组分(1),在相同T、P下使体系重新达到汽液平衡,此时汽、液相的组成分别为 ,则 和 。(错,二元汽液平衡系统的自由度是2,在T,P给定的条件下,系统的状态就确定下来了。)
12.virial方程 结合一定的混合法则后,也能作为EOS法计算汽液平衡的模型。(错,该方程不能用汽液两相)
13.对于理想体系,汽液平衡常数Ki(=yi/xi),只与T、P有关,而与组成无关。(对,可以从理想体系的汽液平衡关系证明)
14.二元共沸物的自由度为1。(对)
15.对于负偏差体系,液相的活度系数总是小于1。(对)
A12=______0.587_____,A21=____0.717____
(已知vanLaar方程为 )
4.在101.3kPa下四氯化碳(1)-乙醇(2)体系的恒沸点是x1=0.613和64.95℃,该温度下两组分的饱和蒸汽压分别是73.45和59.84kPa,恒沸体系中液相的活度系数 。
4.组成为x1=0.2,x2=0.8,温度为300K的二元液体的泡点组成y1的为(已知液相的 Pa)___0.334____________。
9.理想系统的汽液平衡Ki等于1。(错,理想系统即汽相为理想气体,液相为理想溶液,)
10.下列汽液平衡关系是错误的 。(错,若i组分采用不对称归一化,该式为正确)
11.EOS法只能用于高压相平衡计算,EOS+ 法只能用于常减压下的汽液平衡计算。(错,EOS法也能用于低压下,EOS+ 法原则上也能用于加压条件下)
