南京理工化工原理课件5 --蒸 馏
化工原理蒸馏培训课件

化工原理蒸馏培训课件一、蒸馏的基本原理蒸馏是一种常用的分离技术,广泛应用于化工领域。
其基本原理是利用液体的沸点差异,在加热的作用下将混合物中不同沸点的组分分别蒸发和凝结,以实现组分的分离。
在化工生产中,蒸馏通常用于从混合物中提取所需组分,去除杂质或回收溶剂等目的。
二、理想蒸馏和精馏1. 理想蒸馏理想蒸馏是指在无限理论塔板的情况下进行的蒸馏过程。
在理想蒸馏中,混合物在蒸发和凝结过程中可视为处于平衡状态,而且不发生任何物质的扩散和混合。
实际上,理想蒸馏是无法实现的,但它为我们理解蒸馏过程提供了一个很好的模型。
2. 精馏精馏是在实际工业生产中常用的一种蒸馏方法。
在精馏过程中,通过设计和优化塔板的结构和操作条件,以增加蒸发和凝结的效果,使得混合物能够在塔板之间进行多次蒸馏、凝结和液相循环,从而实现更好的分离效果。
三、蒸馏塔的结构和工作原理蒸馏塔是蒸馏过程中最常用的设备之一。
其基本结构包括进料管、塔板、塔板间隔板、冷凝管和顶部和底部的收集器。
蒸馏塔的工作原理是将混合物从塔底加热,将蒸发气体和液相分离,然后通过塔板和间隔板的作用,在各塔板之间进行多次蒸馏和凝结,最后从顶部收集纯净组分。
四、蒸发和凝结的影响因素蒸馏过程中,蒸发和凝结过程的效果直接影响着分离效果和产品纯度。
以下是影响蒸发和凝结的几个主要因素:1. 温度温度是影响蒸发和凝结的关键因素。
通过调节加热温度和冷却温度,可以控制蒸发和凝结的速率和效果,从而实现理想的分离效果。
2. 压力压力对蒸发和凝结的影响与温度相似。
通过调节系统的压力,可以改变组分的沸点和凝结点,从而影响蒸发和凝结的过程和效果。
3. 塔板结构塔板的结构和设计对蒸发和凝结过程有着重要影响。
合理设计的塔板可以提高传质效率,增加蒸发和凝结的表面积,进而提高分离效果。
4. 入料速度和塔底温度入料速度和塔底温度会影响塔内液相的循环和分布。
合理控制入料速度和塔底温度可以提高蒸发效果,减少不良组分的凝结。
化工原理蒸馏.ppt

p
0 A
=116.9kPa,
pB0=45.8 kPa。求得
xA
P pB0
p
0 A
pB0
0.78 0.8
重设t=84.5 ℃,重复上述计算,可得 pA0=115.2 kPa,
p
0 B
=45
kPa,求得
xABiblioteka P pB0p0 A
pB0
0.802 0.8
说明所设温度正确,且 p=A0 115.2kPa,故 y 0.9
液体的蒸 馏
——沸点不同的液体混合物的分离
混合物的分类: 非均相物系(气固相混合物) 均相物系(液体混合物、气体混合物等)
均相物系分离的条件: 依据物系中不同组分之间的某些性质差异。
传质分离过程的概念: 将物质在相间的转移过程称为传质(分离)
过程。 常见的传质分离过程有精馏、吸收、萃取等。
蒸馏分离的对象:液体混合物的分离 利用被分离液体之间挥发度的差异, 采用加热的方式 在一定范围遵循拉乌尔定律
xA
P
p
0 B
p
0 A
p
0 B
0.26
yA
p
0 A
P
xA
0.46
已知双组分混合液中,苯(A)占80%,甲苯占20%(摩尔百
分率)。试求常压下与该液相相平衡的汽相组成及温度。苯、
甲苯的饱和蒸汽压可按上例中的Antoine公式计算。
解:由已知x=0.8,P=101.3 kPa,汽相平衡组成可利用
蒸馏过程的特点:
10 蒸馏过程 将液体溶液加热至沸腾,液体便汽化,由于溶液
中各组分的挥发性不同,即蒸汽压不同,产生的所 相与液相组成便不同,易挥发的组成较多地进入气 相,而难挥发组分则较多的留在液相,于是,由原 来单一的液体溶液分成接触的浓度不同的汽液两 相,——这样便实现了组份的初步分离——这种分 馏原理叫蒸馏原理,根据蒸馏原理而设计的各种分 离操作都属于蒸馏过程,常见的的蒸馏过程有闪蒸, 简单蒸馏、连续精馏和间隙精馏等。
化工原理第六章蒸馏

恒摩尔气流 恒摩尔液流
注意:V不一定等于V′,L不一定等于L′
溶液中两组分的摩尔汽化热相等,即rA rB; 因汽液两相温度不同而传递的热量可忽略; 假定 精馏塔保温良好,其热量损失可以忽略。
三、进料热状态参数q
1.进料热状况的定性分析:
A — — 过冷液体;
B — — 饱和液体;
加料板及其以下 ——提馏段
加料板以上 ——精馏段
间歇精馏:
——只有精馏段, 没有提馏段
第三节 双组分连续精馏的计算与分析
设计型计算: 操作型计算:
一、全塔物料衡算
F、D、W — kmol( A B) h
xF、xD、xW — kmolA kmol( A B) 总物料:F D W
Ln1 温度 易挥发汽化多
Vn yn
气相
液相
yn yn1 xn xn1
Ln1 x n1
Ln xn
n-1 n n+1
塔顶:纯A 塔釜:纯B
Vn1 y n 1
yn+1 tn+1 tn tn-1 xn
G O P
yn
t/℃
xn-1
0
x或y
1.0
加料位置 ——与原料液组成和温度相近的板上进料
240 101.33
pA
pB
0
,kPa ,kPa
101.33 116.9 135.5 155.7 179.2 204.2 40.0 46.0 54.0 63.3 74.3 86.0
0
温度℃
80.1
85
90
95
100
105
110.6 240
pA
0
,kPa
化工原理精馏-PPT

基本要求
1、掌握精馏原理和塔板数的计算 2、了解回流比对精馏操作的影响 3、了解精馏塔的基本结构和主要性能
重点
精馏原理、塔板数的计算;回流比对精馏的影响
难点
连续精馏的原理,传质的概念
§1.1 概 述
1.蒸 馏 通过加热造成气液两相物系,利用物系中各组 分挥发度不同的特性以实现分离的单元操作 传质(mass transfer)过程:物质在相间的 转移过程称为传质(分离)过程
L qF L qF W
x 'm
W L qF
W
xW
例题1-5
二、进料热状况:
(1)温度低于泡点的冷液体; (2)泡点温度的饱和液体; (3)温度介于泡点和露点之间的气液混合物; (4)露点温度的饱和蒸气; (5)温度高于露点的过热蒸气。
进料热状况影响L、L’及V、V ’之间的关系
(1)冷液进料: L’包括三部分: ①L;②F;③ 因 原 料 温 度 低 于 加料板上气液温度,故原料 进入加料板后将一部分从提 馏段上升蒸气冷凝下来
某组分在气相中的平衡分压与该组分在液相中
的摩尔分率之比
挥发度意义
vi
pi xi
某组分由液相挥发到气相中的趋势,是该组分 挥发性大小的标志
双组分理想溶液
vA
pA xA
pAo xA xA
pAo
vB
pB xB
pBo xB xB
pBo
☆相对挥发度定义
溶液中易挥发组分挥发度与难挥发组分挥发度之比
vA pA / xA
vB pB / xB
压强不高,气相遵循道尔顿分压定律
pyA / xA yA xB
pyB / xB yB xA
化工原理蒸馏一章课件

m 1x1 b F 1 ln ln W m 1 m 1x2 b
馏出液的平均组成 y:
总物料衡算 易挥发组份
D F W
D y Fx1 Wx2
43
例1-2、1-3
44
简单蒸馏和平衡蒸馏分离效果的比较
比较:在相同的原料液浓度及相同釜液的条件下,简单 蒸馏所得到的馏出液浓度高于平衡蒸馏,而平衡蒸馏的优 点是连续操作,但其分离效果不如间歇操作的简单蒸馏。 总结:简单蒸馏和平衡蒸馏一般只能用于对原料的初步
10
P p A pB
0 A 0 A
p x A p 1 x A p p x A p
0 B 0 B 0 B
P p xA 0 pA p
0 A
0 B 0 B
xB 1 x A
若平衡的气相为理想气体,可用道尔顿分压定律:
pA p yA x P P
q 注意:该直线通过点xF , xF ,其斜率为 。 q 1
33
二、热量衡算 对加热器作热量衡算,忽略热损失,则:
Q Fc p T t F
Q:加热器的热负荷,kJ/h; F:原料液流量,kmol/h; Cp:原料液平均比热,kJ/(kmol﹒0C); tF:原料液温度,0C; T:原料液通过加热器后的温度,0C。
7/30/2013 50
冷凝器condenser
塔顶产品,
xD
改进:回流→使不处于平衡状态 的两相接触→热、质传递→部分冷
Overhead product 液相回流 Liquid reflux 精馏段 Rectifying section
凝和部分汽化同时发生。
精馏原理:在塔内,对气、液两
化工原理—蒸馏ppt课件

双组分精馏:例如乙纯-水体系的分别。
本章着重讨论常压下双组分延续精馏。其原理和计算方法可 推行运用到多组分体系。
气液两相的接触方式
延续接触〔微分接触〕:气、液两 相的浓度呈延续变化。如填料塔。
溶剂 溶剂
规整填料 塑料丝网波纹填料
散装填料 塑料鲍尔环填料
级式接触:气、液两相逐级接触传 质,两相的组成呈阶跃变化。 如板 式塔。
对非理想物系,气〔汽〕、液相的逸度服从以下方程:
fˆiG Pyii
fˆiL fiLxii
式中 i — 气〔汽〕相 i 组分的逸度系数; i — 液相 i 组分的活度系数; fiL — 纯液体 i 在系统温度、压力下的逸度。
fiLpi0i0exV piLP RT pi0
波印丁〔Poynting 〕
xA
P pB0 pA0 pB0
泡点方程〔bubble-point equation〕
理想溶液的汽液平衡——拉乌尔〔Raoult〕定律
xA
P pB0 pA0 pB0
因 poA、poB 取决于溶液沸腾时的〔泡点〕温度,所以上 式实践表达的是一定总压下液相组成与溶液泡点温度关系。
知溶液的泡点可由上式计算液相组成;反之,知组成也可由 上式算出溶液的泡点,但普通需试差。
根据相平衡常数的定义
Ki
yi xi
fiL i Pi
式中 i,i 的计算分别与气〔汽〕相组成和液相组成有关 ,相平衡常数 K 不仅与系统温度、压强有关,也与相组成 有关。要确定非理想物系相平衡关系有相当难度。
相平衡常数〔distribution coefficient〕
当系统压力较低,气相近似为理想气体时,气相逸度系数 i 接近于1,波印丁因子也接近于1,有
化工原理之蒸馏培训课件

化工原理之蒸馏培训课件1. 蒸馏的基本原理蒸馏是一种通过控制液体的汽化和冷凝来分离混合物的常用技术。
在蒸馏过程中,通过对混合物加热,使其蒸发,然后将蒸汽通过冷凝器冷凝,生成纯净的组分。
1.1 蒸馏的基本过程蒸馏可以分为以下几个基本过程: - 加热:将混合物加热到使其中的易挥发组分蒸发的温度。
-蒸发:易挥发组分随着蒸汽脱离混合物。
- 冷凝:将蒸汽通过冷凝器冷凝成液体。
- 收集:将冷凝后的液体收集。
1.2 蒸馏的作用蒸馏技术可以用于以下几个方面: - 分离纯净组分:通过蒸馏,可以将混合物中的组分分离出来,得到纯净的单一组分。
- 浓缩液体:通过蒸馏,可以将溶液蒸发浓缩,得到更浓的溶液或者固体。
- 去除杂质:通过蒸馏,可以将混合物中的杂质分离出去,得到纯净的物质。
2. 蒸馏的分类根据不同的实际应用和具体工艺条件,蒸馏可以分为以下几种分类:2.1 常压蒸馏常压蒸馏是一种在大气压下进行的蒸馏过程,常用于液体分离和某些化学反应的应用中。
常压蒸馏的特点是操作简单,但分离效果较差。
2.2 精馏精馏是一种利用物料在不同温度下汽化和冷凝的特性进行分离的技术。
精馏相对于常压蒸馏来说,可以得到更高纯度的产品。
精馏过程中,通常会采用多个分馏塔,每个分馏塔的操作压力和温度都不同。
2.3 水蒸气蒸馏水蒸气蒸馏是一种利用水蒸气的汽化和冷凝过程进行分离的技术。
水蒸气蒸馏广泛应用于精制石油产品、生物制药、食品加工等领域。
水蒸气蒸馏可以提高分离效果,得到更高纯度的产品。
3. 蒸馏的设备和操作在蒸馏过程中,涉及到一些常用的设备和操作方法。
3.1 蒸馏塔蒸馏塔是进行精馏蒸馏的主要设备,常用于分离液体混合物。
蒸馏塔通常由填料层和塔板组成,通过塔板和填料的结构,可以增加液体和气体之间的接触面积,提高分离效果。
3.2 冷凝器冷凝器是将蒸汽冷凝成液体的设备,常用于蒸馏过程中收集纯净组分。
冷凝器通常采用冷却水循环或冷却剂来降低蒸汽的温度并冷却。
化工原理 第五章 蒸馏

对易挥发组分,dt前后的微分物料衡算为:
2020/10/6
2020/10/6
2020/10/6
2020/10/6
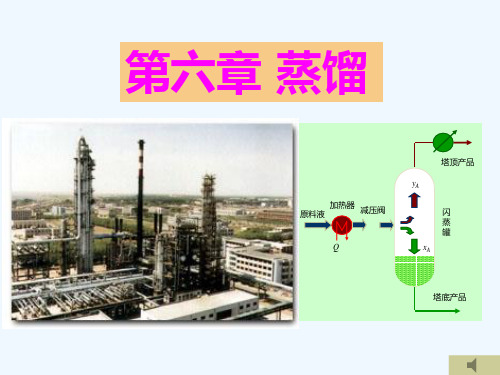
二、平衡蒸馏(Equilibrium distillation)
1、原理与流程
使混合液体部分 气化,并使气液 两相处于平衡状 态,然后将气液
2020/10/6
2020/10/6
第五章 蒸馏 Distillation
第二节 蒸馏方式
一、简单蒸馏
Simple distillation 二、平衡蒸馏 Equilibrium distillation
2020/10/6
一、简单蒸馏( Simple distillation)
1、流程及原理
2020/10/6
两相分开。
又名闪蒸(flash distillation)
2020/10/6
2020/10/6
2020/10/6
2020/10/6
2020/10/6
2020/10/6
2020/10/6
2020/10/6
设馏出液的平均组成为
2020/10/6
第五章 蒸馏 Distillation
第三节 精馏原理和流程
按操作压强
常压 加压
减压
一般情况下多用常压 常压下不能分离或达不到分离要求
混合物中组分
双组分 多组分
按操作方式
间歇 连续
2020/10/6
2020/10/6
二、拉乌尔定律
理想溶液 溶液
非理想溶液
1、拉乌尔定律
2020/10/6
2020/10/6
化工原理精馏培训课件

概述
3. 蒸馏的分类
间歇精馏:多用于小批量生产或某些有特殊要求的场合。 连续精馏:多用于大批量工业生产中。
常压蒸馏:蒸馏在常压下进行。 减压蒸馏:常压下物系沸点较高或热敏性物质不能承受高温的情况 加压蒸馏:常压下为气体的物系精馏分离,加压提高混合物的沸点. 多组分精馏:例如原油的分离。 双组分精馏:如正异构丁醛,苯-甲苯体系等。
严格地说没有完全理想的物系。对那些性质相近、结构相似的组分 所组成的溶液,如苯-甲苯,甲醇-乙醇等,可视为理想溶液;若汽相 压力不太高(<10Mpa),可视为理想气体,则物系可视为理想物系。
对非理想物系不能简单地使用上述定律。汽液相平衡数据更多地依靠 实验测定。
1 双组分溶液的气液相平衡关系
1.2.1 汽液平衡相图: T-x(y) 图
fˆiL fiLxii
式中:i — 气(汽)相 i 组分的逸度系数; i — 液相 i 组分的活度系数;
fiL — 纯液体 i 在系统温度、压力下的逸度,可由下式计算
fiLpi0i0exV piLP RT pi0
式中: pio — 纯组分i 的饱和蒸汽压;
io — 纯组分 i 的逸度系数;
ViL — 纯液体 i 的摩尔体积。
理想物系:
液相为理想溶液、汽相为理想气体的物系。理想溶液服从拉乌尔 (Raoult)定律,理想气体服从 道尔顿分压定律。 根据拉乌尔定律,两组分物系理想溶液上方的平衡蒸汽压为
pA pAxA
pB pB xB
式中:poA、poB ——溶液温度下纯组分饱和蒸汽压。
6.1 双组分溶液的气液相平衡关系
溶液沸腾时,溶液上方的总压应等于各组分分压之和,即
化工原理 PPT 蒸馏
与t(泡点)~ x间的计算类似, t(露点)~ y间的计算也有两 种类型,算法也类似。其中已知总压p及气相组成y、求露点t 的计算也要用试差(或迭代)法。
(3)气液两相平衡组成y ~ x间的关系式 把拉乌尔定律代入道尔顿分压定律可得:
0 pA pA x y p p
0 pA K p
y Kx
蒸馏的分离对象:均相的液体混合物 蒸馏分离的介质:实现部分汽化与部分冷凝所需的热量及冷量 蒸馏分离的依据:混合液体中各组分挥发度不同 将液体混合物加热沸腾使之部分气化必有yA> xA或yB < xB; 将蒸汽混合物冷却使之部分冷凝必有xB > yB 。上述两种情况所 得到的气、液相组成均满足
气相中A组分 的摩尔分数 液相中A组分 的摩尔分数
④ 液体的正常沸点(蒸汽压等于101.3kPa时的温度)较
低,表明在同一温度下其蒸汽压较高,故理想溶液两组分挥 发的难易也可以用其沸点的高低来表示,沸点差越大,则相 对挥发度也越大。
6.2.5 非理想溶液
(1)正偏差溶液
aAB<aAA,aAB<aBB,即
异 分子间的排斥倾向起了主 导作用,使溶液的两个组 分的平衡蒸汽压都比拉乌
6.2.2 两组分理想物系的气液平衡
(1)液相组成x与液相温度t (泡点)关系式
理想物系包括两个含义: ①液相为理想溶液,服从拉乌尔定律:
液相上方A组分 的蒸汽压 液相中A组分的摩尔分数
0 p p x A A A
(6-1)
在溶液温度t 下纯 组分A饱和蒸汽压 液相上方B组分 的蒸汽压 液相中B组分的摩尔分数
注意:式中p0的单位为kPa,温度t 的单位为℃。
泡点t与液相组成x之间的计算类型及算法有哪些呢?
化工原理蒸馏PPT

测数据或用安托因(Antoine )方程 进行推算:
p P
0 A
0 P pB 0 p0 p A B
B ln p A t C
0
2 用相对挥发度表示的气液平衡关系
对于混合液中的某一组分 i,挥发度i 定义为:
pA vA xA
vB pB xB
显然对理想溶液,根据拉乌尔定律有:
t f x
理想物系
?
理想物系的 t-x(y)相平衡关系:
0 对理想物系,汽相满足: P p A pB p 0 x p A B (1 x )
0 P pB x 0 0 p A pB pA p0 Ax y P P
0 p0 A 、 p B 仅与温度 t 有关,可采用实
纯组分的饱和蒸气压仅与温度 t 有关,可采用实测数据或用安托因 (Antoine)方程进行推算:
B ln p A t C
0
液体的饱和蒸气压是表示液体挥发能力的一种属性。 液体的挥发能力越大,其蒸气压就越大。
什么是挥发度?
对于纯液体,可以用蒸汽压 p0 大小表示其挥发度
对于混合液中的某一组分 i,挥发度i 定义为:
α的大小反映了混合液分离的难易程度。
表1
t, 0C
苯-甲苯物系的相对挥发度随温度的变化关系
80.1 760 292 2.60 84 856 334 2.56 88 963 381 2.53 92 1081 434 2.49 96 1210 492 2.46 100 1350 556 2.43 104 1502 627 2.40 108 1668 705 2.37 110.6 1783 760 2.35
液体混合物的蒸气压
1、对于二组分混合液,由于B组分的存在,使得A组 分在汽相中的蒸气分压比其在纯态下的饱和蒸气压 要小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蒸 馏
第一节 概述
蒸馏是分离液体混合物的典型单元操 作。这种操
作是利用液体混合物中各组分挥发度不同的特性 而实现分离的目的。
蒸馏按操作是否连续可分为连续蒸馏和间歇蒸馏。
按蒸馏方法可分为简单蒸馏、平衡蒸馏、精馏和
特殊精馏等。
按操作压强可分为常压、加压和减压精馏 。
第二节 两组分理想物系气液平衡
E NT NP 100%
3.塔高的确定
Z =(NP-1)·T H
二、塔径的计算
V
D
4
D 2u
4V u
5-5-8 两组分精馏的其它类型
(1)直接蒸气加热;
(2)多侧线进料或出料; (3)塔顶为分凝器; (4)回收塔。
一、直接蒸汽加热 总物料 : L′+V0=V′+W
易挥发组分
L′xm′+V0y0=V′ym+1′+Wxw
一、进料热状况的影响
A
B
冷液
泡点 饱和液体 气液混合 平衡
C
DLeabharlann 露点饱和蒸汽E 过热蒸汽
1.q与五种进料的关系
q
L L F
进料中液相所占的比例
L L qF
V V 1 q F
泡点进料
q 1
L´=F+L
V´=V
平衡进料
0 q 1
L´=qF+L
V´=V-(1-q)F
R R 1 xD R 1
yn 1
xn
xD
x
5.5.2
提馏段操作线方程推导
y
xD R 1
xW
ym 1 L' L W
'
xm
WxW L W
'
xD
上次课主要内容
理论板的概念和恒摩尔流假定 物料衡算和操作线方程 进料热状况参数
?
理论板
n
t1
t2 n+1
t3
t4
?
Wxm′=V0ym+1′+Wxw
y m 1
W W xm xw V0 V0
y
xD R 1
xW
xD
x
三、塔顶为分凝器
塔顶产品流量D与分凝
器中未冷凝的蒸气量Dv
相等,产品组成与分凝器 中 未 冷 凝 的 蒸 气 组 成 y0 相等
D=Dv,xD=y0
y n 1 R 1 xn y0 R 1 R 1
三、用相对挥发度表示的气液平衡关系
vA
a=
pA xA
pA / xA pB / xB
pB vB xB
vA vB
a= Py A / x A y A x B
Py B / x B
yB x A
ax y 1 a 1x
5.2.2 两组分理想溶液的气液平衡相图
一、温度—组成(t-x-y)图
dL L
dy yx
ln
F W
x1 x2
dx yx
5.4
精馏原理和流程
5.4.1 多次部分汽化、部分冷凝
5.4.2 塔板的作用
液体与蒸气在塔 板上充分接触, 发生物质传递和 热量传递
5.4.3 精馏操作流程图
5.5 常压双组分连续精馏的计算
5.5.1精馏段操作线 y
xD R 1
D,ID F,IF
QB----外界通过蒸馏釜输入的热量流率 QF----由原料加热器输入的热量流率 QC----由全凝器输出的热量流率
W,IW QB
QF
回流比的影响(全回流)
全回流理论板数
最小回流比
适宜回流比确定
R=(1.2~2.0)Rmin
5-5-6 理论板数的简捷计算 (gililand图)
计算机技术的发展使逐板计算法应用愈来愈广。
二 、 图 解 法 ( ) 法
1.特征点
a (xD,xD)
g (xW, xW)
M-T
d (xq,yq)
2.图解法步骤 在x--y图上作对角线和平衡线;
作精馏段操作线及提馏段操作线; 从a点开始,在精馏段操作线与平衡线之间绘直角 梯级; 当梯级跨过两操作线交点d时,改为在提馏段操作 线与平衡线之间绘梯级,梯级的铅垂线达到或超过g 点时为止。
一、逐板计算法
平 衡 线
y2 y3
••••••
操作线
x1
x2
y 2
x3
••••••
x1 xn xF
x m xW
第n板为加料板,精馏段有n-1块板 提馏段有m块板(包括再沸器)
应用说明
逐板计算法是求解理论板数的基本方法,计算 结果准确,且可同时求得各层板上的气液相组 成,比较繁琐;
总压为101.33kPa下, 苯—甲苯混合液的相图 上曲线为t-y线,下曲 线为t-x线,分成三个 区域即:液相区、过 热蒸气区、气液共存 区
二、x-y图
苯—甲苯混合液在P=101.33kPa下的x-y图
第三节 平衡蒸馏和简单蒸馏
5.3.1 平衡蒸馏
平衡蒸馏(或闪蒸)是一 种单级蒸馏操作。当在单 级釜内进行平衡蒸馏时, 釜内液体混合物被部分汽 化,并使气相与液相处于 平衡状态,然后将气液两 相分开。
5-2-1 两组分理想物系的气液平衡关系
一、两组分理想物系的相律 F=C-φ +2 二、用饱和蒸汽压和相平衡常数表示气液平衡关系 根据拉乌尔定律,理想溶液上方的平衡分压为 pA=pA° xA pB=pB°xB=(1-x A)
气液平衡时气相组成与平衡温度间的关系 p A P pB yA P p A pB
精馏段 操作线方程 提馏段
yn 1
R R 1
xn
xD R 1
精馏段操作线 方程
问题的提出:
?
已知xF、xD和xW及进料热状态
完成指定生产任务,需多少块NT?
本次课主要内容
5.5.3理论板层数的求法 5.5.4理论板数的影响因素
5.5.3 理论板数的求法
离开任一理论板的气液两相平衡 原理: 相邻板间气液相符合操作线关系 假设 塔顶为全凝器,泡点回流 塔底间接蒸汽加热 泡点进料
四、回收塔
y n 1
L W xn xw V V
回收塔图解
q
xW
xF
xD
第六节 板式塔
3.应用说明
图解法直观形象,有利于问题的分析,对于平衡关
系难以用解析式表示的情况也适用,若所需理论板
数较多,误差较大。
三、其它情况
1.塔顶:全凝器 泡点回流 2.塔底:间接蒸汽加热 分凝器 冷回流 直接蒸汽加热
3.多股进料或侧线出料
5.5.4 理论板数的影响因素
精馏塔的影响因素 进料热状况 的影响 回流比 的影响 加料位置 的影响
5-5-7 塔高和塔径的计算
一、塔高的计算 1.单板效率
EMV =
E ML
yn - yn-1 一块实际板汽相浓度的变化
* yn - yn-1 一块理论板汽相浓度的变化
x n 1 x n
* x n 1 x n
一块实际板液相浓度的变化 一块理论板液相浓度的变化
2.全塔效率
平衡蒸馏计算所应用的基本关系:
一、物料衡算
F=D+W
令
W F q
FxF=Dy+Wx
则
xF q y x q 1 q 1
Fcp(T-te)=(1-q)Fr
二、热量衡算 Q=Fcp(T-tF) 三、气液平衡关系 ax y 1 a 1x
及
te=f(x)
5.3.2 简单蒸馏
简单蒸馏又称微分蒸馏, 也是单级蒸馏操作,常 以间歇方式进行。 是非定态过程,计算应 该作微分衡算 总物料: dD=-dL 易挥发组分: Lx=(L+dL)(x+dx)+ydD
进料热状况 冷液
泡点 平衡 露点 过热蒸气
q值
q>1 q=1 0<q<1 q=0 q<0
2.进料方程(q线方程) y
q q 1
x
1 q 1
xF
y
xD R 1
(xF,xF)
xW
x xF
xD
q=1 0<q<1
q>1
q=0 q<0
3.q对理论板数的影响
q2 q1
q3
QC
FIF+QF+QB= DID+WIW+QC
