晶胞计算专题均摊法
常见晶体模型及晶胞计算
晶胞中微粒个数的计算,求化学式
小结:高考常见题型
1、(2013·江苏,21A(1)) 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。
X与Y所形成化合物晶体的晶胞如右图所示。 ①在1个晶胞中,X离子的数目为 。 ②该化合物的化学式为 。
Mg、Zn、Ti 每个晶胞含 个原子 六方最密堆积的配位数 =12 2
④面心立方最密堆积(铜型)
Cu、Ag、Au 面心立方堆积的配位数 =12 每个晶胞含 个原子 4
面心立方最密堆积的空间占有率
=74%
金属晶体的四种堆积模型对比
堆积模型
采纳这种堆积的典型代表
(3)若NaCl晶体的密度为ρg/cm3,则 NaCl晶体中Na+与Na+间的最短距离是多少?
a/2
a/2
=
练习
CsCl的晶体结构
(1)每个Cs+( Cl-)周围等距且紧邻的Cl- (Cs+)有 个, Cs+( Cl-)的配位数为 。
8
8×1/8=1
6
——晶胞为体心立方体
8
(2)每个Cs+ ( Cl-)周围 等距且紧邻的Cs+ ( Cl-)有 个。
1
3
6
4
2
A
5
密置层
配位数为4
配位数为6
返
A
B
A
B
A
返
第三层的另一种排列方式,是将球对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
1
2
3
4
5
6
1
2
3
均摊法

晶胞中微粒数的计算方法——均摊法晶胞中粒子个数的计算,其重要问题是正确分析晶胞中任意位置上的一个粒子被几个晶胞所共有。
1.平行六面体------长方体(正方体)晶胞中不同位置的粒子对晶胞的贡献:顶 ----1/8 棱----1/4 面----1/2 心----12.六方晶胞:在六方体顶点的微粒为6个晶胞共有,在面心的为2个晶胞共有,在体内的微粒全属于该晶胞。
3.非平行六面体---非长方体(正方体)晶体中粒子视具体情况而定。
如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占该粒子的1/3。
【练习】1.石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:(1)图中平均每个正六边形占有C 原子数为____个、占有的碳碳键数为____个。
碳原子数目与碳碳化学键数目之比为_______。
2.根据下列结构示意图,判断下列说法中不正确的是( )A .在NaCl 晶体中,距Na+最近的多个C l -构成正八面体B .在CaF 2晶体中,每个晶胞平均占有4个Ca 2+C .在金刚石晶体中,碳原子与碳碳键数之比为1:2D .该气态团簇分子的分子式为EF 或FE3.最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中白球表示钛原子,黑球表示碳原子,则它的化学式为( )A.TiCB.1314Ti CC.47Ti CD.1413Ti C4.在高温超导领域中,有一种化合物叫钙钛矿,其晶体结构中有代表性的最小单位结构如图所示试回答:(1)在该晶体中每个钛离子周围与它最近且相等距离的钛离子有多少个?(2)在该晶体中氧、钙、钛的粒子个数化是多少?5、如图是CsCl 晶体的晶胞(晶体中最小的重复单元)已知晶体中2个最近的Cs+核间距离为acm ,氯化铯的相对分子质量为M ,NA 为阿佛加德罗常数,则CsCl 晶体的密度为()A 、8M/a3NAB 、a3M/8NAC 、M/a3NAD 、a3M/NA6.现有四种晶体,其离子排列方式如图所示,其中化学式不属AB 型的是( )A B C D7、磁光存储的研究是Williams 等在1957年使Mn 和Bi 形成的晶体薄膜磁化并用光读取之后开始的。
晶胞的有关计算课件-高二化学人教版(2019)选择性必修2

A.MgB
B.MgB2
C.Mg2B
D.MgB6
随堂演练
下图是以上哪种组成
随堂演练
10.最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如
图所示,其中“ ”表示钛原子,“ ”表示碳原子,则它的化学式为(
)
A.TiC
B.Ti14C13
C.Ti4C7
D.Ti13C14
团簇分子或纳米颗粒与晶胞不同,这两类物质是独立的分子,所有
③MgO的密度为(写出计算式即可)
知识梳理
3. 配位数的计算
随堂演练 在该晶体中每个Ti周围与它距离最近且相等的Ti的个数为____。 在晶体中1个Co原子周围距离最近的O原子数目为___个。
随堂演练
➢硫离子成面心立方密堆积 ➢锌离子被硫离子以四面体的形式包围着 问:①与Zn2+最近且相等的S2-的个数
)
A.1 4 2 C.3 8 4ຫໍສະໝຸດ B.2 9 4 D.3 9 4
随堂演练
(2023年全国乙卷)一种硼镁化合物具有超导性能,晶体结构属于立 方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有 _______个, 该物质化学式为_______。
随堂演练
在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一 层硼的相间排列,如图是从该晶体微观空间中取出的部分原子沿z轴方向的 投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投 影在同一平面上。根据该图确定硼化镁的化学式为( )
②与S2-最近且相等的Zn2+的个数 ③与Zn2+最近且相等的Zn2+的个数
(2023年全国甲卷
随堂演练
随堂演练
4. 晶体空间利用率的计算
晶胞计算专题均摊法讲解学习
(2)每个Na+周围等距
且
12
紧(3)邻每的个N晶a胞+有中平均有 4 个Na+, 4 个Cl-
个,。故每个晶胞4 中含有 个“NaCl”结构单元;
N(Na+) ︰ N( Cl-) = 1 ︰1 ,化学为 NaCl 。
CaF2的晶体结构
(1)每个Ca2+周围等距且 紧邻的F-有8 个, Ca2+8配位数为 。
(2)实际含有原子 个数应为?
8×1/8 + 6×1/2 + 4 = 8
金刚石晶体中含有 共价键形成的C原
子环,其6中最小的
C环上有_____个C 原子。
用脑
思考:1.一个金刚石晶胞里有8_
2.平均每个碳原子有__2_个C--C键?
3.每个碳原子为__12__个六元环共用?
4.每个C-C键为___6 _个六元环共用?
算
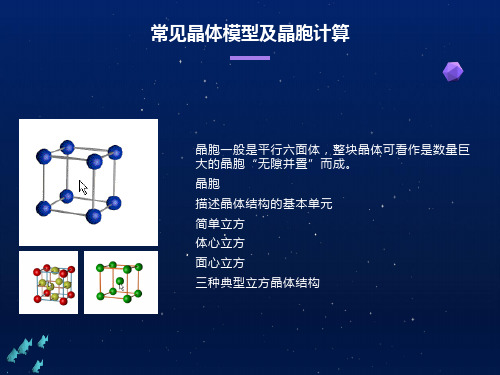
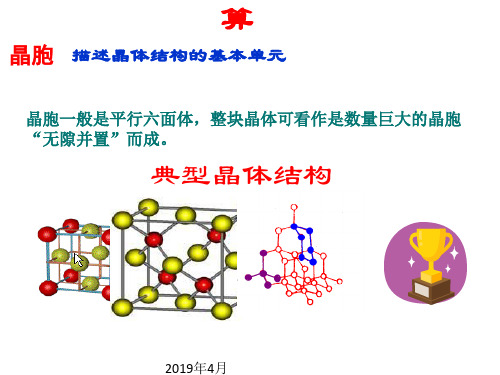
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的晶胞 “无隙并置”而成。
典型晶体结构
2019年4月
平行六 面体
无隙并置
请看:
4
8 51
棱边:1/4
1
3 73
62
2
4
面心:1/2
2
顶点:1/8
1
1
体心:1
一、晶胞中粒子个数计算规律
1.立方晶胞
晶胞 顶角
立方体 1/8
碳键数为____个。
(2)层内71个4 六元环完全占有
的C原子数为_____个,2碳:3原子
数目与碳碳化学键数目之比为_ ______.
巩固练习二:
已知晶体硼的基本结构单元 是由硼原子组成的正二十面 体,如图所示:其中有二十 个等边三角形的面和一定数 目的顶点,每个顶点为一个 硼原子,试通过观察1分2 析右 图回答:此基30 本结构单元是 由___个硼原子构成,60有0 ___ 个B-B化学键,相邻BB键的键角为____.
晶胞计算专题均摊法讲解学习共30页

56、死去何所道,托体同山阿。 57、春秋多佳日,登高赋新诗。 58、种豆南山下,草盛豆苗稀。晨兴 理荒秽 ,带月 荷锄归 。道狭 草木长 ,夕露 沾我衣 。衣沾 不足惜 ,但使 愿无违 。 59、相见无杂言,但道桑麻长。 60、迢迢新秋夕,亭亭月将圆。
谢谢你的生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
晶胞均摊法计算

均摊法计算晶胞中粒子的个数一、NaCl晶胞(4)与Na+紧邻的Cl-构成的空间结构为。
(5)该晶胞中,若相邻的Na+和Cl-之间的距离为0.5×10-10m,二、CsCl晶胞则晶体的密度为g·cm-3。
(4)若2个最近的Cs+核间距离为acm,氯化铯的相对分子质量为M,N A为阿佛加德罗常数,则CsCl晶体的密度为g·cm-3。
三、CO2晶胞(1)每个晶胞中CO2分子数为个。
(2)与CO2分子距离相等且最近的CO2分子共有个。
(3)若CO2晶胞的密度为 g/cm3,N A为阿佛加德罗常数,则最近的两个CO2分子的距离为cm。
四、金刚石、石墨晶体(1)每个金刚石晶胞中碳原子数为个。
(2)如果C—C键的键能是WkJ·m ol-1,则将12 g金刚石碳碳键完全破坏掉需要的能量是kJ。
(3)石墨晶体同一层中,每个C原子与个C原子形成C-C键,键角为,其中最小的环为元环,每个C原子被个六元环共有,每个C-C键被个六元环共有;每个六元环拥有的C 原子数为个,拥有的C-C键数为个,则C原子数与C-C键数之比为。
☆(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,晶胞边长为361.5pm,立方氮化硼晶胞中含有_____个氮原子、_____个硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式)⊿六棱柱晶胞①处于顶点的微粒,同时为个晶胞所共有,每个晶胞占有该微粒的;②处于侧棱上的微粒,同时为个晶胞所共有,每个晶胞占有该微粒的;③处于底棱上的微粒,同时为个晶胞所共有,每个晶胞占有该微粒的;④处于面上的微粒,同时为个晶胞所共有,每个晶胞占有该微粒的;⑤处于晶胞内部的微粒,则完全属于该晶胞。
练1:2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。
右下图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上、下底面还各有一个镁原子;6个硼原子位于棱柱内。
正三棱柱晶胞均摊法的计算

正三棱柱晶胞均摊法的计算
正三棱柱晶胞均摊法是一种计算晶体结构中原子位置的方法。
在正三棱柱晶胞中,原子通常位于晶格点上,而且它们的位置相对较容易确定。
均摊法是通过考虑晶胞中原子的对称性来确定原子的位置。
首先,我们需要知道正三棱柱晶胞的结构特征。
正三棱柱晶胞有三个等边三角形的侧面和两个平行的正三角形底面。
在这种晶胞中,原子通常位于顶点和中心位置。
接下来,我们可以使用均摊法来计算原子的位置。
均摊法考虑了晶胞的对称性,以确定原子的位置。
具体步骤包括:
1. 确定晶胞中原子的类型和数量。
根据晶体的化学组成和晶胞的结构,确定晶胞中原子的种类和数量。
2. 考虑晶胞的对称性。
根据晶胞的对称性,确定原子可能的位置,并考虑原子之间的相互作用。
3. 计算原子的坐标。
根据晶胞的结构和原子的可能位置,计算
原子的坐标,通常使用笛卡尔坐标系或晶体学坐标系。
值得注意的是,均摊法是一种近似方法,它假设晶体中原子的
位置是均匀分布的。
在实际应用中,需要结合实验数据和理论模型
来确定原子的精确位置。
总之,正三棱柱晶胞均摊法的计算涉及确定晶胞中原子的位置,考虑晶胞的对称性,并计算原子的坐标。
这种方法在研究晶体结构
和性质时具有重要的应用。
晶胞计算专题均摊法

种粒子数之比是( )
B
A.3∶9∶4
B.1∶4∶2
C.2∶9∶4
D.3∶8∶4
A B C
4.最近发现一种由钛原子和碳原子构成的气态团簇分
子,如右图所示:
7
课堂检测:
1.钛酸钡的热稳定性好,
介电常数高,在小型变
Ba
压器、话筒和扩音器
中都有应用。其晶体
Ti
的结构示意图如右图
O
所示。则它的化学式
为( D)
A.BaTi8O12 C. BaTi2O4
B. BaTi4O6 D. BaTiO3
2.正六棱柱晶胞
顶点: 1/6 面心: 1/2 (上、下)棱: 1/4 中棱: 1/3
立方体
顶角 1/8
棱上 1/4
面上 1/2
中心 1
顶角 棱上
面上 中心
分子晶体 干冰晶体结构 ——晶胞为面心立方体
8个CO2分子位于立方体顶点 6个CO2分子位于立方体面心
在每个CO2周围等距离且相距最近
的CO2共有
12个。
在每个小立方体中平均分摊到的CO2 分子数为: (8×1/8 + 6×1/2) =个4
金刚石晶体中含有共价键 形成的C原子环,其中最
小的C环上有6_____个C原
子。
用脑
思考:1.一个金刚石晶胞里有_ _个碳原子?8
2.平均每个碳原子有___个C--C2键?
3.每个碳原子为____个六12元环共用?
4.每个C-C键为____个六元6 环共用?
用心
思考:1.金刚石晶胞中,每个C原子均可与相邻的___
常见晶体模型及晶胞均摊计算
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的晶胞“无隙并置”而成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的晶胞 “无隙并置”而成。
典型晶体结构
A
1
2019年4月
平行六 面体
无隙并置
A
2
请看:
4
8 51
棱边:1/4
1
3 73
62
2
4
面心:1/2
2
顶点:1/8
1
体心:1 A
1
3
一、晶胞中粒子个数计算规律
1.立方晶胞
晶胞 顶角 棱上 面上
立方体 1/8 1/4 1/2
中心 1
顶角 棱上
面上
A
中4 心
分子晶体 干冰晶体结构 ——晶胞为面心立方体
8个CO2分子位于立方体顶点 6个CO2分子位于立方体面心
在每个CO2周围等距离且相距最近 的CO2共有 12 个。
在每个小立方体中平均分摊到的CO2
分子数为:(8×1/8 + 6×1/2) = 4 个
•B.6个
•C.8个
•D.18个
A
14
•冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如下 图:
(1)一个水分子含___2__个孤电子对,水分子能与很多金属 离子形成配合物,请写出它与铜离子形成的一种蓝色的配合 物离子的化学式为__________Cu。(H2O)42+ (2)每个冰晶胞平均占有__8__个水分子,冰的熔点远低于 金刚石熔点的原因是____破__坏_的_作__用_力_不__同_,_金_。刚石融化需要破坏
例2.氢气是重要而洁净的能源,要利用氢气作能源, 必须安全有效地储存氢气。某种合金材料有较大的储氢
容量,其晶胞如图所示。则这种合金的化学D式为( )
A.LaNi6 B. LaNi3 C.LaNi4 D. LaNi5
A
23
3.正三棱柱
顶点: 1/12 面心: 1/2 (上、下)棱:1/4 中棱: 1/6
图回答:此基30 本结构单元是
由___个硼原子构成,60有0 ___
个B-B化学键,相邻B-
B键的键角为____. A
17
巩固练习三:
已知晶体的基本单元是由 12个硼原子构成的(如右 图),每个顶点上有一个 硼原子,每个硼原子形成 的化学键完全相同,通过 观察图形和推算,可知此 基本20结构单元是一个正__ __面体。
(2)实际含有原子 个数应为?
8×1/8 + 6×1/2 + 4 = 8
A
10
金刚石晶体中含有 共价键形成的C原
子环,其6中最小的
C环上有_____个C 原子。
A
11
用脑
思考:1.一个金刚石晶胞里有8_ _个碳原子
2.平均每个碳原子有__2_个C--C键?
3.每个碳原子为__12__个六元环共用?
A
18
巩固练习五:
(1) 平均每个正六边形拥有___2__个锗原子, ___3__个氧原子. (2) 化学式为:__(G__e_C_H__2C__H_2_C_O__O__H_)_2O_ 3 或Ge2C6H10O3
A
19
拓展练习1:
某晶胞结构如 图所示,晶胞中 各微粒个数分别
为: 铜___3_____个 钡___2_____个 钇___1_____个 氧___7_____个
共价键,而冰融化需要破坏氢键
•(3)实验测得冰中氢键的作用力为18.5 kkJJ//mmooll,,而这冰说的明熔冰化熔热化为成水5.0,氢键_________(填部分全部或部 分)被破坏。
A
15
巩固练习一:
石墨晶体的层状结构,层内为平
面正六边形结构(如图),试回
答下列问题:
(1)图中平均2 每个正六边形占 有C原子3 数为____个、占有的碳
8*2=16
4.一个晶胞中含有C-C键数为_ ___个?
A
13
•晶胞是构成晶体的基本重复单元.在二氧化 硅晶胞中有8个硅原子位 于立方晶胞的8个 顶角,有6个硅原子位于晶胞的6个面心,还 有4个硅原子与16个氧原子在晶胞内构成4个 硅氧四面体,它们均匀错开排列于晶胞内. 根据图示二氧化硅晶胞结构,每个晶胞内所 含“SiO2”基元数为( C ) A.4个
A
20
课堂检测:
1.钛酸钡的热稳定性好,
介电常数高,在小型变
Ba
压器、话筒和扩音器
中都有应用。其晶体
Ti
的结构示意图如右图
O
所示。则它的化学式
为(D)
A.BaTi8O12 C. BaTi2O4
B. BaTi4O6 D. BaTiO3
A
21
2.正六棱柱晶胞
顶点: 1/6 面心: 1/2 (上、下)棱:1/4 A 中棱: 1/3 22
A
24
例3.某晶体的一部分如右图所示,这种晶
(2)每个F周围等距且紧4邻的Ca2+有 个, F4-配位数为 。
(3)每个晶胞中含 4 个Ca2+、含8
Ca2+和F-的个数1︰比2是
。
FCa2+
个F-,
A
8
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为
(4 + 6 ×1/2 + 8 ×A 1/8) = 8个。
9
思考
金刚石晶胞
(1)C原子位于晶胞 的哪些位置,分别有 几个?
碳键数为____个。
(2)层内71个4 六元环完全占有的
C原子数为_____个,碳2原:3子数
目与碳碳化学键数目之比为____
___.
A
16
巩固练习二:
已知晶体硼的基本结构单元
是由硼原子组成的正二十面
体,如图所示:其中有二十
个等边三角形的面和一定数
目的顶点,每个顶点为一个
硼原子,试通过观察1分2 析右
(2)每个Na+周围等距
且
12
紧(3)邻每的个N晶a胞+有中平均有 4 个Na+, 4 个Cl-
个,。故每个晶胞4 中含有 个“NaCl”结构单元;
N(Na+) ︰ N( Cl-) = 1 ︰1 ,化学为 NaCl 。
A
7
CaF2的晶体结构
(1)每个Ca2+周围等距且 紧邻的F-有8 个, Ca2+8配位数为 。
A
5
冰
冰的结构模型中,每个水分子与相邻的4
个水分子以氢键相“氢键”。
6
离子晶体
NaCl的晶体结 ——简单立方体
(1构)每个Na+( Cl-)周围等 Cl
距且紧邻的Cl- (Na+)有
-
Na+
6 个,构成 正八面体 ,
Na+( Cl-)的配位数为 6 。
4.每个C-C键为___6 _个六元环共用?
A
12
No Image
用心
思考:1.金刚石4晶胞中,每个C原子均可与相邻的___
个C构成实心的正四面体? 2
2.在一个小正四面体中平均含6有___个碳原子?
3. 在金刚石中最小的环1/2是____元环?
1个环中平均含有1 ____个C原子?
含C-C键数为____个?
