第02章--多相多组分系统热力学--习题及答案
04 多组分系统热力学 习题课(含答案)
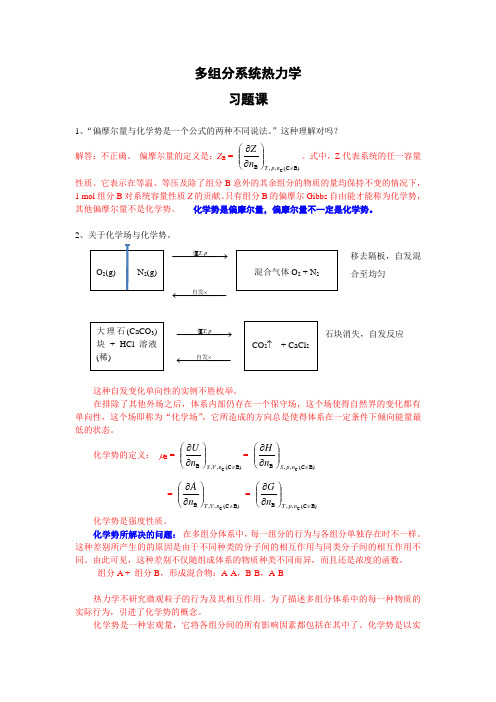
多组分系统热力学习题课1、“偏摩尔量与化学势是一个公式的两种不同说法。
”这种理解对吗? 解答:不正确。
偏摩尔量的定义是:Z B = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n Z 。
式中,Z 代表系统的任一容量性质。
它表示在等温、等压及除了组分B 意外的其余组分的物质的量均保持不变的情况下,1 mol 组分B 对系统容量性质Z 的贡献。
只有组分B 的偏摩尔Gibbs 自由能才能称为化学势,其他偏摩尔量不是化学势。
化学势是偏摩尔量,偏摩尔量不一定是化学势。
2、关于化学场与化学势。
−−−−→−pT,恒 移去隔板,自发混合至均匀−−−−−←⨯自发−−−−→−pT,恒 石块消失,自发反应 −−−−−←⨯自发这种自发变化单向性的实例不胜枚举。
在排除了其他外场之后,体系内部仍存在一个保守场,这个场使得自然界的变化都有单向性,这个场即称为“化学场”,它所造成的方向总是使得体系在一定条件下倾向能量最低的状态。
化学势的定义: μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV S n U = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np S n H= B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV T n A = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G化学势是强度性质。
化学势所解决的问题: 在多组分体系中,每一组分的行为与各组分单独存在时不一样。
这种差别所产生的的原因是由于不同种类的分子间的相互作用与同类分子间的相互作用不同。
由此可见,这种差别不仅随组成体系的物质种类不同而异,而且还是浓度的函数。
组分A + 组分B ,形成混合物:A-A ,B-B ,A-B热力学不研究微观粒子的行为及其相互作用。
为了描述多组分体系中的每一种物质的实际行为,引进了化学势的概念。
化学势是一种宏观量,它将各组分间的所有影响因素都包括在其中了。
化学势是以实际应用为背景引入的一个概念,有很强的实践性。
化学势的物理意义:μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G = 偏摩尔Gibbs 自由能G B它表示在T 、p 和其他组分的含量不变的条件下,增加1 mol 组分B 对于体系总Gibbs自由能的贡献。
多组分系统热力学、化学平、多相平衡习题课

(D)
12.在298K时,气相反应H2 + I2 === 2HI 的△rGm = -16778J· mol-1 ,则反应的标准平衡常数k为 A. 2.0×1012 C. 873 B. 5.91×106 D. 18.9 (C)
13.在一定温度下,一定量的PCl5(g)在某种条件下的解离度为 α ,欲使α 增加则需采用 ( C )
4. 某一反应在一定条件下最大转化率为30%,在同样条件 下,加入催化剂后,其转化率将 (C)
A. 大于30%; B. 小于30%; C. 等于30%; D. 不确定 5.已知373K时,液体A的饱和蒸汽压为5x104Pa,液体B的饱和 蒸汽压为105Pa,A和B构成理想液态混合物,当A在溶液中的 物质的量分数为0.5时,气相中B物质的量分数为 ( A ) A . 1/1.5; B. 1/2; C. 1/2.5; D. 1/3 6. 主要取决于溶解在溶液中粒子数目,而不取决于这些粒子的 性质的特性较 ( B )
据平衡移动原理,在恒压下加入惰性组分平衡要向生成产
物的方向移动,也就是增加惰性组分后有利于气体的物质 的量增大的反应。因此对于该反应,通入水蒸气生产上可 以提高转化率。
4. 对于合成氨反应:N2 + 3H2(g) === 2NH3(g).在实际生产过程中 ,未反应完全的原料气N2,H2混合物要循环使用。在循环中,不断 加入新的原料气,N2和H2不断反应,而其中惰性组分,如甲烷、氩 等因不起反应而不断地积累,含量逐渐增高,要定期放空一部分惰
明理由? 答:在101.325KPa及-10℃条件下,H2O(l)→H2O(s)为自发过 程,据化学势判据,相变过程自发向化学势低的方向进行, 因此有μ*(l)>μ*(s)
3.乙苯脱氢制苯乙烯的反应:
多组分系统热力学及其在溶液中的应用习题

多组分系统热力学及其在溶液中的应用BCCAC; BDBAC DBCCA CDDBA CABAD DCCAC DDCAB A01>298K,标准压力下,苯和甲苯形成理想液体混合物,第一份溶液体积为2dm3,苯的摩尔分数为0.25,苯的化学势为μ1,第二份溶液的体积为1dm3,苯的摩尔分数为0.5,化学势为μ2,则:解答A.μ1>μ2 B.μ1<μ2 C.μ1=μ2 D.不确定02> 298K,标准压力下,有两瓶萘的苯溶液,第一瓶为2dm3(溶有0.5mol萘),第二瓶为1dm3(溶有0.25mol萘),若以μ1,μ2分别表示两瓶中萘的化学势,则:解答A.μ1=10μ2 B.μ1=2μ2 C.μ1=μ 2 D.μ1=0.5μ203>重结晶制取纯盐的过程中,析出的NaCl固体的化学势与母液中NaCl的化学势比较,高低如何?解答A.高B.低C.相等D.不可比较04>从多孔硅胶的强烈吸水性能说明在多孔硅胶吸水过程中,自由水分子与吸附在硅胶表面的水分子比较,化学势高低如何?解答A.前者高B.前者低C.相等D.不可比较05> 273K,10下,液态水和固态水(即冰)的化学势分别为μ(l)和μ(s),两者的关系为:解答A.μ(l)>μ(s) B.μ(l)=μ(s) C.μ(l)<μ(s) D.不能确定06>在298K时,A和B两种气体单独在某一溶剂中溶解,遵守Henry定律,Henry常数分别为k A和k B,且知k A>k B,则当A和B压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为:解答A.A的量大于B的量B.A的量小于B的量C.A的量等于B的量D.A的量与B的量无法比较07>在温度T时,纯液体A的饱和蒸气压为,化学势为,并且已知在标准压力下的凝固点为,当A中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为p A,μA,T f,则解答A.<p A,<μA,<T f B.<p A,<μA,<T fC.<p A,<μA,>T f D.<p A,>μA,>T f08>在400K时,液体A的蒸气压为4×104Pa,液体B的蒸气压为6×104Pa,两者组成理想液体混合物,平衡时溶液中A的物质的量分数为0.6,则气相中B的物质的量分数为:解答A.0.60 B.0.50 C.0.40 D.0.3109>已知373.15K时,液体A的饱和蒸气压为133.32kPa,另一液体B可与A构成理想液体混合物。
物理化学第二章作业及答案

第二章多相多组分系统热力学2007-4-24§2.1 均相多组分系统热力学 练习1 水溶液(1代表溶剂水,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若 V = A +B b 2+C (b 2)2(1)试列式表示V 1和V 2与b 的关系;答: b2: 1kg 溶剂中含溶质的物质的量, b 2=n 2, 112222,,,,2T P n T P n V V V B cb n b ⎛⎫⎛⎫∂∂===+ ⎪ ⎪∂∂⎝⎭⎝⎭ ∵ V=n 1V 1+n 2V 2( 偏摩尔量的集合公式)∴ V 1=(1/n 1)(V-n 2V 2)= (1/n 1)( V-b 2V 2)= (1/n 1)(A+Bb 2+c(b 2)2-Bb 2-2cb 2)= (1/n 1)[A-c(b 2)2] (2)说明A ,B , A/n 1 的物理意义;由V = A +B b 2+C (b 2)2 , V=A;A: b 2→0, 纯溶剂的体积,即1kg 溶剂的体积B; V 2=B+2cb 2, b 2→0, 无限稀释溶液中溶质的偏摩尔体积A/n 1:V 1= (1/n 1)[A-c(b 2)2],∵b 2→0,V = A +B b 2+C (b 2)2, 纯溶剂的体积为A, ∴A/n 1 为溶剂的摩尔体积。
(3)溶液浓度增大时V 1和V 2将如何变化?由V 1,V 2 的表达式可知, b 2 增大,V 2 也增加,V 1降低。
2哪个偏微商既是化学势又是偏摩尔量?哪些偏微商称为化学势但不是偏摩尔量? 答: 偏摩尔量定义为,,c B B T P n Z Z n ⎛⎫∂= ⎪∂⎝⎭所以,,c B B T P n G G n ⎛⎫∂= ⎪∂⎝⎭ ,,c B B T P n H H n ⎛⎫∂= ⎪∂⎝⎭ ,,cBB T P n F F n ⎛⎫∂= ⎪∂⎝⎭ ,,cB B T P n U U n ⎛⎫∂= ⎪∂⎝⎭ 化学势定义为:,,c B B T P n G n μ⎛⎫∂=⎪∂⎝⎭= ,,c B T V n F n ⎛⎫∂ ⎪∂⎝⎭= ,,c B S V n U n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S P n H n ⎛⎫∂ ⎪∂⎝⎭ 可见,偏摩尔Gibbs 自由能既是偏摩尔量又是化学势。
第02章--多相多组分系统热力学--习题及答案

第02章--多相多组分系统热⼒学--习题及答案第⼆章多相多组分系统热⼒学习题及答案§2. 1 均相多组分系统热⼒学(P68)1. ⽔溶液(1代表溶剂⽔,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若V = A +Bb 2+C (b 2)2(1)试列式表⽰V 1和V 2与b 的关系; (2)说明A 、B 、A/n 1的物理意义; (3)溶液浓度增⼤时V 1和V 2将如何变化解:(1) 由b 2的定义“1kg 溶剂中所含溶质的物质的量”,因此本题中可视溶剂⽔为1kg ,从⽽认为将 b 2=n 2。
★112222,,,,2T P n T P n V V V B Cb n b===+ ? ?据偏摩尔量的集合公式V=n 1V 1+n 2V 2,★V 1 =2211()V n V n -=2211()V b V n - =22222211[A+Bb +C(b )-Bb -2C(b )]n =2211[A-C(b )]n = 2211A C(b )n n - (2)20lim b V A →=,故A 表⽰当b 2→0,纯溶剂的体积,即1kg 溶剂⽔的体积;220lim b V B →=,故B 表⽰当b 2→0,⽆限稀溶液中溶质的偏摩尔体积;2101lim b AV n →=,A/n 1表⽰溶剂⽔的摩尔体积。
(3)由以上V 1和V 2 的表达式可知,溶液浓度(b 2)增⼤时,V 2 增⼤,V 1减⼩。
2. 哪个偏微商既是化学势⼜是偏摩尔量哪些偏微商称为化学势但不是偏摩尔量答:化学势表达式: ,,c B B T P n G n µ= ?= ,,c B T V n F n ?= ,,c B S P n H n ?= ,,cB S V n U n ??偏摩尔量: ,,c B B T P n G G n = ?,,,c B B T P n F F n = ?,,,c B B T P n H H n = ?,,,c B B T P n U U n ??=可见,只有偏微商,,c B T P n G n ??? ????既是化学势⼜是偏摩尔量,,,c B T V n F n ??? ????、,,c B S P n H n ??、,,cB S V n U n ??称为化学势,但不是偏摩尔量。
热力学问答题 2

第二章习题解答一、问答题:2-1为什么要研究流体的pVT 关系?【参考答案】:流体p-V-T 关系是化工热力学的基石,是化工过程开发和设计、安全操作和科学研究必不可少的基础数据。
(1)流体的PVT 关系可以直接用于设计。
(2)利用可测的热力学性质(T ,P ,V 等)计算不可测的热力学性质(H ,S ,G ,等)。
只要有了p-V-T 关系加上理想气体的idp C ,可以解决化工热力学的大多数问题。
2-2在p -V 图上指出超临界萃取技术所处的区域,以及该区域的特征;同时指出其它重要的点、线、面以及它们的特征。
【参考答案】:1)超临界流体区的特征是:T >T c 、p >p c 。
2)临界点C 的数学特征:3)饱和液相线是不同压力下产生第一个气泡的那个点的连线;4)饱和汽相线是不同压力下产生第一个液滴点(或露点)那个点的连线。
5)过冷液体区的特征:给定压力下液体的温度低于该压力下的泡点温度。
6)过热蒸气区的特征:给定压力下蒸气的温度高于该压力下的露点温度。
7)汽液共存区:在此区域温度压力保持不变,只有体积在变化。
2-3 要满足什么条件,气体才能液化?【参考答案】:气体只有在低于T c 条件下才能被液化。
2-4 不同气体在相同温度压力下,偏离理想气体的程度是否相同?你认为哪些是决定偏离理想气体程度的最本质因素?【参考答案】:不同。
真实气体偏离理想气体程度不仅与T 、p 有关,而且与每个气体的临界特性有关,即最本质的因素是对比温度、对比压力以及偏心因子r T ,r P 和ω。
2-5 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?()()()()点在点在C V PC V PT T 0022==∂∂∂【参考答案】:偏心因子ω为两个分子间的相互作用力偏离分子中心之间的作用力的程度。
其物理意义为:一般流体与球形非极性简单流体(氩,氪、氙)在形状和极性方面的偏心度。
为了提高计算复杂分子压缩因子的准确度。
第02章--多相多组分系统热力学--教案.

第二章多相多组分系统热力学§2.1 均相多组分系统热力学混合物和溶液都是一种多组分均相系统。
混合物:用来描述多种物质的气态、液态或固态均相系统,系统中所有物质用不分彼此的方法处理。
可以选用相同的方法研究每一个组分的性质。
溶液:用来描述多种物质的液态或固态均相系统。
相对含量较少的叫溶质,较多的叫溶剂。
对于溶质的溶剂需建立不同的标准研究。
一组成标度(组成表示法)1 混合物常用的组成标度B的质量分数w B=m B/mB的摩尔分数x B=n B/∑BB nB的物质的量浓度c B=n B/V2 溶质B常用的组成标度质量摩尔浓度:b B= n B / m A溶质B的摩尔分数x B=n B/∑BB n溶质B的物质的量浓度c B= n B/V不同浓度之间可以相互换算。
二偏摩尔量对于一定量的单组分单相封闭系统,一般只要两个状态变量就可以确定系统的状态。
而对与均相多组分系统大量实验事实说明:①均相多组分系统或均相敞开系统其容量性质如体积V ,热力学能U 等不仅是T ,p 的函数,还是系统中各组分物质的量n 的函数,因此要确定均相多组分系统的状态就必须考虑系统的组成。
②均相多组分系统的容量性质不具有简单的加和性,即V ≠∑B V (B)。
1 偏摩尔量的定义对于任一容量性质Z ,若系统中所含物质的量分别为n 1,n 2,…,则Z = f (T ,p ,n 1,n 2,…)Z 的微小变化d Z = n p T Z ,⎪⎭⎫⎝⎛∂∂d T +nT p Z ,⎪⎪⎭⎫ ⎝⎛∂∂d p + 1,,1dn n Z ncP T ⎪⎪⎭⎫⎝⎛∂∂ + 2,,2dn n Z ncP T ⎪⎪⎭⎫ ⎝⎛∂∂ +… =n p T Z ,⎪⎭⎫ ⎝⎛∂∂d T +nT p Z ,⎪⎪⎭⎫ ⎝⎛∂∂d p + c B B Z n ,p ,T n ∑⎪⎪⎭⎫ ⎝⎛∂∂d n B 等温、等压条件下d Z =cBBZ n ,p ,T n ∑⎪⎪⎭⎫⎝⎛∂∂d n B令: Z B =cB n ,p ,T n Z ⎪⎪⎭⎫ ⎝⎛∂∂Z B 表示系统中任意物质B 的偏摩尔量,Z 可为任一容量性质,例V B =c ,,B n p T n V ⎪⎪⎭⎫ ⎝⎛∂∂ G B =c ,,B n p T n G ⎪⎪⎭⎫ ⎝⎛∂∂ S B =c,,B np T n S ⎪⎪⎭⎫ ⎝⎛∂∂ 偏摩尔量的含义可从以下两个方面理解:① 指定T 、p 、各组分浓度不变的条件下,,往无限大量的系统中加入1摩尔物质B 所引起的体积的改变,称为物质B 的偏摩尔体积。
多组分多相体系热力学自测题答案

1、在恒温抽空的玻璃罩中封入两杯液面相同的糖水(A) 和纯水(B)。
经历若干时间后,两杯液面的高度将是:( A)(A) A 杯高于B 杯(B) A 杯等于B 杯(C) A 杯低于B 杯(D) 视温度而定2、在温度T时,纯液体A 的饱和蒸气压为p A*,化学势为μA*,并且已知在p∃压力下的凝固点为T f*,当A 中溶入少量与A 不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为p A,μ A,T f ,则( D)(A) p A*< p A, μA*<μA,T f* < T f(B) p A*> p A, μA*<μA,T f* < T f(C) p A*< p A, μA*<μA,T f* > T f(D) p A*> p A, μA*>μA,T f* > T f3、已知373.15 K 时,液体A 的饱和蒸气压为133.32 kPa,另一液体B 可与A 构成理想液体混合物。
当 A 在溶液中的物质的量分数为1/2 时,A 在气相中的物质量分数为2/3 时,则在373.15 K时,液体B 的饱和蒸气压应为:( A)(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa4、关于亨利系数,下列说法中正确的是: ( D)(A)其值与温度、浓度和压力有关(B)其值与温度、溶质性质和浓度有关(C)其值与温度、溶剂性质和浓度有关(D)其值与温度、溶质和溶剂性质及浓度的标度有关5、关于亨利定律,下面的表述中不正确的是:(C)(A)若溶液中溶剂在某浓度区间遵从拉乌尔定律,则在该浓度区间组分B必遵从亨利定律(B)温度越高、压力越低,亨利定律越正确(C)因为亨利定律是稀溶液定律,所以任何溶质在稀溶液范围内都遵守亨利定律(D)温度一定时,在一定体积的溶液中溶解的气体体积与该气体的分压力无关6、298 K时,HCl(g,M r=36.5)溶解在甲苯中的亨利常数为245 kPa⋅kg⋅mol-1,当HCl(g)在甲苯溶液中的浓度达2%时,HCl(g)的平衡压力为:( A)(A) 138 kPa (B) 11.99 kPa (C) 4.9 kPa (D) 49 kPa7、下述诸说法正确的是:( D)(1) 溶液的化学势等于溶液中各组分的化学势之和(2) 对于纯组分,则化学势等于其Gibbs自由能(3) 理想溶液各组分在其全部浓度范围内服从Henry定律(4) 理想溶液各组分在其全部浓度范围内服从Raoult定律(A) (1),(2) (B) (2),(3) (C) (2),(4) (D) (3),(4)8、设N2和O2皆为理想气体。
大学物理化学 第二章 热力学第二定律学习指导及习题解答

3.熵可以合理地指定
Sm$
(0K)
0
,热力学能是否也可以指定
U
$ m
(0K)
0
呢?
答:按能斯特热定理,当温度趋于0K,即绝对零度时,凝聚系统中等温变化过
程的熵变趋于零,即
, 只要满足此式,我们就可以任意
选取物质在0K时的任意摩尔熵值作为参考值,显然 Sm$ (0K) 0 是一种最方便的
选择。但0K时反应的热力学能变化并不等于零,
(2)变温过程
A.等压变温过程 始态 A(p1,V1,T1) 终态 B(p 1,V2,T2)
S
T2
δQ R
T T1
T2 Cp d T T T1
Cp
ln
T2 T1
B.等容变温过程 始态 A(p1,V1,T1) 终态 B(p2,V1,T2)
S
T2
δQ R
T T1
C.绝热过程
T2 CV d T T T1
,所以不
能指定
U
$ m
(0K)
0
。
4.孤立系统从始态不可逆进行至终态S>0,若从同一始态可逆进行至同
一终态时,则S=0。这一说法是否正确?
答:不正确。熵是状态函数与变化的途径无关,故只要始态与终态一定S
必有定值,孤立系统中的不可逆过程S>0,而可逆过程S=0 是毋庸置疑的,
问题是孤立系统的可逆过程与不可逆过程若从同一始态出发是不可能达到相同
4.熵 (1)熵的定义式
dS δ QR T
或
S SB SA
B δ QR AT
注意,上述过程的热不是任意过程发生时,系统与环境交换的热量,而必须是在
可逆过程中系统与环境交换的热。
大学物理化学4-多组分体系热力学课后习题及答案

多组分体系热力学课后习题一、是非题下述各题中的说法是否正确?正确的在题后括号内画“√”,错的画“⨯”1. 二组分理想液态混合物的总蒸气压大于任一纯组分的蒸气压。
( )2. 理想混合气体中任意组分B 的逸度B ~p 就等于其分压力p B ~。
( )3.因为溶入了溶质,故溶液的凝固点一定低于纯溶剂的凝固点。
( ) 4.溶剂中溶入挥发性溶质,肯定会引起溶液的蒸气压升高。
( ) 5.理想溶液中的溶剂遵从亨利定律;溶质遵从拉乌尔定律。
( ) 6. 理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p 与液相组成x B 呈线性关系。
( )7. 如同理想气体一样,理想液态混合物中分子间没有相互作用力。
( )8. 一定温度下,微溶气体在水中的溶解度与其平衡气相分压成正比( )9. 化学势是一广度量。
( )10. 只有广度性质才有偏摩尔量( )11. )B C C,(,,B ≠⎪⎪⎭⎫⎝⎛∂∂n V S n U 是偏摩尔热力学能,不是化学势。
( ) 二、选择题选择正确答案的编号,填在各题题后的括号内1. 在α、β两相中都含有A 和B 两种物质,当达到相平衡时,下列三种情况, 正确的是:( )。
(A)ααμ=μB A ; (B) βαμ=μA A ; (C) βαμ=μB A 。
2. 理想液态混合物的混合性质是:( )。
(A)Δmix V =0,Δmix H =0,Δmix S >0,Δmix G <0;(B)Δmix V <0,Δmix H <0,Δmix S <0,Δmix G =0;(C)Δmix V >0,Δmix H >0,Δmix S =0,Δmix G =0;(D)Δmix V >0,Δmix H >0,Δmix S <0,Δmix G >0。
3. 稀溶液的凝固点T f 与纯溶剂的凝固点*f T 比较,T f <*fT 的条件是:( )。
(A )溶质必需是挥发性的;(B )析出的固相一定是固溶体;(C )析出的固相是纯溶剂;(D )析出的固相是纯溶质。
《多组分系统热力学》习题及答案.doc

(A)纯理想气体的标准状态就是标准压力P(100KPa)T 的状态 (B)纯液体物质的标准状态就是标准压力P (lOOKPa)下的纯液体(C) 纯固体物质的标准状态就是标准压力P (lOOKPa)下的纯固体(D) 不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同 答案:D 6.稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它 们有关,其中正确的是(A)只有溶质不挥发的稀溶液才有这些依数性 正比 (0所有依数性都与溶剂的性质无关 答案:B7. 关于亨利系数,下面的说法中正确的是 (A)其值与温度、浓度和压力有关 (0其值与溶剂性质、温度和浓度大小有关 度等因素都有关答案:D8. 定义偏摩尔量时规定的条件是 (A)等温等压(B)等嫡等压(C)等温,溶液浓度不变(D)等温等压,溶液浓度不变答案:D9. 关于偏摩尔量,下面的说法中正确的是 (A)偏摩尔量的绝对值都可求算(B)(0同一系统的各个偏摩尔量之间彼此无关 答案:B10. 关于偏摩尔量,下面的叙述中不正确的是 (A)偏摩尔量是状态函数,其值与物质的数量无关(0纯物质的偏摩尔量等于它的摩尔量 (B)所有依数性都与溶液中溶质的浓(D)所有依数性都与溶质的性质有(B)(D其值只与温度、溶质性质和浓度标度有关 其值与温度、溶剂和溶质的性质及浓度标系统的容量性质才有偏摩尔量 没有热力学过程就没有偏摩尔量 (D(B)系统的强度性质无偏摩尔量(D)偏摩尔量的数值只能为整《多组分系统热力学》习题及答案选择题1. 在373. 15K 和101325Pa 下水的化学势与水蒸气化学位的关系为(A) u (水)=p(汽)(B) u (水)< P (汽)(C) 11(水)>口(汽)(D)无法确定 答案:A 。
两相平衡,化学势相等。
2. 下列哪种现象不属于稀溶液的依数性(A)凝固点降低 (B)沸点升高 (C)渗透压 (D)蒸气压升高 答案:D 。
2-多相多组分系统热力学典型例题

一、 选择题1、 下列偏微分中,能称为偏摩尔量的是:( A )(A ),,()B T P nc C B V n ≠⎛⎫∂ ⎪∂⎝⎭ (B) ,,()B S P nc C B H n ≠⎛⎫∂ ⎪∂⎝⎭ (C) ,,()B P V nc C B G n ≠⎛⎫∂ ⎪∂⎝⎭ (D) ,,()B T H ncC B S n ≠⎛⎫∂ ⎪∂⎝⎭ 2、某溶液由2mol A 和1.5mol B 混合而成,总体积为0.42 dm 3。
该溶液中已知A 的偏摩尔体积V A =0.03 dm 3•mol -1 ,则组分B 的偏摩尔体积V B 为 ( C )(A )0.20 dm 3•mol -1 (B) 0.30 dm 3•mol -1( C) 0.24 dm 3•mol -1 (D) 0.28 dm 3•mol -13、在一定温度和压力下,设纯的A(1)的化学势为μ*,其标准态化学势为μθ。
若在A 中加入另一液相B(1),形成理想的液态混合物,这时A(1)的化学势为μA ,标准态化学势为μA θ,则两种化学势之间的关系为( B )(A ) μ*=μA , μθ=μA θ (B) μ*>μA , μθ=μA θ( C) μ*=μA , μθ>μA θ (D) μ*>μA , μθ<μA θ4*、在298K 时,设液体A 和B 能形成理想的液态混合物,它们的蒸气形成理想的气体混合物。
已知纯A 和纯B 的饱和蒸气压分别为50A p kPa *=,60B p kPa *=,若液相中0.4A x =,则平衡的气相中B 的摩尔分数B y 的值为 ( A )(A ) y B =0.64 (B) y B =0.25( C) y B =0.50 (D) y B =0. 405、设373K ,100kPa 时,2()H O g 的化学势为1μ;373K ,50kPa 时,2()H O g 的化学势为2μ。
如果两者有如下4个关系式(1 ) μ1θ=μ2θ (2) μ2-μ1 =RTln2( 3) μ2-μ1 =-RTln2 (4) μ2=μ1- RTln0.5这些关系中正确的是 (B)(A) (1), (2) (B) (1), (3)(C ) (3), (4) (D) (2), (4)6、在298K 时,已知①2()H g 和②2()O g 在水中的Henry 系数分别为9,17.1210x k Pa =⨯,9,2 4.410x k Pa =⨯。
多组分系统热力学

多组分系统热力学一、判断题:1 克拉佩龙方程适用于纯物质的任何两相平衡.( )2 克-克方程比克拉佩龙方程的精确度高。
( )3 一定温度下的乙醇水溶液,可应用克—克方程式计算其饱和蒸气压.()4 将克—克方程的微分式用于纯物质的液气两相平衡,因为vap H m>0,所以随着温度的升高,液体的饱和蒸气压总是升高的。
( )5 二组分理想液态混合物的总蒸气压大于任一纯组分的蒸气压。
( )6 理想混合气体中任意组分B的逸度就等于其分压力p B。
( )7 因为溶入了溶质,故溶液的凝固点一定低于纯溶剂的凝固点。
( )8 溶剂中溶入挥发性溶质,肯定会引起溶液的蒸气压升高。
( )9 理想稀溶液中的溶剂遵从亨利定律,溶质遵从拉乌尔定律()10 理想液态混合物与其蒸气成气、液两相平衡时,气相总压力p与液相组成x B呈线性关系。
()11 如同理想气体一样,理想液态混合物中分子间没有相互作用力。
()12 一定温度下,微溶气体在水中的溶解度与其平衡气相分压成正比。
( )13 化学势是一广度量。
()14 只有广度性质才有偏摩尔量.()15 稀溶液的沸点总是高于纯溶剂的沸点。
()16 单组分系统的熔点随压力的变化可用克劳休斯—克拉佩龙方程解释。
( )17.公式 d G = -S d T + V d p只适用于可逆过程。
()18.某一体系达平衡时,熵最大,自由能最小。
( )19.封闭体系中,由状态1经定温、定压过程变化到状态2,非体积功W/<0,且有W/>∆G 和∆G<0,则此变化过程一定能发生。
()20.根据热力学第二定律,能得出,从而得到。
()21.只有可逆过程的∆G才可以直接计算。
()22.凡是自由能降低的过程一定都是自发过程。
( )23.只做体积功的封闭体系,的值一定大于零.()24.偏摩尔量就是化学势。
( )25.在一个多组分溶液中,只有溶质才有偏摩尔量.()26.两组分混合成溶液时,没有热效应产生,此时形成的溶液为理想溶液。
物理化学-多组分体系热力学 (1)

5molCO的Δ SΔ G为: H 5 6018 30090 J
2.课本P203,第28题。
S 5 9.654 48.27 J / K ; G 193695 J
解:
C S Pm dT T 298
1000
1000
298
22.47 201.8 103 T 63.5 106 T 2 dT T
773 773 r S r S C p ln 66.67 1.337 ln 67.944 J / K 298 298 r Gm r H m T S 773 r m 31635 773 67.944 31635 52521 20886 J
这里务须注意,称为偏摩尔量的热力学性质必须(1)是容量性质, (2) 下标必须是T,P(等温等压下)
G ( 如 n )T ,V ,nC (C B ) B
就不能讲是偏摩尔量,只能讲是偏导数。这是偏 摩尔量的规定。偏摩尔体积是最直观的一个偏摩尔量,一酒精与水 组成的溶液为例:2表示酒精,1表示水,
02(g) 0 205.1 4 32.99
(1)求该反应存298K的标准平衡常数KΘ (2)求773K时反应的 r Hm 和
r Sm
(3)求773K时反应标准平衡常数KΘ
注:TK时标准平衡常数 K m 由该温度时的 r Hm 和 r Sm
求得:
r Gm r H m T r Sm RT ln Km
分对总体量的贡献。 (2)
B
Z Z B nB : Z n1 Z1 n2 Z2 ; 再微分得:
B B
dZ Z B dnB nB d Z B ; dZ Z1dn1 Z2dn2 n1d Z1 n2d Z2
物理化学_第2章_多组分多相系统热力学

( pg,T ) * ( pg,T , p)
33
B( pg, p ,T ) B( pg, p,T ) ( pg,T ) * ( pg,T , p)
d *
dGm*
S* m
dT
Vm*dp
dT 0
d *
Vm*dp
RT p
dp
RTd ln
p
d RT d ln p * ( pg,T , p)
0)
27
B( ) dT0,dp0,W '0 B( )
( )
( )
dnB ( ) dnB ( )
dnB ( )
dG
B
(
)dnB
(
)
B
(
)dnB
(
)
B
(
)dnB
(
)
B
()dn ( ) ( )dn ( )
B
B
B
B
[B()Fra bibliotek B(
)]dnB
(
)
dG 0 ( ) ()
B
B
化学势从高到低的变化是自发过程
T
,nC
dp
B
G nB
dnB
T , p,nCB
S
V
G nB
T , p,nCB
B
dG
G T
p,nB
dT
G p
T
,nB
dp
B
G nB
dnB
T , p,nCB
dG SdT Vdp BdnB
B
16
对混合物:U U(S,V , nB , nC , nD ...)
dU U dS U dV
B
dG SdT Vdp BdnB
多组分系统热力学补充练习题

第3章多组分系统热力学(一)、填空题1.偏摩尔量是指多组分系统中的任一量X(如、、等)在温度和压力及除了组分B以外其它各组分的物质的量均不变的条件下,由于某一组分B的物质的量的极微小变化而引起系统量X随组分B的物质的量的变化率。
2.理想液态混合物是指在一定温度下,液态混合物中的任意组分在全部的组成范围内都遵守定律的混合物,可以认为此溶液中各种分子的是相同的。
3.物质标准态的规定如下,固态:固体纯物质在的状态;液态:纯液体在的状态;气态:-在任一温度T,标准压力p°下的状态。
在这些状态下物质所具有的化学势为各自的标准化学势。
4.A、B两液体形成理想液态混合物,已知在温度T时纯A和B的饱和蒸气压分别为p A*=40kPa和p B*=120 kPa,若该混合物在温度T及压力100 kPa时开始沸腾,则此时的液相和气相组成为x B= , y B= 。
5.在室温下,一定量的苯和甲苯混合,这一过程所对应△H的大约为。
6.在某温度下,纯液体A的饱和蒸气压是纯液体B的13倍,A和B形成理想液态混合物,若平衡时的气相中A和B的摩尔分数相等,则液相中A和B的摩尔分数比为。
7.0.5molNaOH固体在288.2K时溶于4.559mol水中形成溶液的蒸气压为1363.9Pa,而此时纯水的蒸气压为1704.9Pa。
则溶液中水的活度为,溶液中溶剂的化学势和纯水的化学势相差。
8.含有某非挥发性溶质的水的稀溶液,在271K时凝固,水的K f为1.86K·kg·mol-1、K b 为0.52 K·kg·mol-1,该溶液的正常沸点为,298.15K时的渗透压为。
9. 353.15K时,苯和甲苯的蒸气压分别为100 kPa和38.7kPa,二者形成混合物,其平衡气相的组成为y(苯)为0.30,则液相的组成x(苯)为。
10. 298.15K时,水(A)和丙酮(B)组成溶液,实验测得x B=0.1791,p=21.30kPa,y B=0.8782,已知p B*=30.61kPa,k x,B=185kPa,将该溶液视为液态混合物,则丙酮(B)的活度系数γB为,将该溶液视为稀溶液,则丙酮(B)的活度系数γx,B为。
物理化学(第二版)第二章 多相多组分系统热力学

化学势(chemical potential)
已知过程的性质判据以及变化的自发方向与限度的 判据与系统的容量性质G,F,H,U在各自特定条件下
的改变值有关,而系统组成的变化,也会引起这些容 量性质的改变。为了导出多组分系统的上述判据,我 们引入化学势。
等T,p条件下,变化的自发方向的判据是 GT,p 0
第二章
第二章
§2.1 均相多组分系统热力学 §2.2 气体热力学 §2.3 单组分多相系统的热力学 §2.4 多组分气—液平衡系统热力学 §2.5 多组分多相平衡 §2.6 两组分系统的相图 §2.7 三组分系统的相平衡
§2.1
一 组成标度 二 偏摩尔量. 三 化学势 四 化学势判据 五 化学势与温度、压力的关系
O B
=
RT
ln OB
以标准状态为基准
B -
O B
= RT ln
( B / OB )
定义aB = ( B /OB ) 称为相对活度,简称活度(activity)
则以此标准状态作为基准的化学势等温表达式为
B
=
O B
+ RT ln aB
这就是化学势的一般表达式,即化学势是活度的对数的
线性函数。它对任意系统都成立,针对不同的系统中的
标准状态(standard state)简称标准态就是 这样一种基线,标准态下的化学势称为标准化学
势,以符号 记BO 之。上标 O便是标准状态的标识。
以绝对活度λ的大小表示物质在不同状态时化学势μ
的相对高低。
标准状态与化学势等温表达式
定义:λB = exp(
B)
RT
于是 B=RTlnλB
该物质在同温度下标准状态的化学势定义为 :
多组分系统热力学及其在溶液中的应用习题

多组分系统热力学及其在溶液中的应用BCCAC; BDBAC DBCCA CDDBA CABAD DCCAC DDCAB A01>298K,标准压力下,苯和甲苯形成理想液体混合物,第一份溶液体积为2dm3,苯的摩尔分数为0.25,苯的化学势为μ1,第二份溶液的体积为1dm3,苯的摩尔分数为0.5,化学势为μ2,则:解答A.μ1>μ2 B.μ1<μ2 C.μ1=μ2 D.不确定02> 298K,标准压力下,有两瓶萘的苯溶液,第一瓶为2dm3(溶有0.5mol萘),第二瓶为1dm3(溶有0.25mol萘),若以μ1,μ2分别表示两瓶中萘的化学势,则:解答A.μ1=10μ2 B.μ1=2μ2 C.μ1=μ 2 D.μ1=0.5μ203>重结晶制取纯盐的过程中,析出的NaCl固体的化学势与母液中NaCl的化学势比较,高低如何?解答A.高B.低C.相等D.不可比较04>从多孔硅胶的强烈吸水性能说明在多孔硅胶吸水过程中,自由水分子与吸附在硅胶表面的水分子比较,化学势高低如何?解答A.前者高B.前者低C.相等D.不可比较05> 273K,10下,液态水和固态水(即冰)的化学势分别为μ(l)和μ(s),两者的关系为:解答A.μ(l)>μ(s) B.μ(l)=μ(s) C.μ(l)<μ(s) D.不能确定06>在298K时,A和B两种气体单独在某一溶剂中溶解,遵守Henry定律,Henry常数分别为k A和k B,且知k A>k B,则当A和B压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为:解答A.A的量大于B的量B.A的量小于B的量C.A的量等于B的量D.A的量与B的量无法比较07>在温度T时,纯液体A的饱和蒸气压为,化学势为,并且已知在标准压力下的凝固点为,当A中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为p A,μA,T f,则解答A.<p A,<μA,<T f B.<p A,<μA,<T fC.<p A,<μA,>T f D.<p A,>μA,>T f08>在400K时,液体A的蒸气压为4×104Pa,液体B的蒸气压为6×104Pa,两者组成理想液体混合物,平衡时溶液中A的物质的量分数为0.6,则气相中B的物质的量分数为:解答A.0.60 B.0.50 C.0.40 D.0.3109>已知373.15K时,液体A的饱和蒸气压为133.32kPa,另一液体B可与A构成理想液体混合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 多相多组分系统热力学习题及答案§2. 1 均相多组分系统热力学(P68)1. 水溶液(1代表溶剂水,2代表溶质)的体积V 是质量摩尔浓度b 2的函数,若V = A +Bb 2+C (b 2)2(1)试列式表示V 1和V 2与b 的关系; (2)说明A 、B 、A/n 1的物理意义; (3)溶液浓度增大时V 1和V 2将如何变化?解:(1) 由b 2的定义“1kg 溶剂中所含溶质的物质的量”,因此本题中可视溶剂水为1kg ,从而认为将 b 2=n 2。
★112222,,,,2T P n T P n V V V B Cb n b ⎛⎫⎛⎫∂∂===+ ⎪ ⎪∂∂⎝⎭⎝⎭ 据偏摩尔量的集合公式V=n 1V 1+n 2V 2,★V 1 =2211()V n V n -=2211()V b V n - =22222211[A+Bb +C(b )-Bb -2C(b )]n =2211[A-C(b )]n = 2211A C (b )n n - (2)20lim b V A →=,故A 表示当b 2→0,纯溶剂的体积,即1kg 溶剂水的体积;220lim b V B →=,故B 表示当b 2→0,无限稀溶液中溶质的偏摩尔体积;2101lim b AV n →=,A/n 1表示溶剂水的摩尔体积。
(3)由以上V 1和V 2 的表达式可知,溶液浓度(b 2)增大时,V 2 增大,V 1减小。
2. 哪个偏微商既是化学势又是偏摩尔量?哪些偏微商称为化学势但不是偏摩尔量?答:化学势表达式: ,,c B B T P n G n μ⎛⎫∂= ⎪∂⎝⎭= ,,cB T V n F n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S P n H n ⎛⎫∂ ⎪∂⎝⎭= ,,cB S V n U n ⎛⎫∂ ⎪∂⎝⎭偏摩尔量: ,,c B B T P n G G n ⎛⎫∂= ⎪∂⎝⎭,,,c B B T P n F F n ⎛⎫∂= ⎪∂⎝⎭,,,c B B T P n H H n ⎛⎫∂= ⎪∂⎝⎭,,,cBB T P n U U n ⎛⎫∂= ⎪∂⎝⎭ 可见,只有偏微商,,c B T P n G n ⎛⎫∂ ⎪∂⎝⎭既是化学势又是偏摩尔量,,,c B T V n F n ⎛⎫∂ ⎪∂⎝⎭、,,c B S P n H n ⎛⎫∂ ⎪∂⎝⎭、,,cB S V n U n ⎛⎫∂ ⎪∂⎝⎭称为化学势,但不是偏摩尔量。
3. 25℃时 物质的量分数为0.4的甲醇水溶液,如果往大量此溶液中加1mol H 2O ,溶液体积增加17.35cm 3,如果往大量此溶液中加1mol CH 3OH 溶液体积增加39.01cm 3。
试计算(1)将0.4mol CH 3OH 和0.6mol H 2O 混合时,混合溶液的体积。
(2)此混合过程中体积的变化。
已知25℃时甲醇密度为0.7911g cm -3,水的密度为0.9971g cm -3。
答:χB =0.4 V H2O =17.35cm 3, V 甲醇=39.01cm 3 (1) V=n 1V 1+n 2V 2=0.4×39.01+0.6×17.35= 26,01cm 3(2) 混合前:V=(0.4×32/ρ甲醇)+ (0.6×18/ρ水)=(0.4×32/0.7911)+(0.6×18/0.9971)=27.01cm 3ΔV=26.01-27.01=-1.0cm 3(3) 20℃时,在1dm 3 NaBr 水溶液中含NaBr(B)321.99g ,体积质量为1.238g cm -3 。
计算该溶液的:(1)溶质B 的浓度c B ;(2)溶质B 的摩尔分数x B ;(3)溶质B 的质量摩尔浓度b B 。
答:V=1dm 3, m NaBr =321.99g, ρ=1.238g/cm 3, M NaBr =103 (1) C B =n B /V 溶液= 321.99/103/1=3.126mol/dm 3 (2) χB =n B /(n A +n B )=321.99103(321.99/103)[(1.2381000321.99)/18]+⨯-=3.126/(3.126+50.889)=0.0578(3)b B =n B /M A = (321.99/103)/[(1238-321.99)/1000]=3.126/0.916=3.4126mol kg -1 [ (1) 3.126 mol dm -3 (2) 0.0580 (3) 3.414 mol kg -1 ]5 18℃时,溶于1kg 水中的硫酸镁溶液的体积与硫酸镁的质量摩尔浓度的关系在b <0.1 mol kg -1 时可表示为V /cm 3 =1001.21+34.69(b 2 -0.07)2计算b = 0.05 mol kg -1 时,硫酸镁的偏摩尔量和水的偏摩尔量。
[ -1.388 cm 3 mol -1 , 18.023 cm 3 mol -1 ]答: 4.,,cB MgSO B T P b V V b ⎛⎫∂= ⎪∂⎝⎭ 将原式展开,得到V=1001.21+34.69b 2-4.8566b+0.16998,对b 微分,4.,,cB MgSO B T P b V V b ⎛⎫∂= ⎪∂⎝⎭=2×34.69 b-4.8566, Bb=0.05, 代入得到V B,MgSO4=-1.388cm 3 mol -1将b = 0.05 mol kg -1 ,代入求得V 的方程得到总体积为1001.22 在利用集合公式V=n 水V 水+n MgSO4V mgS04. 其中,n 水 等于1000/18=55.556mol ; n MgSO4=0.05mol ,得到,V B ,H2O =18.023cm 3mol -16 比较d G = - S d T + V d p 及d G = - S d T + V d p +∑BB B d n μ 的应用对象和条件。
d G = - S d T + V d p :单组分封闭系统,无其他功 d G = - S d T + V d p +∑BB B d n μ多组分封闭系统,无其他功。
§2.2 气体热力学(P74)1 证明: 理想气体标准状态的化学势与压力无关。
2 试由理想气体化学势表达式: B μ(g ,T ,p B )=O B μ(g ,T )+RT ln (p B/O p ) ,导出理想气体状态方程3. 理想气体混合物组分B 的化学势表达式为OB BO (,,,)(,)BB p g T p x g T RTln pμμ=+,O B (,)g T μ为标准态的化学势,这个标准态指的是怎样的状态?真实气体混合物组分B化学势表达式中,其标准态化学势的标准态与它是否相同?答:理想气体混合物:标准态O B (,)g T μ指温度为T 、压力为p Ө的纯B 理想气体。
真实气体混合物:标准态OB (,)g T μ指温度为T 、压力为p Ө,且服从理想气体状态方程的纯B 气体。
★ 二者标准态相同,均以纯气体B ,温度为T 、压力为p Ө,服从理想气体定律。
但对真实气体来说,它的标准态是一个实际上并不存在的假想状态。
4 求0℃,20.3×106Pa 时CH 4的逸度因子,已知CH 4 的T C =190.7 K , p c = 46.4×105 Pa 。
[ 0.68 ]5 估计在92℃,15.2×106Pa 时的CO 2的逸度,已知CO 2 的T C =304.2 K , p c =73.8×105 Pa 。
[ 10.3×106 Pa ] §2 34.解:根据m l s m l s V T H dT dp ∆∆=,近似:ml s ml s H V T p T ∆∆=∆∆ ΔT=-0.35=273.15×(18/0.9998 –18/0.9168)×10-6×Δp /333.5×18 Δp =4.739×106Pa5.解:(1) 121212)(ln T T R T T H p p m gl ⨯⨯-∆=,)15.27315.373/(15.27315.373314.8)92.1171(ln -⨯⨯⨯=∆m g l H =38.04kJ mol -1 (2) ⎪⎪⎭⎫⎝⎛-=2115.3731314.838040171100lnT ,T 2=357.5K 6.解:11637.414163715.47388--⋅=⋅=⨯=∆mol kJ mol J H m g l 121212)(ln T T R T T H p p m g l ⨯⨯-∆=,15.47315.293314.8)15.47315.293(41637100ln 2⨯⨯-=p p 2=150.48 Pa ,p 2= n 2RT/V ,150.48=n 2×8.314×293.15/1n 2=0.0617 mol m(油)=0.0617×120=7.41 g§2.3 单组分多相系统的热力学(P81)1. 从 VT p ⎪⎭⎫ ⎝⎛∂∂= TV S ⎪⎭⎫ ⎝⎛∂∂ 应用于纯物质气液平衡系统,可直接导出Tp d d =V S ∆∆ ,你对Maxwell 关系的适用条件及上述推导的思路是如何理解的?答:Maxwell 关系式适用条件:封闭系统,W’=0,单组分均相系统(无论可逆与否)。
多组分多相系统的不可逆过程中,组成会发生改变,所以Maxwell 关系式不适用。
Tpd d =VS ∆∆ 适用于单组分系统的两相平衡过程(可逆过程)2. 请就以下三方面比较Clapeyron 方程与Clausius-Clapeyron 方程: 答:(1)应用对象;Clapeyron 方程适用所有的单组分两相平衡过程;Clausius-Clapeyron方程:只能用于固气;液气两相平衡过程(2)限制条件;Clapeyron 方程适用单组分两相平衡过程;Clausius-Clapeyron 方程只能用于单组分固气;液气两相平衡过程,其中必须有一相为气相(3)精确度: Clausius-Clapeyron 方程中V g -V l ≈V g ; V g -V s ≈V g , 不如Clapeyron 方程精确。
3. 已知液体A 和液体B 的标准沸点分别为70℃和90℃。
假定两液体均满足Trouton 规则,试定性地阐明:在25℃时,液体A 的蒸气压高于还是低于液体B 的蒸气压? 答: 依据特鲁顿规则:A 的汽化热Δl g H m = (273.15+70)×88=30.197 kJ mol -1 ;B 的汽化热Δl g H m = (273.15+90)×88=31.957 kJ mol -1 ln(P 2/P 1)=[Δl g H m (T 2-T 1)]/(RT 2T 1),则有ln(P A, 25℃/P Ө)=[30197(298.15-343.15)]/(8.314×298.15×343.15), P 25℃=0.2 P Ө,同理:B 而言:P B, 25℃=0.1 P Ө, 可见 P A, 25℃> P B, 25℃4. 已知水和冰的体积质量分别为0.9998 g cm -3和0.9168 g cm -3;冰在0℃时的质量熔化焓为333.5 J g -1 。
