化学物质反应平衡状态的判断
化学平衡-平衡状态的判断

(1)对于同一物质来说,当:
Ⅰ.V(正)=V(逆) 或 Ⅱ.V(消耗)=V(生成) 时,化学 反应达到平衡状态 (2)对于不同物质来说: 判断方法:反应速率方向相反,并且速率之比等于 化学计量数之比
【例1】 在一定温度下,可逆反应:
A(g)+3B(g) 2C(g)达到平衡的标志是(AC )
化学反应的限度
化学平衡状态的判断
商城高中
3、化学平衡状态的特征
(1)逆:可逆反应 (2)动:动态平衡(正逆反应仍在进行)
(3)等:正反应速率=逆反应速率≠0 (4)定:反应混合物中各组分的浓度或质量保持恒定 不变
(5)变:条件改变,原平衡被破坏,在新的条件下建 立新的平衡。
三、化学平衡状态的判断 以xA(g)+yB(g) zC(g)为例,分析 化学反应达到平衡状态的标志:
•
解析 关于平衡状态的判断,一定要根 据实际反应分析选项,判断是否达到平衡 状态,只有在平衡状态下具备的性质才能 作为“标志”。本题中的反应是一个反应 前后气体物质的量不等的可逆反应。②在 反应过程中的任意时刻都符合。⑧可能是 平衡状态,也可能不是平衡状态。 • 答案 A
【例 4】 在一定温度下固定体积的容器中 , 下 列 叙 述 是 可 逆 反 应 A(g)+3B(g) 2C(g)+2D(s) 达 到 平 ①③④⑤⑥⑦ 衡 的 标 志 的 是 ( ) ①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB ③A、B、C的浓度不再变化 ④混合气体的密度不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化 ⑦单位时间内消耗amolA,同时生成 3amolB
• 答案 A
高中化学化学平衡状态的标志

化学平衡状态的标志一、化学平衡的标志化学平衡的标志是:①;②各组分的物质的量、质量、含量保持不变。
二、速度与平衡的关系1、,平衡向正反应方向移动。
2、,平衡不移动。
3、,平衡向逆反应方向移动。
三、化学平衡状态的特征逆:研究对象是可逆反应。
等:。
动:动态平衡。
定:达平衡后,各组分的浓度保持不变。
变:条件改变,平衡发生移动。
同:在外界条件一定时,相当量的反应物和生成物间,不论从正反应开始,还是从逆反应开始,达到的平衡状态是相同的。
四、化学平衡状态的判断方法1、达到化学平衡状态的本质标志化学平衡状态的本质标志是:正反应速率等于逆反应速率,但不等于零,是对同一反应物或同一生成物而言。
对某一反应物来说,正反应消耗掉反应物的速度等于逆反应生成该反应物的速度。
2、达到化学平衡状态的等价标志所谓“等价标志”是指可以间接衡量某一可逆反应是否达到化学平衡状态的标志。
(1)与等价的标志①同一物质:该物质的生成速率等于它的消耗速率,如:。
②不同的物质:速率之比等于化学方程式中的化学计量数之比,但必须是不同方向的速率,如:。
③可逆反应的正、逆反应速率不再随时间发生变化。
④化学键断裂情况=化学键生成情况。
对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
对不同物质而言,与各物质的化学计量数和分子内的化学键多少有关。
如:对反应,当有3mol H—H键断裂,同时有键断裂,则该反应达到了化学平衡。
(2)反应混合物中各组成成分的含量保持不变①质量不再改变:各组成成分的质量不再改变,各反应物或生成物的总质量不再改变(不是指反应物的生成物的总质量不变),各组分的质量分数不再改变。
②物质的量不再改变:各组分的物质的量不再改变,各组分的物质的量分数不再改变,各反应物或生成物的总物质的量不再改变。
[反应前后气体的分子数不变的反应,如:除外]③对气体物质:若反应前后的物质都是气体,且化学计量数不等,总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)保持不变。
高中化学平衡状态的判断方法

高中化学平衡状态的判断方法你一定会遇到这样的选择题:下列能说明某反应达到平衡状态的选项是哪些?说到底,就是让你判断反应是否处于化学平衡状态。
化学平衡状态,实质是正逆反应速率相等;特征为各物质浓度不再改变。
我们在判断是否达到平衡的时候,自然也就有了两个依据:一为实质性依据,即从正逆反应速率的关系上判断,我们总结一句话,叫做“一正一逆,符合比例”;二为特征性依据,即是否出现反映物质浓度不再改变的属性状态,我们总结一句话,叫做“变量不变,平衡出现”。
一、根据速率判断平衡状态,常见的方式有以下几种1.生成(或消耗)a mol A物质的同时,生成(或消耗)b mol B 物质此类进行判定的要点,一是看两个过程是不是分别代表一正一逆两相反过程,二是看两个数值a与b之比,是不是符合A与B在反应中的系数比。
2.断裂(或形成)a mol某化学键的同时,断裂(或形成)b mol 另一种化学键此类进行判定的要点,一是看两种化学键变化的过程,是否代表一正一逆两相反过程,二是看化学键变化所揭示的的物质变化,是否符合系数比关系。
3.同一时间内,v正(A):v逆(B)=a:b,或者 b v正(A)=a v逆(B)此种类型的判定较为常见,也较为简单,只需要一正一逆两反应速率比符合A与B在反应中的系数比即可。
例如:以下能证明反应N2 + 3H2 ? 2NH3达到平衡状态的是:A.一段时间内,生成1.5molH2的同时,消耗了0.5molN2B.一段时间内,断裂4.8molN-H键的同时,断裂了0.8molN≡NC.一段时间内,v正(N2):v逆(H2)=1:3二、根据平衡状态的特征属性进行判断,常见的依据有:温度,颜色,压强,密度,平均相对分子量等。
判定的要点是:若某个属性对于未达平衡的反应体系是一个变量,当其达到恒定不变的状态时,即达到了反应的平衡状态。
例如:恒容体系中,可逆反应N2(g) + 3H2(g) ? 2NH3(g)达到平衡的标志可以是:压强不再改变(因反应未达平衡时,压强是一变量),可以是气体的平均相对分子量不再改变(反应未达平衡时,平均相对分子量是一变量),但不可以是气体密度不再改变(因反应未达平衡时,气体密度是一恒量)。
如何判断化学反应是否达到平衡

如何判断化学反应是否达到平衡如何判断化学反应是否达到平衡化学反应平衡是高中化学的一个重要的内容,可以说是高中化学中最常用的,下面有途网小编分享给大家如何判断化学反应是否达到平衡。
本质性判断,化学平衡状态的本质性标志是:“正反应与逆反应的速率相等”。
这样就可以直接或间接地衍生出以下6种判断方式:(1)从速率的角度描述:同一物质的生成速率等于消耗速率;(2)从速率的角度描述:处于可逆方程式同一侧(即两者同为反应物或两者同为生成物)的不同种物质,必须一种物质生成同时另一种物质消耗,且两者的速率之比等于化学方程式中化学计量数之比;(3)从速率的角度描述:处于可逆方程式不同侧(即一为反应物,另一为生成物)的不同种物质,必须两种物质同时生成或同时消耗,且两者的速率之比等于化学方程式中化学计量数之比;(4)从时间和物质的生消量的角度描述:单位时间内消耗掉某物质的量与生成该物质的量相等;(5)从断键角度描述:如H2+I2 2HI的反应,单位时间内断裂一个H—H键的同时,形成一个H—H键,或形成一个I—I 键,或断裂2个H—I键;(6)从能量角度描述:绝热容器中,反应放出的热量与吸收的热量相等,即体系温度不变。
特征性判断。
化学平衡状态的特征性标志是:“反应混合物中各组分的浓度保持不变。
”这样,就又可以直接或间接地衍生出以下5种判断方式:(7)反应混合物中和物质的物质的量浓度保持不变;(8)反应混合物中各物质的物质的量分数、质量分数、体积分数(对气体物质而言)等保持不变;(9)反应混合物中各物质的物质的量、质量、分子数等保持不变;(10)反应混合物中某一种反应物的转化率、某一生成物的产率等保持不变;(11)反应混合物中某些特征,如某组分有颜色,体系的颜色不再改变时。
整体性判断,化学平衡状态可以从各组分来判断以外,对于有些可逆反应,还可以采取反应混合物的整体情况来判断。
如:对于mA(g)+nB(g) pC(g)+qD(g) (其中m+n=?p+q)或者mA(s)+nB(g) pC(g)+qD(g) (其中n=?p+q)等可逆反应而言,只要出现下列几种情况时,也达到了平衡状态:(12)定温、定容条件下,总压强保持不变;(13)定温、定压条件下,总体积保持不变;(14)定容条件下,气体密度保持不变(仅指除气体外还有固、液物质反应或生成的反应)(15)总物质的量保持不变;(16)总分子数保持不变。
化学平衡状态的判断标志

化学平衡状态的判断标志湖北省巴东县第二高级中学444324 谭贤凤化学平衡状态的判断是化学平衡教学中的难点,为了帮助同学们有效地掌握这方面的知识,笔者对化学平衡的概念深入剖析,总结规律,从不同侧面认识化学平衡,以化解难点,提高对知识的应用能力。
一.剖析概念,把握标志化学平衡状态是指在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
从其概念可知,判断一个可逆反应在一定条件下是否达到平衡状态主要根据两点:一是根据化学平衡状态的本质特征——正反应速率与逆反应速率相等;二是根据化学平衡状态的宏观表现——各组分的浓度保持不变。
二.深入理解,把握规律㈠化学平衡状态的一般标志化学平衡状态的标志可概括为“一等五不变”,现以mA(g)+nB(g)2pC(g)+qD(g)为例,化抽象为具体,提高学生对此标志的理解。
1.一等“一等”即正反应速率等于逆反应速率,其意义是针对反应体系中同一反应物(或生成物)而言的,而不是同一反应中的不同物质。
若用同一反应中不同物质来表示正反应速率和逆反应速率,必须要求两速率反向(切忌单向速率)且两速率之比等于其对应的化学计量数之比。
在试题中可有以下几种具体形式出现:⑴同一物质的正反应速率等于逆反应速率,如υA(消耗)=υA(生成)或υD(消耗)=υD(生成)。
⑵某反应物的正反应速率与另一反应物的逆反应速率之比等于化学计量数之比,如υA(消耗):υB(生成) =m:n,或υC(消耗):υD(生成) =p:q。
⑶某反应物的正反应速率与某生成物的逆反应速率之比等于化学计量数之比,如υA(消耗):υC(消耗) =m:p,或υB(生成):υD(生成) = n:q。
⑷对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
2.五不变“五不变”即反应混合物中各组分的浓度保持不变,其意义是指各组分的物质的量不变;各组分的浓度不变;各组分的百分含量不变;反应物的转化率不变;对于全为气体的可逆反应,当m+n╪p+q 时,混合气体总物质的量不变。
化学平衡状态的判断方法与易错点精析

化学平衡状态的判断方法与易错点精析一、化学平衡状态的判断方法1、抓住可逆反应平衡状态的本质:对达到平衡状态的某一反应体系中的某一物质而言,其参加反应的速率与其生成的速率相等,即v正=v逆,其最直接的表现是该物质在体系中的组分不发生变化。
2、外显的条件都可以根据本质进行分析和判断。
3、技巧:“变量”不变时可以判断反应达到平衡状态,不变量不变不能作为判断依据。
【例】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4s2NH 3 g +CO 2 g 。
判断该分解反应已经达到化学平衡的是()A. 2(NH3)(CO2)B.密闭容器中总压强不变C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变【答案】BC【分析】A 选项:平衡前后各物质反应速率的比值是一个定值,为不变量,且题中给出的比例关系不正确,应为(NH3)2(CO2),不能作为该反应是否达到平衡的依据;B选项:题中反应未达平衡时体系的压强是一个变化量,达到平衡时,气体的量不再发生变化,压强不再发生变化,变量达到不变,可以作为该反应是否达到平衡的判据;=m(气体)C选项:密闭容器中气体密度的计算公式为r V(容器),达到平衡前气体的质量是变量,容器体积不变,因此混合气体的密度是一个变量,变量达到不变,可以作为平衡判据;D 选项:题中体系的初识状态是没有气体,从反应开始发生到平衡状态NH3和CO2的体积比值恒定不变,因此容器中氨气的体积分数是一个不变量,不能作为平衡的判据。
故选 BC。
Tip:有时候整理归纳那么多,不如把握本质,掌握方法来得有效,要的就是以不变应万变!二、化学平衡状态问题易错点1、两种提问方式的混淆①判断某一可逆反应达到平衡的依据;②某一可逆反应达到平衡时具有的特征。
微信公众号:上海试卷平时做练习时遇到①的情况比较多,会习惯用①的思路思考第②类问题。
【例】自然界的矿物、岩石的成因和变化受到许多条件的影响。
化学平衡的标志和判断

化学平衡的标志和判断长乐高级中学 黄炳生化学平衡状态的判断:具体表现为“一等六定”:一等:正逆反应速率相等;六定:① 物质的量一定,② 平衡浓度一定,③ 百分含量保持一定,④ 反应的转化率一定,⑤ 产物的产率一定,⑥ 正反应和逆反应速率一定。
除了上述的“一等六定"外,还可考虑以下几点:①同一物质单位时间内的消耗量与生成量相等。
②不同物质间消耗物质的量与生成物质的量之比符合化学方程式中各物质的化学计量数比。
③在一定的条件下,反应物的转化率最大,或产物的产率最大.④对于有颜色变化的可逆反应,颜色不再改变时。
对于反应前后气体总体积变的可逆反应,还可考虑以下几点:①反应混合物的平均相对分子量不再改变.②反应混合物的密度不再改变。
③反应混合物的压强不再改变。
还可以从化学键的生成和断裂的关系去判断是否处于化学平衡状态。
1、等速标志:指反应体系中用同一种物质来表示的正反应速率和逆反应速率相等。
即 V (正)= V (逆)2、各组分浓度不变标志:因为V (正)= V (逆)≠0,所以在同一瞬间、同一物质的生成量等于消耗量。
总的结果是混合体系中各组成成分的物质的量、质量、物质的量浓度;各成分的体积分数、质量分数;转化率等不随时间变化而改变。
3.有气体参与的可逆反应:(1)从反应混合气体的平均相对分子质量(M )考虑:M=m (总)/n (总) ①若各物质均为气体:当气体△n(g )≠0时,若M 一定时,则标志达平衡.如2SO 2(g )+O 2(g ) 2SO 3(g )当气体△n(g )=0时,若M 为恒值,无法判断是否平衡.如H 2(g )+I 2(g) 2HI (g )②若有非气体参加:无论△n(g)≠0或△n(g)=0时,当若M一定时,则标志达平衡。
如C(s)+O2(g)CO2(g)、CO2(g)+ C(s) 2CO(g)(2)从气体密度考虑:密度=质量/体积①若各物质均为气体:A.恒容:密度总为恒值,不能作为平衡标志.B.恒压:a. △n(g)=0时,密度总为恒值,不能作为平衡标志.b. △n(g)≠0时,密度为一定值,则可作为平衡的标志。
化学平衡状态的判断

1、直接判定: V正=V逆(化学平衡状态的本质)
(1)同一物质:该物质的生成速率等于它的消耗 速率。
(2)不同的物质:不同物质的生成速率和消耗速 率之比等于化学方程式的计量数之比。即一种物 质表示V正,另一物质表示V逆,且数值之比等于计量 数之比。
例1:能说明反应 N2+3H2
(2)反应体系中的总物质的量、总体积、总压强、平 均摩尔质量、混合气体的密度、颜色保持不变时,要 根据具体情况判断是否为平衡状态。
例 2、在一恒容密闭容器中,发生反应:
2S平O衡2+状O2态的是2:SO3下列说法能够证明上述反应已达
√①各物质的物质的量浓度不再改变
②SO2 、O2、SO3的浓度之比为2:1:2
√⑨ CO2在气体中的质量分数
1.下列说法中可以说明反应: P(g)+Q(g) 恒温下已达平衡状态的是( A ) A. P、Q、R、S的浓度不再变化 B .P、Q、R、S的分子数比为1:1:1:1 C.反应容器内P、Q、R、S共存 D.反应容器内总物质的量不随时间而变化
R(g)+S(g)在
2.在一定温度下的恒容容器中,当下列物理量不再发生
√ √ ③ SO2的转化率不再改变 ④ SO3的体积分数不再改变
⑤混合物的总质量不再改变
√⑥混合气体的密度不再改变 ⑦混合物的颜色不再改变 √⑧混合物的平均摩尔质量不再改变 √⑨绝热容器中反应体系的温度不再改变 √⑩恒温容器中混合气体的压强一定
例 3、在一恒容密闭容器中,发生反应:
H2(g)+I2 (g) 2HI(g) 证明该反应已达到平衡状态的 是: ①③⑨
H2(g)+CO2(g)
以下说法能判断上述哪些反应达到了平衡状态(用序 号填空)
化学平衡条件与推断方法

化学平衡条件与推断方法化学平衡条件是指在一个封闭的化学系统中,正反两个化学反应的速率相等时,系统达到动态平衡的状态。
这个平衡状态可以用化学平衡常数(K)来描述。
平衡常数是一个表征反应进行程度的物理量,它与反应物和生成物的浓度有关。
对于一个化学反应:[ aA + bB cC + dD ]平衡常数K可以表示为:[ K = ]其中,[ [X] ] 表示物质X的摩尔浓度。
化学平衡的推断方法主要包括:1.浓度变化法:通过改变系统中某一物质的浓度,观察其他物质浓度的变化,从而推断平衡的位置。
2.压力变化法:对于有气体参与的反应,改变系统的压强,观察平衡如何移动,从而推断平衡的位置。
3.温度变化法:改变系统的温度,观察反应速率和平衡位置的变化,从而推断平衡的状态。
4.化学势法:根据物质的标准化学势,利用吉布斯自由能公式,计算系统的吉布斯自由能变化,从而推断平衡的位置。
以上是化学平衡条件与推断方法的基本知识点,希望对你有所帮助。
习题及方法:已知反应 ( 2H_2(g) + O_2(g) 2H_2O(l) ) 的平衡常数Kc为1.0×10^(-2),若起始时 ( [H_2] = 0.4 ) mol/L,( [O_2] = 0.3 ) mol/L,求平衡时各物质的浓度。
首先,根据平衡常数表达式计算出平衡时的水浓度,然后根据水浓度计算氢气和氧气的新浓度。
1.设平衡时 ( [H_2O] = x ) mol/L,则 ( [H_2] = 0.4 - 2x ) mol/L,( [O_2]= 0.3 - x ) mol/L。
2.代入平衡常数表达式得:( Kc = = 1.0 10^{-2} )。
3.解方程得 ( x = 0.1 ) mol/L。
4.平衡时 ( [H_2] = 0.2 ) mol/L,( [O_2] = 0.2 ) mol/L,( [H_2O] = 0.1 )mol/L。
在一定温度下,将 ( 0.1 ) mol ( CO_2 ) 和 ( 0.1 ) mol ( H_2O ) 通入一密闭容器中,发生反应 ( CO_2(g) + H_2O(g) CO(g) + OH(g) ),若容器中 ( p(CO_2) = 0.05 ) bar,( p(H_2O) = 0.05 ) bar,( p(CO) = 0.02 ) bar,( p(OH) = 0.03 ) bar,求该反应的平衡常数Kp。
判定化学平衡状态的方法

化学平衡状态的判定方法主要有以下几种:
1. 浓度法:当反应体系中各物质的浓度不再随时间改变时,说明反应达到了平衡状态。
2. 压力法:对于气相反应,当反应体系中各气体的分压不再随时间改变时,说明反应达到了平衡状态。
3. 体积法:对于有气体参与的反应,当反应体系的体积不再随时间改变时,说明反应达到了平衡状态。
4. 质量法:当反应体系的总质量不再随时间改变时,说明反应达到了平衡状态。
5. 活度法:当反应体系中各物质的活度不再随时间改变时,说明反应达到了平衡状态。
6. 平衡常数法:当反应的平衡常数不再随时间改变时,说明反应达到了平衡状态。
以上方法在实际应用中需要根据具体的反应体系和实验条件进行选择。
化学平衡状态的判断
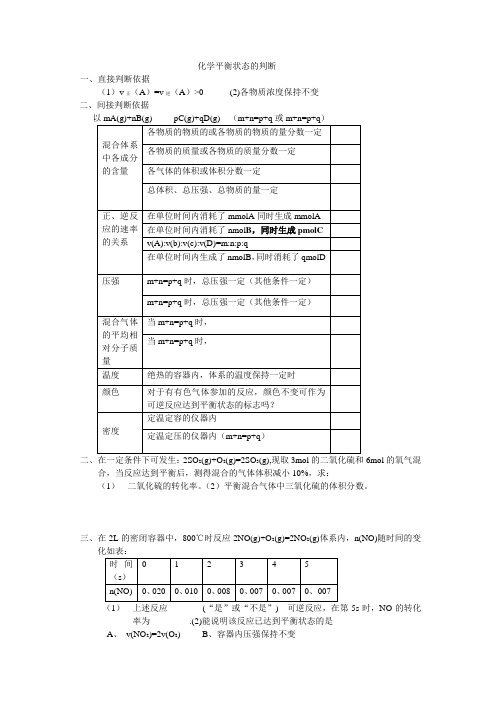
化学平衡状态的判断一、直接判断依据(1)v正(A)=v逆(A)>0 (2)各物质浓度保持不变二、间接判断依据二、在一定条件下可发生:2SO2(g)+O2(g)=2SO3(g),现取3mol的二氧化硫和6mol的氧气混合,当反应达到平衡后,测得混合的气体体积减小10%,求:(1)二氧化硫的转化率。
(2)平衡混合气体中三氧化硫的体积分数。
三、在2L的密闭容器中,800℃时反应2NO(g)+O2(g)=2NO2(g)体系内,n(NO)随时间的变化如表:(1)上述反应________(“是”或“不是”) 可逆反应,在第5s时,NO的转化率为_________.(2)能说明该反应已达到平衡状态的是A、v(NO2)=2v(O2)B、容器内压强保持不变C、v逆(NO)=2v正(O2)D、容器内密度保持不变四、一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)=2C(g)达到平衡标志的是①C 的生成速率与C的消耗速率相等②单位时间内生成a molA,同时生成3 molB③A、B、C的浓度不再变化④C的物质的量不再发生变化⑤混合气体的总压强不再发生变化⑥混合气体的总物质的量不再变化⑦单位时间消耗a molA,同时生成3a molB⑧A、B、C的分子数之比为1:3:2A、②⑧B、④⑦C、①③D、⑤⑥五、在密闭的容器中进行反应:X2(g)+Y2(g)=2Z(g),已知X2、Y2、Z的起始浓度为0.1 mol/L,0.3mol/L,0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是A、Z为0.3mol/L B、Y2为0.4mol/LC、X2为0.2mol/LD、Z为0.4mol/L六、可逆反应:2NO2(g)= 2NO(g)+O2(g),在体积固定的密闭容器内进行,达到平衡状态的标志是:①单位时间内生成n mol的氧气的同时生成2n molNO2②单位时间内生成n mol的氧气的同时生成2n molNO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态七、下列说法可以证明H2(g)+I2(g)= 2HI(g)已达到平衡状态的是_________________(填序号) ①单位时间内生成n molH2的同时,生成n mol的HI②一个H-H键断裂的同时有两个H-I键断裂③百分含量HI%=I2%④反应速率v(H2)=v(I2)=1/2HI(g)⑤c(HI):c(H2):c(I2)=2:1:1⑥温度和体积一定时,某一生成物浓度不再变化⑦温度和体积一定时,容器内压强不再发生变化⑧条件一定,混合气体的平均相对分子质量不再发生变化⑨温度和体积一定时,混合气体颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化八、在一恒温、恒容的密闭容器中发生反应:A(s)+2B(g)= C(g)+D(g),当下列物理量不再发生变化时,能够表明该反应已达到平衡状态的是A、混合气体的压强B、混合气体的平均相对分子质量C、A的物质的量浓度D、气体的总的物质的量稀有气体对化学反应速率的景响定温定容下,向合成氨气的反应中充入稀有气体---------反应的速率___________定温定压下,向合成氨气的反应体系中充入稀有气体------反应的速率___________化学反应的限度任何可逆反应都有一定的限度。
怎么判断是否达到化学平衡状态

解答化学平衡和速率的方法在遇到关于化学平衡和速率问题时,首先分析清楚习题的疑问是关于化学反应速率的,还是关于化学平衡的。
如果是有关反应速率的问题,始终把握如下几点理论1、温度升高时,反应速率增大,在此时对于可逆反应来说,正反应速率和逆反应速率都增大,而且正反应速率和逆反应速率增大的幅度一定不同,正向为放热反应,则逆反应速率增大幅度大一些。
2、增大反应物的浓度,增反应速率增大,在刚加入反应物的那一时刻,逆反应速率和加入前相同,过了那一个时刻,逆反应速率也增大;另外若所加物质为固体或纯液体时,正逆反应速率都不变。
除此外,增大一种反应物的浓度,其自身的转化率降低,其它反应物的转化率都增大。
3、增大压强时,若不能使反应物和生成物浓度发生改变,则正逆反应速率都不变,如向体系内加入惰性气体时,容器体积不变的情况。
4、增大压强时,若能使反应物和生成物浓度发生改变,反应速率增大。
在此时对于可逆反应来说,正反应速率和逆反应速率都增大,正反应速率和逆反应速率增大的幅度可能相同也可能不同,反应物中气体的计量数大于生成物中气体的计量数时,则正反应速率增大幅度大一些。
5、催化剂对可逆反应来说,正反应速率和逆反应速率都增大,正反应速率和逆反应速率增大的幅度一定相同。
如果是化学平衡类的问题,首先注意体系为恒容容器还是恒压容器,然后要分析清楚是化学平衡中的哪一类型的问题,不同的类型要用不同的解题方法分析,在化学平衡类的习题中包含的类型主要有如下五种:1、判断某状态时是否为平衡状态,这类问题主要会从以下几个方面提出,每个方面都要把握其原理和本质。
(1)、所有物质的浓度或物质的量都保持不变时,达到了平衡状态。
(2)、正逆反应速率相等时,达到平衡状态。
但是这种问题中一定要注意,必须是同一种物质的生成速率等于其消耗速率,或同一种物质的化学键断裂速率等于其化学键的生成速率。
若选项中指的不是同一种物质,要根据不同物质的反应速率之比等于它们的计量数之比进行转化。
化学平衡状态的判断
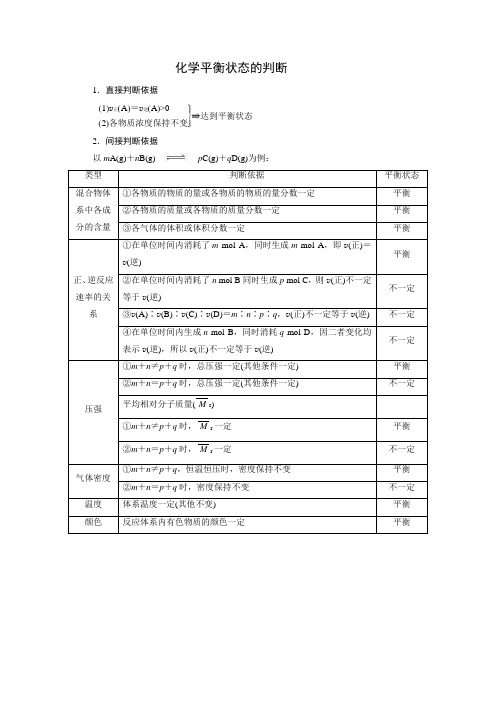
化学平衡状态的判断
1.直接判断依据
⎭
⎪⎬⎪
⎫(1)v 正(A )=v 逆(A )>0
(2)各物质浓度保持不变⇒达到平衡状态
2.间接判断依据 以m A(g)+n
B(g)p C(g)+q D(g)为例:
[例1](2012·山东高考节选)对于反应N
O4(g)2NO2(g)ΔH>0,将1 mol N2O4充
2
入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
1.可逆反应N2(g)+3H2(g)2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。
下列各关系中能说明反应已达到平衡状态的是()
A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
2.在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+
H2O(g)CO(g)+H2(g),不能确定上述可逆反应在一定条件下已达到化学平衡状态的是()
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键。
化学反应平衡的判断

学术研讨Academic research■ 陈宇恒化学反应平衡的判断摘要:本文主要以恒温恒容和恒温恒压两大方面探讨了高中化学反应平衡的判断方法,并以此作为依据,分别展开了例题讨论。
以期为广大学生提高解题效率提供一些参考和意见。
关键词:高中化学;反应平衡;判断方法判断化学平衡的方法具有多样性,所有方法的展开断基础是“等效平衡法”。
等效法是指在两种或者多种反应物质在平衡状态下,利用平衡原理相关知识点对反应物或者生成物进行化学平衡判断的探讨。
1恒温、恒压条件下的判断在恒温、恒压条件下,判断物质的反应是否可以达到平衡或者等效状态,可以从反应物物质的量改变和分子数不变两方面入手。
第一,起始阶段。
在恒温、恒压条件下,无论是化学反应平衡还是方程式系数和的相等,并不是完全等效平衡的有效条件。
在反应物的起始阶段,假设反应物物质量不对等,基于化学方程式系数与基于一半物质量的比例仍然与原平衡一样,则表示这是一种等效平衡行为。
[1]例如,在温度保持恒温的状态下,封闭容器中发生的反应方程式:AX (g)=BY(g)+CZ(g)。
在这一反应达到一个平衡状态时,在温度不改变的情况下将容器容积压缩至一半。
容器容积压缩之后,无论是压强还是体积,都会变小,其反应也会达到一个新的平衡。
最后测得物质Y和Z的浓度均为原来的1.8倍。
下列表述中,正确的是()。
A.可逆系数为:a>b+cB.v正增大和v逆减小是容器体积变化后会出现的两种情况C.容器容积压缩后,当反应达到一个新平衡状态时,X的转化率会逐渐降低D.物质的质量分数与容器内反应物的平衡状态息息相关。
在新的平衡状态下,物质质量分数会随着容器体积的变化而逐渐增加。
根据题目中的已知条件可以得知,由于分层系数形式较为抽象化。
因此解答这题的关键点在于熟悉和了解化学平衡的极限等效法,并以此作为解题的基础。
首先,化学反应平衡在容器压缩之后会发生移动。
假设在容器压缩过程中没有平衡的移动时,物质的浓度也会增加至两倍。
化学平衡状态的判断方法有哪些

化学平衡状态的判断⽅法有哪些
在⼀定条件下,当⼀个可逆反应的正反应速率与逆反应速率相等时,反应物的浓度与⽣成物的浓度不再改变,达到⼀种表⾯静⽌的状态,即"化学平衡状态"。
如何判断化学反应达到平衡
1.同⼀物质的⽣成速率和分解速率相等
2.反应体系中各物质的物质的量或者浓度,百分含量,体积分数,质量分数,物质的量分数不再改变
3.同⼀物种化学键的断裂和形成数⽬相等
4.有⽓体参加反应,当反应前后⽓体总体积不等的时候,⽓体的平均相对分⼦质量,密度,压强不变
5.若反应为绝热体系,反应体系温度⼀定
6.转化率相同
7.若反应有颜⾊的改变,则颜⾊不变时平衡。
化学平衡状态的特点
化学平衡状态具有逆,等,动,定,变、同六⼤特征。
逆:化学平衡研究的对象是可逆反应。
等:平衡时,正、逆反应速率相等,即v正=v逆。
动:平衡时,反应仍在进⾏,是动态平衡,反应进⾏到了最⼤限度。
定:达到平衡状态时,反应混合物中各组分的浓度保持不变,反应速率保持不变,反应物的转化率保持不变,各组分的含量保持不变。
变:化学平衡跟所有的动态平衡⼀样,是有条件的,暂时的,相对的,当条件发⽣变化时,平衡状态就会被破坏,由平衡变为不平衡,再在新的条件下建⽴新平衡,即化学平衡发⽣了移动。
同:⼀定条件下化学平衡状态的建⽴与反应的途径⽆关。
即⽆论是从正反应开始,还是从逆反应开始,或是从任⼀中间状态开始建⽴,只要外界条件相同,达到平衡时的效果都相同。
专题——化学平衡状态的判断

1专题——化学平衡状态的判断一、考点分析 化学平衡是高考的热点,化学平衡状态的判断是化学平衡的考点之一,在历年的高考试题中屡有出现。
难度系数在0.50~0.55左右。
二、考查方向1、主要以选择题的形式考查。
2、主要从浓度、速率、压强、密度、颜色、温度、平均摩尔质量等角度考查。
三、解题指导思想1、细心审题,注意关键字词,留心陷阱。
2、运用公式并注意状态与系数。
四、判断方法(大部分资料都介绍以下方法)(一)、判断化学平衡状态的标志1、什么是化学平衡状态 : 化学平衡状态是指一定条件下的可逆反应里,正反应速率=逆反应速率,反应混合物中各组分的含量保持不变的状态。
2、平衡状态的判断方法 :直接判定: V 正=V 逆 >0①同一物质,该物质的生成速率等于它的消耗速率。
②不同的物质分两种情况:在方程式同一侧的不同物质,它们的生成速率与消耗速率之比(或消耗速率与生成速率之比,前后比较项必须相反)等于反应方程式中化学计量数之比;方程式不同侧的物质,它们的生成速率与生成速率之比(或消耗速率与消耗速率之比,前后比较项必须相同)等于反应方程式中化学计量数之比。
③从微观化学键的断裂与生成判断。
如N 2(g )+3H 2(g )== 2NH 3(g )化学键 N ≡N 3H-H 6 N-H同种物质,新键生成和旧键断裂数目相同同侧不同物质,生成与断裂(或断裂与生成)数目;不同侧物质,生成与生成(断裂与断裂)数目例1、N 2(g )+3H 2(g )== 2NH 3(g )的生成或消耗速度来表示下列各关系中能说明反应已达平衡状态的是( )A. 3V (N 2消耗)=V (H 2消耗)B. V (N 2生成)=V (N 2消耗)C. 2V (H 2消耗)=3V (NH 3消耗)D. 2V (N 2生成)=V (NH 3消耗)例2、可逆反应2NO 2(g)= 2NO(g) + O 2(g),在体积固定的密闭容器中,达到平衡状态的( )A 单位时间内生成n mol O 2的同时生成2n mol NO 2B 单位时间内生成n mol O 2的同时生成2n mol NOC 单位时间内生成n mol NO 2的同时消耗n mol NO 2D 用NO 2、NO 、O 2表示的反应速率的比为2 : 2 : 1的状态例3、4NH 3(g) + 5O 2(g)==4NO(g) + 6H 2O(g)( ) A 4v 正(O 2)=5v 逆(NO) B x mol NO 的同时消耗x mol NH3 C ,则正反应速率减小,逆反应速率增大 D 2v 正(NH 3)=3v 正(H 2O)例3、下列方法中可以说明N 2+3H 2 = 2NH 3已达到平衡的是( ) A N ≡N 键断裂的同时有三个H-H 键形成 B N ≡N 键断裂的同时有三个H-H 键断裂 C N ≡N 键断裂的同时有六个N-H 键断裂 D N ≡N 键断裂的同时有六个N-H 键形成间接判定①组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度保持不变。
判断化学反应达到平衡状态的标志

判断化学反应达到平衡状态的标志1、任何情况下均可作为标志的:(1)v正=v逆(同一种物质)(2)各组分含量(百分含量、物质的量、质量)不随时间变化(3)某反应物的消耗(生成)速率:某生成物的消耗(生成)速率=化学计量数之比2、在一定条件下可作为标志的:(1)对于有色物质参加或生成的可逆反应体系,颜色不再变化。
(2)对于有气态物质参加或生成的可逆反应体系,若反应前后气体的物质的量变化不为0,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
(3)对于恒容绝热体系,体系的温度不再变化。
3、不能作为判断标志的:(1)各物质的物质的量或浓度变化或反应速率之比=化学计量数之比(任何情况下均适用)(2)对于全气体的反应,若反应前后气体的体积无变化,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
[例题与解析]例1、下列方法中可以证明2HI(g)=H2(g)+I2(g)已达平衡状态的是()①单位时间内生成n mol H2的同时生成n mol HI②一个H—H键断裂的同时有两个H—I键断裂③百分组成HI%=I2%④反应速率v (H2)=v (I2)=0.5 v (HI)时⑤C (HI)=C (H2)=C (I2)=2∶1∶1⑥温度和体积一定时,某一生成物浓度不再变化⑦温度和体积一定时,容器内压强不再变化⑧条件一定,混合气体的平均相对分子质量不再变化⑨温度和体积一定时混合气体的颜色不再变化⑩温度和压强一定时混合气体密度不再变化分析:这是一个反应前后气体体积没有变化的反应①表示不同方向的反应,但生成H2与生成HI的物质的量之比应等相应化学计量数之比;②表示不同方向的反应且等于化学计量数之比,正确;③毫无根据,只在极特殊情况下成立;④任何情况下均成立;⑤平衡状态时浓度之比不一定等于化学计量数之比;⑥浓度不变,说明已达平衡,正确;⑦此反应前后气体体积不变,恒温恒容条件下任何时候容器内压强均不变;⑧此反应前后气体物质的量不变,总质量不变条件下任何时候气体平均相对分子质量均不变;⑨颜色不变说明浓度不变,正确;⑩此反应前后气体物质的量不变,恒温恒压条件下体积不变,任何时候气体密度均不变。
化学平衡判断方法

化学平衡状态的判断方法1、对于可逆反应中的任意一个(或多个)组份,物质的量、质量、浓度(g、aq)、百分含量、体积(g)、体积分数(g)等保持不变时,能判断已达平衡练习(填“能”或“不能”)(1)密闭容器中,N2(g)+3H2(g) 2NH3(g),N2浓度不再变化时,判断已达平衡(2)密闭容器中,2NO22NO+O2,各组份体积分数保持恒定时,判断已达平衡(3)密闭容器中,3Fe(s)+4 H2O(g) Fe3O4(s)+4 H2(g),Fe的质量不随时间变化时,判断已达平衡(4)密闭容器中,I2(g)+H2(g) 2HI(g),I2%、H2%、HI%保持不变时,判断已达平衡2、常见的可逆反应均有气体参加或生成,首先观察方程式反应前后气体系数之和是否相等,因为系数决定了物质的量、体积以及压强①若相等,则“总压强、总物质的量、总体积不变”,均不能判断已达到平衡(系数相等时,以上各量始终不变)②若不相等,则“总压强、总物质的量、总体积不变”,能判断已达平衡③对于全部是气体的反应,气体系数之和相等时,混合气体的平均摩尔质量M r不变,不能判断已达平衡(因为M r=m气/n气,m始终不变,系数相等时,n也始终不变,所以M r始终不变);气体系数之和不相等时,混合气体的平均摩尔质量M r不变,能判断已达平衡(因为M r=m气/n气,m 始终不变,而n一直变化,M r不变时,表明n不变,物质的量不变即平衡)④对于有固体(s)或液体(L)的反应,只要混合气体的平均摩尔质量M r不变,能判断已达平衡(与系数之和无关,因为有固体或液体时,m气会发生变化,M r不变时,表明m气不变,质量不变即平衡)练习(填“能”或“不能”)(1)密闭容器中,N2(g)+3H2(g) 2NH3(g)总压强、总物质的量、总体积、混合物的平均质量不变,判断已达平衡(2)密闭容器中,I2(g)+H2(g) 2HI(g)总压强、总物质的量、总体积、混合物的平均质量不变,判断已达平衡3、对于“混合气体密度不变”,应区分以下几种情况:①反应物及产物全部是气体(g)i.密闭容器(即容积不变),“密度不变”不能判断已达平衡(因为m和V始终不变,密度不改变)ii.容积可变的容器,看反应前后气体系数之和是否相等a. 若相等,则“密度不变”不能判断已达平衡(因为m和V始终不变,密度不改变)b. 若不相等,则“密度不变”能判断已达平衡②反应物及产物中有非气体物质(固体S,液体L等),“密度不变”能判断已达平衡(与气体系数之和无关)练习(填“能”或“不能”)(1)密闭容器中,N(g)+3H2(g) 2NH3(g) ,混合气体密度不变,判断已达平衡(g)+H2(g) 2HI(g),混合气体密度不变,判断已达平衡(2)密闭容器中,I(3)容积可变的容器,N(g)+3H2(g) 2NH3(g) ,混合气体密度不变,判断已达平衡(g)+H2(g) 2HI(g),混合气体密度不变,判断已达平衡(4)容积可变的容器中,IO(g) CO(g)+H2(g) ,混合气体密度不变,判断已达平衡(5)对于C(S)+H(6)对于3Fe(s)+4 HO(g) Fe3O4(s)+4 H2(g) ,混合气体密度不变,判断已达平衡4、出现“浓度之比、分子数之比、物质的量之比、体积之比、速率之比”等字样,均不能判断已达平衡;“消耗(分解)速率之比、生成速率之比、”等,能判断已达到平衡【比值等于其系数之比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.对可逆反应 4NH3(g) + 5O2 (g) 4NO(g) + 6H2O(g),
下列叙述正确的是 A
A.达到化学平衡时,4v正(O2)= 5v逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速 率减少,逆反应速率增大
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体积压强不再改变
⑤NH3%、N2%、H2%都不再改变 ⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/L·min,逆反应速
率v(NH3)=0.4mol/L·min
A. 全部
B. 只有①③④⑤
C. ②③④⑤⑦
D. 只有①③⑤⑥⑦
D.化学反应速率关系是:2v正(NH3)= 3v正(H2O)
4.已知N2O4(g)
2NO2(g) ΔH>0,现将
1 mol N2O4充入一恒压密闭容器中,下列示意
图正确且能说明反应达到平衡状态的____a_d。
解析 b项,对于一个特定反应,ΔH固定不变,不能作为判断反应是否达 到平衡状态的依据;c项,随着反应的进行,N2O4分解速率逐渐降低。
1、理解化学平衡建立的过程; 2、掌握化学平衡状态的判断;
华美高三化学备课组 张亮鹏
第11周星期三
【判断】 回顾可逆反应的定义,判断下列说 法是否正确:
1. 氢气在氧气中燃烧生成水,水在电解时生成 氢气和氧气,2H2+ O2 = 2H2O是可逆反应。
2. 硫酸铜晶体加热变成白色粉末,冷却又变成 蓝色,所以无水硫酸铜结合结晶水的反应是 可逆反应。
高考第一轮复习
第二节 化学平衡状态及其平衡常数
第2课时 化学平衡常数
华美高三化学备课组 张亮鹏
第11周星期六
2013年 第31题
2011年 第31题
高考引路
教学目标: 1、掌握平衡常数表达式的书写; 2、掌握“三行式”解决平衡常数的相关计算
考点二 化学平衡常数
状元360第144页
1.概念 在一定温度下,可逆反应达到平衡后,各生成物浓度化学计量数 次方幂的乘积与各反应物浓度化学计量数次方幂的乘积的比值,
为一常数,该值就称为这个反应的平衡常数,用K表示。
以mA(g)+nB(g)
pC(g)+qD(g)为例
2.表达式:K=_______________。
注意事项:(1)反应物或生成物中有固体和液态水存在时,由于其 浓度可看做“常数”而不代入公式。 (2)化学平衡常数是指某一具体反应方程式的平衡常数。若反应方 向改变,则平衡常数__改__变______。若方程式中各物质的化学计量 数等倍扩大或缩小,尽管是同一反应,平衡常数也会 ____改__变_____,但意义不变。
【当堂训练】
5 .(双选)密闭容器中发生可逆反应:
X2(g)+ Y2(g)
2 Z(g)。已知起始
时X2、 Y2、 Z各物质的浓度分别为0.1mol/L 、
0.3mol/L、0.2mol/L,反应在一定条件下达到
平衡时,各物质的物质的量浓度可能是(AB)
A、c(Z)=0.3mol/L B、c(Y2)=0.35mol/L C、 c(Y2)=0.2mol/L D、 c(Z)=0.4mol/L
2C (g) +D (g)
已经达到平衡状态 的是( BC )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
2. 可以证明可逆反应N2+3H2
2NH3已达到平
衡状态的是:( C )
①一个N≡N键断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
√DE..单NO位2、时N间2O内4生的成分1子m数o之l N比2O为4的2∶同1时生成2 mol NO2
F.混合气体的密度不再随时间而变化
√G.NO2的浓度不再随时间而变化
面对面 P116表格
【当堂训练】
1.在一定温度下的恒容容器中,当下列物理
量不再发生变化时,表明反应:
A(s)+3B (g)
高考第一轮复习
第二节 化学平衡状态及其平衡常数
点面导图
考向分析
本节高考重点考查: (1)化学平衡的建立、特征 和实质; (2)化学平衡常数的含义和 应用; (3)化学平衡的计算; (4)化学平衡移动与图像。
高考第一轮复习
第二节 化学平衡状态及其平衡常数 第1课时 化学平衡状态的建立和判断 教学目标
3. 氯化铵加热变成氨气和氯化氢气体,两种气 体又自发变成氯化铵,氯化铵的分解是可逆 反应。反应
正反应
同时
<
2.化学平衡状态—化学反应的限度
N2+3H2
催化剂 高温高压
2NH3
速
率 V(正)
V(逆)
平衡状态 时间
t1 V~t图
(1)0~t1:v(正)>v(逆)
状元360第144页
写出下表中各反应的平衡常数的表达式。
反应
K
(1)C(s)+CO2(g) 2CO(g)
考点一:化学平衡状态的判定
例1、(2012·广东质检题组合)在一定温度下向a L密闭容
器中加入1 mol NO2(g)发生2NO2(g) 应达到平衡的标志是________。
N2O4(g),此反
√AB..容v(N器O的2)总正=压v强(N不2O再4)随逆 时间而变化 √C.容器中气体的颜色不再变化
(2)t1:v(正)=v(逆)
由于v(正)= v(逆) ≠0,虽然正、逆反应都在同时进行,但各种 物质浓度都不会发生变化.
从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是化学平衡状态。
3、平衡状态的特征
动态
浓度 外观看起来像停止了一样,所有的量都不在改变。
发生移动
考点一:化学平衡状态的判定 本质:1、 v(正)= v(逆) ≠0 2、各组分的量保持不变
考点二、极端假设法解化学平衡状态题的应用
例2、在一密闭容器中进行如下反应: 2SO2(g)+O2(g) 2SO3(g),已知反应 过程中某一时刻SO2、O2、SO3的浓度分别为 0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡
时,可能存在的数据是( B )
A、SO2为0.4mol/L、O2为0.2mol/L B、 SO2为0.25mol/L C、 SO2、SO3均为0.15mol/L D 、SO3为0.4mol/L
