化工原理下册公式
化工原理公式及各个章节总结汇总

第一章 流体流动与输送机械1. 流体静力学基本方程:gh p p ρ+=022. 双液位U 型压差计的指示: )21(21ρρ-=-Rg p p )3. 伯努力方程:ρρ222212112121p u g z p u g z ++=++4. 实际流体机械能衡算方程:f W p u g z p u g z ∑+++=++ρρ222212112121+ 5. 雷诺数:μρdu =Re6. 范宁公式:ρρμλfp d lu u d l Wf ∆==⋅⋅=22322 7. 哈根-泊谡叶方程:232d lup f μ=∆ 8. 局部阻力计算:流道突然扩大:2211⎪⎭⎫ ⎝⎛-=A A ξ流产突然缩小:⎪⎭⎫ ⎝⎛-=2115.0A A ξ第二章 非均相物系分离1. 恒压过滤方程:t KA V V V e 222=+令A V q /=,A Ve q e /=则此方程为:kt q q q e =+22第三章 传热1. 傅立叶定律:n t dAdQ ϑϑλ-=,dxdt A Q λ-= 2. 热导率与温度的线性关系:)1(0t αλλ+= 3. 单层壁的定态热导率:bt t AQ 21-=λ,或mA b tQ λ∆=4. 单层圆筒壁的定态热传导方程: )ln1(21221r r t t l Q λπ-=或m A b tt Q λ21-=5. 单层圆筒壁内的温度分布方程:C r l Qt +-=ln 2λπ(由公式4推导)6. 三层圆筒壁定态热传导方程:34123212141ln 1ln 1ln 1(2r r r r r r t t l Q λλλπ++-=7. 牛顿冷却定律:)(t t A Q w -=α,)(T T A Q w -=α8. 努塞尔数λαl Nu =普朗克数λμCp =Pr 格拉晓夫数223μρβtl g Gr ∆= 9. 流体在圆形管内做强制对流:10000Re >,1600Pr 6.0<<,50/>d lk Nu Pr Re 023.08.0=,或kCp du d ⎪⎭⎫⎝⎛⎪⎪⎭⎫ ⎝⎛=λμμρλα8.0023.0,其中当加热时,k=,冷却时k= 10. 热平衡方程:)()]([1222211t t c q T T c r q Q p m s p m -=-+=无相变时:)()(12222111t t c q T T c q Q p m p m -=-=,若为饱和蒸气冷凝:)(12221t t c q r q Q p m m -== 11. 总传热系数:21211111d d d d b K m ⋅+⋅+=αλα 12. 考虑热阻的总传热系数方程:212121211111d d R R d d d d b K s s m ⋅++⋅+⋅+=αλα 13. 总传热速率方程:t KA Q ∆=14. 两流体在换热器中逆流不发生相变的计算方程:⎪⎪⎭⎫⎝⎛-=--22111112211lnp m p m p m c q c q c q KA t T t T 15. 两流体在换热器中并流不发生相变的计算方程:⎪⎪⎭⎫ ⎝⎛+=--22111122111lnp m p m p m c q c q c q KA t T t T 16. 两流体在换热器中以饱和蒸气加热冷流体的计算方程:2221ln p m c q KAt T t T =--第四章 蒸发1. 蒸发水量的计算:110)(Lx x W F Fx =-=2. 水的蒸发量:)1(1x x F W -= 3. 完成时的溶液浓度:WF F x -=4. 单位蒸气消耗量:rr D W '=,此时原料液由预热器加热至沸点后进料,且不计热损失,r 为加热时的蒸气汽化潜热r ’为二次蒸气的汽化潜热5. 传热面积:mt K QA ∆=,对加热室作热量衡算,求得Dr h H D Q c =-=)(,1t T t -=∆,T 为加热蒸气的温度,t 1为操作条件下的溶液沸点。
化工原理公式

化工原理公式
1. 质量守恒公式:
在化学反应中,质量守恒是一个基本的原理。
它可以用如下公式表示:
质量物质的总量 = 当前的质量物质的总量 + 生成的物质的质量 - 消失的物质的质量
2. 摩尔质量计算公式:
摩尔质量是指一个物质的摩尔质量与其质量之间的关系。
它可以用如下公式表示:
摩尔质量 = 质量 / 物质的摩尔数
3. 反应物比例公式:
反应物比例可以通过计算摩尔比来确定。
反应物比例为生成物比例的化学计量关系。
它可以用如下公式表示:
摩尔比 = 摩尔数 / 最小摩尔数
4. 摩尔分数公式:
摩尔分数是指一个化合物在混合物中所占的比例。
它可以用如下公式表示:
摩尔分数 = 摩尔数 / 总摩尔数
5. 离子浓度公式:
离子浓度可以用来描述溶液中离子的浓度。
它可以用如下公式表示:
离子浓度 = 离子的摩尔数 / 溶液的体积
请注意,这些公式仅为化工原理中的一部分,还有很多其他的公式和原理没有包括在内。
同时,这些公式可能会依赖于具体的实验条件和问题的要求,因此在使用时需谨慎。
化工原理公式总结

化工原理公式总结
化工原理公式总结如下:
1. 质量平衡公式:
输入质量 = 输出质量 + 累积质量
2. 物质平衡公式:
输入组分质量流率 = 输出组分质量流率 + 生成/消耗组分质量流率 + 储存组分质量流率
3. 能量平衡公式:
输入能量 = 输出能量 + 生成/消耗能量 + 储存能量
4. 平均温度计算公式:
平均温度= ∫(T*dA) / ∫dA,其中 T 为温度,dA 为面积微元
5. 理想气体状态方程:
PV = nRT,其中 P 为压力,V 为容积,n 为物质的摩尔数,R 为气体常数,T 为温度
6. 液体体积膨胀公式:
V2 = V1 * (1 + β * ΔT),其中 V1 为初始体积,V2 为最终体积,β 为膨胀系数,ΔT 为温度变化
7. 理想混合气体摩尔分数公式:
Xi = ni / n,其中 Xi 表示组分 i 的摩尔分数,ni 表示组分 i 的摩尔数,n 表示总摩尔数
8. 溶液浓度计算公式:
质量分数 = 溶质质量 / 总溶液质量
摩尔分数 = 溶质摩尔数 / 总溶液摩尔数
体积分数 = 溶质体积 / 总溶液体积
9. 反应速率公式:
反应速率 = k * [A]^m * [B]^n,其中 k 为速率常数,[A] 和[B] 表示反应物 A 和 B 的浓度,m 和 n 为反应级数
10. 溶解度公式(亨利定律):
P = K * C,其中 P 为气体的分压,K 为溶解度常数,C 为溶质的浓度。
化工原理公式

化工原理公式化工原理是化学工程专业的基础课程之一,它涉及到化工过程中的物质平衡、能量平衡、动量平衡等方面的知识。
在化工原理的学习过程中,掌握相关的公式是非常重要的。
本文将介绍化工原理中常用的公式,帮助大家更好地理解和应用化工原理的知识。
1. 物质平衡公式。
在化工过程中,物质平衡是非常重要的,它描述了物质在化工过程中的流动和转化情况。
物质平衡公式可以用来描述化工过程中物质的输入、输出和转化关系,通常表示为:输入物质 = 输出物质 + 产生物质消耗物质。
这个公式可以帮助工程师分析化工过程中物质的流动情况,从而优化生产过程,提高生产效率。
2. 能量平衡公式。
能量平衡是化工过程中另一个重要的方面,它描述了能量在化工过程中的转化和传递情况。
能量平衡公式可以用来描述化工过程中能量的输入、输出和转化关系,通常表示为:输入能量 = 输出能量 + 产生能量消耗能量。
这个公式可以帮助工程师分析化工过程中能量的流动情况,从而设计和优化能源利用系统,提高能源利用效率。
3. 动量平衡公式。
在一些流体力学的化工过程中,动量平衡也是非常重要的。
动量平衡公式可以用来描述流体在化工过程中的流动情况,通常表示为:输入动量 = 输出动量 + 产生动量消耗动量。
这个公式可以帮助工程师分析化工过程中流体的流动情况,从而设计和优化管道系统,提高流体传输效率。
除了以上提到的物质平衡、能量平衡和动量平衡公式外,化工原理中还涉及到许多其他重要的公式,如反应速率公式、传质公式、传热公式等。
这些公式在化工工程中都有着重要的应用,工程师们需要深入理解这些公式,并灵活运用于实际工程中。
总之,化工原理中的公式是化工工程师们设计、优化和控制化工过程的重要工具,掌握这些公式对于工程师们来说是非常重要的。
希望本文介绍的化工原理公式能够帮助大家更好地理解和应用化工原理的知识,为化工工程的发展贡献自己的力量。
通过以上对化工原理公式的介绍,相信大家对化工原理中的公式有了更深入的了解。
化工原理公式总结

化工原理公式总结化工是一门应用科学,它的发展离不开理论的支持。
理论的核心之一就是化工原理公式。
化工原理公式是化工领域常用的数学表达式,通过这些公式,我们可以计算化工过程中涉及的各种物理和化学参数,从而指导化工实践。
在这篇文章中,我将对一些常用的化工原理公式进行总结,以帮助读者更好地理解和运用这些公式。
一、质量守恒公式质量守恒是化工过程设计和运行的基本原则之一。
质量守恒公式描述了化工系统中物质质量的变化情况。
在闭合系统中,质量守恒公式可以表示为:输入质量 = 输出质量 + 反应质量这个公式可以应用于各种化工过程中,包括物料输送、反应器设计、分离过程等。
二、能量平衡公式能量平衡是化工系统中另一个重要的基本原则。
能量平衡公式描述了化工系统中能量的变化情况。
在闭合系统中,能量平衡公式可以表示为:输入能量 = 输出能量 + 产生能量这个公式可以用于计算化工过程中的热交换、化学反应放热或吸热等情况。
能量平衡公式的应用可以帮助我们合理地设计和控制化工过程中的能量供给和消耗。
三、摩尔平衡公式在化学反应中,摩尔平衡公式是描述反应体系中化学组分变化的数学表达式。
它可以帮助我们计算反应物和生成物之间的摩尔比例关系。
对于简单的化学反应,摩尔平衡公式可以表示为:aA + bB → cC + dD其中,a、b、c、d分别代表反应物A、B和生成物C、D的摩尔系数。
通过摩尔平衡公式,我们可以预测反应的理论产物和反应物消耗的比例。
四、质量传递公式在化工分离过程中,质量传递是一个关键环节。
质量传递公式可以描述物质在流体中的传递速率和传递量。
常见的质量传递公式包括扩散速率公式、传质通量公式等。
这些公式可以帮助我们设计高效的化工分离设备,如吸附塔、蒸馏塔等。
五、动态平衡公式化工过程中往往存在着各种动态平衡现象,如化学反应过程中的反应动力学平衡、质量传递过程中的浓度分布平衡等。
动态平衡公式可以描述这些平衡现象的动态演化过程。
在这方面,常用的公式包括物质转移方程、速率方程等。
化工原理下册重点公式及典型例题

1、平衡溶解度:A A c H p *=⋅,温度升高不利于吸收,故T ↑→H ↓,E ↑. 越易溶的气体H 越大,E 就越小。
2、气相平衡分压:/A Ap c H *= 气膜控制物系:易溶气体如NH 3;液膜控制物系:难溶气体如CO 2、O 2.3、A A p E x *=⋅ E 为亨利系数;此式表明溶质气体在溶液面上方的平衡分压与溶质在溶液中的摩尔分数成正比。
4、与液相(摩尔分数为x )平衡的气相摩尔分数y mx *= /x y m *= a a y mx *=5、气相失去的等于液相得到的.:a b G G ,气体组分出塔、入塔的流率 :a b L L ,液体组分入塔、出塔的流率:G L , 通过塔任一截面的汽、液流率 :a b y y , 出塔、入塔气体的摩尔分数:a b x x , 入塔、出塔液体的摩尔分数 :x y , 任一截面的气、液的摩尔分数 :b a Y Y ,吸收前、后溶质在气相中的摩尔比 :a b X X ,吸收前、后溶质在液相中的摩尔比6、全塔物料衡算()()G y y Lx x -=-baba 液气比b ab ay y L G x x -=- b b Y Y L G X X -=-aa 7、X 、Y 为组成摩尔比:X=x/1-x , Y=y/1-y ; X b =x b /1-x b ,Y b =y b /1-y b ; x b = X b /1+x b 8、吸收过程操作线在平衡线上方,解吸则在下方。
通常入塔气体的摩尔分数y b <0.1时,可作为低浓度气体处理。
对于低浓度气体,可以近似用摩尔分数代替摩尔比。
9、最小液气比min ()b a b a Y Y L G X X *-=- min ()b a b a y y L G x x *-=- b b y x m *= 1b b bx X x ***=- 10、吸收率η=1-Y a /Y b 当溶质含量较低(<5%)时,Y a =y a Y b =y b 则η=1-y a /y b11、塔顶气相总推动力a a a a a y y y y mx *∆=-=- 塔底气相总推动力b b b b b y y y y mx *∆=-=-推动力的对数平均值ln(/)b a m b a y y y y y ∆-∆∆=∆∆ 故填料层高度0b aOG OG y my y G h H N K a y -==∆12、1ln (1)1bay b a OG y a a y mx dy N S S y y S y mx ⎡⎤-==-+⎢⎥-*--⎣⎦⎰脱吸因数/S mG L =111=0=,ln (1)111b a b a OG a a a y mx y x N S S y mx y S ηη-⎡⎤==-+⎢⎥----⎣⎦当时,则此时,13、理论板数N 与气相总传质单元数N OG 的关系:11ln ln OG N A S N A A S--==⋅14、相平衡方程:1111()()D x yy x y x x yαααα===+---或 , 对于二元物系,x A =1- x B , y A =1- y B .15、F-进料液流量,D-塔顶馏出液,W-塔底釜液。
化工原理所涉及的基本公式和重要公式

传质速率方程式
N A = K y ( y − ye ) = K x ( xe − x)
吸收过程基本方程式 对数平均推动力
吸收因数法
最小液气比 物料衡算式
( y1 − mx 1 ) − ( y 2 − mx 2 ) y − mx 1 ln 1 y 2 − mx 2 1 mG y1 − mx 2 mG N OG = ln[(1 − ) + ] mG L y 2 − mx 2 L 1− L y − y2 L ( ) min = 1 G x 1e − x 2 G ( y1 − y 2 ) = L( x1 − x 2 ) ∆y m =
流化床压降
Re p < 2
∆P =
m (ρ − ρ )g Aρ p p
第六章 传热
傅立叶定律 牛顿冷却定律 努塞尔数 普朗特数
dt dn q = α (T − TW ) q = −λ Nu = Pr = αl λ C pµ λ
λ 0.8 b Re Pr 受热 b=0.4,冷却 b=0.3 d 1 传热系数 K1 = d δd 1 1 + R1 + + R2 + 1 α1 λd m α 2d 2 传热基本方程式 Q = KA∆ t m
圆管内强制湍流
α = 0.023
热量衡算式
∆ t1 − ∆ t 2 ∆t ln 1 ∆t 2 Q = qm1C p1 (T1 − T2 ) = qm 2C p 2 ( t1 − t 2 ) ∆t m =
或
Q = qm 1r
第七章 蒸发
蒸发水量 热量衡算 传热速率 溶液沸点
W = F (1 −
w0 ) w Q = Dr0 = FC 0 ( t − t 0 ) + Wr + Q损 Q = KA(T − t ) t = t0 + ∆
化工原理下公式大全

B A B A p -p p -p =x B A A A p p x y =BA p p y x x y =--=)1()1(αx x y )1(1-+=ααqF L L +=, F q V )1(V -+=,泡点(饱和液体)q=1 露点(饱和蒸汽)q=0气液混合0<q<1 D L R = 精馏操作线D n n x D L D x D L L y +++=+1提操W m n x W qF L W x W qF L qF L y -+--++=+,1 最小回流比qq q D q D q D x y y x x x x x R --=⎥⎥⎦⎤⎢⎢⎣⎡----=11(11min ααq 线方程11---=q x x q q y F 塔高T p H N Z )1(-=单板效率气相*111*1n n n n ml n n n n mv x x x x E y y y y E --=≠--=--++液相 塔径u v D s π4=[]V m s VM s m p T VTp V ρ3600/36004.223或 =再沸器热负荷()()W W B x x V Q -+=1, 冷凝器负荷()()D D c x kmol kg kg kJ x kmol kg kg kJ V Q -+=1*/*/*/*/p E m []kpa kpa s m kmol s m kmol pk k G y *)/()/(22⋅⋅=⋅=最小液气比2121min X m Y Y Y V L --=⎪⎭⎫ ⎝⎛ Ω=a k V H Y OG ()⎥⎦⎤⎢⎣⎡+----=S Y Y Y Y S S N OG *22*211ln 11液相v 变l ,s 变A 即S 倒数 湿度()v ss v v g v p p f p p p p p p n n H ,622.0622.0622.0=-=-==ϕϕ 饱和湿度()p t f p p p H s s s ,622.0=-=相对湿度s v p p =ϕ比热容H c H 88.101.1+= 比体积()[]pa 100133.1273273244.1722.05p t H v H ⨯⨯+⨯+=焓()H t H I 249088.101.1++= 干球t 湿球tw 绝热饱和冷却温度tas (等焓操作至饱和湿度)露点td (等湿之饱和湿度) 饱和空气t>tw(tas )>td 不饱和全等X X w +=1ww X -=1湿物料比热容X c c s m 187.4+=()()1212X X G H H L W -=-= 绝干空气消耗量()()()121212H H W H H X X G L -=--=新鲜()11H L L +=所谓理论板,是指在其上气液两相充分混合,各自组成均匀,且传热及传质过程阻力均为零的理想化塔板。
化工原理公式复习

Y1 Y2 Y1 X2 m
平衡曲线为凸形曲线时: ( )min 填料层高度: 用气相推动力表示: Z 用液相推动力表示: Z
L V
Y1 Y2 X 1,max X 2
z
0
dZ
V KY A
L KXA
Y
Y1
2
dY Y Y*
dX X X
*
z
0
dZ
X
X1
2
K Y 或 K X ,称为“总体积传质系数”
用气相推动力表示的总传质单元高度 HOG:
H OG V V L mV KY A kY A kX A L
用液相推动力表示的总传质单元高度 HOL:
H OL L L V L KXA kX A kY A mV
化工原理公式复习
14 轻机 1. 蒸馏
1. 自由度: F C 2
0 0 2. 拉乌尔定律: p A p A0x A , p B p B x B pB (1 x A ), p p A p B
3. 安托因方程:lg p 0 A
0 p pB 4. 泡点方程: x A 0 0 pA pB
x
xF q 1
(6)芬斯克公式: N min ( 7 )最小回流比: (8)单板效率
x 1 xW lg[( D )( )] 1 xD xW 1 lg m
R min
R min 1
xD yq xD yq , R min x D xq y q xq
气相默弗里效率: E MV 液相默弗里效率: E ML 全塔效率: ET
湿空气密度:
1H
《化工原理》公式总结

《化工原理》公式总结化工原理是化学工程与化学技术的基础课程之一,主要涵盖了化学工程量的单位与转化、物质平衡、能量平衡、物质和能量平衡的综合应用等内容。
在学习化工原理时,我们会接触到各种各样的公式,这些公式是化工原理的重要知识点,也是我们日后进行工程设计和实践操作的基础。
下面是对于《化工原理》中常用公式的总结:1.化学工程量的单位与转化:-物质的量(n):n=m/M其中,n为物质的量,m为物质的质量,M为物质的摩尔质量。
-质量与浓度的关系:C=m/V其中,C为浓度,m为溶质的质量,V为溶液的体积。
-分子量:M=m/n其中,M为摩尔质量,m为质量,n为物质的量。
-摩尔浓度(C):C=n/V其中,C为摩尔浓度,n为溶质的量,V为溶液的体积。
2.物质平衡:-输入质量流率=输出质量流率+产物质量流率m1=m2+m3-输入摩尔流率=输出摩尔流率+产物摩尔流率n1=n2+n3-输入物质量浓度=输出物质量浓度+产物物质量浓度C1=C2+C3-输入物质摩尔浓度=输出物质摩尔浓度+产物物质摩尔浓度C1=C2+C33.能量平衡:-输入能量流率=输出能量流率+产物能量流率Q1=Q2+Q3-比热容:Cp=Q/(m*ΔT)其中,Cp为比热容,Q为吸收或放出的热量,m为物质的质量,ΔT 为温度变化。
-等效热容:Cp=Q/(m*ΔT)-热量转化效率:η=(Q1-Q2)/Q1其中,η为热量转化效率,Q1为输入的热量,Q2为产出的热量。
4.物质和能量平衡的综合应用:- 塔板间液相物质平衡方程:(n1 * y1) + (n2 * y2) + ... + (nm * ym) = (n1 * x1) + (n2 * x2) + ... + (nm * xm)其中,n为摩尔流率,y为液相的摩尔分数,x为气相的摩尔分数,m 为塔板总数。
- 塔板间液相能量平衡方程:(h1 * n1 * y1) + (h2 * n2 * y2)+ ... + (hm * nm * ym) = (h1 * n1 * x1) + (h2 * n2 * x2) + ... + (hm * nm * xm)其中,h为液相的比焓,n为摩尔流率,y为液相的摩尔分数,x为气相的摩尔分数,m为塔板总数。
化工原理公式及各个章节总结汇总

第一章 流体流动与输送机械1. 流体静力学基本方程:gh p p ρ+=022. 双液位U 型压差计的指示: )21(21ρρ-=-Rg p p )3. 伯努力方程:ρρ222212112121p u g z p u g z ++=++4. 实际流体机械能衡算方程:f W p u g z p u g z ∑+++=++ρρ222212112121+ 5. 雷诺数:μρdu =Re6. 范宁公式:ρρμλfp d lu u d l Wf ∆==⋅⋅=22322 7. 哈根-泊谡叶方程:232d lup f μ=∆ 8. 局部阻力计算:流道突然扩大:2211⎪⎭⎫ ⎝⎛-=A A ξ流产突然缩小:⎪⎭⎫ ⎝⎛-=2115.0A A ξ第二章 非均相物系分离1. 恒压过滤方程:t KA V V V e 222=+令A V q /=,A Ve q e /=则此方程为:kt q q q e =+22第三章 传热1. 傅立叶定律:n t dAdQ ϑϑλ-=,dxdt A Q λ-= 2. 热导率与温度的线性关系:)1(0t αλλ+= 3. 单层壁的定态热导率:bt t AQ 21-=λ,或mA b tQ λ∆=4. 单层圆筒壁的定态热传导方程: )ln1(21221r r t t l Q λπ-=或m A b tt Q λ21-=5. 单层圆筒壁内的温度分布方程:C r l Qt +-=ln 2λπ(由公式4推导)6. 三层圆筒壁定态热传导方程:34123212141ln 1ln 1ln 1(2r r r r r r t t l Q λλλπ++-=7. 牛顿冷却定律:)(t t A Q w -=α,)(T T A Q w -=α8. 努塞尔数λαl Nu =普朗克数λμCp =Pr 格拉晓夫数223μρβtl g Gr ∆= 9. 流体在圆形管内做强制对流:10000Re >,1600Pr 6.0<<,50/>d lk Nu Pr Re 023.08.0=,或kCp du d ⎪⎭⎫⎝⎛⎪⎪⎭⎫ ⎝⎛=λμμρλα8.0023.0,其中当加热时,k=0.4,冷却时k=0.3 10. 热平衡方程:)()]([1222211t t c q T T c r q Q p m s p m -=-+=无相变时:)()(12222111t t c q T T c q Q p m p m -=-=,若为饱和蒸气冷凝:)(12221t t c q r q Q p m m -== 11. 总传热系数:21211111d d d d b K m ⋅+⋅+=αλα 12. 考虑热阻的总传热系数方程:212121211111d d R R d d d d b K s s m ⋅++⋅+⋅+=αλα 13. 总传热速率方程:t KA Q ∆=14. 两流体在换热器中逆流不发生相变的计算方程:⎪⎪⎭⎫⎝⎛-=--22111112211lnp m p m p m c q c q c q KA t T t T 15. 两流体在换热器中并流不发生相变的计算方程:⎪⎪⎭⎫ ⎝⎛+=--22111122111lnp m p m p m c q c q c q KA t T t T 16. 两流体在换热器中以饱和蒸气加热冷流体的计算方程:2221ln p m c q KAt T t T =--第四章 蒸发1.蒸发水量的计算:110)(Lx x W F Fx =-= 2.水的蒸发量:)1(1x x F W -= 3.完成时的溶液浓度:WF F x -=4. 单位蒸气消耗量:rr D W '=,此时原料液由预热器加热至沸点后进料,且不计热损失,r 为加热时的蒸气汽化潜热r ’为二次蒸气的汽化潜热5.传热面积:mt K QA ∆=,对加热室作热量衡算,求得Dr h H D Q c =-=)(,1t T t -=∆,T 为加热蒸气的温度,t 1为操作条件下的溶液沸点。
化工原理下册考试重点复习公式

复 习(下)第一章 蒸 馏第二节 两组分溶液的气液平衡1-2-1 两组分溶液的气液平衡A A A x p p 0=)1(00A B B B B x p x p p -==000BA B A p p p P x --= 00000BA B A A A A p p p P P p x P p y --⋅== BB B A A A x p v x p v ==, 000,//BA B B A A B A p p x p x p v v ===αα xx y )1(1-+=αα yy x )1(--=αα )1()1(y x x y --=α 第五节 两组分连续精馏的计算1-5-2 物料衡算和操作线方程W D F +=W D F Wx Dx Fx +=WD W F x x x x F D --=)( D F W -=%100⨯=FD D Fx Dx η %100)1()1(⨯--=F W W x F x W η D n n x R x R R y 1111+++=+ DL R = W m m x WL W x W L L y ---=+'''''1 1-5-3 进料热状况的影响rt t c r r I I r I I I I q b p F L L V F V )(-+=-+=--= qF L L +='F q V V )1(-+='W m m x WqF L W x W qF L qF L y -+--++=+''1 F x q x q q y 111---= 1-5-6 回流比的影响及其选择m W W D D x x x x N αlog )1)(1(log 1min⎥⎦⎤⎢⎣⎡--=+ q q qD x y y x R --=min⎥⎥⎦⎤⎢⎢⎣⎡----=q D q D x x x x R 1)1(11min αα 1-5-8 塔高和塔径的计算 P T T N N E = 11+*+--=n n n n MV y y y y E*----=nn n n ML x x x x E 11第二章 吸 收第一节 气—液相平衡2-1-2 享利定律Ex p =*, Hc p A =* mx y =*, mX Xm mX Y ≈-+=)1(1* xx X -=1,y y Y -=1 S S S A S A L EM EM M M c H ρρ≈-+=)(P E m =,EC H = 第二节 传质机理与吸收速率2-2-1 分子扩散与菲克定律dzdc D J A A -= 2-2-2 气相中的定态分子扩散)(21A A A p p RTz D N -⋅= )(1Ai A BmA p p p P RTz D N -⋅⋅= 11ln B Bi B Bi Bm p p p p p -= 2-2-3 液相中的定态分子扩散)(2A Ai SmA c c c C z D N -⋅⋅=SiS Si S Sm c c c c c 22ln -= 2-2-4 扩散系数23000)(T T P P D D = 2-2-5 对流传质)(Ai AG BmG A p p p P RTz D N -⋅⋅= )(AL Ai SmL A c c c C z D N -⋅⋅= BmG G p P RTz D k ⋅= Sm L L c C z D k ⋅=)(i G G A p p k N -=)(L i L A c c k N -=GL i L i G k k c c p p -=-- *)(p p K N G G A -=)*(L L A c c K N -= Hk k K L G G 111+= G L L k H k K +=11 G i G Y i Y A Pk Y Y Pk k Y Y k N ≈++=-=)1)(1(),( L i L X i X A Ck X X Ck k X X k N ≈++=-=)1)(1(),( LG HK K =G G Y Y A PK Y Y PK K Y Y K N ≈++=-=*)1)(1(*),( L L X X A CK X X CK K X X K N ≈++=-=)1*)(1(),*( XY Y k m k K +=11 YX X mk k K 111+= G y i y A Pk k y y k N =-=),(L x i x A Ck k x x k N =-=),(G y y A PK K y y K N =-=*),(L x x A CK K x x K N =-=),*(xy y k m k K +=11 y x x mk k K 111+= 第三节 吸收塔的计算2-3-1 吸收塔的物料衡算与操作线方程11X VL Y X V L Y -+= 22X VL Y X V L Y -+= 12121)1(,Y Y Y Y Y A A ϕϕ-=-=2-3-2 吸收剂用量的决定 212121212*121min )(X Y Y Y X mY Y Y X X Y Y V L --=--=--=⎪⎭⎫ ⎝⎛ϕ 2121min X X Y Y V L -'-=⎪⎭⎫ ⎝⎛ 2-3-4 填料层高度的计算YX mK K =yx mK K =⎰⋅=-⋅Ω⋅⋅=12*Y Y OG OG Y N H Y Y dY a K V z ⎰⋅=-⋅Ω⋅⋅=12*X X OL OL X N H XX dX a K L z ⎰⋅=-⋅Ω⋅⋅=12Y Y G G i Y N H Y Y dY a k V z ⎰⋅=-⋅Ω⋅⋅=12X X L L i X N H XX dX a k L z L G OG H L mV H H += G L OL H mVL H H += m OG Y Y Y N ∆-=21 *,ln 2121Y Y Y Y Y Y Y Y m -=∆∆∆∆-∆=∆ 当21Y Y ∆=∆时,21Y Y Y m ∆=∆=∆mOL X X X N ∆-=21 X X X X X X X X m -=∆∆∆∆-∆=∆*,ln 2121 当21X X ∆=∆时,21X X X m ∆=∆=∆⎥⎦⎤⎢⎣⎡+----=S mX Y mX Y S S N OG 2221)1(ln 11 LmV S =—— 脱吸因数 2-4-3 吸收系数的准数关联式 Dl P RTp k Sh Bm G G = 'D l C c k Sh Sm LL =DSc G G G ρμ= 'D Sc L L L ρμ= G G G σμ4Re =L L W σμ4Re = 223L gl Ga μρ= 第五章 干 燥 第一节 湿空气的性质及湿度图5-1-1 湿空气的性质 p P pH -=622.0%100⨯=Sp pϕPt H v H 510013.1273273)244.1772.0(⨯⋅+⋅+=H c H 88.101.1+=H t H I 2490)88.101.1(++=)(,H H r kt t tw s twH w --=α)(0H H c r t t as Has --=tds td s td s H PH p ,,,622.0+=d w as t t t t >>)(,(不饱和空气)d w as t t t t ==)(,(饱和空气)第二节 干燥过程的物料衡算与热量衡算5-2-1 湿物料中含水量的表示方法X X w +=1, ww X -=1 5-2-2 干燥系统的物料衡算)()(1221H H L X X G W -=-=121221)(H H W H H X X G L -=--= 121H H W L l -== ,1)1(2112w w G G --=)1()1(2211w G w G G -=-= 5-2-3 干燥系统的热量衡算))(88.101.1()(01001t t H L I I L Q P -+=-=L D Q I I G I I L Q +'-'+-=)()(1212 L D P Q I I G I I L Q Q Q +'-'+-=+=)()(1202 L m Q Gc t W t t L +-+++-=)()88.12490()(01.112202θθ%100)88.12490(2⨯+=Qt W η 第三节 固体物料在干燥过程中的平衡关系与速率关系)(11c c X X SU G -'=τ **ln ***ln 222X X X X U X X S G X X X X S k G c c c c X --⋅-⋅'=--'=τ。
化工原理下册总复习
• 3、板式塔的流体力学特性
• ①塔板压降:干板压降、对传质的影响
• ②液泛:现象,发生场合,利弊分析
• ③液沫挟带:现象,利弊分析
• ④漏液:发生场所,影响
• ⑤液面落差:产生原因,影响
• ⑥操作弹性图:操作点及弹性比
填料塔
• 1、基本结构与特点 • 2、填料:①性能参数:比表面、空隙率、填料因子
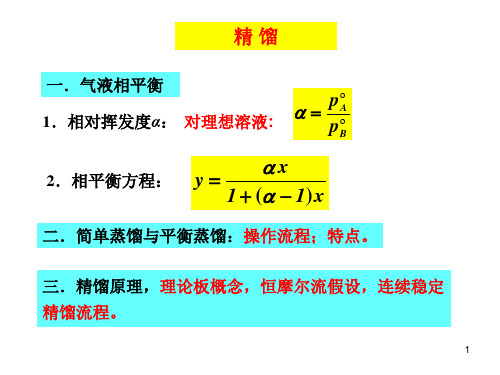
精馏
一.气液相平衡 1.相对挥发度α: 对理想溶液:
p
A
p
B
2.相平衡方程: y
x
1 ( 1)x
二.简单蒸馏与平衡蒸馏:操作流程;特点。
三.精馏原理,理论板概念,恒摩尔流假设,连续稳定 精馏流程。
1
四.双组分连续精馏的计算:√
1.全塔物料衡算
F DW
F xF D xD W xW
29.下述说法中错误的是( B )。 A理想溶液满足拉乌尔定律,也满足亨得定律; B理想溶液满足拉乌尔定律,但不满足亨利定律; C非理想稀溶液满足亨利定律,但不满足拉乌尔定律; D服从亨利定律并不说明溶液的理想性,服从拉乌尔 定律才表明溶液的理想性
30 .精馏的操作线为直线,主要是因为( )。 A理论板假定; B塔顶泡点回流D; C. 理想物系; D. 恒摩尔流假定
9
3.填料层高度的计算:√
(1)填料层高度:
H HOG NOG
G HOG KY aΩ
NOG
Y1 dY Y2 Y Y *
(2)传质单元数的计算:平衡关系为直线时:
脱吸因数法:
N OG
1 1 S
ln[(1
S )Y1 Y2
Y2* Y2*
化工原理 公式

化工原理公式
化工原理是一个综合性学科,涉及到很多方面的知识。
在学习化工原理的过程中,我们经常会遇到一些重要的公式。
下面是一些常见的化工原理的公式,以及它们的应用。
1. 质量守恒公式
质量守恒公式用于描述一个化学反应中物质的质量守恒关系。
它表示为:
∑mi = ∑mf
其中,∑mi表示反应物的质量总和,∑mf表示生成物的质量总和。
2. 能量守恒公式
能量守恒公式用于描述一个化学反应中能量的守恒关系。
它表示为:
∆H = Q - W
其中,∆H表示反应的焓变,Q表示系统吸收或释放的热量,W表示系统对外做功。
3. 浓度公式
浓度公式用于描述溶液中溶质的浓度。
常见的浓度单位有摩尔浓度、体积分数、质量分数等。
以摩尔浓度为例,它表示为:C = n/V
其中,C表示溶液的摩尔浓度,n表示溶质的摩尔数,V表示溶液的体积。
4. 饱和度公式
饱和度公式用于描述气体和液体混合物中各组分的饱和度。
以气体饱和度为例,它表示为:
φ = p/p*
其中,φ表示气体的饱和度,p表示气体的实际压力,p*表示气体的饱和蒸汽压力。
这些公式是化工原理中常见的一些公式,它们在实际应用中有着重要的作用。
在学习和应用这些公式时,我们需要注意理解公式的意义和适用条件,以确保正确使用。
化工原理公式汇总下册

石油化学工程原理(下册)公式总结第八章 传质1.质量分率 : 可知 1=+++ C B A a a a2.摩尔分率: 可知1=+++ C B A x x x3.质量分率与摩尔分率的换算4.质量比 有 摩尔比 有5.等分子反向扩散)(21A A A p p RT D N --=δ )(21B B B B p p RT D J N --==δ 且 A B N N -=L A A L AL AL C C D J N )(21-⎪⎭⎫ ⎝⎛-==δ LB B LBL BL C C D J N )(21-⎪⎭⎫⎝⎛-==δ 6.一组分通过另一停滞组分的扩散(单向扩散))(21A A BmA p p p p RT D N -=δ LA A SmM L AL C C C CD N )()(21-=δ第九章 精馏1.拉乌尔定律 A o A Ax p p = )1(A oB B o B B x p x p p -== 2.道尔顿分压定律: B A P P P += 其中,A A Py P = ,B B Py P =3.相平衡常数:i ii x y K =对于低压下液相为理想溶液的物系,有:P P K i i 0=4.相对挥发度:BB AA B A x P x P //==ννα 5.(1)泡点方程:o B o A o B A P P P P x --= (2)露点方程:)()(o B o A o B oA A o A A P P P P P P P x P y --== (3)相平衡方程:i i i x K y = 由于α随温度的变化不大,所以通常也可表示为xxy )1(1-==αα6. 精馏过程计算:(1)全塔物料衡算 F=D+W W D F Wx Dx Fx += (2)精馏段物料衡算 :精馏段操作线方程为:D n n x VD x V L y +=+1 回流比D LR =,RD L =,D R V )1(+=∑∑==iiA A i i A A A M a M a M a m M m a x ∑=ii AA A M x n nM x aB A m m a =a a a -=1BA nn X =xx X -=1X X x +=1a a a +=1 ,,,nn x n n x n n x C C BB A A ===,,,m m a m m a m m aC C BB A A ===气相液相气相式中 液相1212ln B B B B Bm p pp p p -=最小回流比q D q D x x y x R R --=+1min minqq q D x y y x R --=minR opt =(1.1~2)R min (3)提馏段操作线方程: '''1V Wx x V L y W m m -=+式中,F q V V qF L L )1(''-+=+=,,进料的千摩尔汽化潜热量态变为饱和蒸汽所需热每千摩尔进料从进料状=--=L V F V h h h h q (4)进料线方程:11---=q x x q qy F过点(F F x x ,)、斜率为)1(-q q 的直线。
化工原理化工计算所有公式总结

化工原理化工计算所有公式总结化工原理是化工专业的基础课程,主要涉及到化学反应工程、质量平衡、热力学等方面的内容。
在学习化工原理过程中,需要掌握一些常用的化工计算公式。
下面就对一些常见的化工计算公式进行总结。
1.化学反应速率计算公式:化学反应速率计算公式通常用来计算反应速率和反应动力学参数。
常见的化学反应速率计算公式有:(1)反应速率的一般表达式:v=k[A]^a[B]^b(2)反应级数与速率常数的关系:k=v/[A]^a[B]^b2.质量平衡计算公式:质量平衡计算公式是用来计算化工过程中物质的质量平衡。
常见的质量平衡计算公式有:(1) 总质量平衡:F = F_in - F_out + R(2) 组件质量平衡:F*A = F_in*A_in - F_out*A_out + R*A3.热平衡计算公式:热平衡计算公式通常用来计算化工过程中的热平衡。
常见的热平衡计算公式有:(1)热量传递公式:Q=U*A*ΔT(2)能量平衡公式:Q=Cp*ΔT+ΔH_r4.流体力学计算公式:流体力学计算公式主要用于计算流体在管道或设备中的流动状态。
常见的流体力学计算公式有:(1)泊肃叶定理:A1V1=A2V2(2) 阿基米德原理:F_buoyancy = ρ_fluid*V_submerged*g(3) 流体阻力公式:F_resistance = 1/2*C_d*ρ_fluid*A*V^25.过程控制计算公式:过程控制计算公式主要用于协助调控化工过程中的各种物理和化学参数。
常见的过程控制计算公式有:(1)控制阀流量公式:Q=Cv*√(ΔP/ρ)(2) 温度控制回路:T = T_sp + K_p*(e + K_i∫e dt + K_d(de/dt))(3) 浓度控制回路:C = C_sp + K_p*(e + K_i∫e dt + K_d(de/dt))总结:以上只是化工原理中一部分常用的计算公式,不同的化工过程和实际问题会有不同的计算公式。
《化工原理》公式总结

第一章 流体流动与输送机械1. 流体静力学基本方程:gh p p ρ+=022. 双液位U 型压差计的指示: )21(21ρρ-=-Rg p p )3. 伯努力方程:ρρ222212112121p u g z p u g z ++=++4. 实际流体机械能衡算方程:f W p u g z p u g z ∑+++=++ρρ222212112121+ 5. 雷诺数:μρdu =Re6. 范宁公式:ρρμλfp d lu u d l Wf ∆==⋅⋅=22322 7. 哈根-泊谡叶方程:232d lup f μ=∆ 8. 局部阻力计算:流道突然扩大:2211⎪⎭⎫ ⎝⎛-=A A ξ流产突然缩小:⎪⎭⎫ ⎝⎛-=2115.0A A ξ第二章 非均相物系分离1. 恒压过滤方程:t KA V V V e 222=+令A V q /=,A Ve q e /=则此方程为:kt q q q e =+22第三章 传热1. 傅立叶定律:n t dAdQ ϑϑλ-=,dxdtA Q λ-= 热导率与温度的线性关系:)1(0t αλλ+= 2. 单层壁的定态热导率:bt t AQ 21-=λ,或mA b tQ λ∆=3. 单层圆筒壁的定态热传导方程: )ln1(21221r r t t l Q λπ-=或m A b t t Q λ21-=4. 单层圆筒壁内的温度分布方程:C r l Qt +-=ln 2λπ(由公式4推导) 5. 三层圆筒壁定态热传导方程:34123212141ln 1ln 1ln 1(2r r r r r r t t l Q λλλπ++-=6. 牛顿冷却定律:)(t t A Q w -=α,)(T T A Q w -=α7. 努塞尔数λαl Nu =普朗克数λμCp =Pr 格拉晓夫数223μρβtl g Gr ∆= 8. 流体在圆形管内做强制对流: 10000Re >,1600Pr 6.0<<,50/>d lk Nu Pr Re 023.08.0=,或kCp du d ⎪⎭⎫⎝⎛⎪⎪⎭⎫ ⎝⎛=λμμρλα8.0023.0,其中当加热时,k=0.4,冷却时k=0.3 9. 热平衡方程:)()]([1222211t t c q T T c r q Q p m s p m -=-+=无相变时:)()(12222111t t c q T T c q Q p m p m -=-=,若为饱和蒸气冷凝:)(12221t t c q r q Q p m m -== 10. 总传热系数:21211111d d d d b K m ⋅+⋅+=αλα 11. 考虑热阻的总传热系数方程:212121211111d d R R d d d d b K s s m ⋅++⋅+⋅+=αλα 12. 总传热速率方程:t KA Q ∆=13. 两流体在换热器中逆流不发生相变的计算方程:⎪⎪⎭⎫⎝⎛-=--22111112211lnp m p m p m c q c q c q KA t T t T 14. 两流体在换热器中并流不发生相变的计算方程:⎪⎪⎭⎫ ⎝⎛+=--22111122111lnp m p m p m c q c q c q KA t T t T 15. 两流体在换热器中以饱和蒸气加热冷流体的计算方程:2221ln p m c q KAt T t T =--第四章 蒸发1.蒸发水量的计算:110)(Lx x W F Fx =-= 水的蒸发量:)1(1x x F W -= 2.完成时的溶液浓度:WF F x -=3. 单位蒸气消耗量:rr D W '=,此时原料液由预热器加热至沸点后进料,且不计热损失,r 为加热时的蒸气汽化潜热r ’为二次蒸气的汽化潜热 4.传热面积:mt K QA ∆=,对加热室作热量衡算,求得Dr h H D Q c =-=)(,1t T t -=∆,T 为加热蒸气的温度,t 1为操作条件下的溶液沸点。
