2016年北京市高考化学试题(清晰版)
北京卷化学2016高考真题北京答案
2016年普通高等学校招生全国统一考试
化学
6.B 7.C 8.A 9.B 10.D 11.C 12.B
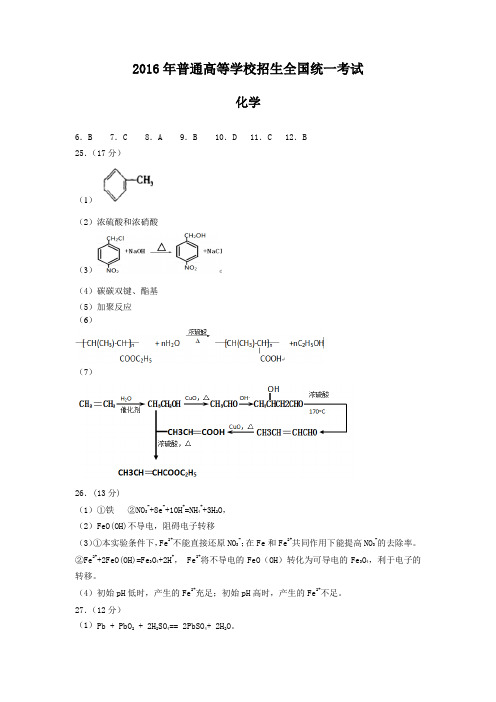
25.(17分)
(1)
(2)浓硫酸和浓硝酸
(3)
(4)碳碳双键、酯基
(5)加聚反应
(6)
(7)
26.(13分)
(1)①铁②NO3-+8e-+10H+=NH4++3H2O,
(2)FeO(OH)不导电,阻碍电子转移
(3)①本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率。
②Fe2++2FeO(OH)=Fe3O4+2H+, Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子的转移。
(4)初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足。
27.(12分)
(1)Pb + PbO
2 + 2H2SO4== 2PbSO4+ 2H2O。
(2)①2Fe3++Pb+SO42—==PbSO4+2Fe2+;
②取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去。
(3)①A、B;②将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤得到PbO固体。
28.(16分)
(1)2Ag++SO32—Ag2SO4↓。
(2)①有红色固体生成;②a.HCl和BaCl2溶液。
b.在I-的作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-。
(3)①Al3+、OH-。
②a、,b、V1明显大于V2。
(4)亚硫酸盐的溶解性、氧化还原性、在水溶液中的酸碱性;两种盐溶液中阴阳离子的性质和反应条件。
2016年北京卷高考真题化学试卷答案

2016年北京卷高考真题化学试卷(答案)一、选择题1.【解析】B屠呦呦发现的抗疟疾的新药青蒿素获得了诺贝尔奖,故选B。
2.【解析】C .冷水浸泡属于物质的溶解,故不符合题意;.加热煎制属于加热,故 不符合题意;.箅渣取液属于过滤操作,故 符合题意;.灌装是液体转移,故 不符合题意;故选 。
3.【解析】A .抗氧化剂减少食品与氧气的接触,延缓氧化的反应速率,故 正确;.调味剂是为了增加食品的味道,故 错误;.着色剂是为了给食品添加某种颜色,故 错误;.增稠剂是改变物质的黏度,故 错误;故选。
4.【解析】B .甲苯反应生成二甲苯是甲苯的苯环上的氢被甲基代替,属于取代反应,故正确;.甲苯的相对分子质量比二甲苯小,故沸点比二甲苯低,故 不正确;.苯的沸点与二甲苯的沸点相差较大,可以用蒸馏的方法分离,故 正确;.因为对二甲苯的熔点最高,所以能用冷却结晶的方法分离出来,故 正确;故选 。
5.D【解析】.在平衡体系中加入酸,平衡逆向移动,重铬酸根离子浓度增大,橙色加深,加入碱,平衡正向移动,溶液变黄,故不合题意;.②中重铬酸钾氧化乙醇,重铬酸钾被还原,故 不合题意;.②是酸性条件,④是碱性条件,酸性条件下氧化乙醇,而碱性条件不能,说明酸性条件下氧化性强,故 不合题意;.若向④溶液中加入 的硫酸到过量,溶液为酸性,可以氧化乙醇,溶液变绿色,故 符合题意;故选。
6.【解析】C两个反应的方程式为:①② ③。
.从方程式分析,当 恰好和 完全反应时,溶液的导电能力最小,故 ① 代表滴加 时的变化曲线,故正确;. 点时加入 进行反应 ②,溶液中含有 ,故 正确;. 点 ① 曲线为 ,②曲线为和,因为浓度相同但 ② 中 浓度大于 ① 中 浓度,所以溶液中的 浓度不相同,故 错误;. 点为 和完全沉淀, 点为溶液,溶液显中性,故正确;故选 。
7.【解析】B根据实验一的实验现象可判断出 作阳极, 作阴极,、 处的电极反应均为, 处的电极反应为,由于 的颜色较浅,短时间观察不到明显的现象。
2016年北京市高考化学试卷

文档2016年北京市高考化学试卷一、选择题.1.(3分)我国科技创新成果斐然,下列成果中获得诺贝尔奖的是()A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法DD.CA.AB.BC.3.(3分)下列食品添加剂中,其使用目的与反应速率有关的是()A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂4.(3分)在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔下列说法不正确的是()A.该反应属于取代反应B.甲苯的沸点高于144℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来2﹣2﹣+.用+2H?OOCr溶液中存在平衡:OCr分)(5.3K(橙色)+H2CrO(黄色)4227227文档KCrO溶液进行下列实验:722结合实验,下列说法不正确的是()A.①中溶液橙色加深,③中溶液变黄2﹣被COHOH还原B.②中Cr5722C.对比②和④可知KCrO酸性溶液氧化性强722D.若向④中加入70%HSO溶液至过量,溶液变为橙色426.(3分)在两份相同的Ba(OH)溶液中,分别滴入物质的量浓度相等的HSO、422NaHSO溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确4的是()A.①代表滴加HSO溶液的变化曲线42+﹣OH、b点,溶液中大量存在的离子是NaB.﹣OH点,两溶液中含有相同量的C.cD.a、d两点对应的溶液均显中性现a、d处试纸变蓝;b处变红,两个石墨电极附近有气泡产生;n处有气泡产文档)下列对实验现象的解释或推测不合理的是(﹣﹣+2OH2H═O+2eH↑A.a、d处:22﹣﹣↑Cl﹣2e═B.b处:2Cl22+﹣Fe═C.c处发生了反应:Fe﹣2e处能析出铜.根据实验一的原理,实验二中mD分)小题,满分58二、解答题(共4的合成路线如下:P8.(17分)功能高分子. H,其结构简式是(1)A的分子式是C87.是)试剂(2a.)反应③的化学方程式:(3..E中含有的官能团:H(4)E的分子式是CO2610. 5)反应④的反应类型是(.)反应⑤的化学方程式:(6CHO)已知:2CH(73,写出合成路线(用结构简式表E以乙烯为起始原料,选用必要的无机试剂合成.,用箭头表示转化关系,箭头上注明试剂和反应条件)示有机物)﹣)已成为环境修复研究的Fe)去除水体中的硝酸盐(NO分)用零价铁((9.133热点之一.文档﹣所示.NO1的反应原理如图(1)Fe还原水体中3.①作负极的物质是.②正极的电极反应式是﹣NO 3﹣. NO 的去除率低.其原因是pH=4.5时,3的水体中投入足量铁粉的同时,补充一定量的)实验发现:在初始pH=4.5(32+﹣2+的作用提出两种假设:的去除率.对FeFe可以明显提高NO3﹣2+;直接还原NOⅠ.Fe32+)氧化层.OHFeO Ⅱ.Fe(破坏.所示,可得到的结论是①做对比实验,结果如图22+.结合该反应的离子方程FeO(OH)反应生成②同位素示踪法证实FeFeO能与43﹣2+.去除率的原因:式,解释加入Fe 提高NO3﹣,结果如表:的3初始pH pH=2.5pH=4.5文档﹣去除率和铁的最终物质pH不同时,NO与(2)中数据对比,解释(2)中初始3.形态不同的原因:及炭黑等)PbSOPbO、分)以废旧铅酸电池中的含铅废料(12Pb、PbO、10.(42,实现铅的再生利用.其工作流程如下:PbOSO为原料,制备高纯和H422+. PbO 和反应生成PbSO (1)过程Ⅰ中,在Fe 的化学方程式是催化下,Pb 42 2+催化过程可表示为:Fe (2)过程Ⅰ中, 3+2﹣2++O+2H+PbO+4H ═+SO2Fe+PbSOi :2Fe 2244:…ii . ii 的离子方程式: ①写出②下列实验方案可证实上述催化过程.将实验方案补充完整.,溶PbOKSCN 溶液,溶液几乎无色,再加入少量a .向酸化的FeSO 溶液中加入24液变红. . b . ,)NaHPbO (aq )s+NaOH (aq )?溶液中,存在平衡:)(3PbO 溶解在NaOHPbO (2其溶解度曲线如图所示.经处理后可在过程Ⅱ中重复使用,其目的是 1①过程Ⅱ的目的是脱硫.滤液.(选填序号)的损失,提高产品的产率Pb .减小A ,提高原料的利用率NaOHB .重复利用浓度,提高脱硫效率NaSOC .增加 42 ②过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:文档溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性NaSO .(16分)以11321﹣Ⅱ.溶液变绿,继续滴L 0.2 mol?加产生棕黄色沉淀CuSO41﹣Ⅲ.开始无明显变化,Al 0.1 mol?L2继续滴加产生白色沉淀溶液SO)(34.用离子方程式解释现象Ⅰ:现象Ⅰ中的白色沉淀是AgSO.(1)经检验,32﹣22+2﹣+.)经检验,现象Ⅱ的棕黄色沉淀中不含SO,含有Cu、Cu和SO(2342++2+.↓(白色),CuCu已知:+ICu+CuCuI2+.的实验现象是①用稀硫酸证实沉淀中含有Cu﹣22+.和②通过下列实验证实,沉淀中含有CuSO3.是是BaSO,试剂1Aa.白色沉淀4﹣2+2.的理由是b.证实沉淀中含有CuSO和32SOSO)在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无(3)已知:Al(4233﹣溶液褪色.,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4.①推测沉淀中含有亚硫酸根和所吸附;.存OH被Al()ii.②对于沉淀中亚硫酸根的存在形式提出两种假设:i3成立.设计了对比实验,证实了假设iiii在于铝的碱式盐中.对假设文档a.将对比实验方案补充完整.步骤一:.(按图形式呈现)步骤二:成立的实验证据是 b.假设ii(4)根据实验,亚硫酸盐的性质有.盐溶液间反应的多样性与有关.文档2016年北京市高考化学试卷参考答案与试题解析一、选择题.1.【分析】2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖.【解答】解:2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖。
2016年北京市高考化学试卷

2016年北京市高考化学试卷一、选择题.1. 我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( ) A.徐光宪建立稀土串级萃取理论 B.屠呦呦发现抗疟新药青蒿素 C.闵恩泽研发重油裂解催化剂 D.侯德榜联合制碱法2. 下列中草药煎制步骤中,属于过滤操作的是( ).冷水浸泡 .加热煎制.箅渣取液 .灌装保存3. 下列食品添加剂中,其使用目的与反应速率有关的是( ) A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂4. 在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔点如表: 下列说法不正确的是( ) A.该反应属于取代反应 B.甲苯的沸点高于C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来 5.溶液中存在平衡: (橙色)(黄色) 。
用 溶液进行如图所示实验。
结合实验,下列说法不正确的是( )A.①中溶液橙色加深,③中溶液变黄B.②中被 还原C.对比②和④可知 酸性溶液氧化性强D.若向④中加入溶液至过量,溶液变为橙色6. 在两份相同的溶液中,分别滴入物质的量浓度相等的、溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是()A.①代表滴加溶液的变化曲线B.点,溶液中大量存在的离子是、C.点,两溶液中含有相同量的D.、两点对应的溶液均显中性7. 用石墨电极完成下列电解实验.实验一实验二、处试纸变蓝;处变红,局部褪色;两个石墨电极附近有气泡产生;处A.、处:B.处:C.处发生了反应:D.根据实验一的原理,实验二中处能析出铜二、解答题(共4小题,满分58分)8. 功能高分子的合成路线如下:(1)的分子式是,其结构简式是________.(2)试剂是________.(3)反应③的化学方程式:________.(4)的分子式是.中含有的官能团:________.(5)反应④的反应类型是________.(6)反应⑤的化学方程式:________.(7)已知:以乙烯为起始原料,选用必要的无机试剂合成,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件).9. 用零价铁去除水体中的硝酸盐已成为环境修复研究的热点之一.(1)还原水体中的反应原理如图所示.①作负极的物质是________.②正极的电极反应式是________.(2)将足量铁粉投入水体中,经小时测定的去除率和,结果如下:接近中性接近中性时,的去除率低.其原因是________.(3)实验发现:在初始的水体中投入足量铁粉的同时,补充一定量的可以明显提高的去除率.对的作用提出两种假设:.直接还原;.破坏氧化层.①做对比实验,结果如图所示,可得到的结论是________.②同位素示踪法证实能与反应生成.结合该反应的离子方程式,解释加入提高去除率的原因:________.(4)其他条件与(2)相同,经小时测定的去除率和,结果如表:与(2)中数据对比,解释(2)中初始不同时,去除率和铁的最终物质形态不同的原因:________.10. 以废旧铅酸电池中的含铅废料( 、 、 、 及炭黑等)和 为原料,制备高纯 ,实现铅的再生利用.其工作流程如下:(1)过程 中,在 催化下, 和 反应生成 的化学方程式是________.(2)过程 中, 催化过程可表示为::…①写出 的离子方程式:________.②下列实验方案可证实上述催化过程.将实验方案补充完整..向酸化的 溶液中加入 溶液,溶液几乎无色,再加入少量 ,溶液变红. .________.(3) 溶解在 溶液中,存在平衡: ,其溶解度曲线如图所示.①过程 的目的是脱硫.滤液 经处理后可在过程 中重复使用,其目的是________(选填序号)..减小 的损失,提高产品的产率 .重复利用 ,提高原料的利用率 .增加 浓度,提高脱硫效率②过程 的目的是提纯,结合上述溶解度曲线,简述过程 的操作:________11. 以 溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性.滴管溶液(1)经检验,现象Ⅰ中的白色沉淀是.用离子方程式解释现象Ⅰ:________.(2)经检验,现象Ⅱ的棕黄色沉淀中不含,含有、和.已知:稀硫酸,(白色).①用稀硫酸证实沉淀中含有的实验现象是________.②通过下列实验证实,沉淀中含有和..白色沉淀是,试剂是________..证实沉淀中含有和的理由是________.(3)已知:在水溶液中不存在.经检验,现象Ⅲ的白色沉淀中无,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性溶液褪色.①推测沉淀中含有亚硫酸根和________.②对于沉淀中亚硫酸根的存在形式提出两种假设:.被所吸附;.存在于铝的碱式盐中.对假设设计了对比实验,证实了假设成立..将对比实验方案补充完整.步骤一:步骤二:________(按图形式呈现)..假设成立的实验证据是________(4)根据实验,亚硫酸盐的性质有________.盐溶液间反应的多样性与________有关.参考答案与试题解析2016年北京市高考化学试卷一、选择题.1.【答案】B【考点】化学史【解析】年月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖.【解答】解:年月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖,故选:.2.【答案】C【考点】物质的分离、提纯的基本方法选择与应用【解析】过滤用于分离不溶性物质和液体的分离,一般利用固体的颗粒大小将固体和液体分离,以此解答该题.【解答】.冷水浸泡属于物质的溶解,故错误;.加热煎制属于加热,故错误;.箅渣取液将固体和液体分离,属于过滤操作,故正确;.灌装是液体转移,故错误。
2016年北京市高考化学真题及答案解析

2016年北京市高考化学试卷一、选择题.1.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是()A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法2.下列中草药煎制步骤中,属于过滤操作的是()A.冷水浸泡B.加热煎制C.箅渣取液D.灌装保存3.下列食品添加剂中,其使用目的与反应速率有关的是()A.抗氧化剂B.调味剂C.着色剂D.增稠剂4.在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔点如表:对二甲苯邻二甲苯间二甲苯苯沸点/℃138********熔点/℃13﹣25﹣476下列说法不正确的是()A.该反应属于取代反应B.甲苯的沸点高于144℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来5.K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O⇌2CrO42﹣(黄色)+2H+.用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( ) A .①中溶液橙色加深,③中溶液变黄 B .②中Cr 2O 72﹣被C 2H 5OH 还原C .对比②和④可知K 2Cr 2O 7酸性溶液氧化性强D .若向④中加入70%H 2SO 4溶液至过量,溶液变为橙色 6.在两份相同的Ba (OH )2溶液中,分别滴入物质的量浓度相等的H 2SO 4、NaHSO 4溶液,其导电能 力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )A .①代表滴加H 2SO 4溶液的变化曲线B .b 点,溶液中大量存在的离子是Na +、OH ﹣C .c 点,两溶液中含有相同量的OH ﹣D .a 、d 两点对应的溶液均显中性 7.用石墨电极完成下列电解实验.实验一 实验二装置现象 a 、d 处试纸变蓝;b 处变红,局部褪色;c 处无明显变化两个石墨电极附近有气泡产生;n 处有气泡产生;下列对实验现象的解释或推测不合理的是( ) A .a 、d 处:2H 2O +2e ﹣═H 2↑+2OH ﹣ B .b 处:2Cl ﹣﹣2e ﹣═Cl 2↑C .c 处发生了反应:Fe ﹣2e ﹣═Fe 2+D .根据实验一的原理,实验二中m 处能析出铜 二、解答题(共4小题,满分58分) 8.(17分)功能高分子P 的合成路线如下:。
2016年高考北京卷理综化学试题解析(解析版)

2016年普通高等学校招生全国统一考试(北京卷)理科综合化学部分6.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法【答案】B【考点定位】本题主要是考查化学史判断【名师点晴】本题侧重于考查我国科学家在化学领域中的重大研究成果,主要是与诺贝尔化学奖有关的判断,学生只要平时注意稍加留意即可得出正确的判断,有利于培养学生的化学兴趣,激发学生的爱国主义热情。
7.下列中草药煎制步骤中,属于过滤操作的是【答案】C【解析】试题分析:A、冷水浸泡属于物质的溶解,A错误;B、加热煎制属于加热,B错误;C、箅渣取液属于过滤操作,C正确;D、灌装保存是液体转移,D错误。
答案选C。
【考点定位】本题主要是考查物质的分离和提纯操作装置判断【名师点晴】该题以我国中草药煎制为载体,侧重考查学生对物质分离与提纯操作装置图的熟练掌握程度,题目难度不大,明确过滤的含义、适用范围以及主要装置是解答的关键。
过滤适用于不溶性固体和液体之间的一种分离方法,主要仪器有铁架台(带铁圈)、烧杯、玻璃棒和漏斗,主要用品是滤纸。
另外还需要注意过滤操作的注意事项。
8.下列食品添加剂中,其使用目的与反应速率有关的是A.抗氧化剂B.调味剂C.着色剂D.增稠剂【答案】A【考点定位】本题主要是考查食品添加剂的有关判断【名师点晴】化学是一门实用性很强的学科,在日常生活及工农业生产和科学技术中应用十分广泛。
食品添加剂关乎我们每个人的健康,了解食品添加剂是每个人应该掌握的基本常识,只有掌握一定的化学知识,才会使我们的生活质量得以提升,也才会更安全、更健康。
了解抗氧化剂、调味剂、着色剂、增稠剂的含义是解答的关键,注意相关知识的积累。
9.在一定条件下,甲苯可生成二甲苯混合物和苯。
有关物质的沸点、熔点如下:下列说法不正确的是A.该反应属于取代反应B.甲苯的沸点高于144℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来【答案】B【解析】试题分析:A、甲苯变二甲苯是甲苯苯环上的氢原子被甲基代替,属于取代反应,A正确;B、甲苯的相对分子质量比二甲苯小,故沸点比二甲苯低,B错误;C、苯的沸点与二甲苯的沸点相差较大,可以用蒸馏的方法分离,C正确;D、因为对二甲苯的熔点较高,冷却后容易形成固体,所以能用冷却结晶的方法分离出来,D正确。
[精校版]2016年全国高考试卷汇编 (word)北京卷 化学部分
![[精校版]2016年全国高考试卷汇编 (word)北京卷 化学部分](https://img.taocdn.com/s3/m/9b4cd222be1e650e52ea99b4.png)
2016年普通高等学校招生全国统一考试(北京卷)理综化学可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Al 27 S 32第一部分(选择题共42分)本部分共7小题,每小题6分,共42分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法7.下列中草药煎制步骤中,属于过滤操作的是( )8.下列食品添加剂中,其使用目的与反应速率有关的是( )A.抗氧化剂B.调味剂C.着色剂D.增稠剂9.在一定条件下,甲苯可生成二甲苯混合物和苯。
有关物质的沸点、熔点如下:下列说法不正确的是( )A.该反应属于取代反应B.甲苯的沸点高于144 ℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来10.K2Cr2O7溶液中存在平衡:Cr2-(橙色)+H2O2Cr-(黄色)+2H+。
用K2Cr2O7溶液进行下列实验:结合实验, 下列说法不正确的是( )A.①中溶液橙色加深,③中溶液变黄B.②中Cr2-被C2H5OH还原C.对比②和④可知K2Cr2O7酸性溶液氧化性强D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色11.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是( )A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH-C.c点,两溶液中含有相同量的OH-D.a、d两点对应的溶液均显中性12.用石墨电极完成下列电解实验。
下列对实验现象的解释或推测不合理的是( )A.a、d处:2H2O+2e-H2↑+2OH-B.b处:2Cl--2e-Cl2↑C.c处发生了反应:Fe-2e-Fe2+D.根据实验一的原理,实验二中m处能析出铜第二部分(非选择题共58分)本部分共4小题,共58分。
2016年北京卷高考真题化学试卷
3. 下列食品添加剂中,其使用目的与反应速率有关的是( )
A. 抗氧化剂
B. 调味剂
C. 着色剂
D. 增稠剂
4. 在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点 /
熔点 /
下列说法不正确的是( )
A. 该反应属于取代反应
B. 甲苯的沸点高于
C. 用蒸馏的方法可将苯从反应所得产物中首先分离出来
装置
、 处试纸变蓝; 处变红,局部褪色; 处 两个石墨电极附近有气泡产生; 处有
现象
无明显变化
气泡产生;……
下列对实验现象的解释或推测不合理的是( )
A. 、 处:
B. 处:
C. 处发生了反应:
D. 根据实验一的原理,实验二中 处能析出
铜
二、非选择题
8. 功能高分子 的合成路线如下:
/
( 1 ) 的分子式是
溶液
Ⅱ.溶液变绿,继续滴加产生 溶液
棕黄色沉淀
溶 Ⅲ.开始无明显变化,继续滴
液
加产生白色沉淀
( 1 )经检验,现象Ⅰ中的白色沉淀是
。用离子方程式解释现象Ⅰ:
。
( 2 )经检验,现象Ⅱ的棕黄色沉淀中不含
,含有
、
和
。
稀
已知:
,
白色
。
1 用稀硫酸证实沉淀中含有
的实验现象是
。
2 通过下列实验证实,沉淀中含有
的去除率和 ,结果如下:
初始
的去除率
约
约
小时
接近中性
接近中性
与(2)中数据对比,解释(2)中初始 不同时,
2016年北京理综化学高考试题文档版(含答案)

绝密★启封并使用完毕前试题类型:2016年普通高等学校招生全国统一考试理科综合能力测试(化学)(北京卷)注意事项:1•本试卷分第I卷(选择题)和第□卷(非选择题)两部分.2•答题前,考生务必将自己的姓名、准考证号填写在本试题相应的位置3.全部答案在答题卡上完成,答在本试题上无效4•考试结束后,将本试题和答题卡一并交回第一部分(选择题共120分)本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项6. 我国科技创新成果斐然,下列成果中获得诺贝尔奖的是A. 徐光宪建立稀土串级萃取理论B. 屠呦呦发现抗疟新药青蒿素C. 闵恩泽研发重油裂解催化剂D. 侯德榜联合制碱法7. 下列中草药煎制步骤中,属于过滤操作的是A.冷水浸泡B.加热煎制C.算渣取液D.灌装保存8. 下列食品添加剂中,其试用目的与反应速率有关的是A .抗氧化剂B .调味剂C .着色剂D .增稠剂9. 在一定条件下,甲苯可生成二甲苯混合物和苯。
有关物质的沸点、熔点如下:对二甲苯邻二甲苯 间二甲苯 苯沸点厂C 138 144 139 80 熔点/ C1325476下列说法不正确的是学 •科.网A. 该反应属于取代反应B. 甲苯的沸点高于 144 CC. 用蒸馏的方法可将苯从反应所得产物中首先分离出来D. 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来2- 2- +10.K 2Cr 2 07溶液中存在平衡:Cr 2O 7 (橙色)+H 20 2 CrO 4 (黄色)+2H 。
用K 2Cr 2O 7溶液进行下列实验:4r fD * JI匚 Vn 别IiDiCCfib 捅戒D!4i …i 结合实验,下列说法不正确的是A. ①中溶液橙色加深,③中溶液变黄B. ②中Cr 2O 72-被C 2H 50H 还原学.科.网C. 对比②和④可知K 2Cr 2O 7酸性溶液氧化性强D. 若向④中加入 70%H 2SO 4溶液至过量,溶液变为橙色11.在两份相同的Ba (OH ) 2溶液中,分别滴入物质的量浓度相等的H 2 SO 4、NaHSO 4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
2016北京化学高考真题含解析
2016年普通高等学校招生全国统一考试理科综合能力测试(北京卷)化学部分6.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法7.下列中草药煎制步骤中,属于过滤操作的是8.下列食品添加剂中,其试用目的与反应速率有关的是A.抗氧化剂B.调味剂C.着色剂D.增稠剂9.在一定条件下,甲苯可生成二甲苯混合物和苯。
有关物质的沸点、熔点如下:对二甲苯邻二甲苯间二甲苯苯沸点/℃138 144 139 80熔点/℃13 25 47 6 下列说法不正确的是A.该反应属于取代反应B.甲苯的沸点高于144 ℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来10.K 2Cr 2O 7溶液中存在平衡:Cr 2O 72-(橙色)+H 2O 2 CrO 42-(黄色)+2H +。
用K 2Cr 2O 7溶液进行下列实验:A.①中溶液橙色加深,③中溶液变黄B.②中Cr 2O 72-被C 2H 5OH 还原C.对比②和④可知K 2Cr 2O 7酸性溶液氧化性强D.若向④中加入70%H 2SO 4溶液至过量,溶液变为橙色11.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H 2SO 4、NaHSO 4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确...的是 A.①代表滴加H 2 SO 4溶液的变化曲线 B.b 点,溶液中大量存在的离子是Na +、OH – C.c 点,两溶液中含有相同量的OH – D.a 、d 两点对应的溶液均显中性 12.用石墨电极完成下列电解实验。
下列对实验现象的解释或推测不合理...的是 A 、a 、b 处:-2222e =2H O H OH -+↑+ B 、b 处:22l 2l C e C ---=↑ C 、c 处发生了反应:22Fe e Fe-+-=D 、根据实验一的原理,实验二中m 处能析出铜25.(17分)功能高分子P的合成路线如下:(1)A的分子式是C7H8,其结构简式是___________________。
2016年北京市高考化学试卷含答案

2016年北京市高考化学试卷一、选择题.1.(3分)我国科技创新成果斐然,下列成果中获得诺贝尔奖的是()A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法2.(3分)下列中草药煎制步骤中,属于过滤操作的是()A.A B.B C.C D.D3.(3分)下列食品添加剂中,其使用目的与反应速率有关的是()A.抗氧化剂B.调味剂C.着色剂D.增稠剂4.(3分)在一定条件下,甲苯可生成二甲苯混合物和苯.有关物质的沸点、熔点如表:下列说法不正确的是()A.该反应属于取代反应B.甲苯的沸点高于144℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来5.(3分)K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O⇌2CrO42﹣(黄色)+2H+.用第1页(共24页)K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是()A.①中溶液橙色加深,③中溶液变黄B.②中Cr2O72﹣被C2H5OH还原C.对比②和④可知K2Cr2O7酸性溶液氧化性强D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色6.(3分)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是()A.①代表滴加H2SO4溶液的变化曲线B.b点,溶液中大量存在的离子是Na+、OH﹣C.c点,两溶液中含有相同量的OH﹣D.a、d两点对应的溶液均显中性7.(3分)用石墨电极完成下列电解实验.第2页(共24页)。
2016年普通高等学校招生全国统一考试(北京卷)化学一、

2016年普通高等学校招生全国统一考试(北京卷)化学一、选择题1.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法解析:2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖。
答案:B2.下列中草药煎制步骤中,属于过滤操作的是( )A.AB.BC.CD.D解析:A.冷水浸泡属于物质的溶解,故A错误;B.加热煎制属于加热,故B错误;C.箅渣取液将固体和液体分离,属于过滤操作,故C正确;D.灌装是液体转移,故D错误。
答案:C3.下列食品添加剂中,其试用目的与反应速率有关的是( )A.抗氧化剂B.调味剂C.着色剂D.增稠剂解析:A.抗氧化剂减少食品与氧气的接触,延缓氧化的反应速率,故A正确;B.调味剂是为了增加食品的味道,与速率无关,故B错误;C.着色剂是为了给食品添加某种颜色,与速率无关,故C错误;D.增稠剂是改变物质的浓度,与速率无关,故D错误。
答案:A下列说法不正确的是( )A.该反应属于取代反应B.甲苯的沸点高于144℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来解析:A、甲苯变成二甲苯是苯环上的氢原子被甲基取代所得,属于取代反应,故A正确;B、甲苯的相对分子质量比二甲苯小,故沸点比二甲苯低,故B错误;C、苯的沸点与二甲苯的沸点相差较大,可以用蒸馏的方法分离,故C正确;D、因为对二甲苯的沸点较低,冷却后邻二甲苯与间二甲苯容易形成固体,从而将对二甲苯分离出来,所以能用冷却结晶的方法分离出来,故D正确。
答案:B5.K2Cr2O7溶液中存在平衡:Cr2O72﹣(橙色)+H2O⇌2CrO42﹣(黄色)+2H+。
用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )A.①中溶液橙色加深,③中溶液变黄B.②中Cr2O72﹣被C2H5OH还原C.对比②和④可知K2Cr2O7酸性溶液氧化性强D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色解析:A.在平衡体系中加入酸,平衡逆向移动,重铬酸根离子浓度增大,橙色加深,加入碱,平衡正向移动,溶液变黄,故A正确;B.②中重铬酸钾氧化乙醇,重铬酸钾被还原,故B 正确;C.②是酸性条件,④是碱性条件,酸性条件下氧化乙醇,而碱性条件不能,说明酸性条件下氧化性强,故B正确;D.若向④溶液中加入70%的硫酸到过量,溶液为酸性,可以氧化乙醇,溶液变绿色,故D错误。
2016年高考北京卷化学答案部分

2016年普通高等学校招生全国统一考试(北京卷)化学部分答案1.C 【解析】过滤是常用的物质分离方法,适用于固液分离,C 项符合题意;A 项和B 项均为浸取,D 项为溶液的转移,A 项、B 项、D 项均不符合题意。
2.A 【解析】相对于食物,抗氧化剂可以更快地被氧气氧化,从而降低了包装袋中氧气的浓度,减缓食品被氧化的速率。
3.B 【解析】甲苯生成二甲苯和苯,可分别理解成甲苯中苯环上的氢被甲基取代、甲苯中的甲基被氢取代,A 项正确;同系物中,碳原子数越多,沸点越高,所以甲苯的沸点应低于二甲苯,即低于138 ℃,B 项错误;苯的沸点最低,可最先分离出来,C 项正确;三种二甲苯间沸点相近,熔点差异大,将温度控制在稍低于13 ℃,对二甲苯结晶析出,D 项正确。
4.D 【解析】A 项,在平衡体系中加入酸,平衡逆向移动,重铬酸根离子浓度增大,橙色加深,加入碱,平衡正向移动,溶液变黄,A 项正确;B 项,②中酸性重铬酸钾溶液氧化乙醇,重铬酸钾被还原为绿色的3Cr +,B 项正确;C 项,②是酸性条件,④是碱性条件,227K Cr O 在酸性条件下能氧化乙醇,而在碱性条件下不能,说明其在酸性条件下氧化性强,C 项正确;D 项,若向④中加入70%24H SO 溶液至过量,溶液为酸性,227K Cr O 可以氧化乙醇,溶液变为绿色,D 项错误。
5.C 【解析】向2Ba (OH)溶液中加入等物质的量浓度的24H SO 溶液,发生反应24H SO +2Ba(OH)4BaSO ↓+22H O ,当加入的24H SO 的物质的量与2Ba(OH)的物质的量相等时,溶液中的离子浓度最低,导电能力最弱,对应①中a 点,继续滴加24H SO 溶液,导电能力逐渐增强,故①代表滴加24H SO 溶液的曲线。
另一份溶液,当加入少量4NaHSO 溶液时,发生反应4NaHSO +2Ba(OH)4BaSO ↓+2H O + NaOH ,当加入的4NaHSO 的物质的量与2Ba(OH)的物质的量相等时,反应后混合液的主要溶质为NaOH ,此时对应②中b 点,B 项正确;继续滴加4NaHSO 溶液,发生反应NaOH +4NaHSO 24Na SO +2H O ,当加入的4NaHSO 的物质的量与2Ba(OH)的总物质的量之比为2:1时,发生反应24NaHSO +2Ba(OH) 4BaSO ↓+24Na SO +2H O ,溶质为24Na SO ,对应②中d 点。
北京高考化学试题及答案高清解析版

2016年北京市高考化学试卷一、选择题.1.(3分)(2016•北京)我国科技创新成果斐然,下列成果中获得诺贝尔奖的是()A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法【答案】B【解析】2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖,故选:B.2.(3分)(2016•北京)【解析】解:A.冷水浸泡属于物质的溶解,故A错误;B.加热煎制属于加热,故B错误;C.箅渣取液将固体与液体分离,属于过滤操作,故C正确;D.灌装是液体转移,故D错误.3.(3分)(2016•北京)下列食品添加剂中,其试用目的与反应速率有关的是()A.抗氧化剂 B.调味剂C.着色剂D.增稠剂【答案】A【解析】解:A.抗氧化剂减少食品与氧气的接触,延缓氧化的反应速率,故A正确;B.调味剂是为了增加食品的味道,与速率无关,故B错误;C.着色剂是为了给食品添加某种颜色,与速率无关,故C错误;D.增稠剂是改变物质的浓度,与速率无关,故D错误.4.(3分)(2016•北京)在一定条件下,甲苯可生成二甲苯混合物与苯.有关物质的沸点、熔点如表:对二甲苯邻二甲苯间二甲苯苯沸点/℃138********熔点/℃1325476下列说法不正确的是()A.该反应属于取代反应B.甲苯的沸点高于144℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来所有【答案】B【解析】解:A、甲苯变成二甲苯是苯环上的氢原子被甲基取代所得,属于取代反应,故A正确;B、甲苯的相对分子质量比二甲苯小,故沸点比二甲苯低,故B错误;C、苯的沸点与二甲苯的沸点相差较大,可以用蒸馏的方法分离,故C正确;D、因为对二甲苯的沸点较低,冷却后邻二甲苯与间二甲苯容易形成固体,从而将对二甲苯分离出来,所以能用冷却结晶的方法分离出来,故D正确;5.(3分)(2016•北京)K22O7溶液中存在平衡:2O72-(橙色)2O 2 42-(黄色)+2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016年北京高考化学试题6.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是A.徐光宪建立稀土串级萃取理论B.屠呦呦发现抗疟新药青蒿素C.闵恩泽研发重油裂解催化剂D.侯德榜联合制碱法7.下列中草药煎制步骤中,属于过滤操作的是8.下列食品添加剂中,其试用目的与反应速率有关的是A.抗氧化剂B.调味剂C.着色剂D.增稠剂9.在一定条件下,甲苯可生成二甲苯混合物和苯。
有关物质的沸点、熔点如下:对二甲苯邻二甲苯间二甲苯苯沸点/℃138 144 139 80 熔点/℃13 25 47 6 下列说法不正确的是A.该反应属于取代反应B.甲苯的沸点高于144 ℃C.用蒸馏的方法可将苯从反应所得产物中首先分离出来D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来10.K 2Cr 2O 7溶液中存在平衡:Cr 2O 72-(橙色)+H 2O 2 CrO 42-(黄色)+2H +。
用K 2Cr 2O 7溶液进行下列实验:结合实验,下列说法不正确的是A .①中溶液橙色加深,③中溶液变黄B .②中Cr 2O 72-被C 2H 5OH 还原C .对比②和④可知K 2Cr 2O 7酸性溶液氧化性强D .若向④中加入70%H 2SO 4溶液至过量,溶液变为橙色11.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H 2SO 4、NaHSO 4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确...的是 A .①代表滴加H 2 SO 4溶液的变化曲线 B .b 点,溶液中大量存在的离子是Na +、OH – C .c 点,两溶液中含有相同量的OH – D .a 、d 两点对应的溶液均显中性 12.用石墨电极完成下列电解实验。
实验一实验二装置现象a 、d 处试纸变蓝;b 处变红,局部褪色;c 处无明显变化两个石墨电极附近有气泡产生;n 处有气泡产生;……下列对实验现象的解释或推测不合理的是 A .a 、d 处:2H 2O+2e - = H 2↑+2OH - B .b 处:2Cl --2e - = Cl 2↑C .c 处发生了反应:Fe-2e - = Fe 2+D .根据实验一的原理,实验二中m 处能析出铜25.(17分)功能高分子P的合成路线如下:(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。
E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(7)已知:2CH3CHO 。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
26.(13分)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如右图所示。
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:初始pH pH=2.5 pH=4.5NO3—的去除率接近100% <50%24小时pH 接近中性接近中性铁的最终物质形态pH=4.5时,NO3—的去除率低。
其原因是____________________________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。
对Fe2+的作用提出两种假设:Ⅰ. Fe2+直接还原NO3—;Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如右图所示,可得到的结论是___________________________。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。
结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:_______________________________。
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:初始pH pH=2.5 pH=4.5NO3—的去除率约10% 约3%1小时pH 接近中性接近中性与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。
其工作流程如下:(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:i:2Fe2++ PbO2+4H++SO42−2Fe3++PbSO4+2H2Oii: ……①写出ii的例子方程式:________________。
②下列实验方案可证实上述催化过程。
将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。
滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。
A.减少PbO的损失,提高产品的产率B.重复利用NaOH,提高原料的利用率C.增加Na2SO4浓度,提高脱硫效率②过程Ⅲ的目的是提纯。
结合上述溶解度曲线,简述过程Ⅲ的操作:____________________。
以Na 2SO 3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验试剂现象滴管试管0.2 mol·L −1Na2SO 3溶液饱和Ag 2SO 4溶液 Ⅰ.产生白色沉淀 0.2 mol·L −1CuSO 4Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 0.1 mol·L −1Al 2(SO 4)3溶液Ⅲ.开始无明显变化,继续滴加产生白色沉淀(1)经检验,现象Ⅰ中的白色沉淀是Ag 2SO 3。
用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO 42−,含有Cu +、Cu 2+和SO 32−。
已知:Cu +Cu +Cu 2+,Cu 2+CuI↓(白色)+I 2。
①用稀硫酸证实沉淀中含有Cu +的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu 2+和SO 32−。
a.白色沉淀A 是BaSO 4,试剂1是____________。
b.证实沉淀中含有Cu 2+和SO 32−的理由是___________。
(3)已知:Al 2(SO 4)3在水溶液中不存在。
经检验,现象Ⅲ的白色沉淀中无SO 42−,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO 4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al (OH )3所吸附;ii.存在于铝的碱式盐中。
对假设ii 设计了对比实验,证实了假设ii 成立。
a.将对比实验方案补充完整。
步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。
盐溶液间反应的多样性与__________有关。
2016北京高考理科综合化学答案6.B7.C8.A9.B 10.D 11.C 12.B25.(17分)(1)(2)浓硫酸和浓硝酸(3)(4)碳碳双键、酯基(5)加聚反应(6)(7)26.(13分)(1)①铁②NO3-+8e-+10H+=NH4++3H2O,(2)FeO(OH)不导电,阻碍电子转移(3)①本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率。
②Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子的转移。
(4)初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足。
27.(12分)(1)Pb + PbO+ 2H2SO4== 2PbSO4+ 2H2O。
2(2)①2Fe3++Pb+SO42—==PbSO4+2Fe2+;②取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去。
(3)①A、B;②将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤得到PbO固体。
28.(16分)(1)2Ag++SO32—Ag2SO3↓。
(2)①有红色固体生成;②a. HCl和BaCl2溶液。
b.在I-的作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-。
(3)①Al3+、OH-。
②a、,b、V1明显大于V2。
(4)亚硫酸盐的溶解性、氧化还原性、在水溶液中的酸碱性;两种盐溶液中阴阳离子的性质和反应条件。
