离子方程式人教版高中化学必修一教学课件
合集下载
人教版高一化学必修一教学课件《22离子反应--离子方程式书写》(共22张)

一定要搞清本质!
2020/12/18
4
❖电解质和非电解质
讨论一:判断一个物质是否是电解质的依据是什么? 讨论二:判断SO2、Cl2、NH3、盐酸是否是电解质? 讨论三:电解质在水溶液中和熔融状态下都能导电? 讨论四:化合物不是电解质就是非电解质? 讨论五:氧化钠溶于水能导电,所以它是电解质。 讨论六:固体氯化钠不导电,所以它不是电解质?
? 我是强电解质,我更亮!
16
二、离子反应 1、概念: 2、判断依据:
电解质在溶液中的反应 电解质在溶液中进行(有离子参加的反应)
在水作用下 2、电离方程式
完全电离 部分电离
2020/12/18
13
3、电离方程式的书写 (1)强电解质——完全电离,用“=”
(2)弱电解质——部分电离,用“ ”
练习:下列物质中是电解质的写出电离方程式: H2SO3、HClO、 Cl2、 CH3COOH、 Ba(OH)2、 Cu(OH)2 、 NH3、 NH3·H2O、 KCl、CaCO3、Na2SO4、 CO2、 H2O 、KMnO4、H2SO4 、AgNO3、 NaHSO4、NaHCO3、
注意区别!
2020/12/18
10
❖强电解质和弱电解质
讨论一:强电解质溶液的导电能力一定强? 讨论二:难溶物一定是弱电解质? 讨论三:强电解质溶液的导电能力一定强于弱电解质?
讨论四:同浓度的强电解质溶液的导电能力一定强于弱 电解质溶液的导电能力?
讨论五:弱电解质一定不完全电离?
❖问题与讨论
2020/12/18
11
练习:
1、下列各项中的物质能导电且属于强电解质的是( )
A、固态氯化镁(MgCl2)
B、液态氯化镁(MgCl2)
人教版化学必修一离子反应教学课件

人教版化学必修一离子反应
人教版化学必修一离子反应
练习2、写出下列反应的离子方程式
NaOH+H2SO4
KOH+HNO3
H++OH-=H2O
Ba(OH)2+HCl
小结:酸碱反应的实质:
由酸电离出来的H+与由碱电离 出来的OH-结合生成了H2O
H++OH-=H2O
人教版化学必修一离子反应
人教版化学必修一离子反应
3:下列各反应中,能用离子方程
式 H++OH-=H2O 表示的是(A)
A、硫酸氢钠溶液和氢氧化钾溶液 反应 B、盐酸和氨水反应 C、稀硫酸和氢氧化钡溶液反应 D、碳酸溶液和石灰水反应
4、下列离子方程式中正确的是( A )
A、向碳酸钠溶液中加入盐酸 CO32-+ 2H+ = CO2 ↑+H2O
B、单质铁和三氯化铁溶液反应生成氯化亚铁
人教版化学必修一离子反应
人教版化学必修一离子反应
作业
课后练习P33-34 课作:T10,其余做在书上。
人教版化学必修一离子反应
2H+ + CO32- = H2O + CO2↑ 本质:溶液中某些离子浓度减少。
练习: 1.下列各组中,所含物质间能发生离子反
应的是( D )
A.KNO3溶液与Na2SO4溶液
B.FeSO4溶液与盐酸
C.NaCl溶液与稀硫酸
D.BaCl2溶液与K2SO4溶液
2.下列化学方程式中,不能用 Ba2++SO42-=BaSO4 表示的是(A.C )
(3)离子方程式的意义 不仅能表示某个具体的化学
反应,而且还可以表示同一类型 的离子反应。
人教版化学必修一离子反应
练习2、写出下列反应的离子方程式
NaOH+H2SO4
KOH+HNO3
H++OH-=H2O
Ba(OH)2+HCl
小结:酸碱反应的实质:
由酸电离出来的H+与由碱电离 出来的OH-结合生成了H2O
H++OH-=H2O
人教版化学必修一离子反应
人教版化学必修一离子反应
3:下列各反应中,能用离子方程
式 H++OH-=H2O 表示的是(A)
A、硫酸氢钠溶液和氢氧化钾溶液 反应 B、盐酸和氨水反应 C、稀硫酸和氢氧化钡溶液反应 D、碳酸溶液和石灰水反应
4、下列离子方程式中正确的是( A )
A、向碳酸钠溶液中加入盐酸 CO32-+ 2H+ = CO2 ↑+H2O
B、单质铁和三氯化铁溶液反应生成氯化亚铁
人教版化学必修一离子反应
人教版化学必修一离子反应
作业
课后练习P33-34 课作:T10,其余做在书上。
人教版化学必修一离子反应
2H+ + CO32- = H2O + CO2↑ 本质:溶液中某些离子浓度减少。
练习: 1.下列各组中,所含物质间能发生离子反
应的是( D )
A.KNO3溶液与Na2SO4溶液
B.FeSO4溶液与盐酸
C.NaCl溶液与稀硫酸
D.BaCl2溶液与K2SO4溶液
2.下列化学方程式中,不能用 Ba2++SO42-=BaSO4 表示的是(A.C )
(3)离子方程式的意义 不仅能表示某个具体的化学
反应,而且还可以表示同一类型 的离子反应。
化学课件《离子方程式》优秀ppt-人教版

如:弱酸、弱减、少数盐、水
(3)强电解质电离方程式
如: NaCl== Na+ + Cl-
这正是NaCl溶液导电的原因
思考: CuSO4 、 BaCl2 、 CuCl2是否为强电
解质?若是请写出电离方程式。
2、书写离子方程式 NaOH + CuSO4 ⑴写:正确书写化学方程式(符合事实)
2NaOH+CuSO4 =Cu(OH)2 +Na2SO4 ⑵拆:将强酸、强碱、易溶于水的盐拆成离子
C、铜片插入硝酸银溶液中: ( 错 )
Cu + Ag+ = Cu2+ + Ag
D、稀盐酸滴在石灰石上: ( 错 )
CO32- + 2H+ = H2O + CO2
8、离子共存(离子之间不发生反应)
判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3- 生成难溶物 CaCO3
② Ca2+ Na+ SO42- NO3- 生成微溶物 CaSO4
③ H+ K+ Cl- OH-
生成水H2O
④ NH4+ K+ OH- SO42- 生成 NH3 ·H2O
⑤ H+ K+ HCO3- SO42- 生成 气体 CO2
⑥ Na+ K+ CO32- OH-
⑦ K+ H+ NO3- Fe2+
能大量共存 Fe2+被氧化成 Fe3+
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
(3)强电解质电离方程式
如: NaCl== Na+ + Cl-
这正是NaCl溶液导电的原因
思考: CuSO4 、 BaCl2 、 CuCl2是否为强电
解质?若是请写出电离方程式。
2、书写离子方程式 NaOH + CuSO4 ⑴写:正确书写化学方程式(符合事实)
2NaOH+CuSO4 =Cu(OH)2 +Na2SO4 ⑵拆:将强酸、强碱、易溶于水的盐拆成离子
C、铜片插入硝酸银溶液中: ( 错 )
Cu + Ag+ = Cu2+ + Ag
D、稀盐酸滴在石灰石上: ( 错 )
CO32- + 2H+ = H2O + CO2
8、离子共存(离子之间不发生反应)
判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3- 生成难溶物 CaCO3
② Ca2+ Na+ SO42- NO3- 生成微溶物 CaSO4
③ H+ K+ Cl- OH-
生成水H2O
④ NH4+ K+ OH- SO42- 生成 NH3 ·H2O
⑤ H+ K+ HCO3- SO42- 生成 气体 CO2
⑥ Na+ K+ CO32- OH-
⑦ K+ H+ NO3- Fe2+
能大量共存 Fe2+被氧化成 Fe3+
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
人教版化学必修一离子反应---离子方程式PPT

1、概念: 离子反应:有离子参加的反应: 离子方程式:用实际参加反应的离子的 符号来表示离子反应的式子。 2、离子方程式的书写步骤: 一写、二拆、三删、四查 3、复分解型离子反应发生的条件: 生成沉淀、放出气体或生成水
请批评指正
19、当你用烦恼心来面对事物时,你会觉得一切都是业障,世界也会变得丑陋可恨。 3 、每件事情都必须有一个期限,否则,大多数人都会有多少时间就花掉多少时间。。 19、蔚蓝的天空下,阳光普照,让我们沐浴和煦的阳光,共同分享成长的苦与乐。让我们一起,祝福青春,把握青春,享受青春。 13 、障碍与失败,是通往成功最稳靠的踏脚石,肯研究、利用它们,便能从失败中培养出成功。 5、不要为没有达到目标而沮丧,因为你在出发前就已经明白了挫折的意义。这成长的烦恼,也正是我成长的快乐,我应该从容地面对它。唯 有挫折,才能让我进步,让我迈向成功的方向,为我修建成功的道路。
(1)看是否符合客观事实 2Fe+6H+ ====2Fe3++3H2↑
(2)看质量是否守恒 Al+3H+ ==== Al3++H2↑
(3)看电荷是否守恒 Ag++Cu= Cu 2++Ag ↓ (4)看是否符合拆分原则
碳酸钙和稀硫酸反应 CO32-+2H+ ==== H2O+CO2↑ (5)看是否漏掉参加反应的离子
离子反应方程式的 书写及正误判断
《三国演义》中有这样一个故事:诸葛亮第四次释放孟 获后,孟获逃至秃龙洞,秃龙洞的毒泉中有一个“哑 泉”,“人若饮之,则不能言,不过旬日必死”。不久, 蜀军先锋王平率数百军士前来探路,由于天气炎热,人 马均争先恐后误喝了哑泉水。军士们个个说不出话来, 生命危在旦夕,诸葛亮也毫无办法.后经一老叟指点, 喝了万安溪安乐泉水后转危为安。大家能解释其中的道 理吗?
1.2.2 离子反应及离子方程式 课件 高一上学期化学人教版(2019)必修第一册

写出NaHSO4的电离方程式: 水溶液中: NaHSO4 = Na+ + H+ + SO42熔融状态 NaHSO4 = Na+ + HSO4它是强酸强碱盐吗?水溶液显什么性?
从分类角度看,具有双重性质,你认为它具有哪两个物质的性质?
它是怎么来的,如何制备?
NaHCO3 的电离方程式如何书写?不同状态写法一样吗~ NaHCO3 = Na+ + HCO3 -
如:碳酸钡和稀硝酸反应 CO32-+2H+ ==== H2O+CO2↑ BaCO3+2H+ ==== Ba2++H2O+CO2↑
Ba2++OH-+H++SO42====BaSO4↓+H2O
Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
(3)是否守恒(三大:原子、电荷、化合价升降)
如何书写离子方程式,即用实际参加反应的离子来表示反应的式子
1.写 写出反应的化学方程式
BaCl2 Na2SO4 BaSO4 2NaCl
2.拆 强酸、强碱、可溶性盐
Ba2 2Cl 2Na SO42 BaSO4 2Na 2Cl
可的 拆物 成质 离 子
强酸:HCl、HNO3、H2SO4 强碱:NaOH、KOH、Ba(OH)2 可溶性盐:钾盐、钠盐、铵盐、硝酸盐及其它
② NaOH溶液与HNO3溶液 能 生成了H2O ③ Zn与CuSO4溶液( 能)在溶液中发生了置换反应
④NH4Cl溶液和NaOH溶液 ( 能 )生成了弱碱
写出Na2CO3与CaCl2溶液反应的离子方程式。
人教版高中化学必修一 《离子反应》PPT

第十五页,共四十一页。
核心突破 攻重难
第十六页,共四十一页。
离子方程式的书写与正误判断
1.书写离子方程式的注意事项 (1)微溶物处理方式有三种情况。 ①出现在生成物中写化学式。 ②反应物处于溶液状态写离子符号。 ③反应物处于浊液或固态时写化学式。
第十七页,共四十一页。
(2)溶液中铵盐与碱反应加热放出 NH3,不加热写 NH3·H2O。 (3)浓盐酸、浓硝酸在离子方程式中写离子符号,浓硫酸保留化 学式。 (4)HCO-3 、HS-、HSO-3 等弱酸的酸式酸根离子不能拆开写。 (5)单质、氧化物保留化学式。
第九页,共四十一页。
2.离子共存 (1)几种离子在溶液中能否大量共存,取决于它们之间是否发生 反应。 (2)在溶液中若离子之间不发生反应,则能大量共存;否则不能 大量共存。
第十页,共四十一页。
1.判断正误(正确的打“√”,错误的打“×”) (1)离子反应中参加反应的全是离子( ) (2)CuSO4 溶液与 BaCl2 溶液反应,实质上是 SO24-和 Ba2+生成 BaSO4 的反应( ) (3)CaCO3 与 HCl 溶液反应的离子方程式:CO23-+2H+===H2O +CO2↑( )
第十八页,共四十一页。
2.离子方程式正误判断 (1)看是否符合客观事实。 (2)看拆分是否正确。 (3)看是否符合原子守恒和电荷守恒。 (4)看是否漏写离子反应。
第十九页,共四十一页。
1.下列反应的离子方程式书写正确的是( ) A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑ B.稀硫酸与 Ba(OH)2 溶液混合:SO24-+Ba2+===BaSO4↓ C.稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3 D.氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
核心突破 攻重难
第十六页,共四十一页。
离子方程式的书写与正误判断
1.书写离子方程式的注意事项 (1)微溶物处理方式有三种情况。 ①出现在生成物中写化学式。 ②反应物处于溶液状态写离子符号。 ③反应物处于浊液或固态时写化学式。
第十七页,共四十一页。
(2)溶液中铵盐与碱反应加热放出 NH3,不加热写 NH3·H2O。 (3)浓盐酸、浓硝酸在离子方程式中写离子符号,浓硫酸保留化 学式。 (4)HCO-3 、HS-、HSO-3 等弱酸的酸式酸根离子不能拆开写。 (5)单质、氧化物保留化学式。
第九页,共四十一页。
2.离子共存 (1)几种离子在溶液中能否大量共存,取决于它们之间是否发生 反应。 (2)在溶液中若离子之间不发生反应,则能大量共存;否则不能 大量共存。
第十页,共四十一页。
1.判断正误(正确的打“√”,错误的打“×”) (1)离子反应中参加反应的全是离子( ) (2)CuSO4 溶液与 BaCl2 溶液反应,实质上是 SO24-和 Ba2+生成 BaSO4 的反应( ) (3)CaCO3 与 HCl 溶液反应的离子方程式:CO23-+2H+===H2O +CO2↑( )
第十八页,共四十一页。
2.离子方程式正误判断 (1)看是否符合客观事实。 (2)看拆分是否正确。 (3)看是否符合原子守恒和电荷守恒。 (4)看是否漏写离子反应。
第十九页,共四十一页。
1.下列反应的离子方程式书写正确的是( ) A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑ B.稀硫酸与 Ba(OH)2 溶液混合:SO24-+Ba2+===BaSO4↓ C.稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3 D.氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
高中化学 第二章 第三节 离子方程式课件 新人教版必修1
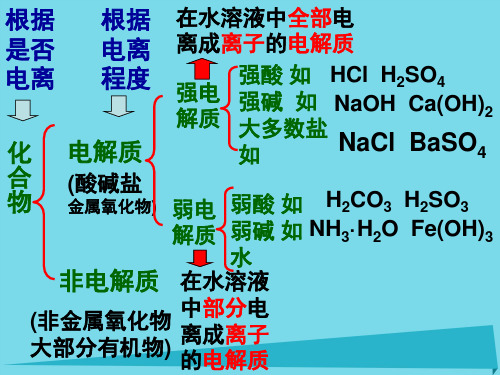
根据 根据 在水溶液中全部电
是否 电离 离成离子的电解质
电离 程度 化 电解质
强电 解质
强酸 如 HCl H2SO4 强碱 如 NaOH Ca(OH)2 大多数盐
如
NaCl BaSO4
合 物
(酸碱盐 金属氧化物) 弱电 弱酸 如 H2CO3 H2SO3
解质 弱碱 如 NH3·H2O Fe(OH)3
水
(6) OH- + HCO3- = H2O+CO32- ________________
T5、下列离子方程式中正确的是(D )
A、澄清石灰水与稀盐酸反应 Ca(OH)2+2H+===Ca2++2H2O
B、氢氧化钡与硫酸反应 OH- + H+=H2O
C、铜片插入硝酸银溶液中 Cu + Ag+=Cu2++Ag
•
蓝色字体部分暂时先了解即可
从上面的例子可以知道,发生离子反应以后 溶液中某些离子的数量会减少或种类会改变。
思考与交流 写出下列反应的离子方程式:
①HCl+NaOH
②H2SO4+KOH ③HNO3+Ba(OH)2
H++OH-== H2O
2、离子方程式
(3)离子方程式的意义:
离子方程式不仅可表示一定物质间的反应, 而且可表示所有同一类型的反应。
⑶强酸性溶液中肯定不存在与H+ 反应的离子。
1、下列离子在水溶液中,能大量共存的是 A、Na+ 、 K+ 、 CO32-、H+ B、Fe3+、K+ 、 Cl-、 OH- C、K+ 、NH4+ 、 H+ 、SO42- D、 Ba2+、Cu2+ 、NO3- 、SO42-
是否 电离 离成离子的电解质
电离 程度 化 电解质
强电 解质
强酸 如 HCl H2SO4 强碱 如 NaOH Ca(OH)2 大多数盐
如
NaCl BaSO4
合 物
(酸碱盐 金属氧化物) 弱电 弱酸 如 H2CO3 H2SO3
解质 弱碱 如 NH3·H2O Fe(OH)3
水
(6) OH- + HCO3- = H2O+CO32- ________________
T5、下列离子方程式中正确的是(D )
A、澄清石灰水与稀盐酸反应 Ca(OH)2+2H+===Ca2++2H2O
B、氢氧化钡与硫酸反应 OH- + H+=H2O
C、铜片插入硝酸银溶液中 Cu + Ag+=Cu2++Ag
•
蓝色字体部分暂时先了解即可
从上面的例子可以知道,发生离子反应以后 溶液中某些离子的数量会减少或种类会改变。
思考与交流 写出下列反应的离子方程式:
①HCl+NaOH
②H2SO4+KOH ③HNO3+Ba(OH)2
H++OH-== H2O
2、离子方程式
(3)离子方程式的意义:
离子方程式不仅可表示一定物质间的反应, 而且可表示所有同一类型的反应。
⑶强酸性溶液中肯定不存在与H+ 反应的离子。
1、下列离子在水溶液中,能大量共存的是 A、Na+ 、 K+ 、 CO32-、H+ B、Fe3+、K+ 、 Cl-、 OH- C、K+ 、NH4+ 、 H+ 、SO42- D、 Ba2+、Cu2+ 、NO3- 、SO42-
高中化学新课标人教版必修一离子反应课件

水
高中化学新课标人教版必修一离子反应 课件
NaCl的电离
电离方程式
NaCl
Na+ +
高中化学新课标人教版必修一离子反应 课件
Cl-
酸的电离方程式
HCl
H+ + Cl-
HNO3
H2SO4
H+ + NO3-
2H+ + SO42-
电离时生成的阳离子全部都是H+的化合物叫 酸
高中化学新课标人教版必修一离子反应 课件
2、让学生掌握离子反应及离子方程式的定义, 使学生对离子反应及离子方程式有了初步的印象, 为下节课的进一步的学习打下基础。
1、掌握离子方程式的书写方法;
2、了解离子方程式的意义,掌握离子反应发生的 条件;
3、学会判断离子方程式的正误,掌握离子共存问
题。
高中化学新课标人教版必修一离子反应
课件
【教学重点】 1、电解质、非电解质的概念; 2、离子反应、离子方程式的定义。 3、离子方程式的书写方法、正误判断及
化合物叫盐
高中化学新课标人教版必修一离子反应
课件
书写电离方程式要注意什么?
1、正确书写离子符号
H2SO4
H2++ SO42-
2、遵守质量守恒定律和电荷守恒定律
MgCl2
Mg2++ Cl-
FeCl3
Fe2+ + 3Cl-
高中化学新课标人教版必修一离子反应 课件
练一练
书写下列物质的电离方程式
Ba(OH)2、AlCl3、FeSO4、Fe(NO3)3
5、大多数有机物和非金属氧化物是非 电解质
高中化学新课标人教版必修一离子反应 课件
高中化学新课标人教版必修一离子反应 课件
NaCl的电离
电离方程式
NaCl
Na+ +
高中化学新课标人教版必修一离子反应 课件
Cl-
酸的电离方程式
HCl
H+ + Cl-
HNO3
H2SO4
H+ + NO3-
2H+ + SO42-
电离时生成的阳离子全部都是H+的化合物叫 酸
高中化学新课标人教版必修一离子反应 课件
2、让学生掌握离子反应及离子方程式的定义, 使学生对离子反应及离子方程式有了初步的印象, 为下节课的进一步的学习打下基础。
1、掌握离子方程式的书写方法;
2、了解离子方程式的意义,掌握离子反应发生的 条件;
3、学会判断离子方程式的正误,掌握离子共存问
题。
高中化学新课标人教版必修一离子反应
课件
【教学重点】 1、电解质、非电解质的概念; 2、离子反应、离子方程式的定义。 3、离子方程式的书写方法、正误判断及
化合物叫盐
高中化学新课标人教版必修一离子反应
课件
书写电离方程式要注意什么?
1、正确书写离子符号
H2SO4
H2++ SO42-
2、遵守质量守恒定律和电荷守恒定律
MgCl2
Mg2++ Cl-
FeCl3
Fe2+ + 3Cl-
高中化学新课标人教版必修一离子反应 课件
练一练
书写下列物质的电离方程式
Ba(OH)2、AlCl3、FeSO4、Fe(NO3)3
5、大多数有机物和非金属氧化物是非 电解质
高中化学新课标人教版必修一离子反应 课件
人教版高中化学必修1:离子反应_课件42

弱酸:HF、HClO 等。 过渡元素中的常见弱碱:Fe(OH)3、Fe(OH)2、Cu(OH)2、Zn(OH)2 等。
考点一
知识梳理
递进题组
返回
递进题组
题组一
1
题组二
2
3
考点一
知识梳理
递进题组
返回
递进题组
题组一
1
题组二
2
3
题组一 电离方程式的书写——理解离子反应的基石
1.写出下列典型物质的电离方程式 (1)H2SO4___H_2_S_O_4_=_=_=_2_H__+_+__S_O_24_-_______________; (2)H2CO3_H_2_C_O_3_=_=_=_H_+_+__H_C__O_- 3_、_H__C_O_- 3_=_=_H_+_+__C_O__23-____; (3)Ca(OH)2_C__a(_O_H__)_2=_=_=_C__a_2+_+__2_O__H_-____________; (4)Fe(OH)3__F_e_(O__H_)3_=_=_=_F_e_3+_+__3_O_H_-______________; (5)NH3·H2O_N_H__3·_H_2_O_=_=_=_N_H_+ 4_+__O_H__-_____________; (6)NaCl__N__aC__l=_=_=__N_a_+_+__C_l_-___________________;
考点一
知识梳理
递进题组
返回
知识梳理
2.判断正误,正确的划“√”,错误的划“×”
(1)强电解质溶液的导电性比弱电解质溶液的导电
性强。
( ×)
解析 电解质溶液导电性的强弱与溶液中离子浓
度的大小及所带电荷数的多少有关,与电解质强弱
考点一
知识梳理
递进题组
返回
递进题组
题组一
1
题组二
2
3
考点一
知识梳理
递进题组
返回
递进题组
题组一
1
题组二
2
3
题组一 电离方程式的书写——理解离子反应的基石
1.写出下列典型物质的电离方程式 (1)H2SO4___H_2_S_O_4_=_=_=_2_H__+_+__S_O_24_-_______________; (2)H2CO3_H_2_C_O_3_=_=_=_H_+_+__H_C__O_- 3_、_H__C_O_- 3_=_=_H_+_+__C_O__23-____; (3)Ca(OH)2_C__a(_O_H__)_2=_=_=_C__a_2+_+__2_O__H_-____________; (4)Fe(OH)3__F_e_(O__H_)3_=_=_=_F_e_3+_+__3_O_H_-______________; (5)NH3·H2O_N_H__3·_H_2_O_=_=_=_N_H_+ 4_+__O_H__-_____________; (6)NaCl__N__aC__l=_=_=__N_a_+_+__C_l_-___________________;
考点一
知识梳理
递进题组
返回
知识梳理
2.判断正误,正确的划“√”,错误的划“×”
(1)强电解质溶液的导电性比弱电解质溶液的导电
性强。
( ×)
解析 电解质溶液导电性的强弱与溶液中离子浓
度的大小及所带电荷数的多少有关,与电解质强弱
人教版高中化学必修一课件:2.2 离子反应(共58张PPT)

例.请判断下列物质哪些是强电解质?哪些是
弱电解质?并写出各自的电离方程式。
(1)HCl、H2SO4、CH3COOH、H2CO3 (2)NaOH、Ba(OH)2、NH3· H2O、 Cu(OH)2 (3)NaCl、Fe2(SO4)3 、 NaHCO3、NaHSO4
(2)电离方程式:
①左边写化学式,表示电解质未电离时的状态, 右边写离子符号,表示电解质电离产生的离子 ②遵循质量守恒定律,即在方程式的两边,原子的种 类和数目必须相等 ③遵循电荷守恒原理,即在电解质溶液中,阳离子所带 正电荷总数等于阴离子所带负电荷总数
⑥ NaHCO3 ⑦NaCl溶液 ⑧ CaCO3 ⑨ CO2
哪些属于非电解质?
⑩ 熔融的Al2O3
注意: (1)电解质、非电解质一定是化合物,不能是 单质或混合物。
(2)电解质导电只须符合条件之一,且自身离解。
【问题】为什么灯泡有明有暗? 1mol/L 氯化钠 溶液
1mol/L 醋酸 溶液
影响电解质溶液导电能力强弱的因素 1、自由移动的离子的浓度 2、离子所带电荷数的多少
OH- + H+ =H2O
Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
【实验分析】
向烧杯中加入一定量的 Ba(OH)2溶液,滴加几滴酚酞, 再向烧杯中逐滴滴加稀H2SO4 溶液,搅拌,观察溶液中的现 象和小灯泡亮度的变化。
④强电解质的电离方程式(中间用=) HCl = H+ + Cl酸:电离时生成的阳离子 H2SO4 = 2H+ + SO4
离子方程式课件人教版高中化学必修一

CuSO4 +BaCl2=BaSO4↓+CuCl2
Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl-
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
2Na++CO32-+2H++2Cl- =2Na++2Cl-+CO2↑+ H2O
离子反应总是向着降低某种离子浓度,减少某种离子数目 的方向进行.
2.2.2 离子方程式 课件 人教版高中化学必修一(共25张PPT)
离子反应
1、概念: 有离子参加或生成的化学反应。
2、复分解反应型的离子反应(实质上就是两种电
解质在溶液中相互交换离子的反应)发生的条件:
(1)生成难溶性物质(见溶解性表) (2)生成挥发性物质 (3)生成难电离物质(水、弱酸、弱碱等)
Байду номын сангаас硫酸钠溶液与氯化钡溶液混合
2
2.2.2 离子方程式 课件 人教版高中化学必修一(共25张PPT)
2.2.2 离子方程式 课件 人教版高中化学必修一(共25张PPT)
[关键一点] 离子方程式的书写的关键是“拆”
把易溶于水并且易电离的物质改写成离子的形式 (难溶物,难电离物质,气态物质、单质、氧化物仍用化学式表示)
BaCl2 + H2SO4
不能 能 能 能
2.下列反应属于离子反应的是 ( B )
A.H2和O2反应生成水 C.KClO3加热分解制取O2
B.锌片投入稀硫酸中 D.H2还原 CuO
2.2.2 离子方程式 课件 人教版高中化学必修一(共25张PPT)
Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl-
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
2Na++CO32-+2H++2Cl- =2Na++2Cl-+CO2↑+ H2O
离子反应总是向着降低某种离子浓度,减少某种离子数目 的方向进行.
2.2.2 离子方程式 课件 人教版高中化学必修一(共25张PPT)
离子反应
1、概念: 有离子参加或生成的化学反应。
2、复分解反应型的离子反应(实质上就是两种电
解质在溶液中相互交换离子的反应)发生的条件:
(1)生成难溶性物质(见溶解性表) (2)生成挥发性物质 (3)生成难电离物质(水、弱酸、弱碱等)
Байду номын сангаас硫酸钠溶液与氯化钡溶液混合
2
2.2.2 离子方程式 课件 人教版高中化学必修一(共25张PPT)
2.2.2 离子方程式 课件 人教版高中化学必修一(共25张PPT)
[关键一点] 离子方程式的书写的关键是“拆”
把易溶于水并且易电离的物质改写成离子的形式 (难溶物,难电离物质,气态物质、单质、氧化物仍用化学式表示)
BaCl2 + H2SO4
不能 能 能 能
2.下列反应属于离子反应的是 ( B )
A.H2和O2反应生成水 C.KClO3加热分解制取O2
B.锌片投入稀硫酸中 D.H2还原 CuO
2.2.2 离子方程式 课件 人教版高中化学必修一(共25张PPT)
人教版化学必修一2.2离子反应(共25页ppt)

是氢氧根离子(OH-)的化合物 Ca(OH)2
电解质电离时生成的阳离子是
盐 金属离子或铵根离子(NH4+),
阴离子是酸根离子的化合物
NaCl NH4NO3
人教版化学必修一2.2离子反应(共25 张ppt )
人教版化学必修一2.2离子反应(共25 张ppt )
练习: 以下中学化学常见的物质:
①Cu②NaCl③NaHSO4④SO3⑤H2SO4⑥C2H5OH ⑦CaCO3⑧BaSO4⑨Cu(OH)2⑩Fe(OH)3⑪NaOH ⑫NH3·H20 请按下列分类标准回答问题:
人教版化学必修一2.2离子反应(共25 张ppt )
二、离子反应及其发生的条件 1、离子反应 (1)、定义:有离子参加或生成的反应
如:向稀HCl中加入AgNO3溶液 再如:实验室制取CO2 (2)、离子反应的特点: 离子反应总是向着某种离子浓度减小 的方向进行
人教版化学必修一2.2离子反应(共25 张ppt )
人教版化学必修一2.2离子反应(共25 张ppt )
4、离子反应发生的条件 (1)生成难溶于水的物质
如:硝酸银溶液和氯化钠溶液 (2)生成难电离的物质
(H2O、弱酸、弱碱等) 如:硫酸和氢氧化钠溶液 (3)生成易挥发性的物质(气体) 如:碳酸钙和稀盐酸
人教版化学必修一2.2离子反应(共25 张ppt )
第二节 离 子 反 应
许多化学反应是在水溶液中进行的
一、酸、碱、盐在水溶液中的电离 1、电解质 (1)定义:在水溶液里或熔化状态下能导电的
化合物 如:H2SO4、 NaOH、 KCl 、Na2O 范围:酸、碱、盐、活泼金属氧化物 (2)注意事项: ①电解质必须是化合物
②化合物不一定都是电解质
人教版化学必修一2.2离子反应---离子方程式优质课件PPT

答疑解惑
原来呀,哑泉当中含有较多的CuSO4 ,人体喝了含 铜盐的水就会中毒,引起说话不清,呕吐腹泻,最
后虚脱而死。万安溪安乐泉水中含有较多的碱,在
人体误食CuSO4后,大量饮此泉水,其中碱先中和 了胃酸,然后多余的碱又会在胃肠中与CuSO4发生 离子反应Cu2++2OH-====Cu(OH)2↓。致使原来会 使 人 体 吸 收 的 可 溶 性 铜 盐 变 成 不 溶 性 的 Cu(OH)2 沉 淀而不再会被吸收,因此,具有解毒作用。
Na2SO4 +BaCl2 ==== BaSO4 ↓+2NaCl
3、反应物的电离方程式怎么写?
B-aCl2====Ba2++2ClNa2SO4==== 2Na ++SO42-
4、反应的实质是什么?
用实际参加反应的 离子的符号来表示 离子反应的式子叫 做离子方程式
Ba2++ SO42-====BaSO4 ↓
1、概念: 离子反应:有离子参加的反应: 离子方程式:用实际参加反应的离子的 符号来表示离子反应的式子。 2、离子方程式的书写步骤: 一写、二拆、三删、四查 3、复分解型离子反应发生的条件: 生成沉淀、放出气体或生成水
请批评指正
我们很容易遭遇逆境,也很容易被一次次的失败打垮。但是人生不容许我们停留在失败的瞬间,如果不前进,不会自我激励的话,就注定只能被这个世界抛弃。自我激 组成部分,主要表现在对于在压力或者困境中,个体自我安慰、自我积极暗示、自我调节的能力,在个体克服困难、顶住压力、勇对挑战等情况下,都发挥着关键性的 有弹性,经常表现出反败为胜、后来居上、东山再起的倾向,而缺乏这种能力的人,在逆境中的表现就大打折扣,表现为过分依赖外界的鼓励和支持。一个小男孩在自 ,对自己大喊:“我是世界上最棒的棒球手!”然后扔出棒球,挥动……但是没有击中。接着,他又对自己喊:“我是世界上最棒的棒球手!”扔出棒球,挥动依旧没 棒和球,然后用更大的力气对自己喊:“我是世界上最棒的棒球手!”可是接下来的结果,并未如愿。男孩子似乎有些气馁,可是转念一想:我抛球这么刁,一定是个 己喊:“我是世界上最棒的挥球手!”其实,大多数情况下,很多人做不到这看似荒谬的自我鼓励,可是,这故事却深深反映了这个男孩子自我鼓励下的执著,而这执
人教版高中化学必修一 离子反应 教学课件

探究一
探究二
素养脉络
随堂检测
离子方程式的书写与正误判断 问题探究 1.判断下列离子方程式的正误,并指出错误的原因。
(1)盐酸与Cu(OH)2反应:H++OH-=H2O(
(2)CuO溶于盐酸:O2-+2H+=H2O(
(3)Na2CO3溶液与稀硫酸反
应:Na2CO3+2H+=2Na++CO2↑+H2O(
(1)生成难溶物或微溶物。如 Ba2+与 CO32-、SO42-,Ag+与 Cl-,Fe3+、 Ca2+与 OH-等。
(2)生成气体或挥发性物质。如 NH4+与 OH-,H+与 CO32-、HCO3- 等。 (3)生成难电离物质。如 H+与 CH3COO-、CO32-、HCO3- 、S2-、HS-、 SO32-、HSO3- 等生成难电离的酸;OH-与 NH4+生成难电离的碱;H+与 OH-生成水等。
离子方程 式
H++OHH2O
H++OHH2O
H++OHH2O
H++OHH2O
两种方程式 的异同
4 个反应的化学方 程式不同,但其离 子方程式却相同
结论:强酸与强碱发生中和反应的实质是,强酸电离出的H+与强 碱电离出的OH-结合生成H2O。
知识铺垫
新知预习
自主测试
课前篇自主预习
②离子方程式的意义
离子方程式不仅可以表示某个具体的化学反应,还可以表示同一 类型的离子反应。
课堂篇探究学习
探究一
探究二
素养脉络
随堂检测
人教版化学必修一离子反应教学课件

人教版化学必修一离子反应(共48页)
人教版化学必修一离子反应(共48页)
小结:电解质与非电解质
⑴酸、碱、盐、水和部分金属氧化物是
电解质。 ⑵大多数有机物和非金属氧化物是非 电解质。
人教版化学必修一离子反应(共48页)
人教版化学必修一离子反应(共48页)
2、强电解质和弱电解质:
强酸:盐酸、硫酸、硝酸等
⑴生成难溶物或微溶物: 如:Ba2+与CO32-、Ag+与Br-、 Ca2+与SO42-等
⑵生成气体或挥发性物质: 如:NH4+与OH-、H+与CO32-、HCO3-、S2-
HS-、SO32-、HSO3-等
⑶生成难电离物质(即弱电解质): 如:H+与Ac-、CO32-、S2-、SO32-等生
成弱酸;OH-与NH4+生成的弱碱; H+与OH-生成水
④、查:整理方程式并检查两边各元素 的原子个数和电荷总数是否相等,系数约 成最简整数比。
2Ag+ + 2Cl- == 2AgCl↓
Ag+ + Cl- == AgCl↓
练一练:用离子方程式表示下列反应:
1、盐酸与氢氧化钠溶液中和 H+ + OH- == H2O
2、硫酸中加入氢氧化钾溶液 H+ + OH- == H2O
NaCl
Na+ + Cl-
人教版化学必修一离子反应(共48页)
人教版化学必修一离子反应(共48页)
酸的电离方程式
HCl
H+ + Cl-
酸的电解有什么 共同特点呢?
HNO3
H2SO4
H+ + NO3-
人教版化学必修一离子反应(共48页)
小结:电解质与非电解质
⑴酸、碱、盐、水和部分金属氧化物是
电解质。 ⑵大多数有机物和非金属氧化物是非 电解质。
人教版化学必修一离子反应(共48页)
人教版化学必修一离子反应(共48页)
2、强电解质和弱电解质:
强酸:盐酸、硫酸、硝酸等
⑴生成难溶物或微溶物: 如:Ba2+与CO32-、Ag+与Br-、 Ca2+与SO42-等
⑵生成气体或挥发性物质: 如:NH4+与OH-、H+与CO32-、HCO3-、S2-
HS-、SO32-、HSO3-等
⑶生成难电离物质(即弱电解质): 如:H+与Ac-、CO32-、S2-、SO32-等生
成弱酸;OH-与NH4+生成的弱碱; H+与OH-生成水
④、查:整理方程式并检查两边各元素 的原子个数和电荷总数是否相等,系数约 成最简整数比。
2Ag+ + 2Cl- == 2AgCl↓
Ag+ + Cl- == AgCl↓
练一练:用离子方程式表示下列反应:
1、盐酸与氢氧化钠溶液中和 H+ + OH- == H2O
2、硫酸中加入氢氧化钾溶液 H+ + OH- == H2O
NaCl
Na+ + Cl-
人教版化学必修一离子反应(共48页)
人教版化学必修一离子反应(共48页)
酸的电离方程式
HCl
H+ + Cl-
酸的电解有什么 共同特点呢?
HNO3
H2SO4
H+ + NO3-
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ba2+ + SO42-==== BaSO4 ↓ 注意本题的D项哦!
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
离子共存的判断 离子共存即溶液中的离子之间不能发生反应,判 断溶液中的离子能否大量共存,事实上是看离子 之间能否反应离子间若能发生反应,则不能大量 共存。(能发生复分解反应的离子不能大量共存)
离子方程式课件人教版高中化学必修 一
3、离子方程式的书写步骤 一写、二拆、三删、四查
写:(是基础) 写出正确的化学方程式
拆:(是关键) 易溶且易电离的物质(包括强酸、强碱、大多数可溶性盐)以 实际参加反应的离子符号表示, 单质、气体、氧化物、难溶物、非电解质、难电离的物质(包 括弱酸、弱碱、水等)等一律用化学式表示.
生成难溶物 CaCO3 生成微溶物 CaSO4 生成水
④ NH4+ K+ ⑤ SO42- K+ ⑥ Na+ K+
OHH+ OH-
SO42HCO3HCO3-
生成 NH3 ·H2O 生成 弱酸 H2CO3
生成CO32-和水
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
1.生成难溶或微溶物质的离子不能大量共存 (1)生成难溶性盐:Ca2+与CO32-,Ba2+与SO42-、CO32-,Ag+ 与Cl-、Br-、I-、CO32-; (2)生成难溶性碱:OH-与Fe3+、Fe2+、Mg2+、Cu2+; (3)生成微溶物质: Ag+与SO42-,Ca2+与SO42-、OH-,Mg2+与CO32-等.
离子方程式课件人教版高中化学必修 一
电解质溶于水或熔融时电离成为离子,所以电解质在水溶液中发生
的反应都是离子反应。
Cu2++H2S=CuS↓+2H+ Ag++Cl-=AgCl ↓
是不是所有的电解 质溶液混合都会发 生离子反应呢?
①生成沉淀(生成更难溶的物质);
2H++S2-=H2S↑ H+ + HCO3- = H2O+ CO2↑ ②离子之间结合成挥发性气体;
离子方程式不仅可以表示某一个具体的化学反应,而且还
可以表示同一类型的离子反应。
离子方程式 的意义
酸和碱的反应是否都用H+ + OH- = H2O表示? 请写出硫酸和氢氧化钡溶液混合的离子方程式
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ H++SO42-+Ba2++OH-=H2O+BaSO4↓ H+ + OH- = H2O是否仅表示酸碱反应?
(1)生成难溶物或微溶物 (2)生成气体或挥发性物质 (3)生成难电离的物质(弱酸、弱碱、水)
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
1.判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3② Ca2+ Na+ SO42- NO3③ H+ K+ Cl- OH-
CuSO4 +BaCl2=BaSO4↓+CuCl2
Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl-
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
2Na++CO32-+2H++2Cl- =2Na++2Cl-+CO2↑+ H2O
NaOH+HCl=NaCl+H2O Na++OH-+H++Cl-=Na++Cl-+H2O
请写出①硫酸和氢氧化钠②硝酸和氢氧化钾反应的化学方程 式和离子方程式。
H2SO4 + 2NaOH ====Na2SO4+2H2O OH-+ H+ ====H2O
KOH+HNO3====KNO3+H2O
OH-+ H+ ====H2O
由以上的题目,你得出什么结论? 异同:化学方程式不同,但离子方程式可以相同。
2、复分解反应型的离子反应(实质上就是两种电
解质在溶液中相互交换离子的反应)发生的条件:
(1)生成难溶性物质(见溶解性表) (2)生成挥发性物质 (3)生成难电离物质(水、弱酸、弱碱等)
上述三个条件中,只要具备其一,离子反应就能发生.
3、本质: 反应 一
CH3COO- +H+ = CH3COOH H+ + OH- = H2O ③离子之间结合成难电离的物质(弱酸、弱碱、水)
离子反应总是向着降低某种离子浓度,减少某种离子数目 的方向进行.
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
离子反应
1、概念: 有离子参加或生成的化学反应。
3. 下列各组中的离子,能在溶液中大量共存的是( D )
A. K+ H+ SO42- OHC. Na+ H+ Cl- CO32-
B. Na+ Ca2+ CO32- NO3D. Na+ Cu2+ Cl- SO42-
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
第二章 化学物质及其变化
§2.2 离子方程式
离子方程式课件人教版高中化学必修 一
酸: 如HCl、 HNO3、CH3COOH等
物质
混和物 纯净物
化合物 单质
电解质
碱: 如NaOH、Ca(OH)2、Mg(OH)2等 盐 可溶性盐:如NaCl、KNO3等
难溶性盐:如AgCl,BaSO4等 金属氧化物:如MgO、CaO等 水
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
4.其他隐含条件 (1) 溶液无色透明时,不存在有色离子 常见的有色离子有:Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、 MnO4-(紫红色). (2)强酸性溶液、pH小于7的溶液或使石蕊试纸变红的溶液,都 含有大量的H+,则与H+能反应的离子不能大量存在. (3)强碱性溶液、pH大于7的溶液或使酚酞试纸变红的溶液,都 含有大量的OH-,则与OH-能反应的离子不能大量存在.
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
离子方程式
定义:用实际参加反应的离子的符号来表示离子反应的 式子叫做离子方程式
怎样书写一个离子反 应的离子方程式呢?
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
物质溶解性规律: 1.所有的Na+、K+、NH4+、NO3-形成的盐都易溶于水 2.OH- :Ba2+易溶,Ca2+微溶,其余不溶 3.Cl-(Br-、I-) :AgX不溶,其余都溶 4.SO42- : BaSO4不溶、CaSO4、Ag2SO4微溶,其余都溶 5.CO32- : MgCO3微溶,其余不溶。
混合前,溶液中各存在哪些离子?请写出电离方程式。
CuSO4==== Cu 2++SO42-
BaCl2====Ba2++2Cl-
混合后,看到什么现象?溶液中又存在哪些离子?
产生了白色沉淀。
Cu 2+和 Cl-
反应的实质是: Ba2++ SO42-====BaSO4 ↓
离子方程式课件人教版高中化学必修 一
非电解质 乙醇、蔗糖等大部分有机物
及非金属氧化物:如CO、CO2等
NH3
不是电解质 也不是非电解质
三国演义“哑泉”
故事解读
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟 获逃到了秃龙洞,秃龙洞的毒泉中有一个“哑泉”,“人若饮之 ,则不能言,不过旬日必死”。不久之后,蜀军先锋王平率数百 军士前来探路,由于天气十分炎热,人马均争先恐后误喝了哑泉 的水。军士们个个都说不出话来,生命危在旦夕,诸葛亮也没有 任何办法。原因是什么呢?原因是士兵喝的水中含有 CuSO4 ,造 成了重金属中毒。后经过一位老叟指点,喝了万安溪安乐泉水后 才转危为安。原来该泉水中含有较多的碱(一般味苦),在人体误 食CuSO4后又大量的饮了此泉水,其中的碱先中和了胃酸,然后多 余的碱又会在胃肠中与CuSO4发生离子反应Cu2++2OH- ====Cu(OH)2↓。致使原来会使人体吸收的可溶性铜盐变成了不溶 性的Cu(OH)2沉淀从而不再会被吸收,所以,具有解毒作用。
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
1. 铁加入硫酸铜溶液的离子方程式为__F__e_+__C_u__2_+_=_F__e_2_+_+__C_u_
2.已知水的反应方程式为:2Na+2H2O=2NaOH +H2↑,则 该反应的离子方程式为_2_N_a_+_2_H_2_O_=_2_N_a_+__+_2_O_H_-_+_H_2↑____。
BaCO3+2H+ ==== Ba2++H2O+CO2↑
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
(5)以物质的组成为依据,看反应物或产物的配比是否正确。 如:氢氧化钡和稀硫酸 Ba2++SO42-====BaSO4↓ Ba2++OH-+H++SO42-====BaSO4↓+H2O Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
离子共存的判断 离子共存即溶液中的离子之间不能发生反应,判 断溶液中的离子能否大量共存,事实上是看离子 之间能否反应离子间若能发生反应,则不能大量 共存。(能发生复分解反应的离子不能大量共存)
离子方程式课件人教版高中化学必修 一
3、离子方程式的书写步骤 一写、二拆、三删、四查
写:(是基础) 写出正确的化学方程式
拆:(是关键) 易溶且易电离的物质(包括强酸、强碱、大多数可溶性盐)以 实际参加反应的离子符号表示, 单质、气体、氧化物、难溶物、非电解质、难电离的物质(包 括弱酸、弱碱、水等)等一律用化学式表示.
生成难溶物 CaCO3 生成微溶物 CaSO4 生成水
④ NH4+ K+ ⑤ SO42- K+ ⑥ Na+ K+
OHH+ OH-
SO42HCO3HCO3-
生成 NH3 ·H2O 生成 弱酸 H2CO3
生成CO32-和水
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
1.生成难溶或微溶物质的离子不能大量共存 (1)生成难溶性盐:Ca2+与CO32-,Ba2+与SO42-、CO32-,Ag+ 与Cl-、Br-、I-、CO32-; (2)生成难溶性碱:OH-与Fe3+、Fe2+、Mg2+、Cu2+; (3)生成微溶物质: Ag+与SO42-,Ca2+与SO42-、OH-,Mg2+与CO32-等.
离子方程式课件人教版高中化学必修 一
电解质溶于水或熔融时电离成为离子,所以电解质在水溶液中发生
的反应都是离子反应。
Cu2++H2S=CuS↓+2H+ Ag++Cl-=AgCl ↓
是不是所有的电解 质溶液混合都会发 生离子反应呢?
①生成沉淀(生成更难溶的物质);
2H++S2-=H2S↑ H+ + HCO3- = H2O+ CO2↑ ②离子之间结合成挥发性气体;
离子方程式不仅可以表示某一个具体的化学反应,而且还
可以表示同一类型的离子反应。
离子方程式 的意义
酸和碱的反应是否都用H+ + OH- = H2O表示? 请写出硫酸和氢氧化钡溶液混合的离子方程式
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ H++SO42-+Ba2++OH-=H2O+BaSO4↓ H+ + OH- = H2O是否仅表示酸碱反应?
(1)生成难溶物或微溶物 (2)生成气体或挥发性物质 (3)生成难电离的物质(弱酸、弱碱、水)
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
1.判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3② Ca2+ Na+ SO42- NO3③ H+ K+ Cl- OH-
CuSO4 +BaCl2=BaSO4↓+CuCl2
Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl-
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
2Na++CO32-+2H++2Cl- =2Na++2Cl-+CO2↑+ H2O
NaOH+HCl=NaCl+H2O Na++OH-+H++Cl-=Na++Cl-+H2O
请写出①硫酸和氢氧化钠②硝酸和氢氧化钾反应的化学方程 式和离子方程式。
H2SO4 + 2NaOH ====Na2SO4+2H2O OH-+ H+ ====H2O
KOH+HNO3====KNO3+H2O
OH-+ H+ ====H2O
由以上的题目,你得出什么结论? 异同:化学方程式不同,但离子方程式可以相同。
2、复分解反应型的离子反应(实质上就是两种电
解质在溶液中相互交换离子的反应)发生的条件:
(1)生成难溶性物质(见溶解性表) (2)生成挥发性物质 (3)生成难电离物质(水、弱酸、弱碱等)
上述三个条件中,只要具备其一,离子反应就能发生.
3、本质: 反应 一
CH3COO- +H+ = CH3COOH H+ + OH- = H2O ③离子之间结合成难电离的物质(弱酸、弱碱、水)
离子反应总是向着降低某种离子浓度,减少某种离子数目 的方向进行.
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
离子反应
1、概念: 有离子参加或生成的化学反应。
3. 下列各组中的离子,能在溶液中大量共存的是( D )
A. K+ H+ SO42- OHC. Na+ H+ Cl- CO32-
B. Na+ Ca2+ CO32- NO3D. Na+ Cu2+ Cl- SO42-
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
第二章 化学物质及其变化
§2.2 离子方程式
离子方程式课件人教版高中化学必修 一
酸: 如HCl、 HNO3、CH3COOH等
物质
混和物 纯净物
化合物 单质
电解质
碱: 如NaOH、Ca(OH)2、Mg(OH)2等 盐 可溶性盐:如NaCl、KNO3等
难溶性盐:如AgCl,BaSO4等 金属氧化物:如MgO、CaO等 水
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
4.其他隐含条件 (1) 溶液无色透明时,不存在有色离子 常见的有色离子有:Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、 MnO4-(紫红色). (2)强酸性溶液、pH小于7的溶液或使石蕊试纸变红的溶液,都 含有大量的H+,则与H+能反应的离子不能大量存在. (3)强碱性溶液、pH大于7的溶液或使酚酞试纸变红的溶液,都 含有大量的OH-,则与OH-能反应的离子不能大量存在.
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
离子方程式
定义:用实际参加反应的离子的符号来表示离子反应的 式子叫做离子方程式
怎样书写一个离子反 应的离子方程式呢?
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
物质溶解性规律: 1.所有的Na+、K+、NH4+、NO3-形成的盐都易溶于水 2.OH- :Ba2+易溶,Ca2+微溶,其余不溶 3.Cl-(Br-、I-) :AgX不溶,其余都溶 4.SO42- : BaSO4不溶、CaSO4、Ag2SO4微溶,其余都溶 5.CO32- : MgCO3微溶,其余不溶。
混合前,溶液中各存在哪些离子?请写出电离方程式。
CuSO4==== Cu 2++SO42-
BaCl2====Ba2++2Cl-
混合后,看到什么现象?溶液中又存在哪些离子?
产生了白色沉淀。
Cu 2+和 Cl-
反应的实质是: Ba2++ SO42-====BaSO4 ↓
离子方程式课件人教版高中化学必修 一
非电解质 乙醇、蔗糖等大部分有机物
及非金属氧化物:如CO、CO2等
NH3
不是电解质 也不是非电解质
三国演义“哑泉”
故事解读
《三国演义》中有这样一个故事:诸葛亮第四次释放孟获后,孟 获逃到了秃龙洞,秃龙洞的毒泉中有一个“哑泉”,“人若饮之 ,则不能言,不过旬日必死”。不久之后,蜀军先锋王平率数百 军士前来探路,由于天气十分炎热,人马均争先恐后误喝了哑泉 的水。军士们个个都说不出话来,生命危在旦夕,诸葛亮也没有 任何办法。原因是什么呢?原因是士兵喝的水中含有 CuSO4 ,造 成了重金属中毒。后经过一位老叟指点,喝了万安溪安乐泉水后 才转危为安。原来该泉水中含有较多的碱(一般味苦),在人体误 食CuSO4后又大量的饮了此泉水,其中的碱先中和了胃酸,然后多 余的碱又会在胃肠中与CuSO4发生离子反应Cu2++2OH- ====Cu(OH)2↓。致使原来会使人体吸收的可溶性铜盐变成了不溶 性的Cu(OH)2沉淀从而不再会被吸收,所以,具有解毒作用。
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
1. 铁加入硫酸铜溶液的离子方程式为__F__e_+__C_u__2_+_=_F__e_2_+_+__C_u_
2.已知水的反应方程式为:2Na+2H2O=2NaOH +H2↑,则 该反应的离子方程式为_2_N_a_+_2_H_2_O_=_2_N_a_+__+_2_O_H_-_+_H_2↑____。
BaCO3+2H+ ==== Ba2++H2O+CO2↑
离子方程式课件人教版高中化学必修 一
离子方程式课件人教版高中化学必修 一
(5)以物质的组成为依据,看反应物或产物的配比是否正确。 如:氢氧化钡和稀硫酸 Ba2++SO42-====BaSO4↓ Ba2++OH-+H++SO42-====BaSO4↓+H2O Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
