中国药科大学生物化学各章复习要点
中国药科大学现代生化药物复习资料(适用于期末、研究生入学考试)

•现代生化药学复习提要第一章 PCR1 PCR的英文全称:Polymerase chain reaction 聚合酶链式反应2 PCR是发明者:Kary Mullis 美国科学家 1985申请专利。
Perkin-Elmer Cetus公司第一台PCR扩增仪。
3 PCR的基本原理是什么?以拟扩增的DNA分子为模板,以一对分别与模板互补的寡核苷酸片段为引物,在DNA聚合酶的作用下,按照办保留复制到机制沿着模板链延伸直至完成新的DNA合成。
A.混合模板DNA,四种核糖的三磷酸盐和DNA聚合酶,加入过量的2种DNA引物,与模板中需要的序列的起始和结束区域结合。
B.加热反应液至94℃以使模板DNA的双链变成单链(变性)C.冷却至50℃,引物与模板DNA的单链结合(退火)D.升温至72℃,DNA聚合酶催化DNA复制以产生双螺旋DNA(延伸)E.重复步骤2-4至满意为止4 PCR反应的产物中一般会生成几种长度不同的产物?反应结束时他们的含量分别是怎样的?一种是与预期长度的片度,一种是比预期长度长的多的产物。
目的产物以指数级数2n增加;另一种产物以几何级数 2n增加,在总产物中所占的比重很小,可以忽略。
5 一般PCR反应中包括几种基本成份?它们的功能分别是什么?7种:模板DNA、特异性引物、热稳定DNA聚合酶、脱氧核苷三磷酸(dNTP)、二价阳离子、缓冲液及一价阳离子、石蜡油○1模板DNA:是待扩增序列的核酸,不能混有任何蛋白酶、核酸酶、TaqDNA聚合酶抑制剂、结合DNA的蛋白。
○2特异性引物:引物是靶DNA的3’端和5’端特异性结合的寡核苷酸片段,是决定PCR特异性的关键。
引物是决定PCR扩增片断的长度、位置和结果的关键。
引物设计的必要条件:与引物互补的靶DNA序列必须是已知的。
○3热稳定DNA聚合酶:○1聚合作用(5’→3’)、○23’→5’的外切酶活力、○35’→3’的外切酶活力○4脱氧核苷三磷酸(dNTP):原料。
完整版)生物化学知识点重点整理

完整版)生物化学知识点重点整理生物分子本章节将介绍生物分子的基本概念和特征,包括蛋白质、核酸、多糖和脂质的结构和功能。
本章节将讨论酶在生化反应中的作用机制和催化过程。
包括酶的分类、酶动力学和酶抑制剂等内容。
本章节将介绍生物体内的代谢途径,包括糖代谢、脂肪代谢和蛋白质代谢等重要过程。
本章节将探讨生物能量转化的过程,包括光合作用和呼吸作用等机制,以及相关的能量产生和消耗。
本章节将介绍生物体内遗传信息的传递过程,包括DNA复制、RNA转录和蛋白质翻译等重要步骤。
DNA复制DNA复制是遗传信息传递的第一步。
在细胞分裂过程中,DNA分子能够准确地复制自身,并将遗传信息传递给下一代细胞。
复制过程中,双链DNA分离,每条链作为模板合成新的互补链,形成两个完全一样的DNA分子。
RNA转录RNA转录是将DNA中的遗传信息转录成RNA的过程。
在细胞核中,RNA聚合酶将DNA作为模板合成RNA分子。
转录的产物是一条与DNA互补的RNA链,它可以是信使RNA(mRNA)、转移RNA(tRNA)或核糖体RNA(rRNA),这些RNA分子携带着遗传信息参与到蛋白质的合成过程中。
蛋白质翻译蛋白质翻译是将RNA中的遗传信息翻译成氨基酸序列,从而合成蛋白质的过程。
蛋白质翻译发生在细胞质的核糖体上,通过配对规则,每个三个核苷酸对应一个特定的氨基酸,从而组成特定的蛋白质。
翻译过程可分为启动、延伸和终止三个阶段。
以上是生物体内遗传信息的传递过程的重要步骤。
深入了解这些过程有助于理解生物体内的遗传机制和生命周期的维持。
本章节将讨论基因调控的机制和影响因素,包括转录因子、表观遗传学和信号转导等内容。
本章节将探讨生物化学与人体健康的关系,包括营养物质、药物代谢和疾病发生机制等相关内容。
本章节将探讨生物化学与人体健康的关系,包括营养物质、药物代谢和疾病发生机制等相关内容。
大一生物化学第二、三、五、七、八、章知识点总结
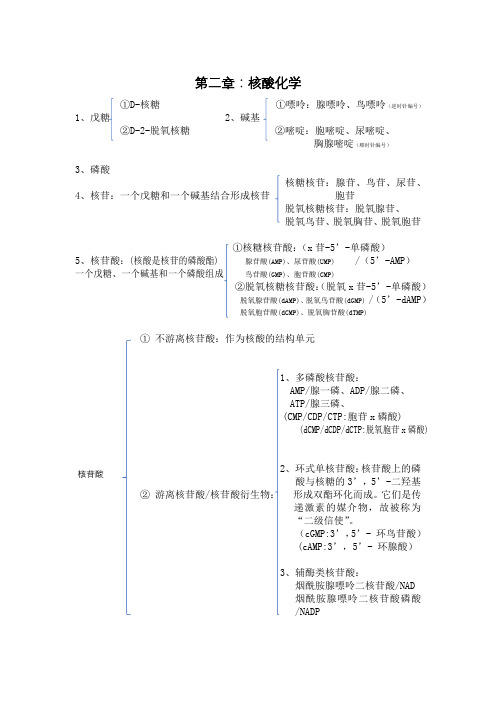
第二章:核酸化学①D-核糖①嘌呤:腺嘌呤、鸟嘌呤(逆时针编号)1、戊糖2、碱基②D-2-脱氧核糖②嘧啶:胞嘧啶、尿嘧啶、胸腺嘧啶(顺时针编号)3、磷酸核糖核苷:腺苷、鸟苷、尿苷、4、核苷:一个戊糖和一个碱基结合形成核苷胞苷脱氧核糖核苷:脱氧腺苷、脱氧鸟苷、脱氧胸苷、脱氧胞苷①核糖核苷酸:(x苷-5’-单磷酸)5、核苷酸:(核酸是核苷的磷酸酯)腺苷酸(AMP)、尿苷酸(UMP) /(5’-AMP)一个戊糖、一个碱基和一个磷酸组成鸟苷酸(GMP)、胞苷酸(CMP)②脱氧核糖核苷酸:(脱氧x苷-5’-单磷酸)脱氧腺苷酸(dAMP)、脱氧鸟苷酸(dGMP) /(5’-dAMP)脱氧胞苷酸(dCMP)、脱氧胸苷酸(dTMP)①不游离核苷酸:作为核酸的结构单元1、多磷酸核苷酸:AMP/腺一磷、ADP/腺二磷、ATP/腺三磷、(CMP/CDP/CTP:胞苷x磷酸)(dCMP/dCDP/dCTP:脱氧胞苷x磷酸)2、环式单核苷酸:核苷酸上的磷核苷酸酸与核糖的3’,5’-二羟基②游离核苷酸/核苷酸衍生物:形成双酯环化而成。
它们是传递激素的媒介物,故被称为“二级信使”。
(cGMP:3’,5’- 环鸟苷酸)(cAMP:3’,5’- 环腺酸)3、辅酶类核苷酸:烟酰胺腺嘌呤二核苷酸/NAD烟酰胺腺嘌呤二核苷酸磷酸/NADP3’,5’磷酸二酯键6、核酸:以核苷酸为基本结构单元所构成的生物大分子。
①一级结构:脱氧核苷酸之间的连接方式和排列顺序1、脱氧核苷酸之间的连接方式:以3’,5’磷酸二酯键相连,DNA分子无分支侧链,只能成环状或线状左侧5’,右侧3’2、脱氧核苷酸之间的排列顺序:基因的遗传信息的物质基础就是4种碱基的精确排列顺序。
(1)碱基当量定律:A+G=C+T1、DNA的组成:Chargaff定律:(2)不对称比率:A+TC+G②二级结构:比值与物种有关DNA(1)DNA分子有两条反向平行的多聚核苷酸链组成,一条链的走向3’到5’,另一条5’到3’。
中国药科大学考研药综一710——生化名解

第一章绪论1.生物化学:是生命的化学,是研究生物体的化学组成和生命过程中的化学变化规律的一门科学,它是从分子水平来研究生物体内基本物质的化学组成、结构与生物学功能,阐明生物物质在生命活动变化中的化学变化规律及复杂生命现象本质的一门学科。
2.新陈代谢:生物体不断与外环境进行有规律的物质交换。
是通过消化、吸收、中间代谢和排泄四个阶段来完成的。
3.分子生物学:是现代生物学的带头学科,它主要研究遗传的分子基础,生物大分子的结构与与功能和生物大分子的人工设计与合成,以及生物膜的结构与功能等。
第二章糖的化学4.糖类:多羟基醛或多羟基酮及其聚合物和衍生物的总称。
5.单糖:凡不能被水解成更小分子的糖称为单糖。
是糖类中最简单的一种,是组成糖类物质的基本结构单位。
6.寡糖:是由单糖缩合而成的短链结构,一般含2~6个单糖分子。
7.多糖:由许多单糖分子缩合而成的长链结构,分子量都很大,均无甜味,也无还原性。
8.粘(黏)多糖:粘多糖是一类含氮的不均一多糖,其化学组成通常为糖醛酸和氨基已糖或其衍生物,有的含有硫酸。
如透明质酸,硫酸软骨素,肝素等。
(07年药综二真题)9.结合糖:是指糖和蛋白质、脂质等非糖物质结合的复合分子。
10.糖脂:糖和脂类以共价键结合成的复合物,组成和总体性质以脂为主,糖类通过其还原末端的糖苷键与脂连接。
11. 糖蛋白:是糖与蛋白质以共价键结合的复合分子,其中糖的含量一般小于蛋白质,糖和蛋白质结合的方式有O连接和N连接。
12.脂多糖:是糖与脂类结合形成的复合物,以糖为主体成分,革兰氏阴性菌细胞壁内的脂多糖一般由外低聚糖链、核心多糖及脂质三部分组成。
13.糖苷键:一个糖半缩醛羟基与另一个分子的羟基、氨基或巯基之间缩合形成的缩醛或缩酮键,常见的糖苷键有O-糖苷键和N-糖苷键。
14.Smith降解:将过碘酸氧化产物进行还原,进行酸水解或部分酸水解。
15.糖基化工程:是在深入研究糖蛋白中糖链结构与功能关系的基础上,通过人为的改变(包括增加,删除)调整糖蛋白的表面的糖链而达到改变糖蛋白的生物学功能的目的。
药学本科生物化学各章复习重点

生化复习第四章蛋白质的化学要点汇总蛋白质:多种氨基酸(amino acids)通过肽键相连形成的高分子含氮化合物。
蛋白质具有多样性的生物学功能作为生物催化剂(酶)?代谢调节作用(激素)?免疫保护作用(抗体)?物质的转运和存储(转运蛋白)?运动与支持作用(胶原蛋白)?控制生长和分化(激活或阻遏蛋白)?参与细胞间信息传递(受体)?生物膜的功能(离子泵)?氧化供能(18%)?必需氨基酸:人体不能合成,必需从食物中获取的一类氨基酸。
主要有:苯丙、蛋、缬、苏、异亮、?亮、色、赖8种氨基酸等电点(isoelectric point,pI):在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势?及程度相等,成为兼性(两性)离子,呈电中性。
此时溶液的pH值称为该氨基酸的等电点。
蛋白质的一级结构:整条多肽链通过肽键形成的氨基酸残基排列顺序。
?肽键:由一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水缩合而形成的化学键。
蛋白质二级结构:局部肽链的主链骨架原子通过氢键形成的三维结构,并不涉及氨基酸残基侧链的?构象。
肽单元:参与肽键的6个原子C 、C、O、N、H、 C位于同一平面。
? 21α -螺旋(①右旋;②3.6个AA残基/螺旋;③1个肽单元N-H和第四个肽单元C=O形成氢键;④侧链R在螺旋外侧。
常见如角蛋白,肌红蛋白)β-折叠(①各链伸展使肽平面之间折叠成锯齿状;②各链平行排列通过氢键相连;③各链走向相同或相反;④侧链R在片层上下方;⑤可在分子内或分子间形成。
常见如蚕丝蛋白)基序:也称超二级结构(或模体),在许多蛋白质分子中,可发现2到3个具有二级结构的肽段,在?空间上相互接近,形成一个有规则和具有特定功能的二级结构组合。
如:αα,βαβ,βββ。
结构域:分子量较大的蛋白质常可折叠成多个结构较为紧密且发挥特定生物学功能的区域。
?蛋白质三级结构:整条多肽链通过疏水键、离子键、氢键等形成的三维结构。
有些蛋白质含有二条或多条多肽链,每条肽链都有完整的三级结构,这种多肽链称为蛋白质的亚基。
生物化学复习提纲

生物化学复习提纲文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]生物化学复习提纲第一章蛋白质化学1. 简述蛋白质的功能:①催化功能-酶②调控功能-激素、基因调控因子③贮存功能-乳、蛋、谷蛋白④转运功能-膜转运蛋白、血红/血清蛋白⑤运动功能-鞭毛、肌肉蛋白⑥结构成分-皮、毛、骨、牙、细胞骨架⑦支架作用-接头蛋白⑧防御功能-免疫球蛋白2. 蛋白质含氮量16%,凯氏定氮法;蛋白质含量 = 每克样品中含氮的克数×凯氏定氮法蛋白质与硫酸和催化剂一同加热消化,分解氨与硫酸结合。
然后碱化蒸馏使氨游离,用硼酸吸收后再以酸滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量3. 酸性氨基酸,碱性氨基酸,芳香族氨基酸,亚氨基酸,含硫氨基酸,含羟基氨基酸酸性氨基酸: Asp、 Glu碱性氨基酸:Arg、Lys、His,另外还有:羟赖氨酸(Hyl)、羟脯氨酸(Hyp)、胱氨酸芳香族氨基酸:Phe、Try、Tyr亚氨基酸:Pro含硫氨基酸:Cys、Met含羟基氨基酸:Ser、Thr4. 必需氨基酸,非必需氨基酸;必需氨基酸:异亮氨酸(Iso)、亮氨酸(Leu)、赖氨酸(Lys)、蛋氨酸(Meth)、苯丙氨酸(Phe)、苏氨酸(Thre)、色氨酸(Try)和缬氨酸(Viline)非必需氨基酸:5. 手性和比旋光度的偏转方向是否有一致性;AA的手性D,L与比旋光度的偏转方向并没有一致性。
6. 具有近紫外光吸收的氨基酸;Tyr/Trp/Phe7. 氨基酸的等电点;①当溶液为某一pH值时,AA主要以兼性离子的形式存在,分子中所含的正负电荷数目正好相等,净电荷为0。
这一pH值即为AA的等电点(pI)。
②在pI时,AA在电场中既不向正极也不向负极移动,即处于两性离子状态。
8;蛋白质的一级结构;蛋白质多肽链的氨基酸排列顺序——蛋白质的一级结构9、肽键中C-N键的性质及肽平面;肽键中C-N键有部分双键性质——不能由旋转组成肽键原处于同平(肽平)10.什么是蛋白质的二级结构,常见的二级结构有哪些,它们有什么特点;⑴①指肽链的主链在空间的排列,或规则的何向、旋转及折叠。
生物化学复习提纲

生物化学基础复习提纲生物化学专业复习提纲第一章糖类本章节包括以下几个知识点1,糖的定义和分类。
2.、葡萄糖代表的单糖的分子结构、分类、重要理化性质。
3,比较三种主要双糖(蔗糖、乳糖、麦芽糖)的组成、连接键的种类及其环状结构。
4,淀粉、糖原、纤维素的组成单位和特有的颜色反应及生物学功能。
5,糖胺聚糖、糖蛋白、蛋白聚糖的定义及键的连接方式。
6,了解糖的生理功能。
,其中必须掌握的重要知识点是第1-4,糖这章很少会出现大题,不过在填空和选择中却每年都会出题,所以大家要注意一下这章中重要知识点,以填空或选择提的形式掌握。
基础阶段,复习时间是从5月份至8月份,对于上面所述的知识点要熟悉,尽量掌握,一些比较零碎的需要加强记忆的知识点,大家最好做一下总结笔记,以便在强化阶段和冲刺阶段较强理解和记忆,得到更好的复习效果。
在复习每一个知识点的过程中,首先要了解知识点,通过反复阅读教材熟悉相应知识点,通过对相应知识点的总结及对应练习题的练习加强对这些知识点的掌握。
当然,在下面的章节中,对于知识点的掌握方法也是一样的,希望大家能尽量按照我所建议的复习要求和方法去做,这样能达到事半功倍的效果。
好,下面就对糖这章的知识点进行一下讲解。
【知识点1】糖的定义和分类:定义糖类是含多羟基的醛或酮类化合物。
化学本质:大多数糖类物质只由C、H、O三种元素组成,单糖的化学本质是多羟基的醛或酮分类:根据分子的结构单元数目,糖可分为单糖、寡糖、多糖。
掌握常见的单糖、寡糖、多糖有哪些【例题1】琼脂和琼脂糖(09)A、主要成分相同,属同多糖B、主要成分不同,属同多糖C、主要成分相同,应用不能代替D、主要成分不同,应用不能代替分析:琼脂糖属于多糖,而琼脂的成分包括琼脂胶和琼脂糖,是一种半乳糖聚合物,不是多糖。
两者主要成分是相同的,两者各有应用上的特点解题:c易错点:区别琼脂和琼脂糖的概念【知识点2】以葡萄糖代表的单糖的分子结构、分类、重要理化性质。
(完整word版)中国药科大学生物化学重点及习题

1第一章蛋白质一、知识要点(一)氨基酸的结构蛋白质是重要的生物大分子,其组成单位是氨基酸。
组成蛋白质的氨基酸有20 种,均为α-氨基酸。
每个氨基酸的α-碳上连接一个羧基,一个氨基,一个氢原子和一个侧链R 基团。
20 种氨基酸结构的差别就在于它们的R 基团结构的不同。
根据20 种氨基酸侧链R 基团的极性,可将其分为四大类:非极性R 基氨基酸(8 种);不带电荷的极性R 基氨基酸(7 种);带负电荷的R 基氨基酸(2 种);带正电荷的R 基氨基酸(3 种)。
(二)氨基酸的性质氨基酸是两性电解质。
由于氨基酸含有酸性的羧基和碱性的氨基,所以既是酸又是碱,是两性电解质。
有些氨基酸的侧链还含有可解离的基团,其带电状况取决于它们的pK 值。
由于不同氨基酸所带的可解离基团不同,所以等电点不同。
除甘氨酸外,其它都有不对称碳原子,所以具有D-型和L-型2 种构型,具有旋光性,天然蛋白质中存在的氨基酸都是L-型的。
酪氨酸、苯丙氨酸和色氨酸具有紫外吸收特性,在280nm 处有最大吸收值,大多数蛋白质都具有这些氨基酸,所以蛋白质在280nm 处也有特征吸收,这是紫外吸收法定量测定蛋白质的基础。
氨基酸的α-羧基和α-氨基具有化学反应性,另外,许多氨基酸的侧链还含有羟基、氨基、羧基等可解离基团,也具有化学反应性。
较重要的化学反应有:(1)茚三酮反应,除脯氨酸外,所有的α-氨基酸都能与茚三酮发生颜色反应,生成蓝紫色化合物,脯氨酸与茚三酮生成黄色化合物。
(2)Sanger 反应,α-NH2 与2,4-二硝基氟苯作用产生相应的DNB-氨基酸。
(3)Edman 反应,α-NH2 与苯异硫氰酸酯作用产生相应的氨基酸的苯氨基硫甲酰衍生物(PIT-氨基酸)。
Sanger 反应和Edmen 反应均可用于蛋白质多肽链N 端氨基酸的测定。
氨基酸通过肽键相互连接而成的化合物称为肽,由2 个氨基酸组成的肽称为二肽,由3 个氨基酸组成的肽称为三肽,少于10 个氨基酸肽称为寡肽,由10 个以上氨基酸组成的肽称为多肽。
