元素熔沸点
卤素单质从上到下熔沸点

卤素单质从上到下熔沸点
卤素单质指的是氟、氯、溴、碘、砹等卤族元素组成的单质。
这些元素的熔沸点从上到下逐渐升高。
以下是卤素单质从上到下的熔沸点数据:
1. 氟:熔点为-219.62℃,沸点为-188.14℃。
2. 氯:熔点为-101.5℃,沸点为-34.6℃。
3. 溴:熔点为-7.2℃,沸点为59.44℃。
4. 碘:熔点为113.5℃,沸点为184.35℃。
5. 砹:熔点为30℃,沸点为330℃。
从这些数据可以看出,卤素单质的熔沸点从上到下逐渐升高,这是因为它们从左到右分子量变大,分子间的范德华力增强,导致熔沸点升高。
此外,卤素单质均为非极性分子,因此它们的熔沸点也与它们在其中的状态有关,例如,碘在常温下为固态,但在高温下可以气化。
高中化学熔沸点百科、列表、解题思路【精装百科ppt】

熔点(melting point)
熔点是固体将其物态由固态转变(熔化)为液态的温度。进行相反动作(即由液态转为固态)的温度, 称之为凝固点。与沸点不同的是,熔点受压力的影响很小。 晶体融化时的温度叫做熔点。物质有晶体和非晶体,晶体有熔点,而非晶体则没有熔点。晶体又因类 型不同而熔点也不同.一般来说晶体熔点从高到低为,原子晶体>离子晶体>金属晶体>分子晶体。在分子 晶体中又有比较特殊的,如水,氨气等.它们的分子只间因为含有氢键而不符合"同主组元素的氢化物熔点 规律性变化''的规律。 熔点是一种物质的一个物理性质。物质的熔点并不是固定不变的,有两个因素对熔点影响很大。一 是压强,平时所说的物质的熔点,通常是指一个大气压时的情况;如果压强变化,熔点也要发生变化。 熔点随压强的变化有两种不同的情况.对于大多数物质,熔化过程是体积变大的过程,当压强增大时, 这些物质的熔点要升高;对于像水这样的物质,与大多数物质不同,冰熔化成水的过程体积要缩小(金 属铋、锑等也是如此),当压强增大时冰的熔点要降低。另一个就是物质中的杂质,我们平时所说的物 质的熔点,通常是指纯净的物质。但在现实生活中,大部分的物质都是含有其它的物质的,比如在纯净 的液态物质中熔有少量其他物质,或称为杂质,即使数量很少,物质的熔点也会有很大的变化,例如水 中熔有盐,熔点就会明显下降,海水就是熔有盐的水,海水冬天结冰的温度比河水低,就是这个原因。 饱和食盐水的熔点可下降到约-220℃,北方的城市在冬天下大雪时,常常往公路的积雪上撒盐,只要这 时的温度高于-22℃,足够的盐总可以使冰雪熔化,这也是一个利用熔点在日常生活中的应用。 熔点实质上是该物质固、液两相可以共存并处于平衡的温度,以冰熔化成水为例,在一个大气压下冰的 熔点是0℃,而温度为0℃时,冰和水可以共存,如果与外界没有热交换,冰和水共存的状态可以长期保持稳 定。在各种晶体中粒子之间相互作用力不同,因而熔点各不相同。同一种晶体,熔点与压强有关,一般取在 1大气压下物质的熔点为正常熔点。在一定压强下,晶体物质的熔点和凝固点都相同。熔解时体积膨胀的 物质,在压强增加时熔点就要升高。 在有机化学领域中,对于纯粹的有机化合物,一般都有固定熔点。即在一定压力下,固-液两相之 间的变化都是非常敏锐的,初熔至全熔的温度不超过0.5~1℃(熔点范围或称熔距、熔程)。但如混有 杂质则其熔点下降,且熔距也较长。因此熔点测定是辨认物质本性的基本手段,也是纯度测定的重要方 法之一。
单质熔沸点比较

单质熔沸点比较单质是指由同种元素组成的纯净物质,其熔沸点是衡量物质状态转变的重要指标之一。
熔沸点是指物质在标准大气压下从固态转变为液态的温度,或从液态转变为气态的温度。
不同的单质由于其原子或分子之间相互作用的差异,其熔沸点也会有所不同。
我们来看看一些常见的单质的熔沸点。
氢气是最轻的元素,其熔点为-259.2℃,沸点为-252.8℃。
氢气的熔沸点非常低,这是因为氢气的分子之间只有弱的范德华力作用,所以需要很低的温度才能使其凝固或沸腾。
相比之下,氧气的熔点为-218.8℃,沸点为-183℃。
氧气的分子之间有较强的范德华力作用,所以需要较低的温度才能使其凝固或沸腾。
接下来,让我们来看看一些金属元素的熔沸点。
铁是一种常见的金属,其熔点为1538℃,沸点为2861℃。
铁的熔沸点较高,这是因为金属元素之间存在着金属键,需要较高的温度才能破坏金属键使其熔化或沸腾。
相比之下,铝的熔点为660℃,沸点为2467℃。
铝是一种轻金属,其熔沸点较低,这是因为铝的原子之间相互作用较弱。
除了氢气、氧气、铁和铝之外,还有许多其他单质的熔沸点也各不相同。
例如,水的熔点为0℃,沸点为100℃。
水的熔沸点较高,这是因为水分子之间存在着氢键,需要较高的温度才能破坏氢键使水熔化或沸腾。
总的来说,单质的熔沸点与其分子或原子之间的相互作用力有关。
强的相互作用力会导致较高的熔沸点,而弱的相互作用力则会导致较低的熔沸点。
此外,单质的熔沸点也受到外界因素的影响,例如压力的变化会改变物质的熔沸点。
通过对单质的熔沸点的比较,我们可以了解到不同单质之间的物理性质差异。
这些差异不仅反映了单质分子或原子之间的相互作用力的差异,也反映了单质的化学性质和用途的差异。
对于科学研究和工业生产来说,了解单质的熔沸点是非常重要的,可以帮助科学家和工程师更好地理解和应用这些物质。
单质的熔沸点是衡量物质状态转变的重要指标之一。
不同单质由于其分子或原子之间相互作用的差异,其熔沸点也会有所不同。
化学元素周期表熔沸点规律总结

化学元素周期表熔沸点规律总结
高中化学元素周期表熔沸点规律是怎样的?因为熔沸点递变在周期表中并不是完全有规律的,所以希望不要一味追求结论,理解才是最重要的,一旦理
解了判断的原理,元素周期表自然就掌握好了。
元素周期表中熔沸点有什幺规律
首先,判断元素单质的熔沸点要先判断其单质的晶体类型,晶体类型不同,决定其熔沸点的作用也不同。
金属的熔沸点由金属键键能大小决定;分子晶体由分子间作用力的大小决定;离子晶体由离子键键能的大小决定;原子晶体由共价键键能的大小决定。
所以第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情
况下,原子半径越小,金属键键能越大,所以碱金属的熔沸点递变规律是:从上到下熔沸点依次降低。
第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是:从上到下熔沸点依次升高。
用这样的方法去判断同主族元素的熔沸点递变规律就行了,因为理解才是最重要的。
同周期的话,不太好说了。
通常会比较同一类型的元素单质熔沸点,比如
说比较na、mg、al的熔沸点,则由金属键键能决定,al所带电荷最多,原子
半径最小,所以金属键最强,故熔沸点是:nah2se>h2s;卤素:
hf>hi>hbr>hcl。
同周期比较的话,是从左至右熔沸点依次升高,因为气态氢
化物的热稳定性是这样递变另外有时还要注意物质的类型,比如让你比较金刚石、钙、氯化氢的熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其。
元素熔沸点表
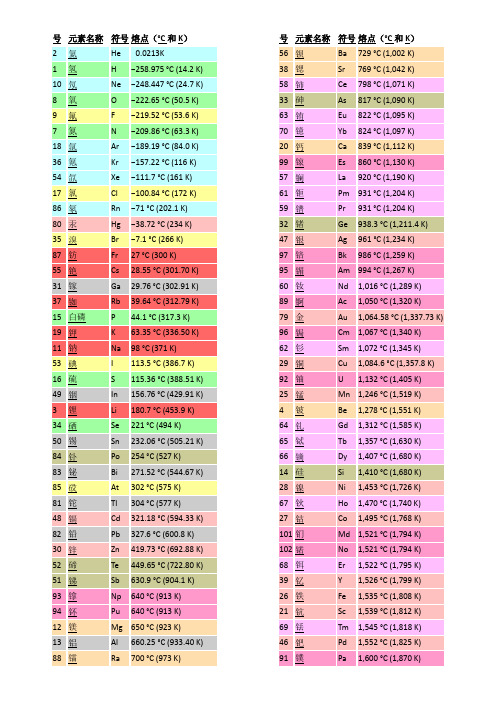
号 名称 45 铑 78 铂 5 硼 93 镎 6 91 镤 92 铀 44 钌 40 锆 77 铱 72 铪 42 钼 41 铌 90 钍 6 43 锝 76 锇 73 钽 75 铼 74 钨
K(热力学温标) 沸点°C(摄氏温标) 3968 4098 4200 4273 3695 3825 3927 4000 4027 4027 4131 4150 4409 4428 4603 4639 4744 4788 4827 4877 5012 5458 5627 5657
10 氖 7 9 氮 氟
18 氩 8 氧 36 氪 54 氙 86 氡 17 氯 118 Uuo 35 溴 53 碘 15 红磷 85 砹 80 汞 16 硫 33 砷 55 铯 87 钫 34 硒 37 铷 97 锫 19 钾 48 镉 11 钠 98 锎 30 锌 84 钋 52 碲 12 镁 70 镱 3 锂 38 锶 81 铊 20 钙 63 铕 83 铋 51 锑
K(热力学温标) 沸点°C(摄氏温标) 2010 2022 2067 2170 2223 2345 2334 2435 2477 2742 2792 2835 2840 2875 2880 2944 2993 3106 3109 3129 3134 3186 3200 3236 3273 3347 3383 3471 3501 3503 3503 3538 3546 3560 3609 3675 3680 3716 3737 3793 1737 1749 1794 1897 1950 2072 2061 2162 2204 2469 2519 2562 2567 2602 2607 2671 2720 2833 2836 2856 2861 2913 2927 2963 3000 3074 3110 3198 3228 3230 3230 3265 3273 3287 3336 3402 3407 3443 3464 3520
kcl,sio2,干冰,金属铜的熔、沸点顺序

Kcl, SiO2, 干冰和金属铜是我们生活中经常遇到的物质,它们都有各自独特的化学性质和物理性质。
在这篇文章中,我将介绍这些物质的熔点和沸点,并讨论它们的顺序。
1. Kcl(氯化钾)是一种常见的无机盐,它在室温下为白色结晶固体。
Kcl的熔点约为771摄氏度,而沸点约为1420摄氏度。
由于其高熔点和沸点,Kcl常用于制备其他化学物质,以及用作肥料和医药品的原料。
2. SiO2(二氧化硅)是一种常见的无机化合物,它在自然界中广泛存在,如石英、石英砂和玻璃等。
SiO2的熔点约为1713摄氏度,而沸点约为2230摄氏度。
由于其高熔点和沸点,SiO2常用于制备玻璃、陶瓷和耐火材料等。
3. 干冰是固态二氧化碳,它的熔点约为-78.5摄氏度,而沸点约为-56.6摄氏度。
由于其低熔点和沸点,干冰在实验室中常用于制冷,并在舞台效果和食品保鲜等方面有广泛应用。
4. 金属铜是一种常见的金属元素,它在室温下为红色固体。
铜的熔点约为1083摄氏度,而沸点约为2567摄氏度。
由于其高导电性和良好的延展性,铜常用于制造电线、管道、硬币和工艺品等。
从上述介绍可以看出,Kcl、SiO2、干冰和金属铜的熔点和沸点顺序分别为:- Kcl: 熔点771摄氏度,沸点1420摄氏度- SiO2: 熔点1713摄氏度,沸点2230摄氏度- 干冰: 熔点-78.5摄氏度,沸点-56.6摄氏度- 金属铜: 熔点1083摄氏度,沸点2567摄氏度总结来说,Kcl和SiO2的熔点和沸点都比较高,干冰的熔点和沸点较低,并且为负值,而金属铜的熔点和沸点居中。
这些物质的熔点和沸点顺序主要取决于它们的化学结构和分子间的相互作用。
了解这些物质的熔点和沸点也有助于我们更好地理解它们的性质和应用。
Kcl, SiO2, Dry Ice, and Copper are all substances that we encounter frequently in our daily lives, each with its own unique chemical and physical properties. In this article, we will dive deeper into these substances and discuss their melting and boiling points.1. Kcl (Potassium Chloride) is amon inorganic salt that exists as a white crystalline solid at room temperature. The melting point of Kcl is approximately 771 degrees Celsius, while the boiling point is around 1420 degrees Celsius. Due to its high melting and boiling points, Kcl is often used in the preparation of other chemical substances, as well as in the production of fertilizers and pharmaceutical ingredients.2. SiO2 (Silicon Dioxide) is a prevalent inorganicpound that is widely found in nature, such as in quartz, silica sand, and glass. The melting point of SiO2 is around 1713 degrees Celsius, while the boiling point is approximately 2230 degrees Celsius. Because of its high melting and boiling points, SiO2 ismonly used in the manufacturing of glass, ceramics, and refractory materials.3. Dry Ice is solid carbon dioxide, with a melting point of around -78.5 degrees Celsius and a boiling point of approximately -56.6 degrees Celsius. Due to its low melting and boiling points, dry ice ismonly used in laboratories for refrigeration and has a wide range of applications in stage effects and food preservation.4. Copper is amon metallic element that exists as a red solid at room temperature. The melting point of copper is approximately 1083 degrees Celsius, while the boiling point is around 2567 degrees Celsius. Due to its high conductivity and excellent ductility, copper ismonly used in the manufacturing of electrical wires, pipes, coins, and artwork.The sequence of melting and boiling points for Kcl, SiO2, Dry Ice, and Copper is as follows:- Kcl: Melting point 771 degrees Celsius, Boiling point 1420 degrees Celsius- SiO2: Melting point 1713 degrees Celsius, Boiling point 2230 degrees Celsius- Dry Ice: Melting point -78.5 degrees Celsius, Boiling point -56.6 degrees Celsius- Copper: Melting point 1083 degrees Celsius, Boiling point 2567 degrees CelsiusIn summary, Kcl and SiO2 have relatively high melting and boiling points, Dry Ice has lower melting and boiling points, and Copper falls in the middle. The melting and boiling points of these substances are primarily determined by their chemical structure and the interactions between molecules. Understanding the melting and boiling points of these substances also helps us betterprehend their properties and applications.Expanding on the scientific aspect, the melting and boiling points of substances are essential characteristics that play a crucial role in various scientific and industrial applications. The specific temperatures at which a substance transitions from thesolid to the liquid phase (melting point) and from the liquid to the gaseous phase (boiling point) provide valuable insights into its physical properties and behavior under different conditions. Additionally, these points also shed light on the intermolecular forces and the strength of bonds between the atoms or molecules of a substance.For instance, the high melting and boiling points of Kcl and SiO2 can be attributed to the strong ionic and covalent bonds that hold their respective crystal lattices together. Thesepounds exhibit a significant degree of hardness and resistance to high temperatures, making them suitable for applications where durability and thermal stability are essential. On the other hand, the low melting and boiling points of Dry Ice are a result of weak van der Waals forces between the carbon dioxide molecules, allowing it to sublimate directly from the solid to the gaseous state. This unique property makes Dry Ice ideal for cooling and preserving perishable goods.As for Copper, its relatively high melting and boiling points can be attributed to the strong metallic bonds between its atoms, which give it excellent thermal and electrical conductivity. These characteristics make Copper an indispensable material invarious industries, including electronics, construction, and metalworking. Furthermore, the understanding of melting and boiling points is crucial for the development of new materials, as scientists and engineers can tailor the properties of substances by manipulating their intermolecular forces.In conclusion, the melting and boiling points of substances are fundamental parameters that provide valuable insights into their physical properties, chemicalposition, and potential applications. By examining these characteristics, scientists and engineers can gain a deeper understanding of the behavior of substances under different conditions and utilize this knowledge to develop innovative materials and processes for various fields.。
元素周期表中熔沸点规律

元素周期表中元素熔沸点变化规律
一、元素周期表中元素熔沸点规律:
1、同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;
2、同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情况下,原子半径越小,金属键键能越大,所以碱金属的熔沸点递变规律是:从上到下熔沸点依次降低。
第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是:从上到下熔沸点依次升高。
二、扩展资料:
现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首先创造的,他将当时已知的63种元素依相对原子质量大小并以表的形式排列,把有相似化学性质的元素放在同一列,制成元素周期表的雏形。
经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序数排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
原子半径由左到右依次减小,上到下依次增大。
元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族(VIII族包含三个纵列)。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。
共有16个族,从左到右每个纵列算一族(VIII族除外)。
例如:氢属于IA族元素,而氦属于0族元素。
卤族元素熔沸点

卤族元素熔沸点
卤族元素熔沸点是一个重要的概念,它是生物化学过程的关键之一,也是物理化学的基础。
它指的是卤族元素以液体或气体的形式存在时的温度范围,这种温度范围可以用摄氏温度或华氏温度标准来计量。
在物理化学的研究中,不同的卤族元素熔沸点代表了不同的特性。
卤族元素的本质决定了它们的熔沸点,而熔沸点则反映了某一物质液体或气体状态变化所需要的温度范围。
例如,氢和氦共有一个极低的熔沸点,它能够在低温下气化,而其他的元素则没有这样的特性,他们的熔沸点都比氢氦更高。
在生物化学的应用方面,卤族元素熔沸点也被认为是重要的参数。
卤族元素的熔沸点可以用来预测生物体内物质究竟处于什么状态,同时它也能够反映出生物体内物质在加热或冷却后可能产生的反应。
此外,这种参数也可以帮助我们判断物质是否具有存在生物体内未知状态的能量。
此外,卤族元素通常有其他一些特殊的性质,它们在固态、液态和气态之间的变化极易受制于温度的变化。
这就意味着,当外界温度发生变化时,卤族元素也可能由固体变为液体或气体,由液体变为固体或气体,由气体变为固体或液体。
这种特性是卤族元素的一个主要特色,尤其当在生物体内发生反应时,它们更为重要。
究其原因,卤族元素有一些特殊的特性,它们能够受到温度变化的影响而被转化成固态、液态或气态,它们也具有可以用来衡量物质
液体或气体状态变化所需要的温度范围的熔沸点。
也正是这些特性,使得卤族元素在生物化学和物理化学方面具有重要的研究价值,它们可以帮助我们更好地理解物质的变化规律。
同族元素从上到下熔沸点

同族元素从上到下熔沸点
你好,我给你写一篇用四川方言和陕西方言穿插的文章,讲讲同族元素从上到下熔沸点这个科学话题。
哎呀,今儿咱来摆摆龙门阵,说说那个化学里头的同族元素,它们从上到下熔沸点那些个事儿。
咱们四川话里头,说这些科学名词儿,也得带点儿地气儿,哈哈。
说起同族元素,那可就像咱们村儿里的老王家,一大家子人,都是同一个祖宗传下来的。
你看那周期表,从上到下,那就是他们家族谱儿。
咱陕西的老乡们说,这就像咱们黄土高原上,从山顶儿到山脚儿,一辈儿辈儿传下来的家族。
那熔沸点呢,就像咱们过年时候的火锅,有的菜叶子一烫就熟,有的肉块子得煮好久。
同族元素也是这样,有的轻轻一热就化了,有的得费老大劲儿才能搞定。
咱们四川的麻辣火锅里头,那辣椒和花椒,一煮就香,那就像同族元素里头的轻家伙,熔沸点低,一加热就活跃得很。
而那陕西的油泼面,面条得煮得筋道,才好吃,那就像同族元素里头的重家伙,熔沸点高,得费点劲儿才能搞定。
你看,这就是同族元素从上到下熔沸点的道理。
咱们用这土话儿一说,是不是就明白多了?科学嘛,也得接地气儿,才能深入人心。
咱们四川话陕西方言穿插着说,也能把科学讲得明明白白,哈哈。
所以啊,大家别觉得科学就是高高在上的东西,咱们用咱们自己的话儿,也能讲明白。
就像这同族元素熔沸点的事儿,咱们一说,大家都懂了吧?
这就是科学的魅力,也是咱们方言的魅力。
好了,今儿就摆到这儿,下回咱再接着摆龙门阵,说说别的科学话题。
大家要是觉得咱这话说得有意思,就给咱点个赞,分享给朋友们听听,哈哈。
硫元素的熔点沸点和密度

硫元素的熔点沸点和密度
硫元素的熔点是115、21,沸点是444、6,密度是2、07。
硫是淡黄色固体,熔点112.8℃(正交硫)或119℃(单斜硫),沸点444.674℃,密度2.07克/厘米3(20℃)。
最重要的硫的变体是正交硫,它是室温下唯一稳定存在的变体,其他形式的硫放置后都将转变为正交硫。
将它缓慢加热,便转变为颜色较深的单斜硫。
如果将熔化的硫骤然冷却,并将它倾入冷水中,就得到弹性硫,其中硫原子形成长而弯曲的链,使它像橡皮一样具有弹性。
硫不溶于水但溶于二硫化碳。
硫的化学性质很活泼,能与氧、氢、氯、碳、磷等非金属及除金、铂、铱之外的金属直接化合。
硫是一种非金属元素,化学符号S,原子序数16。
硫是氧族元素之一,在元素周期表中位于第三周期。
通常单质硫是黄色的晶体,又称作硫磺。
硫单质的同素异形体有很多种,有斜方硫、单斜硫和弹性硫等。
硫元素在自然界中以硫化物、硫酸盐或单质形式存在。
[1]硫是人体内蛋白质的重要组成元素,对人的生命活动具有重要意义。
硫主要用于肥料、火药、润滑剂、杀虫剂和抗真菌剂生产。
硫单质难溶于水,微溶于乙醇,易溶于二硫化碳。
as的熔沸点

as的熔沸点熔沸点是一个物质在固态和液态之间转变的温度。
在化学中,as是指砷,是一种原生态元素,具有独特的性质和应用。
下面将讨论as的熔沸点以及与该元素相关的一些重要信息。
熔沸点是一个物质的物理性质,它取决于分子或原子间相互作用的强弱。
在as的情况下,它的熔点和沸点分别为熔点816度和沸点613度。
这意味着当温度高于816度时,as将从固态转变为液态,并且当温度高于613度时,as将从液态转变为气态。
砷是一种常见的元素,广泛存在于地壳中。
它可以以多种形式存在,包括金属砷、白砷和有机砷化合物。
它的熔沸点是研究和应用该元素的重要参考参数。
由于砷的高熔点,它在一些特殊的工业应用中具有重要作用。
例如,砷被广泛用于制造半导体材料,如砷化镓。
砷化镓是一种重要的半导体材料,具有特殊的电子特性,可用于制造太阳能电池、激光器和其他电子设备。
此外,砷还有一些其他的应用。
它被用作防腐剂,常见于木材保护和农业领域。
砷化氢是一种有毒气体,具有强烈的毒性,可以用作杀虫剂和制造某些化学品。
然而,由于其毒性,砷和砷化物的使用受到限制,并且需要严格的安全措施。
除了应用于工业和农业领域,砷也在医学和生物学研究中发挥作用。
例如,砷被用作治疗某些白血病的药物。
已经发现,砷能抑制白血病细胞的生长,从而改善患者的病情。
总之,as是一种重要的元素,具有独特的性质和应用。
其熔沸点是物质性质的重要参考参数,可以用于研究和应用该元素。
砷的高熔点使其在制造半导体材料和其他特殊工业应用中发挥重要作用。
然而,由于其毒性,对砷及其化合物的使用需要严格的安全措施。
此外,砷还在医学和生物学领域发挥作用,在治疗某些疾病方面显示出潜力。
