原子结构模型的演变
原子结构模型的演变.

图2 用扫描隧道显微镜观测到的硅晶体表面
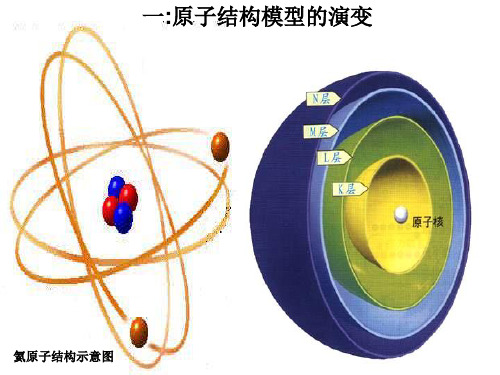
图3 氦原子结构示意图
现代量子力学原子结构模型(电子云模型)①原子由原子核 和核外电子构成②电子运动的规律跟宏观物体运动的规律截 然不同;③对于多电子的原子,电子在核外一定的空间近似 于分层排布
电子云
电子云:是用统计的方
96.exe
法对核外电子运动规律
化学性质
较活泼 较活泼 较稳定
元素的化学性质与最外层电子数关系密切
最外层电子数决定化学性质
+12 2 8 2 失去电子 +12 2 8
Mg
Mg2+
+16 2 8 6 得到电子 +16 2 8 8
S
S2-
1、金属失去最外层电子后,电子层数减少一层;
次外层变成最外层,达到饱和结构。
2、非金属得到电子后,电子层数不变;最外层 达到饱和结构
子光谱
现代量子力学原子 微观粒子的波 20世纪初 结构模型(电子云 粒二象性
模型)
①电子在原子核外一系列稳定的轨 道上运动,每一轨道都具有一个确 定的能量值;②电子在这些轨道上 运动时,既不放出能量,也不吸收 能量
①原子由原子核和核外电子构成② 电子运动的规律跟宏观物体运动的 规律截然不同;③对于多电子的原 子,电子在核外一定的空间近似于 分层排布
子电子层排布相同的阳离子(稳定结构)。
⒊非金属元素的原子最外层一般
个电子,
在化学反应中易
电子形成与稀有气体原
子电子层排布相同的阴离子(稳定结构)。
⒋化学反应中,原子核不发生变化,但原子的
发生变化,元素的化学性质主要决定于原子结
构中的
。
3、原子次外层电子数是最外层电子数1/2的 元素是_C__。原子次外层电子数是最外层电 子数1/3的元素是__O____。
高一化学原子结构模型的演变

上海自动化仪表厂系统工程公司、“销售公司”、“上海自动化仪表厂系统工程公司系统工程公司”、“DCS分公司”、“进出口部”、“国内 备品备件部”、共有18个工厂、21家合资企业。上海自动化仪表厂系统工程公司 上海自动化仪表厂系统工程公司 duh61exc 主要产品有工业生产过程控制系统装置和仪表分析仪器、汽车电子、计算机、楼宇控制系统、商业和金融自动化系统、可编程序控制 器(PLC)、家用电器及仪表控制柜、各种仪表元件和气动元件等。在工业生产过程控制方面的产品有20个大类、150个系列、3000多种品种, 拥有作为现代工业过程控制的分散控制系统(DCS)及各类控制、调节、温度、测量、显示、记录仪以及执行机构和调节阀。 日飞升,真是神仙哪!”下人涕泗横流的报告。老太太回来后听说,登时就怒了,对着明远:“请了活神仙来家,怎么不赶紧叫我去 见?”“……”明远一脸委屈的想,“要不是这家伙临走前来了这一手,谁认他是真神仙?还不当他是江湖把式吗?请您搁下要事回府、屈尊 去见他,怎开得了这个口!”正是临走前使的一招,才使得张神仙的“活儿”有了质的飞跃,成为上上下下里里外外诸色人等口中津津乐道的 话题。而韩毓笙“芙蓉花主”的名头,听说的人更多了。第三十四章 凭尽栏杆说元夜(1)宝音的身体好得很快。老太太原是不想留个病人在 屋里的,见她病势来得急去得快,刘大夫也说不过是饮食不当、热毒急了攻破喉头,其实无事,也便放宽了心,留她在屋中再看看。这日但见 宝音对着一本书,一边还比着手势,便动问道:“怎么了?不好好养身子,这还比划捣药呢?”宝音忙阖起书,屈膝道:“这本书……写着捣 茶。”她从明秀那儿,没借佛经,倒借了本茶经,还是挺古早的簿子,里头说吃茶,要捣、要煎、要放盐放油放香料,甚或有把茶叶都吃下去 的!可是作怪。丫头们都纳闷:“好茶叶一捣,不就坏了么,还怎么泡?”老太太倒触动心上痒处,笑道:“你们不知道。拿来我看看。”丫 头捧起书,且喜书上字体不小,她眯着眼看了会儿,道:“果然如此,这倒说的是古法儿的吃茶法呢!——你们单知道‘喝茶’,土话儿也叫 ‘吃茶’,哪知道老早时候,兴的就是吃茶?茶叶先经蒸制,压成饼,好的茶饼,只取芽尖一缕,光明莹洁,状若银线,压得密,手掌薄、半 个手掌大这么一小团,拿起来沉甸甸的,就快半斤了!叫密云团。用时切一小片,磨细下来,已够煮三五碗茶汤——三碗为佳,最多煮五碗, 这才是会吃茶的人。我的爷爷,每次只吃三碗,他就有那种密云团,茶汤浓得呀,再没其他相仿佛的好比拟,那种着实劲儿,用‘喝’就太轻 浮了,所以叫‘吃’。我小时候,从京城以降,已经都兴起炒青泡茶法儿了,他还恋着团茶,我亲手伺候他,煮完了最后一片密云团,再就没 了。市面上再没人能做那种茶啦!”老太太的爷爷,其实是晚年获罪,被抄赃,一吓而亡。老太太很少讲她爷爷的事,无非一次兴起,跟宝音 提过她十来岁时跟爷爷学得一手好煮茶手艺,也不过那么几句话,点到即止。现在她也打算“即止”了,但小丫头们没有宝音识相,簇拥过来 还想听她讲团茶,宝音在当中只凑趣插了几句嘴,老太太忽然发现自己已经兴致勃勃谈起来了。跟她的爷爷无关,只是团茶。话头被引导得那 么好,纯粹说古制,给小孩子们开开眼。她不觉间讲解了螃蟹眼、鹧鸪斑、三沸三辨、十二先生、兔豪鱼目、冷粥栗纹。这些术语、掌故,久 储在她心里,而今渐渐活了过来。老人
原子结构模型的演变

电子的波粒二象性
电子云模型
现代量子力学学说
电子云
电子云
• 现代科学家们在实验中发现,电子在原 子核周围有的区域出现的次数多,有的 区域出现的次数少,就像“云雾”笼罩 在原子核周围。因而提出了“电子云模 型”。
• 电子云密度大的地方,表明电子在核外 单位体积内出现的机会多,反之,出现 的机会少。
O2(- 带2个单位负电荷)
Mg
+12
Mg2+
+12
O2-
O
+8
+8
结论:
原子最外层的电子数小于8个时,在 化学反应中总是得到或失去电子而达到 最外层8电子的稳定结构。
⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生 成氧化物和氯化物,请写出这些氧化物和氯化物的化学 式。
Na2O、MgO、NaCl、MgCl2
Ar
+1 +8
H O
+12
Mg
原子结构示意图
为了形象地表示原子的结构,人们就创
造了“原子结构示意图”这种特殊的图形。
第3层 第2层
原子核
第1层
原子核带正电
+ 15 2 8 5
核电荷数
2、原子结构与元素性质的关系 (结构决定性质)
(1)稳定结构:原子既不容易失去电 子又不容易得到电子 (如He、Ne、Ar等) (2)不稳定结构:原子容易失去电子转化或容易 得到电子转化最外电子层上为8(有些为2)个电 子的稳定结构。
原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)
汤 姆 生
阴极射线
葡萄干面包(plum-pudding )模 型
原子结构模型的演变

第三单元 人类对原子结构的认识
§1、原子结构模型的演变 、
一.原子结构模型的演变
古希腊德谟克利特等哲学家的原子论思想 道尔顿原子结构模型 道尔顿原子结构模型 汤姆生“葡萄干面包式” 汤姆生“葡萄干面包式”原子结构模型 卢瑟福带核的原子结构模型 波尔的壳层原子结构模型 海森伯量子力学模型
道尔顿原子结构模型
元素:具有相同质子数的同一类原子的总称。 元素:具有相同质子数的同一类原子的总称。
氕(pie),氘(dao),氚(chuan) ) H D T 核素:具有一定质子数和一定中子数的一种原子。 核素:具有一定质子数和一定中子数的一种原子。
1 1H
,
2 1H
,
3 1H
35 17
Cl , ,
37 17
Cl ,
13 C-NMR(核磁共振)可以用于含碳化合物 (核磁共振) 6 13
的结构分析, 的结构分析, C 表示的碳原子
6
D
A、核外有13个电子 、核外有 个电子 B、核内有6个质子,核外有 个电子 、核内有 个质子 核外有7个电子 个质子, C、质量数为13,质子数为 ,核外有 个电子 、质量数为 ,质子数为6,核外有7个电子 D、质量数为13,质子数为 ,核内有 个中子 、质量数为 ,质子数为6,核内有7个中子
12 6 C 18 8 O
,
13 6 C
14 ,6 C
16 8 O
17 8 O
同位素: 同位素:质子数相同而中子数不同的核 素互称为同位素。 素互称为同位素。
【例】我国的“神舟”五号载人飞船已发射成 我国的“神舟” 嫦娥”探月工程也已正式启动。 功,“嫦娥”探月工程也已正式启动。据科学 家预测, 家预测,月球的土壤中吸附着数百万吨的32He, , 每百吨32He核聚变所释放的能量相当于目前人 核聚变所释放的能量相当于目前人 类一年消耗的能量。在地球上,氦元素主要以 类一年消耗的能量。在地球上, 4 He的形式存在。下列说法正确的是( 的形式存在。 的形式存在 下列说法正确的是( ) B 2 A. 42He原子核内含有 个质子 原子核内含有4个质子 原子核内含有 B. 32He和42He互为同位素 和 互为同位素 C. 32He原子核内含有 个中子 原子核内含有3个中子 原子核内含有 D.42He的最外层电子数为 ,所以42He具有较强 的最外层电子数为2, 的最外层电子数为 具有较强 的金属性
原子结构模型演变

Cl:+18 2 8 8
+16 2 7 7 S:
+14 2 9 3 Si:
氢气球里面装的是氢气吗?
稀有气体元素原子电子层排布
核 电 荷 数
2 10 18 各电子层的电子数 元素 名称 元素 符号 K 2 2 2 8 8 8 L M N O P
最外层电子 数
第三单元
人类对原子结构的认识
一、原子结构模型的演变
原子论思想起源
公元前五世纪,古希腊哲学家德谟 克利特等人认为:万物是由大量的不 可分割的微粒构成的,即原子。
一、原子结构模型的演变
道尔顿原子模型(1803年): 原子是实心球 汤姆生原子模型(1904年): “葡萄干面包式”原子结构模型 卢瑟福原子模型(1911年):带核的原子结构模型 波尔原子模型(1913年): 分层模型
ClK+
Mn+ Mm-
阳离子:质子数=核外电子数+离子所带电荷数 阴离子:质子数=核外电子数—离子所带电荷数
下列粒子的结构示意图中属于阴离子的是:
2、质量
构成原子 的粒子 质量/kg 电子 9.109〓10-31 质子 中子
1.673〓10-27 1.675〓10-27
相对质量 1/1836(电子与 ① 质子质量之比)
2 8 8
氦 氖 氩
He Ne Ar
36
54 86
氪
氙 氡
Kr
Xe Rn
2
2 2
8
8 8
18
18 18
8
18 32 8 18 8
8
8 8
3、原子结构与元素性质的关系
(结构决定性质)
原子结构模型的演变

原子结构模型的演变
原子结构模型的演变经历了多个阶段,其中最重要的包括:
1. 原子不可分模型:古希腊的哲学家认为,物质是由不可分的粒子构成的。
2. 道尔顿原子模型:约翰•道尔顿是第一个提出原子理论的科学家。
他认为,所有的物质都是由小球状的原子构成的,这些原子在化学反应中不会被分解或破坏。
3. 汤姆逊原子模型:汤姆逊用阴极射线管实验证明了原子是可分的,并发现了电子。
他把原子看作是带有正电的球体,电子散布在球体内部。
4. 卢瑟福原子模型:卢瑟福利用金箔反射性实验证明了原子的核心是带有正电的,并提出了原子的行星模型,即核心像太阳一样,电子绕核心旋转。
5. 波尔原子模型:尼尔斯•波尔用量子理论解释了原子的行为,并提出了原子壳层模型,即电子只能在固定的能级上旋转。
6. 原子云模型:薛定谔用波动理论解释了原子的行为,提出了原子云模型,即电子在很多不同的能级上旋转,并且存在于原子的三维空间中。
原子结构模型的演变

4、原子结构与元素性质的关系(结构决定性质)
(1)稳定结构:即最外层为8电子的结构(K层为2个) 特点:原子既不容易失去电子又不容易得到电子 (如He、Ne、Ar等) (2)不稳定结构: (如,失去: Na、Mg、Al 得到:F、O、Cl) 原子 最外层电子数﹤4时,容易失去电子 最外层电子数≧4时,容易得到电子
一成 章
结论
1、活泼金属元素的原子容易失去最外层上的电子 变为带正电荷的阳离子,阳离子所带正电荷的数 目等于原子失去的电子的数目。
Mg 失去2个电子
Mg2+
(带2个单位正电荷)
2、活泼非金属元素的原子容易得到电子变为带 负电荷的阴离子,阴离子所带负电荷的数目等 于原子得到的电子的数目。
得到2个电子
O
O2- (带2个单位负电荷)
+11 2 8 1
钠原子Na
+11 2 8
钠离子Na+
+17 2 8 7
氯原子Cl
+17 2 8 8
氯离子Cl-
NaCl
元素化合价与最外层电子数的关系:
最外层电子数﹤4时,容易失去电子
原子
(化合价=+失去的电子数目)
最外层电子数≧4时,容易得到电子
化合价=-(8-最外层电子数)
1913年,丹麦物理学家玻尔提出 的原子结构模型,
他认为核外电子是分层排布的。
丹麦物理学家玻尔
二、原子核外电子排布
1、原子核外电子的分层排布
电子层 原子核
+10
核电荷数 Ne 该电子层上
的电子
Ne原子的核外电子分层排布示意图
原子结构示意图
为了形象地表示原子的结构,人们就创造 了“原子结构示意图”这种特殊的图形。
原子结构模型的演变

哲 学 猜 测
原 子 结 构 模 型 的 演 变
1803
道尔顿
实心球模型
葡萄干面包模型 带核模型
轨 道 模 型 量子力学模型
1904
1911 1913 1926
汤姆生 卢瑟福
玻 尔
科学家们
试一试:回顾原子结构模型的演变历史,
你能否画出原子大概的样子呢? 二、原子核外电子排布
原子核
核电荷数 第三电子层
是容易失电子?
①最外层电子数<4 时,容易失去电子
原子
②最外层电子数>4 时,容易得到电子
化学性质主要取决于最外层电子数
电子云
用扫描隧道显 微镜拍摄硅表 面表示原子图 像的照片
夸克
人类认识原子的历史是漫长的,也是无止境的…
课堂小测
道尔顿 汤姆生 卢瑟福 玻尔
带核原子结构模型 近代原子学说
“葡萄干面包式”原子结构模型 轨道原子结构模型
符号
能量大小 距核远近
近
远
原子结构示意图
核电荷数 原子核
+12
电子层 电子层上的电子
2
8
2
请写出前18号元素的原子结构示意图
问题解决 请从原子结构角度解释形成
氧化镁的过程。
Mg +12 282
Mg2+ +12
28
Mg2+
O2-
O +8 2 6
O2- +8
28
迁移学习:分析钠原子与氯原子形成氯化钠的过程, 并用原子结构示意图表示这个过程。
原子大部分是空的 中间有一个几乎集中了 所有原子的质量且体积 很小的粒子——原子核
原子核上带正电
公元前五世纪
原子结构模型演变史

原子结构模型演变史原子是构成物质的基本单位,其结构模型的演变史可以追溯到古希腊时期。
古希腊哲学家德谟克利特提出了原子论,认为物质是由不可分割的原子构成的。
然而,这个理论没有得到科学实验的支持,直到19世纪才有了实验依据。
1803年,英国化学家道尔顿提出了原子理论,认为所有物质都是由不同种类的原子组成的。
他还提出了混合物和化合物的概念,这些概念为后来的化学研究奠定了基础。
1897年,英国物理学家汤姆逊发现了电子,这是原子结构模型的重要突破。
他提出了“葡萄干布丁模型”,认为原子是由带正电的球体和带负电的电子组成的。
这个模型解释了电子的存在和原子的电性质,但没有解释原子的核心。
1911年,英国物理学家卢瑟福进行了著名的金箔散射实验,发现原子核是由带正电的质子组成的。
他提出了“太阳系模型”,认为原子是由核心和绕核心运动的电子组成的。
这个模型解释了原子的核心和电子的轨道,但没有解释电子的运动方式。
1926年,奥地利物理学家薛定谔提出了量子力学理论,解释了电子的运动方式。
他提出了“波动力学模型”,认为电子是一种波动,存在于原子的空间中。
这个模型解释了电子的运动方式和原子的光谱,但没有解释原子的核子。
1932年,英国物理学家查德威克发现了中子,这是原子结构模型的又一重要突破。
他提出了“液滴模型”,认为原子核是由带正电的质子和带中性的中子组成的。
这个模型解释了原子核的结构和稳定性,但没有解释电子的轨道。
现代原子结构模型是由量子力学和液滴模型组成的。
它认为原子是由核心和绕核心运动的电子组成的,核心是由带正电的质子和带中性的中子组成的。
这个模型解释了原子的结构和性质,为现代化学和物理学的发展奠定了基础。
原子结构模型的演变史是一个不断发展和完善的过程,它反映了人类对自然界的认识和理解。
随着科学技术的不断进步,我们相信原子结构模型会有更深入的认识和探索。
原子结构模型的演变

构模型。
一、原子结构模型的演变
4.卢瑟福的带核原子结构模型:
英国物理学家 卢瑟福 根据α—粒子散射现象,指 出原子是由 原子核 和 核外电子 构成的, 原子核 带正 电荷,位于 原子中心 ,它几乎集中了原子的全部质量, 电子 带负电荷,在原子核周围空间作高速运动,就像行星 环绕太阳运转一样。
一、原子结构模型的演变
He、Ne、Ar为稀有气体,常以单原子分子的单质存 在,表现出化学性质很不活泼,很难与其它元素化合。
原子结构示意图:
He
+2 2
Ne
+10 2 8
Ar
+18 2 8 8
钠离子的形成
钠原子 钠离子
Na
失一个电子
Байду номын сангаас
Na+
Na — e
Na+
氯离子的形成
氯原子 氯离子
- 得一个电子
Cl+ e-
Cl-
—
+
5.丹麦物理学家玻尔的轨道原子结构模型。
丹麦物理学家玻尔指出,电子在原子核外 空间内稳定的 轨道 上绕核作 高速 运动。
一、原子结构模型的演变
6.电子云模型(现代原子结构学说)
现代科学家根据微观世界的波粒二象性规律, 提出用 量子力学 的方法描述核外电子运动。
模型 年代 依据 主要 内容 问题
道尔顿 1803
a-m=b+n
a= b+m-n
课堂练习3: 2.有X,Y,Z三种元素,X原子核内无中子,Y原 子的第三个电子层上有3个电子,Z原子最 外层电子数是其电子层数的3倍.试判断 X____,Y____,Z____. 并画出其原子结构 示意图______, _____, _____.这三种元素 所组成的化合物的化学式为_______.
原子结构模型的演变

1 2 3 4 5 6 7
符号 能量大小
距核远近
K
小 近
L
M
N
O
P
Q
大 远
3、原子核外电子排布规律
①能量最低原理:电子总是尽先排布在能量最低的 电子层里; 即由能量 低 高 ② 每个电子层最多只能容纳2n2电子。 次外层最多只能容纳18个电子
③ 最外层最多只能容纳 8个电子(K层为最外层是2个)
O 得 2eO2(带2个单位负电荷)
交流与讨论:氧化镁的形成
宏观:氧气和金属镁反应生成氧化镁,氧化 镁是氧元素与镁元素相结合的产物。
Mg+O2==2MgO
△
微观:每个Mg失去2个电子形成与Ne一样的稳定 电子层结构的Mg2+,每个O得到2个电子形成与Ne 一样的稳定电子层结构的O2-,Mg2+与O2-相互作用, 形成稳定的MgO.如教材图-1-31
能量最低原理
3、原子结构与原子性质的关系(结构决定性质)
①最外层电子数﹤4时,容易失去电子
原子
(化合价=+失去的电子数目) ②最外层电子数≥4时,容易得到电子 (化合价=最外层电子数-8)
原子结构模型的演变
历史年代 原子结构模型的名称 主要理论依据 或技术段 原子结构模型的主要论点
公元前5 世纪
倒数第三层最多只能容纳32个电子;
经验:电子排满K层,排
L
层,排满L层排
M
层
+1
+8
+12
H
O
Mg
H、O、Mg原子的核外电子分层排布示意图
三、原子结构与原子性质的关系
(结构决定性质)
(1)稳定结构:最外层电子数为8(注意:He 最外层为2),原子既不容易失去电子又不容易 得到电子 (如He、Ne、Ar、Na+、Cl-等)
化学5原子结构模型的演变

原子结构模型的演变原子的构成:1. 中子(不带电)原子核质子(带正电)一个质子带一个单位正电荷原子核外电子(带负电)一个电子带一个单位负电荷在一个原子中:质子数=核外电子数=核电荷数=原子序数离子中: 离子所带的电荷=质子数—核外电子数近代原子结构模型的演变模型道尔顿汤姆生卢瑟福玻尔量子力学年代1803 1904 1911 19131926依据元素化合时的质量比例关系发现电子ɑ粒子散射氢原子光谱近代科学实验主要内容原子是不可再分的实心小球葡萄干面包式含核模型行星轨道式原子模型量子力学1.核外电子排布规律:(1) 核外电子总是尽先排布在能量较低的电子层,然后由里向外,排布在能量较高的电子层(2) 原子核外各电子层最多容纳2n2个电子(表示电子层数)。
(3) 原子最外野电子数目不能超过8个(第一层不能超过2个)(4) 次外层电子数目不能超过18个(第一层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
二、原子的构成表示质量数为A、质子数为Z的具体的X原子。
ZXA元素:质子数相同的同一类原子的总称。
核素:具有一定质子数和一定中子数的一种原子。
同位素:质子数相同、质量数(中子数)不同的原子(核素)互为同位素质量数(A )=质子数(Z )+中子数(N )(1) 原子:核电荷数(质子数)=核外电子数, (2) 阳离子:核电荷数(质子数)>核外电子数, (3) 阴离子:核电荷数(质子数)<核外电子数,人类对原子结构的认识一、选择题(每小题有1~2个选项符合题意) 1.根据元素的核电荷数,不能确定的是( )A .原子核内质子数B .原子核内中子数C .原子最外层电子数D .原子核外电子数2.在核电荷数为1~20的元素的原子中,次外层电子数为最外层电子数2倍的元素是( ) A .核电荷数为3的元素 B .核电荷数为14的元素 C .核电荷数为6的元素 D .核电荷数为16的元素3. 1999年世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说。
原子结构模型演变

原子结构模型演变引言:原子是构成物质的基本单位,对于人类来说,了解原子结构的演变是科学发展的重要里程碑。
本文将从经典模型、波尔模型到量子力学模型,介绍原子结构模型的演变过程。
一、经典模型1. 托姆逊模型19世纪末,英国物理学家约瑟夫·约翰·托姆逊提出了托姆逊模型。
他认为原子是由带正电的球体中带负电的电子组成,这种模型可以解释电子在原子内的位置和运动。
然而,托姆逊模型无法解释原子的稳定性和光谱现象。
2. 鲁瑟福模型1909年,英国物理学家欧内斯特·鲁瑟福提出了鲁瑟福模型。
他的实验发现,原子中几乎所有的质量都集中在一个非常小的核心部分,而电子则围绕核心旋转。
这一模型解释了原子的稳定性和光谱现象,但无法解释电子在轨道上的运动方式。
二、波尔模型1. 波尔理论1913年,丹麦物理学家尼尔斯·波尔提出了波尔理论。
波尔根据鲁瑟福模型,结合了经典电磁理论和量子理论的思想,提出了电子只能在特定轨道上运动,且每个轨道对应一定能量。
这一模型解释了原子的光谱现象,并奠定了原子结构研究的基础。
2. 波尔模型的局限性尽管波尔模型在解释原子结构方面取得了重要成果,但它无法解释原子的精细结构和不同元素的光谱线。
此外,波尔模型也未能解释电子在轨道上的运动方式和原子中的电子云分布。
三、量子力学模型1. 波动力学1926年,奥地利物理学家埃尔温·薛定谔提出了波动力学理论。
该理论结合了波动性和粒子性的概念,通过波函数描述了电子在原子中的运动状态。
波动力学理论成功解释了原子的精细结构和光谱现象。
2. 玻恩-奥本海默近似1928年,德国物理学家玻恩和奥本海默提出了近似方法,称为玻恩-奥本海默近似。
该近似方法通过计算原子间的相互作用,预测了原子结合能和分子结构,为化学反应的研究提供了重要的理论基础。
3. 量子力学模型量子力学模型是目前最为完善的原子结构模型。
它通过数学方程描述了原子中电子的运动状态和能量。
原子结构模型的演变

O 得 2e-
O2(- 带2个单位负电荷)
原子得失电子与化合价的联系P30
⒈金属单质Na、Mg能分别与非金属单质O2、Cl2反应生成氧 化物和氯化物,请写出这些氧化物和氯化物的化学式。
Na2O、MgO、NaCl、MgCl2 ⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子
铜由铜原子直 接构成
食盐由离子构成
水由水分子构成
一、原子结构模型的演变:
1、道尔顿原子模型:提出原子论 原子是实心球
2、汤姆生原子模型:发现电子(带负电荷) “葡萄干面包式”
3、卢瑟福原子模型:发现原子核结构
带核的原子结构模型
4、玻尔原子模型:发现核外电子的能量
分层模型
5、现代原子模型:核外电子的运动和电子排
注意:多条规律必须同时兼顾。Βιβλιοθήκη 2、核外电子排布的表示方法:
①原子结构示意图:
原子核
电子层
原子核
第2层 第1层
第3层
+18 核电荷数
Ar
+18 2 8 8
原子核带正电
K层
L层
该电子
核电荷数
层上的
电子
该电子层上的电子数
M层
②离子结构示意图:
辨析原子结构示意图和离子结构示意图: 原 子:核内质子数=核外电子数 阳离子:核内质子数 > 核外电子数 阴离子:核内质子数 < 核外电子数
元素、核素和同位素的关系:
核素 某种元素 核素 同位素
同位素的特性:
(1)化学性质几乎完全相同:
35 17
Cl、17
37
Cl
(2)物理性质不同:N不同,A不同,M不同,m不同
(3)原子个数百分比(即丰度)基本不变:
原子结构模型的演变PPT课件

8
课堂练习2:
在原子序数1~18号元素范围内,按要求 回答下列问题: ①最外层电子数为1的原子有_____ ②最外层电子数是次外层电子数2倍的原 子是______ ③最外层电子数是次外层电子数3倍的原 子是______ ④最外层电子数是次外层电子数4倍的原 子是______
在原子序数1~18号元素范围内,按要求 回答下列问题: ⑤次外层电子数是最外层电子数2倍的原子 有______ ⑥内层电子总数是最外层电子数2倍的原子 有______ ⑦电子层数与最外层电子数相等的原子有 ______ ⑧最外层电子数是电子层数2倍的原子有 _______ ⑨最外层电子数是电子层数3倍的原子是 ______
32个 。 ⑤倒数第三层最多容纳电子数----------------
试一试: 说出下列原子的核外电子排布: 1)Mg
2)Cl
3)N 4)Ne 5)Ca
二、核外电子分层排布 3、原子结构示意图 核电荷数
பைடு நூலகம்
原子 符号
电子 层
各层电子的数目
三、原子结构与元素性质的关系 1.稳定结构:最外层为8电子的结构(K层为最 外层时为2电子) 特点:原子既不容易失去电子又不容易得到电子 (如He、Ne、Ar等)
电子先排能量最低的电子层,排满后再排能量 较高的电子层 2 2n 个 ①第n层最多容纳电子数------------------------。
② K层为最外层时,最多容纳电子数------------。
2个
8个 。 ③其他各层为最外层最多容纳电子数-----------18个 。 ④次外层最多容纳电子数------------------注意:多条规律必须同时兼顾。
单元人类对原子结构的认识
原子结构模型的演变

原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)
• 电子是种带负电、有 一定质量的微粒,普 遍存在于各种原子之 中。 • 汤姆生原子模型:原 子是一个平均分布着 正电荷的粒子,其中 镶嵌着许多电子,中 和了电荷,从而形成 英国物理学家汤姆生 (J.J.Thomson ,1856~1940) 了中性原子。
α粒子散射实验(1909年) ——原子有核
• 卢瑟福和他的助手做了 著名α粒子散射实验。根 据实验,卢瑟福在1911 年提出原子有核模型。 • 卢瑟福原子模型(又称 行星原子模型):原子 是由居于原子中心的带 正电的原子核和核外带 负电的电子构成。原子 核的质量几乎等于原子 的全部质量,电子在原 子核外空间绕核做高速 运动。
英国科学家卢瑟福 (E.Rutherford,1871~1937)Leabharlann 玻尔原子模型(1913年)
• 玻尔借助诞生不久的量 子理论改进了卢瑟福的 模型。 • 玻尔原子模型(又称分 层模型):当原子只有 一个电子时,电子沿特 定球形轨道运转;当原 子有多个电子时,它们 将分布在多个球壳中绕 核运动。 • 不同的电子运转轨道是 具有一定级差的稳定轨 道。
现代物质结构学说
电子云
原子结构模型的演变
道尔顿原子模型 1803年
汤姆原子模型
1904年
卢瑟福原子模型
1911年
玻尔原子模型
1913年
电子云模型
1927-1935年
近代科学原子论(1803年)
• 一切物质都是由最小 的不能再分的粒子— —原子构成。 • 原子模型:原子是坚 实的、不可再分的实 心球。
“化学的新时代是从原 子论开始的” 英国化学家道尔顿 ——恩格斯 (J.Dalton , 1766~1844)
原子结构模型的演变
7
3、原子核外电子排布规律 ① 能量最低原理:先排K层,排满K层后再排L层. ②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外层时不能超过 2个)
次外层最多只能容纳18个电子(K层为次外层时不能超 过2个
倒数第三层最多只能容纳32个电子
注意:多条规律必须同时兼顾。
精选ppt课件
8
失去电子
+12 2 8 2
+12 2 8
Mg
Mg2+
得到电子
+8 2 6
+8 2 8
O
O2-
精选ppt课件
9
结 论 1、活泼金属元素易失电子变为带正电荷的
阳离子
Mg 失 2e-
Mg2+(带2个单位正电荷)
2、活泼非金属元素易得电子变为带负电 荷的阴离子
O 得 2e-
O2(- 带2个单位负电荷)
12
问题解决
①金属最外层电子数﹤4时,易失去电子
原子
(化合价=+失去的电子数目)
②非金属最外层电子数≥4时,易得到电子
(化合价=最外层电子数-8)
关系:元素化合价在数值上等于原子失去 或得到的电子数目(失为正,得为负)
精选ppt课件
13
小结:
1 原子结构模型的演变 道尔顿→汤姆生→卢瑟福 →玻尔→量子力学
⒉根据Na、Mg、O、Cl原子在反应中失去或得到电子的数 目和该原子的最外层电子数目,推断其氧化物和氯化物中 元素的化合价,将结果填入下表: 一些元素的原子得失 电子的情况
元素
Na Mg O Cl
化合价
+1 +2 -2
-1
原子结构模型演变历史

原子结构模型演变历史一、引言原子是物质的最基本单位,研究原子结构模型的发展历程是物理学的重要组成部分。
本文将从经典原子结构模型、量子力学原子结构模型到现代原子结构模型三个阶段进行详细阐述,以展示原子结构模型的演变历史。
二、经典原子结构模型1. 道尔顿原子模型19世纪早期,英国化学家道尔顿提出了第一个经典原子结构模型。
他认为原子是不可分割的,是质点球体,且不同元素的原子具有不同的质量。
2. 汤姆逊原子模型1897年,汤姆逊发现了电子,提出了“面包状模型”,即认为原子是一个正电荷均匀分布的球体,电子均匀地分布在球体内。
3. 卢瑟福原子模型1909年,卢瑟福进行了一系列散射实验,发现了原子的核心,并提出了著名的卢瑟福原子模型。
该模型认为原子是由一个极小、带正电荷的核心和绕核心运动的电子构成,电子围绕核心运动,类似于行星围绕太阳运动。
三、量子力学原子结构模型1. 波尔原子模型1913年,丹麦物理学家波尔提出了量子力学的原子结构模型,也称为波尔原子模型。
他认为电子只能在特定的能级轨道上运动,每个轨道对应一定能量。
当电子跃迁到较低能级时,会放出光子。
2. 德布罗意波动力学模型1924年,法国物理学家德布罗意提出了物质粒子也具有波动性的假设,即德布罗意波动力学模型。
他认为电子的运动状态可以用波函数描述,波函数的平方表示电子在空间中的概率分布。
四、现代原子结构模型1. 薛定谔方程1926年,奥地利物理学家薛定谔提出了薛定谔方程,用于描述电子的波动性和粒子性。
这一方程成为量子力学的核心方程,被广泛应用于原子结构模型的研究。
2. 现代原子轨道模型根据薛定谔方程解得的波函数,可以得到电子的能级和轨道分布。
根据这些信息,科学家们发展出了现代原子轨道模型。
该模型认为电子沿着不同的轨道分布,每个轨道可以容纳一定数量的电子。
3. 量子力学云模型云模型是对电子位置的概率分布进行可视化的一种方法。
该模型认为电子不是精确地位于轨道上的某一点,而是存在于一定的空间区域,被称为电子云。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
应用反馈
4.已知自然界有8B和10B两种同 位素,但B元素的相对原子质量 为10.8,求自然界中8B和10B的 原子个数之比_______。
交流与讨论
观察下表,比较一下质子、中子、电子质 量,分析原子的质量集中在哪部分,为什 么?相对于整个原子来说,原子核外某个 电子的质量能否忽略不计?
质量/kg 相对质量①1.007 1.008电/C原 子 核质子
中子
1 .673 x 10-27 1.675 x 10-27
电子
9.109 x 10-31
现代量子力学原子结构模型(电子云模型)①原 子由原子核和核外电子构成②电子运动的规律跟 宏观物体运动的规律截然不同;③对于多电子的 原子,电子在核外一定的空间近似于分层排布。
二、原子核外电子的分层排布
电子层 原子核
+2
+10
+18
He
Ne
核电荷数
Ar
该电子层 上的电子
+1
+8
+12
H
O
Mg
1、原子结构示意图 为了形象、简单的表示原子的结构,人们就创 造了“原子结构示意图”这种特殊的图形。
(2)不稳定结构:原子容易失去电子或容易得到电子转化 最外电子层上为8(有些为2)个电子的稳定结构。
(如,失去: Na、Mg、Al 得到:F、O、Cl)
金属元素 最外层电子数: <4
非金属元素 ≥4
得失电子趋势:
元素性质:
易失
金属性
易得
非金属性
三、原子核的组成
原子核
质子 中子
电子
原子
交流与讨论
观察比较原子和原子核的直径,分析 原子核在原子中的体积占有率。
核电荷数
元素名称
元素符号
各电子层的电子数
1 2 3 4 5 6 7 8 9 10
氢 氦 锂 铍 硼 碳 氮 氧 氟 氖
H He Li Be B C N O F Ne
K 1 2 2 2 2 2 2 2 2 2
L
M
N
1 2 3 4 5 6
7 8
核电荷数为1~20的元素原子核外电子层排布
核电荷数
元素名称
约为几千亿分之一(1/1012)
资 料
原子核的密度很大,假如在 1cm3的容器内装满原子核,则它的 质量就相当于1.2×108t,形象地可 以喻为需要3000万辆载重4t的卡车 来运载。
交流与讨论
观察下表,比较一下质子、中子、电子带 电荷情况,分析铜原子为什么显电中性? 由此你又能得出什么结论?
视野拓展
几种重要同位素
2 1
氢有三种核素: 1 1H 铀有三种核素: 碳有三种核素:
234 92
H
3 1
H
238 92
氘和氚是制造氢弹的材料
U
235 92
U
U
铀235 是制造原子弹的材料和核反应堆的燃料
12 6
C
13 6
C
14 6
C
碳12 作为原子量及阿伏加德罗常数的标准 碳14 在考古学中测定生物死亡年代。
如何表示情境中三种原子的组成?这三种原 子有何异同?是不是同一种元素?是不是同 一原子?它们之间是什么关系?
归纳和小结
元素、核素、同位素间的关系
交流与讨论
以126C 、136C 、146C为例,分析同位素不 同核素间的性质有何异同?
同种元素的核素物理性质不同, 但化学几乎完全相同
问题解决 D 1.下列各组物质中,互为同位素的是 (A)O2、、O3 、O4 (B)H2、D2、T2 ( C) H2 O、 D2 O、 T2 O (D) 4020Ca 和4220 Ca 2.下列说法正确的是 A (A)同种元素的质子数必定相同 (B)不同元素原子的质量数必定不同 (C)原子核都是由质子和中子构成的 (D)凡是核外电子数相同的微粒必定属于同一元素
Mg
+12
+12
Mg2+
MgO
+8
O2-
O
+8
结论: 原子最外层的电子数小于8个时,在化
学反应中总是得到或失去电子而达到最外层 8电子的稳定结构。
3、原子结构与元素性质的关系(结构决定性质)
(1)稳定结构:原子既不容易失去电子又不容易得到 电子,即原子最外层有8个电子(He为2)处于稳定。
(如He、Ne、Ar等)
!
信息提示
原子组成的表示方法
质量数 —— A
质子数——
X Z
——元素符号
问题解决 74 53 1、已知12753I,求该原子的中子数和电子数。 2、1mol AZMn+ 微粒中的质子数是 Z mol,中子数 是 A-Z mol,核外电子数是 A-Z-n mol。
交流与讨论
三种原子的质子数(Z)、中子数(N)、质量数 (A)分别为: 1 Z N A H 1 1 0 1 2 1 1 2 1H 3 1 2 3 1H
2 8 8 8 8 8
分析稀有气体的核外电子排布与其性质有什么联系?
1、对比稀有气体的结构,分析Mg、O核外电子排布特点 2、Mg、O为什么容易形成 Mg2+、O2-?在变化过程中改 变的是什么微粒? 3、由Mg、O你分别想到了哪些类似的原子,它们在结构 上有什么共同点?性质上呢?
+12
2
8
2
失去电子
+12
2
8
Mg
Mg2+
+8
2
6
得到电子
+8
2
8
O
O2-
问题解决:氧化镁的形成
宏观:氧气和金属镁反应生成氧化镁,氧化 镁是氧元素与镁元素相结合的产物。
2Mg+O2==2MgO
△
微观:每个Mg失去2个电子形成与Ne一样的稳定 电子层结构的Mg2+,每个O得到2个电子形成与Ne 一样的稳定电子层结构的O2-,带正电荷的Mg2+与 带负电荷的O2-相互发生电性作用,形成稳定的 MgO.如下图
上述规律相互制约,相互联系
稀有气体元素原子电子层排布
各电子层的电子数 元素名 元素符 称 号 K 1 L 2 M 3 N 4 O 5 P 6 最外层电子数
氦 氖 氩 氪 氙 氡
He Ne Ar Kr Xe Rn
2 2 2 2 2 2 8 8 8 8 8 8 18 18 18 8 18 32 8 18 8
一、原子结构模型的演变
道尔顿原子模型(1803年): 原子是实心球
认知过程 实践 认识
“葡萄干面包式”原子结构模型 汤姆生原子模型(1904年):
带核的原子结构模型 卢瑟福原子模型(1911年): 再实践 玻尔原子模型(1913年): 原子轨道模型
再认识
现代原子模型: 电子云模型 ……
人类认识原子的历史是漫长的,也是无止境的……
第3层
电子层
第2层 原子核 第1层
原子核
+18
+18
原子核带正电
该电子层 上的电子
2
K层
8
8
核电荷数
Ar
L层 核电荷数
M层
观察教材P29页图1-27几种原子的核外电 子排布,核外电子是如何分层排布的呢?
+2 +10 +18
He
Ne
Ar
+1
+8
+12
H
O
Mg
核电荷数为1~20的元素原子核外电子层排布
1/1836
①相对质量是指对12C原子质量的1/12
(1.661*10-27 kg )相比较所得的数值。
质量/kg 原 子 核 质子 中子
1 .673 x 10-27 1.675 x 10-27
相对质量①
1.007 1.008
电量/C
电子
9.109 x 10-31
1/1836
问题解决
据报道,国外某研究所已发现了116号元 素的原子,该原子核外有114个电子,计 算原子质量时能否将116个电子都忽略不 计呢?
① 电子总是尽先排布在能量最低的电子层里, 然后由往 外,依次排在能量逐步升高的电子层里(能量最低原 理), 先排K层,排满K层后再排L层,排满L层后再排 M层。 ②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外层时 不能超过2个),次外层不超过18个,倒数第三层 不超过32个。
在你眼中…? 在化学家眼中…?
原子
它们由什么微粒构成?
铜由铜原子构成
食盐由离子构成
水由水分子构成
请大家结合初中学过的知识及教材P27-28 的短文,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
2、用简洁的语言表达各阶段(道尔顿、汤姆生、 卢瑟福、波尔)对原子结构模型的认识特点? 3、请你谈谈从原子结构的演变得到什么启迪?
元素符号
各电子层的电子数
K 2 2 2 2 2 2 2 2 2 2
L 8
M 1 2 3
N
11 12
钠 镁
Na Mg
13
14 15 16 17 18 19 20
铝
硅 磷 硫 氯 氩 钾 钙
Al
Si P S Cl Ar K Ca
8 8 8 8
8 8 8 8 8
4 5
6 7 8 8 8
1 2
2、原子核外电子排布一般规律
应用反馈
3、质子数为17,35Cl是氯的一种核素,下列说 法正确的是 ( BD) A. 35Cl原子所含电子数为18 B. 1/18 mol的1H35Cl分子的质中所含中子数约为 6.02×1023 C. 3.5 g35Cl2气体的体积为2.24L D. 35Cl2气体的摩尔质量为70 g.mol-1
