氯化钠的晶胞结构
氯化钠的危害及注意事项

氯化钠简介管制信息本品不属于管制品名称中文名称:氯化钠英文别名:Sodium Chloride (AS),Table salt , Roch salt , Sea salt化学式NaCl相对分子质量58.44性状白色立方结晶或结晶性粉末。
25℃时,1g溶于2.8ml水、2.6ml沸水、10ml甘油,极微溶于乙醇。
其水中溶解度因盐酸存在而减少,几乎不溶于浓盐酸。
水溶液呈中性,pH为6.7~7.3。
相对密度 2.17。
熔点804℃。
沸点1413℃。
半数致死量(大鼠,经口)3.75±0.43g/kg。
储存密封保存。
用途测定硝酸银的基准。
微量测定氟和硅酸盐。
用于高纯分析。
血液常规检验。
肝功能试验。
制备细菌血清学培养基。
致冷混合剂。
食物保存。
照相。
质检信息质检项目指标值钡(Ba),% ≤0.001砷(As),% ≤0.00002pH值(50g/L,25℃) 5.0~8.0六氰合铁(Ⅱ)酸盐[以Fe(CN)6计],% ≤0.0001水不溶物,% ≤0.003重金属(以Pb计),% ≤0.0005镁(Mg),% ≤0.001钾(K),% ≤0.01钙(Ca),% ≤0.002铁(Fe),% ≤0.0001干燥失量,% ≤0.2含量(NaCl),% ≥99.8总氮量(N),% ≤0.0005硫酸盐(SO4),% ≤0.001磷酸盐(PO4),% ≤0.0005溴化物(Br),% ≤0.005碘化物(I),% ≤0.001澄清度试验合格所属化合物类别:盐晶体类型:离子晶体(右图为其晶胞结构)氯化钠晶胞结构来源:由海水(平均含2.4%氯化钠)引入盐田,经日晒干燥,浓缩结晶,制得粗品,粗盐中因含有杂质(MaCl2和CaCl2),在空气中较易潮解。
亦可将海水,经蒸汽加温,砂滤器过滤,用离子交换膜电渗析法进行浓缩,得到盐水(含氯化钠160~180g/L)经蒸发析出盐卤石膏,离心分离,制得的氯化钠95%以上(水分2%)再经干燥可氯化钠制得食盐(table salt)。
氯化钠空间结构模型

在氯化钠晶体中,一个Na+位于晶胞的中心,12个Na+分别位于晶胞的12条棱上,则属于该晶胞的Na+相当于3个(×12=3,棱边上的每个Na+同时被4个晶胞共用,属于该晶胞的Na+仅占1/4),因此一个晶胞中共含有4个Na+,8个Cl-分别位于晶胞的8个顶点上,则属于该晶胞的Cl-相当于1个(×8=1,顶点上的每个Cl-同时被8个晶胞共用,属于该晶胞的Cl-仅占1/8),6个Cl-分别位于晶胞的6个面心上,则属于该晶胞的Cl-相当于3个(×6=3,面心上的每个Cl-同时被2个晶胞共用,属于该晶胞的Cl-仅占1/2),所以一个晶胞中共含有4个Cl-。
可见NaCl晶体中Na+、Cl-的个数比为1∶1。
图中位于晶胞中心的Na+实际上共有3个平面通过它,通过中心Na+的每个平面都有4个Na+位于平面的四角,这4个Na+与中心Na+距离最近且距离相等。
所以在NaCl晶体中,每个Na+周围与它距离最近且距离相等的Na+共有12个,按相似的方法可推出每个Cl-周围与它最近且距离相等的Cl-也共有12个。
氯化钠的晶胞结构

氯化钠的晶胞结构1. 简介氯化钠(NaCl)是一种常见的化合物,也是一种重要的无机盐。
它的晶胞结构是指它的晶体中,氯化钠分子的排列方式和结构特征。
氯化钠的晶胞结构具有一定的复杂性和稳定性,对于深入理解其物理性质和化学性质非常重要。
2. 宏观结构氯化钠晶体呈立方晶系,具有明显的立方结构特征。
在晶体中,钠离子(Na+)和氯离子(Cl-)依靠离子键紧密结合,形成稳定的晶格结构。
每个钠离子都被六个氯离子包围,而每个氯离子也被六个钠离子包围。
这种排列形式保证了晶体的整体稳定性,同时也决定了氯化钠晶体的许多物理性质。
3. 晶胞结构的基本单位氯化钠晶体的基本单位是晶胞。
晶胞是晶体中最小的重复单元,也是描述晶体结构的基础。
对于氯化钠晶体而言,每个晶胞内包含一个钠离子和一个氯离子。
晶胞的形状通常是立方体,每边的长度称为晶胞常数。
4. 晶胞参数氯化钠晶体的晶胞参数具有以下几个重要的特征:4.1. 晶胞常数晶胞常数是描述晶胞大小的参数,通常用a来表示。
对于氯化钠晶体而言,其晶胞常数为5.64埃(1埃=10^-10米)。
4.2. 离子半径离子半径是描述离子大小的参数。
在氯化钠晶体中,钠离子的半径为0.95埃,氯离子的半径为1.81埃。
4.3. 共晶位点共晶位点是指两种离子在晶胞中所占据的位置。
在氯化钠晶体中,钠离子和氯离子分别位于晶胞的正中间和角落位置。
4.4. 晶体密度晶体密度是指晶体中单位体积所包含的质量。
对于氯化钠晶体,其密度为2.16g/cm^3。
5. 晶体结构5.1. 离子键氯化钠晶体中的钠离子和氯离子之间通过离子键结合在一起。
离子键是由两种离子之间的电荷相互作用所形成的强力。
在氯化钠晶体中,钠离子失去一个电子成为Na+离子,氯离子获得一个电子成为Cl-离子,钠离子和氯离子之间的电荷相互作用使它们紧密结合在一起。
5.2. 离子排列在氯化钠晶体中,钠离子和氯离子呈交替排列的方式。
每个钠离子都被六个氯离子包围,而每个氯离子也被六个钠离子包围。
氯化钠晶胞结构

氯化钠晶胞结构
氯化钠的晶体结构:
氯化钠是食盐和石盐的主要成分,离子型化合物。
无色透明的立方晶体,熔点为801 ℃,沸点为1413 ℃,相对密度为2.165。
有咸味,含杂质时易潮解;溶于水或甘油,难溶于乙醇,不溶于盐酸,水溶液中性。
在水中的溶解度随着温度的升高略有增大。
当温度低于0.15 ℃时可获得二水合物NaCl·2H2O。
无机和有机工业用作制造氯气、氢气、盐酸、纯碱、烧碱、氯酸盐、次氯酸盐、漂白粉、金属钠的原料、冷冻系统的致冷剂,有机合成的原料和盐析药剂。
钢铁工业用作热处理剂。
高度精制的氯化钠用作生理盐水。
食品工业、日常生活中,用于调味等。
高温热源中与氯化钾、氯化钡等配成盐浴,可作为加热介质,使温度维持在820~960℃间。
此外、还用于玻璃、染料、冶金等工业。
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
氯碱工
业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
氯化钠的晶胞结构.ppt

不同类型的晶体
晶体概念
分子晶体
晶体判断
基本类型
原子晶体
课堂练习
离子晶体
知识归纳
晶体的概念
什么叫晶体?
Some substance have a characteristic shape of smooth , flat sides with shar edges and corners .
人造金刚石就是依据在5-7万大气压,1200℃-1800℃温度的条件下,
碳元素就会结晶成为金刚石这个原理用合金片作触媒使外加的压力
和温度降低,达到将碳转为金刚石的目的.
用途:金刚石的用途十分广泛,用量较大的是矿山、地质、煤田 勘探,公路建设、建材、国防等行业及高精尖科研领域。
液晶材料主要是脂肪族 、芳香族、硬脂酸等有 机物。液晶也存在于生 物结构中。日常生活中 ,适当浓度的肥皂水溶 液就是一种液晶。目前 已经发现或人工合成的 液晶材料已达五千多中 液晶显示器(liquid crystal)。
金属阳离子和自由电子
金属阳离子和自由电子以金属键结合形成金属晶体Metallic crystals
离子晶体
什么叫离子晶体?
离子间通过离子键结合而成的晶体。
离子晶体的特点?
无单个分子存在;NaCl不表示分子式。 熔沸点较高,硬度较大。 水溶液或者熔融状态下均导电。
哪些物质属于离子晶体?
强碱、部分金属氧化物、部分盐类。
例4、实现下列变化时,需克服相同类型作用力
的是
()
(A)水晶和干冰的熔化 (B)食盐和冰醋酸熔化
C)液溴和液汞的气化(D)纯碱和烧碱的熔化
氯化钠(Table salt Sodium Chloride) 的晶体结构
nacl晶体结构

nacl晶体结构
氯化钠的晶体结构:
氯化钠是食盐和石盐的主要成分,离子型化合物。
无色透明的立方晶体,熔点为801 ℃,沸点为1413 ℃,相对密度为2.165。
有咸味,含杂质时易潮解;溶于水或甘油,难溶于乙醇,不溶于盐酸,水溶液中性。
在水中的溶解度随着温度的升高略有增大。
当温度低于0.15 ℃时可获得二水合物NaCl·2H2O。
无机和有机工业用作制造氯气、氢气、盐酸、纯碱、烧碱、氯酸盐、次氯酸盐、漂白粉、金属钠的原料、冷冻系统的致冷剂,有机合成的原料和盐析药剂。
钢铁工业用作热处理剂。
高度精制的氯化钠用作生理盐水。
食品工业、日常生活中,用于调味等。
高温热源中与氯化钾、氯化钡等配成盐浴,可作为加热介质,使温度维持在820~960℃间。
此外、还用于玻璃、染料、冶金等工业。
工业上用电解饱和NaCl溶
液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
氯化钠(NaCl)晶体的晶胞解析
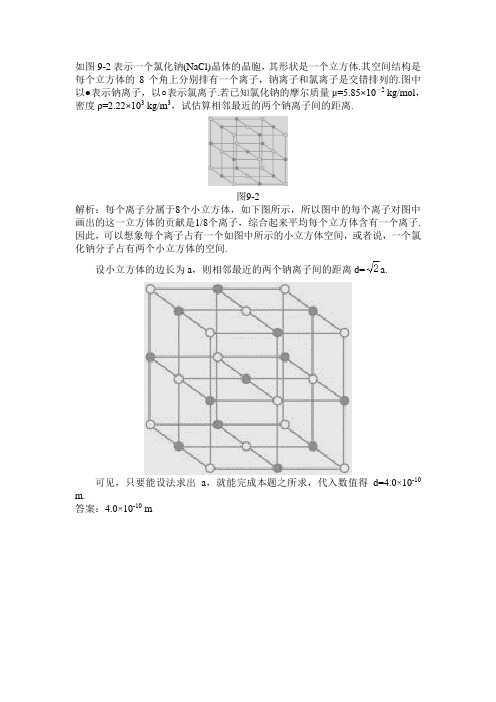
如图9-2表示一个氯化钠(NaCl)晶体的晶胞,其形状是一个立方体.其空间结构是每个立方体的8个角上分别排有一个离子,钠离子和氯离子是交错排列的.图中以●表示钠离子,以○表示氯离子.若已知氯化钠的摩尔质量μ=5.85×10-2 kg/mol,密度ρ=2.22×103 kg/m3,试估算相邻最近的两个钠离子间的距离.
图9-2
解析:每个离子分属于8个小立方体,如下图所示,所以图中的每个离子对图中画出的这一立方体的贡献是1/8个离子,综合起来平均每个立方体含有一个离子.因此,可以想象每个离子占有一个如图中所示的小立方体空间,或者说,一个氯化钠分子占有两个小立方体的空间.
设小立方体的边长为a,则相邻最近的两个钠离子间的距离d= a.
可见,只要能设法求出a,就能完成本题之所求,代入数值得d=4.0×10-10 m.
答案:4.0×10-10 m。
nacl晶胞的配位数

NaCl晶胞的配位数一、引言NaCl(氯化钠)是一种常见的离子化合物,具有岩盐的晶体结构。
在NaCl的晶体结构中,钠离子(Na+)和氯离子(Cl-)以离子键的方式结合,形成一个正负电荷相互平衡的晶胞结构。
配位数是指离子或原子周围邻近的其他离子或原子的数目。
本文将对NaCl晶胞的配位数进行探讨。
二、NaCl的晶胞结构NaCl的晶胞结构是典型的面心立方(FCC)结构。
每个钠离子都被6个氯离子所包围,而每个氯离子也被6个钠离子所包围。
这种排列方式使得正负电荷之间达到了最佳平衡,保持了晶体的稳定性。
三、NaCl晶胞的配位数NaCl晶胞中,每个离子或原子周围都有特定的邻近离子或原子。
下面将分别探讨钠离子和氯离子的配位数。
3.1 钠离子的配位数钠离子(Na+)的配位数为6。
具体而言,每个钠离子都被6个氯离子所包围。
这是因为在NaCl晶胞中,每个钠离子位于一个八面体的中心,而这个八面体的六个顶点分别和六个氯离子相接触。
3.2 氯离子的配位数氯离子(Cl-)的配位数也为6。
与钠离子类似,每个氯离子都被6个钠离子所包围。
在NaCl晶胞中,每个氯离子位于一个八面体的中心,而这个八面体的六个顶点分别和六个钠离子相接触。
四、NaCl晶胞的稳定性NaCl晶胞的配位数对于晶体的稳定性起着重要作用。
在NaCl晶胞中,钠离子和氯离子的配位数均为6,这种配位数的方式使得每个离子周围的邻近离子与其之间的电荷平衡最佳,从而保持晶体的稳定性。
五、其他晶胞的配位数除了NaCl晶胞外,还存在许多其他晶体结构,它们的配位数也各不相同。
例如,对于六方最密堆积(HCP)结构,每个原子的配位数为12;对于面心立方(FCC)结构,每个原子的配位数为12;对于体心立方(BCC)结构,每个原子的配位数为8。
六、总结NaCl晶胞的配位数是指周围邻近的其他离子或原子的数目。
在NaCl晶体中,钠离子和氯离子的配位数均为6,这种排列方式使得正负电荷之间达到了最佳平衡,保持了晶体的稳定性。
NaCl、CsCl、CO2、SiO2、金刚石、石墨、C60晶体结构的特点分析

晶体结构的特点分析通常采用均摊法来分析这些晶体的结构特点。
均摊法的根本原则是:晶胞任意位置上的原子如果是被n 个晶胞所共有,则每个晶胞只能分得这个原子的1/n 。
1. 氯化钠晶体由下图氯化钠晶体结构模型可得:每个Na +紧邻6个-Cl ,每个-Cl 紧邻6个+Na (上、下、左、右、前、后),这6个离子构成一个正八面体。
设紧邻的Na +与Cl -间的距离为a ,每个Na +与12个Na +等距离紧邻(同层4个、上层4个、下层4个),距离为a 2。
由均摊法可得:该晶胞中所拥有的Na +数为4216818=⨯+⨯,-Cl 数为441121=⨯+,晶体中Na +数与Cl -数之比为1:1,则此晶胞中含有4个NaCl 结构单元。
2. 氯化铯晶体每个Cs +紧邻8个Cl -,每个Cl -紧邻8个Cs +,这8个离子构成一个正立方体。
设紧邻的Cs +与Cl -间的距离为a 23,则每个Cs +与6个Cs +等距离紧邻(上、下、左、右、前、后)。
在如下图的晶胞中Cs +数为812164112818=+⨯+⨯+⨯,-Cl 在晶胞内其数目为8,晶体中的+Cs 数与-Cl 数之比为1:1,则此晶胞中含有8个CsCl 结构单元。
3. 干冰每个CO 2分子紧邻12个CO 2分子(同层4个、上层4个、下层4个),则此晶胞中的CO 2分子数为4216818=⨯+⨯。
4. 金刚石晶体(晶体硅同) 每个C 原子与4个C 原子紧邻成键,由5个C 原子形成正四面体结构单元,C-C 键的夹角为'28109︒。
晶体中的最小环为六元环,每个C 原子被12个六元环共有,每个C-C 键被6个六元环共有(用组合法计算一个碳原子所形成的4个键有C42= 6种两两相邻的组合,故一个碳原子最多可形成C42 ×2= 6× 2 =12个六元环;固定一个键,其余三个键与该键有C31 = 3种两两相邻的组合,故一个C-C 键最多可形成C31 ×2 = 6 个六元环.由"平均值原理"知一个六元环实际拥有6× 1/12 = 1/2个碳原子,拥有6× 1/6 = 1 个C-C 键.),每个环所拥有的C 原子数为211216=⨯,拥有的C-C 键数为1616=⨯,则C 原子数与C-C 键数之比为2:11:21=。
氯化钠的晶胞结构

8 2
4
12 1 4
常见晶体的微观结构
铯离子:体心
氯离子:顶点;或者反之。
(2)CsCl晶体 (1)铯离子和氯离子的位置:
(2)每个晶胞含铯离子、氯 离子的个数 铯离子:1个 ;氯离子:1个 (3)与铯离子等距离且最近 的铯离子、氯离子各有几个? 铯离子:6个 ;氯离子:8个
常见晶体的微观结构
非金属单质 气态氢化物 非金属氧化物 大多数有机物 金属单质 酸和极少数盐 和合金
四种晶体导电的比较
晶体类型 固体 熔化时 溶于水 离子晶体 导电 不导电 导电 (NaCl) 原子晶体 除半导体 除半导体 不导电 (SiO2) 外不导电 外不导电 分子晶体 部分 不导电 不导电 导电 (HCl)
金属晶体 (Cu)
3、分析下列物质的性质,判断晶体类型: A、碳化铝,黄色晶体,熔点2200℃,熔融 态不导电;________________ 原子晶体 B、溴化铝,无色晶体,熔点98 ℃,熔融态 分子晶体 不导电;________________ C、五氟化钒,无色晶体,熔点19.5℃,易 分子晶体 溶于乙醇、氯仿、丙酮中;______________ D、物质A,无色晶体,熔融时或溶于水中都 能导电_____________ 离子晶体
氯化钠的点阵结构

氯化钠的点阵结构
氯化钠是一种离子晶体,其点阵结构为面心立方晶格。
其晶格常数为5.64 Å。
氯离子在晶格中占据面心位置,钠离子则在其八面体空隙处。
氯化钠晶格中的每个空穴,都被八个钠离子所包围。
每个钠离子也被八个氯离子所包围。
这种八面体型的空隙和离子包围形式,在氯化钠的晶体结构中重复出现,形成了整个
晶体的共同结构。
氯化钠的点阵结构也可以用X射线衍射来确定。
这种方法在晶体结构研究中非常常用,因为它能够给出非常准确的晶体结构信息。
对于氯化钠这种简单的晶体结构来说,其X射
线衍射图形中的峰位,可以直接用来确定其晶体结构。
氯化钠是一种非常重要的化学物质,广泛应用于生物学、化学、工业以及医学等领域。
对其晶体结构的研究不仅具有纯学术意义,也对相应的应用具有重要的指导意义。
氯化钠化学结构式-概述说明以及解释

氯化钠化学结构式-概述说明以及解释1.引言1.1 概述氯化钠,化学式为NaCl,是一种常见的无机化合物。
它是由钠离子(Na+)和氯离子(Cl-)组成的晶体固体。
氯化钠在常温下呈现为白色晶体粉末或结晶体,可溶于水,但不溶于有机溶剂。
氯化钠是一种重要的化学物质,在日常生活中具有广泛的应用。
首先,它被广泛用作食盐,添加在食物中用来增加风味和保鲜。
此外,氯化钠还是水处理领域的一种常用材料,用于净化和消毒水源。
在化工工业中,氯化钠也用作许多化学反应的催化剂或原料。
氯化钠的化学结构式简单明了,将一个钠离子和一个氯离子结合在一起,形成了一个离子晶格结构。
在晶体中,钠离子和氯离子以离子键的方式相互吸引和结合,稳定地排列在一起。
这种离子晶格结构使得氯化钠具有一些特殊的化学性质,比如具有良好的溶解性和热稳定性。
综上所述,氯化钠是一种重要的化学物质,具有广泛的应用领域。
它的化学结构式简单明了,由钠离子和氯离子组成的离子晶格结构。
对氯化钠的深入研究可以帮助我们更好地理解和应用这种常见的化合物。
文章结构部分的内容应着重介绍整篇文章的组织架构和各部分的内容概要,为读者提供对全文结构的整体了解。
以下是对文章1.2部分的内容的一个示例:"1.2 文章结构本文主要围绕氯化钠的化学结构式展开讨论,全文分为以下几个部分:2.1 氯化钠的化学结构式:本节将详细阐述氯化钠(NaCl)的化学结构,并探讨其组成、原子排列以及配位关系等方面的内容。
我们将通过图表和文字的描述,帮助读者深入了解氯化钠的分子构象。
2.2 氯化钠的物理性质:在此部分,我们将重点介绍氯化钠的一些重要物理性质,如外观、溶解性、熔点、沸点等。
通过对氯化钠物理性质的解读,读者将对氯化钠的特征有更全面的认识。
通过以上两个部分的内容,我们将全面探讨氯化钠的化学结构及其相关的物理性质。
接下来的结论部分将对全文进行总结,并对氯化钠的研究和应用做出展望。
希望本文能为读者提供关于氯化钠化学结构式的详尽信息,并对其在不同领域的应用有所启发。
氯化钠晶体电子结构第一性质原理研究

目录氯化钠晶体电子结构第一性质原理研究摘要离子晶体的研究,一直是物理学着重研究的课题,一方面是它作为新型绝缘材料在技术上的广泛应用;另一方面是它在解释各种物理现象中扮演着重要角色。
现在随着人们对功能性材料研究的不断深入,各种具有特殊功能的晶体材料的研究和利用也引起越来越多研究者的关注,如今对于晶体电子结构的深入研究常常用较为简单的NaCl晶体结构,至此本文现如今以NaCl为例,应用第一性原理研究NaCl晶体结构并计算NaCl的电子结构、能带结构。
关键词离子晶体;Nacl;第一性原理;电子结构;能带结构Abstractkeywords1、前言1.1氯化钠简介1.1.3研究背景作用和用途无机物和有机物工业用作制造氯气、氢气、盐酸、纯碱、烧碱、铝酸盐、次氯酸盐、漂白粉、金属钠的原料、冷冻系统的致冷剂,有机合成的原料和盐析药剂。
钢铁工业用作热处理剂。
高度精制的氯化钠用作生理盐水。
食品工业、日常生活中,用于调味等。
高温热源中与氯化钾、氯化钡等配成盐浴,可作为加热介质,使温度维持在820~960℃之间。
此外、还用于玻璃、染料、冶金等工业。
1.1.1物理性质氯化钠,无色立方体结晶或白色结晶。
溶于水、甘油,微溶于乙醇、液氨。
不容于盐酸。
在空气中微有潮解性。
用于制造纯碱和烧碱及其其他化工场品,矿石冶炼。
食品工业和渔业用于盐碱,还可以用作调味的原料与精制食盐。
它的它是离子晶体,PH值为:6.75~7.34;熔点为801C0;沸点为1413C0,;水解度:常温(25C0)下每100g可溶解约36.2g,溶解度随着温度变化而变化如表格:60 37.370 37.880 38.490 39.0100 39.81.1.2化学性质1.2氯化钠晶体结构介绍氯化钠晶体,也就是人们常常说的食盐,其晶体具有规则的立方体外形。
氯化钠晶体内部结构,是人类测试的第一个晶体结构。
氯化钠是晶体。
在氯化钠晶体中,每个氯离子的周围都有6个钠离子,每个钠离子的周围也有6个氯离子。
NaCl、CsCl、CO2、SiO2、金刚石、石墨、C60晶体结构的特点分析

晶体结构的特点分析通常采用均摊法来分析这些晶体的结构特点。
均摊法的根本原则是:晶胞任意位置上的原子如果是被n 个晶胞所共有,则每个晶胞只能分得这个原子的1/n 。
1. 氯化钠晶体由下图氯化钠晶体结构模型可得:每个Na +紧邻6个-Cl ,每个-Cl 紧邻6个+Na (上、下、左、右、前、后),这6个离子构成一个正八面体。
设紧邻的Na +与Cl -间的距离为a ,每个Na +与12个Na +等距离紧邻(同层4个、上层4个、下层4个),距离为-Cl 数为a 2。
由均摊法可得:该晶胞中所拥有的Na +数为4216818=⨯+⨯,441121=⨯+,晶体中Na +数与Cl -数之比为1:1,则此晶胞中含有4个NaCl 结构单元。
2. 氯化铯晶体每个Cs +紧邻8个Cl -,每个Cl -紧邻8个Cs +,这8个离子构成一个正立方体。
设紧邻的Cs +与Cl -间的距离为a 23,则每个Cs +与6个Cs +等距离紧邻(上、下、左、右、前、后)。
在如下图的晶胞中Cs +数为+Cs 数与812164112818=+⨯+⨯+⨯,-Cl 在晶胞内其数目为8,晶体中的-Cl 数之比为1:1,则此晶胞中含有8个CsCl 结构单元。
3. 干冰每个CO 2分子紧邻12个CO 2分子(同层4个、上层4个、下层4个),则此晶胞中的CO 2分子数为4216818=⨯+⨯。
4. 金刚石晶体(晶体硅同) 每个C 原子与4个C 原子紧邻成键,由5个C 原子形成正四面体结构单元,C-C 键的夹角为'28109︒。
晶体中的最小环为六元环,每个C 原子被12个六元环共有,每个C-C 键被6个六元环共有(用组合法计算一个碳原子所形成的4个键有C42= 6种两两相邻的组合,故一个碳原子最多可形成C42 ×2= 6× 2 =12个六元环;固定一个键,其余三个键与该键有C31 = 3种两两相邻的组合,故一个C-C 键最多可形成C31 ×2 = 6 个六元环.由"平均值原理"知一个六元环实际拥有6× 1/12 = 1/2个碳原子,拥有6× 1/6 = 1 个C-C 键.),每个环所拥有的C 原子数为211216=⨯,拥有的C-C 键数为1616=⨯,则C 原子数与C-C 键数之比为2:11:21=。
晶体结构中的模板——氯化钠

晶体结构中的模板——氯化钠丛高(江苏省如东县教育局教研室226400)摘要:通过举例介绍了在多种晶体结构中起着桥梁性作用的结构模板——氯化钠,揭示了面心立方晶胞与其它多种立方晶系等之间的衍生关系,强化了氯化钠这种典型结构在建模思维中的举一反三功能。
关键词:晶胞面心立方空隙配位数投影实际教学过程中,我们发现许多重要的晶体结构可以看作是氯化钠的“结构相关型”,可以这样说作为典型结构的氯化钠在晶体结构中起着结构模板的作用,掌握好它对于深入学习晶体结构无疑具有深远的意义。
图1为氯化钠晶体模型,简言之,在空间三维方向上Cl-和Na+都呈交替间隔排列,其中Cl-(或Na+)位于顶点和面心,则Na+(或Cl-)位于体心和棱心。
图1 氯化钠晶体模型1 堆积—填隙氯化钠的晶胞类型是面心立方,Cl-的堆积方式是面心立方堆积(即A1,晶胞参数为a,a适用全文),Na+填充所有的八面体空隙(图2),所以氯化钠的堆积周期可表示为…A c B a C b A c B a C b…,其中A、B、C表示Cl-层,a、b、c表示Na+层。
且有Cl-(或Na+)数目与八面体空隙、四面体空隙之比是1∶1∶2。
八面体空隙四面体空隙CaF2立方ZnS 金刚石图2氯化钠型的还有:锂钠钾铷的卤化物、氟化银、镁钙锶钡的氧化物等;还有许多结构可以看作氯化钠的“结构相关型”:如把氯化钠晶体的Na+换成Fe2+,Cl-换成S22-,就得到黄铁矿晶体,只是由于S22-存在不同的4种取向,无法进行面心平移,故原面心立方晶胞转变为简单立方晶胞。
同样,方解石(CaCO3)晶体也可看作是氯化钠的“结构相关型”,在中国化学会第23届全国高中学生化学竞赛(省级赛区)试题中曾出现,由于所给的平行六面体平行棱上的CO32-的取向不同,因而不是方解石的晶胞,其正当晶胞其实是菱方晶胞,可●:Cl-○:Na+以理解成“顺着碳酸根平面的法线方向压扁了的氯化钠结构型”[1]。
氯化钠和氯化铯晶体结构

氯化钠和氯化铯晶体结构
氯化钠和氯化铯是两种常见的离子晶体,它们是由离子相互组成
的结晶体,在此,我将分步骤阐述它们的晶体结构。
第一步:离子的组成
氯化钠晶体由钠离子和氯离子构成,钠离子具有正电荷,氯离子具有
负电荷。
氯化铯晶体也是由铯离子和氯离子组成的,铯离子同样具有
正电荷,氯离子仍旧是负电荷。
第二步:晶体结构
氯化钠晶体和氯化铯晶体的基本结构相同。
它们都是具有面心立方结
构的晶体。
在这种结构中,每个正离子都被六个负离子所包围,每个
负离子也被六个正离子所包围。
这种结构被称为离子晶体的典型结构。
第三步:晶格常数
氯化钠晶体的晶格常数是 5.6 Å,而氯化铯晶体的晶格常数是 6.05 Å。
它们的晶格常数取决于离子的大小和间距。
第四步:晶体稳定性
氯化钠晶体和氯化铯晶体都很稳定,它们的结构经过长时间的研究和
分析,被确认为是离子晶体中最重要的两种结构。
它们的晶格稳定性
和离子键的强度也成正比。
综上所述,氯化钠和氯化铯晶体都是具有离子晶体结构的晶体。
它们的结构基本相同,但晶格常数会有所不同,离子的大小和间距也
对其晶格常数产生影响。
这两种晶体都非常稳定,通常被用于各种领域。
例如,氯化钠被用于研究生命体系中的离子传输;而氯化铯被广
泛用于原子钟。
氯化钠晶胞 四面体空隙大小

氯化钠晶胞四面体空隙大小氯化钠是常见的盐类化合物,由钠离子和氯离子组成。
在固态氯化钠中,钠离子和氯离子按照一定比例排列成晶体结构,形成了晶格。
氯化钠的晶胞是一个立方体,其中每个角落上有一个钠离子和一个氯离子相邻,每个面心上有一个氯离子和一个钠离子相邻,每个体心上有一个氯离子和一个钠离子相邻。
这个晶胞的结构称为面心立方格子。
在氯化钠的晶胞中,存在四面体空隙。
四面体空隙是指晶格中的一种空隙,由四个离子构成一个四面体形状。
氯化钠晶胞中的四面体空隙由两个钠离子和两个氯离子共同构成,其中两个离子在同一面心上,另外两个离子在另一面心上。
这种四面体空隙的大小与晶胞中离子的尺寸密切相关。
在氯化钠的晶胞中,离子的尺寸可以用离子半径来衡量。
离子半径是离子的中心到离子球面的距离。
在氯化钠中,钠离子的离子半径为0.102 nm,氯离子的离子半径为0.181 nm。
在晶胞中,四面体空隙的大小可以用四面体空隙半径来衡量。
四面体空隙半径是指四面体空隙中心到四个离子的球面的距离。
在氯化钠中,四面体空隙半径约为0.276 nm。
由于离子的尺寸和四面体空隙的大小的关系,氯化钠的晶格中存在着一定的缺陷。
当一个离子尺寸较大时,它在晶格中占据的空间会比较大,从而导致四面体空隙变小。
这种情况下,晶格中的四面体空隙就会被占据,形成缺陷。
相反,当离子尺寸较小时,四面体空隙就会变大,晶格中就存在着空隙。
这种情况下,晶格中的缺陷就会被填充。
总的来说,氯化钠的晶胞四面体空隙大小与晶格中离子的尺寸密切相关。
四面体空隙的大小和离子的尺寸决定了晶格中的缺陷和空隙。
这些缺陷和空隙对于氯化钠的性质和应用有着重要的影响。
氯化钠结构简式

氯化钠结构简式
氯化钠(NaCl)是一种常见的盐类化合物,由钠离子(Na+)和氯离子(Cl)组成。
其结构可以用简式表示如下:
Na+Cl
在简式中,Na+表示一个钠离子,Cl表示一个氯离子。
钠离子和氯离子通过离子键相互吸引在一起,形成了一个离子晶体
结构。
离子晶体是由正负电荷互相吸引的离子构成的三维排列。
氯化钠结构的特点是:钠离子和氯离子呈现等量的正负电荷,通过离子键相互结合,形成一个离子晶体结构。
由于离子晶体
具有高度有序的结构,氯化钠晶体呈现出透明的外观。
氯化钠在固态下呈结晶盐的形态,可以形成立方晶体结构。
每个钠离子被六个氯离子包围,每个氯离子被六个钠离子包围。
这种结构被称为面心立方结构,每个离子被称为一个晶胞。
总结起来,氯化钠的简式结构可以用Na+Cl来表示,这两
种离子通过离子键相互吸引,在固态下形成一个有序的离子晶
体结构。
氯化钠晶体结构模型

氯化钠晶体结构模型
氯化钠是一种常见的化学物质,广泛应用于食品加工、医药制造、化工等领域。
它的晶体结构模型具有重要的理论和实际意义。
下面将从晶体结构的基本概念、氯化钠晶体结构的特点和应用等方面介绍氯化钠晶体结构模型。
晶体结构是指物质中原子、离子或分子的排列方式和周期性。
晶体结构的研究对于理解物质的性质和开发新材料具有重要意义。
氯化钠晶体是一种离子晶体,由氯离子和钠离子组成。
在晶体结构中,离子之间通过电磁力相互作用形成稳定的结构。
氯化钠晶体结构的特点是具有面心立方结构。
在晶体中,钠离子和氯离子交替排列,每个钠离子周围都有六个氯离子,每个氯离子周围也有六个钠离子。
这种排列方式使得氯化钠晶体具有高度的稳定性和均匀性。
氯化钠晶体结构模型的应用非常广泛。
首先,在食品行业中,氯化钠用作调味剂,其晶体结构的稳定性和均匀性保证了食品的品质。
其次,在医药制造中,氯化钠用于注射液和口服溶液的制备,其晶体结构保证了药物的溶解性和稳定性。
此外,氯化钠还用于水处理、冶金、化工等领域,其晶体结构的特点使其在这些领域中具有重要的应用价值。
总结一下,氯化钠晶体结构模型具有面心立方结构,由氯离子和钠
离子交替排列形成。
其晶体结构的稳定性和均匀性保证了氯化钠的广泛应用。
氯化钠晶体结构模型在食品、医药、化工等领域具有重要的实际应用价值。
对于深入理解晶体结构和开发新材料具有重要的理论意义。
通过对氯化钠晶体结构模型的研究,可以为相关领域的发展提供理论指导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铜 2CH3CH2OH+O2加热 2CH3CHO+2H2O
结束
第五节 乙醛
结束
一、乙醛的结构
1、分子式: 2、结构式: 3、结构简式: 4、官能团:
结束
二、物理性质
1、无色液体 2、刺激性气味 3、密度比水小
4、易溶于水(能与水以任意比例互溶)、易溶于有机物
(4)银氨溶液是很弱的氧化剂,它都可以氧化醛
说明什么问题?
结束
(3)和新制的氢氧化铜悬浊液的反应。
加热
CH3CHO+2Cu(OH)2
Cu2O↓+CH3COOH+2H2O
结束
思考:
1、某一有机物中既含有双键又含有醛基,设计一 个实验证明该物质有双键存在? 2、某一有机物中既含有双键又含有醛基,设计一 个实验证明该物质有醛基存在?
结束
三、化学性质
1、加成反应
催化剂
CH3CHO+H2 加热
CH3CH2OH
(1)有机还原反应:
有机化学中把加氢或是去氧的反应叫还原反应。
(2)有机氧化反应:
有机化学中把去氢或是加氧的反应叫氧化反应。
结束
醇
还原
醛
氧化
结束
2、乙醛的氧化反应。 (1)直接被氧气氧化
Ni
2CH3CHO+O2 加热 2CH3COOH
结束
小结:
醇 还原 醛 氧化 酸
氧化 醛既有氧化性又有还原性
结束
四、醛类 1、醛类的结构特点和通式
R—CHO
饱和一元醛的通式:CnH2nO n≥1 2、醛的化学通性 (1)都可以发生加成反应生成醇
结束
(2)都可以发生氧化反应 银镜反应 被新制的氢氧化铜悬浊液氧化
醛 被氧气氧化
发生燃烧反应
使高锰酸钾酸性溶液褪色
4、醛的同分异构体的写法
(1)写出符合分子式C4H8O属于醛的同分异 构体的结构简式。 (2)写出符合分子式C5H10O属于醛的同分异 构体的结构简式。
结束
5、甲醛的同系物的结构特点和物理通性 (1)结构特点:
含有一醛基、烃基是饱和的。
(2)物理通性 含有一到三个碳原子的醛能以任意比例 和水互溶。
工业上用此法制被乙酸
氧化
醛
酸
结束
(2)银镜反应
AgNO3+NH3·H2O==AgOH↓+NH4NO3 AgOH+2 NH3·H2O==[Ag(NH3)2]OH+2H2O
加热
CH3CHO+2 [Ag(NH3)2]OH 2Ag ↓+CH3COONH4+3NH3+H2O
(1)这个反应叫银镜反应,实质的反应类型是? (2)试管上的银怎样洗涤? (3)这个性质有什么工业价值?
结束
3、甲醛的性质
(1)物理性质 无色有刺激性气味的气体,易溶于水、35%—— 40%的甲醛的水溶液叫福尔马林。
(2)甲醛的用途
(3)甲醛的化学性质
加热
HCHO+ 4 [Ag(NH3)2]OH
4Ag ↓+CO2↑+8NH3+3H2O
加热
HCHO+4Cu(OH)2
2Cu2O↓+CO2↑+5H2O
结束
结束
