九年级化学元素周期表专项练习
初中化学元素周期表100道练习题

初中化学元素周期表100道练习题一、选择题(每题2分,共60分)1. 元素周期表是根据元素的什么性质排列的?(A)原子质量(B)原子序数(C)元素的单质(D)元素的氧化价答案:B2. 原子的核外电子称为什么?(A)质子(B)中子(C)电子(D)伽玛射线答案:C3. 下列元素中,哪个元素的原子序数最小?(A)氢(B)氧(C)铁(D)铜答案:A4. 具有相同元素符号的原子,它们的原子序数是否相等?(A)相等(B)不相等答案:B5. 元素周期表第一周期有几个元素?(A)2个(B)4个(C)8个(D)18个答案:A...二、填空题(每题3分,共30分)1. 具有相同原子序数的元素称为_____。
答案:同位素2. 原子的质子数等于其原子序数,如果一个元素的原子序数为17,那么它的质子数是_____。
答案:173. 氧的原子序数是_____, 其符号是_____。
答案:8,O4. 元素周期表上第一个周期只有两个元素,它们是氢和_____。
答案:氦5. 钠的原子序数是_____, 其符号是_____。
答案:11,Na...三、简答题(每题10分,共10分)1. 请简要介绍一下元素周期表的发现和组成原理。
答案:元素周期表是由德国化学家门捷列夫于1869年发现的。
它根据元素的原子序数,将元素按照递增的顺序排列,同时根据元素的化学性质划分为不同的周期表们,周期表的行称为周期,列称为族。
元素周期表的设计整齐清晰,方便研究和记忆各个元素的性质和特点。
...四、综合题(每题15分,共15分)1. 下表是某元素周期表的一部分,请填写表格中的缺失信息:| 元素符号 | 原子序数 | 原子质量 |答案:- Be的原子质量:9.012- B的原子序数:5- N的原子序数:7- O的原子序数:8...注意:以上题目仅供参考,具体题目和答案还需根据实际情况进行调整。
九年级化学(元素周期表)同步练习题

九年级化学(元素周期表)同步练习题
1. 第一题
题目:请列出前五个元素的名字和符号。
答案:
- 氢(H):Hydrogen
- 氦(He):Helium
- 锂(Li):Lithium
- 铍(Be):Beryllium
- 硼(B):Boron
2. 第二题
题目:请写出氧气(O2)和氧化钙(CaO)的化学式。
答案:
- 氧气(O2):Oxygen
- 氧化钙(CaO):Calcium oxide
3. 第三题
题目:请定义“周期表”。
答案:
周期表是一张显示所有已知化学元素的表格。
元素按原子序数排列,从左到右和从上到下按照一定规律分布。
周期表提供了有关各元素的化学性质和特征的信息。
4. 第四题
题目:请解释“原子序数”的含义。
答案:
原子序数是指元素的原子核中所含质子的数量,也等于元素中电子数的数量。
原子序数决定了元素的化学性质和特征,不同的原子序数对应不同的元素。
5. 第五题
题目:请说明同一周期内元素性质的变化规律。
答案:
同一周期内的元素性质变化规律是:从左到右,原子序数逐渐增加,原子半径逐渐减小,电子云层逐渐靠近原子核,元素性质逐渐变为非金属性质。
初中化学元素周期表练习题及答案

初中化学元素周期表练习题及答案1. 以下不属于主族元素的是:a) 碳b) 铜c) 锌d) 铝答案: b) 铜2. 下列元素中,原子序数最小的是:a) 氧b) 氢c) 氮d) 锂答案: b) 氢3. 元素周期表中,横行被称为:a) 周期b) 纵行c) 族d) 分组答案: a) 周期4. 下列元素中,能形成正离子的是:a) 氯b) 溴c) 氧d) 氖答案: a) 氯5. 元素周期表中第一周期有几个元素?a) 4b) 6c) 8d) 2答案: d) 26. 下列元素中,化学性质相似的是:a) 镁、铝、硅b) 碳、氧、氮c) 钾、钙、铷d) 锌、铁、铜答案: b) 碳、氧、氮7. 具有类似电子结构的元素在元素周期表中位于同一:a) 周期b) 族c) 分组d) 列答案: a) 周期8. 具有相同周期的元素,其原子核中的电子层数:a) 相等b) 不相等c) 无法确定d) 取决于元素种类答案: a) 相等9. 在元素周期表中,第一周期元素是:a) 碱金属b) 碱土金属c) 非金属d) 惰性气体答案: a) 碱金属10. 具有不完全填满外层电子层的元素,其化学性质更倾向于成为:a) 阴离子b) 阳离子c) 氧化剂d) 物质答案: b) 阳离子总结:元素周期表是化学中重要的工具,帮助我们理解和组织化学元素。
通过掌握元素周期表的基本知识,我们可以更好地理解元素的性质和周期规律。
希望以上练习题能够帮助您巩固对元素周期表的了解。
九年级化学元素习题精选

九年级化学元素习题精选习题精选(一)1.一种元素跟另一种元素之间的最本质的不同点是()。
A.质子数B.中子数C.电子数D.相对原子质量2.地壳中含量最多的四种元素,由多到少的排列顺序正确的是()。
A.Si、O、Fe、AlB.O、Si、Al、FeC.Al、Fe、Si、OD.O、Fe、A1、Si3.表示4个氮原子的符号是()。
A.N4B.4N2C.2N2D.4N4.下列符号中,同时表示一种单质、一种原子和一种元素的是()。
A.2OB.H2C.ND.Fe5.下列元素符号中,书写正确的是()。
A.MnB.CAC.alD.Hg6.食用碘盐可预防甲状腺肿等疾病。
市售加碘食盐的包装袋上标明每千克含碘20~40mg,这里标明的碘的含量是指()。
A.碘单质B.碘分子C.碘元素D.碘原子7.在元素周期表中,非金属元素主要位于()。
A.左上方区域B.右上方区域C.左下方区域D.右下方区域8.写出下列元素的符号或名称。
硫,钙,钾,Zn ,Ba ,Mn 。
9.过氧化氢(H2O2,又名“双氧水”)是实验室制取氧气的原料,也是隐形眼镜洗液的主要成分。
过氧化氢是由氢和氧组成的,科学实验证明:在1个过氧化氢分子中含有2个氢和2个氧。
(填“元素”或“原子”)10.X、Y、Z三种原子的原子核中质子数相同,但中子数不同,它们是元素的原子。
(填“同”或“不同”)参考答案:1.A 2.B 3.D 4.D 5.A、D 6.C 7.B8.S Ca K 锌钡锰9.元素元素原子原子10.同不同习题精选(二)一、选择题1.下列各组物质中,前一种是单质,后一种是混合物的是()A.铝、二氧化硫B.冰、水蒸气C.水银,食盐水D.氮气、空气2.下列物质中,属于化合物的是()A.水B.食盐水C.氮气D.红磷3.下列物质中,不属于氧化物的是()A.高锰酸钾B.五氧化二磷C.水D.氧化镁4.地壳中含量最多的金属元素是()A.氧元素B.铁元素C.硅元素D.铝元素5.一瓶气体经过化验和其中只有一种元素,则该气体是()A.一种单质B.一种化合物C.单质、化合物的混合物D.既可能是一种单质,也可能是几种单质的混合物二、填空题1.在氯化钠、五氧化二磷、氯酸钾、二氧化锰、水、二氧化碳、空气、氧气、碳中,①属于混合物的是_______,②属于纯净物的是_______,③属于单质的是_______,④属于化合物的是_______,⑤属于氧化物的是_______,⑥含有氧分子的是_______。
科学版九年级上册化学 2.4.2 元素符号元素周期表 重点习题练习复习课件

12.(1)用恰当的元素符号填空: ①地壳中含量最多的金属元素是____A_l___; ②相对原子质量最小的元素是____H____; ③常温下为液态的金属元素是___H_g____; ④三个硫原子:___3_S____; ⑤两个铁离子:__2_F_e_3_+__。
(2)写出下列符号表示的意义: ①Cl:氯__元__素__,__一__个__氯__原__子____________________; ②2Fe:__两__个__铁__原__子_________________________; ③5Mg2+:_五__个__镁__离__子_______________________。
【解析】只由一种元素组成的纯净物叫单质,一种元素也 可以组成混合物,故A错;由不同种元素组成的纯净物叫 化合物,所以化合物中一定含有不同种元素,故B正确; 混合物中一定含多种物质,不一定含多种元素,如氧气和 臭氧的混合物中只含一种元素,故C错;由两种元素组成, 且其中一种为氧元素的化合物叫氧化物,所以含有氧元素 的化合物不一定是氧化物,故D错。 【答案】B
第二章 空气时
元素符号 元素周期表
1.【中考·桂林】元素“Al”的名称是( B ) A.氯 B.铝 C.硅 D.氦
2.下列元素名称与其对应的元素符号完全正确的是( C )
A.氯cl
B.氖 Na
C.镁Mg
D.铜Ca
3.【中考·河南】下列各组元素中,元素符号的第
(3)上述(2)中符号,既有宏观意义,又有微观意义的是 ____①______,只有微观意义的是____②__③____。
(4)说出下列符号中数字“2”的意义。
①2F:___2_个__氟__原__子_____;
②Mg2+:____1_个__镁__离__子__带__2_个__单__位__正__电__荷____;
九年级化学化学元素专题训练必考含答案

九年级化学化学元素专题训练必考含答案学校:___________姓名:___________班级:___________考号:___________一、单选题1.门捷列夫发现元素周期律具有重要的历史意义。
下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最外层电子数之和为8,下列正确的是( )A.Y的氢化物的形式为YH3B.W的单质具有助燃性C.X的氧化物的形式为X2O3D.W的氢化物溶于水显酸性2.下列化学符号中,既能表示一个原子,又能表示一种物质的是( )A.2H B.Zn C.O2D.N3.地壳里含量最多的金属元素是A.铁B.铝C.氧D.硅4.汞对环境和人类健康有较大的负面影响,为此,要在汞的生产、使用等环节加以严格控制,如图是元素周期表中汞元素的信息示意图,下列有关汞的说法错误的是A.汞原子比铁原子质量大(铁原子相对原子质量为56)B.汞原子的核外电子数为80C.测体温时,体温计中的汞升高是因为汞原子体积变大了D.汞是常温下呈液态的金属,具有导电性5.下列有关资源的叙述正确的是( )A.地壳中含量最多是金属元素是铁,目前提取量最大的也是铁B.海水中含有80多种元素,含量最多的非金属元素是氯C.世界上铜的年产量已超过了铝,位于铁之后,居第二位D.目前世界上已有50%以上的铁得到了回收利用6.元素周期表是学习化学的重要工具,如图是元素周期表中的一格,从图获得的正确信息是A.该元素的原子在化学反应中易失去电子B.该元素的质子数为9C.该元素在地壳中的含量为19.00%D.该元素属于金属元素7.“高钙牛奶”中的钙应理解为( )A.离子B.原子C.分子D.元素8.下列符号中,既表示一种元素,又能表示该元素的一个原子,还表示一种物质的是( ) A.H B.N C.H2D.Cu二、填空题9.图一是锶元素在周期表中的信息,图二是几种粒子的结构示意图。
请回答:图一中锶原子的核外电子数为______,图二中表示阴离子的是________(填序号);③中表示的元素在周期表中排在第_____周期。
(完整版)元素周期表练习题(附答案)

元素周期表练习题 一、选择题(每小题只有1个选项符合题意)[ ]1.下列关于元素周期表的说法,错误的是A.元素周期表是元素按原子量大小排列而成的B.从第一周期到第三周期元素,其原子的价电子数和族数是一致的C.主族元素中(氢除外)族序数越小的元素,其最高价氧化物的水化物碱性越强D.元素周期表是元素周期律的具体表现形式[ ]2.下列各图若为元素周期表的一部分(表中数字为原子序数),其中正确的是[ ]3.下列各组中的元素用原子序数表示,其中都属于主族的一组元素是A.2、4、6 B.19、20、21C.1、3、5 D.8、16、18[ ]4.主族元素在周期表中的位置取决于元素原子的A.原子量和核外电子数 B.电子层数和最外层电子数C.原子量和最外层电子数 D.电子层数和次外层电子数二、选择题(每小题有1或2个选项符合题意)[ ]6.下列关于周期表中第三周期元素性质从左到右变化趋势的叙述,错误的是A.最高正价依次升高B.气态氢化物稳定性逐渐增强C.原子半径逐渐增大D.最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强[ ]7.下列气态氢化物中,按稳定性由强到弱的顺序排列的是A.HI、HBr、HCl、HF B.HCl、H2S、PH3、SiH4C.H2O、H2S、HCl、HBr D.HF、H2O、NH3、CH4[ ]8.下列各组元素最高价氧化物对应水化物碱性渐弱,酸性渐强的是A.NaOH、Mg(OH)2、H3PO4、H2SO4B.KOH、NaOH、H2SO4、HClO4C.Be(OH)2、Ca(OH)2、HBrO4、HClO4D.Mg(OH)2、Ba(OH)2、H3PO4、H2SO4[ ]9.同主族3种元素X、Y、Z,已知它们的最高价氧化物对应水化物的酸性HXO4>HYO4>HZO4则下列判断正确的是A.原子半径X>Y>Z B.气态氢化物稳定性HX<HY<HZC.非金属性X>Y>Z D.气态氢化物还原性HX>HY>HZ[ ]10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是A.R元素处于3周期ⅥA族B.R元素是较活泼的非金属元素C.原子核外共有14个电子D.元素最低化合价为-2价[ ]11.某元素Y的核外电子数等于核内中子数,取2.8 g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则该元素在周期表中位置A.第三周期 B.第二周期C.第ⅣA族 D.第Ⅴ族[ ]12.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是内层电子总数的一半,Y的二价阴离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是A.Z是酸性氧化物B.Z的水化物是碱C.Z的化学式为X2Y D.Z的水化物的酸性强于硫酸[ ]13.A、B、C 3种元素的核外电子数都比氩原子少,若A和C处于同一主族,A和B的核电荷数之差为5,B原子的M电子层比L电子层少2个电子,则A、B、C 3种元素分别为A.Li、Na、S B.Na、S、LiC.Na、K、Br D.K、Br、Na[ ]14.X和Y 2元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径,X、Y、Z3种元素原子序数的关系是A.X>Y>Z B.Y>X>Z C.Z>X>Y D.Z>Y>X[ ]15.短周期元素X和Y能形成XY4化合物,若X的原子序数为m,Y的原子序数为n,则m和n 不可能的关系是A.m-13=n B.n+5=m C.m+8=n D.n-11=m[ ]16.某元素原子最外电子层上只有两个电子,该元素A.一定是金属元素B.一定是ⅡA族元素C.一定是过渡元素D.可能是金属元素,也可能不是金属元素三、填空题1.在短周期元素中:①金属性最强的元素是________,与水反应最剧烈的非金属是________;②地壳中含量最丰富的元素位于第________周期第________族,地壳中含量最多的金属元素位于周期表的第________周期第________族.在11~18号的元素中;③原子半径最小的元素是________,阳离子半径最小的是________,阴离子半径最小的是________;④最高价氧化物中既能与盐酸,又能与烧碱反应的有________.2.在短周期元素中:原子核外电子总数是其最外层电子数2倍的元素是________,原子电子层数和核外最外层电子数相等的元素是________,最外层电子数为电子层2倍的元素是________.3.已知X、Y是前20号元素,X、Y的最外层有n和m-5个电子,次外层有n+2和m个电子,则X、Y为________和________(写出元素符号).4.某元素的原子具有3个电子层,最外电子层上有5个电子,它在周期表中的位置是________,它的最高价氧化物的化学式是________,最高价氧化物对应的水化物的化学式是________.写出它与足量烧碱溶液反应的离子方程式________.5.原子序数为34的元素在周期表中的位置________.其最高价氧化物的化学式________,最高价氧化物对应水化物的化学式________,气态氢化物的化学式________.6.A、B、C 3种短周期元素,A、B为同一周期,B的原子序数比A的原子序数大1,B和C的原子最外层电子数相同,B原子比C原子多8个电子,3种元素的原子序数之和为33,3种元素原子最外层电子数之和为11,则3种元素的名称分别是A________、B________、C________,其中原子半径最大的元素(写元素符号)________,写出3种元素最高价氧化物对应水化物的化学式(按酸性逐渐增强的顺序排列)________.7.取钠、镁、铝的单质各1g,分别与足量盐酸反应,产生氢气最快的是________,产生氢气最多的是________,反应中失电子数目最多的是________,还原性最强的是________,生成氢气的物质的量之比是________. 一、1.A,2.D,3.A,4.B,二、6.C,7.B、D,8.A、B,9.C,10.C,11.A、C,12.A,13.B,14.D,15.C,16.D三、1.①Na,F2;②2、ⅥA,3、ⅢA;③Cl,Al3+,Cl-;④Al2O32.Be,H、Be、Al,He、C、S.3.S、Al5.4周期ⅥA族;SeO3,H2SeO4,H2Se6.铝、硅、碳、Al,Al(OH)3<H4SiO4<H2CO37.钠,铝,铝,钠,36∶69∶92四、A、B、C、D4种元素分别为H、N、S、K,(略). 。
初三元素周期表背诵练习题

初三元素周期表背诵练习题元素周期表是化学中一个重要且基础的知识点,对于初三的学生来说,熟练背诵和理解元素周期表中的元素是非常关键的。
本文将提供一些初三学生可以使用的元素周期表背诵练习题,以帮助他们加强对元素的记忆和理解。
练习题一:填写元素名称根据元素的序号填写对应的元素名称。
例如:序号1对应的元素是氢。
1. H2. O3. He4. C5. N练习题二:填写元素符号根据元素的名称填写对应的元素符号。
例如:氧的元素符号是O。
1. 氢2. 碳3. 氧4. 铁5. 铜练习题三:判断正误判断下列语句的正误,正确的写“√”,错误的写“×”。
1. 元素周期表是按照元素的原子序数大小排列的。
2. 氧气的化学式是O2。
3. 锌的元素符号是Zn。
4. 动态周期表是一种可以展示元素周期性变化的工具。
5. 铁是位于第八周期的元素。
练习题四:填写元素的基本信息根据提供的问题,填写对应元素的基本信息。
1. 氢的元素符号是什么?它在元素周期表中的位置是?2. 氧的元素符号是什么?它的原子序数是多少?3. 碳的元素符号是什么?它的原子质量是多少?4. 硫的元素符号是什么?它是什么颜色的非金属元素?5. 铂的元素符号是什么?它是一种什么颜色的贵金属?练习题五:元素周期表的分组和周期填写下列句子中的空格。
1. 元素周期表的垂直列称为______。
2. 具有相似化学性质的元素位于同一______中。
3. 前两个周期都有多少个元素?______。
4. 集中分布在元素周期表中间的元素是______元素。
5. 第一周期只有______个元素。
练习题六:简答题回答下列问题。
1. 请解释什么是元素周期律?2. 从元素周期表中的元素符号可以获得哪些信息?3. 请解释元素周期表中水平行的含义。
4. 为什么元素周期表被称为一张“有机体”?5. 元素周期表的发现对化学研究有什么重要贡献?这些练习题可以帮助初三学生巩固对元素周期表的掌握,提高背诵和理解的能力。
初三化学元素试题

初三化学元素试题1.如图是钠元素在元素周期表中的信息。
(1)上图方框的横线上填的是______。
(2)用化学符号和数字表示:3 个氟原子________。
(3)钠元素属于___________(填“金属”或“非金属”)元素。
【答案】(1)Na;(2)3F;(3)金属【解析】从元素周期表解读某些元素的相关数据,要注意结合名称和符号还有原子核外电子的排布来分析。
(1)熟练掌握常见元素符号的书写:第一个字母要大写,第二个字母要小些,故金属钠的元素符号为Na;(2)数字在前时,读法是从前往后读,中间加“个”,数字后面是多种元素符号的读作分子,单一元素符号的读作原子,带电的读作离子,所以3个氟原子应写为3F;(3)元素类别既可以借助原子最外层的电子数的特点来界定,即一般金属少于4,非金属大于四个;也可以借助汉语名称来界定,带金属旁的是金属,其余都是非金属。
故钠元素属于金属。
【考点】元素的符号及其意义,元素的简单分类点评:解答这类问题关键是要熟悉原子的结构和元素周期表的有关知识以及有关化学用语的书写规则,知道元素的分类。
2.下列物质中,哪些含有氧分子?哪些含有氧元素?哪些物质是混合物?哪些物质是纯净物?哪些物质是单质?哪些物质是化合物?哪些物质是氧化物?①二氧化碳②海水③氯酸钾④空气⑤水⑥三氧化二铁⑦高锰酸钾⑧氧气【答案】含有氧分子的:②④⑧;含有氧元素的:①②③④⑤⑤⑦⑧;混合物:②④;纯净物是①③⑤⑥⑦⑧;单质有:⑧;化合物有:①③⑤⑥⑦;氧化物有:①⑥。
【解析】可以根据物质的分类进行解答。
纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物;氧化物是由两种元素组成并且一种元素是氧元素的化合物。
含有氧气的物质就含有氧分子,含有氧的元素符号的就含有氧元素。
氧分子是能够独立存在并保持氧气化学性质的微粒,在非氧气的纯净物中是不可能含有氧气单质的,故含有氧分子的是②④⑧;氧元素是一类氧原子的总称,某物质中只要含有氧原子,就可以说含有氧元素,故含有氧元素的是①②③④⑤⑥⑦⑧;混合物和纯净物可根据组成物质的种类来区分,故混合物是②④,纯净物是①③⑤⑥⑦⑧;根据组成元素的种类将纯净物分为单质与化合物,故单质是⑧,化合物是①③⑤⑥⑦;含氧的双元素化合物为氧化物,故氧化物是①⑥。
(完整版)元素周期表练习及答案

元素周期表练习---黄博伟一、选择题1.美国劳伦斯国家实验室曾在1999年宣布用86Rb离子轰击208Pb靶得到118号元素的一种原子,其质量数为293。
其后,反复实验均未能重现118号元素的信号,因此该实验室在2001年8月宣布收回该论文;但是科学家们相信,完整的第7周期包含的元素数目与第6周期相同。
若118号元素将来被确认,则下列预测合理的是()A.它的中子数是118 B.它是第8周期元素C.它是活泼的金属元素D.它的最外层电子数是82.14C具有放射性,它能自发放出某种射线,而衰变成其他元素。
考古学对出土生物遗骸的年代断定可以使用多种方法,其中较精确的一种是基于14C放射性的方法,但被断定的年代一般不超过5万年。
下列考古遗址发现的遗物中能用14C测定年代的是() A.战国曾侯乙墓的青铜编钟(距今约2400年)B.马家窑文化遗址的粟(距今约5300年)C.秦始皇兵马俑(距今约2200年)D.元谋人的门齿(距今约170万年)3.对于第二周期从左到右的主族元素,下列说法中不正确的是()A.原子半径逐渐减小B.电子层数逐渐增多C.最高正化合价逐渐增大D.元素的非金属性逐渐增强4.据报道,某些花岗岩会产生氡(22286Rn),这是一种放射性很强的原子,会对人体产生伤害,因此,家庭装修时应尽量避免使用天然产的花岗岩材料。
已知氡是一种稀有气体元素,下列叙述正确的是()A.该原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子层结构B.该原子最外层有8个电子C.该原子中子数是86 D.1 mol气体氡的质量大约是444 g 5.2011年3月17日,因日本福岛第一核电站发生核辐射泄漏,放射碘可能被附近居民吸入,引发甲状腺疾病或甲状腺癌。
我国香港和内地出现抢购碘盐的疯狂热潮,用于防护核辐射,医疗专家提醒:由于碘盐中碘含量相对较低,根本起不到预防放射性碘的作用,不可盲目过量吃碘盐或碘片,否则可能诱发甲状腺毒症、甲状腺技能减退、甲状腺肿等疾病。
初三元素周期表练习题

初三元素周期表练习题元素周期表是化学中的重要知识点,对于初三学生来说,掌握元素周期表的基本概念和特点非常重要。
通过练习题的方式来学习元素周期表,不仅可以巩固知识,还可以提高学生的应用能力。
下面是一些初三元素周期表练习题,帮助同学们更好地理解和记忆元素周期表的内容。
1. 第1周期中有几个元素?2. 元素周期表中共有多少个周期和多少个族?3. 第2周期中的元素有哪些?它们的原子序数分别是多少?4. 从元素周期表中找出放射性元素,它们主要放在哪个区域?5. 元素周期表中哪个元素的原子序数最大?它是哪个周期的第一个元素?6. 第17族元素通常具有什么性质?这一族元素有没有放射性元素?7. 找出元素周期表中的稀有气体,它们主要分布在哪个周期和哪个族?8. 元素周期表中有哪些元素的符号与英文名称不一致?分别是什么?9. 根据元素周期表,判断下列说法是否正确,并纠正错误的地方:a) 第18族中的元素通常有较高的电子亲和能力。
b) 第3周期中的元素具有较小的原子半径。
c) 银元素的符号是Ag。
d) 锌元素的化学符号是Zn。
10. 列举出第1至第5周期中的金属元素和非金属元素。
通过解答以上的练习题,同学们可以逐步掌握元素周期表中各个元素的位置和特点,加深对元素周期表知识的理解。
在做题的过程中,建议同学们结合元素周期表进行查找和分析,加深记忆和理解。
同时,通过纠错题的方式,不仅能让同学们发现并纠正错误的知识点,还可以加强对相关知识的记忆和理解。
总之,初三元素周期表练习题是帮助同学们巩固知识、提升应用能力的有效方法。
同学们可以结合练习题来复习元素周期表的内容,提高对元素周期表的理解和掌握程度。
希望同学们能够通过练习题的学习,更好地掌握元素周期表的知识,为化学学科的学习打下扎实的基础。
初中化学(新人教版)九年级全一册同步测试:元素(同步习题)【含答案及解析】

课题3元素知能演练提升能力提升1.下列有关元素的说法错误的是()A.物质都是由元素组成的B.同种元素的原子核内中子数相同C.元素均可以用化学符号表示D.元素周期表中原子序数等于该元素原子核内的质子数2.元素周期表是学习和研究化学的重要工具,从元素周期表中不能得到的信息是()A.元素符号B.原子序数C.相对原子质量D.元素在自然界中的分布3.元素、原子、分子等概念之间既有联系又有区别,下列描述中正确的是()A.物质是由元素构成的B.化学变化中元素种类、分子的种类都保持不变C.分子可以再分,原子不能再分D.分子、原子都在不停地运动着4.如图是元素周期表的一部分。
下列说法正确的是()A.硼为金属元素B.碳的原子序数是12.01C.铝是地壳中含量最高的元素D.三种原子中质量最大的是铝5.已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是()A.以上原子的核外都有3个电子层B.Na+和Mg2+的核外电子数不相同C.第三周期有3种金属元素D.在化学反应中氯原子容易得到电子6.下图为元素周期表第三周期的局部。
据此判断下列说法中正确的是()11Na 23.0012Mg24.3113Al26.9814Si28.09A.它们都属于金属元素B.1个铝原子的质量是26.98 gC.硅元素的原子序数为14D.硅原子的相对原子质量为147.近日,中国在四川某地发现了一个超大规模的锂矿,储量高达52万吨。
锂矿是重要的国家战略资源,有着21世纪改变世界格局的“白色石油”和“绿色能源金属”之称。
下图是锂原子结构示意图和锂元素在元素周期表中的相关信息。
下列说法正确的是()A.锂元素属于非金属元素B.锂原子在化学反应中易得电子C.锂原子的相对原子质量是6.941 gD.锂原子核内有3个质子8.★如图是钠元素和氯元素在元素周期表中的信息和有关的4种粒子结构示意图。
下列说法正确的是()A.钠、氯都属于金属元素B.氯化钠是由a、d两种粒子构成的C.氯的相对原子质量是35.45 gD.a表示的是一种阴离子9.如图甲是铝元素在元素周期表中的相关信息,图乙是几种粒子的结构示意图,根据图中信息回答下列问题:(1)图甲中,铝元素的信息有一处错误,请加以改正:。
2024年中考化学高频考点专项测试元素周期表分析

2024年中考化学高频考点专项测试----元素周期表分析1.宏观、微观、符号相结合是化学学科特有的思维方式。
根据图示回答下列问题。
(1)硒元素被科学家称为“抗癌之王”,科学界研究发现血硒水平的高低与癌的发生息息相关。
如图甲是硒元素的相关信息:硒元素属于(填“金属”或“非金属”)元素,硒原子的核电荷数是。
(2)如图乙,Na、Mg、Al三种元素位于元素周期表中第周期,Na、Mg、Al三种金属活动性由强到弱的顺序是,Na失去最外层电子后变成(填化学符号)。
(3)Na、Mg、Al三种金属可以与很多物质发生化学反应。
请你写出任意一个反应的化学方程式:。
2.氟是人体必需的十余种微量元素之一,如图是元素周期表中氟元素的相关信息及原子结构示意图。
请回答下列问题:(1)氟属于(填“金属”或“非金属”)元素。
(2)在化学反应中,氟原子易得到个电子,达到稳定结构。
C N/CQDs),能利用太阳光分解水,原理如图所示。
回3.Ⅰ.一种新型复合光催化剂(34答下列问题:(1)这个过程将能转化为化学能。
(2)写出反应Ⅰ的化学方程式:。
Ⅰ.1869年,门捷列夫发现了元素周期律,使化学学习和研究变得有规律可循。
下表是元素周期表的一部分。
(3)16号元素的最低负化合价与钠形成的化合物的化学式为;(4)某磷原子的相对原子质量为31,则其中子数为。
Ⅰ.铟是一种银白色金属,有毒。
它的原子结构示意图如图所示,请据图回答下列问题。
(5)x ,能量最低的电子层上的电子数为。
(6)在10~18号元素的原子中找出与铟化学性质相似的原子,并画出其原子结构示意图。
4.眼下,新能源汽车如雨后春笋般繁荣发展,而其中的核心要害——动力电池技术也日新月异。
印度某公司宣称研发出崭新的铝离子电池!实验数据显示,这款电池在能量密度、充电速度、使用成本等各方面均超过现有的锂电池。
铝电池或将引领电池技术领域一次重大变革,我们拭目以待。
如图是铝元素在元素周期表中的信息及A、B两种粒子的结构示意图:(1)铝原子的核外电子数为。
新人教版九年级化学元素周期表综合练习题

新人教版九年级化学元素周期表综合练习
题
请完成以下化学元素周期表的综合练题。
每个问题后面的括号内为答题区,你可以在对应的括号内填写你的答案。
1. 元素周期表是按照什么规律排列的?()
2. 元素周期表中横行被称为什么?()
3. 元素周期表中纵列被称为什么?()
4. 元素周期表中元素的原子序数代表什么?()
5. 元素周期表中第一横行的元素被称为什么?()
6. 元素周期表中第十八纵列的元素被称为什么?()
7. 在元素周期表中,相邻两个元素的原子序数相差多少?()
8. 元素周期表中左侧的元素主要是什么性质的?()
9. 元素周期表中右侧的元素主要是什么性质的?()
10. 元素周期表中的惰性气体位于周期表的哪个位置?()
请将你的答案填写在括号内。
1. (按照原子序数递增排列)
2. (横行被称为周期)
3. (纵列被称为族或群)
4. (元素的原子序数代表原子核中质子的个数,也是元素的唯一标识)
5. (第一横行的元素被称为第一周期元素)
6. (第十八纵列的元素被称为惰性气体或稀有气体)
7. (相差1)
8. (金属)
9. (非金属)
10. (周期表的最右侧)
希望你能通过这些练习题更好地理解和记忆元素周期表的相关知识。
祝你学习顺利!。
第三单元物质构成的奥秘:元素周期表分析专项练习--2025学年九年级化学人教版(2024)上册

1.2024年是门捷列夫诞辰190周年。
元素周期表是学习和研究化学的重要工具。
如图是元素周期表部分内容,请根据表中信息完成相关问题。
(1)核废水放射性元素氚3H在图中位置(填序号)。
(2)门捷列夫预测了镓(Ga)元素的存在,并命名为“类铝”(与铝化学性质相似),镓应该在族。
(3)观察每一周期元素,你有什么发现。
(写出一条)2.(2023秋•黔东南州期末)钛和钛合金具有很多优良性能,被广泛用于火箭、导弹、航天飞机、化工和通信设备等。
物质的性质决定用途,而性质是由其结构决定的。
钛的原子结构示意图如图甲所示,图乙是四种粒子的结构示意图。
(1)钛属于(填“金属”或“非金属”)元素。
知识点练习元素周期表分析(2)钛的元素符号为“Ti”,钛原子在化学反应中容易(填“得到”或“失去”)电子,形成的微粒是(填“阳离子”或“阴离子”)。
(3)图乙中,D为原子,则X=;其中达到稳定结构的粒子是(填序号,下同)。
与钛元素化学性质相似的粒子是;AC两种粒子形成的物质化学式为。
3.(2024春•丰城市校级期末)元素周期表中部分元素的信息如图。
(1)空气中含量最多的元素,其相对原子质量是。
(2)第14号元素属于(选填“金属”或“非金属”)元素,质子数为16的原子易(选填“得到”或“失去”)电子,形成的离子的符号是。
(3)11号和17号元素组成的物质由(选填“分子”、“原子”或“离子”)构成。
(4)已知如图2所示的原子对应的元素在元素周期表中位于铝元素的正下方,且与铝元素的化学性质相似,则m的值为。
4.如图为元素周期表中部分元素的相关信息。
根据图示回答下列问题:(1)原子序数为14的元素的相对原子质量为,它位于元素周期表中的第周期。
(2)请画出原子序数为15的元素的原子结构示意图。
(3)元素在周期表中处于同一周期的原因是它们的原子的。
(4)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似结构和性质。
下列各组粒子属于等电子体的是(填字母序号)。
九年级化学元素周期表练习专项试题

元素周期表练习题1、下表列出了①~⑦七种元素在周期表中的位置:用化学用语回答下列问题:(1)写出下列元素的元素符号:①⑥(2)元素④的原子结构示意图是元素⑤的离子结构示意图是(3)元素③~⑦的原子半径大小顺序是(4)金属活泼性最强的元素是(填元素符号,下同)非金属活泼性最强的元素是第三周期中化学性质最稳定的元素是最高价氧化物属于两性氧化物的是(5)在盛有水的烧杯中加入元素③的单质,反应的离子方程式为向上述反应后的溶液中再加入元素④或⑥的单质,发生反应的离子方程式分别为:;2、元素周期表是学习化学的重要工具,它隐含许多信息和规律。
(1)下图为周期表的一部分,用元素符号标出氦、氧、钠、镁、铝、硫、氯、钾的对应位置:(2)硫元素处于周期表中第周期,第族。
(3)上述几种元素的最高价氧化物对应水化物中,酸性最强的是,碱性最强的是(填化学式)(4)写出氧化铝、氢氧化铝分别与氢氧化钠溶液反应的离子方程式(5)金属活泼性最强的元素是;非金属活泼性最强的元素是;化学性质最稳定的元素是(填元素符号)3、(1)请补充完成下表:(2)甲、乙、丙、丁四种元素中,原子半径最大的是 (填元素符号),写出元素丙的氯化物的电子式(3)元素丁的最高价氧化物对应水化物既能与元素丙的最高价氧化物对应水化物反应,又能中和过多胃酸。
请分别写出上述反应的离子方程式(4)丙单质在乙单质中燃烧产物的颜色是 ,该产物与二氧化碳反应的化学方程式是4、下表是元素周期表的一部分,在①~⑦的元素中,用元素符号或化学式回答下列问题。
(1)最活泼的金属元素是 (填元素符号,下同),形成的氢化物最稳定的元素是(2)最高价氧化物对应水化物中,酸性最强的是 (填化学式,下同)碱性最强的是(3)可形成结构为 的离子是 (4)⑤和⑨形成化合物的电子式是 (5)⑨的单质与②的氢化物反应的化学方程式是选择题1、下列说法正确的是( )A .金属性:Li >Na >K B.氧化性:F >Cl >BrC.原子半径:Li <Na <KD.稳定性:HCl <HBr <HI 2、红宝石的主要成分是第ⅢA 族元素的氧化物,该氧化物为( ) A .Al 2O 3 B .CuO C .Fe 2O 3 D .MgO 3、下列各组物质互为同素异形体的是( )A .C 60与金刚石、石墨B .16O 2与18O 2C .H 与D 、T D .H 2O 与D 2O 4、下列各组物质及粒子性质变化不正确的是( ) A.金属置换出氢的能力:Cs >Rb >K >Ca B.非金属与氢反应的剧烈程度:F 2<Cl 2<Br 2<I 2C.金属与水反应的剧烈程度:Li <Na <KD.原子半径: F >Cl >Br >+Z 2 8。
新课标人教版九年级化学 ——《元素符号和元素周期表》同步检测试卷(含答案)

新课标人教版九年级化学——《元素符号和元素周期表》同步检测试卷(含答案)一、选择题1.下列科学家中,发现了元素周期律并编制了元素周期表的是()A.拉瓦锡B.门捷列夫C.道尔顿D.阿伏加德罗2.下列元素名称与元素符号书写都正确的是()A.锌Zn B.硅SI C.氯cl D.贡Hg3.下列符号所表示的元素中全部是金属元素的是()A.O、C、H、Cl B.Al、Fe、Zn、HgC.H、P、Si、K D.S、Mg、N、Ar4.“2O”表示的意义是()A.2个氧原子B.1个氧分子C.氧元素D.氧气5.下列符号中,既有宏观意义,又有微观意义的是()A.Fe2+B.Fe3+C.Fe D.2Fe6.[2018·潍坊]某矿石样本只含有如图1所示的四种元素,该矿石中可能含有的物质是()图1A.碳酸钙(CaCO3)B.二氧化硅(SiO2)C.氧化铝(Al2O3)D.二硫化亚铁铜(CuFeS2)7.图2是钠元素在元素周期表中的信息和钠原子的结构示意图。
下列说法错误的是()图2A.钠的原子序数为11B.钠原子核外有3个电子层C.钠的相对原子质量为22.99D.化学反应中,钠原子易得电子8.[2018·重庆B]“中国芯”的主要材料是高纯度的单质硅,其结构类似于金刚石。
下列有关硅的说法正确的是()A.属于金属元素B.元素符号为SIC.硅元素是地壳中含量最多的元素D.单质硅由原子构成9.图3是元素周期表第4周期的一部分。
据此判断下列说法中错误的是()图3A.镍元素的符号为NiB.钴元素的相对原子质量是58.93 gC.从左到右各元素的原子序数依次增大D.各元素都属于金属元素10.[2017·江西]改编2017年5月我国发布了四种新元素的中文名称,图4是其中一种元素的信息。
下列有关说法错误的是()图4A.镆属于金属元素B.镆的原子序数115表示其核内有115个中子C.“Mc”表示镆元素、1个镆原子D .四种新元素的原子中质子数不同11.[2018·滨州]下表列出了部分元素的原子结构示意图。
九年级化学元素周期表专项练习
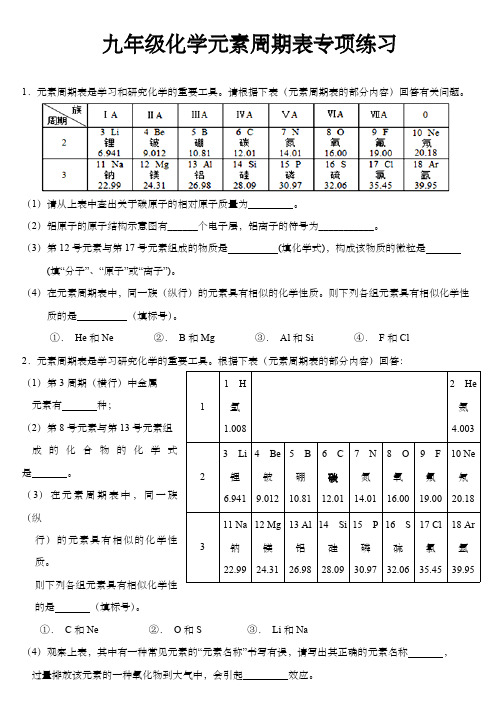
九年级化学元素周期表专项练习1.元素周期表是学习和研究化学的重要工具。
请根据下表(元素周期表的部分内容)回答有关问题。
(1)请从上表中查出关于碳原子的相对原子质量为 。
(2)铝原子的原子结构示意图有______个电子层,铝离子的符号为___________。
(3)第12号元素与第17号元素组成的物质是 (填化学式),构成该物质的微粒是 (填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。
则下列各组元素具有相似化学性质的是 (填标号)。
①. He 和Ne②. B 和Mg③. Al 和Si④. F 和Cl2.元素周期表是学习研究化学的重要工具。
根据下表(元素周期表的部分内容)回答:(1)第3周期(横行)中金属元素有 种;(2)第8号元素与第13号元素组成的化合物的化学式是 。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。
则下列各组元素具有相似化学性的是 (填标号)。
①. C 和Ne②. O 和S③. Li 和Na(4)观察上表,其中有一种常见元素的“元素名称”书写有误,请写出其正确的元素名称 ,过量排放该元素的一种氧化物到大气中,会引起 效应。
11 H 氢1.0082 He 氦4.00323 Li 锂6.941 4 Be 铍9.012 5 B 硼10.81 6 C 碳12.017 N 氮14.018 O 氧16.009 F 氟19.0010 Ne 氖20.18311 Na 钠22.9912 Mg 镁24.3113 Al 铝26.9814 Si 硅28.0915 P 磷30.9716 S 硫32.0617 Cl 氯35.4518 Ar 氩39.95(5)聚合物锂离子电池被誉为“21世纪的电池”,根据上图元素周期表中锂元素的相关信息,回答下列问题:锂元素在化学反应中容易 (填“得到”或“失去”)电子;锂元素与第17号元素组成的化合物的化学式是 。
中考化学专题练习 元素与元素周期表(含解析)-人教版初中九年级全册化学试题

元素与元素周期表一、选择题1.运用2008年诺贝尔化学奖的研究成果,可依据生物发光现象检测超微量钙的存在.这里的“钙”是指()A.分子 B.原子 C.元素 D.单质2.元素在自然界里分布并不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国某某富含黄金,但从在整个地壳含量来看,最丰富的金属元素是()A.O B.Si C.Al D.Fe3.医疗上,用C﹣14呼气试验取代胃镜,可以无痛、快速检测幽门螺旋杆菌.已知C﹣14原子中核电荷数为6,中子数为8,则该原子核外电子数为()A.14 B.6 C.8 D.124.下列符号中,既能表示氢元素,又能表示氢原子的是()A.2H B.2H+C.2H2D.H5.著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子.一种元素的原子经过放射变成另一种元素的原子,据此推断放射出的粒子一定是()A.离子 B.质子 C.中子 D.原子核6.如图是元素周期表中的一格,从该图中获取的相关信息中错误的是()12 Mg镁A.该元素的名称是镁B.该元素的原子核外电子数是12C.该元素的原子序数是12D.该元素的一个原子的实际质量是7.有一种含氧的多原子分子由m 种元素组成,下列叙述正确的是()A.m=1 B.m≥1 C.m≥2 D.以上都不对8.如图是几种粒子的结构示意图,有关说法不正确的是()A.①和②属同种元素 B.②属于稀有气体元素C.①和③的化学性质相似 D.④属于金属元素9.日本福岛第一核电站发生严重的核辐射泄漏,日本政府向福岛核电站附近居民发放碘片(I﹣127),以降低放射性碘对人体的伤害.已知核辐射中放射性碘(碘﹣131)的核电荷数为53,则下列说法不正确的是()A.核裂变是一种物理变化B.碘I﹣127原子和放射性碘原子I﹣133属于同种元素C.核能的利用证实原子的可分性D.碘127原子和碘131原子的相对原子质量相同10.关于Na与Na+说法正确的是()A.Na+和Na都属于钠元素B.Na得到1个电子后能变为Na+C.Na+和Na核外电子排布相同D.质量相差很大11.质子数和电子数与NH4+相同的微粒是()A.NH3B.Na+C.K+D.H2O12.具有相同质子数和不同中子数的同一元素的不同原子互称同位素.氘和氚是核聚变的原料,已知氘、氚原子核内都只有1个质子,但含不同数目的中子,聚变发生后,氘、氚原子核转变为氦原子核.根据以上叙述,下列说法正确的是()A.核聚变是化学变化B.氘原子和氚原子是氢的不同元素C.氘原子和氚原子是氢的两种同位素D.氘原子和氚原子的相对原子质量相同13.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似.有关该粒子的说法不正确的是()A.不显电性B.相当于一个氦(He)原子的质量C.失去一个中子后显+1价D.在周期表中与氢元素占同一位置14.化学上用符号“X”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和.已知X n+和Y m﹣的电子层排布完全相同,则下列关系正确的是()A.b﹣a=d﹣c B.a﹣n=c+m C.a+n=c﹣m D.b﹣n=d+m15.下表是元素周期表中部分元素的相关信息,根据有关信息判断不正确的是()A.同一族的元素对应的原子从上往下电子层数在逐渐增加B.同一周期的元素对应的原子的电子层数相同C.第ⅠA的元素不一定都是金属元素D.同一周期的元素的金属性逐渐增强二、非选择题:16.如图中的①、②分别是氟元素、钙元素在元素周期表中的信息,A、B、C、D分别是四种粒子的结构示意图.根据题某某息回答:(1)氟原子的核电荷数为,钙元素的相对原子质量为.(2)X=;A、B、c、D中属于同种元素的粒子是(填序号).(3)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似(填序号).17.写出两种质子数为9且电子数为10的微粒符号、.18.如表是某原子(在X中X为元素符号,Z为原子的质子数、A为该原子的质量数)的相关数据:11H12H13H816O818O918F质子数 1 1 1 8 8 9中子数0 1 2 8 10 9核外电子数 1 1 1 8 8 9分析以上数据,你得到了哪些结论?请写出其中三条:(1);(2);(3).元素与元素周期表参考答案与试题解析一、选择题1.运用2008年诺贝尔化学奖的研究成果,可依据生物发光现象检测超微量钙的存在.这里的“钙”是指()A.分子 B.原子 C.元素 D.单质【考点】元素的概念.【专题】元素推断题.【分析】根据物质中的钙是对所有钙原子的总称,意即钙元素进行分析解答本题.【解答】解:物质中的钙是对所有钙原子的总称,意即钙元素,而不是钙原子,也不是钙的单质.依据生物发光现象检测超微量钙的存在.这里的“钙”是指钙元素.故选:C.【点评】本题考查学生根据物质中的钙是对所有钙原子的总称,意即钙元素进行分析解题的能力.2.元素在自然界里分布并不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国某某富含黄金,但从在整个地壳含量来看,最丰富的金属元素是()A.O B.Si C.Al D.Fe【考点】地壳中元素的分布与含量.【专题】物质的微观构成与物质的宏观组成.【分析】地壳中元素的含量由多到少的顺序为:氧硅铝铁,它们在地壳中的含量分别为:氧元素的含量为48.60%,硅元素的含量为:26.30%,铝元素的含量为7.73%,铁元素的含量为4.75%.【解答】解:在地壳中氧元素的含量为48.60%,硅元素的含量为:26.30%,铝元素的含量为7.73%,铁元素的含量为4.75%;故答案为:C.【点评】本题解题的关键是识记地壳中元素的含量由多到少的顺序.3.医疗上,用C﹣14呼气试验取代胃镜,可以无痛、快速检测幽门螺旋杆菌.已知C﹣14原子中核电荷数为6,中子数为8,则该原子核外电子数为()A.14 B.6 C.8 D.12【考点】原子的定义与构成.【专题】有关化学式的计算.【分析】熟记“原子序数=核内质子数=核外电子数=核电荷数”,由题意“C﹣14原子中核电荷数为6”,则该原子核外电子数.【解答】解:由题意“已知C﹣14原子中核电荷数为6,中子数为8”;根据“原子序数=核内质子数=核外电子数=核电荷数”,则可知该原子核外电子数为6.故选B.【点评】了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的.4.下列符号中,既能表示氢元素,又能表示氢原子的是()A.2H B.2H+C.2H2D.H【考点】化学符号及其周围数字的意义.【专题】课本知识同类信息.【分析】元素符号表示一种元素,还表示这种元素的一个原子.分为宏观和微观两个意义:(1)宏观意义:①表示一种(元素种类)元素.②表示物质.(固体的金属、非金属、稀有气体的单质.)(2)微观意义:表示这种元素的(一种同位素)一个原子.元素符号前加系数时,只表示原子个数.【解答】解:A、表示两个氢原子,不能表示氢元素,故错误;B、表示两个氢离子,不符合题意,故错误;C、表示两个氢分子,不能表示氢元素、氢原子,故错误;D、元素符号H可表示:①氢元素,②一个氢原子;故正确;故选D.【点评】了解元素的符号和意义,知道其有宏观意义和微观意义,是解答本题的关键.5.著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子.一种元素的原子经过放射变成另一种元素的原子,据此推断放射出的粒子一定是()A.离子 B.质子 C.中子 D.原子核【考点】元素的概念.【专题】物质的微观构成与物质的宏观组成.【分析】掌握元素的概念:具有相同核电荷数(核内质子数)的一类原子的总称;由题意可知“放射性,即原子能自动地放射出一些固定的粒子.一种元素的原子经过放射变后变成了另一种元素的原子”,而元素种类的改变与核内质子数有关.故可知答案.【解答】解:掌握元素的概念:具有相同核电荷数(核内质子数)的一类原子的总称;由题意可知“放射性,即原子能自动地放射出一些固定的粒子.一种元素的原子经过放射变后变成了另一种元素的原子”,而元素种类的改变与核内质子数有关,则据此推断放射出的粒子一定是质子.故选:B.【点评】了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;掌握元素的概念:具有相同核电荷数(核内质子数)的一类原子的总称.6.如图是元素周期表中的一格,从该图中获取的相关信息中错误的是()12 Mg镁A.该元素的名称是镁B.该元素的原子核外电子数是12C.该元素的原子序数是12D.该元素的一个原子的实际质量是【考点】元素周期表的特点及其应用;常见的金属和非金属的区分;原子的有关数量计算;物质的元素组成;相对原子质量的概念及其计算方法.【专题】物质的微观构成与物质的宏观组成;化学用语和质量守恒定律.【分析】由上图元素周期表中的一格可知:该元素的名称、该元素的原子序数、根据核外电子数可以推测该元素的原子结构示意图等信息.【解答】解:A、由上图元素周期表,可知该元素的名称是镁,说法正确,故A不可选;B、由题目中的元素周期表的信息,结合“原子序数=核内质子数=核外电子数”,可知:该元素的原子核外有l2个电子,故B不可选;C、由题目中的元素周期表的信息,该元素的原子序数为12,说法正确,故C不可选;D、由题目中的元素周期表的信息可知,该元素的相对原子质量为24.31,而不是一个原子的实际质量,故D可选.故选D.【点评】了解元素周期表的特点及其应用,了解原子结构示意图与离子结构示意图的特点.7.有一种含氧的多原子分子由m 种元素组成,下列叙述正确的是()A.m=1 B.m≥1 C.m≥2 D.以上都不对【考点】氧化物、酸、碱和盐的概念;分子、原子、离子、元素与物质之间的关系.【专题】物质的微观构成与物质的宏观组成;物质的分类.【分析】可根据元素和原子的区别进行分析解答.元素只有种类,原子既有种类又有数量.【解答】解:若m=1,说明该物质是单质,如O2、O3.若m=2,该物质是氧化物,如CO2、SO3、Fe3O4等.若m=3,则该物质可能为含氧酸、碱或含氧酸盐等.若m=4,也有如NaHCO3,当然还有复杂的如有机物等.综合以上分析答案应是B故选B【点评】解答本题首先要分清分子是由原子构成的,原子可以是同种元素的原子,也可是不同元素的原子.8.如图是几种粒子的结构示意图,有关说法不正确的是()A.①和②属同种元素 B.②属于稀有气体元素C.①和③的化学性质相似 D.④属于金属元素【考点】原子结构示意图与离子结构示意图.【专题】微观粒子模拟图型;压轴实验题.【分析】质子数决定元素的种类,所以质子数相同时,元素种类相同.最外层电子数决定元素的化学性质.最外层电子数相同时化学性质相似.【解答】解:①和②的质子数相同,所以①和②是同种元素.①和③的最外层电子数相同,所以化学性质相似.稀有气体是指最外层电子数达到相对稳定结构的原子.所以②不属于稀有气体.11号是钠元素,属于金属元素.故选B【点评】最外层电子数决定元素的化学性质,但是最外层电子数相同时,化学性质不一定相似.如镁原子和氦原子.9.日本福岛第一核电站发生严重的核辐射泄漏,日本政府向福岛核电站附近居民发放碘片(I﹣127),以降低放射性碘对人体的伤害.已知核辐射中放射性碘(碘﹣131)的核电荷数为53,则下列说法不正确的是()A.核裂变是一种物理变化B.碘I﹣127原子和放射性碘原子I﹣133属于同种元素C.核能的利用证实原子的可分性D.碘127原子和碘131原子的相对原子质量相同【考点】原子的定义与构成;元素的概念;相对原子质量的概念及其计算方法;化学变化和物理变化的判别.【专题】结合课本知识的信息.【分析】由题意可知,核辐射中放射性碘(碘﹣131)的核电荷数为53,再根据“原子序数=核内质子数=核外电子数=核电荷数”和“相对原子质量≈质子数+中子数(近似整数值)”,则可推测正确选项.【解答】解:A、核裂变是原子变化,化学变化中原子不变化,则核裂变是一种物理变化,故A正确;B、碘I﹣127原子和放射性碘原子I﹣133属于同种元素,因为它们为质子数相同的不同类原子,但为同种元素,故B正确;C、核能的利用证实原子的可分性,说法正确,故C正确;D、因为“相对原子质量≈质子数+中子数(近似整数值)”,质子数相同,但中子数不同,其相对原子质量不相同,所以说法错误,故D错误.故选D.【点评】了解原子的定义和构成;掌握相对原子质量的概念及其计算;了解元素的概念;掌握化学变化和物理变化的判别.10.关于Na与Na+说法正确的是()A.Na+和Na都属于钠元素B.Na得到1个电子后能变为Na+C.Na+和Na核外电子排布相同D.质量相差很大【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】据Na和Na+两种粒子可以看出它们都是钠元素形成的不同微粒,则它们的质子数相同,它们的电子数不同,据此分析解答即可;【解答】解:A、因它们的核电荷数均是11,所以是同种元素,两者是同种元素形成的不同微粒,故对;B、钠离子带一个单位的正电荷,所以钠离子是钠原子失掉一个电子后形成的,故错;C、Na原子失去1个电子变成阳离子Na+,故二者的电子数不同其核外电子排布也不同;故错;D、Na原子失去1个电子变成阳离子Na+,由于原子的质量主要集中在原子核上,所以两者质量几乎相同;故错.故选A.【点评】本题考查原子和离子的相互转化,学生应注意单原子形成的微粒中质子数与电子数的关系,抓住质子数是判断元素的关键.11.质子数和电子数与NH4+相同的微粒是()A.NH3B.Na+C.K+D.H2O【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据微粒中质子数为各原子的质子数之和,若微粒为分子,质子数=电子数;若微粒为阳离子,电子数=质子数﹣电荷数;若微粒为阴离子,电子数=质子数+电荷数.【解答】解:NH4+中N原子的质子数为7,H原子的质子数为1,所以NH4+的质子数为11,电子数=11﹣1=10;A、NH3中质子数为10,电子数=10,故A错误;B.Na+中质子数为11,电子数=11﹣1=10,故B正确;C、K+中质子数为19,电子数=19﹣1=18,故C错误;D、H2O中质子数为10,电子数=质子数=10,故D错误;故选:B.【点评】本题考查了微粒中质子数和电子数之间的关系,难度不大,明确阳离子中电子数=质子数﹣电荷数、阴离子中电子数=质子数+电荷数.12.具有相同质子数和不同中子数的同一元素的不同原子互称同位素.氘和氚是核聚变的原料,已知氘、氚原子核内都只有1个质子,但含不同数目的中子,聚变发生后,氘、氚原子核转变为氦原子核.根据以上叙述,下列说法正确的是()A.核聚变是化学变化B.氘原子和氚原子是氢的不同元素C.氘原子和氚原子是氢的两种同位素D.氘原子和氚原子的相对原子质量相同【考点】元素的概念;相对原子质量的概念及其计算方法;化学变化的基本特征.【专题】物质的微观构成与物质的宏观组成.【分析】A、化学变化是生成新物质的变化.B、质子数相同元素种类相同.C、根据同位素的概念分析.D、质子数与中子数相同,原子质量相同.【解答】解:A、化学变化是生成新物质,不是生成新原子,故错.B、质子数相同元素种类相同,氘原子和氚原子质子数相同,属于同种元素,故错;C、氘、氚原子核内都只有1个质子,但含不同数目的中子,因此氘原子和氚原子是氢的两种同位素,故正确;D、质子数与中子数相同,相对原子质量相同,氘原子和氚原子中子数不同,质子数相同,所以相对原子质量一定不同,故错;故选C.【点评】此题是对原子知识的考查,解题的关键是对相关原子知识的掌握,属基础性知识考查题.13.法国里昂的科学家发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”.它与天体中的中子星构成类似.有关该粒子的说法不正确的是()A.不显电性B.相当于一个氦(He)原子的质量C.失去一个中子后显+1价D.在周期表中与氢元素占同一位置【考点】原子的定义与构成.【专题】物质的微观构成与物质的宏观组成.【分析】根据“四中子”的构成进行分析.“四中子”是由四个中子构成的粒子,微粒中无质子,根据“原子序数=核内质子数”,则知它不是某种元素,而只有中子,又知中子不带电.据此分析即可.【解答】解:由题意可知:A、由于中子不显电性,该微粒中只有中子,所以不显电性.故A正确;B、因为中子的质量≈质子的质量,该粒子的质量≈一个氦原子的质量=4,故B正确;C、由于该微粒中只有中子,失去中子也不显电性,故不会化合价为+,故C错误;D、因为它不是某种元素,而只有中子,故周期表中没有该“元素”的位置.故D错误.故选CD.【点评】了解原子的定义和构成:原子是由原子核和核外电子构成.原子核由质子和中子构成,中子不带电,中子质量约等于质子质量,记住元素周期表的排列依据.14.化学上用符号“X”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和.已知X n+和Y m﹣的电子层排布完全相同,则下列关系正确的是()A.b﹣a=d﹣c B.a﹣n=c+m C.a+n=c﹣m D.b﹣n=d+m【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】在原子中,核电荷数=质子数=核外电子数,相对原子质量=质子数+中子数;两种离子的电子层排布完全相同,就说明这两种离子的核外电子数相等.【解答】解、A、此项表示的X、Y离子的中子数相等,而XY离子的中子数不一定相等,故此项错误.B、X n+和Y m﹣的电子层排布完全相同,是离子的电子数相等,此等式表示X、Y离子的核外电子数相等,符合题意,正确.C、此项等式表示XY原子的电子数相等,故不正确.D、此项等于没有正确是意义,故不正确,故选B.【点评】此题难度较大,要在原来原子里的等量关系的基础上,还要考虑电子得失,故不易选出正确答案.15.下表是元素周期表中部分元素的相关信息,根据有关信息判断不正确的是()A.同一族的元素对应的原子从上往下电子层数在逐渐增加B.同一周期的元素对应的原子的电子层数相同C.第ⅠA的元素不一定都是金属元素D.同一周期的元素的金属性逐渐增强【考点】元素周期表的特点及其应用.【专题】化学用语和质量守恒定律.【分析】A、根据元素周期律:同一纵行(族)从上到下电子层数逐渐增加;进行解答;B、根据元素周期律:电子层数等于周期数;进行解答;C、根据第ⅠA的元素H不是非金属元素,进行解答;D、根据同一周期的元素的金属性逐渐减弱,非金属性增强,进行解答.【解答】解:A、根据元素周期律:同一纵行(族)从上到下电子层数逐渐增加;故A说法正确;B、根据元素周期律:电子层数等于周期数;所以同一周期的元素对应的原子的电子层数相同;故B 说法正确;C、根据第ⅠA的元素H不是非金属元素,所以第ⅠA的元素不一定都是金属元素;故C说法正确;D、根据同一周期的元素的金属性逐渐减弱,非金属性增强,故D说法错误;故选D.【点评】本题考查学生对元素周期律知识的理解与掌握,并能在解题中灵活应用的能力.二、非选择题:16.如图中的①、②分别是氟元素、钙元素在元素周期表中的信息,A、B、C、D分别是四种粒子的结构示意图.根据题某某息回答:(1)氟原子的核电荷数为9 ,钙元素的相对原子质量为40.08 .(2)X= 8 ;A、B、c、D中属于同种元素的粒子是BC (填序号).(3)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似 B (填序号).【考点】元素周期表的特点及其应用;原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】原子中核电荷数=核内质子数=核外电子数=原子序数;具有相同核电荷数的一类原子总称为元素;最外层电子数相同的原子化学性质相似.【解答】解:(1)氟原子的核电荷数为9,钙元素的相对原子质量为40.08.故填:9;40.08.(2)X=8;A、B、c、D中属于同种元素的粒子是BC,这是因为BC中的核电荷数相等.故填:8;BC.(3)A粒子的化学性质与B、C、D中的B粒子的化学性质相似,这是因为A和B的最外层电子数相等.故填:B.【点评】元素周期表反映了元素之间的内在联系,要注意理解和应用.17.写出两种质子数为9且电子数为10的微粒符号F﹣、OH﹣.【考点】化学符号及其周围数字的意义;原子和离子的相互转化.【专题】化学用语和质量守恒定律.【分析】质子数和电子数不同说明是一个离子,电子数大于质子数说明是阴离子.【解答】解:质子数为9的原子为氟原子,得到一个电子,则电子数为10,即为F﹣质子数为9的原子团有氢氧根OH,得到一个电子,则电子数为10,即为OH﹣故答案为:F﹣;OH﹣【点评】本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较难.18.如表是某原子(在X中X为元素符号,Z为原子的质子数、A为该原子的质量数)的相关数据:11H12H13H816O818O918F质子数 1 1 1 8 8 9中子数0 1 2 8 10 9核外电子数 1 1 1 8 8 9分析以上数据,你得到了哪些结论?请写出其中三条:(1)同种元素可以有不同的原子;(2)同种元素的不同原子具有相同的质子数;(3)同种元素的不同原子具有不同的中子数.【考点】原子的定义与构成.【专题】物质的微观构成与物质的宏观组成.【分析】质子数相同的一类原子属于同种元素,同一种元素可能有很多种原子,而且这些原子的中子数不同,在原子中质子数一定等于核外电子数.【解答】解:根据表格提供的信息可以看出:(1)同种元素可以有不同的原子;(2)同种元素的不同原子具有相同的质子数;(3)同种元素的不同原子具有不同的中子数;(4)对原子来说,质子数一核外电子数;(5)质量数=质子数十中子数;(6)不是所有原子都含有中子;故答案为:同种元素可以有不同的原子;同种元素的不同原子具有相同的质子数;同种元素的不同原子具有不同的中子数.【点评】本题难度不是很大,主要考查了有关原子的知识,重在培养学生的理解能力和分析能力.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学元素周期表专项练习1.元素周期表是学习和研究化学的重要工具。
请根据下表(元素周期表的部分内容)回答有关问题。
(1)请从上表中查出关于碳原子的相对原子质量为 。
(2)铝原子的原子结构示意图有______个电子层,铝离子的符号为___________。
(3)第12号元素与第17号元素组成的物质是 (填化学式),构成该物质的微粒是 (填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。
则下列各组元素具有相似化学性质的是 (填标号)。
①. He 和Ne②. B 和Mg③. Al 和Si④. F 和Cl2.元素周期表是学习研究化学的重要工具。
根据下表(元素周期表的部分内容)回答:(1)第3周期(横行)中金属元素有 种;(2)第8号元素与第13号元素组成的化合物的化学式是 。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。
则下列各组元素具有相似化学性的是 (填标号)。
①. C 和Ne②. O 和S③. Li 和Na(4)观察上表,其中有一种常见元素的“元素名称”书写有误,请写出其正确的元素名称 ,过量排放该元素的一种氧化物到大气中,会引起 效应。
11 H 氢1.0082 He 氦4.00323 Li 锂6.941 4 Be 铍9.012 5 B 硼10.81 6 C 碳12.017 N 氮14.018 O 氧16.009 F 氟19.0010 Ne 氖20.18311 Na 钠22.9912 Mg 镁24.3113 Al 铝26.9814 Si 硅28.0915 P 磷30.9716 S 硫32.0617 Cl 氯35.4518 Ar 氩39.95(5)聚合物锂离子电池被誉为“21世纪的电池”,根据上图元素周期表中锂元素的相关信息,回答下列问题:锂元素在化学反应中容易 (填“得到”或“失去”)电子;锂元素与第17号元素组成的化合物的化学式是 。
3.如图是元素周期表中的一部分,请回答下列问题。
第一周期1H2He第二周期3Li4Be5B6C7N8O9F10Ne第三周期11Na12Mg①14Si15P16S②18Ar(1)表中,①所示元素的名称是 ,②所示元素组成的单质的化学式 。
(2)X3+与Ne的核外电子排布相同,则X的元素符号为 ,它处在元素周期表中第 周期,它与氧元素组成的化合物的化学式为 。
4.元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分。
请分析图中信息回答下列问题:(1)图中位于第2周期、第ⅥA族的元素是 (填元素名称)。
(2)铍元素的相对原子质量是 ,它属于 (填“金属”或“非金属”)元素。
(3)氯元素的原子在化学变化中容易 (填“得到”或“失去”)电子,它与钠元素组成的化合物是 。
(填化学式)5.元素周期表是学习和研究化学的重要工具,它的内容十分丰富。
下表是元素周期表的一部分:试根据上表回答下列问题:(1)妍妍同学考查后发现,第3周期开头的是 元素(填“金属”或“非金属”),尾部是稀有气体元素。
则表中x= ;若某种钙原子的相对原子质量为40,则它的中子数为 。
(2)碳元素的核电荷数是 ,不同种元素的本质区别是 。
(3)硫原子在化学反应中容易 (填“得到”或“失去”)电子成为 (填离子符号),硫离子与硫原子的化学性质 (填“相同”或“不同”)。
6.如图是元素周期表的部分信息。
(1)两种元素的本质区别是 不同。
镁元素的相对原子质量是 。
(2)17号元素的符号是 。
在化学反应中,该原子容易 (填“得”或“失”)电子。
(3)地壳中含量最多的金属元素是 (写元素符号),其质子数为 。
7.下表是元素周期表的部分内容,请认真分析并回答下列问题:(1)请从下表中查出铝元素的相对原子质量为 ;(2)不同种元素最本质的区别是 (填序号);A.相对原子质量不同B.质子数不同C.中子数不同(3)金属Na、Mg化学性质不同的原因是 ;(4)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,请写出其中一条: 。
8.物质是由元素组成的。
(1)馍元素的相关信息如右图所示,则馍的相对原子质量为 。
(2)水和过氧化氢都是由 (填元素符号)组成的但是它们的性质有很大的差异其原因是 。
9.人体中约有50多种元素,其中钙元素主要存在于骨骼牙齿中,是人体必须元素。
右图是钙元素在元素周期表中的相关信息。
(1)钙元素的原子序数是 ;(2)钙元素属于 (“金属”或“非金属”)元素;(3)钙元素的相对原子质量为 。
10.右图是元素周期表的一部分(1)其中氟原子的核外电子数是 ,相对原子质量为 。
(2)画出15号元素的原子结构示意图 。
(3)硅磷硫氯四种原子核外电子排布的相同点是 。
11.右图表示元素周期表中的钇元素,则该元素的相对原子质量是 ,其元素符号是 ,这种原子的质子数是 。
12.元素周期表是我们学习和研究化学的重要工具,它的内容十分丰富。
下面是元素周期表部分内容,请回答下列问题。
(1)从表中可查出镁元素的相对原子质量为 ;(2)8和12号元素组成的化合物的化学式是 。
(3)X2+的结构示意图与Ar的原子结构示意图一样,则参考元素周期表X2+对应的符号是 。
13.元素周期表是学习和研究化学的重要工具。
请分析图中信息回答相关问题:(1)氯元素的质子数是 ,它属于 (填“金属”或“非金属”)元素。
(2)硫原子在化学反应中容易 (填“得到”或“失去”)电子成为硫离子。
(3)8号和16号元素组成的化合物的化学式是 。
15.小明利用12种元素副作了一张如图所示的“元素钟面”。
(1)钟面上的这些元素之间最根本的区别是 不同;(2)钠原子在化学反应中易 (填“得到”或“失去”)电子;(3)在元素周期表中,钠元素和镁元素位于 (填字母标号)A.同一周期B.不同周期C.同一族D.不同族16.元素周期表是学习和研究科学的重要工具。
如下图是元素周期表的一部分,表中①处元素的元素符号为 ,表中②处元素组成的单质的化学式可表示为 ,表中③处元素的种类属于 元素。
(选填“金属”或“非金属”)17.为了便于研究元素的性质,科学家把所有的已知元素科学有序地排列起来,得到元素周期表。
请阅读下列元素周期表(部分),并按要求作答。
(1)图中位于第2 周期、ⅦA族的元素,该原子的原子核内中子数为 ;(2)第11 号元素与第17 号元素组成的化合物是生活中常用的调味品,构成该物质的微粒是 、(填具体微粒的符号);(3)X号元素的原子的核外电子数为 。
18.元素周期表是学习和研究化学的重要工具,试根据如图所示回答相应问题。
(1)图甲是铯元素在元素周期表中的信息,则铯元素属于 (填“金属”或“非金属”),该元素原子的核外电子数为 ,中子数为。
(2)乙图为周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 。
(多选)A.原子序数:Z>Y B.核外电子数:X=Y C.Y和Z处于同一周期D.X表示氧元素19.钋是目前已知最稀有的元素之一,由著名科学家居里夫人与丈夫皮埃尔•居里在1898年发现,为了纪念居里夫人的祖国波兰,两人将这种元素命名为钋。
钋元素在元素周期表中的信息如图所示,下列说法正确的是 。
A.钋的相对原子质量为209 g B.钋原子的核外电子数为84C.1个钋原子的中子数为1251个钋原子中质子、中子、核外电子的粒子总数为 。
20.元素周期表是学习化学的重要工具。
如图是元素周期表中的一部分,请回答下列问题:(1)表中,①所示元素的名称是 ,它的原子结构示意图为 。
(2)X 2﹣与Ar 的核外电子排布相同,则X 的元素符号是 ,它处在元素周期表中第 周期。
21.如图为元素周期表的一部分,请按要求填空:(1)表中元素②形成单质的化学式为 。
(2)表中9号和17号元素最外层电子数相同,都易 (填“得到”或“失去”)电子。
(3)表中不同种元素最本质的区别是 。
A .质子数不同B .中子数不同C .相对原子质量不同D .最外层电子数不同22.根据右图的元素周期表回答问题:(1)为纪念门捷列夫,科学家将一种由人工核反应获得的新元素命名为钔(Md ),已知钔原子核电荷数为101,相对原子质量为256,则其核外电子数为 ,钔失去三个电子后形成离子,该离子符号为 。
(2)如表是元素周期表的一部分,表中③所代表的元素属于 元素(填“金属”或“非金属”),由表中①和②两种元素组成的物质的化学式为 。
23.元素周期表是化学学习的重要工具,请按要求作答。
族\ 周期ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 023Li锂4Be铍5B硼6C碳7N氮8O氧9F氟10Ne氖6.9419.01210.81 12.0114.0116.0019.0010.18311Na钠22.9912Mg 镁24.311314Si 硅28.0915P 磷30.9616S 硫32.0617Cl 氯35.4518Ar 氩39.95(1)图中位于第2周期、第ⅥA 族的元素,该原子的原子核中的中子数为 (2)第13号元素与地壳中含量最多的元素可组成的一种物质是 (填化学式)(3)第11号元素与第17号元素组成的化合物的俗称是 。
(4)第1、8、11号元素组成的物质的化学式_______________。
24.元素周期表是学习化学的重要工具。
如图是元素周期表中的一部分,请回答下列问题:(1)表中,①所示元素的名称是 ;(2)相对分子质量最小的氧化物的化学式 ;(3)X 2+与Ne 的核外电子排布相同,则X 的元素符号是 ,它处在元素周期表中第 周期;26.根据元素周期表中1﹣18号元素的排列情况。
我对它进行探究:(1)第16号元素属于 元素(填“金属”或“非金属”)。
(2)①表示的元素对应单质的化学式是 。
(3)研究表明:在同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强。
由此推断:第二周期中得电子能力最强的是 (填名称)原子;第9号和第12号元素形成的化合物化学式是 。
27.如表是元素周期表的部分内容,回答有关问题:族\周期IA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA23 Li锂6.9414 Be 铍9.0125 B 硼10.816 C 碳12.017 N 氮14.018 O 氧16.009 F 氟19.0010 Ne 氖20.18311 Na12 Mg 13 Al 14 Si 15 P16 S17 Cl 18 Ar钠22.99镁24.31铝26.98硅28.09磷30.97硫32.06氯35.45氩39.95(1)第二周期中属于金属元素的有 (填元素符号),它们在化学变化中容易 电子(填“得到”或“失去”)。
(2)位于第三周期的元素,其原子结构上的相同点是: 相同。
