酒精水溶液比重、体积和重量百分数的关系
在百分数应用题中有一类叫溶液配比问题

在百分数应用题中有一类叫溶液配比问题。
我们都知道,将糖溶于水就得到了糖水,其中糖叫溶质,水叫溶剂,糖水叫溶液。
如果水的量不变,那么糖加得越多,糖水就越甜,也就是说,糖水甜的程度是由糖(溶质)与糖水(溶液=糖+水)二者重量的比值决定的,这个比值就叫糖水的含糖量或糖含量。
类似地,酒精溶于水中,纯酒精与酒精溶液二者重量的比值就叫酒精含量。
溶质、溶剂、溶液及溶质含量有如下基本关系:溶液重量=溶质重量+溶剂重量,溶质含量=溶质重量÷溶液重量,溶液重量=溶质重量÷溶质含量,溶质重量=溶液重量×溶质含量。
溶质含量通常用百分数表示。
例如,10克白糖溶于90克水中,含糖量(溶例5有含糖量为7%的糖水600克,要使其含糖量加大到10%,需要再加入多少克糖?分析与解:在600克含糖量为7%的糖水中,有糖(溶质)600×7%=42(克)。
设再加x克糖,可使其含糖量加大到10%。
此时溶质有(42+x)克,溶液有(600+x)克,根据溶质含量可得方程需要再加入20克糖例6 仓库运来含水量为90%的一种水果100千克,一星期后再测,发现含水量降低到80%。
现在这批水果的总重量是多少千克?分析与解:可将水果分成“水”和“果”两部分。
一开始,果重100×(1-90%)=10(千克)。
一星期后含水量变为80%,“果”与“水”的比值为因为“果”始终是10千克,可求出此时“水”的重量为所以总重量是10+40=50(千克)。
1.某修路队修一条路,5天完成了全长的20%。
照此计算,完成任务还需多少天?2.服装厂一车间人数占全厂的25%,二车间人数比一车间少20%,三车间人数比二车间多30%。
已知三车间有156人,全厂有多少人?3.有三块地,第二块地的面积是第一块地的80%,第三块地的面积比第二块多20%,三块地共69公顷,求三块地各多少公顷。
4.某工厂四个季度的全勤率分别为90%,86%,92%,94%。
乙醇精馏

乙醇-水精馏实验一.实验内容1.研究不同浓度对操作条件和分离能力的影响对于一给定的精馏塔,冷液进料,由于前段工序的原因,使进料浓度发生了变化。
进料浓度的变化,直接影响着精馏操作。
请你根据实验室的设备和物料,完成下列实验任务。
(1)从理论上分析,对于已给定的精馏塔,当进料浓度发生变化时,若不改变操作条件,对塔顶和塔釜产品质量有何影响。
(2)探讨进料浓度变化对全塔效率的影响。
(3)根据实验室现有条件,拟定改变进料浓度的方法,制定出实验方案(包括实验操作条件、实验设备流程、实验操作方法和注意事项等)。
(4)根据实验结果,探讨在进料浓度发生变化时,若要保证塔顶和塔釜产品的质量,可采取哪些措施。
2.研究不同回流比对操作条件和分离能力的影响对于一给定的精馏塔,回流比是一个对产品质量和产量有重大影响而又便于调节的参数。
请你根据实验室提供的设备和物料,完成下列实验任务。
(1)从理论上分析,对于已给定的精馏塔,回流比的改变对精馏操作和分离能力的影响。
(2)探讨不同回流比对全塔效率和单板效率的影响,以及不同回流比时浓度曲线分布有何不同。
(3)确定其中一组操作条件下的最小回流比,并计算最小回流比与实际回流比的关系。
(4)根据实验室现有条件,拟定改变回流比的方法,制定出实验方案(包括实验操作条件、实验设备流程、实验操作方法和注意事项等)。
3.研究不同进料位置对操作条件和分离能力的影响最适宜进料板的位置是指在相同的理论板数和同样的操作条件下,具有最大分离能力的进料板位置或在同一操作条件下所需理论板数最少的进料板位置。
在化学工业中,多数精馏塔都设有两个以上的进料板,调节进料板的位置是以进料组分发生变化为依据的。
请你根据实验室提供的设备和物料,完成下列实验任务。
(1)从理论上分析,改变进料位置对精馏操作和分离能力的影响。
(2)探讨不同进料位置对全塔效率和单板效率的影响。
(3)不同进料位置的浓度曲线分布有何不同。
(4)在本实验的进料浓度下,你认为最佳进料位置应该在哪一块板上?(5)为完成上述任务,请你制定出实验方案,实验方案包括实验操作条件、实验设备流程、实验操作方法和注意事项等。
95%酒精稀释成75%的方法

体积分数75%酒精的配制方法使用95%(体积分数)的酒精,配制成75%(体积分数)的酒精,有两种方法:(1)量取100ml 体积分数95%酒精,加水,到总体积126.7ml,得到体积分数75%酒精。
(2)称取100g体积分数为95%的酒精,加入36.4g水,得到体积分数75%酒精。
体积分数75%酒精,是用乙醇和水配制的,是体积分数为75%的乙醇水溶液,溶质是乙醇,溶剂是水。
它的浓度定义、配制理解和配制方法,详细如下:1、体积分数和质量分数的定义体积分数,按《JJF1074-2018 酒精密度-浓度测量用表》定义,溶液中,所含溶质体积V’与溶液体积V的百分比,即:q=V′V×100%质量分数,溶液中溶质质量m’与溶液质量m的百分比,溶液质量等于溶质和溶剂的质量之和,即:p=m′m×100%2、75%酒精的理解(1)浓度为75%的酒精,也被叫作75%酒精、75度酒精,它的浓度也常表示为75%(V/V)。
(2)75%医用酒精,按《GB/T 26373-2010 乙醇消毒剂卫生标准》规定,乙醇消毒剂的乙醇含量是70%~80%(体积分数)。
如果按此标准,允许的配制浓度偏差是很有空间的。
(3)按体积分数的定义,75%酒精的配制方法是:取75ml的乙醇,加水配成100ml溶液。
(4)这种理解是错误的:75ml的乙醇,加25ml水,得到体积分数75%的酒精。
这样配制得到的浓度虽然符合70%~80%(体积分数),但它不符合体积分数的定义。
(5)酒精溶液的体积百分数,是用酒精计测定的,一般标准温度为20℃。
而且,因为乙醇、水的热胀冷缩程度是不同的,所以,配制和确定一个酒精溶液的体积分数时,必须要规定温度的,一般标准温度是20℃。
(7)体积分数75%的酒精的准确理解:规定标准温度为20℃,取75ml的乙醇,加水配成100ml溶液。
3、用95%酒精配制成75%酒精的方法准确地表述,应该是,用体积分数为95%的乙醇或者酒精,稀释配制成体积分数为75%的酒精溶液。
食用酒精 乙醇浓度的测定 比重法

1 范围 本方法采用酒精计法测定食用酒精中乙醇的浓度 本方法适用于食用酒精中乙醇浓度的测定 结果表示为体积百分数 即%(v/v) 保留一 位小数 2 原理 乙醇(酒精)体积浓度 是指在 20 时 酒精水溶液中所含乙醇的体积与在此同一温度下 该溶液总体积之百分比 利用酒精比重计和温度计直接读取酒精比重计和温度的示值 然后 查 GB/T 394.2-94 中的附录 A 酒精比重计示值换算成 20 时的乙醇浓度 酒精度 表 换算成 20 时的酒精度 3 仪器 3.1 酒精比重计 90% 100%(v/v) 分度值为 0.1%(v/v) 3.2 温度计 0~50 分度值为 0.2 3.3 量筒 100mL 4 操作步骤 将试样倒入洁净 干燥的 100mL 量筒中 静置至样品中气泡消失后 放入洗净 擦干的 酒精计 同时插入温度计 平衡 5 分钟 水平观测酒精计 读取酒精计与液体弯月面相切处 的刻度示值 同时记录温度 根据测得的酒精计示值和温度 查附录 A 校正成 20 时的乙 醇浓度 酒精度 5 精密度 同一样品两次测定值之差 不得超过 0.1%(v/v) 6 参考文献 GB/T 394.2-94 酒精通用试验方法 中 4.4 乙醇浓度(酒精度)
1
酒精比重与百分含量对照表
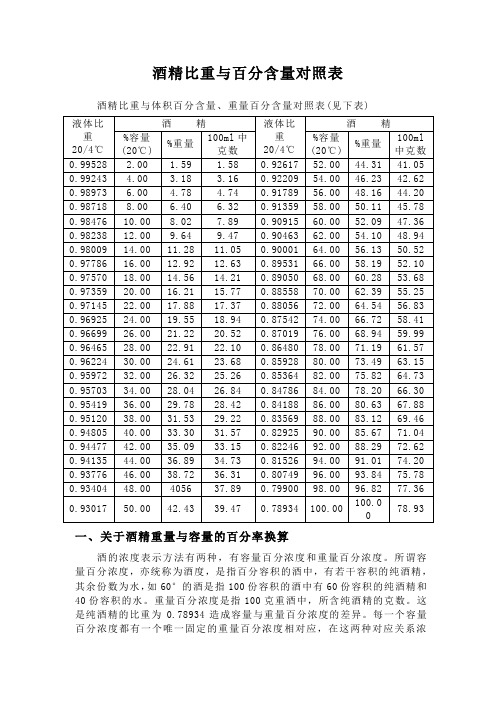
酒精比重与百分含量对照表酒精比重与体积百分含量、重量百分含量对照表(见下表)一、关于酒精重量与容量的百分率换算酒的浓度表示方法有两种,有容量百分浓度和重量百分浓度。
所谓容量百分浓度,亦统称为酒度,是指百分容积的酒中,有若干容积的纯酒精,其余份数为水,如60°的酒是指100份容积的酒中有60份容积的纯酒精和40份容积的水。
重量百分浓度是指100克重酒中,所含纯酒精的克数。
这是纯酒精的比重为0.78934造成容量与重量百分浓度的差异。
每一个容量百分浓度都有一个唯一固定的重量百分浓度相对应,在这两种对应关系浓度表示法中,存在着相互换算的数学关系。
换算公式的推导是这样的:V%:表示容量百分率(酒度)纯酒精容量数即×100%酒精(白酒)总容量数W%:表示重量百分率(酒度)纯酒精重量数即×100%酒精(白酒)总重量数D20/4:表示酒精(白酒)的比重(密度,在20℃时,酒精(白酒)的重量与同体积的纯水在)4℃时的重量之比)。
酒精(白酒)总容量数即纯酒精容量数0.78934:纯酒精在20℃/4℃时的比重。
为了方便推导,设样品酒的体积为1L。
那么,该样品酒中纯酒精的重量也可以利用容量百分率计算出来。
1L酒中纯酒精重量=1×D20/4×W% (2)(1)式应该等于(2)式便得:1×0.7893×V%=1×D20/4×W%D20/4V%= ×W% (3)0.789340.78934W%= ×W% (4)D20/4(3)式和(4)式就是这两种浓度相互换算的公式.例:有重量百分率为52.09%的酒,其比重为0.90915,示容量百分率。
由(3)式得:D20/4 0.90915V%= ×W% = ×52.09% = 60%0.78934 0.78934例:有容量百分率为70%的酒(70度),其比重为0.88558,由重理百分率导入(4)式得:0.78934 0.78934V%= ×W%= ×70% = 62.39% D20/4 0.88558关于酒的两种浓度的互相换算,经过前人努力,已把它们的对应关系算成表——“酒精容量%、密度、重量%对照表”,使用起来十分方便,我假道学必重复前人算过来的数字,只要从理论上弄清它们之彰的换算关系的来历,用时查表即可。
理化实验室基础知识之试剂百分浓度的表示方法及计算公式!

理化实验室基础知识之试剂百分浓度的表示方法及计算公式!百分浓度使用广泛,计算方便。
百分浓度又分重量百分浓度和体积百分浓度两种。
其中以重量百分浓度用的较多。
一、重量百分浓度用100克溶液中所含溶质的克数来表示溶液的浓度,叫做重量百分浓度。
即,溶质和溶剂的重量总和为100克或100克的倍数。
如公式表示:溶质(克)+溶剂(克)=100克溶液由于溶质有固体和液体,又可分别用下列公式计算重量百分浓度:1)如果溶质是固体设:W为需配成溶液的总重量;X%为需配制溶液的浓度;V为需用溶剂的克(毫升)数;x为需称取溶质的克数。
则x=X% ×WV=W-x例如:配制15%碘化钾溶液200克已知:W=200克 X%=15%x=200×0.15=30克(固体碘化钾)V=200-30=170克(溶剂的重量)称取30克碘化钾加170克水溶解即可。
2)如果溶质和溶剂均为液体设:W为需配制溶液总重量;X%为需配制溶液的浓度;a%为溶质的浓度;d为溶质的比重;V为应量取溶剂的体积或应称取重量(克);V'为应量取溶质的体积(毫升)。
V'=W×X%×1/(d×a%)V=W-(W×X%)例如:要配制20%的硝酸溶液500克(由瓶签上注明已知:浓硝酸的浓度90%,其比重为1.49)。
则:W=500,X%=20%a%=0.90,d=1.49V'=(W×X%)÷(d×a%)=500×0.20/1.49×0.90=74.57毫升V=W-(W×X%)=500-500×0.20=400毫升量取400毫升水,加入74.57毫升浓硝酸混匀即可。
二、体积百分浓度以100毫升溶液中所含溶质的毫升数来表示溶液的浓度,叫做体积百分浓度。
这是一种溶质和溶剂均是液体并且两者比重又相近,以体积比例来混合配制的溶液。
酒精配置

(1)95%酒精配制成75%酒精以100克为例:100克95%酒精中含酒精:100×95%=95克75%酒精中若有95克酒精,其总重量为:95÷75%=126.67克所以需要增加水的总量为:126.67-100=26.67克以100ml为例:100ml95%酒精中含酒精:100×95%=95ml75%酒精中若有95克酒精,其总重量为:95÷75%=126.67ml所以需要增加水的总量为:126.67-100=26.67ml(2)用95%的酒精配制500ml的75%酒精的计算方法500*75%=375ml 即需要纯酒精375ml,375/95%=390ml即需要95%的酒精390ml(3)有一公斤95%的酒精,要配制成75%的酒精需加水多少克,按重量算W=1*95%/75%=1.27kg加水0.27kg(4)用95%的酒精配制75%的酒精1000毫升,需要加水多少克!求高手告诉我解达过程!210.5mL需要95%的酒精的体积是1000*75%/95%=789.5mL需要水的体积是1000-789.5=210.5mL(5)请问浓度为95%的酒精配成浓度为75%的1kg,该加多少水和多少95%的酒精?75%*1kg/95%=0.79kg该加1kg-0.79kg=0.21kg 水和0.79kg95%的酒精。
(6)用75%的酒精1000ml用于皮肤消毒,现有为95%和40%两个浓度的酒精,利用上述两浓度将如何配制成浓度为75%的�95%与40%酒精的体积比是:(75-40)/(95-75)=7/4需要95%的酒精1000×7/11=636.4ml需要40%的酒精1000×4/11=363.6mL按计算的95%和40%酒精的体积混合即可。
A:设95%的体积为X,40%的为Y,则(95%x+40%y)/(x+y)=75%,可求出x/y=7/4,只要是体积比为7:4配比就可配成浓度75%,若要配1000ml,则x+y=1000,可求出x、y具体值B: 0.95x+0.4y=0.75(x+y)x+y=1000。
白酒酒精度等换算知识

白酒酒精度等换算知识
白酒酒精度等换算知识
酒精度最常用的表示方法有体积分数(%)和质量分数(%)。
体积分数(%)是指100mL酒中所含纯酒精的体积(mL)。
质量分数(%)是指100g酒中所含纯酒精乙醇的质量(g)。
一、酒精体积分数和质量分数的相互换算
(一)体积分数换算成质量分数
ω=Φ×0.78924/d204
式中ω——质量分数,%
Φ——体积分数,%
d204——样品的相对密度,是指20℃时样品的质量与同体积的纯水在4℃时质量之比0.78924——纯酒精在20℃/4℃时的相对密度例1:酒精为60%(体积分数),其相对密度为0.90911,求其质量分数。
ω(%)=Φ×0.78924/d20 4= 60×0.78924/0.90911=52.0887(二)将质量分数换算成体积分数(即酒精度)
Φ(%)=ω×d20 4/0.78924
例2:酒精质量分数为50.6009%,其相对密度为0.91248,求其体积分数。
Φ(%)=ω×d20 4/0.78924=50. 6009×0.91248/0.78924=58.5
二、低度酒和高度酒的相互换算
低度酒和高度酒的相互换算涉及折算率。
折算率又称换算系数,它是根据“酒精体积分数,相对密度,质量分数对照表”的有关数据推算而来。
其公式如下:。
酒精稀释公式

酒精稀释公式体积分数75%酒精的配制方法使用95%(体积分数)的酒精,配制成75%(体积分数)的酒精,有两种方法:(1)量取100ml 体积分数95%酒精,加水,到总体积126.7ml,得到体积分数75%酒精。
(2)称取100g体积分数为95%的酒精,加入36.4g水,得到体积分数75%酒精。
体积分数75%酒精,是用乙醇和水配制的,是体积分数为75%的乙醇水溶液,溶质是乙醇,溶剂是水。
它的浓度定义、配制理解和配制方法,详细如下:1、体积分数和质量分数的定义体积分数,按《JJF1074-2018酒精密度-浓度测量用表》定义,溶液中,所含溶质体积V’与溶液体积V的百分比,即:q=V′V×100%质量分数,溶液中溶质质量m’与溶液质量m的百分比,溶液质量等于溶质和溶剂的质量之和,即:p=m′m×100%2、75%酒精的理解(1)浓度为75%的酒精,也被叫作75%酒精、75度酒精,它的浓度也常表示为75%(V/V)。
(2)75%医用酒精,按《GB/T26373-2010乙醇消毒剂卫生标准》规定,乙醇消毒剂的乙醇含量是70%~80%(体积分数)。
如果按此标准,允许的配制浓度偏差是很有空间的。
(3)按体积分数的定义,75%酒精的配制方法是:取75ml的乙醇,加水配成100ml溶液。
(4)这种理解是错误的:75ml的乙醇,加25ml水,得到体积分数75%的酒精。
这样配制得到的浓度虽然符合70%~80%(体积分数),但它不符合体积分数的定义。
(5)酒精溶液的体积百分数,是用酒精计测定的,一般标准温度为20℃。
而且,因为乙醇、水的热胀冷缩程度是不同的,所以,配制和确定一个酒精溶液的体积分数时,必须要规定温度的,一般标准温度是20℃。
(7)体积分数75%的酒精的准确理解:规定标准温度为20℃,取75ml的乙醇,加水配成100ml溶液。
3、用95%酒精配制成75%酒精的方法准确地表述,应该是,用体积分数为95%的乙醇或者酒精,稀释配制成体积分数为75%的酒精溶液。
乙醇溶液的体积浓度与粘度的关系

乙醇溶液的体积浓度与粘度的关系引言乙醇溶液是一种常见的溶液体系,在许多领域中都有广泛的应用。
乙醇溶液的体积浓度是指溶液中乙醇的质量与溶液体积之比,而粘度是指流体内部分子间相互作用力的表现。
本文将探讨乙醇溶液的体积浓度与粘度之间的关系。
一、乙醇溶液的体积浓度乙醇溶液的体积浓度是指溶液中乙醇的质量与溶液体积之比。
体积浓度通常用百分数或摩尔浓度表示。
当乙醇溶液的体积浓度增加时,溶液中乙醇分子的数量增多,分子间的相互作用也会增强。
二、乙醇溶液的粘度粘度是指流体内部分子间相互作用力的表现,是流体内部分子间相互作用的阻碍力。
乙醇溶液的粘度受到温度、浓度、分子大小、分子形状等因素的影响。
当乙醇溶液的浓度增大时,溶液中分子间的相互作用力也会增强,从而使溶液的粘度增加。
三、乙醇溶液体积浓度与粘度的关系乙醇溶液的体积浓度与粘度之间存在一定的关系。
一般来说,随着乙醇溶液的体积浓度增加,溶液的粘度也会增加。
这是因为乙醇溶液中乙醇分子的数量增多,分子间的相互作用力增强,导致溶液的粘度增加。
然而,乙醇溶液的体积浓度与粘度之间的关系并非线性关系,而是呈现出一定的非线性特征。
随着乙醇溶液的体积浓度继续增加,溶液的粘度增加的速度会逐渐减缓。
这是因为在高浓度下,乙醇分子之间的相互作用力已经达到饱和状态,无法继续增强。
乙醇溶液的温度也会对体积浓度与粘度之间的关系产生影响。
一般情况下,温度升高会导致溶液的粘度降低。
因此,在研究乙醇溶液的体积浓度与粘度之间的关系时,需要同时考虑温度的影响。
结论乙醇溶液的体积浓度与粘度之间存在一定的关系。
一般来说,乙醇溶液的体积浓度增加会导致溶液的粘度增加。
然而,这种关系呈现出一定的非线性特征,随着体积浓度的增加,粘度增加的速度会逐渐减缓。
此外,温度的变化也会对体积浓度与粘度之间的关系产生影响。
在实际应用中,我们需要根据具体的需求和条件来选择适当的乙醇溶液浓度,以达到所期望的粘度要求。
体积百分比与质量浓度单位

体积百分比与质量浓度单位
体积百分比和质量浓度是化学中常用的浓度表示方式。
体积百分比是指溶液中溶质占总溶液体积的比例,通常用百分号表示。
质量浓度是指溶液中溶质质量与溶液总质量的比值,通常用克/升表示。
在实际应用中,体积百分比和质量浓度的单位可能会有所不同。
例如,在医疗领域中,常用的质量浓度单位是毫克/毫升,而在工业
生产中,常用的质量浓度单位是克/升。
当需要将两种不同的浓度单位进行转换时,需要知道溶液的密度。
因为体积百分比和质量浓度都是基于溶液总体积或总质量计算的,而密度是体积和质量的比值,因此可以使用密度将两种浓度单位进行转换。
例如,如果需要将一个体积百分比为5%的溶液转换为质量浓度,首先需要知道该溶液的密度。
假设该溶液的密度为1.2克/毫升,则
该溶液的质量浓度为:
5% × 1.2克/毫升 = 0.06克/毫升
同样地,如果需要将一个质量浓度为100毫克/毫升的溶液转换
为体积百分比,也需要知道该溶液的密度。
- 1 -。
体积比的表示方法

体积比的表示方法
宝子们!今天咱们来唠唠体积比这个事儿。
体积比呢,简单来说就是两种或多种物质在混合的时候,它们体积之间的比例关系。
最常见的表示方法呀,就像写分数那样。
比如说,把1份体积的酒精和3份体积的水混合,那这个体积比就可以写成1:3。
这就像在说,在这个混合液体里,酒精占1份,水占3份,多直白呀。
还有一种表示方法呢,就是用百分数。
不过这个百分数不是直接用总体积来算的哦。
还是刚刚那个例子,1份酒精和3份水,总体积就是4份啦。
那酒精的体积占总体积的比例就是1÷4 = 0.25,换算成百分数就是25%,水的体积占总体积就是3÷4 = 0.75,也就是75%。
这种表示方法在一些需要精确计算比例关系,或者和其他数据一起比较的时候就很有用啦。
在生活中也经常能看到体积比的影子呢。
像咱们喝的果汁饮料,有的会在标签上写果汁和其他添加物的体积比。
比如说,果汁和水的体积比是3:7,那咱就知道这个果汁饮料里果汁的含量大概是多少啦。
宝子们可别小看这个体积比哦。
在化学实验里,它可重要啦。
不同物质按照特定的体积比混合,可能会发生各种各样奇妙的反应呢。
比如说,在做一些溶液的配制实验时,准确的体积比能让实验结果更准确,要是体积比弄错了,那实验结果可能就会变得乱七八糟,就像你做菜的时候把盐和糖的量弄反了一样,那味道可就“灾难”啦。
酒精的物理化学性质

酒精的物理化学性质乙醇俗称酒精,是一种有机物,结构简式CHCHOH或CHOH,分子式CHO,是最常见的一元醇。
紧接着我们为你整理了酒精的物理化学性质,一起来看看吧。
酒精的物理性质溶解性能与水以任意比互溶;可混溶于醚、氯仿、甲醇、丙酮、甘油等多数有机溶剂。
无色透明液体,有特殊香味,易挥发。
相对密度0.816。
乙醇液体密度是0.789g/cm,乙醇气体密度为1.59kg/m,沸点是78.4℃,熔点是-114.3℃。
易燃,其蒸气能与空气形成爆炸性混合物,能与水以任意比互溶。
乙醇是一种非常不错的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分;也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提升反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相中充分接触,加快反应速率。
乙醇的物理性质主要与其低碳直链醇的性质有关。
分子中的羟基可以形成氢键,因此乙醇黏性大,也不及相近相对分子水平的有机化合物极性大。
室温下,乙醇是无色、易燃、有特殊香味的挥发性液体。
=589.3nm和18.35℃下,乙醇的折射率为1.36242,比水稍高。
挥发性作为溶剂,乙醇易挥发,且可以与水、乙酸、丙酮、苯、四氯化碳、氯仿、乙醚、乙二醇、甘油、硝基甲烷、吡啶和甲苯等溶剂混溶。
此外,低碳的脂肪族烃类如戊烷和己烷,氯代脂肪烃如1,1,1-三氯乙烷和四氯乙烯也可与乙醇混溶。
潮解性由于存在氢键,乙醇具有潮解性,可以很快从空气中吸收水分。
羟基的极性也使得大量离子化合物可溶于乙醇中,如氢氧化钠、氢氧化钾、氯化镁、氯化钙、氯化铵、溴化铵和溴化钠等。
氯化钠和氯化钾则微溶于乙醇。
此外,其非极性的烃基使得乙醇也可溶解一些非极性的物质,例如大部分香精油和大量增味剂、增色剂和医药试剂。
乙醇溶液密度每含有乙醇水平g浓度(体积比%)=度含有乙醇重量g浓度(体积比%)=度例如:密度为0.791g/cm每含有乙醇重量:0.79199.5%=0.787045g浓度:99.7%=99.7度酒精的化学性质酸碱性酸性乙醇的各种化学式乙醇分子中含有极化的氧氢键,电离时生成烷氧基负离子和质子。
