最新硫化物的溶解性归纳
高中化学 金属硫化物的溶解情况

金属硫化物•金属硫化物:(1)碱金属硫化物(Li----Cs)全部易溶于水。
(硫化铵在低温下0度左右易溶于水,但是在常温下会逐渐分解为氨和硫化氢)(2)碱土金属硫化物(除了Be)(Mg----Ba)易溶于水,但是同时完全水解为氢氧化物和硫氢化物。
(3)铝,铍,铬的硫化物全部水解为硫化氢气体和氢氧化物沉淀。
(4)FeS,ZnS,MnS,NiS,CoS不溶于水但溶于稀盐酸。
(5)Bi2S3,SnS,SnS2,PbS,CdS,Bi2S5等不溶于水和稀盐酸,只溶于浓盐酸。
(6)CuS,Cu2S,Ag2S不溶于水,稀盐酸,浓盐酸,只溶于浓硝酸。
(7)Hg2S,HgS不溶于水,浓稀盐酸,浓硝酸,只溶于王水。
•金属硫化物的溶解性归纳:1.溶于水的有:等,由于的水解,此类金属硫化物的水溶液显碱性:。
2.不溶于水但溶于稀盐酸的有:FeS、ZnS、MnS等。
如:。
3.不溶于稀盐酸但溶于浓盐酸的有:Cds、SnS、PbS等。
4.不溶于浓盐酸但溶于硝酸溶液的有:CuS等。
5.仅溶于王水的有:HgS等。
注意:遇水后,都水解,且相互促进,反应方程式为,因而不能与水共存,只能在干态下制取。
硫的价态转化规律:硫元素的价态比较多,常见的有-2、0、+4、+6 价,它们间的转化关系是:现将它们在化学反应中复杂的变化规律归结如下:1.邻位价态转化规律(1)是硫元素的最低价态,只有还原性。
它与氧化剂反应,其价态一般会升至相邻的价态()。
(2)S能发生自身氧化还原反应(即歧化反应),在反应时分别升至和降至与其相邻的价态。
如(3)处于中间价态,既有氧化性又有还原性。
与弱氧化剂作用时,被氧化成相邻的高价态;与弱还原剂作用时,被还原成相邻的低价态。
如(4)是硫元素的最高价态,只有氧化性。
遇到还原剂时,其价态一般降至相邻的价态()。
如2.跳位转化规律(1)遇到强氧化剂时,价态会发生跳位转化。
如(2)反应条件改变时,硫的价态也会发生跳位转化。
如3.互不换位规律(1)发生氧化还原反应时,只能转化为中间价态,不可能互换位置。
硫化物的溶解性

硫化物的溶解性杜晓莹高一化学第六章《氧族元素》在讲授“氢硫酸与某些重金属盐反应”这一性质时,经常会碰到这样的问题:H2S + CuSO4=CuS↓+ H2SO4H2S + Pb(NO3)2=PbS↓+ 2HNO3H2S + FeCl2 -→(不反应)如果是通过对鲜明的实验现象让学生接受上述反应并不困难。
但是往往有学生会有这样的疑问:这些反应为什么有的能发生,有的不能发生?能发生的反应是不是复分解反应?弱酸怎么能制取强酸?要理解这些问题就必须弄清硫化物在水中的溶解性。
新教材对硫化物的要求已不是很高,为了方便学生学习和教师参考,现将硫化物的溶解性归纳如下。
硫化物可以看作是氢硫酸所生成的正盐,一般认为是由电负性较硫小的元素与硫形成的化合物,其中大多数为金属硫化物。
自然界中金属硫化物矿约200余种。
有辉铜矿Cu2S、辉锑矿Sb2S3、辉钼矿MoS2、闪锌矿ZnS、方铅矿PbS、辰砂HgS、黄铁矿FeS2、雄黄As4S4、雌黄As2S3、辉铋矿Bi2S3、黄铜矿CuFeS2、斑铜矿Cu5FeS4等,无碱金属、碱土金属(Be除外)硫化物矿。
在金属硫化物中,碱金属硫化物和CaS、BaS是易溶于水的,其余碱土金属硫化物微溶于水(除BeS难溶),其余大多数硫化物都是难溶于水,并具有不同颜色的固体。
实际应用中常利用硫化物的特殊颜色来鉴别和判断所含的金属离子。
硫化物在水中或酸中的溶解包括溶解和电离两个过程,根据溶解平衡的观点硫化物的溶解过程显然与溶液中的硫离子浓度有很大关系,故了解硫化物的溶解性首先要知道H2S的溶解性。
在饱和的H2S水溶液中H+和S2-浓度之间的关系是:[ H+ ]2[ S2- ]=9.23×10-22从上式可以看出,溶液的PH值与S2-浓度密切相关。
同样,难溶金属硫化物在水中的溶解情况也与其溶度积常数有一定关系。
若溶液中金属离子和硫离子浓度的乘积小于该金属硫化物的Kθsp,此时该硫化物在溶液中以溶解状态存在。
硫化物的溶解性

未知驱动探索,专注成就专业
硫化物的溶解性
硫化物的溶解性与其离子性质有关。
一般来说,碱金属、碱土金属和铵离子的硫化物溶解性较好,而大多数过渡金属的硫化物溶解性较差。
在溶液中,硫化物会与氢离子反应生成氢硫化物,也就是硫化氢气体。
硫化氢溶解度较低,容易挥发出来。
同时,溶剂的性质也会影响硫化物的溶解性。
例如,水是一种良好的溶剂,可溶解许多硫化物。
而非极性溶剂如乙醚、苯等对硫化物的溶解性较差。
总体而言,硫化物的溶解性因硫化物离子的性质和溶剂的性质而异。
1。
硫化物的溶解性归纳

氢硫酸可产死正盐战酸式盐,酸式盐均易溶于火,而正盐中除碱金属(包罗NH4+)的硫化物战BaS易溶于火中,碱土金属硫化物微溶于火(BeS易溶),其余硫化物大多易溶于火,并具备特性的颜色.大普遍金属硫化物易溶于火.从结构圆里去瞅,S2-的半径比较大,果此变形性较大,正在取沉金属离子分离时,由于离子相互极化效率,使那些金属硫化物中的M—S键隐同价性,制成此类硫化物易溶于火.隐然,金属离子的极化效率越强,其硫化物溶解度越小.根据硫化物正在酸中的溶解情况,将其分为四类.睹表11-13.表11-13硫化物的分类
溶于密盐酸
·L-1HCl)
易溶于密盐酸
溶于浓盐酸
易溶于浓盐酸
溶于浓硝酸
仅溶于王火
MnSCoS
(肉色) (乌色)
ZnSNiS
(红色) (乌色)
FeS
(乌色)
SnSSb2S3
(褐色)(橙色)
SnS2Sb2S5
(黄色)(橙色)
PbSCdSS3
(乌色)(浅黄)
Cu2SAs2S6
果此那些金属硫化物正在火溶液中是没有存留的.制备那些硫化物必须用搞法,如用金属铝粉战 硫粉曲交化合死成Al2S3. 可溶性硫化物可用做还本剂,制制硫化染料、脱毛剂、农药战鞣革,也用于制荧光粉.
S2-+ H2O HS-+ OH-
碱土金属硫化物逢火也会爆收火解,比圆:
2CaS + 2H2O Ca(HS)2+ Ca(OH)2
某些氧化数较下金属的硫化物如Al2S3、Cr2S3等逢火爆收实足火解:Al2S3+ 6H2O ─→ 2Al(OH)3↓ + 3H2S↑
Cr2S3+ 6H2O ─→ 2Cr(OH)3↓ + 3H2S↑
高考化学_重要知识点:硫化物颜色、溶解性规律及应用

易忽视但重要的知识点:硫化物颜色、溶解性规律及应用
一、硫化物的颜色及溶解性规律:
硫化银(Ag2S):灰黑色,微溶于热水,溶于浓硫酸和KCN溶液。
三硫化二锑(Sb2S3):黄红色,难溶于水,溶于酒精、NH4HS、K2S溶液和盐酸;不溶于醋酸。
硫化亚铁(FeS):黑棕色,难溶于水,溶于稀硫酸和盐酸(起反应);不溶于氨水。
硫化铅(PbS):黑色,难溶于水,溶于硝酸;不溶于碱和酒精。
根据硫化物分别在水、稀酸、浓酸、氧化性酸中的溶解情况,将其分成四类,粗略地以金属活动性顺序为顺序:
说明:溶解性一栏中,后者可以溶解前者,例:浓盐酸可溶解SnS、PbS、ZnS及其以左的物质,而SnS、PbS却不能溶于稀盐酸。
二、解释常见金属硫化物性质
1、Na2S+FeSO4=Na2SO4+FeS↓ ① FeS+2HCl=H2S↑+FeCl2②
FeS+12HNO3(浓)=Fe(NO3)3+H2SO4+9NO2↑+5H2O③
反应①能发生是因为FeS不溶于水,但是FeS却能与盐酸反应,S被硝酸氧化,所以
发生反应②③。
2、H2S+CuSO4=CuS↓+H2SO4① 3CuS+8HNO3=3Cu(NO3)2+3S↓+2NO↑+4H2O②
反应①发生是因为CuS不溶于稀硫酸或稀盐酸,CuS可被硝酸氧化所以反应②发生。
3、H2S+Pb(NO3)2=PbS↓+2HNO3① H2S+2AgNO3= PbS↓+2HNO3②
反应①常用来检验H2S气体,反应①②发生是因为PbS 、PbS不易被硝酸氧化。
金属硫化物性质除与相应化合价有关外,还与其结构紧密程度有关,在学习中也应引起注意,不能单凭化合价判断性质。
1/ 1。
硫化物的溶解性归纳

氢硫酸可形成正盐和酸式盐,酸式盐均易溶于水,而正盐中除碱金属(包括NH4+)的硫化物和BaS易溶于水外,碱土金属硫化物微溶于水(BeS难溶),其它硫化物大多难溶于水,并具有特征的颜色。大多数金属硫化物难溶于水。从结构方面来看,S2-的半径比较大,因此变形性较大,在与重金属离子结合时,由于离子相互极化作用,使这些金属硫化物中的M—S键显共价性,造成此类硫化物难溶于水。显然,金属离子的极化作用越强,其硫化物溶解度越小。根据硫化物在酸中的溶解情况,将其分为四类。见表11-13。表11-13?硫化物的分类
溶?于?稀?盐?酸(0.3mol·L-1HCl)
难?溶?于?稀?盐?酸
溶于浓盐酸
难溶于浓盐酸
溶于浓硝酸
仅溶于王水
MnS?CoS(肉色) (黑色)ZnS?NiS?(白色) (黑色)FeS?(黑色)
SnS Sb2S3(褐色)?(橙色)SnS2Sb2S5(黄色)?(橙色)PbS CdS?(黑色)?(黄色)Bi2S3?(暗棕)
CuS?As2S3?(黑色) (浅黄)Cu2SAs2S6?(黑色) (浅黄)Ag2S?(黑色)
HgS?(黑色)Hg2S?(黑色)
>10-24
10-2Байду номын сангаас?>?> 10-30
<10-30
<<10-30
现以MS型硫化物为例,结合上述分类情况进行讨论。(1) 不溶于水但溶于稀盐酸的硫化物。此类硫化物的?>10-24,与稀盐酸反应即可有效地降低S2-浓度而使之溶解。例如:ZnS + 2H+?─→ Zn2+?+ H2S↑(2) 不溶于水和稀盐酸,但溶于浓盐酸的硫化物。此类硫化物的?在10-25~10-30之间,与浓盐酸作用除产生H2S气体外,还生成配合物,降低了金属离子的浓度。例如:PbS + 4HCl ─→ H2[PbCl4] + H2S↑(3) 不溶于水和盐酸,但溶于浓硝酸的硫化物。此类硫化物的?<10-30,与浓硝酸可发生氧化还原反应,溶液中的S2-被氧化为S,S2-浓度大为降低而导致硫化物的溶解。例如:3CuS + 8HN03?─→ 3Cu(NO3)2?+ 3S↓+ 2NO↑ + 4H2O(4) 仅溶于王水的硫化物。对于?更小的硫化物如HgS来说,必须用王水才能溶解。因为王水不仅能使S2-氧化,还能使Hg2+与Cl-结合,从而使硫化物溶解。反应如下:3HgS + 2HNO3?+ 12HCl ─→ 3H2[HgCl4] + 3S↓+ 2NO↑+ 4H2O由于氢硫酸是弱酸,故硫化物都有不同程度的水解性。碱金属硫化物,例如Na2S溶于水,因水解而使溶液呈碱性。工业上常用价格便宜的Na2S代替NaOH作为碱使用,故硫化钠俗称“硫化碱”。其水解反应式如下:S2-?+ H2O?HS-?+ OH-碱土金属硫化物遇水也会发生水解,例如:2CaS + 2H2O?Ca(HS)2?+ Ca(OH)2某些氧化数较高金属的硫化物如Al2S3、Cr2S3等遇水发生完全水解:Al2S3?+ 6H2O ─→ 2Al(OH)3↓ + 3H2S↑Cr2S3?+ 6H2O ─→ 2Cr(OH)3↓ + 3H2S↑因此这些金属硫化物在水溶液中是不存在的。制备这些硫化物必须用干法,如用金属铝粉和 硫粉直接化合生成Al2S3。可溶性硫化物可用作还原剂,制造硫化染料、脱毛剂、农药和鞣革,也用于制荧光粉。
溶解性表

溶解性表
溶:该物质可溶于水
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
—:该物质不存在或遇水发生水解
归纳:常见物质溶解性
1.氢氧化物:除K+、Na+、NH4+、Ba2+易溶,Ca(OH)2微溶,其它都难溶。
2.硝酸盐:均易溶
3.盐酸盐:AgCl、Hg2Cl2难溶,PbCl2微溶,其它都易溶。
4.硫酸盐:BaSO4、PbSO4难溶,Ag2SO4、Hg2SO4、CaSO4微溶,其它都易溶。
5.硫化物:除K+、Na+、NH4+盐易溶,其它都难溶或遇水分解。
6.亚硫酸盐:除K+、Na+、NH4+盐易溶,MgSO3微溶,其它都难溶。
7.碳酸盐:除K+、Na+、NH4+盐易溶,MgCO3微溶,其它都难溶或遇水分解。
8.硅酸盐:除K+、Na+、NH4+盐易溶,其它都难溶或遇水分解。
9.磷酸盐:除K+、Na+、NH4+盐易溶,其它都难溶。
10.含氧酸:除硅酸难溶,其它都易溶。
硫化物的溶解性归纳
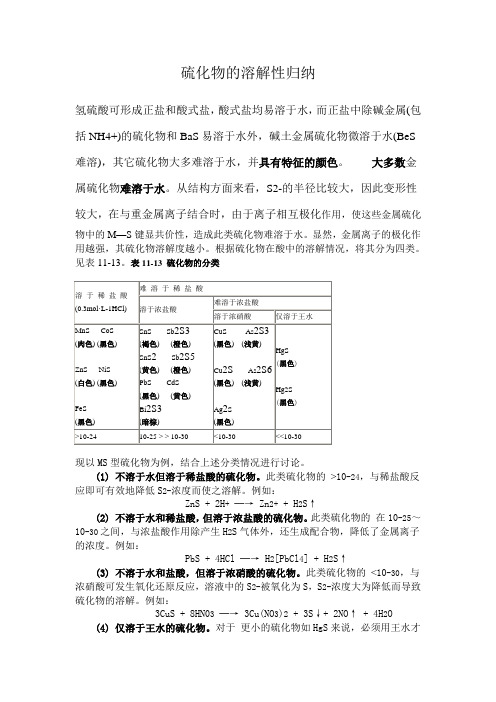
硫化物的溶解性归纳氢硫酸可形成正盐和酸式盐,酸式盐均易溶于水,而正盐中除碱金属(包括NH4+)的硫化物和BaS易溶于水外,碱土金属硫化物微溶于水(BeS 难溶),其它硫化物大多难溶于水,并具有特征的颜色。
大多数金属硫化物难溶于水。
从结构方面来看,S2-的半径比较大,因此变形性较大,在与重金属离子结合时,由于离子相互极化作用,使这些金属硫化物中的M—S键显共价性,造成此类硫化物难溶于水。
显然,金属离子的极化作用越强,其硫化物溶解度越小。
根据硫化物在酸中的溶解情况,将其分为四类。
见表11-13。
表11-13 硫化物的分类现以MS型硫化物为例,结合上述分类情况进行讨论。
(1) 不溶于水但溶于稀盐酸的硫化物。
此类硫化物的>10-24,与稀盐酸反应即可有效地降低S2-浓度而使之溶解。
例如:ZnS + 2H+─→ Zn2+ + H2S↑(2) 不溶于水和稀盐酸,但溶于浓盐酸的硫化物。
此类硫化物的在10-25~10-30之间,与浓盐酸作用除产生H2S气体外,还生成配合物,降低了金属离子的浓度。
例如:PbS + 4HCl ─→ H2[PbCl4] + H2S↑(3) 不溶于水和盐酸,但溶于浓硝酸的硫化物。
此类硫化物的<10-30,与浓硝酸可发生氧化还原反应,溶液中的S2-被氧化为S,S2-浓度大为降低而导致硫化物的溶解。
例如:3CuS + 8HN03─→ 3Cu(NO3)2+ 3S↓+ 2NO↑ + 4H2O(4) 仅溶于王水的硫化物。
对于更小的硫化物如HgS来说,必须用王水才能溶解。
因为王水不仅能使S2-氧化,还能使Hg2+与Cl-结合,从而使硫化物溶解。
反应如下:3HgS + 2HNO3+ 12HCl ─→ 3H2[HgCl4] + 3S↓+ 2NO↑+ 4H2O 由于氢硫酸是弱酸,故硫化物都有不同程度的水解性。
碱金属硫化物,例如Na2S溶于水,因水解而使溶液呈碱性。
工业上常用价格便宜的Na2S代替NaOH作为碱使用,故硫化钠俗称“硫化碱”。
硫化物溶解度

硫化物溶解度是指硫化物在溶剂中能溶解的最大浓度。
一般来说,硫化物的溶解度与溶剂的pH值、温度以及溶解的硫化物的种类有关。
通常来说,当溶剂的pH值增加时,硫化物的溶解度也会增加,因为pH值较高的溶剂中含有较多的氢离子,这些氢离子可以与硫化物反应生成溶解性较强的硫酸盐。
此外,随着温度的升高,硫化物的溶解度也会增加,因为高温可以促进物质的溶解。
同时,不同的硫化物在相同条件下的溶解度也可能不同,例如氯化硫酸盐的溶解度要比硫酸盐的溶解度高得多。
硫化物的溶解性 (2)

硫化物的溶解性
硫化物的溶解性取决于其盐的稳定性以及溶剂的性质。
一
般来说,硫化物具有较低的溶解度,尤其是重金属硫化物。
具体来说,以下是一些常见硫化物的溶解度情况:
- 碱金属硫化物(如Na2S、K2S)在水中具有较高的溶解度,形成碱性溶液。
- 碱土金属硫化物(如CaS、MgS)在水中溶解度较低,
但仍能产生碱性溶液。
- 过渡金属硫化物(如FeS、CuS)溶解度较低,通常需要较强的酸性条件才能溶解。
- 重金属硫化物(如HgS、PbS)溶解度非常低,通常需要使用强酸或强氧化剂才能溶解。
总的来说,硫化物的溶解度较低,特别是对于重金属硫化物。
这是由于硫化物离子在水中的溶解度较低,同时硫化物盐的稳定性较高。
然而,溶剂的性质和反应条件(例如温度、pH值等)也会对硫化物的溶解性产生影响。
硫化物的溶解性归纳讲解学习
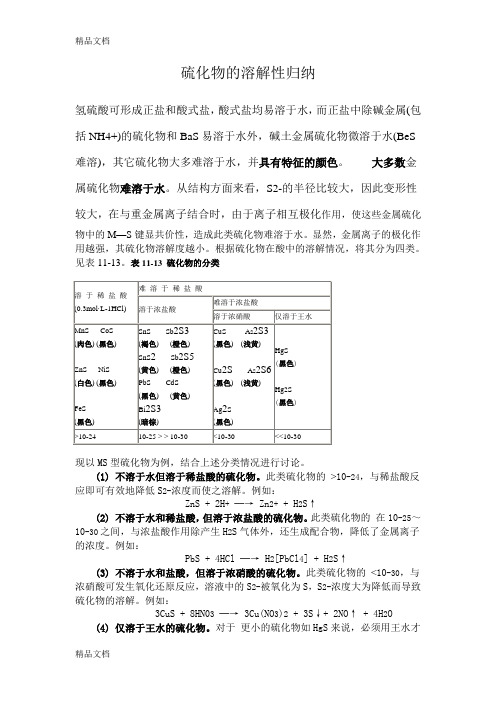
硫化物的溶解性归纳氢硫酸可形成正盐和酸式盐,酸式盐均易溶于水,而正盐中除碱金属(包括NH4+)的硫化物和BaS易溶于水外,碱土金属硫化物微溶于水(BeS 难溶),其它硫化物大多难溶于水,并具有特征的颜色。
大多数金属硫化物难溶于水。
从结构方面来看,S2-的半径比较大,因此变形性较大,在与重金属离子结合时,由于离子相互极化作用,使这些金属硫化物中的M—S键显共价性,造成此类硫化物难溶于水。
显然,金属离子的极化作用越强,其硫化物溶解度越小。
根据硫化物在酸中的溶解情况,将其分为四类。
见表11-13。
表11-13 硫化物的分类现以MS型硫化物为例,结合上述分类情况进行讨论。
(1) 不溶于水但溶于稀盐酸的硫化物。
此类硫化物的>10-24,与稀盐酸反应即可有效地降低S2-浓度而使之溶解。
例如:ZnS + 2H+─→ Zn2+ + H2S↑(2) 不溶于水和稀盐酸,但溶于浓盐酸的硫化物。
此类硫化物的在10-25~10-30之间,与浓盐酸作用除产生H2S气体外,还生成配合物,降低了金属离子的浓度。
例如:PbS + 4HCl ─→ H2[PbCl4] + H2S↑(3) 不溶于水和盐酸,但溶于浓硝酸的硫化物。
此类硫化物的<10-30,与浓硝酸可发生氧化还原反应,溶液中的S2-被氧化为S,S2-浓度大为降低而导致硫化物的溶解。
例如:3CuS + 8HN03─→ 3Cu(NO3)2+ 3S↓+ 2NO↑ + 4H2O(4) 仅溶于王水的硫化物。
对于更小的硫化物如HgS来说,必须用王水才能溶解。
因为王水不仅能使S2-氧化,还能使Hg2+与Cl-结合,从而使硫化物溶解。
反应如下:3HgS + 2HNO3+ 12HCl ─→ 3H2[HgCl4] + 3S↓+ 2NO↑+ 4H2O 由于氢硫酸是弱酸,故硫化物都有不同程度的水解性。
碱金属硫化物,例如Na2S溶于水,因水解而使溶液呈碱性。
工业上常用价格便宜的Na2S代替NaOH作为碱使用,故硫化钠俗称“硫化碱”。
硫化物的溶解性

硫化物的溶解性1.硫化物溶解性:Na+,K+等碱金属,NH4+的硫化物极易溶于水,并水解呈强碱性(硫化铵除外);MgS,CaS,SrS,BaS则几乎完全水解而微溶于水。
Al2S3则全部水解为氢氧化铝和H2S气体;其余硫化物都难溶于水,并显出不同的颜色。
硫化锌1.2*10^-23硫化锰1.4*10^-15硫化亚铁3.7*10^-19硫化铅3.4*10^-28硫化镉3.6*10^-29硫化锑2.9*10^-59硫化亚锡1.2*10^-25硫化汞4.0*10^-53硫化银1.6*10^-49硫化铜8.9*10^-45参考资料:《无机化学》第四版下册498页高等教育出版社2.硫化物稳定性:硫化物一般稳定性较小,因为S2-具有较强的还原性,在加热的条件下,H2S,CuS等均可分解为S,H2和Cu2S,S而碱金属,碱土金属硫化物热稳定性较大。
3.PH影响:氢硫酸是个弱酸,向大多数硫化物中加入稀强酸或弱酸,都可以溶解硫化物而放出H2S气体,而少数的硫化物连浓盐酸都无法溶解(CuS,HgS等)而这些只溶于王水。
不溶于水的硫化物通常不能溶于碱。
4.毒性:可溶性的硫化物有一定毒性,这是基源于硫化物水解导致的强碱性和硫离子的毒性;而不溶于水的硫化物毒性主要在于重金属离子(如Pb2+,Hg2+等)毒性,不过由于溶解度小,重金属离子的毒性较不突出。
5.腐蚀性:可溶性硫化物具有较强的腐蚀性。
因为常见的硫化钠,硫化钾水解程度很大,水溶液中水解产生的NaOH,KOH的浓度大,对人体皮肤粘膜,呼吸道等具有很强的腐蚀性,另外对金属Al,Zn,Pb等也有较强腐蚀作用!这是根据“软硬酸碱理论”:软硬有两个因素影响,一是电子云的变形能力,变形能力强的就软,差的就硬。
比如i离子就软,f离子就硬。
二是电荷数,同周期的电荷越高越硬。
比如na,mg,al,al就硬些,na就相对软些。
软硬配合的好的盐就比较难溶,比如caf2,而配合的差的就比较好溶(容易被溶剂破坏)比如nai (最后这一条是我的猜测)在其他强极性溶剂中也是如此,比如dmf另外具体的学习一下:软硬酸碱理论theory of hard and soft acids and bases将酸和碱根据性质不同分为软硬两类的理论。
硫化物的溶解性归纳

硫化物的溶解性归纳氢硫酸可形成正盐和酸式盐,酸式盐均易溶于水,而正盐中除碱金属(包括NH4+)的硫化物和BaS易溶于水外,碱土金属硫化物微溶于水(BeS 难溶),其它硫化物大多难溶于水,并具有特征的颜色。
大多数金属硫化物难溶于水。
从结构方面来看,S2-的半径比较大,因此变形性较大,在与重金属离子结合时,由于离子相互极化作用,使这些金属硫化物中的M—S键显共价性,造成此类硫化物难溶于水。
显然,金属离子的极化作用越强,其硫化物溶解度越小。
根据硫化物在酸中的溶解情况,将其分为四类。
见表11-13。
表11-13 硫化物的分类现以MS型硫化物为例,结合上述分类情况进行讨论。
(1) 不溶于水但溶于稀盐酸的硫化物。
此类硫化物的>10-24,与稀盐酸反应即可有效地降低S2-浓度而使之溶解。
例如:ZnS + 2H+─→ Zn2+ + H2S↑(2) 不溶于水和稀盐酸,但溶于浓盐酸的硫化物。
此类硫化物的在10-25~10-30之间,与浓盐酸作用除产生H2S气体外,还生成配合物,降低了金属离子的浓度。
例如:PbS + 4HCl ─→ H2[PbCl4] + H2S↑(3) 不溶于水和盐酸,但溶于浓硝酸的硫化物。
此类硫化物的<10-30,与浓硝酸可发生氧化还原反应,溶液中的S2-被氧化为S,S2-浓度大为降低而导致硫化物的溶解。
例如:3CuS + 8HN03─→ 3Cu(NO3)2+ 3S↓+ 2NO↑ + 4H2O(4) 仅溶于王水的硫化物。
对于更小的硫化物如HgS来说,必须用王水才能溶解。
因为王水不仅能使S2-氧化,还能使Hg2+与Cl-结合,从而使硫化物溶解。
反应如下:3HgS + 2HNO3+ 12HCl ─→ 3H2[HgCl4] + 3S↓+ 2NO↑+ 4H2O 由于氢硫酸是弱酸,故硫化物都有不同程度的水解性。
碱金属硫化物,例如Na2S溶于水,因水解而使溶液呈碱性。
工业上常用价格便宜的Na2S代替NaOH作为碱使用,故硫化钠俗称“硫化碱”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、什么叫“白描”
白描也是诗歌表现手法之一,主要用朴素简炼的文字描摹形象,不重词藻修饰与渲染烘托。
它要求抓住对象的特征,如实地勾勒出人物、事件、景物的情态面貌。
二、“白描”在古诗中的运用:
1、刻画人物,不绘背景,只突出主体。
如白居易的《卖炭翁》:
卖炭翁,伐薪烧炭南山中。
满面尘灰烟火色,两鬓苍苍十指黑。
卖炭得钱何所营?身上衣裳口中食。
可怜身上衣正单,心忧炭贱愿天寒。
夜来城外一尺雪,晓驾炭车辗冰辙。
牛困人饥日已高,市南门外泥中歇。
在这首小型叙事诗中,作者以白描的手法,成功地塑造了卖炭老翁的感人形象。
“满面尘灰烟火色,两鬓苍苍十指黑。
”这十四个字的肖像描写,不仅准确地表现了卖炭翁的职业和年龄特征,而且使人想到他的辛酸劳作和痛苦生活。
长期受烟火熏烤使皮肤变色,终日扒摸木炭把十指沾黑,而“两鬓苍苍”又表现出卖炭翁的凄楚和衰老。
这样拚死拚活的苦干,只不过为了“身上衣裳口中食”,挣点钱勉强度日。
“可怜身上衣正单”,“夜来城外一尺雪”。
作者又以对照的写法来表现卖炭翁的困苦生活。
“心忧炭贱愿天寒”,是更深入一层的心理刻画。
一般人在衣单不能御寒时,总想天气暖和,可是卖炭翁却在“衣正单”时“愿天寒”,一怕
天气暖,炭卖不掉,衣食无所出,二想天气寒冷,卖个好价钱。
这两句诗深刻地表现了他对“卖炭得钱”的殷切期望,反映了他十分悲惨的生活境遇。
用白描手法刻画人物,三言两语就能揭示人物的外貌、神态,使读者如见其人。
2、叙写事件,不求细致,只求简明。
如聂夷中的《田家》:
父耕原上田,子属山下荒;六月禾未秀,官家已修仓。
这首诗表现田家的悲苦命运,没有大肆铺张,用语简炼,诗人冷静地叙述田家的生活与遭际:父亲在原田上耕种,儿子在山边开垦荒地,他们不惜流血流汗,想尽办法扩大耕种,增加收获,以维持生计,图个日子过得好一点。
然而,在青黄不接的六月,田地里的庄稼还没有成熟,“官家”早已迫不及待地修缮粮仓,张开血盆大口,只等着禾苗成熟,便如数搜刮进自己的仓里。
全诗没有半句议论与抒情,却深刻地提示了农民深受苦难的根源。
用白描手法用于叙事,使人感到线条明晰,言简意真。
3、描写景物,不尚华丽,务求朴实。
如马致远的《天净沙·秋思》:
枯藤老树昏鸦,小桥流水人家,古道西风瘦马。
诗人连用九个名词,分别描绘了“枯藤”“老树”“昏鸦”“小桥”“流水”“人家”“古道”“西风”“瘦马”九个意象,成一幅苍凉寂寥的秋景图,表现出浓烈的思乡之情。
尽管作者不著一个哀字,但是悠悠哀愁在这样萧瑟苍凉的暮景中尽露无遗。
用白描手法写景,可让人快速抓住景物的特征,体会作者所寄寓的感情。
最后想补说一句,白描,有别于细描。
细描是对事物的主要特征作细致入微的刻画。
这种描写,文字绚丽,色彩斑斓,有如镂金错彩,绚丽华美。
常运用对比、比喻、拟人、夸张等修辞手法。
白描则是强调简单质朴,不重词藻修饰与渲染烘托。
