2020创新设计一轮复习化学_人教版核心素养提升17不同结构物质的沸点比较(最新整理)
总复习高三化学一轮复习优化设计(第七辑):一百零二 醇和酚

聚焦与凝萃1.掌握乙醇、苯酚的结构和主要化学性质;2.了解醇、酚的分类及结构特点,一般通性和典型的用途;3.认识有机物分子中原子或原子团之间的相互影响,形成结构决定性质,性质反映结构的学科思想。
解读与打通常规考点一、乙醇1.分子组成与结构:分子式:C2H6O结构简式:CH3—CH2—OH电子式:比例模型:2.物理性质:乙醇是无色透明而有特殊香味的液体,密度比水小,沸点为78.5 ℃,易挥发,能和水以以任意比混溶,乙醇本身是良好的有机溶剂,能溶解多种有机物和无机物。
3.化学性质:(1)与活泼金属反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑(2)氧化反应:①燃烧:CH3CH2OH+3O2 2CO2+3H2O,②催化氧化反应:CH3CH2OH+CuO−→−∆CH3CHO+Cu+H2O③通入KMnO4酸性溶液,可使溶液褪色。
(3)与氢卤酸反应:CH3CH2OH+HBr CH3CH2Br+H2O(4)分子间脱水反应:(5)分子内脱水反应:(6)酯化反应:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 注意:①浓硫酸的作用为:催化剂、吸水剂。
②用烧瓶或大试管,大试管倾斜成45°角(使试管受热面积大),长导管起冷凝回流和导气作用。
③采用如下措施提高产率:用浓硫酸吸水,使平衡向正反应方向移动;加热将酯蒸出,使平衡向正反应方向移动;可适当增加乙醇的量以提高乙酸的转化率,并使用冷凝回流装置.④饱和Na2CO3溶液的作用:中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度.⑤玻璃导管的末端不要插入液面以下,以防液体倒吸;⑥加入试剂的顺序:乙醇→浓硫酸→乙酸;⑦对试管进行加热时,一定要用小火使温度慢慢升高,防止乙酸、乙醇的挥发,提高乙酸、乙醇的转化率,同时生成足够多的乙酸乙酯。
二、醇类1.概念:醇是羟基与烃基或苯环侧链上的碳原子相连的化合物,饱和一元醇的分子通式为C n H2n+1OH (n≥1).2.醇的分类一元醇:C2H5OH(1)据含羟基数目二元醇:乙二醇多元醇:丙三醇(2)据含烃基种类分:饱和醇和不饱和醇。
专题04 烷烃(核心素养)-2023学年高二化学知识整合讲练(人教版2019选择性必修3)(原卷版)
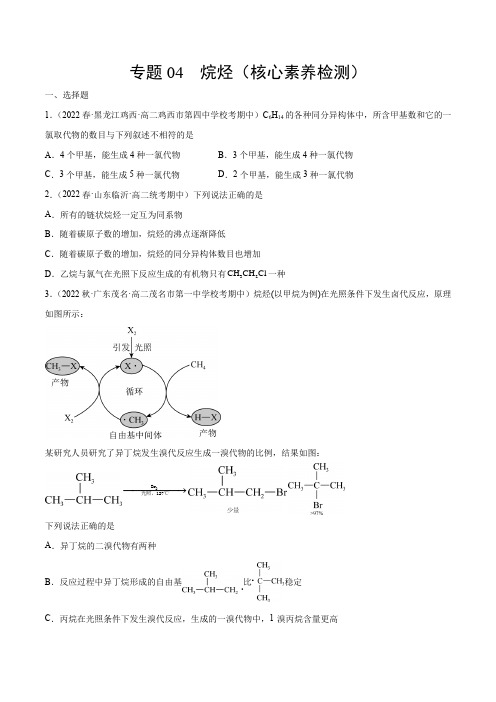
专题04 烷烃(核心素养检测)一、选择题1.(2022春·黑龙江鸡西·高二鸡西市第四中学校考期中)C6H14的各种同分异构体中,所含甲基数和它的一氯取代物的数目与下列叙述不相符的是A.4个甲基,能生成4种一氯代物B.3个甲基,能生成4种一氯代物C.3个甲基,能生成5种一氯代物D.2个甲基,能生成3种一氯代物2.(2022春·山东临沂·高二统考期中)下列说法正确的是A.所有的链状烷烃一定互为同系物B.随着碳原子数的增加,烷烃的沸点逐渐降低C.随着碳原子数的增加,烷烃的同分异构体数目也增加CH CH Cl一种D.乙烷与氯气在光照下反应生成的有机物只有323.(2022秋·广东茂名·高二茂名市第一中学校考期中)烷烃(以甲烷为例)在光照条件下发生卤代反应,原理如图所示:某研究人员研究了异丁烷发生溴代反应生成一溴代物的比例,结果如图:Br−−−−−−→2光照,127℃下列说法正确的是A.异丁烷的二溴代物有两种B.反应过程中异丁烷形成的自由基比稳定C.丙烷在光照条件下发生溴代反应,生成的一溴代物中,1-溴丙烷含量更高D .光照条件下卤素单质分子中化学键断裂是引发卤代反应的关键步骤4.(2022春·黑龙江双鸭山·高二校考期中)下列烷烃的系统命名正确的是A .4-甲基-4,5-二乙基己烷B .3-甲基-2,3-二乙基己烷C .2-甲基-3-乙基丁烷D .2-甲基-4-乙基庚烷5.(2022春·重庆江津·高二校考期中)下列说法不正确的是A .烷烃分子中碳原子间以单键结合,碳原子剩余价键全部与氢原子结合B .分子组成符合C n H 2n +2的烃一定是烷烃C .正丁烷分子中的4个碳原子在一条直线上D .有机化合物中的三键含有一个σ键和两个π键6.(2022秋·上海宝山·高二上海交大附中校考期中)完全燃烧相同质量的烷烃,消耗氧气的随着C 原子数的增加而A .减小B .不变C .增加D .周期性变化7.(2022秋·上海宝山·高二上海交大附中校考期中)在烷烃分子中,3CH —、2CH ——、、中的碳原子分别称为伯、种叔、季碳原子,数目分别用1n 、2n 、3n 、4n 表示。
高中化学物质熔沸点的高低比较

物质熔、沸点高低的规律小结熔点是固体将其物态由固态转变〔熔化〕为液态的温度。
熔点是一种物质的一个物理性质,物质的熔点并不是固定不变的,有两个因素对熔点影响很大,一是压强,平时所说的物质的熔点,通常是指一个大气压时的情况,如果压强变化,熔点也要发生变化;另一个就是物质中的杂质,我们平时所说的物质的熔点,通常是指纯净的物质。
沸点指液体饱和蒸气压与外界压强相同时的温度。
外压力为标准压(1.01×105Pa)时,称正常沸点。
外界压强越低,沸点也越低,因此减压可降低沸点。
沸点时呈气、液平衡状态。
在近年的高考试题及高考模拟题中我们常遇到这样的题目:以下物质按熔沸点由低到高的顺序排列的是,A、二氧化硅,氢氧化钠,萘B、钠、钾、铯C、干冰,氧化镁,磷酸D、C2H6,C(CH3)4,CH3(CH2)3CH3在我们现行的教科书中并没有完整总结物质的熔沸点的文字,在中学阶段的解题过程中,具体比较物质的熔点、沸点的规律主要有如下:1.根据物质在相同条件下的状态不同一般熔、沸点:固>液>气,如:碘单质>汞>CO22. 由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似;还有ⅢA族的镓熔点比铟、铊低;ⅣA族的锡熔点比铅低。
3. 同周期中的几个区域的熔点规律①高熔点单质C,Si,B三角形小区域,因其为原子晶体,故熔点高,金刚石和石墨的熔点最高大于3550℃。
金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨〔3410℃〕。
②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,如氦的熔点〔-272.2℃,26×105Pa〕、沸点〔268.9℃〕最低。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。
2024-2025学年高中化学第3章本章重难点专题突破四物质熔、沸点高低的比较规律教案鲁科版选修3

甲烷的熔点和沸点低于乙烯,原因在于甲烷分子是非极性分子,分子间作用力较小,分子间距离较大,导致其熔点和沸点较低。而乙烯分子是极性分子,分子间作用力较大,分子间距离较小,因此其熔点和沸点较高。
2.例题2:判断下列物质中,哪些具有较高的熔点和沸点。
(1)氮气(N2);(2)水(H2O);(3)氦气(He);(4)氯化钠(NaCl)。
2.关键词:
①熔点;②沸点;③分子间作用力;④分子结构;⑤实际应用。
3.句/表述:
①物质熔、沸点是分子间作用力与分子结构的函数;
②掌握比较规律,能解释不同物质熔、沸点的高低;
③物质熔、沸点在工业生产、医药、食品等领域具有广泛应用。
艺术性和趣味性设计:
1.使用图表、示意图等视觉元素,展示物质熔、沸点的变化规律,使板书更具直观性;
4.在线讨论区:便于学生提问、交流和分享学习心得。
教学手段:
1.讲授法:讲解物质熔、沸点高低的比较规律;
2.实验法:通过实验分析物质熔、沸点的影响因素;
3.小组讨论法:引导学生探讨实验现象和解决问题;
4.案例分析法:结合实际案例,深入理解熔、沸点规律的应用;
5.反馈评价法:通过作业、测验等方式,了解学生掌握程度,及时调整教学策略。
2.以故事化、情境化的方式呈现物质熔、沸点的实际应用案例,增加板书的趣味性;
3.设计生动、形象的人物或卡通形象,代表不同物质,进行熔、沸点的比较,使板书更具艺术性;
4.运用色彩、字体变化等设计手法,突出重点知识点,提高板书的吸引力;
5.板书设计中加入互动环节,如提问、讨论等,激发学生的主动性和参与度。
5.教室桌椅:便于学生进行实验和小组讨论。
物质熔沸点高低的比较及应用

物质熔沸点高低的比较及应用如何比较物质的熔、沸点的高低,首先分析物质所属的晶体类型,其次抓住同一类型晶体熔、沸点高低的决定因素,现总结如下供同学们参考:一、不同类型晶体熔沸点高低的比较一般来说,原子晶体>离子晶体>分子晶体;金属晶体(除少数外)>分子晶体。
例如:SiO2>NaCL>CO2(干冰)金属晶体的熔沸点有的很高,如钨、铂等;有的则很低,如汞、镓、铯等。
二、同类型晶体熔沸点高低的比较同一晶体类型的物质,需要比较晶体内部结构粒子间的作用力,作用力越大,熔沸点越高。
影响分子晶体熔沸点的是晶体分子中分子间的作用力,包括范德华力和氢键。
1.同属分子晶体①组成和结构相似的分子晶体,一般来说相对分子质量越大,分子间作用力越强,熔沸点越高。
例如:I2>Br2>Cl2>F2。
②组成和结构相似的分子晶体,如果分子之间存在氢键,则分子之间作用力增大,熔沸点出现反常。
有氢键的熔沸点较高。
例如,熔点:HI>HBr>HF>HCl;沸点:HF>HI>HBr>HCl。
③相对分子质量相同的同分异构体,一般是支链越多,熔沸点越低。
例如:正戊烷>异戊烷>新戊烷;互为同分异构体的芳香烃及其衍生物,其熔沸点高低的顺序是邻>间>对位化合物。
④组成和结构不相似的分子晶体,分子的极性越大,熔沸点越高。
例如:CO>N2。
⑤还可以根据物质在相同的条件下状态的不同,熔沸点:固体>液体>气体。
例如:S >Hg>O2。
2.同属原子晶体原子晶体熔沸点的高低与共价键的强弱有关。
一般来说,半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高。
例如:金刚石(C-C)>二氧化硅(Si-O)>碳化硅(Si-C)晶体硅(Si-Si)。
3.同属离子晶体离子的半径越小,所带的电荷越多,则离子键越强,熔沸点越高。
例如:MgO>MgCl2,NaCl>CsCl。
4.同属金属晶体金属阳离子所带的电荷越多,离子半径越小,则金属键越强,高沸点越高。
例如:Al>Mg>Na。
高考化学溶沸点比较知识讲解

高考化学溶沸点比较主要方法有如下几种(1)由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似。
还有ⅢA族的镓熔点比铟、铊低,ⅣA族的锡熔点比铅低。
(2)同周期中的几个区域的熔点规律①高熔点单质 C,Si,B三角形小区域,因其为原子晶体,熔点高。
金刚石和石墨的熔点最高大于3550℃,金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410℃)。
②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,而氦是熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA 族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。
最低熔点是Hg(-38.87℃),近常温呈液态的镓(29.78℃)铯(28.4℃),体温即能使其熔化。
(3)从晶体类型看熔、沸点规律原子晶体的熔、沸点高于离子晶体,又高于分子晶体。
金属单质和合金属于金属晶体,其中熔、沸点高的比例数很大(但也有低的)。
在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。
判断时可由原子半径推导出键长、键能再比较。
如熔点:金刚石>碳化硅>晶体硅分子晶体由分子间作用力而定,其判断思路是:①结构性质相似的物质,相对分子质量大,范德华力(分子间作用力指存在于分子与分子之间或惰性气体原子间的作用力,又称范德华力)大,则熔、沸点也相应高。
如烃的同系物、卤素单质、稀有气体等。
②相对分子质量相同,化学式也相同的物质(同分异构体),一般烃中支链越多,熔沸点越低。
烃的衍生物中醇的沸点高于醚;羧酸沸点高于酯;油脂中不饱和程度越大,则熔点越低。
如:油酸甘油酯常温时为液体,而硬脂酸甘油酯呈固态。
2024届高考一轮复习化学课件(人教版):物质结构与性质-物质结构与性质填空题突破

②BCl3中B原子的_s_p_2杂__化___轨道与Cl原子的__3_p__轨道形成σ键;形成BCl3过程中基 态B原子价电子层上的电子先激发,再杂化,激发后B原子的价层电子轨道表示式为
NA mol
真题演练 1 2
(2)以分子结构为主线的考查角度
(3)以晶体结构为主线的考查角度
跟踪 训练
1.(2022·西安模拟)硒(Se)是一种有重要作用的元素,可以形成多种化合物。 (1)基态硒原子的核外电子排布式为__[_A_r_]3_d_1_0_4_s2_4_p_4__。
硒为34号元素,基态Se原子核外电子排布式为[Ar]3d104s24p4。
真题演练 1 2
(3)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 __C__sC__l _。解释X的熔点比Y高的原因__C_s_C_l_为__离__子__晶__体__,__I_C_l为__分__子__晶__体____。
CsICl2发生非氧化还原反应,各元素化合价不变,生成无色晶体和红棕色液体, 则无色晶体为CsCl,红棕色液体为ICl,而CsCl为离子晶体,熔化时克服的是离子 键,ICl为分子晶体,熔化时克服的是分子间作用力,因此CsCl的熔点比ICl高。
(2)A中C原子杂化轨道类型为__sp_2_和__s_p_3;按VSEPR模型预测B中∠HCC约为__1_2_0_°_、 __1_0_9_°_2_8_′__(填角度)。B在碱性条件下断裂极性最大的键是_O_—__H__。具有分子内氢键 的是__B___(填“A”或“B”)。
A中,饱和C原子采取sp3杂化,碳氧双键中的C原子采取sp2杂化,故A中C原子杂 化轨道类型为sp2和sp3;按VSEPR模型,B中碳碳双键上的一个碳原子和其相邻 的原子构成了接近正三角形的结构,该结构中的∠HCC约为120°,甲基和相邻 的碳原子构成了接近正四面体的结构,故该结构中的∠HCC约为109°28′; B中O和H的电负性差异最大,故极性最大的键为O—H;如图所示,B分子中的 酮羰基上的O和羟基上的H形成分子内氢键。
2024届高考化学一轮复习课件(人教版)第十一单元 有机化学 第5讲

______________________________________________。
核心素养
微专题
高考真题演练
课时作业
b.碱性条件下——皂化反应 油脂+NaOH――△→ 17 __高__级__脂__肪__酸__钠__+__甘__油_______。 例如:硬脂酸甘油酯在碱性条件下水解的反应方程式为 18
目分多元羧酸
核心素养
微专题
高考真题演练
课时作业
3.羧酸的化学性质 羧酸的化学性质主要取决于羧基,反应时的主要断键位置如图:
(1)酸的通性(以乙酸为例):乙酸是一种弱酸,其酸性比碳酸 01 __强__,
在水溶液里的电离方程式为 02 __C__H_3_C_O_O__H____C__H_3_C_O__O_-_+__H__+___。可以
物,官能团为 03 —___C_O_O__H_,饱和一元羧酸的通式为 04 __C__nH__2n_O__2(_n_≥_1_)_____。
2.分类
按烃基脂肪酸:如乙酸、硬脂酸、油酸
不同分芳香酸:如苯甲酸
羧,酸) 按羧一元羧酸:如甲酸(HCOOH)、乙酸、硬脂酸
基数二元羧酸:如乙二酸(HOOC—COOH)
(7)苯胺(
)和酰胺(
)均能发生水解反应。
错因:_苯__胺__不__能__发__生__水__解__反__应__。____________________________
核心素养
微专题
高考真题演练
课时作业
1.酯化反应的五大类型 (1)一元羧酸与一元醇之间的酯化反应。如
浓硫酸 CH3COOH+C2H5OH △ CH3COOC2H5+H2O。 (2)一元羧酸与多元醇之间的酯化反应。如
物质结构与性质高考热点归纳 熔沸点、溶解性、稳定性、酸性等性质比较

物质结构与性质高考热点归纳物质熔沸点、溶解性、稳定性等性质的比较物质溶沸点的比较一、先将物质分类:从物质的晶体类型上一般分为分子晶体,离子晶体,原子晶体和金属晶体。
不同物质类别熔沸点的比较方法不同。
一般情况下:原子晶体﹥离子晶体﹥分子晶体。
金属晶体有常温是液态的汞和熔点高达三千多摄氏度的钨。
1.对于分子晶体:a.结构相似时,相对分子质量越大分子间作用力越强其熔沸点越高。
如:CH4﹤SiH4﹤GeH4;CH4﹤C2H6﹤C3H8﹤C4H10b.能形成分子间氢键时熔沸点陡然增高。
如:H2O﹥H2Te﹥H2Se﹥H2S(能形成氢键的元素有N、O、F,如HF 、H2O、NH3,低级醇、醛、酸与水均能形成氢键) 。
c.当形成分子内氢键时熔沸点降低。
如:邻羟基甲苯的熔沸点低于对羟基甲苯。
d.对于烃类物质碳原子数相同时支链越多熔沸点越低。
2.对于离子晶体:a、要看离子半径的大小和离子所带电荷的多少,离子半径越小,离子所带电荷越多则离子键越强晶格能越大熔沸点越高。
如:KCl﹤NaCl﹤MgO (注意:NaCl、MgCl2晶体中离子排列方式不同,不能简单得出熔沸点NaCl﹤MgCl2,实际上刚好相反。
有些参考书上熔沸点NaCl﹤MgCl2是错误的,根据所学知识无法比较。
)3.原子晶体:要看原子半径的大小,原子半径越小,则键长越短,导致键能越大,熔沸点越高。
如:金刚石﹥碳化硅﹥单晶硅(注意:金刚石、碳化硅、硅原子晶体中原子排列方式相同,但与二氧化硅不同,不能简单得出二氧化硅熔沸点的位置。
有些参考书上熔沸点金刚石﹥二氧化硅﹥碳化硅﹥单晶硅是错误的,根据所学知识无法比较。
)例:C60与金刚石的熔点比较,不应该从键长角度比较。
因为C60是分子晶体,熔沸点由分子间作用力决定。
C60熔点应该比金刚石的熔点低很多。
4.金属晶体:一般比金属离子的半径和金属阳离子所带电荷的多少(教材:单位体积内自由电子数目的多少)。
如Na﹤Mg﹤Al二、从物质在常温常压下的状态去分析。
人教版 高考化学复习 核心素养测评31 认识有机化合物00

认识有机化合物一、选择题(本题包括4小题,每题6分,共24分)1.现有一瓶由两种液态有机物乙二醇和丙三醇(甘油)组成的混合液,根据下表性质判定,要将乙二醇和丙三醇相互分离的最佳方法是( )物质分子式熔点℃沸点℃密度(g·cm-3)溶解性乙二醇C2H6O2-11.5 198 1.11 易溶于水和乙醇丙三醇C3H8O317.9 290 1.26 能跟水、酒精以任意比互溶A.萃取B.升华C.蒸馏D.分液【解析】选C。
二者性质相似,沸点不同,可用蒸馏法进行分离。
2.S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )A.含有碳碳双键、羟基、羰基、羧基B.含有苯环、羟基、羰基、羧基C.含有羟基、羰基、羧基、酯基D.含有碳碳双键、苯环、羟基、羰基【解析】选A。
由S-诱抗素的结构简式可知,1个该有机物的分子结构中存在3个碳碳双键、1个羰基、1个(醇)羟基、1个羧基;结构中只有一个六元环,无苯环结构;分子中无酯基结构。
3. (双选)(原创)1957年美国化学家施莱尔在实验时无意中发现产物中含有约10%的金刚烷副产物,并通过优化条件提高了其产率,从廉价的石化产品环戊二烯二聚体经两步即可制得,从此金刚烷成为了一种十分易得的有机物。
下列有关金刚烷的表述错误的是( )A.金刚烷的分子式为C10H14B.金刚烷的二氯代物有5种C.金刚烷完全燃烧的耗氧量是其自身物质的量的14倍D.金刚烷可以发生取代反应和氧化反应【解析】选A、B。
金刚烷的分子式为C10H16,A错误;金刚烷的二氯代物有6种,B错误;1 mol金刚烷完全燃烧消耗氧气14 mol,C正确;金刚烷的性质与烷烃相似,可以发生取代反应和氧化反应,D正确。
4.(2020·宁波模拟)下列说法不正确的是( )A.某烷烃R的相对分子质量为86,1H核磁共振谱(1H-NMR)显示分子中有两个峰。
则R的名称一定为2,3-二甲基丁烷B.为DDT的结构简式,分子中最多有13个碳原子共平面C.乳酸(C3H6O3)与葡萄糖最简式相同,它们互为同系物D.青蒿素(C15H22O5)的结构如图所示【解析】选C。
(完整版)2020创新设计一轮复习化学(人教版)讲义:第十二章+第3讲+烃的含氧衍生物及答案

第3讲烃的含氧衍生物【2020·备考】最新考纲:1.掌握醇、酚的结构与性质,以及它们之间的相互转化。
2.掌握醛、羧酸、酯的结构与性质。
3.掌握醛、羧酸、酯与其他有机物的相互转化。
4.了解有机分子中官能团之间的相互影响。
核心素养:1.宏观辨识与微观探析:认识烃的衍生物的多样性,并能从官能团角度认识烃的衍生物的组成、结构、性质和变化,形成“结构决定性质”的观念。
2.证据推理与模型认知:具有证据意识,能基于证据对烃的衍生物的组成、结构及其变化提出可能的假设。
能运用相关模型解释化学现象,揭示现象的本质和规律。
考点一醇、酚(频数:★★★难度:★★☆)名师课堂导语本考点主要考查醇、酚的性质,重点掌握醇的酯化反应和消去反应;酚羟基的检验以及含酚羟基的同分异构体等。
1.醇、酚的概念(1)醇是羟基与烃基或苯环侧链上的碳原子相连的化合物,饱和一元醇的分子通式为CnH2n+1OH(n≥1)。
(2)酚是羟基与苯环直接相连而形成的化合物,最简单的酚为。
(3)醇的分类2.醇、酚的物理性质(1)醇类物理性质的变化规律物理性质递变规律密度一元脂肪醇的密度一般小于1 g·cm-3沸点①直链饱和一元醇的沸点随着分子中碳原子数的递增而逐渐升高②醇分子间存在氢键,所以相对分子质量相近的醇和烷烃相比,醇的沸点远高于烷烃水溶性低级脂肪醇易溶于水,饱和一元醇的溶解度随着分子中碳原子数的递增而逐渐减小醇羟基是亲水基,多羟基化合物如丙三醇等都与水以任意比例互溶。
(2)苯酚的物理性质3.由断键方式理解醇的化学性质如果将醇分子中的化学键进行标号如图所示,那么醇发生化学反应时化学键的断裂情况如下表所示:以乙醇为例,完成下列条件下的化学方程式,并指明断键位置及反应类型。
反应物及条件断键位置 反应类型 化学方程式 Na ① 置换反应 2CH 3CH 2OH +2Na―→2CH 3CH 2ONa +H 2↑HBr ,△ ② 取代反应CH 3CH 2OH +HBr ――→△CH 3CH 2Br+H 2OO 2(Cu),△ ①③ 氧化反应 2CH 3CH 2OH +O 2――→Cu △2CH 3CHO +2H 2O浓硫酸,170 ℃ ②⑤ 消去反应 CH 3CH 2OH ――→浓H 2SO 4170 ℃CH 2===CH 2↑+H2O浓硫酸,140 ℃①②取代反应2CH3CH2OH――→浓H2SO4140 ℃__CH3CH2OCH2CH3+H2OCH3COOH (浓硫酸) ①取代(酯化)反应CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O4.由基团之间的相互影响理解酚的化学性质由于苯环对羟基的影响,酚羟基比醇羟基活泼;由于羟基对苯环的影响,苯酚中苯环上的氢比苯中的氢活泼。
化学教学设计核心素养

化学教学设计核心素养作为一位辛劳耕耘的教育工作者,每一天都需要为自己的课程教学担忧,特别是教案的编写。
那么,优秀的教案是什么样的呢?下面是由作者给大家带来的化学教学设计核心素养5篇,让我们一起来看看!化学教学设计核心素养篇11、理论学习:抓好教育理论特别是最新的教育理论的学习,及时了解课改信息和课改动向,转变教学观念,形成新课标教学思想,建立现代化、科学化的教育思想。
2、做好各时期的计划:为了搞好教学工作,以课程改革的思想为指导,根据学校工作计划的安排以及九年级化学任务和内容,做好学期教学工作的整体计划和安排。
3、备好每堂课认真研究新课标和教材,做好备课工作,对教学情形和各单元知识点做到心中有数,备好学生的学习和对知识的掌控情形,写好每节课的教案为上好课提供保证,做好课后反思,以提高自己的教学理论水平和教学实践能力。
4、做好课堂教学创设教学情境,激发学习爱好,爱因斯曾经说过:“爱好是最好的老师。
”激发学生的学习爱好,是化学教学进程中提高质量的重要手段之一。
结合教学内容,选一些与实际联系紧密的化学问题让学生去解决,教学组织公道,教学内容语言生动。
想尽各种办法让学生爱听、乐听,以全面提高课堂教学质量。
5、批改作业精批细改每一位学生的每份作业,学生的作业缺点,做到心中有数。
对每位学生的作业订正和掌控情形都尽力做到及时反馈,再次批改,让学生获得了一个较好的巩固机会。
6、做好课外辅导全面关心学生,这是老师的神圣职责,在课后能对学生进行针对性的辅导,解答学生在知道教材与具体解题中的困难.充分调动学生学习化学的积极性,扩大他们的知识视野,发展智力水平,提高分析问题与解决问题的能力。
总之,我一定深入学习新的教育思想,本着以教育为中心,以课堂为基地,扎实的练好个人基本功。
在班上抓好常规教学,多方位掌控孩子们的进步与变化,有针对性的改进教学方法。
特别是在化学教学方面,应当更多的体现化学课的特点,用实验代替老师的指令,让孩子们在一种轻松愉快的氛围中学习,从而产生对学习的爱好。
2020年高考优设计化学一轮复习第9单元第1节甲烷乙烯、苯

烃
无色气体,难溶于水
无色液体
第九单元
第1节 甲烷、乙烯、苯
核心考点
对点演练
-4-
考点一
考点二
考点三
基础梳理 考点突破
物质名称
甲烷
乙烯
苯
燃烧 易燃,完全燃烧生成 CO2 和 H2O
化学 溴
不反应
性质
酸性高锰 酸钾溶液
不反应
发生加成反应
在 FeBr3 作用下发生 取代反应
发生氧化反应 不反应
主要反 应类型
b.与 H2 反应:CH2 CH2+H2 c.与 HCl 反应:CH2 CH2+HCl
d.与 H2O 反应:CH2 CH2+H2O
CH3CH3。 CH3CH2Cl。
CH3CH2OH。
第九单元
第1节 甲烷、乙烯、苯
核心考点
对点演练
-7-
考点一
考点二
考点三
基础梳理 考点突破
③苯的加成反应: 苯与 H2 发生加成反应的化学方程式为
第九单元
第1节 甲烷、乙烯、苯
核心考点
对点演练
考点一
考点二
考点三
基础梳理 考点突破
几种常见烃的结构与性质 1.甲烷、乙烯和苯的比较
物质名称
甲烷
乙烯
苯
结构简式 结构特点 物理性质
CH4
CH2 CH2
环上碳碳键等同,介于 只含单键 含碳碳双键的 “C C”键与“C—C” 键 的饱和烃 不饱和链烃 之间特殊化学键的芳香
(2)烷烃分子中的碳原子并不都在一条直线上,而是呈锯齿状。 (3)溴水、酸性KMnO4溶液均可鉴别乙烷和乙烯,但要除去乙烷 中的乙烯时,只能选用溴水,因为酸性高锰酸钾溶液能将乙烯氧化 成CO2。 (4)苯不能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色、苯的 邻二氯代物只有一种,均可说明苯分子中不存在单双键交替结构。
【最新推荐】高考化学一轮复习熔沸点大小比较规律-推荐word版 (1页)

【最新推荐】高考化学一轮复习熔沸点大小比较规律-推荐word版
本文部分内容来自网络整理,本司不为其真实性负责,如有异议或侵权请及时联系,本司将立即删除!
== 本文为word格式,下载后可方便编辑和修改! ==
高考化学一轮复习熔沸点大小比较规律
熔沸点是化学物质重要的物理性质,以下是熔沸点大小比较规律,请大家参考。
一、从晶体类型看
1)一般原子晶体最大,离子晶体、金属晶体次之,分子晶体最小。
2)原子晶体中:原子半径小、键短、键能大熔沸点高,如C-C、C-SI SI-SI
3)离子晶体中:原子半径小、离子电荷高、键能大熔沸点高,如NaFNaBrNaI
如MgCI2NaCI 如X+CI2=XCI2+Q1 Y+CI2=YCI2+Q2 Q2键能XCI2YCI2 4)金属晶体中:原子半径小、金属性弱、价电子多熔沸点高,如锂钾铯如铝钠 5)分子晶
体中:结构组成相似的,分子量大熔沸点高,如C1-4气C5-16液C16以上固
如F2
如:烃卤代烃(氯代烃溴代烃碘代烃)羧酸(含有氢键)
6)存在氢键的一般熔沸点高,如HFHBrHCI如H2OH2SeH2S 注意:分子间形成氢键,熔沸点反而低。
如邻羟基苯甲酸。
二、从状态上看:常温下固态液态气态如I2 HCI
三、从结构上看:直链的、排列紧密的熔沸点高,如:正丁烷异丁烷。
熔沸点大小比较规律的内容就是这些,化学网预祝大家新学期取得更好的成绩。
201X年高考第一轮复习备考专题已经新鲜出炉了,专题包含高考各科第一轮复
习要点、复习方法、复习计划、复习试题,大家来一起看看吧~。
第一篇主题四微题型5分子性质熔、沸点的比较-2025届高考化学二轮复习课件

(2)同为分子晶体
答题策略
一般先氢键,后范德华力,最后分子的极性
同为分子晶体,×××存在氢键,而×××仅存在较弱的范德 华力 同为分子晶体,×××的相对分子质量大,范德华力强,熔、 沸点高 答题模板 同为分子晶体,两者的相对分子质量相同(或相近),××× 的极性大,熔、沸点高 同为分子晶体,×××形成分子间氢键,而×××形成的则是 分子内氢键,形成分子间氢键会使熔、沸点增大
12345678
8.[2023·全国乙卷,35(2)]已知一些物质的熔点数据如下表:
Na与Si均为第三周期元素,NaCl熔 点明显高于SiCl4,原因是_氯__化__钠___ _为__离__子__晶__体__,__而__S_i_C_l_4为__分__子__晶__体___ 。
分析同族元素的氯化物SiCl4、GeCl4、 SnCl4熔点变化趋势及其原因_熔__点__ _依__次__升__高__,__因__为__S_i_C_l_4_、__G_e_C_l_4_、___
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 C.酰胺在酸或碱存在并加热的条件下可发生水解反应 D.冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超
分子
12345678
有手性异构体的分子被称为手性分子,A错误; 邻羟基苯甲醛中含有分子内氢键,分子内氢键可以降低物质的熔、沸 点,因此邻羟基苯甲醛的熔、沸点低于对羟基苯甲醛的熔、沸点,B正确; 超分子是由两种或两种以上的分子通过分子间作用力形成的分子聚集 体,冠醚(18-冠-6)的空穴大小为260~320 pm,可以适配K+(276 pm), 冠醚与K+之间通过弱相互作用结合,D正确。
(2)氢键对溶解性的影响
规律
与水形成分子间氢键有利于溶质在水中溶解;溶质分子内形成氢 键时不利于溶质在水中溶解
高考总复习 化学 (人教版)核心素养提升17 不同结构物质的沸点比较

17不同结构物质的沸点比较[宏观辨识与微核心素养提升○观探析]素养说明:由于晶体类型在必修中不再要求,所以沸点比较失去了理论依据,但在一些高考题目中,对于沸点高低有所涉及,对不同结构物质的沸点比较进行总结,符合学科素养和高考要求。
物质沸点高低是由构成物质质点间作用力大小决定的。
物质质点间作用力包括分子间作用力和各种化学键。
以下是常见的几种比较物质沸点高低的方法。
1.根据物质状态判断即物质沸点高低按常温下的状态:固体>液体>气体。
如:NaCl>H2O>CO2。
2.根据物质不同结构特点判断(1)原子晶体:原子晶体间键长越短、键能越大,共价键越稳定,物质熔、沸点越高,反之越低。
如:金刚石(C—C)>晶体硅(Si—Si)。
(2)离子晶体:离子晶体中阴、阳离子半径越小,电荷数越多,则离子键越强,熔、沸点越高,反之越低。
如KCl>KBr。
(3)分子晶体:分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低。
①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔、沸点越高。
如:CH4<SiH4<GeH4<SnH4。
②因为氢键>范德华力,所以存在分子间氢键的物质沸点高于只存在范德华力的物质。
如:乙醇>氯乙烷;HF>HCl。
[题型专练]1.比较下列化合物熔沸点的高低(填“>”或“<”)。
(1)CO2SO2(2)NH3PH3(3)O3O2(4)Ne Ar答案(1)<(2)>(3)>(4)<2.通过比较归纳可以加深对化学物质的认识。
下列比较或归纳一定正确的是()A.稳定性:NH3>PH3>H2SB.酸性:HClO4>H2SO4>H3PO4C.离子半径:阴离子>阳离子D.熔沸点:离子化合物>共价化合物答案 B3.(2015·课标全国Ⅰ,12)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18,下列说法正确的是()A.单质的沸点:W>XB.阴离子的还原性:W>ZC.氧化物的水化物的酸性:Y<ZD.X与Y不能存在于同一离子化合物中解析W的L层无电子,则W为氢元素。
高考化学一轮第5章物质结构与性质元素周期律大题增分三晶体熔沸点高低原因解释新人教版

是 H2O2分子之间存在更强的氢键作用
。
4.已知3种共价晶体的熔点数据如表:
晶体
金刚石
碳化硅
晶体硅
熔点/℃
>3 550
2 600
1 415
金刚石熔点比晶体硅熔点高的原因是
_共_价__晶__体__中__,_原__子__半__径__越__小__,共__价__键__键__能__越__大__,_熔__点__越__高__,原__子__半__径__:_C_<_S__i(_或__
大题增分(三) 晶体熔、沸点高低原因解释
1.不同类型晶体熔、沸点比较 答题模板 ×××为×××晶体,而×××为×××晶体。
[例1] (1)金刚石的熔点比NaCl高,原因是
金刚石是共价晶体,而NaCl是离子晶体
。
(2)SiO2的熔点比CO2高,原因是 SiO2是共价晶体,而CO2是分子晶体 。
2.同类型晶体熔、沸点比较 (1)分子晶体 答题模板 ①同为分子晶体,×××存在氢键,而×××仅存在较弱的范德华力。 ②同为分子晶体,×××的相对分子质量大,范德华力强,熔、沸点高。 ③同为分子晶体,二者的相对分子质量相同(或相近),×××的极性大,熔、 沸点高。 ④同为分子晶体,×××形成分子间氢键,而×××形成的则是分子内氢键, 分子间氢键会使熔、沸点升高。
_德_华__力__,_范__德__华__力__比__离__子__键__弱__,所__以__C__O_2_晶__体__熔__点__低__;两__种__离__子__晶__体__中__P__b_O_的__
Pb2+半径小,所带电荷数多,所以熔点高
。
(2)NaF 的熔点 > (填“>”“=”或“<”)
BF4- 的熔点,其原因是
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
○17
核心素养提升 不同结构物质的沸点比较[宏观辨识与微
观探析]
素养说明:由于晶体类型在必修中不再要求,所以沸点比较失去了理论依据,但
在一些高考题目中,对于沸点高低有所涉及,对不同结构物质的沸点比较进行总结,符合学科素养和高考要求。
物质沸点高低是由构成物质质点间作用力大小决定的。
物质质点间作用力包括
分子间作用力和各种化学键。
以下是常见的几种比较物质沸点高低的方法。
1.根据物质状态判断
即物质沸点高低按常温下的状态:固体>液体>气体。
如:NaCl>H2O>CO2。
2.根据物质不同结构特点判断
(1)原子晶体:原子晶体间键长越短、键能越大,共价键越稳定,物质熔、沸点越高,反之越低。
如:金刚石(C—C)>晶体硅(Si—Si)。
(2)离子晶体:离子晶体中阴、阳离子半径越小,电荷数越多,则离子键越强,熔、沸点越高,反之越低。
如KCl>KBr。
(3)分子晶体:分子晶体分子间作用力越大,物质的熔、沸点越高,反之越低。
①组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质
的熔、沸点越高。
如:CH4<SiH4<GeH4<SnH4。
②因为氢键>范德华力,所以存在分子间氢键的物质沸点高于只存在范德华力
的物质。
如:乙醇>氯乙烷;HF>HCl。
[题型专练]
1.比较下列化合物熔沸点的高低(填“>”或“<”)。
(1)CO2 SO2
(2)NH3 PH3
(3)O3 O2
(4)Ne Ar
答案 (1)< (2)> (3)> (4)<
2.通过比较归纳可以加深对化学物质的认识。
下列比较或归纳一定正确的是( )
A.稳定性:NH3>PH3>H2S
B.酸性:HClO4>H2SO4>H3PO4
C.离子半径:阴离子>阳离子
D.熔沸点:离子化合物>共价化合物
答案 B
3.(2015·课标全国Ⅰ,12)W、X、Y、Z均为短周期主族元素,原子序数依
次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子
数之和为18,下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y<Z
D.X与Y不能存在于同一离子化合物中
解析 W的L层无电子,则W为氢元素。
X的L层为5个电子,则X为氮元素。
Y、Z的L层均为8个电子,均在第三周期,最外层电子数之和为12。
Y、Z的最
外层电子数可能分别为5、7或6、6(若为4、8,则Z为Ar,不是主族元素),若
为6、6,则Y为氧元素(不在第三周期),不可能,所以Y为磷元素,Z为氯元素。
A项,N2的相对分子质量大于H2,分子间的作用力强,所以N2的沸点高于H2,
错误;B项,因为氢的非金属性弱于氯(可根据HCl中氢显+1价判断),所以H-
还原性强于Cl-,正确;C项,由于没有说明是最高价氧化物的水化物,所以氯元
素的氧化物的水化物的酸性不一定大于磷元素的氧化物的水化物,如H3PO4的
酸性强于HClO,错误;D项,如离子化合物(NH4)3PO4中同时存在氮和磷两种元
素,错误。
答案 B
4.根据沸点说明如何分离空气。
___________________________________________________________________ ___________________________________________________________________。
答案 通常是利用氮气的沸点(-195.8 ℃)比氧气的沸点(-183 ℃)低而控制温度对液态空气加以分离
5.根据沸点解释浓硫酸制取氯化氢;钠制取钾。
____________________________________________________________________ ___________________________________________________________________。
答案 浓硫酸制备氯化氢,是利用浓硫酸的高沸点,以高沸点的酸制备低沸点酸;钠的沸点(882.9 ℃)高于钾的沸点(774 ℃),故可以通过控制温度使钾呈气态,钠呈液态。
应用平衡移动,使反应发生
6.工业上用Al2O3为原料通过电解法冶炼Al时,为什么要加入冰晶石?
____________________________________________________________________ ___________________________________________________________________。
答案 这是因为Al2O3的熔点高(2 050 ℃),而加入冰晶石后可以使Al2O3在1000 ℃左右熔解在冰晶石中
“”
“”
At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!。
