四大谱图详解演示文稿
波谱四种谱图的综合解析26页PPT

▪
26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。——卢梭
▪
27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰
▪
28、知之者不如好之者,好之者不如乐之者。——孔子
▪
29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇
▪
30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本析
11、用道德的示范来造就一个人,显然比用法律来约束他更有价值。—— 希腊
12、法律是无私的,对谁都一视同仁。在每件事上,她都不徇私情。—— 托马斯
13、公正的法律限制不了好的自由,因为好人不会去做法律不允许的事 情。——弗劳德
14、法律是为了保护无辜而制定的。——爱略特 15、像房子一样,法律和法律都是相互依存的。——伯克
有机四大谱课件

8
二、紫外吸收光谱(UV)
基本原理
物质分子吸收一定波长的紫外光时,分子中的价电子
从低能级跃迁到高能级而产生的吸收光谱叫紫外光谱。
*
* E n
电子跃迁的类型有: *, *, n *, n *。
9
电荷迁移跃迁 用光照射化合物时,电子从给予体向与接受 体相联系的轨道上的跃迁称为电荷迁移跃迁。 这种跃迁谱带较宽,吸收强度大。
核磁样品制备
试样浓度:5~10%;需要纯样品15~30 mg;傅立 叶变换核磁共振波谱仪需要纯样品1 mg ; 标样浓度(四甲基硅烷 TMS) : 1%; 溶剂:1H谱 四氯化碳,二硫化碳; 氘代溶剂:氯仿,丙酮、苯、二甲基亚砜的氘代物
黄石理工学院医学院药学系
4-2 影响化学位移的因素
(1)取代基电负性影响:
磁能级的跃迁,从而产生吸收信号。这种原子核
对射频电磁波辐射的吸收称为核磁共振(nuclear magnetic resonance, NMR)。
黄石理工学院医学院药学系
核磁共振条件
(1) 核有自旋(磁性核) (2)外磁场,能级裂分; (3)照射频率与外磁场的比值0 / H0 = / (2 )
常用于高分子有机化合物的测定。 熔 融 法:对于熔点较低,而且热稳定性好的样品,可以 采用此法。 溶液成膜法:将试样溶解于沸点较低的溶剂中,然后将溶液 分布在成膜介质(水银、玻璃、塑料、金属板) 上,让溶剂蒸发后形成试样膜。
4、图谱解析
100 90 80
2924 3005 3062 1595
Transmittance %
液膜厚度的选择: 脂肪族碳氢化合物 ~0.02mm 卤化物、芳香族化合物 ~0.01mm 含氧、氮的有机物 ~0.005mm 含硅、氟的有机物 ~0.03mm ② 溶液法
波谱四种谱图的综合解析

A: CH3 - CH (COOH) - O-Ph-Cl
最后对其推导的结构再进一步确认
• 推导成功!你将得到鲜花和掌声!
从估计分子式:C9H9ClO3中减去—Cl、—C6H4-、 >CH-CH3、—COOH基团,只剩下—O—基团, 因此,可拼出以下结构:
H3CHC
O
Cl
H3CHC Cl
OCOOHຫໍສະໝຸດ COOHAB
检查 MS 谱, m/e=155 、 128 、 111 均含有 C1 原子, 说明 C1 原子与苯环直接相连,因此 C1 原子上的 孤对电子与苯环发生 p-π 共轭,所以不易被丢失, 上述三个离子的裂解可有下图得到合理的解释, 所以未知物的结构应是A:
• 由 IR 谱在 32002500 cm-1 的宽 峰 和 接 近 1700 cm-1 的 强 峰 可 推测分子中可 能含有 -COOH , 在 1200-1250 附 近的强峰可推 测分子中可能 含 有 醚 键 (C-O-C);
• 从 1H-NMR 谱的高场到低场各峰的积分曲线高度比 为3:1:2:2:1,估计分子中可能是9个H,再估计 C 数 为 ( 200-9-16×3-35 ) /12=9 , 估 计 分 子 式 : C9H9ClO3 • 不饱和度=1+n4+1/2×(n3-n1) =1+9+1/2×(0-9-1)=5;
四种谱图的综合解析
• 其它辅助参考: • 物理常数的测定:熔点、沸点、比重、 折射率… … • 元素分析:C、H、N、S、O、P、F、Cl、 Br、I … … • 物理状态的观察:液、固、气味、灼烧--特证火焰颜色… …
四种谱图的综合解析
例1:由如下四种谱图解析C5H10O的结构
四大谱图解析

常用术语
吸收带:由相同的电子跃迁产生的吸收峰,叫.. R带:由化合物n→π* 跃迁产生的吸收带,它具有杂 原子和双键的共轭基团(醛、酮)。例:>C=O, —N=N—。 特点:a. 吸收峰出现区域在250nm~500nm。 b.摩尔吸光系数小,吸收强度在10 ~100,属 于禁阻跃迁。
影响紫外吸收的因素-溶剂效应
(2) * 跃迁,溶剂极性增加,吸收红移。
因为在多数π→π*跃迁中,激发态的极性要强于基态,极性大的 π*轨道与溶剂作用强,能量下降较大,而π轨道极性小,与极 性溶剂作用较弱,故能量降低较小,致使π及π*间能量差值变 小。因此,π→π*跃迁在极性溶剂中的跃迁能△Ep小于在非极 性溶剂中的跃迁能△En。所以在极性溶剂中,π→π*跃迁产生 的吸收峰向长波长方向移动。
影响紫外吸收的因素-溶剂效应
1. 在极性溶剂和非极性溶剂中测试,非极性化合物λ max无 明显差异。 2.在极性溶剂和非极性溶剂中测试,极性化合物λmax一般有变 化. 溶剂效应:在不同的溶剂中谱带产生的位移称为溶剂效应。 是由于不同极性的溶剂对基态和激发态样品分子的生色团 作用不同或稳定化程度不同所致。 极性溶剂使R带(250~500nm)蓝移,使K带(210~250)红移。
紫外吸收与分子结构关系 • (2)、简单的不饱和化合物:
• 简单烯烃、炔烃 • 简单醛酮 • n—π*跃迁在紫外区,为弱吸收
紫外吸收与分子结构关系
简单烯烃、炔烃 孤立的 * 跃迁在近紫外区无吸收。 例:CH2=CH2 max= 165nm HC≡CH max= 173nm
位于真空紫外区,助色基团的存在可以使波长红移 当烯烃双键上引入助色基团时,π→π* 吸收将发生红移, 甚至移到近紫外光区。原因是助色基团中的n电子可以产 生p-π共轭,使π→π* 跃迁能量降低,烷基可产生超共轭效 应,也可使吸收红移,不过这种助色作用很弱
四大谱图综合解析1
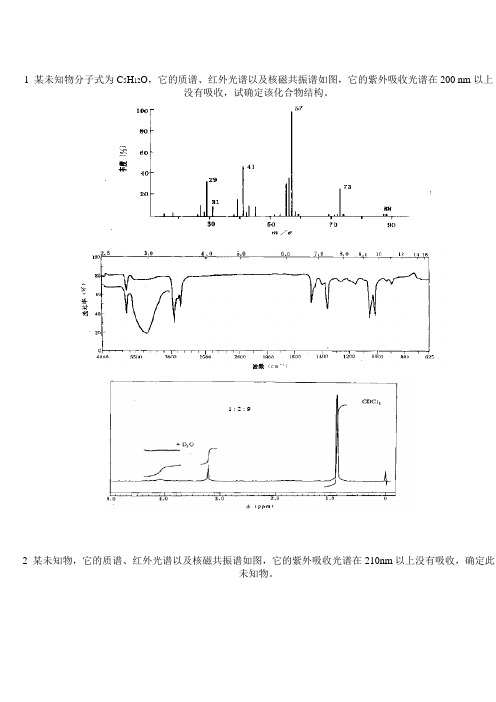
1 某未知物分子式为C5H12O,它的质谱、红外光谱以及核磁共振谱如图,它的紫外吸收光谱在200 nm以上没有吸收,试确定该化合物结构。
1 :2 : 92 某未知物,它的质谱、红外光谱以及核磁共振谱如图,它的紫外吸收光谱在210nm以上没有吸收,确定此未知物。
22633 待鉴定的化合物(I)和(II)它们的分子式均为C8H12O4。
它们的质谱、红外光谱和核磁共振谱见图。
也测定了它们的紫外吸收光谱数据:(I)λmax223nm,δ4100;(II)λmax219nm,δ2300,试确定这两个化合物。
未之物(I)的质谱未之物(II)质谱化合物(I)的红外光谱化合物(II)的红外光谱化合物(I)的核磁共振谱化合物(II)的核磁共振谱4某未知物C11H16的UV、IR、1H NMR、MS谱图及13C NMR数据如下,推导未知物结构。
未知物碳谱数据5 某未知物的IR、1H NMR、MS谱图及13C NMR数据如下,紫外光谱在210 nm以上无吸收峰,推导其结构。
未知物碳谱数据10. 某一未知化合物,它的质谱、红外光谱和核磁共振谱如图所示。
它的紫外吸收光谱数据为:λmax=292nm(环己烷),ε23.2。
确定该化合物结构。
12 某一未知化合物,其分子式为C10H10O。
已测定它的紫外吸收光谱、红外光谱(KBr压片)以及核磁共振谱,见图确定该化合物结构。
511315某未知化合物的质谱、红外光谱、核磁共振氢谱如图,分子式根据元素分析为C6H11O2Br,试推测其结构。
17 某一未知化合物,其分子式为C8H10SO3。
已测定它的紫外吸收光谱(在环己烷中测定)、红外光谱和核磁共振谱如图,试确定该未知化合物。
18 某一未知化合物,其分子式为C13H16O4。
已测定它的红外光谱、核磁共振谱以及紫外吸收光谱.如图,试确该未知化合物的结构。
有机化学的四谱综合解析PPT课件
活泼氢反应
重水交换 分子中如果有活泼氢: —OH、—NH2、—COOH等 本身化学位移较大,易辨认 加入重水(D2O)后,信号减弱或消失 酰胺质子交换速度慢,不易消失 易形成分子内氢键的活泼氢也难消失
18
核磁共振碳谱
19
核磁共振发展初期,大家更多关注13C NMR 大部分有机化合物都具有碳骨架或碳原子 但是这些碳原子以12C为主,它不是磁性核 13C的天然丰度只有12C的1.1% 13C在核磁共振上的灵敏度只有1H的1.6% 13C的整个灵敏度只有1H的1/5700
——The Nobel Prize in Chemistry 1991
40
COSY谱图
堆积图
平面等值线图
41
1-氯-2-丙醇 1H-1H COSY图
42
1-氯-2-丙醇的 1H-13C COSY图
43
波谱综合解析
波谱解析的基本知识 波谱解析的基本步骤 波谱解析的技巧策略 实例 习题
44
波谱解析的基本步骤
1、鉴别谱图中真实谱峰 2、计算不饱和度 3、掌握影响化学位移的因素
34
4、分子对称性分析:
若谱线数目等于元素组成式中碳原子数目, 说明分子无对称性;若谱线数目小于元素组 成中的碳原子数目,说明分子有一定的对称 性,这在推测结构时应予以重视。如果化合 物中碳原子数目较多时,应考虑到不同碳原 子的值可能偶合重合。
20世纪70年代开始,由于傅立叶变换仪器的 使用,可同时激发所有的13C核而使得13C NMR迅速得到广泛应用 其发展地位已经接近1H NMR
20
核磁共振碳谱
选用核磁共振碳谱的优点在于: ①每种有机化合物必定含有碳元素; ②化学位移分布在很宽的范围内; ③能够区别分子中有微小差异的碳原子,还 能观察到不与氢核相连的碳原子; ④能提供碳骨架信息。
(完整版)四大波谱基本概念以及解析

四大谱图基本原理及图谱解析一质谱1. 基本原理:用来测量质谱的仪器称为质谱仪,可以分成三个部分:离子化器、质量分析器与侦测器。
其基本原理是使试样中的成分在离子化器中发生电离,生成不同荷质比的带正电荷离子,经加速电场的作用,形成离子束,进入质量分析器。
在质量分析器中,再利用电场或磁场使不同质荷比的离子在空间上或时间上分离,或是透过过滤的方式,将它们分别聚焦到侦测器而得到质谱图,从而获得质量与浓度(或分压)相关的图谱。
在质谱计的离子源中有机化合物的分子被离子化。
丢失一个电子形成带一个正电荷的奇电子离子(M+J叫分子离子。
它还会发生一些化学键的断裂生成各种r =£碎片离子。
带正电荷离子的运动轨迹:经整理可写成:m _ rjH2电"2比2式中:口/e为质荷比是离子质量与所带电荷数之比;近年来常用m/z 表示质荷比;z表示带一个至多个电荷。
由于大多数离子只带一个电荷,故m/z就可以看作离子的质量数。
质谱的基本公式表明:(1)当磁场强度(H)和加速电压(V)一定时,离子的质荷比与其在磁场中运动半径的平方成正比(m/z x r2m),质荷比(m/z)越大的离子在磁场中运动的轨道半径(rm)也越大。
这就是磁场的重要作用,即对不同质荷比离子的色散作用。
(2)当加速电压(V) 一定以及离子运动的轨道半径(即收集器的位置)一定时,离子的质荷比(m/z)与磁场强度的平方成正比(m/z x H2)改变H即所谓的磁场扫描,磁场由小到大改变,则由小质荷比到大质荷比的离子依次通过收集狭缝,分别被收集、检出和记录下来。
(3)若磁场强度(H)和离子的轨道半径(rm)一定时,离子的质荷比(m/z)与加速电压(V)成反比(m/z x 1/V),表明加速电压越高,仪器所能测量的质量范围越小。
就测量的质量范围而言,希望质量范围大一些,这就必须降低加速电压。
从提高灵敏度和分辨率来讲,需要提高加速电压。
这是一对矛盾,解决的办法是在质量范围够用的情况下尽量提高加速电压,高分辨质谱计加速电压为8kV,中分辨为4〜3kV。
四大图谱综合解析

O
即未知物的结构式。恰好在核磁共振谱的δ1.55 ~ 2 .20处有一宽 而强的峰(4 H) ,相当于多个亚甲基,其化学位移与相应质 子在结构式中的位置也是匹配的,从而印证了所提出的未知 物的结构。
CH3
CH3
N
CH2
1
2013/12/2
3.某未知物 C11H16 的 UV、IR、1H NMR、MS谱图及13C NMR数据如下,推
导未知物结构。
未知物碳谱数据
序号 δc
碳原子
(ppm) 个数
1 143.0
1
2 128.5
2
3 128.0
2
4 125.5
1
序号 δc
碳原子
(ppm) 个数
6
32.0
未知物的红外光谱是在CCl4溶液中测定的,样品的CCl4稀溶液 的红外光谱在3640cm-1处有1尖峰,这是游离O H基的特征吸收
峰。样品的CCl4浓溶液在3360cm-1处有1宽峰,但当溶液稀释
后复又消失,说明存在着分子间氢键。未知物核磁共振谱中δ4.
1处的宽峰,经重水交换后消失。上述事实确定,未知物分子
O
• (1)未知物中含有
C N 基团,其理由如下:
• ① 碳谱 171.45 ppm 的峰反映羰基应与杂原子相连,而未知物中,除氧之外,
杂原子仅余氮;
• ② 红外光谱中,1649.1 cm-1的强吸收只能是此基团,羰基若不连氮,其吸 收位置在 1680 cm-1之上;目前数值与叔酰胺相符。
• (2)未知物中含正构长链烷基:
《谱图综合解析》PPT课件

第六章 谱图综合解析
精选ppt
1
§6.1 综合解析四种谱图的步骤
一、各种图谱解析的主要着眼点 1. 质谱(MS) (1)从M.+--分子量 (2)从(M+2)/M、(M+1)/M查贝农表,估计C数 (3)从M、M+2、M+4--Cl、Br、S (4)氮律 (5)主要碎片离子峰--官能团
4
125.5
1
9
10.0
1
5
36.0
1
精选ppt
6
精选ppt
7
精选ppt
8
解:
1. 从分子式为 C11H16 ,计算 Ω=4; 2. 结构式推导 UV : 240~275 nm 吸收带具有精细结构,表明化合物为芳烃; IR : 695、740 cm-1 表明分子中含有单取代苯环; MS : m/z 148为分子离子峰,其合理丢失一个碎片,得到m/z 91 的苄基离子; 13C-NMR :在(40~10)ppm 的高场区有5个 sp3 杂化碳原子; 1H-NMR: 积分高度比表明分子中有 1 个 CH3 和 4 个 -CH2-,其中 (1.4~1.2)ppm 为 2 个 CH2 的重叠峰; 因此,此化合物应含有一个苯环和一个 C5H11 的烷基。 1H-NMR 谱中各峰裂分情况分析,取代基为正戊基,即化合物的结构为:
2. 初步查看、分析四种谱图,从而判断化合物是脂肪族还是芳香族、是 否含不饱和键等等一些明显的结论。
3. 仔细辨认四种谱图,通常利用一种谱图的明显特征来印证另一谱图的 更精细的内容,从而了解样品分子中的官能团及其取代关系。
4. 利用已确定的结构单元,组成该化合物的几种可能结构。
四大图谱综合解析

2013/12/2四大图谱综合解析1 某未知物分子式为C5 H12 O,它的质谱、红外光谱以及核磁共振谱如图,它的紫外吸收光谱在200 nm以上没有吸收,试确定该化合物结构。
CCl4稀溶液的红外光谱, CCl4浓溶液 在3360cm-1处有1宽峰[解] 从分子式C5H12O,求得不饱和度为零,故未知物应为 饱和脂肪族化合物。
未知物的红外光谱是在CCl4溶液中测定的,样品的CCl4稀溶液 的红外光谱在3640cm-1处有 1尖峰,这是游离 O H基的特征吸收 峰。
样品的CCl4浓溶液在 3360cm-1处有 1宽峰,但当溶液稀释 后复又消失,说明存在着分子间氢键。
未知物核磁共振谱中δ4. 1处的宽峰,经重水交换后消失。
上述事实确定,未知物分子 中存在着羟基。
未知物核磁共振谱中δ0.9处的单峰,积分值相当3个质子,可 看成是连在同一碳原子上的3个甲基。
δ3.2处的单峰,积分值 相当2个质子,对应1个亚甲基,看来该次甲基在分子中位于特 丁基和羟基之间。
质谱中从分子离子峰失去质量31(- CH2 OH)部分而形成基 峰m/e57的事实为上述看法提供了证据,因此,未知物的结构 CH3 是H3CCCH3CH2OH根据这一结构式,未知物质谱中的主要碎片离子得到了如下 解释。
CH 32. 某未知物,它的质谱、红外光谱以及核磁共振谱如图,它的 紫外吸收光谱在210nm以上没有吸收,确定此未知物。
CH2+ OH m/e31 -2H+ . CH2OHH3CCH3H3CCCH 3C+CH3m/e88 -CH3 m/e29 m/e73m/e57 -CH3 -H CH 3 C + CH 2m/e41[解] 在未知物的质谱图中最高质荷比131处有1个丰度很小的峰,应 为分子离子峰,即未知物的分子量为131。
由于分子量为奇数,所以未 知物分子含奇数个氮原子。
根据未知物的光谱数据中无伯或仲胺、腈、 酞胺、硝基化合物或杂芳环化合物的特征,可假定氮原子以叔胺形式存 在。
波谱四种谱图的综合解析PPT共26页

39、没有不老的誓言,没有不变的承 诺,踏 上旅途 ,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
波谱四种谱图的综合解析
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
四大波谱基本概念以及解析

四大谱图基本原理及图谱解析一.质谱1.基本原理:用来测量质谱的仪器称为质谱仪,可以分成三个部分:离子化器、质量分析器与侦测器。
其基本原理是使试样中的成分在离子化器中发生电离,生成不同荷质比的带正电荷离子,经加速电场的作用,形成离子束,进入质量分析器。
在质量分析器中,再利用电场或磁场使不同质荷比的离子在空间上或时间上分离,或是透过过滤的方式,将它们分别聚焦到侦测器而得到质谱图,从而获得质量与浓度(或分压)相关的图谱。
在质谱计的离子源中有机化合物的分子被离子化。
丢失一个电子形成带一个正电荷的奇电子离子(M+·)叫分子离子。
它还会发生一些化学键的断裂生成各种碎片离子。
带正电荷离子的运动轨迹:经整理可写成:式中:m/e为质荷比是离子质量与所带电荷数之比;近年来常用m/z表示质荷比;z表示带一个至多个电荷。
由于大多数离子只带一个电荷,故m/z就可以看作离子的质量数。
质谱的基本公式表明:(1)当磁场强度(H)和加速电压(V)一定时,离子的质荷比与其在磁场中运动半径的平方成正比(m/z ∝r2m),质荷比(m/z)越大的离子在磁场中运动的轨道半径(rm)也越大。
这就是磁场的重要作用,即对不同质荷比离子的色散作用。
(2)当加速电压(V)一定以及离子运动的轨道半径(即收集器的位置)一定时,离子的质荷比(m/z)与磁场强度的平方成正比(m/z∝H2)改变H即所谓的磁场扫描,磁场由小到大改变,则由小质荷比到大质荷比的离子依次通过收集狭缝,分别被收集、检出和记录下来。
(3)若磁场强度(H)和离子的轨道半径(rm)一定时,离子的质荷比(m/z)与加速电压(V)成反比(m/z∝1/V),表明加速电压越高,仪器所能测量的质量范围越小。
就测量的质量范围而言,希望质量范围大一些,这就必须降低加速电压。
从提高灵敏度和分辨率来讲,需要提高加速电压。
这是一对矛盾,解决的办法是在质量范围够用的情况下尽量提高加速电压,高分辨质谱计加速电压为8kV,中分辨为4~3kV。
四大谱图综合解析

1 某未知物分子式为C5H12O,它的质谱、红外光谱以及核磁共振谱如图,它的紫外吸收光谱在200 nm以上没有吸收,试确定该化合物结构。
1 :2 : 9[解] 从分子式C5H12O,求得不饱和度为零,故未知物应为饱和脂肪族化合物。
未知物的红外光谱是在CCl4溶液中测定的,样品的CCl4稀溶液的红外光谱在3640cm-1处有1尖峰,这是游离O H基的特征吸收峰。
样品的CCl4浓溶液在3360cm-1处有1宽峰,但当溶液稀释后复又消失,说明存在着分子间氢键。
未知物核磁共振谱中δ4. 1处的宽峰,经重水交换后消失。
上述事实确定,未知物分子中存在着羟基。
未知物核磁共振谱中δ0.9处的单峰,积分值相当3个质子,可看成是连在同一碳原子上的3个甲基。
δ3.2处的单峰,积分值相当2个质子,对应1个亚甲基,看来该次甲基在分子中位于特丁基和羟基之间。
质谱中从分子离子峰失去质量31(-CH 2OH )部分而形成基峰m/e57的事实为上述看法提供了证据,因此,未知物的结构是CCH 3H 3CCH 3CH 2OH根据这一结构式,未知物质谱中的主要碎片离子得到了如下解释。
CCH 3H 3CCH 3CH 2OH+.C +CH 3CH 3H 3CCH 2OH +m/e31m/e88m/e57-2H -CH 3-CH 3-HCH 3C CH 2+m/e29m/e73m/e412 某未知物,它的质谱、红外光谱以及核磁共振谱如图,它的紫外吸收光谱在210nm 以上没有吸收,确定此未知物。
2263[解] 在未知物的质谱图中最高质荷比131处有1个丰度很小的峰,应为分子离子峰,即未知物的分子量为131。
由于分子量为奇数,所以未知物分子含奇数个氮原子。
根据未知物的光谱数据亚无伯或仲胺、腈、酞胺、硝基化合物或杂芳环化合物的特征,可假定氮原子以叔胺形式存在。
红外光谱中在1748 cm -1处有一强羰基吸收带,在1235 cm -1附近有1典型的宽强C -O -C 伸缩振动吸收带,可见未知物分子中含有酯基。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电子能级间的能量差一 般为1~20电子伏特 (eV)
振动能级间的能量差约 为0.05~1 eV
转动能级间的能量差小
A
于0.05 eV
紫外吸收光谱的产生
紫外光谱产生:分子在入射光的作用下发生了电子 能级间的跃迁,吸收了特定波长的光波形成
• 杂原子(末成键电子) 被激发向反键轨道的跃 迁 ( n *, n*跃 迁)
O π 电子
C
σn电子
电子跃迁的类型
• 1.N-V跃迁 1) 定义:分子中的电子由成键轨道向反键轨道的
跃迁。 2) 分类
(1)σ→σ* 跃迁:电子由σ成键轨道向σ*轨道的跃
迁。存在于饱和碳氢化合物中。
(2)π→π* 跃迁:由π成键轨道向π* 轨道的跃迁。
存在于含有不饱和键的化合物中
电子跃迁的类型
• 2.N-Q跃迁 1)定义:分子中的电子由非键轨道向反键轨道的
跃迁。 2)分类:
a. n→σ* 跃迁:由n非键向σ* 的跃迁。存在于含
杂原子的饱和碳氢化合物中。
b. n→π* 跃迁:由n非键向π* 的跃迁。存在于含
杂原子的不饱和碳氢化合物中。
* 和 n* 跃迁,吸收波长:< 200nm (远紫外区); * 和 n* 跃迁,吸收波长: 200-400nm (近紫外区);
△ E = h ( h为普朗克常数)
表现形式:在微观上出现分子由较低的能级跃迁到 较高的能级; 在宏观上则透射光的强度变小。
若用一连续辐射的电磁波照射分子,将照射前 后光强度的变化转变为电信号,并记录下来,然后 以波长为横坐标,以吸收程度(吸光度 A)为纵坐 标,就可以得到一张光强度变化对波长的关系曲线 图——分子吸收光谱图。
二氧杂环己烷
/nm 177 178 204 214 186 339,665 280 300,665 270
max
13000 10000 41 60 1000 150000 22 100 12
跃迁类型
* * n* n*
n*,n*
n*, n* n* n*
常用术语
红移与蓝移 吸收峰向长波方向移动的现象叫红 移。 吸收峰向短波方向移动的现象叫蓝 移,也叫紫移。
电子跃迁的类型
有机化合物中的电子 σ电子:形成单键的电子。 π电子:形成双键和叁键的电子。 n电子(孤电子对):没有形成化学键的电子,存在
于氧、氮、硫、氯、溴、碘原子上(统称杂原子)。
这些电子统称──价电子
电子跃迁的类型
• 电子从基态(成键轨道) 向激发态(反键轨道)的 σn 电子 跃迁(*, →*跃 迁)
分类: E1 带:180nm,ε=60000; E2 带:203nm,ε=8000
特点: a. 苯环上有助色团取代时,E 带长移,但吸收带波长一般不
超过210nm。 b. 苯环上有发色团取代并和苯环共轭时,E2 带长移与 发色
团的K带合并,统称K带,同时也使B带长移。
影响紫外吸收的因素
返回
• 共轭效应:红移 • 助色团的影响 • 超共轭效应 :烷基与共轭体系相连时,可以使波长产生少
四大谱图详解演示文稿
波谱产生原理
电磁波谱
区域 γ射线 X射线 远紫外 紫外 可见 红外 远红外 微波 无线电波
波长 10-3~0.1nm 0.1~10nm 10~200nm 200~400nm 400~800nm 0.8~50μm 50~1000μm 0.1~100cm
1~100m
原子或分子的跃迁 核跃迁
电子跃迁的类型
常用术语
生色团:分子中产生紫外吸收的主要官能团。都是不饱和基团, 含有π电子,可以发生π n→π * 、 n →π * 跃迁。(p76)
助色团:含有孤对电子,本身不产生紫外吸收的基团,但与生色 团相连时,可使生色团吸收峰向长波方向移动并提高吸收强度 的一些官能团,称之为助色团。常见助色团助色顺序为:
内层电子跃迁 中层电子跃迁 外层(价)电子跃迁
分子转动和振动
核磁共振(核自旋跃迁)
四种仪器的概述及相应的谱图 解析
紫外光谱分析
• 概述 • 影响紫外吸收的因素 • 紫外吸收与分子结构关系 • 应用
紫外吸收光谱的产生
分子的三种运动状态: •(1)电子相对于原子核的运动
•(2)核间相对位移引起的振动
产生的吸收带。例:芳香族包括杂环芳香族。
特点:a. 苯蒸汽及苯的非极性溶剂在 230~270nm 之间呈细微结构。(由电子 能级跃起引起的吸收叠加振动能级跃迁 引起的,是芳香化合物的重要特征。)
b. 苯在极性溶剂中呈一宽峰,重心 256nm,
ε=220。
ቤተ መጻሕፍቲ ባይዱ
常用术语
4. E带 产生:苯环中共轭体系的π→π* 跃进产生的吸收带。
量红移
• 空间效应:空间位阻,构型 外部因素:溶剂效应 ,温度,pH值影响
影响紫外吸收的因素-共轭效应
π*
E
E
π
共轭系统的能级示意图 及共轭多烯的紫外吸收
影响紫外吸收的因素-助色基的影响
使最大吸收向长波红移,颜色加深(助色效应)。
体 系 XC = C XC = CC = O
N R 2 40 95
-F<-CH3<-Br<-OH<-OCH3<-NH2<-NHCH3<NH(CH3)2<-NHC6H5<-O-
苯 ( *) 204
254
270 苯酚
(—OH为助色团)
/nm
常用术语
常见生色团
生色团 烯 炔 羧基 酰胺基 羰基 偶氮基 硝基 亚硝基 硝酸酯
溶剂 正庚烷 正庚烷 乙醇 水 正己烷 乙醇 异辛酯 乙醚
b.摩尔吸光系数小,吸收强度在10 ~100,属 于禁阻跃迁。
常用术语
• 2. K带 由共轭体系中π→π* 产生的吸收带。例:
• >C=C—C=C—C=C< 。 特点:a. 吸收峰出现区域:210~250nm,即在近紫 外区。 b. ε >104 。
常用术语
3. B带 产生:由苯环本身振动及闭合环状共轭双键π→π* 跃迁而
增色效应与减色效应 吸收峰吸收强度增加的现象叫增色 效应。 吸收峰吸收强度减小的现象叫减色 效应。
常用术语
吸收带:由相同的电子跃迁产生的吸收峰,叫..
R带:由化合物n→π* 跃迁产生的吸收带,它具有杂原 子和双键的共轭基团(醛、酮)。例:>C=O, —N=N—。 特点:a. 吸收峰出现区域在250nm~500nm。
nm的增值
O R SR
30
