南京大学化学化工学院2010第一学期-期末-A卷
江苏省2010~2011学年度第一学期高一期末考试(化学)

江苏省滨海中学2010~2011学年度第一学期高一期末考试(化学)卷面分值:100分 考试时间:90分钟本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
请将第Ⅰ卷的答案涂在答题卡上,第Ⅱ卷答在答题纸上,在试卷上作答无效。
可能用到的相对原子质量: H -1 C -12 N -14 O -16 Mg -24 Al -27 S -32Cl -35.5 K -39 Ca -40 Fe -56 Cu -64 Ba -137第Ⅰ卷(46分)一、单项选择题(本题包括8小题,每小题2分,共16分。
每小题只有一个....选项符合题意)1.2009年12月7~18日在丹麦首都哥本哈根,召开了全球气候会议,商讨2012年至2020年的全减排协议。
下列行为中不符合...“促进低碳经济”宗旨的是 A .发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖B .推广煤的气化、液化技术,提供清洁、高效燃料和基础化工原料,挖掘使用价值C .限制化学发展,关停化工企业,消除污染源头D .推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气2.进行化学实验必须注意安全。
下列说法正确的是A .剩余的药品倒入水池B .不能用手直接接触药品C .尝一下实验室酒精的味道D .用鼻孔凑到容器口去闻气体的气味 3.下图所示的实验操作,不能..达到相应目的的是4.要使氯化铝中的铝离子完全转化成氢氧化铝沉淀,应选的最佳试剂 A .氢氧化钠溶液 B .稀盐酸 C .硝酸银溶液 D .氨水5.用N A 表示阿伏加德罗常数的值。
下列判断错误..的是 A .N A 个H +的质量为1 g B .标准状况下,1 mol H 2O 中含有N A 个分子C .32 g O 2中含有2N A 个O 原子D .2 L 0.5mol/L Na 2CO 3溶液中含N A 个Na +6.下面有关氧化还原反应的叙述不正确...的是 棉花 NH 4Cl 和 Ca(OH)2 D .实验室制氨气蓝色钴玻璃 B .检验K 2CO 3中的K + Cl 2 浓H 2SO 4 A .干燥Cl 水 NH 3 气球C .证明氨气极 易溶于水A.氧化还原反应的本质是电子的转移B.在氧化还原反应中,失去电子的物质,一定有元素化合价升高C.肯定有一种元素被氧化,另一种元素被还原D.在反应中不一定所有元素的化合价都发生变化7.下列说法中正确的是A.光导纤维主要成分是硅B.只要溶于水能导电的物质就是电解质C.首先发现电子并提出“葡萄干面包式”原子结构模型的科学家是汤姆生D.海水中的各种化学资源的开发过程,必须都要发生化学反应8.现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是:①看颜色②石蕊试剂③品红溶液A.只有①②B.只有①③C.只有②③D.①②③二、不定项选择题(本题包括10小题,每小题3分,共30分。
2010年江苏高考化学试题(含答案、解析)精校版

2010年江苏高考化学试题(含答案、解析)精校版LT江苏省2010年普通高等学校招生统一考试化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16Na 23 Mg 24 Al 27 S 32 Cl 35.5 Ca 40 Mn 55Fe 56 Co 59 Cu 64 Br 80 Ba 137选择题单项选择题:本题包括7小题,每小题2分,共计14分。
每小题只有一个....选项符合题意。
1.化学与能源开发、环境保护、资源利用等密切相关。
下列说法正确的是A .为提高农作物的产量和质量,应大量使用化肥和农药B .绿色化学的核心是应用化学原理对环境污染进行治理C .实现化石燃料清洁利用,就无需开发新能源D .垃圾是放错地方的资源,应分类回收利用2.水是最宝贵的资源之一。
下列表述正确的是A .H 2O 的电子式为....H :O:H -+⎡⎤⎢⎥⎣⎦B .4℃时,纯水的pH=7C .162D O 中,质量数之和是质子数之和的两倍 D .273K 、101kPa ,水分子间的平均距离d :d (气态)>d (液态)>d (固态)3.下列离子方程式表达正确的是A .用惰性电极电解熔融氯化钠:2222Cl +2H O Cl +H +2OH --=↑↑通电B .用氢氧化钠溶液除去铝表面的氧化膜:2322Al O 2OH 2AlO H O --+=+ C .用稀氢氧化钠溶液吸收二氧化氮:2322OH 2NO NO +NO +H O --+=↑ D .用食醋除去水瓶中的水垢:233322CO +2CH COOH 2CH COO CO H O --=+↑+ 4.下列有关物质的性质或应用的说法不.正确的是 A .二氧化硅是生产光纤制品的基本原料B .水玻璃可用于生产黏合剂和防火剂C .盐析可提纯蛋白质并保持其生理活性D .石油分馏可获得乙烯、丙烯和丁二烯5.设N A 为阿伏加德罗常数的值,下列叙述正确的是A .常温下,1L0.1mol •L -1的NH 4NO 3溶液中氮原子数为0.2N AB .1mol 羟基中电子数为10N AC .在反应中,每生成3mol I 2转移的电子数为6N AD .常温常压下,22.4L 乙烯中C H —键数为4N A6.常温下,下列各组离子在指定溶液中能大量共存的是致的是选项实验操作 实验目的或结论 A 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体说明该钾盐是K 2CO 3 B 向含有少量FeCl 2的MgCl 2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤除去MgCl 2溶液中少量FeCl 3 C 常温下,向饱和Na 2CO 3溶液中加少量BaSO 4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生说明常温下Ksp(BaCO 3)<Ks p(SO 4) D C 2H 5OH 与浓硫酸170℃共热,制得的气体通入酸性KMnO 4溶液检验制得气体是否为乙烯11.右图是一种航天器能量储存系统原理示意图。
2010-2023历年浙江省宁波市八校高一上学期期末联考化学试卷(带解析)

2010-2023历年浙江省宁波市八校高一上学期期末联考化学试卷(带解析)第1卷一.参考题库(共20题)1.下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是A.蒸馏、蒸发、分液、过滤B.蒸馏、过滤、分液、蒸发C.分液、过滤、蒸馏、蒸发D.过滤、蒸发、分液、蒸馏2.科学家刚刚发现了某种元素的原子,1个该原子质量是ag,一个12C的原子质量是b g,N A是阿伏加德罗常数的值,下列说法正确的是①该原子的相对原子质量为②m g该原子的物质的量为 mol③该原子的摩尔质量是aN A g④Wg该原子中含有个该原子⑤由已知信息可得:A.①②④B.②③④C.①②⑤D.①③⑤3.下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是①金属钠投入到FeCl3溶液②过量NaOH溶液和明矾溶液③Ba(HCO3)2溶液和NaHSO4溶液④Na2O2投入FeCl3溶液A.①④B.②③④C.②③D.①③④4.用98%的浓硫酸(密度1.84g · mL-1)配制100mL1mol·L-1的稀硫酸。
现给出下列配制中可能用到的仪器:①100 mL量筒;②10 mL量筒;③50 mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒。
按使用仪器的先后顺序作出的下列排列中正确的是A.④③⑥⑦⑤⑥B.②⑥③⑦⑤⑥C.①③⑤⑦⑤⑥D.②③⑥⑦⑤⑥5.只用溴水就可以将下列物质鉴别出来的是A.水、CCl4、酒精、汽油B.NaCl溶液、NaBr溶液、NaI溶液、NaOH溶液C.AgNO3溶液、NaOH溶液、KI溶液、CCl4D.CCl4、酒精、NaCl溶液、KI-淀粉溶液6.已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。
则W、X不可能是选项WXA盐酸Na2CO3溶液BNaOH溶液AlCl3溶液CCO2Ca(OH)2溶液DCl2Fe7.下列有关物质分类的叙述正确的是A.根据金属铜能导电可判断:铜为电解质B.根据分类的观点可判断:纯碱属于碱类C.根据分散质粒子的直径大小可区分:胶体和溶液D.根据都能使有色物质褪色这一现象推断:氯水和活性炭的漂白原理相同8.下列除杂质的操作中不正确的是A.铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤C.Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液D.氯气中混有少量氯化氢气体:将混合气体通过盛饱和食盐水的洗气瓶9.正在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O。
]南大物化选择题+答案
![]南大物化选择题+答案](https://img.taocdn.com/s3/m/c2e7511dff00bed5b9f31d46.png)
第二章热力学第一定律及其应用物化试卷(一)~1.物质的量为n的纯理想气体,该气体在如下的哪一组物理量确定之后,其它状态函数方有定值。
(A) p (B) V (C) T,U (D) T, p2. 下述说法哪一个正确?(A) 热是体系中微观粒子平均平动能的量度(B) 温度是体系所储存热量的量度(C) 温度是体系中微观粒子平均能量的量度(D) 温度是体系中微观粒子平均平动能的量度3. 有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与筒外压力相等时关闭活塞,此时筒内温度将:(A) 不变(B) 升高(C) 降低(D) 无法判定4. 1 mol 373 K,标准压力下的水经下列两个不同过程变成373 K,标准压力下的水气,(1) 等温等压可逆蒸发,(2) 真空蒸发这两个过程中功和热的关系为:(A) |W1|> |W2| Q1> Q2(B) |W1|< |W2| Q1< Q2(C) |W1|= |W2| Q1= Q2(D) |W1|> |W2| Q1< Q25. 恒容下,一定量的理想气体,当温度升高时热力学能将:(A) 降低(B) 增加(C) 不变(D) 增加、减少不能确定6. 在体系温度恒定的变化中,体系与环境之间:(A) 一定产生热交换(B) 一定不产生热交换(C) 不一定产生热交换(D) 温度恒定与热交换无关7. 一可逆热机与另一不可逆热机在其他条件都相同时,燃烧等量的燃料,则可逆热机拖动的列车运行的速度:(A) 较快(B) 较慢(C) 一样(D) 不一定8. 始态完全相同(p1,V1,T1)的一个理想气体体系,和另一个范德华气体体系,分别进行绝热恒外压(p0)膨胀。
当膨胀相同体积之后, 下述哪一种说法正确?(A) 范德华气体的热力学能减少量比理想气体多(B) 范德华气体的终态温度比理想气体低(C) 范德华气体所做的功比理想气体少(D) 范德华气体的焓变与理想气体的焓变相等9.ΔH =Q p , 此式适用于下列哪个过程:(A) 理想气体从106 Pa反抗恒外压105 Pa膨胀到105 Pa (B) 0℃ , 105 Pa 下冰融化成水(C) 电解CuSO4水溶液(D) 气体从(298 K, 105 Pa) 可逆变化到(373 K, 104 Pa)10.在100℃和25℃之间工作的热机,其最大效率为:(A) 100 % (B) 75 % (C) 25 % (D) 20 %11.对于封闭体系,在指定始终态间的绝热可逆途径可以有:(A) 一条(B) 二条(C) 三条(D) 三条以上12.某理想气体的γ =Cp/Cv =1.40,则该气体为几原子分子气体?(A) 单原子分子气体(B) 双原子分子气体(C) 三原子分子气体(D) 四原子分子气体13.实际气体绝热恒外压膨胀时,其温度将:(A) 升高(B) 降低(C) 不变(D) 不确定14.当以5 mol H2气与4 mol Cl2气混合,最后生成2 mol HCl气。
南京外国语学校2010学年第一学期期末考试高三化学(精)

南京外国语学校 2010学年第一学期期末考试高三化学班级姓名学号成绩第一卷 (选择题共 74分可能用到的相对原子质量:H — 1 C — 12 N — 14 O — 16 Na — 23 S — 32 Cl — 35.5 Fe — 56 Ba — 137 Mg — 24一、选择题(本题包括8小题,每小题4分,共 32分,每小题只有一个选项符合题意 1.据报道,在我国各地发生过多次因混合洁污剂而引起氯气中毒事件,据此推测,相混合的洁污剂中最有可能.... 含有 ( A . ClO 3-、 Cl -、 OH -B . ClO -、 Cl -、 H +C . NaClO 、 NaClO 3D . NaClO 、 NaCl2.在医学、日常生活中常见的溶液:①福尔马林②医用消毒酒精③生理盐水④食醋,这些溶液中的溶质质量分数由大到小顺序为 ( A .①②③④ B .②①③④C .②④①③D .②①④③3.下列现象不是因为发生化学变化而产生的是 ( A . 皮肤不慎沾上浓硝酸而呈黄色 B . 食盐撒在燃着的液化气火焰上, 火焰呈黄色 C .久置的 KI 溶液呈黄色 D .盛在无色试剂瓶中的浓硝酸呈黄色4.下列说法不正确的是 (A .水分子间形成氢键会使水的稳定性升高B .分散质粒子的直径在 1nm -100nm 之间的分散系叫做胶体C .用渗析法除去鸡蛋白溶液中少量的葡萄糖杂质D .石墨晶体中,每个正六边形平均分摊到 2个碳原子5.已知短周期元素的离子, a A 2+、 b B +、 cC 3—、 d D —都具有相同的电子层结构, 则下列叙述正确的是 ( A . 原子半径 A>B>C>D B .原子序数 D>C>B>AC .离子半径 C 3— >D— >B+>A2+D .单质的还原性 A>B>D>C6.将 40℃的饱和石灰水冷却至 10℃或加入少量 CaO ,温度仍保持 40℃,在这两种情况下均未改变的是 ( A .溶液中 Ca 2+的物质的量浓度 B . Ca(OH2的溶解度、溶剂的质量C .溶液的质量D .溶液中 Ca 2+的数目7.汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO 2+Pb +2H 2SO 4=2PbSO 4↓+2H 2O , 根据此反应判断下列叙述中正确的是(A . Pb O2是电池的负极B .负极的电极反应式为:Pb +SO 42--2e -=PbSO 4 ↓C .电池放电时, PbO 2得电子,被氧化D .电池放电时,溶液酸性增强8.根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是 (A . SiCl 4形成的是分子晶体B .单质 B 可能是原子晶体C .电解 NaCl 水溶液可制得金属钠D .不能用电解熔化 AlCl 3制取单质铝二、选择题:(本题包括 10小题,第 9~16题每小题 4分,第 17、 18题每小题 5分,共 42分。
(完整word版)南京工业大学2010-2011年分析化学试卷1.doc

一、选择题(每小题 2 分,共 40 分)1(A)(B)(C)(D)23(A) 1.030 mol/L (B) pH = 12.023(C) 1.023 mol/L (D) pH = 1.233(A) (B)(C)(D)4 NaOH(A)K b = 4.6× 10-10 (B) NH 4NO 3 NH 3 K b = 1.8× 10-5(C)K a =1.4×10-4(D) Na 2SO 45 pH 3(A) HAc pK =4.74(B) pKa =3.74a(C)pK a =2.86 (D)pK a =1.306 H 3PO 42.12 7.20 12.36NaOHpH(A) 2.12(B) 5.66(C) 7.20(D) 9.787nn(A)(C)Y(H)Y(H)1K a i[ H]i(B)i 1niH[ H ] i1(D)i1Y(H)Y(H)1[ H ] ii 1n [H ]i 1K a ii 18EDTABi 3+ Pb 2+ Bi 3+Pb 2+lg K BiY27.94 lg K PbY 18.04 pK sp,Bi(OH) 3 30.4 pK sp,Bi(OH) 3 14.93(A) pH(B) pH(C) Bi 3+Bi(OH) 3Bi(OH) 3Bi 3+(D) Pb 2+Pb(OH) 2Bi 3+9lg K ZnY16.5pH45 67lgY(H)8.44 6.454.563.200.02000 mol/L EDTA0.02 mol/L Zn2+0.1%(A) pH 4(B) pH 6(C) pH8(D) pH 1010Fe 3+ Fe 2+Fe 3+/Fe 2+(A)H SO4(B)(C) NHF(D) K Cr O7242 211E 0' 4/Ce 31.44 V E 0' 3/Fe 20.68VCe 4++ Fe 2+ = Ce 3+ + Fe 3+CeFeFe 3+ Fe 2+(A) 1.08 × 10-18 (B) 92.5(C) 36.2(D) 2.76 × 106(A) [Fe 3+ ]=[Cr 3+ ], [Fe 2+2-] (B) 3+ 3+2+2- ]]=[Cr 2 O 73[Fe ]=[Cr] , [Fe]=6[Cr 2O 7(C) [Fe 3+]=3[Cr 3+], [Fe 2+]=6[Cr 2O 72- ] (D) [Fe 3+]=3[Cr 3+] , 6[Fe 2+]=[Cr 2O 72- ]13 间接碘量法的主要误差来源是 ()(A) 碘的挥发和空气中的氧对碘离子的氧化 (C) 淀粉指示剂对大量碘的吸附(B) 碘的溶解度较小,易在溶液中析出(D) 碘的黄色褪去不易观察14 在不另加试剂的情况下, 可以用莫尔法直接滴定的含氯试样是()(A) FeCl3(B) BaCl2(C) NaCl + NaS (D) NaCl + Na SO42215 某荧光吸附指示剂 HFl 形式为黄色,游离的 Fl -形式呈蓝色, Fl -被吸附后显紫红色。
学年第一学期期末试卷检查工作总结

教学督导组2010-2011学年第一学期期末试卷检查情况通报根据教务处《关于做好2010-2011学年第一学期期末考试试卷检查工作的通知》的要求,教学督导组于4月1日至4月15日对全校21个院(系、部)上学期期末考试试卷进行了检查。
本次检查按各院(系、部)试卷装订数量10%的比例进行抽查,最低基数为3本,全校共抽查试卷123本。
各院系抽查试卷检查情况如下:2010-2011学年第一学期各院(系、部)期末试卷抽查情况一览表(说明:①A、B、C、D、F五个等级所对应的分数为5、4、3、2、1,总分为各等级的平均分。
②公共课试卷命题错误、答案错误,责任在院(系、部),从总分中扣分。
)从抽查结果看,全校总平均分为分,比上学期的分高出分,各等级所占抽查总数比重与上学期相比情况见下表:2009-2010学年第二学期与2010-2011学年第一学期试卷抽查结果各等级比重对比表从上表中可以看出,本学期与上学期相比,A级比重虽稍有下降,但B级比重增长较大,同时,C级、D级和F级的比重均有所减少,总体趋势表明试卷工作整体质量有所提高。
虽然试卷工作整体质量有所提高,但问题仍然较多,为了便于各院(系、部)教学管理人员和全体教师,对试卷命题、批改、成绩录入、考试与试卷相关材料的填写、整理装订等环节中存在的问题有比较全面的了解,我们将本次试卷检查中存在的问题,分类整理如下:一、封面1.封面填写的课程名称与试卷印制的课程名称不一致,如:中文系的2本试卷,封面上都是《现代汉语》,但试卷印制的课程名称,一门是《现代汉语(上)》,一门是《现代汉语(下)》,这是2门不同课程的试卷;《大学英语》有(一)、(二)、(三)、(四)四级,因此,必须在课程名称中标明是几级大学英语。
2.课程代码填写不正确,如政治学系《社会主义市场经济理论与实践》试卷,封面填写的课程代码为“(2010-2011-1)ZJ6”,正确的课程代码是“ZJ61010”。
2010-2023历年江苏省南京市、盐城市高三年级第一次模拟考试化学试卷(带解析)

2010-2023历年江苏省南京市、盐城市高三年级第一次模拟考试化学试卷(带解析)第1卷一.参考题库(共20题)1.我国科研人员从天然姜属植物分离出的一种具有显著杀菌、消炎、解毒作用的化合物H。
H的合成路线如下:(1)A→B的反应类型是。
(2)化合物B中的含氧官能团为和(填官能团名称)。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式。
I.苯环上有两个取代基;II.分子中有6种不同化学环境的氢;III.既能与FeCl 溶液发生显色反应,又能发生银镜反应,水解产物之一也能发生银镜反应。
3(4)实现F→G的转化中,加入的化合物X(C12H14O3)的结构简式为。
(5)化合物是合成紫杉醇的关键化合物,请写出以为原料制备该化合物的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:2.下列有关物质的性质与其应用不相对应的是A.Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品B.NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂C.NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏D.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒3.有关海洋中部分资源的利用(如图)的说法不正确的是A.工业上利用Cl2与澄清石灰水反应制取漂白粉B.用MgCl2·6H2O晶体制无水MgCl2,需在HCl气流中加热脱水C.SO2水溶液吸收Br2的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBrD.粗碘中混有少量HCl和IBr可加入KI进行升华提纯4.仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图2、图3)就能实现相应实验目的是5.常温下,下列各组离子在指定溶液中一定能大量共存的是A.能溶液Al2O3的溶液:Na+、K+、HCO—3、NO—3B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I—、Cl—C.能使甲基橙显红色的溶液:K+、Fe2+、Cl—、NO—3D.加入KSCN显红色的溶液:Na+、Mg2+、Cl—、SO2—46.设N A表示阿伏加德罗常数的值,下列说法正确的是A.常温常压下,5.6L CH4含C—H键数目为N AB.常温常压下,100g17%H2O2水溶液含氧原子总数为N AC.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为N AD.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为N A7.下列有关化学用语表示正确的是A.中子数为18的硫原子:B.COCl2的电子式:C.Al3+的结构示意图:D.聚丙烯的结构简式:8.碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
第一学期期末考试高三化学试卷

启东市汇龙中学2005-2006学年度第一学期期末考试高三化学试卷第Ⅰ卷(选择题共74分)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 Si 28 S 32 Cl 35.5 Cu 64 Zn 65 Ba 137一、选择题(本题包括8小题。
每小题4分,共32分。
每小题只有一个选项符合题意) 1.“神舟六号”的成功发射和返回,第一次实现了我国有人参与的空间科学实验。
整个飞船应用了许多尖端的合成材料。
下列物质中,不属于...合成材料的是A.人造丝B.有机玻璃C.硅橡胶D.黏合剂2.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。
工业上冶炼钼的化学原理为①2MoS2 + 7O2高温2MoO3 + 4SO2;②MoO3+ 2NH3·H2O = (NH4)2MoO4+ H2O;③(NH4)2MoO4+ 2HCl = H2MoO4↓+ 2NH4Cl;④H2MoO4△MoO3+ H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是A.MoS2煅烧产生的尾气可直接排空B.H2MoO4是一种强酸C.MoO3是金属氧化物,也是碱性氧化物D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2 3.每个公民都应该有安全意识,今年频繁发生的有关化学品泄漏或爆炸事件一次又一次给我们敲响了警钟。
下列做法存在安全隐患的是①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌;②给试管中液体加热时,应将试管倾斜,与桌面成45°角,再集中在药品处加热;③取用金属Na或K时,用剩的药品要放回原瓶;④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风;⑤在做苯酚性质实验时,因为常温时苯酚在水中溶解度较小,所以可以将废液直接通过水池排入下水道;⑥废旧电池应回收处理。
A.全部B.①②④⑤C.①③⑤D.①④4.共价键的断裂有均裂和异裂两种方式,即:均裂:A∶B →A·+B·;异裂:A∶B →A++[∶B]-。
物理化学试题A卷参考答案-化学化工学院-09-10下

物理化学试题A卷参考答案-化学化⼯学院-09-10下西南⼤学课程考核《物理化学》课程试题【A】卷(C)φ平,阳<φ阳;?平,阴<φ阴(D)φ平,阳>φ阳;φ平,阴<φ阴2. [答] (B)3. 对⼤多数纯液体其表⾯张⼒随温度的变化率是:( )(A) (?γ/?T)p> 0(B) (?γ/?T)p< 0(C) (?γ/?T)p= 0(D) ⽆⼀定变化规律3. [答] (B)4. 298 K时,⽔-空⽓的表⾯张⼒γ= 7.17×10-2 N·m-1,若在298 K,标准压⼒p?下,可逆地增加4×10-4 m2⽔的表⾯积,环境对体系应做的功W为(?U = Q -W):( )(A) -2.868×10-5 J(B) 2.868×10-5 J(C) -7.17×10-5J(D) 7.17×10 –5 J4. [答](A)5. 如果反应2A + B =2D 的速率可表⽰为:r = -12d c A/d t = - d c B/d t =12d c D/d t则其反应分⼦数为:()(A) 单分⼦(B) 双分⼦(C) 三分⼦(D) 不能确定5. [答](D)6. 量⼦的思想最先是由提出的。
( 1)(A) 玻尔(B) 爱因斯坦(C) 普朗克(D) 薛定谔6. [答](C)7. 微观粒⼦的能量ε,动量p与其物质波的频率ν和波长λ的关系为( 1 )西南⼤学课程考核 (试题【A 】卷)(A) ε = h λ, p = h /ν (B) ε = h ν, p = h /λ (C)ε = h /ν, p = h λ (D) ε = h /λ, p = h ν 7. [答](B )8. 下列分⼦⼀定没有偶极矩的是 ( 4 )(A) H 2O 2 (B) NH 3 (C) ClHC=CHCl (D) H 2C=CH 2 8. [答](D )9. ⽤休克尔分⼦轨道法处理丁⼆烯分⼦的π电⼦结构,四个π分⼦轨道ψ i (i = 1, 2, 3, 4)的图形如右,它们的能量分别为E i (i = 1, 2, 3, 4)。
[高等教育]全文字版江苏省南京市2010届高三上学期期末考试化学
![[高等教育]全文字版江苏省南京市2010届高三上学期期末考试化学](https://img.taocdn.com/s3/m/77f2a1a859eef8c75ebfb343.png)
南京市2010届高三上学期期末考试化学试题本试卷分选择题和非选择题两部分。
共120分。
考试时间120分钟。
注意事项:答题前,考生务必将自己的姓名、班级、学号写在上;答题纸的密封线内。
选择题答案按要求填涂在答题卡...非选择题的答案写在答题纸上对应题目的答案空格内,...答案不写在试卷上。
考试结束后,请将答题卡、答题纸一并交回。
可能用到的相对原子质量:H 1 N 14 O 16 S 32 Cl 35.5 Fe 56 Ag 108 Ba 137选择题共42分单项选择题:本题包括6小题,每小题3分,共计18分。
每小题只有一个选项符合题意。
1.化学在生产和生活中有着广泛的应用。
下列做法错误的是()..A.用聚乙烯塑料做食品包装袋B.用二氧化硫加工食品使食品增白点燃C.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜要求D.用明矾做净水剂除去水中的悬浮物2.氢化亚铜(CuH)可用CuSO4溶液和另一种反应物在40℃~50℃时反应生成。
CuH不稳定,易分解,在氯气中能燃烧,常温下跟盐酸反应能产生气体。
以下表述错误..的是()A.生成CuH的反应中CuSO4被氧化B.CuH既可作氧化剂也可作为还原剂C.2CuH+3Cl2====2CuCl2+2HClD.CuH+HCl=CuCl+H2↑3.用NA表示阿伏加德罗常数的值。
下列说法正确的是 ( )A .标准状况下,22.4L 乙醇中含有的碳原子数目为2N AB .1molC n H 2n 含有的共同电子对数为(3n+1)N A C .1mol CO 2与1mol Na 2O 2完全反应时,转移的电子数目为N AD .1mol/L 的FeCl 3溶液中,所含Fe 3+的数目小于N A4.下列实验能达到的预期目的的是()①用硝酸钡溶液鉴别硫酸根离子与亚硫根离子;②用溴水检验汽油中是否含有不饱和脂肪烃;③用乙醇从碘水中萃取碘;④用盐析方法分离提纯蛋白质;⑤用加热方法提纯含有少量碳酸氢钠的碳酸钠固体;⑥用氨水清洗试管壁附着的银镜A .②④⑤B .①③⑥C .①②④⑤D .②③④⑤⑥5.在溶液中能大量共存的一组微粒是( )A .NH +4、H +、NO -3、HCO -3B .K +、Cu 2+、SO 2-4、NH 3·H 2OC .Ca 2+、K +、SiO 2-3、OH -D .Na +、CH 3COO -、CO 2-3、OH -6.下列实验所用装置正确的是( )A.用甲图装置电解精炼铝B.用乙图装置制取乙炔C.用丙图装置制备氢氧化亚铁D.用丁图装置制取乙烯不定项选择题:本题包括6小题,每小题4分,共计24分。
2010-2023历年江苏省如东县高三上学期期末四校联考化学试卷(带解析)
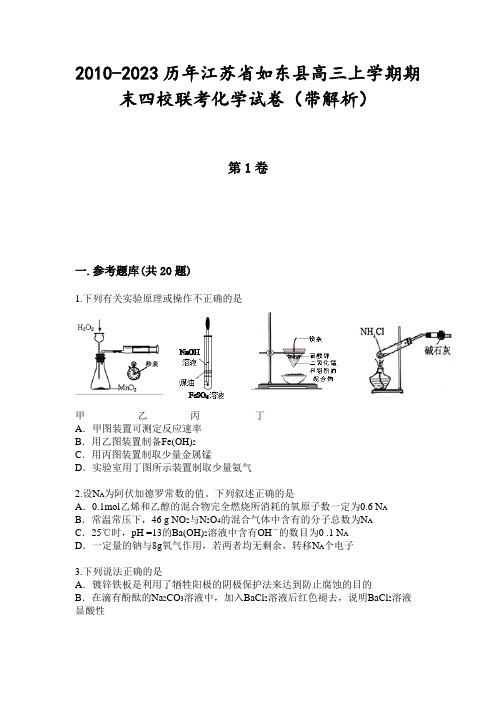
2010-2023历年江苏省如东县高三上学期期末四校联考化学试卷(带解析)第1卷一.参考题库(共20题)1.下列有关实验原理或操作不正确的是甲乙丙丁A.甲图装置可测定反应速率B.用乙图装置制备Fe(OH)2C.用丙图装置制取少量金属锰D.实验室用丁图所示装置制取少量氨气2.设N A为阿伏加德罗常数的值。
下列叙述正确的是A.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 N AB.常温常压下,46 g NO2与N2O4的混合气体中含有的分子总数为N AC.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 N AD.一定量的钠与8g氧气作用,若两者均无剩余,转移N A个电子3.下列说法正确的是A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动D.汽车尾气的净化反应2NO+2CO2CO2+N2△H<0,则该反应一定能自发进行4.随着社会的发展,人们日益重视环境问题、节能减排,下列说法不正确的是A.绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染B.大力开发和应用氢能源有利于实现“低碳经济”C.吸烟不会造成室内PM2.5污染D.采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体5.通过NO x传感器可监测NO x的含量,其工作原理示意图如下:下列说法正确的是()A.NiO 电极是该电池的正极B.Pt电极附近的pH 增大C.NiO 电极的电极反应式:NO—2e—+O2—=NO2D.固体电解质中O2-向正极移动6.常温下,下列各组离子在指定溶液中一定能大量共存的是A.1.0 mol/L的NaHSO4溶液:K+、Fe2+、NO3-、Cl-B.l.0 mol·L-1 NaClO溶液:Fe2+、K+、I一、Cl-C.甲基橙显黄色的溶液: Na+、CO32-、NO3-、SO32-D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Ca2+、C1-、K+7.霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:下列说法中正确的是()A.1molMMF与足量NaOH 溶液共热,最多可消耗3molNaOHB.可以用NaHCO3溶液区别MMF与化合物ⅠC.化合物R 的分子式为C6H12NO2D.MMF分子中含有三种官能团8.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
(A) 化学反应工程期末试卷及其答案

化学化工学院《化学反应工程》课程考试试题(A 卷)2013-2014学年 第一学期 班级时量120分钟 总分100分 考试形式:闭卷一、填空题(每空1.5分,共21分)1、按照反应器型式或形状来分类,可分为______、______、______反应器。
2、化学反应速率式为βαB A C A C C K r =-,用浓度表示的速率常数为C K ,假定符合理想气体状态方程,如用压力表示的速率常数P K ,则C K =_______P K 。
3、活化能的大小直接反映了______________对温度的敏感程度。
4、全混流反应器的返混_______,而平推流反应器的返混为_______。
5、平推流管式反应器t t ≥时,F(t)=_______。
6、平推流管式反应器其E(θ)曲线的方差2θσ=_______。
7、非理想流动不一定是由返混造成的,返混造成了______和反应物浓度的降低。
8、对于多孔性的催化剂,分子扩散很复杂,当微孔孔径远大于分子平均自由程时,扩散过程与孔径无关,扩散阻力是由分子间碰撞所致,这种扩散通常称为_______。
9、描述固定床反应器的数学模型,忽略了粒子与流体之间温度与浓度的差别的模型称之为_______。
10、稳定态条件下操作的全混釜其操作温度和转化率应满足 衡算和 衡算方程。
二、选择题(每小题2分,共26分,每题只一个选择项是正确答案)1、“三传一反”是化学反应工程的基础,其中所谓的“一反”是指_______。
A. 化学反应B. 反应原理C. 反应热力学D. 反应动力学2、下列属于均相反应的是_______。
A. 煤炭燃烧B. 氢气燃烧C. 离子交换D. 加氢裂解3、对于反应sS pP bB aA +→+,则=P r _______)(A r -。
A. ||a p B. a pC. p aD. p a || 4、气相反应A + B → 3P + S 进料时无惰性气体,A 与B 以1∶1摩尔比进料,则膨胀因子A δ=_______。
自-南京大学计算机组成原理2010冬试题-A-答案

考试科目名称 计算机组织与系统结构 (A 卷)2010——2011学年第 1 学期 教师 袁春风/杨若瑜 考试方式:闭卷 系(专业) 计算机科学与技术 年级 2009 班级 学号 姓名 成绩一、选择题(每小题2分,共36分)1. -1022的32位补码用十六进制表示为( D )。
A. 0000 03FEHB. 0000 FC02HC. FFFF 03FEHD. FFFF FC02H2. 假定变量f 的数据类型为float ,f=-4.093e3,则变量f 的机器数表示为( B )。
A. 457F D000HB. C57F D000HC. C5FF D000HD. C67F E800H3. 某8位计算机中,假定带符号整数变量x 和y 的机器数用补码表示,[x]补=F5H ,[y]补=7EH ,则x –y的值及其相应的溢出标志OF 分别是( D )。
A. 115、0B. 119、0C. 115、1D. 119、14. 考虑以下C 语言代码:short si= –8196; int i=si;执行上述程序段后,i 的机器数表示为( D )。
A. 0000 9FFCHB. 0000 DFFCHC. FFFF 9FFCHD. FFFF DFFCH5. 以下几种存储结构中,采用相联存取方式访问信息的是( C )。
A.堆栈B.直接映射cacheC. 分支历史记录表D. 主存页表6. 假定用若干个16K×8位的存储器芯片组成一个64K×8位的存储器,按字节编址,芯片内各单元交叉编址,则地址BFFFH 所在的芯片的最小地址为( D )。
A. 0000HB. 0001HC. 0002HD. 0003H7. 假定主存地址位数为32位,按字节编址,主存和cache 之间采用全相联映射方式,主存块大小为一个字,每字32位,采用回写(Write Back )方式和随机替换策略,则能存放32K 字数据的cache的总容量至少应有多少位?( D ) A. 1536KB. 1568KC. 2016KD. 2048K8. 某计算机按字节编址,采用小端方式存储信息。
南昌大学2010-2011-2有机化学期末考试试卷(A)及答案

南昌大学2021~2021 学年第二学期期末考试试卷7.(0109)庚烷、1-庚炔、1,3-己二烯中区别出1-庚炔最简明的方法是采用:7Br2 + CCl4(B) Pd + H2(C) KMnO4,H+(D) AgNO3,NH3溶液8.(0045)烯烃与卤素在高温或光照下进行反响,卤素进攻的主要位置是:(A) 双键C原子(B) 双键的α-C原子(C) 双键的β-C原子(D) 叔C原子9.(0048)CF3CH=CH2 + HCl 产物主要是:(A) CF3CHClCH3(B) CF3CH2CH2Cl(C) CF3CHClCH3 与CF3CH2CH2Cl相差不多(D) 不能反响10.(0224)(CH3)2CHMgCl + 环氧乙烷生成哪种产物?11.(0225)以下化合物苯甲醇(I),二苯甲醇(II),三苯甲醇(III),甲醇(IV)与HBr反响的活性顺序为:(A) III>II>I>IV (B) IV>I>II>III (C) IV>III>II>I (D) I>II>III>IV 12.(0234)以下哪种化合物能形成分子内氢键?(A) 对硝基苯酚(B) 邻硝基苯酚(C) 邻甲苯酚(D) 对甲苯酚13.(0236)比拟苯酚(I)、环己醇(II)、碳酸(III)酸性的大小:(A) II>I>III (B) III>I>II(C) I>II>III (D) II>III>I14.(0069)1-甲基-4-叔丁基环己烯与溴在稀甲醇溶液中的加成产物是:15.(7517)以下化合物碱性最弱的应是:(A) HC≡C-(B) (C6H5)3C-(C) H2C=CH-(D) C6H5-16.(0090)比拟C≡C(I), C=C(II), C─C(III), C=C─C=C中的C2-C3 (IV)的键长次序为:(A) I>II>III>IV (B) III>II>IV>I(CH3)3CBrOCH3CH3C(CH3)3BrOCH3CH3(CH3)3CBrOCH3CH3(CH3)3COCH3CH3Br(A)(B)(C)(D)23. (0104)RC≡CH + NaNH 2 ──> RC≡CNa + NH 3,炔钠加水又能恢复成炔烃,RC≡CNa + H 2O ──> RC≡CH + NaOH ,据此可推测酸性大小为: (A) NH 3>RC≡CH>H 2O (B) H 2O>RC≡CH>NH 3 (C) H 2O>NH 3>RC≡CH (D) NH 3>H 2O>RC≡CH 24.(0106)炔烃经臭氧化可得到什么产物?(A) 过氧化物 (B) 醛或酮 (C) 环氧化物 (D) 羧酸 25.(0107)确定分子是否具有共轭结构,通常采用什么光谱? (A) 红外光谱(IR) (B) 紫外光谱(UV)(C) 核磁共振谱(NMR) (D) 质谱(MS) 26.(0108)区别丙烯、丙炔、环丙烷时鉴别丙炔最好的方法是采用: (A) Br 2, CCl 4 (B) KMnO 4, H +(C) 臭氧化 (D) Cu 2Cl 2, NH 3溶液 27.(0111)二溴苯有三种异构体o-,m-,p-,其熔点最高者为: (A) o-二溴苯 (B) m-二溴苯 (C) p-二溴苯 (D) 无法预测 28.(0129)用KMnO 4氧化的产物是:29. (0134)由 → 最好的路线是:(A) 先硝化,再磺化,最后卤代 (B) 先磺化,再硝化,最后卤代 (C) 先卤代,再磺化,最后硝化 (D) 先卤代,再硝化,最后磺化 30.(0146) 主要产物是:31.(0222)Williamson 合成法是合成哪一种化合物的主要方法? (A) 酮 (B) 卤代烃 (C) 混合醚 (D) 简单醚 32.以下分子式哪个对应的化合物为恰好是一个环或者一个双键?COOH C(CH 3)3CH 3COOH COOH COOH CHOC(CH 3)3(D)(C)(B)(A)ClO 2N NO 2SO 3H CH 2CH 2CH 2COClAlCl3CH 2CH 2CH 2CO(C)(A)COCH 2CH 2CH 3(D)(B)O33.以下化合物哪些加水产生氢气?34.35.以下哪种说明了上述化合物的酸性降低顺序?36.上述反响是以下哪种反响?〔A〕消除反响〔B〕亲核取代〔C〕亲电加成〔D〕亲电芳香取代〔E〕羟醛缩合37.这个化合物有几种立体异构体?(A)2种(B)3种(C)4种(D)5种(E)6种38.以下哪种为间-氟苯酚溴化过程中产生的最稳定共振式?39.为得到最高产率的叔丁基甲醚,以下哪种原料的组合是最恰当的?40.以下哪种反响得到1-戊醇为主要产物?,乙醚溶液中,然后。
2010-2023历年江苏省南京市、盐城市高三一模化学试卷(带解析)

2010-2023历年江苏省南京市、盐城市高三一模化学试卷(带解析)第1卷一.参考题库(共20题)1.从植物中分离出的活性化合物zeylastral的结构简式如图所示。
下列说法不正确的是A.分子中含有6个手性碳原子B.能与FeCl3溶液、银氨溶液发生反应C.1mol zeylastral最多与5molH2发生反应D.1mol zeylastral最多可与lmolBr2发生反应2.25℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)关系如图所示。
下列说法正确的是A.Ksp(CuS)约为l×10-20B.向Cu2+浓度为10-5mol•L-1废水中加入ZnS粉末,会有CuS沉淀析出C.向l00mL浓度均为10-5mol•L-1Zn2+、Fe2+、Mn2+的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀D.Na2S溶液中:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+)3.下列指定反应的离子方程式正确的是A.用稀硫酸去除铜器表面的Cu2(OH)2CO3:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3 H2OB.用稀硝酸去除试管内壁的银镜:Ag+NO3-+2H+=Ag++NO2↑+H2OC.向AlCl3溶液中加入氨水制Al(OH)3:Al3++3OH-=Al(OH)3↓D.向FeI2溶液中加入盐酸和过量的H2O2:2I-+H2O2+2H+=I2+2H2O4.12分)化学需氧量(COD)常作为衡量水体中有机物含量多少的指标。
某化学课外小组的同学拟采用碱性高锰酸钾溶液测定某海水试样的COD,实验流程如下:已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O③2S2O32-+I2=2I-+S4O62-(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是。
南昌大学2010-2011-2有机化学期末考试试卷(B)及答案

南昌大学 2010~2011 学年第二学期期末考试试卷试卷编号:6046 (B )卷课程编号:Z5503B301 程名称:有机化学(上)考试形式:闭卷适用班级:09化学、09应化1、2 姓名:学号:班级:学院:理学院专业:考试日期:题号一二三四五总分累分人签名题分66 7 12 8 7 100得分考生注意事项:1、本试卷共13页,请查看试卷中是否有缺页或破损。
如有立即举手报告以便更换。
2、考试结束后,考生不得将试卷、答题纸和草稿纸带出考场。
一、选择题:(每小题1.2分,共55小题,66分)得分评阅人1.在1H NMR中左边物质的哪一种质子将被观察为二重峰?(A),a (B),b (C),c (D),d (E), e2.下列哪种物质为该反应的主要产物?3.下列哪种物质更倾向于以s-反式存在?4.下列哪种物质为该反应的主要产物?5.下列哪种物质为该反应的主要产物?6.下列哪种物质为该反应的碳正离子重排主要产物7.下列哪两种是环己烯溴化过程中的链增长步骤?(A), I 和II (B), I 和IV (C), I 和V (D), II 和V (E), III和IV8.实现这个转换可采用下列哪种方法?9.实现这个转换可采用下列哪种方法?10.下列哪种为该反应系列的主要产物?与其邻位异构体与其邻位异构体11.这个物质(R)-3-溴-5-羟基戊酸经氧化后产生3-溴戊二酸,该3-溴戊二酸是:(A) 两个不等量的非对映异构体的混合物(B) 外消旋混合物(C) 单一的纯的对映体(D) 一个内消旋化合物(E) 一个非手性化合物12.下列化合物哪种发生单分子消除更容易?13.下列哪种是该亲核取代反应的主要产物?14.下列哪种是该化合物的IUPAC名字?(A),2-(1-甲基乙基)-3-丁基-戊烷(D),2,3-二-甲基-4-乙基辛烷(B),2-异丙基-3-丁基戊烷(E),2-异十二烷(C),3-乙基-2-异丙基庚烷15.上述两种结构是(A)相同的(B) 同一化合物的两种构象(C) 对映体(D)非对映异构体(E) 构造异构体16.下列哪种反应式得到的产物是该反应的主要产物?17.下列哪种中间体是该反应中生成最快的?18.下列哪种化合物是非手性的?19.通过Diels-Alder反应制得该物质,下列哪种是最好的原料组合?20.下列哪种是该反应的关键中间体?21.上述物质与碘化钠的丙酮溶液反应性顺序是:22.下列哪种方法是合成左边这个物质的最佳?23.(8550)下面化合物中,哪一根键最长?C H3C H C H2C H C C HA B C D24. (8551)Lindlar 试剂的组成是什么?A B C DCrO 3P d -BaSO 4Hg(OAc)2/THF HCl+ZnCl 2//NN25. (8552) 预测CH 3CCCH 2CH 3在酸催化下与水加成后,生成下述产物中的哪一种?A 一种酮B 一种醛C 两种酮的混合物D 一种二元醇 26. (8553)根据化合物的酸碱性,下列反应不能发生的是:A B CRC CH CNa NH 3RONa R 'C ROHCH 3CH 2ONaOH +RC +NH 2+CHR 'C CNa+CNa +CH 3C CH +DHCAg(N H 3)2NO 3AgC CAgCH +(白色)27. (8902)下列反应机理说明正确的是:++AB CDCH 3CHCH 2BrCH 3CH 3OH CH 3CHCH 2OCH 3CH 3CH 3CHCH 3CH 3OCH 3S N 1CH 3I +-OHCH 3OH +-I --+NaOHC HBrC 6H 5CH 3C HOH C 6H 5CH 3+H 2OC 6H 5CHCH 3OH(+)-(R)-C 6H 5CHCH 3BrS N 2S N 1S N 128. (8914)下列哪些化合物不能用来制备Grinard 试剂?(1)(2)(3)(4)(5)BrCH 2COOHBrOBr CH 3CCCH 2ICH 3CH CH 2CH 2Br NH 2(A ) 1,3,4 (B )1,2(C )1,3,5 (D )3,529. (8878)丙烷二氯代时,得四种产物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13.
下列各电极的 ϕ y 大小的顺序是___________________________________。 (1) ϕ y (Ag+/Ag) (3) ϕ y (AgI/Ag) (2) ϕ y (AgBr/Ag) (4) ϕ y (AgCl/Ag) 。
装 订 线 内 请 勿 答 题
14.
按照质子亲和势增加的顺序将下列各碱排序为
20
11
20.
氧化剂为(1)_______________,(2)_______________,(3)________________。 ( ϕ y (Cl2/Cl) = 1.36 V, ϕ y (Br2/Br) = 1.08 V, ϕ y (H2O2/H2O) = 1.78 V,
2 − /Cr3+) = 1.33 V, ϕ y (MnO − /Mn2+) = 1.49 V, ϕ y (F /F−) = 2.87 V ϕ y (Cr2O 7 2 4
南
装 订 线 内 请 勿 答 题
学
10.
在 K2Cr2O7 法测定铁 (无汞) 时, 加入钨酸钠的目的是………………… (
Hale Waihona Puke 化9. 根据配合物的稳定性和酸碱平衡的知识,判断下列反应逆向进行的是( ) + 2− 2− − − − − (A) HgCl 4 + 4I = HgI 4 + 4Cl (B) [Ag(CN)2] + 2NH3 = [Ag(NH3)2] + 2CN + − 3− 2− − (C) [Cu(NH3)4]2+ +4H+ =Cu2+ +4 NH 4 (D) Fe(C 2 O 4 ) 3 3 + 6CN = Fe(CN) 6 + 3 C 2 O 4 − − K 稳 = 1.6 × 1020; Fe(CN) 3 K 稳 = 1.0 × 1042 已知: Fe(C 2 O 4 ) 3 3 6
(2) 其氧化性不变的是____________________________________。
2/
21
2
件
(3) 其氧化性减弱的是____________________________________。
-------------------------------------------------------------------------------------------------------------------------------------------------------------------
− HS−,F−,I−, NH 2
___________,负极是_________________。在 CuSO4 溶液中加入过量氨水,溶 液颜色变为________,这时电动势_____________;在 ZnSO4 溶液中加入过量 氨水,这时电池的电动势_________。
16.
AgClO4 在苯中的溶解性明显高于在烷烃中的溶解性,用 Lewis 酸碱性质对
课
件
芦 昌 盛
考试形式:
闭 卷
(A) E y = 2 ϕ y (Ag+/Ag) – ϕ y (Zn2+/Zn) (C) E y = ϕ y (Ag+/Ag) – ϕ y (Zn2+/Zn)
-------------------------------------------------------------------------------------------------------------------------------------------------------------------
ϕ y (Fe3+/Fe2+) = 0.77 V)
/1
(2) 电池负极反应为________________________________________________; (3) 电池反应为____________________________________________________。 欲把 Fe2+ 氧化到 Fe3+,而又不引入其它金属元素,可以采用的切实可行的
(B) E y = [ ϕ y (Ag+/Ag)]2 – ϕ y (Zn2+/Zn) (D) E y = ϕ y (Zn2+/Zn) – ϕ y (Ag+/Ag)
装 订 线 内 请 勿 答 题
7. 反应 3A2+ + 2B ─→ 3A + 2B3+ 在标准状态下电池电动势为 1.8 V, 某浓度时, y 反应的电池电动势为 1.6 V, 则此时该反应的 lg K 值为…………………… ( ) (A)
18.
订 线 内 请 勿 答 题
下列物种中,亲核试剂是 NH3,Cl−,Ag+,S2-,Al3+
南
装
京
量= 64)____________克。
大
17.
电解硫酸铜溶液时,通过 0.50 F 的电量,在阴极沉积出金属铜(相对原子质
学
此事实作出的解释是
化
学
。 ,亲电试剂是 。
ϕ y = -1.22 V
19.
装 订 线 内 请 勿 答 题
f 区元素以 M(III)亲石形式存在于硅酸盐矿中,按软硬酸碱规则可知这些元 。
素属于 23.
KCr(SO4)2·12H2O 的摩尔质量 = 499 g·mol-1。 ) 25.
− 已知: ϕ y (NO 3 /NO) = 0.96 V, ϕ y (S/S2-) = -0.48 V,Ksp(CuS) = 1.3 × 10-36;
3 × 1.8 0.059
(B)
3 × 1.6 0.059
(C)
6 × 1.6 0.059
−
(D)
6 × 1.8 0.059
(A) 提供离子强度
(B) 配位剂
京
大
Fe 2O3 HCl;滴加SnCl 2 3;Na 2 WO 4 → Fe 2 + + Fe3 + (少量) TiCl → Fe 2 + + Ti 3+ FeO (C) 反应指示剂 (D) 组成缓冲溶液
0.515V
京
3+ 2− 1. 在 Cr2 O 7 + I− + H+ → Cr + I2 + H2O 反应式中,配平后各物种的化学计量 数从左至右依次为……………………………………………………………… ( ) 1 (B) 2,6,28,4,3,14 (A) 1,3,14,2,1 2 ,7 (C) 1,6,14,2,3,7 (D) 2,3,28,4,1 1 ,14 2
气, 写出两个配平的离子方程式,并利用下列 ϕ y 值计算有关的反应的平衡常数。 Cl2 + 2e− = 2Cl− HClO + H+ + e− = 1 2 Cl2 + H2O ClO− + H2O + 2e− = Cl− + 2OH−
京
大
26.
通氯气到熟石灰中可得到漂白粉(Ca(OCl)2),在漂白粉中加入盐酸可得到氯
2/
则(1) 电池正极反应为________________________________________________;
21.
已知:Zn(OH) 4 + 2e − = Zn + 4OH−
21
已知电池:Ag│AgBr│Br−(1 mol·dm-3)‖Ag+(1 mol·dm-3)│Ag
2−
3
原
理
南京大学化学化工学院试卷(A)
2010-2011 学年第一学期《 大学化学 》课程期末考试
院系 化学化工学院 年级 2010 级 姓名 任课教师: 学号
题号 一 二 三 四 五 六 七 八 九 十 总分 得分
阅卷教师
一、选择题 ( 共 10 题
20 分 )
装 订 线 内 请 勿 答 题
3.
11
4.
/1
− + 2+ 2MnO-4 + 5C 2 O 2 + 10CO 2 + 8H 2O 4 + 16 H ⇒ 2 Mn
20
11
请简述滴定过程中温度、酸度、介质和滴定速度对结果的影响。 28. 在 V2O5 存在时,SO2(g) 与过量氧气反应生成 SO3(g) SO2(g) + O2(g) → SO3(g) 此反应是合成硫酸的重要步骤,通过实验观察到如下事实: 若 SO2 浓度为 [SO2],SO3 浓度为 [SO3] 时,反应速率为 v; 当 SO2 浓度为 3[SO2],SO3 浓度为 [SO3] 时,反应速率为 3v; 当 SO2 浓度为 [SO2],SO3 浓度为 3[SO3] 时,反应速率为( 1 / 3 )v;
− y
2/
21
0.159V
南
2.
使 Cr2+ 离子能放出氢的水溶液是………………………………………… ( 3+ 2+ y y (已知: ϕ (Cr /Cr ) = -0.40 V, ϕ (O2/H2O) = 1.23 V) (A) pH = 0 (B) pH = 10 (C) pH = 0 无氧 (D) pH = 7 无氧
− ϕ y ( ClO 3 /Cl−)=…………………………………………………………………(
2Ag + Zn2+ 组成原电池,当[Zn2+]和[Ag+]均为 1 6. 用反应 Zn + 2Ag+ mol·dm-3, 在 298.15 K 时, 该电池的标准电动势 Ey为……………………… ( )
