2019-2020高考化学选择题专题突破2:阿伏伽德罗常数NA word教师版
2020高考化学二轮专题精练专题2 阿伏加德罗常数含答案

2020高考化学二轮专题精练专题2阿伏加德罗常数1.(2019·衡中同卷综合一)设N A表示阿伏加德罗常数的值。
下列说法正确的是() A.1 L 0.1 mol·L-1的AlCl3溶液中所含离子总数为0.4N AB.标准状况下,22.4 L空气中所含原子的总数目为2N AC.向含有等物质的量的氯化铁和氯化铜的混合溶液中加入5.6 g铁粉,充分反应后,置换出铜原子的数目为0.1N AD.1 mol铜与足量浓硫酸反应,转移的电子数为2N A2.(2019·四川名校联考)N A为阿伏加德罗常数的值,下列说法正确的是()A.1 mol C2-2中含有的电子数为10N AB.0 ℃、101 kPa时,22.4 L SO3中含有的氧原子数目为3N AC.25 ℃时,向1 L 0.5 mol/L的CH3COONa溶液中加入醋酸溶液至混合溶液呈中性,则混合溶液中CH3COO-的数目为0.5N AD.将足量的Cu与50 mL 18 mol/L的浓硫酸充分反应,转移的电子数为0.9N A3.(2019·四川三市联考)N A代表阿伏加德罗常数的值。
下列说法正确的是()A.在6.0 g SiO2晶体中,含有的Si—O键数目为0.2N AB.完全燃烧乙酸、葡萄糖混合物6.0 g,消耗的O2数目为0.2N AC.在常温下,1 m3 pH=4的溶液中由水电离出的H+数目为0.1N AD.2.24 L Cl2完全与CH4发生取代反应,生成的HCl数目为0.1N A4.(2019·成都第一次诊断)N A代表阿伏加德罗常数的值。
下列判断正确的是() A.1 L pH=13的Ba(OH)2溶液中含OH-的数目为0.2N AB.46 g CH3CH2OH含C-H键数目为6N AC.4.6 g Na与含0.1 mol CH3COOH的稀醋酸完全反应,转移的电子数为0.1N AD.2.24 L CH4和0.5 mol Cl2充分反应所得混合物中氯原子数为N A5.(2019·成都石室中学模拟)N A代表阿伏加德罗常数的值。
2019高考化学选择题对点专练:2 阿伏加德罗常数

2 阿伏加德罗常数1.(2018·全国卷Ⅰ)N A是阿伏加德罗常数的值。
下列说法正确的是()A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1N AB.22.4 L(标准状况)氩气含有的质子数为18N AC.92.0 g甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A解析:选B Fe(OH)3胶体粒子是若干个Fe(OH)3的集合体,A项错误;氩气是单原子分子,标准状况下,22.4 L氩气的物质的量为1 mol,含有的质子数为18N A,B项正确;92.0 g甘油的物质的量为1 mol,每个甘油分子含有3个羟基,所以1 mol甘油含有的羟基数为3.0N A,C项错误;CH4与Cl2发生取代反应生成的有机物除了CH3Cl以外,还有CH2Cl2、CHCl3和CCl4,生成的CH3Cl分子数小于1.0N A,D项错误。
2.(2018·全国卷Ⅱ)N A代表阿伏加德罗常数的值。
下列说法正确的是()A.常温常压下,124 g P4中所含P—P键数目为4N AB.100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1N AC.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2N AD.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2N A解析:选C124 g P4的物质的量为1 mol,每个P4分子中含有6个P—P键,所以含有P—P键数目为6N A,A项错误;Fe3+在水溶液中能发生水解,100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目小于0.1N A,B项错误;标准状况下,11.2 L甲烷和乙烯混合物的物质的量为0.5 mol,每个甲烷和乙烯分子都含有4个氢原子,所以含有氢原子数目为2N A,C项正确;SO2和O2的化合反应为可逆反应,2 mol SO2和1 mol O2催化反应后,混合气体的物质的量大于2 mol,即分子总数大于2N A,D项错误。
01阿伏加德罗常数(NA)(附答案解析)-2023年高考化学大二轮专题突破

B.1.8g重水(D2O)中所含质子数为NA
C.足量的浓盐酸与8.7gMnO2反应,转移电子的数目为0.4NA
D.32g甲醇的分子中含有C-H键的数目为4NA
5.(2022·浙江6月)NA为阿伏加德罗常数的值,下列说法正确的是()
(1)标准状况下,18gH2O所含的氧原子数目为NA()
(2)常温常压下,3.2gO2所含的原子数为0.2NA()
(3)7 g CnH2n中含有的氢原子数目为NA()
(4)18g冰水混合物中有3NA个原子和10NA个电子NA()
(5)常温常压下,3g甲醛气体含有的原子数是0.4NA()
3.特殊物质中的原子、离子的分析
(5)120g由NaHSO4和KHSO3组成的混合物中含有硫原子NA个()
(7)常温常压下,甲醛和冰醋酸的混合物共6.0g,其中含有的原子总数为0.8NA()
(8)1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA()
(10)28 g的丁烯和环己烷混合气体中所含原子总数为6NA()
6.一定量的物质中共价键(或共用电子对)数目、价层电子对数及杂化方式的分析
HF
NH4+
OH-
-OH
【题型突破4•查漏缺】判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)1.5 g甲基所含有的电子数目为0.9NA()
(2)1 mol碳正离子(CH3+)所含的电子总数为9NA()
(3)常温常压下,1mol碳烯(:CH2)所含的电子数为8NA()
(4)16g CH4与18 g NH4+所含质子数相等()
【题型突破3•查漏缺】判断下列说法是否正确,正确的打“√”,错误的打“×”
高考选择。阿伏伽德罗专题。(含答案解析)

高考选择。
阿伏伽德罗专题。
(含答案解析)1.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
3.6 g D₂O中含有的中子数为2N_A。
B。
10 g C₂H₄和4 g CO组成的混合气体中含有的分子数为0.5N_A。
C。
标准状况下,2.24 L HF中含有的分子数为0.1N_A。
D。
KIO₃与HI溶液反应,生成0.1 mol I₂转移的电子数为0.2N_A。
2.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
标准状况下,22.4 L盐酸含有N_A个HCl分子。
B。
常温常压下,7.8 g Na₂O₂含离子数为0.4N_A。
C。
室温下向1 L pH=1的醋酸溶液中加水,所得溶液中H 数目大于0.1 N_A。
D。
1 mol 乙酸(忽略挥发损失)与足量的 C₂H₅OH 在浓硫酸作用下加热,充分反应可生成N_A个CH₃COOC₂H₅。
3.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列有关叙述正确的是:A。
将 78 g Na₂O₂与过量 CO₂反应转移的电子数为2N_A。
B。
1 mol N₂与4 mol H₂反应生成的 NH₃分子数为2N_A。
C。
标准状况下,2.24 L CCl₄中所含原子数为0.5N_A。
D。
标准状况下,18 g D₂O中所含电子数为9N_A。
4.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
标准状况下,11.2 L的甲醇所含的氢原子数等于2N_A。
B。
常温常压下,Na₂O₂与H₂O反应生成1 mol O₂时,转移电子数是2N_A。
C。
25℃时,Ksp(BaSO₄)=1×10⁻¹³,则 BaSO₄饱和溶液中 Ba 数目为1×10⁻¹³N_A。
2019年高考化学备考全方案12题揭秘专题02阿伏伽德罗常数题型揭秘2019030713
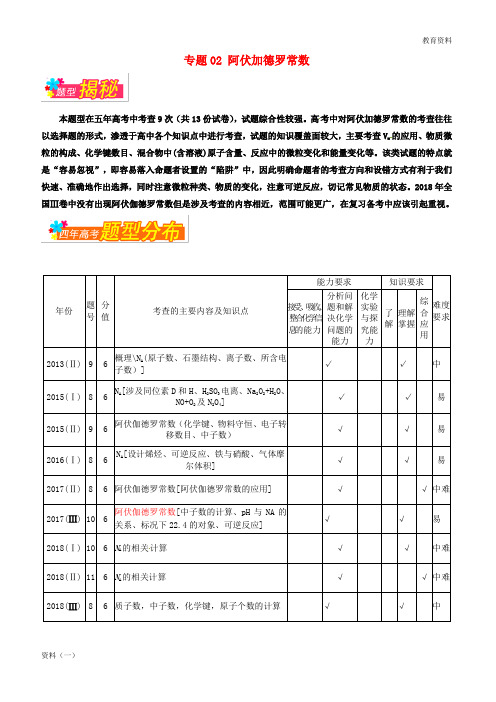
专题02 阿伏加德罗常数本题型在五年高考中考查9次(共13份试卷),试题综合性较强。
高考中对阿伏加德罗常数的考查往往以选择题的形式,渗透于高中各个知识点中进行考查,试题的知识覆盖面较大,主要考查V m的应用、物质微粒的构成、化学键数目、混合物中(含溶液)原子含量、反应中的微粒变化和能量变化等。
该类试题的特点就是“容易忽视”,即容易落入命题者设置的“陷阱”中,因此明确命题者的考查方向和设错方式有利于我们快速、准确地作出选择,同时注意微粒种类、物质的变化,注意可逆反应,切记常见物质的状态。
2018年全国Ⅲ卷中没有出现阿伏伽德罗常数但是涉及考查的内容相近,范围可能更广,在复习备考中应该引起重视。
的相关计算1.【2018新课标1卷】N A是阿伏加德罗常数的值,下列说法正确的是A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB.22.4 L(标准状况)氩气含有的质子数为18N AC.92.0 g甘油(丙三醇)中含有羟基数为1.0N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0N A【答案】B【解析】A、16.25g氯化铁的物质的量是16.25g÷162.5g/mol=0.1mol,由于氢氧化铁胶体是分子的集合2.【2018新课标2卷】N A代表阿伏加德罗常数的值。
下列说法正确的是A.常温常压下,124 g P4中所含P—P键数目为4N AB.100 mL 1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1N AC.标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2N AD.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2N A【答案】C【解析】A.常温常压下,124 g P4的物质的量是1mol,由于白磷是正四面体结构,含有6个P-P键,因此其中所含P—P键数目为6N A,A错误;B.铁离子在溶液中水解,所以100 mL 1mol·L−1FeCl3溶液中所含Fe3+的数目小于0.1N A,B错误;C.甲烷和乙烯分子均含有4个氢原子,标准状况下,11.2 L甲烷和乙烯混合物的物质的量是0.5mol,其中含氢原子数目为2N A,C正确;D.反应2SO2+O22SO3是可逆反应,因此密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数大于2N A,D错误。
高中化学专题03 阿伏伽德罗常数(NA)提分精准突破(解析版)

03 阿伏伽德罗常数(N A)精准突破1. 阿佛加德罗常数与化学核心素养阿佛加德罗常数核心素养体现在“宏观辨识与微观探析,变化观念与平衡思想”。
核心素养生成——结合气体摩尔体积、物质的组成或原子结构、氧化还原反应及电离、水解等基本概念和基本理论以及常用化学计量的相关计算。
从不同视角对纷繁复杂的化学变化进行分类研究,逐步揭示各类变化的特征和规律,从而逐步提高化学核心素养。
阿伏加德罗常数的正误判断一直保持着较高的稳定性与连续性。
预测在2020年高考中,仍会利用阿伏加德罗常数这个载体综合考查相关知识,涉及一定量的物质所含粒子(分子、原子、离子、质子、中子等)数目、氧化还原反应中转移电子的数目、以及由于反应、浓度等的变化导致微粒数目变化等。
本专题包括五个高频微考点:☆N A与气体摩尔体积(22.4L/mol)使用条件的考查☆N A与电子转移数目的考查☆N A与溶液中粒子数目的考查☆N A与隐含反应的考查☆N A与化学键数目的考查2. 阿佛加德罗常数“陷阱”的多维性☆阿佛加德罗常数所涉及的粒子数目的相互转换☆阿佛加德罗常数题常见“陷阱”维度⑴标准状况物质聚集状态难辨别性(标况下非气态如H2O、SO3、HF、CHCl3等)⑵物质组成的特殊性(特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目如Ne、D2O、18O2、H37Cl等)⑶化学反应的隐蔽性(如62 g Na2O溶于水后所得溶液中含有O2−离子数为N A)⑷电子转移数目的难判断性(如5.6 g铁粉与硝酸反应失去的电子数一定为0.3 N A等)⑸物质结构的复杂性(如标准状况下1 mol苯中约含有3N A个碳碳双键;P4分子中P原子和P—P键数目的比为1∶1等)⑹电化学基本知识的模糊性(如铜的电解精炼时,每转移2 mol电子阳极上溶解的铜原子数等于N A;1mol OH-在电解过程中被氧化时,提供电子的数目为N A个)⑺电离与水解中概念的混淆性与数据的缺失性(如1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子数目为N A)⑻化学键数目的难计算性(如在含氧原子的数目为4N A的石英晶体中含有4 mol Si—O键等)3.“类推法”的多维判断突破阿佛加德罗常数题类推法是指通过对已掌握的物质结构、转移电子、气体摩尔体积等常见“设陷方向”形成的解题模型,通过对给出选项的对比,找出它们的相似点或相同点,然后以此为依据,把其中某一对象的有关知识或结论推移到另一对象中去,在较广的范围内把两个(或两类)不同事物联系起来,异中求同,同中求异,形成解决新问题的思路。
2020届高考化学考前突破训练 阿伏加德罗常数及其应用(含解析)

2020届高考化学考前突破训练阿伏加德罗常数及其应用(共40题,每题2.5分,共计100分)1.(2019·河南洛阳模拟)设N A表示阿伏加德罗常数的值。
下列说法正确的是( )A.0.5 mol 雄黄(As4S4),结构如图,含有N A个S—S键B.17 g甲基(—14CH3)所含的中子数为8N AC.标准状况下,33.6 L二氯甲烷中含有氯原子的数目为3N AD.高温下,16.8 g Fe与足量水蒸气完全反应,转移的电子数为0.6N AB 解析As原子最外层有5个电子,能够形成3个共价键,而S原子最外层有6个电子,只能形成2个共价键,根据图示可知,白球表示S原子,黑球表示As原子,雄黄分子中不存在S—S键,A项错误;17 g甲基(—14CH3)的物质的量为1 mol, 每个—14CH3中含有8个中子,所以所含中子的数目为8N A,B项正确;标况下,二氯甲烷为液体,不能使用气体摩尔体积,C项错误;16.8 g铁的物质的量为 0.3 mol,而铁与水蒸气反应后变为+83价,0.3 mol 铁失去0.8 mol 电子,即0.8N A个,D项错误。
2.N A为阿伏加德罗常数的值。
下列说法正确的是( )A.标准状况下,2.24 L苯乙烯中碳碳双键数为0.1N AB.4.6 g Na与足量H2O充分反应,生成气体分子数为0.1N AC.0.l mol MnO2与40 g 36.5%的盐酸加热充分反应,转移电子数为0.2N AD.1 L 0.2 mol/L FeSO4溶液与0.1 mol H2O2反应,溶液中Fe3+数为0.2N AB 解析标准状况下,苯乙烯不是气体,不能用气体摩尔体积计算物质的量,A项错误;4.6 g Na的物质的量为0.2 mol,与足量水反应生成0.1 mol H2,所以生成H2的分子数为0.1N A,B项正确;随着反应进行,盐酸浓度降低,变为稀盐酸,反应不再发生,所以生成氯气的分子数小于 0.2N A,C项错误;溶液中Fe3+水解,所以Fe3+数小于0.2N A,D项错误。
02专题过关检测2阿伏加德罗常数(附答案解析)-2023年高考化学大二轮专题突破

专题过关检测2 阿伏加德罗常数(N A)1.设N A为阿伏加德罗常数的值。
下列说法正确的是()A.1 mol CHCl3含有C—Cl键的数目为3N AB.1 L 1.0 mol·L-1的盐酸含有阴离子总数为2N AC.11.2 L NO与11.2 L O2混合后的分子数目为N AD.23 g Na与足量H2O反应生成的H2分子数目为N A2.N A是阿伏加德罗常数的值。
下列说法正确的是()A.22.4 L(标准状况)氮气中含有7N A个中子B.1 mol重水比1 mol水多N A个质子C.12 g石墨烯和12 g金刚石均含有N A个碳原子D.1 L 1 mol·L-1 NaCl溶液含有28N A个电子3.已知N A是阿伏加德罗常数的值,下列说法错误的是()A.3 g 3He含有的中子数为1N AB.1 L 0.1 mol·L-1磷酸钠溶液含有的PO3-4数目为0.1N AC.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N AD.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A4设N A为阿伏加德罗常数的值,下列说法正确的是()A.17 g —OH中含有的电子数为10N AB.25 ℃时,K sp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5N AC.1 L 1 mol·L-1 CH3COONH4溶液中CH3COO-与NH+4数目均为N AD.含0.5 mol晶胞(如图)的Cu2O晶体中Cu+的数目为2N A5.用N A表示阿伏加德罗常数的值,下列说法正确的是()A.用稀盐酸溶解5.6 g表面锈蚀的铁钉,转移电子数目小于0.2N AB.标准状况下,2.24 L甲醇中含有共价键的数目为0.5N AC.16 g甲烷燃烧,一定能生成N A个CO2D.500 mL 0.1 mol·L-1 NaHS溶液中含有HS-、S2-的总数为0.05N A6.设N A为阿伏加德罗常数的值,下列说法正确的是()A.1 mol SiO2和Si的混合物中含有的化学键数目为2N AB.常温下,1 L pH=1的NaHSO4溶液中含有的氧原子数为0.4N AC.标准状况下,5.6 L F2和C2H6的混合物中含有电子的数目为4.5N AD.含有0.01 mol CH3COO-的CH3COONa溶液中的Na+数目为0.01N A7.设N A为阿伏加德罗常数的值。
2020届高考化学一轮复习阿伏伽德罗常数及其应用作业Word版

阿伏伽德罗常数及其应用一.选择题(共20小题)1.N A是阿伏加德罗常数的值。
下列说法正确的是()A.常温下,11.2LSO2含有的氧原子数小于N AB.0.1 molNa2O2和Na2O的混合物中含有的离子总数等于0.4N AC.10g质量分数为34%的H2O2溶液含有的氢原子数为0.2N AD.100mL0.1mol/L醋酸中含有的醋酸分子数是0.0lN A2.N A代表阿伏加德罗常数的值。
下列有关叙述正确的是()A.常温常压下,1.8g甲基(﹣CD3)中含有的中子数为N AB.2.3g钠被O2完全氧化时,钠得到的电子数目为0.1N AC.9.2g甲苯被酸性KMnO4氧化生成苯甲酸时,反应中转移电子数为0.6N AD.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10﹣9 N A 3.设N A为阿伏加德罗常数的值,下列说法正确的是()A.CrO5中Cr元素的化合价为+6价,每个CrO5分子中存在两个过氧键B.标准状况下,11.2 L Cl2溶于水,溶液中Cl﹣、ClO﹣和HClO的微粒数之和为N A C.密闭容器中2 mol NO与1 mol O2充分反应后,产物的分子数为N AD.常温常压下,0.1 mol NH3与0.1 mol HCl充分反应后所得产物含0.1 N A个分子4.N A代表阿伏加德罗常数的值。
下列判断正确的是()A.1LpH=13的Ba(OH)2溶液中含OH﹣的数目为0.2N AB.46gCH3CH2OH含C﹣H键数目为6N AC.4.6gNa与含0.1 mol CH3COOH的稀醋酸完全反应,转移的电子数为0.1N A D.标况下,2.24LCH4和0.5 molCl2充分反应所得混合物中氯原子数为N A5.设N A表示阿伏加德罗常数的值,下列说法正确的是()A.标准状况下,11.2L SO3中含有的氧原子数为1.5N AB.10g D2O中含有的质子数与中子数分别为5N A和4N AC.1mol乙酸与足量的乙醇发生酯化反应,生成乙酸乙酯的分子数为N AD.室温下,pH=6的(NH4)2SO4溶液中,水电离出的H+浓度为10﹣6mol/L 6.N A为阿伏伽德罗常数值。
2019-2020年高考化学题型步步衔接 专题03《阿伏伽德罗常数及应用》(含解析)

2019-2020年高考化学题型步步衔接专题03《阿伏伽德罗常数及应用》(含解析)【母题来源】xx新课标Ⅱ卷理综化学【母题题文】N A代表阿伏加德罗常数的值。
下列叙述正确的是()A.60g丙醇中存在的共价键总数为10N AB.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1N AC.钠在空气中燃烧可生成多种氧化物。
23g钠充分燃烧时转移电子数为1N AD.235g核互U发生裂变反应:U+nSr+U+10n,净产生的中子(n)数为10N A【答案】C【试题解析】A.60g丙醇的物质的量是1mol,丙醇的结构简式为CH3CH2CH2OH,所以分子中存在的共价键总数为11N A,A错误;B.根据物料守恒可知1L 0.1mol·L-1的NaHCO3溶液中H2CO3、HCO3-和CO32-离子数之和为0.1N A,B错误;C.钠在空气中燃烧可生成多种氧化物,氧化钠或过氧化钠,23g钠的物质的量是23g÷23g/mol=1mol。
钠不论是转化为氧化钠,还是过氧化钠,均失去1个电子,所以钠充分燃烧时转移电子数为1N A,C 正确;D.235g核素U的物质的量=235g÷235g/mol=1mol,根据发生的裂变反应U+nSr+U+10n可知净产生的中子(n)数为9N A,D错误,答案选C。
【命题意图】本题主要是考查阿伏加德罗常数的有关计算,涉及丙醇分子中共价键判断、溶液中物料守恒应用、氧化还原反应中电子转移计算以及核裂变反应等【命题方向】阿伏伽德罗常数为高考的常考题型,以阿伏伽德罗常数为载体,考查物质的量相互转化关系,通常涉及物质结构、氧化还原反应、离子反应、电解质溶液等相关知识。
【得分要点】将分子、原子的结构、相对分子质量或式量、物质质量、摩尔质量、物质的量、物质的量在物质及其所含构成微粒关系式计算中的应用、溶液体积、溶质的物质的量浓度、溶质的物质的量、溶质与水化合即电解质的电离、可逆反应、取值范围、气体摩尔体积、物质的状态、电解质溶液中存在的微粒、钠的燃烧、氧化还原反应、化合价、物质的量在钠与失去电子的关系式计算中的应用等联系起来。
2020年高考化学热点专练二 阿伏加德罗常数(含答案)

热点2 阿伏加德罗常数(限时:30分钟)1.(2019·新课标Ⅱ卷)已知N A是阿伏加德罗常数的值,下列说法错误的是A. 3g 3He含有的中子数为1N AB. 1 L 0.1 mol·L−1磷酸钠溶液含有的34PO-数目为0.1N AC. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N AD. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A【答案】B【详解】A. 3He的中子数为3-2=1,则3g3He的中子数为3g3g/mol AN⨯=NA,A项正确;B. 磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1L 0.1mol/L的磷酸钠溶液中磷酸根离子的个数小于1L×0.1mol/L×N A mol-1 =0.1N A,B项错误;C. 重铬酸钾被还原为铬离子时,铬元素从+6降低到+3,1mol重铬酸钾转移的电子数为3mol×2×N A mol-1 =6N A,C项正确;D. 正丁烷与异丁烷的分子式相同,1个分子内所含共价键数目均为13个,则48g正丁烷与10g异丁烷所得的混合物中共价键数目为48g+10g58g/mol×13×N A mol-1 =13N A,D项正确。
2.(2019·山东省济南外国语学校高考模拟)设N A为阿伏加德罗常数的值。
下列说法正确的是()A. 用惰性电极电解CuSO4溶液一段时间后,若加入29.4 gCu(OH)2能使溶液复原,则电解过程中转移电子的数目为1.2N AB. 常温常压下,0.5 molO3与11.2 LO2所含的分子数均为0.5N AC. 一定条件下,丁烷催化裂化生成1mol乙烯时,消耗丁烷的数目为N AD. 25℃时,1LpH=10的NaHCO3溶液中含有H2CO3的数目为10-4N A【答案】A【详解】A、若加入29.4gCu(OH)2能使溶液复原,则相当于阴极上析出氢气和铜,生成0.3mol铜转移电子个数=0.3mol×2×N A/mol=0.6N A,根据原子守恒知,生成0.3mol水需要0.3mol氢气,生成0.3mol氢气转移电子的个数=0.3mol×2×N A/mol=0.6N A,所以电解过程中共转移电子数为1.2N A,选项A正确;B、常温常压下,11.2L O2的物质的量小于0.5mol,0.5mol O3和11.2L O2的分子数不相等,选项B错误;C、一定条件下,丁烷催化裂化除生成乙烯和乙烷这种均裂外,还会裂解生成甲烷和丙烯,则生成1mol乙烯时,消耗丁烷的数目大于N A,选项C错误;D、25℃时,1LpH=10的NaHCO3溶液中含有H2CO3的数目小于10-4N A,选项D 错误。
2020高考化学二轮专题精练专题2 阿伏加德罗常数包含答案

2020高考化学二轮专题精练专题2阿伏加德罗常数1.(2019·衡中同卷综合一)设N A表示阿伏加德罗常数的值。
下列说法正确的是() A.1 L 0.1 mol·L-1的AlCl3溶液中所含离子总数为0.4N AB.标准状况下,22.4 L空气中所含原子的总数目为2N AC.向含有等物质的量的氯化铁和氯化铜的混合溶液中加入5.6 g铁粉,充分反应后,置换出铜原子的数目为0.1N AD.1 mol铜与足量浓硫酸反应,转移的电子数为2N A2.(2019·四川名校联考)N A为阿伏加德罗常数的值,下列说法正确的是()A.1 mol C2-2中含有的电子数为10N AB.0 ℃、101 kPa时,22.4 L SO3中含有的氧原子数目为3N AC.25 ℃时,向1 L 0.5 mol/L的CH3COONa溶液中加入醋酸溶液至混合溶液呈中性,则混合溶液中CH3COO-的数目为0.5N AD.将足量的Cu与50 mL 18 mol/L的浓硫酸充分反应,转移的电子数为0.9N A3.(2019·四川三市联考)N A代表阿伏加德罗常数的值。
下列说法正确的是()A.在6.0 g SiO2晶体中,含有的Si—O键数目为0.2N AB.完全燃烧乙酸、葡萄糖混合物6.0 g,消耗的O2数目为0.2N AC.在常温下,1 m3 pH=4的溶液中由水电离出的H+数目为0.1N AD.2.24 L Cl2完全与CH4发生取代反应,生成的HCl数目为0.1N A4.(2019·成都第一次诊断)N A代表阿伏加德罗常数的值。
下列判断正确的是() A.1 L pH=13的Ba(OH)2溶液中含OH-的数目为0.2N AB.46 g CH3CH2OH含C-H键数目为6N AC.4.6 g Na与含0.1 mol CH3COOH的稀醋酸完全反应,转移的电子数为0.1N AD.2.24 L CH4和0.5 mol Cl2充分反应所得混合物中氯原子数为N A5.(2019·成都石室中学模拟)N A代表阿伏加德罗常数的值。
专题01 阿伏加德罗常数-2019年高考化学高频考点深度解析Word版含解析

专题一阿伏加德罗常数【考纲要求】1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(V m)、物质的量浓度(c)、阿伏加德罗常数(N A)的含义。
2.能根据微粒(原子、分子、离子)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
3.了解溶液浓度的表示方法。
理解溶液中溶质的质量分数和物质的量浓度的概念,并能进行有关计算。
掌握配制一定溶质质量分数溶液和物质的量浓度溶液的方法。
【考情分析】(1)近五年来全国卷中有关阿伏加德罗常数的题目常以选择题的形式出现(分值6分),但难度不大,以中等难度居多,题目常结合物质结构、盐类水解、可逆反应等知识综合考查,较好地考查了考生的“宏观辨识与微观探析”素养;(2)以物质的量为核心、依据化学方程式的计算题目主要在全国卷Ⅱ中出现(分值6~8分),难度较大,计算题的分值有增多趋势,传递出高考越来越重视对考生“体会定量研究对化学科学的重要作用”的能力要求。
【基础落实】考点1:物质的量与阿伏加德罗常数1.物质的量(n)物质的量是用0.012 kg 12C中所含碳原子数目作为标准来衡量其他微粒集合体所含微粒数目多少的物理量。
物质的量是七个基本物理量之一。
单位:摩尔(mol)注意:1、微粒一般指分子、原子、离子、质子、中子、电子或其特定组合。
2、物质的量只能用于衡量微观物质。
3、物质的量是一个整体,不能拆分或增加。
4、使用物质的量时指代要明确,其后一般跟化学符号。
2.阿伏加德罗常数(N A)(1)定义:1 mol任何微粒所含的微粒数与0.012 kg 12C所含的碳原子数(6.02×1023 mol-1)相等。
6.02×1023 mol-1称为阿伏加德罗常数。
(2)应用:粒子数(N)与物质的量之间的换算。
计算公式为n=NN A注意:N A有单位,其单位为mol-1,该值是一个近似值。
3.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。
2019高考(全国版)化学高考选择题突破 阿伏加德罗常数NA题型(共36张PPT)

4. (2017· 新课标Ⅱ卷)设阿伏加德罗常数的值为 NA。下列说法正确的是( D ) A. 1 L 0.1 mol· L-1NH4Cl 溶液中,NH+ 4 的数量为 0.1NA B. 2.4 g Mg 与 H2SO4 完全反应,转移的电子数为 0.1NA C. 标准状况下,2.24 L N2 和 O2 的混合气体中分子数为 0.2NA D. 0.1 mol H2 和 0.1 mol I2 于密闭容器中充分反应后,其分子总数为 0.2NA
5. (2017· 新课标Ⅲ卷)设 NA 为阿伏加德罗常数的值。下列说法正确的是( A ) A. 0.1 mol 的 11B 中,含有 0.6NA 个中子 B. pH=1 的 H3PO4 溶液中,含有 0.1NA 个 H
+
C. 2.24 L(标准状况)苯在 O2 中完全燃烧,得到 0.6NA 个 CO2 分子 D. 密闭容器中 1 mol PCl3 与 1 mol Cl2 反应制备 PCl5(g),增加 2NA 个 P—Cl 键
P—Cl 键的数目小于 2NA,D 错误。
6. (2016· 新课标Ⅰ卷)设 NA 为阿伏加德罗常数的值。 下列有关叙述正确的是( A ) A. 14 g 乙烯和丙烯混合气体中的氢原子数为 2NA B. 1 mol N2 与 4 mol H2 反应生成的 NH3 分子数为 2NA C. 1 mol Fe 溶于过量硝酸,电子转移数为 2NA D. 标准状况下,2.24 L CCl4 含有的共价键数为 0.4NA
核心突破
能力 1 命题角度
整体与部分的关系 举例 判断正误
+
注意事项 要注意溶质中和溶剂 中都含有的微粒;要 注意是离子还是官能 团;1 mol Na2O2、 CaC2 中所含阴离子
2 O2 2 、C2 分别是 1
(江苏专用)2019届高考化学二轮复习选择题热点3阿伏加德罗常数的应用课件

解析
1
30.0 g 氟化氢的物质的量为 30.0 g÷ 20 g·mol
-
=1.5 mol,含有氟原子的数目为 1.5NA,故 A 正确;标
准状况下, 33.6 L 乙烯与乙炔的混合气体的物质的量为 1.5 mol,且 1 个乙烯或乙炔分子中均含有 2 个碳原子,则混 合物中含有碳原子的数目为 3NA,故 B 正确;50×10
6 .设 NA 为阿伏加德罗常数,下列说法正确的是 ( ) A.常温下,22 g CO2 含碳氧双键数目为 2NA B.12.0 g NaHSO4 固体中含阳离子数为 0.1NA C.标准状况下,22.4 L Br2 中所含分子数为 NA D.7.8 g Na2O2 与足量的水反应转移电子数为 0.2NA
9.设 NA 为阿伏加德罗常数的值。下列有关叙述正 确的是( )
+
A.1.8 g NH4 中含有的电子数为 1.1NA B.2.2 g CO2 和 N2O 的混合气体中原子数为 0.15NA C.1 mol Na2O2 与足量的 CO2 反应,转移电子数为 2NA D.25 ℃、101 kPa 时,2.24 L CH4 含有的共价键数 为 0.4NA
解析
FeCl3 是强酸弱碱盐,Fe 在水溶液中发生水
+ -
3+
解, 若 FeCl3 溶液中 Fe3 的物质的量为 1 mol, 则 Cl 的数 目大于 3NA,A 错误;标准状况下,22.4 L 乙烷的物质的 量为 1 mol,每个乙烷分子中有 7 个共价键,故所含共价 键数目为 7NA,B 错误;根据化学式可知,两种物质中碳、 氢元素的质量之比是 6∶1,含氢元素的质量分数为 12%, 则含碳元素的质量分数为 72%, 所以氧元素的质量分数是 16%,100 g 混合物中氧元素的质量为 16 g,所含氧原子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.(2019·全国卷Ⅱ,8)已知N A 是阿伏加德罗常数的值,下列说法错误的是 A .3 g 3He 含有的中子数为1N AB .1 L 0.1 mol·L −1磷酸钠溶液含有的34PO -数目为0.1N AC .1 mol K 2Cr 2O 7被还原为Cr 3+转移的电子数为6N AD .48 g 正丁烷和10 g 异丁烷的混合物中共价键数目为13N A 答案:B2.(2019·全国卷Ⅲ,11)设N A 为阿伏加德罗常数值。
关于常温下pH=2的H 3PO 4溶液,下列说法正确的是A .每升溶液中的H +数目为0.02N AB .c (H +)= c (42H PO -)+2c (24HPO -)+3c (34PO -)+ c (OH −)C .加水稀释使电离度增大,溶液pH 减小D .加入NaH 2PO 4固体,溶液酸性增强 答案:B3.(2018全国I 卷)N A 是阿伏加德罗常数的值,下列说法正确的是A .16.25 g FeCl 3水解形成的Fe(OH)3胶体粒子数为0.1 N AB .22.4 L (标准状况)氩气含有的质子数为18N AC .92.0 g 甘油(丙三醇)中含有羟基数为1.0N AD .1.0 mol CH 4与Cl 2在光照下反应生成的CH 3Cl 分子数为1.0N A 答案:B4、(2017·全国卷Ⅱ,8)阿伏加德罗常数的值为N A 。
下列说法正确的是( )A .1L0.1mol·L -1NH 4Cl 溶液中,NH +4的数量为0.1N AB .2.4gMg 与H 2SO 4完全反应,转移的电子数为0.1N AC .标准状况下,2.24LN 2和O 2的混合气体中分子数为0.2N AD .0.1molH 2和0.1molI 2于密闭容器中充分反应后,其分子总数为0.2N A 答案:D5.(2017·全国卷Ⅲ,10)N A为阿伏加德罗常数的值。
下列说法正确的是() A.0.1mol的11B中,含有0.6N A个中子B.pH=1的H3PO4溶液中,含有0.1N A个H+C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6N A个CO2分子D.密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加2N A个P—Cl键答案:A6.(2016·全国卷Ⅰ,8)设N A为阿伏加德罗常数值。
下列有关叙述正确的是() A.14g乙烯和丙烯混合气体中的氢原子数为2N AB.1molN2与4molH2反应生成的NH3分子数为2N AC.1molFe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24LCCl4含有的共价键数为0.4N A答案:A7.(2015全国I卷)N A为阿伏伽德罗常数的值.下列说法正确的是()8.(2017·全国卷Ⅱ,8)阿伏加德罗常数的值为N A。
下列说法正确的是() A.1L0.1mol·L-1NH4Cl溶液中,NH+4的数量为0.1N AB.2.4gMg与H2SO4完全反应,转移的电子数为0.1N AC.标准状况下,2.24LN2和O2的混合气体中分子数为0.2N AD.0.1molH2和0.1molI2于密闭容器中充分反应后,其分子总数为0.2N A答案 D9.(2017·全国卷Ⅲ,10)N A为阿伏加德罗常数的值。
下列说法正确的是() A.0.1mol的11B中,含有0.6N A个中子B.pH=1的H3PO4溶液中,含有0.1N A个H+C.2.24L(标准状况)苯在O2中完全燃烧,得到0.6N A个CO2分子D.密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加2N A个P—Cl键答案 A10.(2016·全国卷Ⅰ,8)设N A为阿伏加德罗常数值。
下列有关叙述正确的是()A.14g乙烯和丙烯混合气体中的氢原子数为2N AB.1molN2与4molH2反应生成的NH3分子数为2N AC.1molFe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24LCCl4含有的共价键数为0.4N A答案 A角度一一定量物质中微粒(共价键)数目的判断1.宏观量(m、V)与微粒数的换算公式物质所含微粒(分子、原子、离子、质子、中子和电子等)数目的计算公式为N=n·N A,因此确定微粒数目(N)的前提是确定目标微粒的物质的量(n),以物质的量为中心的化学计量间的换算关系如下:[说明]①物质的量、质量、微粒数目的多少均与温度、压强无关。
②物质的量浓度的大小与所取溶液的体积无关。
2.熟悉每摩常考物质中指定微粒(共价键)数目(1)求微粒数目(2)求共价键数3.判断混合物中指定微粒数目的常用技巧——求同存异例用N A表示阿伏加德罗常数的值,下列叙述正确的是() A.1mol的羟基与1mol的氢氧根离子所含电子数均为9N A B.12g石墨和C60的混合物中质子总数为6N AC.84gNaHCO3晶体中含有N A个CO2-3D.标准状况下,0.1mol己烷中共价键数目为19N A答案 B1.用N A表示阿伏加德罗常数的值,下列说法不正确的是()A.1molF2和Ar所含质子数均为18N AB.标准状况下,2.24L甲烷和氨气的混合气,所含电子数是N AC.14gC n H2n中含有的碳原子数目为N AD.标准状况下,22.4L空气中含有N A个单质分子答案 D2.设N A为阿伏加德罗常数的值,下列叙述不正确的是()A.20gD2O中所含的电子数为10N AB.60gSiO2晶体中含有Si—O键的数目为2N AC.0.2mol金属钠与足量的O2反应,产物中离子数为0.3N AD.1molOD-中含有的质子、中子数均为9N A答案 B3.设N A为阿伏加德罗常数的值,则下列说法不正确的是()A.3.0g甲醛和甲酸甲酯的混合物中含有的原子数为4N AB.8.0gCu2S和CuO的混合物中含有铜原子数为0.1N AC.常温常压下,1.6gO2和O3的混合气体中所含电子数为0.8N AD.常温下,4.4gCO2和N2O混合物中含有的原子数为0.3N A答案 A[新题预测]4.设N A为阿伏加德罗常数的值。
下列叙述正确的是()A.100g含氢元素质量分数为12%的乙烯与乙醛的混合气体中氧原子数为N A B.0.1molCl2与过量稀NaOH溶液反应,转移电子的数目为0.2N AC.常温下,1L0.1mol·L-1Na2SO3溶液中SO2-3的数目一定等于0.1N AD.标准状况下,22.4LCHCl3中含有氯原子数目为3N A答案 A5.用N A表示阿伏加德罗常数的值,下列有关说法中正确的是()角度二阿伏加德罗常数的综合考查1.常考电子转移数目的判断总结2.常考陷阱总结例N A为阿伏加德罗常数的值。
下列说法正确的是()A.1molI-被氧化为I2时失去电子数为2N AB.2L0.5mol·L-1亚硫酸溶液中含有的H+的数目为2N AC.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2N AD.密闭容器中2molNO与1molO2充分反应,产物的分子数为2N A答案 C1.用N A表示阿伏加德罗常数的值,下列说法正确的是()A.密闭容器中46gNO2含有的分子数为N AB.1mol·L-1碳酸钠溶液中Na+的数目是2N AC.0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1N A个胶粒D.V L a mol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023答案 D2.用N A 表示阿伏加德罗常数的值。
下列有关叙述正确的是( ) A .0.5molFe 2+被足量的H 2O 2溶液氧化,转移0.5N A 个电子B .用双氧水分解制取0.1mol 氧气,转移的电子总数为0.4×6.02×1023C .1mol 铁粉在1mol 氯气中充分燃烧,失去的电子数为3N AD .高温下,16.8gFe 与足量水蒸气完全反应失去0.9N A 个电子 答案 A3.N A 表示阿伏加德罗常数的值。
下列说法正确的是( )A .一定条件下,1molN 2和3molH 2混合,反应转移的电子数目为6N AB .1.0L0.1mol·L -1Na 2S 溶液中含有的S 2-数为0.1N AC .1molCu 与含2molH 2SO 4的浓硫酸充分反应,生成的SO 2的分子个数为N AD .向含有FeI 2的溶液中通入适量氯气,当有1molFe 2+被氧化时,该反应转移电子的数目至少为3N A 答案 D4.(2015·全国卷Ⅱ,10)N A 代表阿伏加德罗常数的值。
下列叙述正确的是( ) A .60g 丙醇中存在的共价键总数为10N A B .1L0.1mol·L-1的NaHCO 3溶液中HCO -3和CO 2-3离子数之和为0.1N AC .钠在空气中燃烧可生成多种氧化物,23g 钠充分燃烧时转移电子数为1N AD .235g 核素23592U 发生裂变反应:23592U +10n ――→裂变9038Sr +13654Xe +1010n ,净产生的中子(10n)数为10N A答案 C [新题预测]5.设N A 为阿伏加德罗常数的值,下列说法正确的是( ) A .34g 质量分数为4%的H 2O 2水溶液中含氧原子数目为0.08N A B .反应3H 2(g)+N 2(g)2NH 3(g) ΔH =-92kJ·mol -1,若放出热量4.6kJ ,则转移电子的数目为0.3N AC .常温常压下,28g 乙烯与丙烯的混合气体中含有的碳原子数目无法计算D .6.4gCu 与40mL10mol·L -1浓硝酸作用生成NO 2的分子数为0.2N A答案 B6.设N A 为阿伏加德罗常数的值。
下列说法正确的是( ) A .5.6g 铁与足量稀硝酸反应,转移电子的数目为0.2N A B .标准状况下,22.4L 二氯甲烷的分子数约为N A C .8.8g 乙酸乙酯中含共用电子对的数目为1.4N A D .1L0.1mol·L -1氯化铜溶液中铜离子数为0.1N A答案 C高考12题逐题特训1.设N A为阿伏加德罗常数的值,下列说法正确的是()A.标准状况下,22.4L空气中O2、N2分子总数为N AB.0.1mol羟基中所含电子数为N AC.28g乙烯、丙烯混合气体中所含原子数为6N AD.5.6g铁与硝酸完全反应时转移的电子数为0.3N A答案 C2.N A为阿伏加德罗常数的数值,下列说法正确的是()A.常温常压下,28gN2所含电子数为10N AB.46g钠充分燃烧时转移电子数为2N AC.0.1mol·L-1NH4Cl溶液中Cl-数为0.1N AD.密闭容器中2molNO与1molO2充分反应,产物的分子数为2N A答案 B3.N A为阿伏加德罗常数的值。
