分子空间构型汇总
一些典型分子的空间构型

3、价层电子对互斥理论
(1)理论要点:
对ABm型分子或离子,中心原子A价层电 子对(包括成键电子对和孤对电子)之间存 在排斥力,将使分子中的原子处于尽可能远 的相对位置上,以使各原子之间斥力最小, 分子体系能量最低。
精选ppt
5
(2)模型:
电子对数
目与立体 2
结构
3
4
5
精选ppt
6
6
一个分子或离子中的价层电子对在空间的分布(即含 孤对电子的VSEPR模型)
120°
109028’
空间构型 实例
直线
BeCl2
平面三角形 BF3
四面体形
CH4
精选ppt
3
2.苯分子的空间结构
杂化轨道理论解释苯分子的结构:
C为SP2杂化 C-C (sp2-sp2 ) ; C-H (sp2-s ) 所有原子(12个)处于同一平面 分子中6个碳原子未杂化的2P轨道 上的未成对电子重叠结果形成了 一个闭合的、环状的大π键 形成的π电子云像两个连续的面包圈,一个位于平面上面, 一个位于平面下面,经能量精选计pp算t ,这是一个很稳定的体系。4
型
分子的立体 结构模型
直线形
分子 的空 间构 型
直线形
H2O
22
4
四面体
V形
NH3
314四面体 Nhomakorabea三角锥形
CH2O CH4
30 40
3
平面三角形
4
精选ppt
正四面体
平面三角形
正四面体
13
第2节 共价键与分子的空间构型
第2课时
精选ppt
1
【学习目标】:
1.知道常见分子苯的空间构型; 2.了解价电子对互斥理论的基
常见分子、离子的立体构型

直 线 型:CO 2、C 2H 2、HCN 、BeCl 2、HgCl 2等平面三角形:包括v 型(BF 3、BCl 3、SO 3、CH 2O 、CO 32-等)、平面三角形(SO 2等);常 见 分 子 离 子 的 立 体 构 型编 号分子或离子电 子 式中心原子 axb中心原子上的孤 电 子 对 数 δ键电子对数价层电子对数VSEPR模 型VSEPR 模 型 名 称分子或离子 立 体 构 型分子或离子立体 构 型 名 称杂 化 轨 道 数 杂化轨道类 型实例1CO 2C 4 2 2 0 2 2直线型直线型0+2Sp2SO 3S 6 3 2 0 3 3平面三角形平面三角形 0+3 Sp23CH 2OC 4 3 4/333平面三角形平面三角形0+3Sp24CO 32-C 4+2=6 3 2 0 3 3平面三角形平面三角形 0+3 Sp25SO 2S 6 2 2 1 2 3平面三角形V 型1+2Sp26H 2OO 6 1 2 2 2 4四面体V 型2+2Sp37NH 3N 5 3 1 1 3 4四面体三角锥形1+3Sp38H 3O +O 6-1=5 3 1 1 3 4四面体三角锥形1+3Sp39CH 4C 4 4 1 0 4 4正四面体正四面体0+4Sp3OO Sp 杂化:得到的为直线型;Sp2杂化:得到的为平面三角形;10NH4+N5-1=441044正四面体正四面体0+4Sp3价层电子对=中心原子的孤电子对+δ键电子对数1、中心原子的孤电子对=1/2(a-xb)a:为中心原子的价电子数(原子:价电子数=原子最外层电子书;阳离子:中心原子的价电子数-离子的电荷数;阴离子:中心原子的价电子数+离子的电荷数)。
分子的空间构型2

2
2021/4/9
2
等电子原理
• 1、定义:具有相同价电子数(指全部电子总数 或价电子总数)和相同原子数的分子或离子具有 相同的结构特征。
• 2、利用等电子原理可以判断一些简单分子或离 子的构型,在制造新材料等方面也有重要应用。
• 3、常见的等电子体:①SiCl4 SiO44- SO42② CO2 N2O BeCl2
2021/4/9
3
极性分子和非极性分子
• 正电荷重心和负电荷重心是否重合 • 双原子分子的极性取决于键的极性 • 多原子分子的极性取决于分子的空间构型
◆空间构型对称的是: ⒈AB2型分子:直线型 (CO2 CS2 BeCl2) ⒉AB3型分子:平面正三角形(BF3 SO3) ⒊AB4型分子:正四面体结构(CCl4 CH4 SiCl4) ⒋其他的对称结构:苯分子、乙烯、白磷等
2021/4/9
BeCl2 C2H2 直线型 180°
BF3 NO3平面正三角型 120°
CCl4 CH4 SiCl4 正四面体 109°28′
1
确定分子构型的简易方法
• 1、ABm型分子(A是中心原子,B是配位原子) n是价电子对数(成键电子对和孤电子对)
• 2、公式
中心原子的价电子4/9
5
感谢您的阅读收藏,谢谢!
2021/4/9
6
2021/4/9
4
◆空间结构不对称的是: ⒈AB2型分子:V形或角形(H2O H2S SO2) ⒉AB3型分子:三角锥形(NH3 PCl3 PH3) ⒊AB4型分子:不对称的四面体(CH3Cl CH2Cl2) ⒋注意:H2O2 CH2Cl2 等并不是对称结构。
对于ABm型分子中心原子的化合价的绝对值等 于它的族序数,那么它是非极性分子。
分子立体构型、结构与种类

CH3OH
资料卡片: 形形色色的分子 C60
C20
C40 分子的立体构型、结构和种类
C70
分子的立体构型、结构和种类
分子的立体构型、结构和种类
思考:
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
分子的立体构型、结构和种类
直线形 V形
二、价层电子对互斥理论(VSEPR)- 预测分子的立体结构
价层电子对数
2
3
4
VSEPR模型
直线形 平面三角形
四面体形
5
三角双锥形
6
正八面体形
分子的立体构型、结构和种类
n
2
3
4
价
电
直线 平面三 正四面体
子 对
180 角形 109°28′
0
1200
空
间
M
构
M
M
型
分子的立体构型、结构和种类
(1)如果中心原子无孤电子对,则分子立体
构型与VSEPR模型相同
ABn(n为B原子数) 分子立体构 价层电子对数 型(VSEPR同)
三氟化硼、碳酸根离子、硫酸根离子、硝酸根 离子、甲烷、铵根离子、五氯化磷、六氟化硫
分子的立体构型、结构和种类
4.价层电子对互斥模型(VSEPR模型) 基本要点
分子(或离子)的中心原子周围的价 电子对的几何构型,主要取决于价电 子对数,价电子对尽量远离,使它们 之间斥力最小。
分子的立体构型、结构和种类
2p
sp
两个sp杂化轨道
分子的立体构型、结构和种类
sp杂化轨道的形成过程
z
z
180°
z
z
y
y
分子空间构型

直线形 平面三角形
四面体
三角双锥 八面体
PCl5
SF 6
②LP≠0 :分子的空间构型不同于电子对的空 间构型。 电子对的 分子的 例 VP LP
空间构型 空间构型
3
1 1
2
平面三角形 四面体 四面体 八面体
V形 三角锥 V形 四方锥
SnCl2 NH3 H 2O IF5
4
6
1
2
八面体
平面正方形
XeF4
电子式
:O::C::O: H : O : H
O=C=O
H : N :H H H-N-H H -
:
:
H : C :H
结构式
O
H-O-H
H-C-H
H H : C :H H H H-C-H H : : - -
O: :
: :
: :
:
:
=
中心原子 有无孤对电子
空间结构
无 直线形
有 V形
有 三角 锥 形
无
无
平面 正 三角形 四面体
4 4 4 4
直线形 V形 V型 平面三角形 三角锥形 正四面体 四面体 正四面体 正四面体
SO42-
等电子体原理
具有相同的通式——ABm,而且价电子总数相等的
分子或离子具有相同的结构特征,这个原理称为“等电 子体原理”。这里的“结构特征”的概念既包括分子的 立体结构,又包括化学键的类型,但键角并不一定相等, 除非键角为180或90等特定的角度。
价层电子对互斥理论:
分子的价电子对(包括成键电子对 和孤电子对)由于相互排斥作用,而 趋向尽可能采取对称的空间构型。
价层电子对互斥理论
基本要点: •分子或离子的空间构型与中心原子的 价层电子对数目有关。 价层电子对=成键电子对+孤对电子对 (VP) (BP) (LP) •价层电子对尽可能远离,以使斥力最小。
化学物质的空间构型

化学物质的空间构型在化学领域中,物质的空间构型是指分子中原子的排列方式和相互之间的空间关系。
了解和研究化学物质的空间构型对于理解分子性质、反应机理以及药物合成等方面具有重要意义。
本文将介绍几种常见的化学物质的空间构型及其相关概念。
一、线性构型线性构型是指分子中的原子沿着一条直线排列的方式。
典型的例子是氮气(N2)分子。
在氮气分子中,两个氮原子通过三重键连接,并且在同一条直线上排列。
除了氮气,一些其他的双原子分子,如氧气(O2)和碘气(I2)等,也具有线性构型。
二、平面构型平面构型是指分子中的原子排列在同一个平面内。
一个典型的例子是二氧化碳(CO2)分子。
在二氧化碳中,一个碳原子与两个氧原子通过双键连接,三个原子排列在一个平面上。
此外,苯分子(C6H6)也具有平面构型。
三、三角锥构型三角锥构型是指四个原子通过共享键排列成三角锥形状。
一个典型的例子是氨(NH3)分子。
在氨分子中,一个氮原子与三个氢原子通过共价键连接,氢原子排列在氮原子的周围形成三角锥形状。
四、四面体构型四面体构型是指五个原子通过共享键排列成四面体形状。
一个典型的例子是甲烷(CH4)分子。
在甲烷中,一个碳原子与四个氢原子通过共价键连接,氢原子均匀分布在碳原子的周围,形成一个四面体。
五、八面体构型八面体构型是指六个原子通过共享键排列成八面体形状。
一个典型的例子是硫酸(H2SO4)分子。
在硫酸中,一个硫原子与四个氧原子和两个氢原子通过共价键连接,形成一个八面体。
值得注意的是,以上所介绍的仅仅是化学物质的一些常见空间构型。
实际上,由于原子之间的各种相互作用,化学物质的空间构型有时会变得复杂和多样化。
通过实验技术,如X射线衍射和核磁共振,可以精确确定并确定化学物质的空间构型。
总结起来,化学物质的空间构型对于理解分子结构和性质具有重要作用。
通过研究和掌握不同构型的特点和性质,我们可以更好地理解化学反应的本质,并为药物合成和材料设计等领域的研究提供指导。
常见分子构型及杂化方式

常见分子构型及杂化方式常见分子构型及杂化方式分子或离子配位原子数孤电子对数杂化方式VSEPR模型名称立体构型H2O 2 2 SP3 正四面体V形NH2- 2 2 SP3 正四面体V形NH3 3 1 SP3 正四面体三角锥形H3O+ 3 1 SP3 正四面体三角锥形CH4 4 0 SP3 正四面体正四面体形NH4+ 4 0 SP3 正四面体正四面体形SiCl4 4 0 SP3 正四面体正四面体形SO32- 3 1 SP3 正四面体三角锥形SO42- 4 0 SP3 正四面体正四面体形PO43- 4 0 SP3 正四面体正四面体形CHCl3 4 0 SP3 正四面体四面体形SO2 2 1 SP2 平面三角形V形BF3 3 0 SP2 平面三角形平面三角形SO3 3 0 SP2 平面三角形平面三角形CO32- 3 0 SP2 平面三角形平面三角形NO3- 3 0 SP2 平面三角形平面三角形NO2- 2 1 SP2 平面三角形V形CO2 2 0 SP 直线形直线形BeCl2 2 0 SP 直线形直线形HCN 2 0 SP 直线形直线形ABn型分子空间构型快速判断方法:1. n=2时,中心原子无孤对电子的是直线形,中心原子有孤对电子为V形,如CO2直线形,H2O为V形。
2. n=3时,中心原子无孤对电子的为平面三角形,有孤对电子的为三角锥形。
BF3为平面三角形,H3O+三角锥形。
3. n=4时,为正四面体。
中心原子价电子对数成键电子对数中心原子孤电子对数微粒空间构型实例2 2 0 CO2,BeCl2,HgCl2 33 0 BF3,SO32 1 SnCl2,SO2,O34 4 0 CH4,NH4+ 3 1 NH3,PCl3 2 2 H2O,OF2,ClO25 5 0 PCl5 4 1 SF4 3 2 BrF32 3 XeF2,I3-6 6 0 SF65 1 IF5,XeOF4 4 2 XeF4。
三维化学-简单分子的空间结构
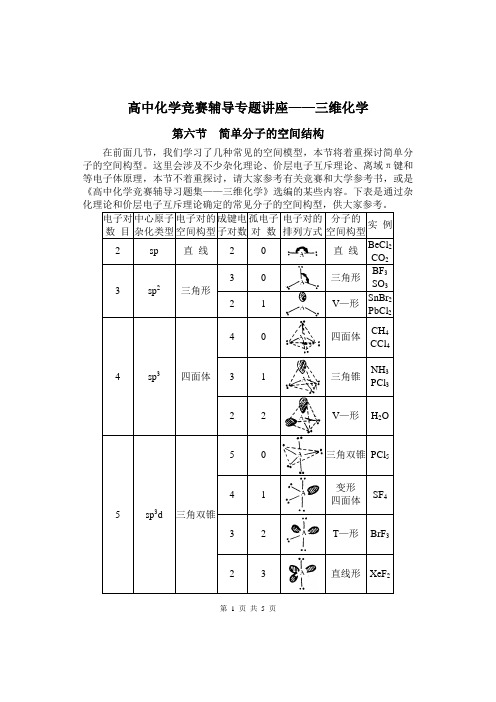
高中化学竞赛辅导专题讲座——三维化学第六节简单分子的空间结构在前面几节,我们学习了几种常见的空间模型,本节将着重探讨简单分子的空间构型。
这里会涉及不少杂化理论、价层电子互斥理论、离域π键和等电子体原理,本节不着重探讨,请大家参考有关竞赛和大学参考书,或是《高中化学竞赛辅导习题集——三维化学》选编的某些内容。
下表是通过杂第 1 页共 5 页【讨论】给出一个分子或离子,我们一般先找出中心原子,确定它的成键电子对数和孤电子对数,判断杂化类型和电子对构型,再判断分子或离子的构型。
由于等电子体具有类似的空间结构,我们也可以据此判断复杂的分子或离子的空间构型。
我们结合以下例题具体讨论。
【例题1】磷的氯化物有PCl3和PCl5,氮的氯化物只有NCl3,为什么没有NCl5?白磷在过量氯气(其分子有三种不同的相对分子质量)中燃烧时,其产物共有几种不同分子。
①【分析】PCl5中心原子P有3d轨道,能与3s、3p轨道一起参与杂化,杂化类型为sp3d,构型为三角双锥。
第二问是通过同位素来考察三角双锥的空间构型:“三角”是一个正三角形的三个顶点,等价的三个点;“双锥”是对称的两个锥顶。
P35Cl5的37Cl的一取代物可在角上和锥顶上2种情况;37Cl 的二取代物可在两个角上、两个锥顶上和一个角一个锥顶上3种情况;利用对称性,三取代物、四取代物与二取代物、一取代物是相同的。
共计有(1+2+3)×2=12种。
【解答】N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5。
12种。
【练习1】PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L,极性为零,P-Cl键长为204pm和211pm两种。
继续加热到250℃时测得压力为计算值的两倍。
PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P-Cl的键长为198pm和206pm两种。
(P、Cl相对原子质量为31.0、35.5)回答如下问题:①180℃下,PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
分子的空间构型

SP3杂化
由1个s轨道和3个p轨道混杂并重新组合成4个能量 与形状完全相同的轨道。由于每个轨道中都含有1/4 的s轨道成分和3/4的p轨道成分,因此我们把这种轨 道称之为 sp3杂化轨道。
为了四个杂化轨道在空间尽可能远离,使轨道间的排 斥最小,四个杂化轨道的伸展方向分别指向正四面体 的四个顶点.
种轨道称之为sp2杂化轨道。
sp2杂化轨道的形成和空间取向示意图
sp2杂化轨道的形成和特点:
由1个s轨道与2个p轨道组合成3个sp2 杂化轨
道的过程称为sp2 杂化。每个sp2 杂化轨道中含有1/3 的s轨道成分和2/3的p轨道成分。
为使轨道间的排斥能最小,3个sp2杂化轨道呈正 三角形分布,夹角为1200。当3个sp2杂化轨道分别与 其他3个相同原子的轨道重叠成键后,就会形成平面 三角形构型的分子。
SP 2 2 180° 直线形 BeCl2 CO2 HgCl2 [Ag(NH3)2]+
SP2 3 3 120° 平面三 角形 BF3 COCl2 NO3— CO32—
SP3 4 4 109.5° 四面体 CH4 CCl4 CHCl3 PO43— 三角 双锥 PCl5 八面体 SF6
价电子 对数目 杂化类 型 理想几 何构型
注:在化合物中以等电子观点看:O- 和F、Cl、NH2相当,O和CH2、NH相当。 则:
NO2 NOCl NO3 NO2 Cl
1个O 换 成 1个Cl
-
1个O 换 成1个Cl
-
CO3 COCl2
CH 3CH 2 CH 3 CH 3OCH 3
第一单元
分子构型与物质的性质
一 分子的空间构型
分子的空间构型 三原子分子的空间构型有直线型和V型两种.如 CO2分子为直线型,而水的空间构型为V型,键角为 104.5°
《分子的空间构型》PPT课件

2、下列各组分子中,都属于含有
极性键的非极性分子的是( C ) 3 A CH4和Br2 B NH3和H2O
4 C C2H4和CO2 D H2S和
C2H2
3 、下列分子中:SO2、SiF4、H2S、 H分2子O2的、NSiHF34、、BPFC3l3,、属BF于3,极属性于分非子极的性有
SO2、H2S、H2O2、NH3、PCl3
[探究一] 用毛皮摩擦的玻璃棒靠近 CCl4液流,观察现象
[探究二] 用上述橡胶棒靠近水流, 观察现象
编辑ppt
7
二、分子的极性
[问题组一]
1.水分子中氧原子和氢原子得电子能力 相比哪个强,为什么?
2.哪个原子带负电荷,哪个原子带正电 荷?
3.正电荷的重心和负电荷的重心分别在空间 的哪个位置,是否重叠?
分子极性
X2Y型 CO2
SO2
极性键
非极性分子
直线型
极性键 角形
极性分子
类型 实例
结构
XY3型 BF3
NH3
键的极性 分子极性
极性键
非极性分子
平面三角形
极性键
极性分子
三角锥形
判断非极性分子和极性分子子 HCl,CO,NO 非极性键→非极性分子 H2,O2,N2
多原子分子
4.四氯化碳和水的空间结构有什么区别?
5.为什么水分子有正负极而四氯化碳不存 在?
水和四氯化碳
编辑ppt
10
二、非极性分子和极性分子
(一) 非极性分子:整个分子的电荷分 布均匀的、正负电荷重心重合的分 子是非极性分子。如: H2、Cl2、N2、 O2等。
二、非极性分子和极性分子
(二) 极性分子:整个分子中电荷分 布不均匀、正负电荷重心不重合的分 子叫做极性分子。 如:HCl、H2O、NH3等。
空间构型

一. 四种基本构型及简单变换:甲烷、乙烯、乙炔、苯1.甲烷的正四面体结构:在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,即甲烷分子中有且只有三原子共面(称为三角形规则)。
当甲烷分子中某氢原子被其他原子或原子团取代时,,可将它看作是原来氢原子位置。
CH 3CH 3左侧甲基和②C 构成“甲烷”分子,此分子中④H 、①C 、②C 构成三角形,同理①C 、②C 、③H 也构成了三角形,即乙烷分子中最多有2个碳原子(①C 、②C )和2个氢原子(③H 、④H )4个原子共面。
CH 3CH 2CH 3其结构式可写成如图2所示。
左侧甲基和②C 构成“甲烷分子”。
此分子中⑤H ,①C ,②C 构成三角形。
中间亚甲基和①C ,③C 构成“甲烷”分子。
此分子中①C ,②C ,③C 构成三角形,同理②C ,③C ,④H 构成三角形,即丙烷分子中最多三个碳原子(①C ,②C ,③C )两个氢原子(④H ,⑤H)五原子可能共面。
2.乙稀的平面结构:乙烯分子中的所有原子都在同一平面内,键角为120°。
当乙烯分子中某氢原子被其他原子或原子团取代时,则代替氢原子的原子一定在乙烯的平面内。
其结构式可写成如图4所示。
三个氢原子(①②③)和三个碳原子(④⑤⑥)六原子一定共面。
根据三角形规则[⑤C ,⑥C ,⑦H构成三角形]。
⑦H 也可能在这个平面上。
最多7原子共面。
同理可推出CH 3CH=CHCH 3至少6个原子,至多8个原子共面。
(CH 3)2C=C(CH 3)2至少6个原子(6个碳原子),至多10个原子共面(6个碳原子和4个氢原子),每个甲基可提供一个氢原子在乙烯平面.3.苯的平面结构苯分子所有原子在同一平面内, 键角为120°。
当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯分子所在平面内。
甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的一个碳原子),5个氢原子(苯环上的5个氢原子)这12个原子一定共面。
分子空间构型汇总

③正离子应减去电荷数,负离子应加上电荷数。
•确定电子对的空间构型: VP=2 直线形
VP=3
VP=4
平面三角形
正四面体
VP=5
VP=6
三角双锥
正八面体
•确定中心原子的孤对电子对数,推断分子 的空间构型。 ① LP=0:分子的空间构型=电子对的空间构型 例如:BeH2
BF3
CH 4
1 VP= 2 (2+2)=2 1 VP= 2 (3+3)=3 1 VP= 2 (4+4)=4 1 VP= 2 (5+5)=5 1 VP= 2 (6+6)=6
探究与讨论:
1、写出H、C、N、O等原子的电子式:
原子 电子式 可形成 共用电子对数 H H· 1 C · · C: 4 N · · N: · 3 O · · O: · · 2
2、写出CO2、H2O、NH3、CH2O、CH4等分子的电子 式、结构式及分子的空间结构:
分子 CO2 H2O NH3 CH2O CH4
电子式
:O::C::O: H : O : H
O=C=O
H : N :H H H-N-H H -
:
:
H : C :H
结构式
O
H-O-H
H-C-H
H H : C :H H H H-C-H H : : - -
O: :
: :
: :
:
:
=
中心原子 有无孤对电子
空间结构ห้องสมุดไป่ตู้
无 直线形
有 V形
有 三角 锥 形
无
无
平面 正 三角形 四面体
价层电子对互斥理论:
分子的价电子对(包括成键电子对 和孤电子对)由于相互排斥作用,而 趋向尽可能采取对称的空间构型。
分子空间构形

(1)线性分子,中心原子为sp杂化,如乙炔。
(2)平面内的分子形如乙烯的,中心原子为sp2杂化。
(3)空间(正)四面体,中心原子sp3杂化,如四氯化碳。
(4)空间六面体(形如两个空间正四面体底对底拼在一起),中心原子为sp3d杂化。
(5)空间八面体(形如两个金字塔底对底拼在一起),中心原子为sp3d2杂化。
相关介绍:
分子的空间构型是指分子中各种基团或原子在空间分布的几何形状。
分子中的原子不是杂乱无章地堆积在一起,而是按照一定规律结合的整体,使分子在空间呈现出一定的几何形状(即空间构型)。
如果确定了某分子内化学键的键长和键角数据,那么这个分子的几何构型就确立了。
1940年美国的Sidgwick N.V.等人相继提出了价层电子对互斥理论,简称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子。
该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用。
这些电子对在中心原子周围按尽可能互相远离的位置排布。
以使彼此间的排斥能最小。
所谓价层电子对,指的是形成σ键的电子对和孤对电子。
孤对电子的存在,增加了电子对间
的排斥力,影响了分子中的键角。
会改变分子构型的基本类型。
分子的空间构型

杂化
O氧子基态
sp3杂化态
H2O分子
课堂思考题:推断、解释NH3的结构?
杂化
N氧子基态
sp3杂化态
NH3分子
H
109.5
C H
H H H
N H H NH3 H H H2O O
CH4
孤电子对数: 0 夹 角:109.5 角:109.5
1 107.3 107.3 三角锥
2 104.5 104.5 V形
中心原子A的价电子数+每个配位原子B提供的价电子数×m 中心原子 的价电子数+每个配位原子 提供的价电子数× 的价电子数 提供的价电子数
2
分子空间构型 实例 BeCl2 CO2、HgCl2 BF3 BCl3 CH4 NH3 H2O CCl4 PCl3 H2S
价电子 对数 成键电子对数 孤电子对数
2 3
空间结构: 正四面体
结论:在CH 结论:在CH4、NH3和H2O分子中,中心 原子都取sp 原子都取sp3杂化,其夹角随孤电子对数 的增加而减少。
2. 确定分子空间构型的其它方法 实验方法:红外光谱、晶体的X衍射、 ⑴实验方法:红外光谱、晶体的X衍射、核磁共振 ⑵确定分子空间构型的简易方法——价电子对互斥理论 确定分子空间构型的简易方法——价电子对互斥理论 —— n= =
杂化轨道的要点
原子形成分子时, 原子形成分子时,是先杂化后成键 同一原子中不同类型、 同一原子中不同类型、能量相近的原子轨道参与杂化 杂化前后原子轨道数不变 杂化后形成的杂化轨道的能量相同 杂化后轨道的形状、 杂化后轨道的形状、伸展方向发生改变 杂化轨道参与形成σ 杂化轨道参与形成σ键,未参与杂化的轨道形成π键 未参与杂化的轨道形成π
乙炔中的碳原子为SP杂化 分子呈直线构型 杂化, 乙炔中的碳原子为 杂化,分子呈直线构型。 1)sp杂化 ) 杂化
分子的空间构型(课件PPT)

是( )
A.CO2与SO2 C.BeCl2与BF3
B
B.CH4与NH3 D.C2H2与C2H4
课堂练习
2、对SO2与CO2说法正确的是( ) D
A.都是直线形结构 B.中心原子都采取sp杂化轨道 C.S原子和C原子上都没有孤对电子 D.SO2为V形结构, CO2为直线形结构
课堂练习
3、指出中心原子可能采用的杂化轨道类型,并预测分 子的几何构型。 (1)PCl3 (2)BCl3 (3)CS2
价层电子对数 2
3
4
5
6
电子对排布方 直线形 平面三角 四面体 三角双 八面体
式
形
锥
二、价层电子对互斥理论的应用实例
(一) CH4 的空间构型
在CH4 中,C 有4个电子,4个H 提供4个电 子,C 的价层电子总数为8个,价层电子对为4 对 。C 的价层电子对的排布为正四面体,由于 价层电子对全部是成键电子对,因此 CH4 的空 间构型为正四面体。
2s
2p 激发 2s
2p
C的基态
H
C
H
H
H
激发态
109°28’
正四面体形 sp3 杂化态
等性sp3 杂化
原子形成分子时,同一个原子中能量相近的一个 ns 轨道与三个 np 轨道进行混合组成四个新的原子轨道称为 sp3 杂化轨道。
SP2
等性sp2 杂化
同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为
BeCl2分子形成
2p 2s
2p 2s
激发
直线形 杂化
Be基态
Cl
180
Be Cl
激发态
键合
sp杂化态 直线形
高中化学空间构型公式总结

高中化学空间构型公式总结
空间构型是指分子中各原子的空间排列方式,对于化学反应的进行和化学性质的表现非常重要。
以下是高中化学中常见的空间构型公式总结:
1. 线性构型:分子中只有两个原子共面排列的构型,可用AX2类型代表。
2. 三角平面构型:分子中有三个原子共面排列的构型,可用AX3类型代表。
3. 均三角锥构型:分子中有四个原子排列成四面体的构型,可用AX4类型代表。
4. 二面角构型:分子中有四个原子排列成二面角的构型,可用AX3E或AX2E2类型代表。
5. 八面体构型:分子中有六个原子排列成八面体的构型,可用AX6类型代表。
6. 正四面体构型:分子中有五个原子排列成正四面体的构型,可用AX4E类型代表。
以上是高中化学中常见的空间构型公式总结,掌握这些构型可以帮助我们更好地理解化学反应和化学性质。
- 1 -。
第二节分子的空间构型-精品

在线练习 根据乙炔分子结构,试用杂化轨道理论分析乙炔 分子的成键情况
乙炔中碳以sp杂 化,C=C中一个
σ和两个π
CH 4
SiCl 4
NH 3 PH 3
HH22OS
4
杂化轨道数=价层电子对数
在线练习
分子 中心原 或 子的价 离子 电子对
数
SiCl4 4
中心原 子的孤 对电子 对数
0
中心原子
VSEPR模型 分子的空间 的杂化轨
名称
构型
道类型
正四面体 正四面体 SP3
CO2
2
0 直线
直线
SP
BF3
3
0 平面三角形 平面三角形 SP2
.H. H C. . H
H HCH
4
0
H
H
.. ..
.. ..
H2O
.. H O. . H
O HH
2
2
..
NH3
H N. . H H
HNH H
3
1
立体结构
分析思考:
甲烷分子中碳原子的价电子构型为2s22p2,若C 原子以1个2S轨道和3个2P轨道,分别与 四个H原子的1S轨道重叠成键,所形成的四 个共价键能否完全相同?
2p
2s
SP3杂化
注意:杂化轨道用于形成σ 键或容纳未参与成键的孤 电子对
杂化轨道理论要点
ns,np
1、在形成多原子分子的过程中,中心原子中能量相 近的原子轨道可以混合起来重新组合形成新的原子 轨道 杂化轨道 2、杂化前后原子轨道数目不变 3、杂化后原子轨道能量相同但前后能量发生变化
4、杂化后原子轨道形状发生变化
5、杂化后原子轨道伸展方向发生变化
分子空间构型汇总

探究与讨论:
1、写出H、C、N、O等原子的电子式:
原子
H
电子式
H·
可形成
共用电子对数
1
C ·C·:
4
N ·N··:
3
O ·O···:
2
2、写出CO2、H2O、NH3、CH2O、CH4等分子的电子 式、结构式及分子的空间结构:
分子 电子式
CO2
H2O
:O::C::O: H :O : H
:: : :
Cl
分子构型 Al
Cl
Cl
三角形
S
S
H
H HO
O
NH
O
H
H
N
O
O
V字构型 三角锥 正四面体 V字形
F F
F
T字形
小结:
中心原子 无孤对电子
价层电子对互斥模型
代表物
中心原子 结合的原子数
分子类型
空间构型
CO2
2
CH2O
3
CH4
4
AB2
直线形
AB3
平面三角形
AB4
正四面体
中心原子
H2O
有孤对电子
2
AB2
思考感悟 2.手性碳原子有什么特点?
【提示】 连接四个不同的原子或基团的碳原 子称为手性碳原子。
具有手性的有机物,是因为其含有手性碳原子 造成的。如果一个碳原子所连的四个原子或原 子团各不相同,那么该碳原子称为手性碳原子, 用*C表示,如:
R1、R2、R3、R4 是互不相同的原子
或原子团。所以,判断一种有机物是否具有手 性异构体,就看其含有的碳原子是否连有四个 不同的原子或原子团。
具有相同的通式——ABm,而且价电子总数相等的 分子或离子具有相同的结构特征,这个原理称为“等电子 体原理”。这里的“结构特征”的概念既包括分子的立 体结构,又包括化学键的类型,但键角并不一定相等, 除非键角为180或90等特定的角度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)CO2、CNS–、NO2+、N3–具有相同的通式—AX2, 价电子总数16,具有相同的结构—直线型分子,中心原 子上没有孤对电子而取sp杂化轨道,形成直线形s-骨架, 键角为180,分子里有两套34p-p大键。
价层电子对互斥理论
基本要点:
•分子或离子的空间构型与中心原子的 价层电子对数目有关。
价层电子对=成键电子对+孤对电子对
(VP)
(BP)
(LP)
•价层电子对尽可能远离,以使斥力最小。
推断分子或离子的空间构型的具体步骤:
•确定中心原子的价层电子对数, 以AXm为例 (A—中心原子,X—配位原子) :
Cl
分子构型 Al
Cl
Cl
三角形
S
S
H
H HO
O
NH
O
H
H
N
O
O
V字构型 三角锥 正四面体 V字形
F F
F
T字形
小结:
中心原子 无孤对电子
价层电子对互斥模型
代表物
中心原子 结合的原子数
分子类型
空间构型
CO2
2
CH2O
3
CH4
4
AB2
直线形
AB3
平面三角形
AB4
正四面体
中心原子
H2O
有孤对电子
2
AB2
VP=1/2[A的价电子数+X提供的价电子数×m
原则:
±离子电荷数(
负 正
)]
①A的价电子数 =主族序数;
②配体X:H和卤素每个原子各提供一个价
电子, 规定氧与硫不提供价电子;
③正离子应减去电荷数,负离子应加上电荷数。
•确定电子对的空间构型: VP=2 直线形 VP=3 平面三角形 VP=4 正四面体 VP=5 三角双锥 VP=6 正八面体
例如:SF4 VP=5 LP=1 F
F F
SF
F F
LP-BP(90o)
3
S
F F
2
结论:LP占据水平方向三角形, 稳定 分子构型为变形四面体(跷跷板形)。
电子对的
VP LP 空间构型 5 1 三角双锥 5 2 三角双锥 5 3 三角双锥
分子的
例
空间构型
变形四面体 SF4
T形
ClF3
直线形
XeF2
结构式
O=C=O H-O-H
中心原子
有无孤对电子 无
有
空间结构
直线形 V 形
-
::
NH3
H:N :H H
H-N-H H
有 三角 锥形
=
O: :
CH2O
::
H :C :H O
H-C-H
:: --
CH4
H H:C :H
H H H-C-H H
无
无
平面 正 三角形 四面体
价层电子对互斥理论:
分子的价电子对(包括成键电子对 和孤电子对)由于相互排斥作用,而 趋向尽可能采取对称的空间构型。
(3)判断共价分子结构的实例
例 1 利用价层电子对互斥理论判断下列分子和离子的几何 构型。要求写出价层电子总数、对数、电子对构型和分子构型 。
AlCl3 H2S
SO32 - NH4 +
NO2
IF3
解:总数 对数
电子对构型
6
8
8
8
3
4
4
4
三角形 正四面体 正四面体 正四面体
5 3
三角形
10 5
三角双锥
探究与讨论:
1、写出H、C、N、O等原子的电子式:
原子
H
电子式
H·
可形成
共用电子对数
1
C ·C·:
4
N ·N··:
3
O ·O···:
2
2、写出CO2、H2O、NH3、CH2O、CH4等分子的电子 式、结构式及分子的空间结构:
分子 电子式
CO2
H2O
:O::C::O: H :O : H
:: : :
(2)CO32–、NO3–、SO3等离子或分子具有相同的通 式—AX3,总价电子数24,有相同的结构—平面三角形分 子,中心原子上没有孤对电子而取sp2杂化轨道形成分子 的s-骨架,有一套46p-p大键。
(3)SO2、O3、NO2–等离子或分子,AX2,18e,中心 原子取sp2杂化形式,VSEPR理想模型为平面三角形,中 心原子上有1对孤对电子(处于分子平面上),分子立体 结构为V型(或角型、折线型),有一套符号为34的p-p 大键。
•确定中心原子的孤对电子对数,推断分子 的空间构型。
① LP=0:分子的空间构型=电子对的空间构型
例如:BeH 2
1
VP= 2 (2+2)=2
直线形
1
BF3 VP= 2 (3+3)=3
平面三角形
CH 4
1
VP= 2 (4+4)=4
四面体
PCl 5
1
VP= 2 (5+5)=5
三角双锥
SF6
1
VP= 2 (6+6)=6
(4)SO42–、PO43–等离子具有AX4的通式,总价 电子数32,中心原子有4个s-键,故取sp3杂化形式,
呈正四面体立体结构;
(5)PO33–、SO32–、ClO3–等离子具有AX3的通式, 总价电子数26,中心原子有4个s-轨道(3个s-键和1 对占据s-轨道的孤对电子),VSEPR理想模型为四面 体,(不计孤对电子的)分子立体结构为三角锥体, 中心原子取sp3杂化形式,没有p-pp键或p-p大键, 它们的路易斯结构式里的重键是d-p大键。
八面体
②LP≠0 :分子的空间构型不同于电子对的空
间构型。
电子对的
VP LP 空间构型
分子的 空间构型
例
3 1 平面三角形 V形
SnCl2
4 1 四面体
三角锥
NH3
2 四面体
V形
H2O
6 1 八面体
四方锥
IF52 八面体平正方形 XeF4VP = 5,电子对空间构型为三角双锥,
LP占据轴向还是水平方向三角形的某个 顶点?原则:斥力最小。
形形色色的分子
O2
HCl
H2O
CO2
C2H2 NH3
CH2O P4
CH4
CH3CH2OH CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
思考:
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
同为四原子分子,CH2O与 NH3 分子的的空间 结构也不同,什么原因?
分子的极性
1.极性分子:正电荷重心和负电荷重心不重合 的分子称为极性分子。
2.非极性分子:正电荷重心和负电荷重心重合 的分子称为非极性分子。
V形
NH3
3
AB3
三角锥形
应用反馈:
化学式
HCN SO2 NH2- BF3 H3O+ SiCl4 CHCl3 NH4+
SO42-
中心原子 孤对电子数
0 1 2 0 1 0 0 0 0
中心原子结合的原 子数
空间构型
2
直线形
2
V形
2
V型
3
平面三角形
3
三角锥形
4
正四面体
4
四面体
4
正四面体
4
正四面体
等电子体原理
