手性配体1_4_双_9_O_奎宁_2_3_二氮杂萘的简便合成方法
手性农药的合成PPT课件

C2H5
H
H2N
COOH
O
O CH2OH
MeOH,SOCl2
C2H5
Cl-H3N
H COOCH3
C2H5
CH2HN
H
CH2=CH(3OH
COOCH3
C2H5
O CH2HN
H
ClCOOCCl3
COO(CH2)3CH=CH2 imidazole
C2H5
O CH2 N
H
COO(CH2)3CH=CH2
16.2 手性农药的发展及特点
手性农药的使用已有很长的历史。烟草中的烟碱(Ⅰ)是一 种杀虫剂,早在1585年,英国就开始投放使用烟草,1700年, 其水提物就用于防治园艺植物上的蚜虫,Mayor在1904年就 确认了烟碱对映异构体毒性的差异。1910年,硫酸烟碱上市 销售,成为当时最为通用的杀虫剂。鱼藤根中的鱼藤酮(Ⅱ)也 是一种重要的杀虫剂,其杀虫活性在1895年分离出鱼藤酮之 前早已为中国人所知,自第一次世界大战前它就被用来防治 蚜虫和毛虫。除此之外,早期重要的商品化产品还有除虫菊 素(Ⅲ)。
1、从光学活性化合物(手性合成子)出发经化学反 应制取光学活性农药的方法
由手性合成子起始合成手性农药是直接合成法中的一种方
法,它是以手性合成子为原料,通过一系列的立体化学控制反 应而最终得到手性产物。手性合成子是从易得的手性前体中衍 生出来,带来天然的手性结构 。如(S)-α-氨基丁酸为起始原 料合成稻瘟酯的异构体。
手性过渡金属催化剂在农药的不对称合成中有比较广泛的 应用。Novartis公司开发的不对称催化氢化合成S-异丙甲草胺 和R-甲霜灵的技术这可以看作是不对称合成中的一个里程碑。 用38g[Ir(COD)Cl]2催化剂前体和62g手性二茂铁配体,可在2h 内将10t底物转化成S构型的中间体,e.e.值超过80%,催化效 率大于106,已经超过了生物酶。
手性化合物制备的方法

化合物的两个对映体之间不仅具有不同的光学性质和物理化学性质, 而且它们具有不同的生物活 性, 比如在药理上, 药物作用包括酶的抑制、 膜的传递 、 受体结合等均和药物的立体化学有关 ; 手性 药物的对映体的生物学活性、 毒性 、 代谢和药物素质完全不同 。 手性化合物的制备已成为当前国 内外较热门的研究课题之一。 本文从非生物法和生物法两个方面较全面地综述了手性化合物的 制备方法, 希望为相关研究者提供参考。 关键词 手性化合物 制备 立体化学 手性是自然界最重要的属性之一, 分子手性识 别在生命活动中起着极为重要的作用。同一化合物 的两个对映体之间不仅具有不同的光学性质和物理 化学性质 , 而且它们具有不同的生物活性, 比如在药 理上, 药物作用包括酶的抑制、 膜的传递、 受体结合 等, 均和药物的立体化学有关 ; 手性药物的对映体的 生物学活性、 毒性、 代谢和药物素质完全不同。获得 手性化合物的方法, 不外乎非生物法和生物法两种。 1 非生物法 非生物催化主要是指采用化学控制等手段来获 得手性化合物, 它主要包括以下几方面 : 1. 1 不对称合成法制备手性化合物 手性合成已经历过相当长的历史, 但早期的科 学研究仅限于对天然产物的化学改性, 没有商业价 值。不对称合成需在反应体系中引入不对称因素 , 如手性试剂、 催化剂等。在底物分子上引入手性辅 助基团控制反应立体选择性, 需要大量手性物质, 操 作繁琐。因此化学计量型不对称合成除应用廉价天 然手性源外, 均难以工业应用。 60 年代后期出现的手性配体过渡金属络合物 催化的不对称合成, 明显优于化学计量不对称合成。 它仅用少量手性催化剂即可将大量前手性底物对映 体选择性地转化为手性产物。经过 20 多年研究已 发展成最经济有效地合成手性物质的一种方法。现
[6]
手性配体 Quinine-奎宁 金鸡纳碱 手性碱

别名 (6-Methoxy-4-quinolyl)(5-vinyl-1-azabicyclo[2.2.2]oct-2-yl)methanol产品名称 奎宁; 无水奎宁; 金鸡纳碱; 金鸡纳霜; (6-甲氧基-4-喹啉基)(5-乙烯基-1-氮杂双环[2.2.2]辛烷-2-基)甲醇 分子结构CAS 登录号130-95-0cinchona alkaloid 金鸡纳属生物碱奎宁(Quinine ),俗称金鸡纳霜,茜草科植物金鸡纳树及其同属植物的树皮中的主要生物碱。
化学称为金鸡纳碱,分子式C 20H 24N 2O 2。
1820年P.-J.佩尔蒂埃和J.-B.卡芳杜首先制得纯品。
用途医疗上应用它的几种盐类,作为解热与及防治各种疟疾,但愈后容易复发。
副作用不少,主要为耳鸣、重听、头昏、恶心、呕吐等,统称金鸡纳反应。
硫酸奎宁和盐酸奎宁均是味道极苦的白色结晶,前者微溶于水,供口服,后者易溶于水,供注射用。
优奎宁(Euquininum )是奎宁的乙基碳酸酯,几乎无味的白色晶体,可供儿童口服用。
奎宁也是通宁水的原料。
关于奎宁有一则流传很广的故事说,1638年当时秘鲁总督的夫人金琼(Condessa de Chinchon )染上间日疟,由统治安地斯地区的西班牙省长带来了一些金鸡纳树树皮磨成的粉。
据当地的原住民告诉省长,这种树皮可以退烧,结果真的有效。
后来女伯爵把这帖药带回故乡西班牙,当时疟疾在欧洲大陆肆虐,这种树皮粉就成为欧洲人首次能有效治疗疟疾的药品[1]。
但经历史研究发现,可能根本无此事,总督夫人没得过疟疾。
奎宁治疗疟疾的最有效的形式被发现于1737年,1820年二位法国化学家佩尔蒂埃(Pelletier )与卡芳杜(Caventou ),从规那(quia )的树皮中单离出来,将之称为奎宁或金鸡纳霜(quinine ),名称来自印加土语的树名quina-quina 。
1850年左右开始大规模使用.1693年,法国传教士洪若翰曾用金鸡纳霜治愈康熙帝的疟疾。
《手性药物合成》课件

生物合成
利用生物代谢途径合成手性药 物。这种方法通常比化学合成 节省能量和时间。
纳米技术合成
纳米技术可用于制备更为精确 的手性药物,包括手性纳米药 物、手性碳纳米管和手性金属 纳米粒子的制备。
化学合成
1
不对映选择性的化学反应
不对映选择性的化学反应,通常只能
对映选择性的化学反应
2
得到手性混合物,需要经过分离和纯 化。
手性药物的重要性
活性和副作用
手性药物中,左右两种异 构体的药效和副作用可能 截然相反。
区别
左旋和右旋异构体在结构 上不同,对人体的作用也 不同。
选择性
选择性是药物相对于不同 的目标蛋白具有的特异性。 选择性可能对治疗和副作 用都产生影响。
手性药物的合成方法
化学合成
通过化学反应制备手性药物, 包括转化选用对映体和合成特 定对映体两种方法。
手性药物合成
手性药物被广泛地应用于医学领域,但其合成过程充满挑战。这个课程将介 绍手性药物的基础知识、不同的合成方法和未来的发展方向。
什么是手性药物
手性分子
在手性分子中,左右两侧的结 构是成镜像对称的。
手性中心
手性中心是一个分子中,一个 原子团连接四个不同的基团的 碳原子。
左旋和右旋异构体
左旋和右旋异构体分别是一种 左旋结构和右旋结构,二者的 构型互为镜像对称。
实例
青霉素和龙胆酸是生物合成类手性药物的代表性例子。
纳米技术合成
1
手性纳米药物合成
通过纳米技术合成手性药物,减小颗
手性碳纳米管的应用
2
粒尺寸,提升溶解度。
利用手性碳纳米管对蛋白质和小分子
进行分离和拆分,提高手性分析的方
有机化学基础知识点手性化合物的分离与合成

有机化学基础知识点手性化合物的分离与合成有机化学基础知识点:手性化合物的分离与合成手性化合物在有机化学领域中扮演着重要的角色,它们具有两种非对称的镜像异构体,即左旋和右旋。
手性化合物的分离与合成是有机化学中的一项重要技术和研究内容。
本文将探讨手性化合物的分离与合成的基础知识点。
一、手性化合物的分离方法1. 基于手性配体的手性柱层析法手性柱层析法是一种基于手性配体与目标分子之间的亲和性进行分离的方法。
通过选择适当的手性配体,可以实现对手性化合物的分离纯化。
例如,利用氨基酸衍生物作为手性配体,可以成功地分离出手性氨基酸和手性药物等。
2. 经典拆分结晶法经典拆分结晶法是一种通过晶体生长的方式分离手性化合物的方法。
通过合适的溶剂和配体选择,可以在晶体生长过程中实现手性化合物的拆分和纯化。
这种方法适用于一些具有较高拆分度的手性化合物。
3. 手性萃取法手性萃取法是一种利用手性选择性较大的手性萃取剂对手性化合物进行分离的方法。
通常通过控制温度、pH值和萃取剂浓度等条件,实现对手性化合物的选择性萃取。
手性萃取法在手性酮、手性醇以及手性药物等的分离中得到了广泛应用。
二、手性化合物的合成方法1. 左旋-右旋互换法左旋-右旋互换法是一种将一种手性化合物转化为其对映异构体的方法。
通常可通过二氧化硫气体的作用,将左旋手性化合物转化为右旋手性化合物,或者通过酸碱反应进行互换。
这种方法在手性药物和手性农药的合成中得到了广泛应用。
2. 手性催化剂的应用手性催化剂是一种能够选择性地促使手性化合物发生反应的催化剂。
通过催化剂的选择,可以实现手性化合物的不对称合成。
例如,手性金属配合物催化剂在不对称氢化和不对称还原反应中起到了关键作用。
3. 有机合成中的修饰法有机合成中的修饰法是一种通过对已有手性分子进行化学修饰,合成新的手性分子的方法。
通过对已有手性分子的保留或改变官能团,可以得到一系列具有不同手性的化合物。
这种方法在新药开发和杂环合成中得到了广泛应用。
有机化学中的手性化合物合成

有机化学中的手性化合物合成手性化合物是指具有非对称碳原子的有机分子,它们的镜像异构体无法通过旋转或平移相互重叠。
手性化合物在生物学、医药学和材料科学等领域具有重要的应用价值。
因此,手性化合物的合成研究一直是有机化学的热点之一。
手性化合物的合成方法多种多样,其中最常用的方法是手性诱导合成。
手性诱导合成是通过引入手性辅助剂或手性催化剂来实现手性化合物的合成。
这种方法的优点是反应条件温和,产率高,选择性好。
手性辅助剂可以通过与底物形成手性中间体,然后再通过去除手性辅助剂来得到手性产物。
手性催化剂则是通过催化剂与底物之间的手性识别来实现手性化合物的合成。
另一种常用的手性化合物合成方法是不对称合成。
不对称合成是通过选择性反应、不对称催化剂或不对称试剂等手段来实现手性化合物的合成。
选择性反应是指在合成过程中,通过调节反应条件和反应物的比例,使得反应只在特定的位置或特定的立体异构体上发生。
不对称催化剂则是指通过选择性催化剂来实现手性化合物的合成。
不对称试剂则是指通过选择性试剂来实现手性化合物的合成。
此外,手性化合物的合成还可以通过手性分离来实现。
手性分离是指将手性化合物中的两个对映异构体分离开来。
常用的手性分离方法包括晶体分离、色谱法和电泳法等。
晶体分离是指通过晶体生长的方法将手性化合物中的两个对映异构体分离开来。
色谱法是指通过在手性色谱柱上进行分离来实现手性化合物的分离。
电泳法是指通过在手性电泳胶上进行分离来实现手性化合物的分离。
在有机化学中,手性化合物的合成是一个复杂而有挑战性的过程。
合成手性化合物需要克服立体障碍,控制反应条件和选择合适的合成方法。
同时,手性化合物的合成也需要考虑到环境友好性和经济性等因素。
因此,有机化学家们在手性化合物的合成研究中不断探索新的方法和策略。
总之,有机化学中的手性化合物合成是一个重要的研究领域。
通过手性诱导合成、不对称合成和手性分离等方法,有机化学家们可以合成出各种各样的手性化合物。
喹啉及喹喔啉类衍生物的合成

喹啉及喹喔啉类衍生物的合成喹啉与喹喔啉类衍生物已成为药物合成中十分重要的抗生素类分子,由于其广泛的抗菌活性及结构复杂,对于药物生产具有重要意义。
本文旨在简要介绍喹啉及喹喔啉类衍生物的合成方式,说明合成过程中可能面临的问题以及可能改进的方法。
喹啉与喹喔啉类衍生物的合成通常包括以下步骤:首先,通过金属催化的共价加成反应,将含氮酸酐与2-氨基-6-氯降冬酚分子通过位交换反应相互作用,形成6,7-二氢喹唑酮。
2-氨基-6-氯降冬酚的氯从其邻位分离,生成2-氨基-5-氯降冬酚。
然后将2-氨基-5-氯降冬酚与另一种拟选定的氯化物经过位交换反应后,通过润滑反应及离子交换反应,进行甲基化催化反应,转化为6,7-二氢喹啉。
最后,通过常压乙烯基取代反应,可以得到6,7-二甲基喹啉。
在进行喹啉及喹喔啉类衍生物合成过程中,可能会遇到以下问题: 1、反应条件最佳化。
通常情况下,金属催化的共价加成反应需要用到高温的条件,以达到更高的催化效果。
然而,高温条件会导致底物及产物的氧化或变性,影响反应结果,因此必须要对反应条件进行最佳化调整,以尽量减少有毒废物的生成。
2、反应材料的选择。
合成喹啉及喹喔啉类衍生物的反应材料必须按照规定的比例,以确保产物的质量。
同时,由于反应材料的金属含量会影响反应效果,所以必须选用质量优良的反应材料,保证反应质量。
3、收率问题。
合成喹啉及喹喔啉的反应收率可能会受到底物的水解、氧化、变性等因素的影响,导致收率降低或产物含量变化。
因此,必须采取措施来解决这些问题,提高反应收率。
为了改善反应条件,提高反应得率及产物质量,可以采取以下措施:1、采用新型催化剂和反应条件,利用新型催化剂及反应条件,可以最大限度地提高反应活性,同时减少有害物质的残留;2、采用新型催化材料,新型催化材料可以促进共价加成反应的有效率;3、采用溶剂萃取技术,溶剂萃取技术可以提高产物收率;4、采用包合物作为催化剂,包合物催化剂可以提高反应的选择性;5、采用连续反应技术,连续反应技术可以缩短反应时间,提高反应效率;6、采用协同催化技术,协同催化技术可以提高反应效率,并可减少有机溶液污染。
奎宁和辛可宁衍生物的合成及其在不对称双羟化反应中的催化作用

奎宁和辛可宁衍生物的合成及其在不对称双羟化反应中的催化作用作者:何炜,刘鹏,金瑛,辛春艳,张生勇【关键词】奎宁;辛可宁;不对称双羟化反应【Abstract】 AIM: To synthesize 2 novel chiral ligands derived from cinchona alkaloids and study their catalytic performance in asymmetric dihydroxylation (AD) of 5 olefins. METHODS: Inexpensive quinine and cinchonine were transformed to 9NH2quinine and9NH2cinchonine, which reacted with 4chlorobenzoyl chloride to afford 2 novel chiral ligands. The AD reactions of olefins were performed inH2OtBuOH (1∶1) using the 2 ligandsK2OSO2(OH)4 as catalysts. RESULTS: The applications of the 2 ligands in AD of 5 olefins produced 5 corresponding chiral diols, respectively in 87%-95% yields and 76%-93% enantiomeric excess. CONCLUSION: 2 novel stable chiral ligands were synthesized by simple and inexpensive methods. When they were used in catalytic AD, high yields and enantiomeric excess of the products were observed.【Keywords】 quinine; cinchonine; asymmetric dihydroxylation【摘要】目的:合成两种新的金鸡纳生物碱类衍生物配体并将其用于催化五种烯烃的不对称二羟化反应,考察催化效果. 方法:以价廉易得的奎宁和辛可宁为原料,经过结构转换得到9氨基奎宁和9氨基辛克宁,进而与对氯苯甲酰氯反应制得两种新型手性配体,并将其用于锇催化的烯烃的不对称双羟化反应. 结果:在五种烯烃的不对称双羟化反应中,化学产率为87%~95%,对映体过量值为76%~93%. 结论:两种对氯苯甲酰胺类新型手性配体合成方法简便、成本低廉、性质稳定,对烯烃的不对称二羟化反应有较强的催化活性和光学选择性.【关键词】奎宁;辛可宁;不对称双羟化反应0引言不对称二羟基化反应(asymmetric dihydroxylation,AD)是一类重要的催化不对称反应[1],它不仅是许多手性药物,如紫杉醇C13侧链、美托洛尔、普萘洛尔、氨苄青霉素、昆虫激素和维生素D活性代谢物合成中的关键步骤[2],而且还为不对称催化反应中新型配体的合成提供了必需的手性砌块[3].研究该反应的核心问题之一是手性配体的设计与合成.迄今为止,文献已经报道了许多行之有效的配体,但是有些配体制备复杂、分离难度大、价格昂贵,因此设计合成简单,价廉和高效的手性配体仍然是目前的研究重点[4].本研究以天然金鸡纳生物碱奎宁和辛可宁为原料,将其结构中的活性基团羟基转换为碱性更强的氨基,与对氯苯甲酰氯反应得到新的手性配体1和2(图1),考察这两种配体在AD 反应中的催化活性及不对称诱导作用.1材料和方法材料奎宁,辛可宁(上海化学试剂二厂,德国进口试剂分装);叠氮化钠(西安试剂厂,化学纯);甲磺酰氯,对氯苯甲酰氯(Acros试剂);甲磺酰胺,(E)二苯乙烯,苯乙烯,α甲基苯乙烯,(E)β甲基苯乙烯,β萘乙烯,锇酸钾(Aldrich试剂);其余试剂为国产AR.或PC.级试剂,用前均经纯化处理. XRC1显微熔点仪(四川大学科学仪器厂),温度计未经校正;PERKINELMER 343型自动旋光仪(美国PE公司);INOVA400型核磁共振波谱仪(美国VARIAN),未作特殊说明者均以CDCl3为溶剂,TMS为基准物质; Apex II和ZABHS型质谱仪(美国Bruker);III型元素分析仪(德国Viro EL);600E型高效液相色谱仪(美国Waters)(Turbochrom数据处理;检测波长220 nm);Chiralcel OJ, OD, OBH, AD,ODH手性色谱柱(日本Daicel).方法奎宁甲磺酸酯的制备按文献[5]的方法,在250 mL的三口瓶中,加入g(12 mmoL)奎宁,70 mL四氢呋喃(经钠和二苯甲酮回流处理过)和7 mL三乙胺.上述反应混合液冷至0℃,慢慢滴加 mL (12 mmoL)甲磺酰氯的10 mL四氢呋喃溶液.滴加完毕后,0℃反应 h,再室温反应4 h直到反应完全(薄层层析监测).抽滤,减压蒸除滤液中的四氢呋喃,余物用1 mol/L HCl酸化至pH=5,水相用乙酸乙酯萃取3次,无水硫酸镁干燥.蒸除乙酸乙酯溶剂后得油状粗产物,粗产物再经快速柱层析(Et2O/MeOH=9∶1)得白色晶体2a g,产率为90%(图2).氨基脱氧奎宁的制备将奎宁甲磺酸酯溶于27 mL DMF中,加入NaN3 (420 mg, mmol),85~90℃搅拌21 h.向反应液中加入20 mL水,用30 mL乙酸乙酯萃取3次.有机层再用水洗,无水硫酸镁干燥.减压蒸除溶剂得红色胶状物.将上述粗产物溶解在绝对甲醇中( mmol/mL),加入催化量的10% Pd/C,室温下用高纯H2常压催化氢化直到反应完全(TLC检测).反应液经短的中性Al2O3填充柱过滤,滤去不溶物,并旋转蒸除溶剂.余物经快速柱层析(EtOAc/MeOH=10∶1)分离得淡黄色油状物9氨基脱氧奎宁,产率为82%(图2).手性配体1的合成将9氨基脱氧奎宁(485 mg, mmol)溶于25 mL二氯甲烷和10 mL三乙胺中,0℃下慢慢滴加对氯苯甲酰氯溶液(25 mg, mmol溶于5mL THF中).滴加完毕,继续室温搅拌,用薄层层析跟踪反应(展开剂为乙酸乙酯∶甲醇=9∶1)直到反应完全(约需要46 h).反应完毕后,向反应液中加入25 mL 二氯甲烷稀释,有机相用10%的碳酸钠水溶液洗3次(20 mL×3),无水碳酸钠干燥.蒸除溶剂后,油状粗产物经快速柱层析(EtOAc/MeOH=10∶1)得白色固体,即为手性配体1,450 mg,产率81%(图2).手性配体2的合成以辛可宁为原料,按照上述方法合成手性配体2.手性配体1和2催化的烯烃不对称双羟化反应于50 mL三颈瓶中加入 g (3 mmol)K3[Fe(CN)6], g(3 mmol)K2CO3, mmol配体, mg ( μmol)K2OsO2(OH)4,95 mg CH3SO2NH2(1 mmol)(端烯不加),1 mmol烯烃,6 mL水和6 mL叔丁醇,0℃搅拌反应,薄层层析检测反应进程. 反应完全后,加入 g Na2SO3,搅拌1 h,加入10 mL乙酸乙酯,搅拌分层.水层用乙酸乙酯萃取(15 mL×3) ,合并有机层,用2 mol/L KOH 10mL洗涤(端烯不用KOH),再用水洗至中性,无水MgSO4干燥,减压浓缩,硅胶柱层析分离(正己烷/乙酸乙酯=7∶3)(图3).催化反应结果的评价方法催化反应的结果是由反应产物的对映体过量值来衡量的. 本研究所选烯烃经不对称双羟化反应所得手性二醇的对映体过量值是按照文献[9]由高效液相色谱测定.2结果手性配体1的波谱数据该物质熔点为110~112℃,总率为60%,[α]20D 为+ (c=,CHCl3). IR(KBr)ν(cm-1):3420,2938,2870,1650,1586,1475. 1H NMR:δ~(m,1 H),~(m,4 H),~(m,1 H),~(m, 4 H),(s,3 H), (m,2 H),(ddd,J=,, Hz,1 H),(m,2 H),~ (m, 9 H), (d,J=,1 H). MS (EI): m/z= 461,322,306,160,82.手性配体2的波谱数据该物质熔点为133~135℃,总产率43%. [α]20D为+ (c=,CHCl3). IR(KBr)ν(cm-1):3320,2935,1640,1515. 1H NMR:δ~ (m,1 H),~ (m,4 H),~ (m,1 H),~(m,5 H), (m,2 H), (br s,1 H),(m,1 H),~ (m,9 H),(d,J=,1 H), (d,J=,1 H). MS(EI): m/z = 7,276,262,157,136,105.不对称催化反应的结果手性配体1和2在锇酸钾的存在下,对5种烯烃进行了不对称二羟化反应.结果显示,这两种新型手性配体都可以有效地催化不对称双羟化反应,对5种烯烃均表现出高的催化活性(化学产率为87%~95%)和不对称诱导作用(对映体过量值为76%~93%)(表1).表1手性配体1和2催化的烯烃不对称双羟化反应3讨论烯烃的不对称双羟化反应经过近十年的发展已取得重大发展,具有良好催化效果的配体主要是金鸡纳生物碱衍生物类手性配体.在讨论配体的构效关系时, Kolb等[6]曾指出C9位的氧原子对于配体与四氧化锇的结合是必需的,当其被碳原子取代时,配合物稳定性会显著下降. 本研究将金鸡纳生物碱9位氧原子用氮原子取代,并在9N位引入芳香取代基,所得配合物性质稳定,在不对称双羟化反应中亦表现出良好的催化活性和对映选择性.另外,通过对配体1和2的催化反应进行比较,我们也发现喹啉环上的甲氧基有利于提高反应速度和立体选择性,这一结论与Kolb等[7]所揭示的规律相符.总之,本研究以价廉易得的天然金鸡纳生物碱奎宁和辛可宁为原料,以温和的反应条件简便地合成了两种适合不对称双羟化反应的手性配体,为烯烃AD反应的配体家族增加了两个新成员,与Jacobsen等[8]报道的类似配体对氯苯甲酸奎宁酯相比,所得手性配体1和2催化的双羟化反应化学产率高,立体选择性也提高了近10个百分点.【参考文献】[1]李月明,范青华,陈新滋.不对称有机反应[M]. 北京:化学工业出版社,20XX: 93-108.[2]郑虎.药物化学[M]. 5版,北京:人民卫生出版社,20XX: 105-110.[3] Cheng SK, Zhang SY, Wang PA, et al. Homogeneous catalytic asymmetric dihydroxylation of olefins induced by an efficient and recoverable polymerbound ligand QNAQNOPEGOMe[J]. Appl Organometal Chem, 20XX, 19: 975-979.[4]张生勇,郭建全.不对称催化反应[M]. 北京:科学出版社,20XX: 93-95.[5] Rper S,Franz MH,Hoffmann MR. Preparetion of enantiopure 1azabicyclo[]nonanes functionalized at carbon C3, from cinchonine and cinchonidine[J]. J Org Chem, 20XX, 68: 4944-4946.[6] Kolb HC,Andersson PG,Sharpless KB. Toward an understanding enantioselectivity in the osmium catalyzed asymmetric dihydroxylation Kinetics[J]. J Am Chem Soc, 1994, 116(4):1278-1291.[7] Kolb HC, van Nieuwenhze MS, Sharpless asymmetric dihydroxylation[J]. Chem Rev, 1994, 94: 2483-2547.[8] Jacobsen EN, Marko I, Mungall WS, et al. Asymmetric dihydroxylation via ligandaccelerated catalysis [J]. J Am Chem Soc,1988, 110(6): 1968-1970。
手性化合物合成方法
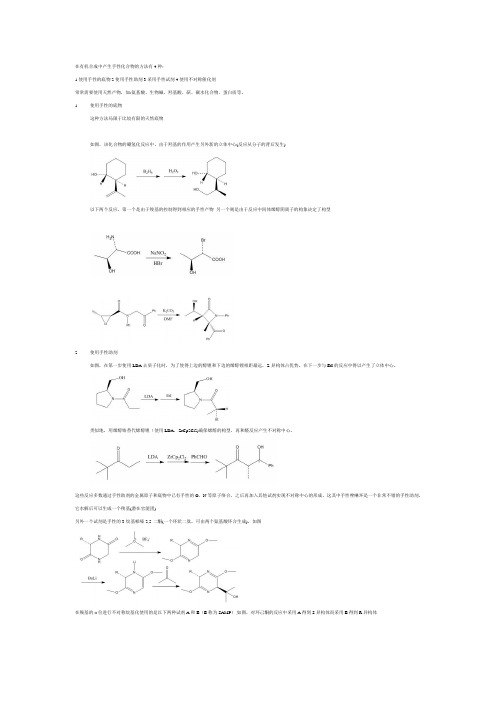
在有机合成中产生手性化合物的方法有4种:1.使用手性的底物2.使用手性助剂3.采用手性试剂4.使用不对称催化剂常常需要使用天然产物,如:氨基酸、生物碱、羟基酸、萜、碳水化合物、蛋白质等。
1.使用手性的底物这种方法局限于比较有限的天然底物如图,该化合物的硼氢化反应中,由于羟基的作用产生另外新的立体中心(反应从分子的背后发生)以下两个反应,第一个是由于羧基的控制得到相应的手性产物..另一个则是由于反应中间体烯醇阴离子的构象决定了构型2.使用手性助剂如图,在第一步使用LDA去质子化时,为了使得上边的醇锂和下边的烯醇锂相距最远,Z-异构体占优势,在下一步与EtI的反应中得以产生了立体中心。
类似地,用烯醇锆替代烯醇锂(使用LDA,ZrCp2Cl2)确保烯醇的构型,再和醛反应产生不对称中心。
这些反应多数通过手性助剂的金属原子和底物中已有手性的O、N等原子络合,之后再加入其他试剂实现不对称中心的形成。
这其中手性唑啉环是一个非常不错的手性助剂,它水解后可以生成一个羧基(潜在官能团)另外一个试剂是手性的3-烷基哌嗪-2,5-二酮(一个环状二肽,可由两个氨基酸环合生成),如图在羰基的α位进行不对称烷基化使用的是以下两种试剂A和B(B称为SAMP),如图,对环己酮的反应中采用A得到S异构体而采用B得到R异构体.在氨基的α位进行不对称烷基化使用的试剂如下二图,用胺和它们作用后再用LDA、MeI甲基化,最后用N2H4脱去助剂得到产物.还有一些有趣的反应如脯氨酸的α烷基化,涉及到一个立体化学的"存储"问题,经历了一个消失和再产生的过程::手性亚砜的作用:分离得到手性亚砜试剂和卤代烷作用后在下一步反应中诱导手性基团的产生,Al/Hg可以方便地除去亚砜基团。
3.采用手性试剂通过铝锂氢化物与手性二胺或氨基醇作用可以得到一个用于不对称还原的试剂。
如图。
利用α-蒎烯和9-BBN作用得到的试剂是一个很好的不对称还原试剂.如图不对称硼氢化反应也是一个很好的构造立体化学中心的反应。
合成金鸡纳生物碱衍生物的简便方法

合成金鸡纳生物碱衍生物的简便方法南鹏娟;陈晶;孙晓莉【摘要】以CaH2为缚酸剂,DMF为溶剂,金鸡纳生物碱通过3,6-二氯哒嗪或1,4-二氯-2,3-二氮杂萘桥连,高产率地合成了用作手性配体的13个金鸡纳生物碱衍生物,其结构经NMR确证.%Thirteen cinchona alkaloid derivatives as chiral ligand were synthesized from cinchona alkaloid using 3,6-dichloro-pyridazine or 1,4-dichloro-2,3-phthalazone as bridged reagent in the presence of CaH2 in DMF under mild condition. The structures were confirmed by NMR.【期刊名称】《合成化学》【年(卷),期】2011(019)005【总页数】4页(P667-670)【关键词】金鸡纳生物碱;哒嗪;二氮杂萘;手性配体;缚酸剂;合成【作者】南鹏娟;陈晶;孙晓莉【作者单位】陕西师范大学化学与材料学院陕西西安710062;陕西师范大学化学与材料学院陕西西安710062;第四军医大学化学系,陕西西安710062【正文语种】中文【中图分类】O629.3;O643.32锇催化的不对称双羟化(AD)反应及不对称氨羟化(AA)反应是2001年诺贝尔化学奖获得者Sharpless教授于1988年和1996年首次报道的两类重要的催化不对称反应[1,2]。
AD和AA反应分别是合成手性连二醇和手性β-氨基醇的最重要的方法之一[3]。
目前该反应已成功地应用于紫杉醇C13侧链、大环抗癌药物、氨苄青霉素、昆虫激素、维生素D活性代谢物等的合成[4~6]。
影响这两种反应工业化的一个关键因素是手性配体,这也是近年来各国科学家研究的一个热点。
手性药物的制取及合成方式分析

1 引言手性制药是医药行业的前沿领域,2001年诺贝尔化学奖就授予分子手性催化的要紧奉献者。
自然界里有很多手性化合物,这些手性化合物具有两个对映异构体。
对映异构体很像人的左右手,它们看起来超级相似,可是不完全相同。
当一个手性化合物进入生命体时,它的两个对映异构体通常会表现出不同的生物活性。
关于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效乃至是有害的。
手性制药确实是利用化合物的这种原理,开发出药效高、副作用小的药物。
在临床医治方面,服用对映体纯的手性药物不仅能够排除由于无效(不良)对映体所引发的毒副作用,还能减少药剂量和人体对无效对映体的代谢负担,对药物动力学及剂量有更好的操纵,提高药物的专一性。
因此具有十分广漠的市场前景和庞大的经济价值。
目前世界上利用的药物总数约为1900 种手性药物占50%以上,在临床经常使用的200种药物中,手性药物多达114种。
全世界2001年以单一光学异构体形式出售的市场额达到1 472亿美元,相较于2000年的1 330亿美元增加了10%以上。
估量手性药物到2020年销售额将达到2 000亿美元。
2、手性药物的制取方式一样可通过从天然产物中提取、外消旋体拆分法获取手性药物,最近几年来,随着合成法的进展和先进分析技术的显现,愈来愈多的手性化合物可通过化学合成法取得不对称合成己成为获取手性物质的重要手腕,与此同时,随着生物技术的不断进步和生物技术与有机化学的交叉融合也使得生物合成成为手性药物生产取得冲破的关键技术。
2.1 从天然产物中提取在某些生物体中含有具有生理活性的天然产物,可用适当的方式提取而得得手性化合物,某些手性药物是从动植物中提取的氨基酸、萜类化合物和生物碱。
如: 具有极强抗癌活性的紫彬醇最初是从紫彬树树皮中发觉和提取的。
2.2 外消旋体拆分法通过拆额外消旋体在手性药物的获取方式中是最经常使用的方式。
目前为止报导的拆分方式有机械拆分法、化学拆分法、微生物拆分法和晶种结晶法等。
1,4-双(9-O-奎宁)-2,3-二氮杂萘的合成及其在烯烃不对称二羟基化反应中的应用

1,4-双(9-O-奎宁)-2,3-二氮杂萘的合成及其在烯烃不对称二羟基化反应中的应用孙晓莉;匡永清;南鹏娟;张生勇【期刊名称】《高等学校化学学报》【年(卷),期】2003(024)007【摘要】通过改进的文献方法制备1,4-双(9-O-奎宁)-2,3-二氮杂萘[(QN)2PHAL]. 在碱性条件下, 奎宁与1,4-二氯-2,3-二氮杂萘之间的亲核取代反应以72%的化学产率生成(QN)2PHAL. 在4种烯烃的不对称二羟基化反应中, (QN)2PHAL表现出很高的对映选择性(83%~92% e.e.)和催化活性(产率83%~93%).【总页数】3页(P1216-1218)【作者】孙晓莉;匡永清;南鹏娟;张生勇【作者单位】第四军医大学化学教研室,西安,710032;第四军医大学化学教研室,西安,710032;第四军医大学化学教研室,西安,710032;第四军医大学化学教研室,西安,710032【正文语种】中文【中图分类】O621【相关文献】1.手性配体3,6-双(9-O-二氢奎尼丁)哒嗪的合成及其在烯烃不对称氨羟化反应中的催化性能 [J], 程司堃;张生勇;李晓晔;姜茹;南鹏娟2.1,4-双(9-O-奎宁)-2,3-二氮杂萘-OsO4催化烯烃的不对称氨羟化反应 [J], 程司堃;匡永清;路丽华;李晓晔;张生勇3.双奎宁基间苯二甲酸酯的合成及其催化烯烃不对称双羟基化反应的初步研究 [J], 张克胜;孙君坦;何炳林4.3,4─二甲基─2─苯基─1,4─氧氮杂■─5,7─二酮在不对称合成中的应用 [J], 杨晓升5.手性配体1,4-双(9-O-奎宁)-2,3-二氮杂萘的简便合成方法 [J], 王巧峰;孙晓莉;姜茹;张生勇因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 实验部分 111 主要仪器与试剂
XR21 显微熔点仪 , 温度计未经校正 ; Varian Inova2400型 核 磁 共 振 波 谱 仪 ; Bruker Apex Ⅱ和 ZAB2HS 型质谱仪 。
[5]a. 孙晓莉 ,匡永清 ,南鹏娟 ,等. [J ]. 高等学校化学学 报 ,2003 ,24 (7) :191021912. b. 程司 . [J ]. 高等学校化学学报 ,2004 ,25 (4) :7582761.
[6 ]Motorina I R , Crudden C M. [J ] . Organic Letters , 2001 , 3 (15) :232522328.
来讲 ,NaH 的量增多有利于二聚体生成 。
3 结论 以 1 ,42二氯22 ,32二氮杂萘和奎宁为原料 ,以
NaH 为缚酸剂 ,以 DMF 为溶剂 ,通过控制原料配 比和反应时间 ,可以顺利合成 1 ,42双 (92O2奎宁) 2 2 ,32二氮杂萘 ,并可以用乙酸乙酯重结晶方法纯 化 。方法简便 、产率高 ,为大量生产该配体提供了 方便 、可行的方法 。
156190 , 147138 , 144175 , 141195 , 132137 , 131160 ,
127120 , 122180 , 122160 , 122147 , 121196 , 118149 ,
114139 ,101190 ,77122 ,60114 ,56173 ,55173 ,42168 , 39190 ,27172 ,23185 ,15129 。MS ( FAB) , m/ z :77511 (M + H + ) ,30712 ,13611 。
通过 TLC 监测发现 ,反应时间短以单代物为 主 ,有原料剩余 ,延长时间二聚体增加 。 213 NaH 量的影响
NaH 的量也影响单代与双代产物比例 。一般
A simple method for the synthesis of 1 ,42bis( 92O2quininyl) phthalazine WANG Qiao2feng , SUN Xiao2li 3 , JIANG Ru , ZHANG Sheng2yong ( Chemistry Deparment of The Fourth Mili2 tary Medical University , Xi′an 710032) , Huaxue Shiji ,2004 ,26 (2) ,65~66 Abstract :The chiral ligand 1 ,42bis (92O2quininyl) phthalazine was prepared in a high yield under mild conditions ,which used DMF as solvent in the presence of NaH. The pure product was re2 crystallized by ethyl acetate. This provides a simple way to syn2 thesize the chiral ligand in a large scale. Key words :1 , 42bis ( 92O2quininyl ) phthalazine ; chiral ligand ; synthesis
奎宁 ( 北京化学试剂公司德国进口分装) ; 1 ,42 二 氯22 , 32二 氮 杂 萘 ( 自 制 ) ; NaH ( Merck2 Schuchardt 公司) ; N , N2二甲基甲酰胺 (天津化学 试剂二厂) ,使用前无水处理 。 112 实验方法 11211 1 ,42二氯22 ,32二氮杂萘的合成
[7 ]Amberg W ,Bennani Y L ,Chadha R K,et al. [J ] . J . Org. Chem. ,1993 ,58 :8442849.
2 结果与讨论 211 投料比的影响
作者在尝试重结晶方法过程中发现 ,有少量 的奎宁存在 ,就直接影响重结晶 。因此投料时要 严格控制 1 ,42二氯22 ,32二氮杂萘和奎宁物质的 量比为 111∶2 ,以防奎宁剩余过多 ,不易重结晶 。 212 反应时间的影响
第 26 卷第 2 期
王巧峰等 :手性配体 1 ,42双 (92O2奎宁)22 ,32二氮杂萘的简便合成方法
65
研究报告与简报
化学试剂 ,2004 ,26 (2) ,65~66
手性配体 1 ,42双( 92O2奎宁)22 ,32二氮杂萘的 简便合成方法
王巧峰 ,孙晓莉 3 ,姜茹 ,张生勇
(第四军医大学 化学教研室 ,陕西 西安 710032)
H2C C) ; 3193 ( s ,6H , CH3O) ; 3150 ( m , 2H) ; 3113 (m , 4H) ; 2160 ( m , 4H) ; 2126 ( s , 2H) ; 1140 ~ 1189 (m , 10H) 。13CNMR ( CDCl3 , 100MHz) ,δ: 157170 ,
[3 ]张克 胜 , 孙 君 坦 , 何 炳 林. [J ] . 高 等 学 校 化 学 学 报 , 1999 ,20 (6) :9002904.
[4 ]a. Kuang Yongqing , Zhang Shengyong ,Jiang Ru. et al. [J ] . Tetrahedron Lett. ,2002 ,43 (20) :366923671. b. Kuang Yongqing , Zhang Shengyong , Wei Linlin. [J ] . Te2 trahedron Lett . ,2001 ,42 (34) :592525927.
摘要 :在 NaH 存在下 ,以 DMF 为溶剂 ,在温和条件下合成了手性配体 1 ,42双 (92O2奎宁)22 ,32二氮杂萘 ,最后用重结晶方 法得到纯品 ,为大量合成该配体提供了可行的方法 。 关键词 :1 ,42双 (92O2奎宁)22 ,32二氮杂萘 ;手性配体 ;合成 中图分类号 :O626 文献标识码 :A 文章编号 :025823283 (2004) 0220065202
1HNMR ( 400MHz , CDCl3 , 内 标 TMS) ,δ: 8165 (d ,2H , J = 513Hz ,Ar —H) ; 8133 ( m ,2H ,Ar —H) ; 7198 ( d , 2H , J = 912Hz , Ar —H) ; 7196 ( m , 2H , Ar —H) ; 7158 ( s , 2H , Ar —H) ; 7144 ( d , 2H , J = 512Hz ,Ar —H) ;7138 (m ,2H ,Ar —H) ;7103 (br ,2H , HC —O ) ; 5183 ( m , 2H , HC C) ; 4199 ( m , 4H ,
锇催化的不对称二羟化 (AD) 反应和不对称 氨羟化 (AA) 反应近年来获得了突破性进展[1] 。 它们是制备手性连二醇及 β2氨基醇的重要方法 之一 ,在手性药物以及具有生物活性的天然产物 的全合成中具有广范用途 ,例如下列美托洛尔等 药物的合成[2 ] 。
配体 。
迄今虽然在 AD 反应及 AA 反应中报道了许 多行之有效的小分子配体[ 3 ]及可回收重复使用的 手性高聚物配体[4] ,但制约其工业生产的主要问 题仍是配体成本太高 。因此 ,合成价廉高效 、制备 方法简便的手性配体具有重要意义 。最近孙晓莉 和程司 [5]分别报道了 1 ,42双 (92O2奎宁) 22 ,32二 氮杂萘 [ (QN) 2PHAL ] ( 其结构式如下) 是 AD 和 AA 反 应 的 优 秀 配 体 , 但 其 合 成 仍 采 用 K2CO3 ,
参考文献 :
[ 1 ] Marko I E , Svendsen J S. In Comprehensive Asymmetric Catalysis[M] . Berlin :Springer ,1999 ,7132787.
[2 ] Kolb H C ,Van Nienwenhze M S ,Sharpless K B. [J ] . Chem. Rev. ,1994 ,94 :248322547.
按文献[ 7 ]方法合成 ,产率 72 % ,m1p116315~ 164 ℃( 文献[7] 值 164 ℃) 。1HNMR及13CNMR与 结 构相符 。 11212 1 ,42双 (92O2奎宁) 22 ,32二氮杂萘的合成
收稿日期 :2003206218
基金项目 :国家自然科学基金资助项目 (20272082) 。 作者简介 :王巧峰 (19722) ,女 ,陕西人 ,硕士研究生 ,主要从 事不对称催化的合成研究 。
66化 学 试 剂2004 年在 100mL 三颈烧瓶中 , 加入 2118g (11mmol ) 1 ,42二氯22 ,32二氮杂萘 ,2145g NaH (使用前用无 水 乙 醚 处 理 , 保 持 干 燥 , 随 做 随 用 ) , 6148g (20mmol) 奎宁 ,N2 保护 ,再加入 30mL 新蒸 DMF , 油浴加热搅拌至 68 ℃, 反应 12h 后 TLC 监测终 点 。反应液冷却至室温 ,向体系中加 20mL 水和 30mL 乙酸乙酯 , 分出有机层 , 水层用乙酸乙酯 (30mL ×3) 洗 ,合并有机层 ,依次用水 ,饱和食盐 水洗涤 ,无水 MgSO4 干燥 。减压除去溶剂 ,得粗 品 8198g ,粗品用 16mL 乙酸乙酯重结晶 ,得白色 晶体 8102g ,产率 94 %。m1p115715~15815 ℃(文 献[7]值 :15715~160 ℃) 。
