各种盐溶液配制计算
实验活动5 一定浓度的NaCl溶液的配制

实验活动5 一定溶质质量分数的
氯化钠溶液的配制
实验一在实验室如何配制50克6%的食盐溶液?
1、需要什么药品和仪器,其作用是什么?
药品:氯化钠、蒸馏水
仪器:托盘天平、烧杯、量筒、玻璃棒、药匙、胶头滴管
2、操作步骤如何?
配制溶质质量分数一定的溶液
如何配制50g 质量分数为6%的氯化钠溶液
1、计算:配制时所需NaCl 质量为__________,
所需水的质量_____
,2、称量
(或量取)用托盘天平称3gNaCl 固体,倒入烧杯中
用量筒量取47m L 水的体积,倒入盛有NaCl
的烧杯中
3、溶解:用玻璃棒搅拌烧杯中的溶液,使NaCl 溶解
4、把配好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(标签上应包括药品名称和溶液中溶质的质量分数)
3g 47g 相当于47m L
用固体配制一定溶质质量分数的溶液
实验步骤:
1、计算所需溶质和溶剂的质量;
2、分别称或量出所需的溶质和溶剂;
3、将溶质和溶剂在烧杯中混合,搅拌至溶质
完全溶解。
4、装瓶,贴标签。
若用液体配制呢?
计算称量溶解装瓶
1、计算:配制50g 质量分数为3%的氯化钠溶液,需要6%的氯化钠溶液g(体积mL);水g 。
2、量取
3、混匀
4、装瓶
实验二用已配好的质量分数为6%的氯化钠
溶液(密度为1.04g/cm 3),配制50g 质量分数
为3%的氯化钠溶液
25 25 24.0
练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
常用生理溶液的配制与使用

常用生理溶液的配制与使用1.常用生理溶液的成分及配制方法配制生理盐水时,应先将上述各组分分别溶解,然后逐个混合,加入氯化钙(或NaHCO3)混合,再加入蒸馏水至1000ml。
最好是新鲜或低温保存。
配制生理盐水的蒸馏水最好提前充气。
还可采用下列简易的配制方法:以最常用的burnslock淡水鱼类生理盐水为例,先配制三种贮备液各500ml:各种生理盐溶液的用途:生理盐水:即与血清等渗之nacl溶液,在冷血动物应用0.6%-0.65%,在温血动物应用0.85%-0.9%。
任的解决方案:用于青蛙和其他冷血动物。
乐氏溶液:用于温血动物之心脏、子宫及其它离体脏器。
用作灌注液者须于用前通入氧气泡15分钟。
低钙乐氏液(含无水氯化钙0.05g)用于离体小肠及豚鼠的离体支气管灌注。
台氏溶液:用于温血动物之离体小肠。
2.消毒液、洗液的配制2.1常用消毒剂的制备方法和使用(见表2.1)2.2常用各种先涤液的配制方法及用途(1)肥皂和水它是一种乳化剂,可以去除污垢。
这是一种常用的乳液,但必须注意肥皂的质量,最好不要含有沙子。
(2)重铬酸钾硫酸洗剂通常称为洗洁液或洗液,其成分主要为重铬酸钾与硫酸,是强氧化剂。
k2cr2o7+4h2so4k2so4+cr2(so4)3+3[o]+由于其强大的氧化能力,血液、尿液和油等一般有机污染物可以被氧化和去除。
如果溶液稍微提前加热,效果会更强。
新鲜的铬酸洗涤溶液呈棕红色。
如果使用次数过多,重铬酸钾会被还原为绿色铬酸盐,效果会降低。
此时,可以加热、浓缩或添加重铬酸钾,重铬酸钾仍可使用。
配方:稀释洗液重铬酸钾10g粗浓硫酸200ml水100ml浓洗液重铬酸钾20g粗浓硫酸350ml水40ml配法:先取粗制重铬酸钾20g,放于大烧杯内,加普通水100ml使重铬酸钾溶解(必要时可加热溶解)。
再将粗制浓硫酸(200ml)缓缓沿边缘加入上述重铬酸钾溶液中即成。
加浓硫酸时须用玻璃棒不断搅拌,并注意防止液体外溢。
醋酸缓冲溶液的配制与计算

醋酸缓冲溶液配制醋酸盐缓冲液(pH3.5) 取醋酸铵25g,加水25ml溶解后,加7mol/L盐酸溶液38m l,用2mol/L盐酸溶液或5mol/L氨溶液准确调节pH值至3.5(电位法指示),用水稀释至100ml, 即得。
醋酸-锂盐缓冲液(pH3.0) 取冰醋酸50ml,加水800ml混合后,用氢氧化锂调节pH值至3.0,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.6) 取醋酸钠5.1g,加冰醋酸20ml,再加水稀释至250ml, 即得。
醋酸-醋酸钠缓冲液(pH3.7) 取无水醋酸钠20g,加水300ml溶解后,加溴酚蓝指示液1ml及冰醋酸60~80ml,至溶液从蓝色转变为纯绿色,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.8) 取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液0.5ml,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.5) 取醋酸钠18g,加冰醋酸9.8ml,再加水稀释至1000ml, 即得。
醋酸-醋酸钠缓冲液(pH4.6) 取醋酸钠5.4g,加水50ml使溶解,用冰醋酸调节pH值至4.6,再加水稀释至100ml,即得。
醋酸-醋酸钠缓冲液(pH6.0) 取醋酸钠54.6g,加1mol/L醋酸溶液20ml 溶解后,加水稀释至500ml,即得。
醋酸-醋酸钾缓冲液(pH4.3) 取醋酸钾14g,加冰醋酸20.5ml,再加水稀释至1000ml,即得。
醋酸-醋酸铵缓冲液(pH4.5) 取醋酸铵7.7g,加水50ml溶解后,加冰醋酸6ml与适量的水使成100ml,即得。
醋酸-醋酸铵缓冲液(pH6.0) 取醋酸铵100g,加水300ml使溶解,加冰醋酸7ml,摇匀,即得。
以上是中国药典中收录的,当然也可以自己设计浓度,pH,但是注意低于3以后醋酸缓冲容量就小了。
用醋酸和醋酸钠配制的缓冲溶液的PH=PKa+lg[C(NaAc)/C(HAc)](在此,C(HAc)指醋酸的浓度,C(NaAc)指醋酸钠的浓度,Ka是醋酸的解离常数=1.8*10-5(1.8乘10的-5次方),PKa=-lgKa=4.75,将PH=5.5代入,可得C(NaAc)/C(HAc)=5.6 通常我们配制时会使C(HAc)=0.1mol/L,或是C(HAc)=0.2mol/L等。
20%盐酸溶液的配制公式

20%盐酸溶液的配制公式20%盐酸溶液的配制公式一、实验目的本实验的目的是通过配制20%盐酸溶液来研究化学计量法的应用。
二、实验原理盐酸是一种常见的无机酸,其分子式为HCl。
盐酸在水中完全离解,生成氯离子(Cl-)和氢离子(H+)。
因此,配制盐酸溶液时只需在适当的质量浓度下加入足够量的盐酸即可。
三、实验步骤1. 实验设备和试剂准备- 实验设备:天平、容量瓶、滴定管、分液漏斗等。
- 实验试剂:盐酸(HCl)、去离子水。
2. 计算所需试剂的质量要配制20%的盐酸溶液,首先需要计算出所需的试剂量。
根据化学计量法,采用以下配方计算:- HCl的质量 = 试剂质量 / (质量浓度 × 100%)根据此公式,可以计算出所需的盐酸质量。
3. 配制盐酸溶液- 取出所需质量的盐酸,加入适量的去离子水中。
注意,应先加入水再加入盐酸,避免剧烈的反应和溅射。
- 用容量瓶测量溶液的体积,添加足够的去离子水到容量瓶刻度线上。
- 用玻璃棒充分搅拌溶液,使其充分混合。
4. 检测盐酸溶液浓度- 用滴定管取出一定量的盐酸溶液,加入酚酞指示剂。
- 使用标准氢氧化钠溶液进行滴定,直到溶液颜色由红变为无色。
- 记录滴定液的用量,根据滴定反应计算出盐酸溶液的浓度。
四、实验注意事项1. 在配制盐酸溶液时,应戴上防护眼镜和实验手套,以免溅入眼睛和接触皮肤。
2. 注意安全操作,避免盐酸溅入周围环境或身体。
3. 实验过程中应注意控制量热反应,避免盐酸快速添加导致剧烈反应。
4. 实验后应及时将废液处理妥善,并清洗实验设备。
五、实验结果及分析根据实验步骤,按照20%盐酸溶液的配方计算,可以得出所需的盐酸质量。
配制好的盐酸溶液应使用标准氢氧化钠进行滴定,以确认其浓度是否达到要求。
实验结果应记录盐酸溶液和用量标准氢氧化钠溶液的体积,通过滴定反应计算出盐酸溶液的浓度。
六、实验总结本实验通过配制20%盐酸溶液的过程,掌握了化学计量法的应用和配制溶液的基本步骤。
溶液配制

甲醇-醋酸-水(35:4:61)取醋酸4ml,甲醇35ml,加入水61ml中,混匀,即得。
本液应临用新制。
甲醇-水-磷酸(47:53:0.2)取磷酸0.2ml、甲醇47ml,加入水53ml中,混匀,即得。
本液应临用新制。
甲醇-0.2mol/L醋酸溶液-冰醋酸(67:33:1)取3.3ml的醋酸加水至100ml,混匀;取冰醋酸1ml,甲醇67ml,加入上述醋酸溶液33ml中,混匀,即得。
甲醇-水(85:15)或(3:7)取甲醇85ml或3ml,分别加入水15ml或7ml中,混匀,即得。
15ml、即得。
2g、4g、20g、新制。
4→1→2mol/L氢氧化钾溶液取氢氧化钾11.2g,加水使溶解成100ml,即得,本液应贮存于密闭的聚乙烯塑料瓶中。
1→10氢氧化钾溶液取氢氧化钾10g,加水使溶解成100ml,即得。
本液应贮存于密闭的聚乙烯塑料瓶中。
0.01mol/L、0.05mol/L、0.1mol/L、0.2mol/L盐酸液取0.01mol/L、0.05mol/L、0.1mol/L、0.2mol/L盐酸滴定液(检验标准操作规程附录ZT-TS-02-04-042-01)。
1→2盐酸溶液取盐酸50ml,加入水中,使成100ml,混匀,即得。
1→4盐酸溶液取1→2盐酸溶液稀释,即得。
1→40盐酸溶液取1→4盐酸溶液稀释,即得。
4→10盐酸溶液取盐酸40ml,加入水中使成100ml,混匀,即得。
18→1000盐酸溶液取盐酸18ml,加入水中使成1000ml,混匀,即得。
1%盐酸溶液取盐酸10ml,加入水中使成1000ml,混匀,即得。
5%盐酸乙醇溶液取盐酸0.5ml,加入乙醇中使成100ml,混匀,即得。
本液应临用新制。
1.81→1→10%100ml1→1→1→10%30%10%3→10硫酸乙醇溶液取硫酸30ml,加入乙醇中使成100ml,混匀,即得。
30%硫氰酸铵溶液取硫握酸铵30g,加水使溶解成100ml,混匀,即得。
七年级科学配制溶液-计算题

有关溶液配制计算题分类解析一、固体+水型例1:配制50 g质量分数为5%的氯化钠钠溶液,需要氯化钠多少克?水多少亳升?解析:这是溶液配制最基本、最典型的类型.可由公式:溶质质量=溶液质量×溶质质量分数;溶剂质量=溶液质量-溶质质量和体积=质量/密度直接计算.解:氯化钠质量=50 g×5%=2.5 g水的质量=50 g-2.5 g =47.5 g水的体积=47.5 g/1 g/ ml=47.5 ml例2:配制500 ml质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm3)需要氢氧化钠和水的质量各多少? 解析:此题涉及溶液密度,要注意转化成质量来计算.溶液中只有质量有加和关系,体积不能直接进行和差计算。
解:氢氧化钠溶质质量=500 ml×1.1 g/cm3×10%=55 g水的质量=500 ml1.1 g/cm3- 55 g=495 g(不要计算成500—55=445)二、溶液+水型例3:用25%的氯化钠溶液和水配制30kg10%的食盐溶液.需要25%的氯化钠溶液和水各多少kg?解析:紧紧抓住配制前后的等量关系是关键。
可以利用配制前后溶质、溶剂的相对应相等来列方程解决。
解:设需要25%的氯化钠溶液和水质量为x和y25%X=30kg×10%,解得x=12kg;Y=30kg—12kg=18kg例4:某工厂化验室配制5000g20%的盐酸,需要38%的盐酸(密度为1.19 g/cm3)和水各多少毫升?解析:可以直接利用质量列方程计算。
解:设需要30%的盐酸体积为x,水的体积为y5000 g×20%=x×1。
19 g/cm3×38%解得x=2212 mly=5000 g—2212 ml×1.19 g/cm3×38% =2453 ml三、溶液+溶液型例5:要配制20%的食盐溶液100 g,需要10%和50%的食盐溶液各多少亳升?解析:此题可根据溶液配制前后的溶质、溶剂、溶液相等来列出方程组解决.解:设10%的食盐溶液和50%的食盐溶液质量各为x和yx+y=10010%X+50%y=100×20%解得 X=75 y=25四、开放型例6:(07年山东威海中考题):实验室要配制50 g溶质质量分数为20%的硝酸钾溶液,现有25 g溶质质量分数为40%的硝酸钾溶液、20 g溶质质量分数为15%的硝酸钾溶液及足够多的硝酸钾晶体和蒸馏水,请选用上述的药品,设计三种配制方案填解析:将上面的三种情况特殊列出来即可。
溶液的配制与分析

7. 装瓶贴标签
容量瓶中不能存放溶 液,因此要把配制好的 溶液转移到试剂瓶中, 贴好标签,注明溶液的 名称和浓度。
实验再现
精确到 0.1g
冷却到室 温
引流
洗涤
胶头 滴管
3. 误差分析
②除了烧杯外还需要什么仪器? 玻璃棒
③溶质溶解后,溶液是否可马上移入容量瓶中呢? 不能,应该冷却至室温后再移入容量瓶
0.6g NaCl
4. 转移
①直接把烧杯中溶液倒入容量瓶中行吗?
不能,由于容量瓶瓶颈较细, 为避免液体 洒在外面,应该 用玻璃棒引流。
②此时溶质是否完全被转移 到容量瓶? 应如何处理?
4. 与c(B)有关的计算:
例:如图为实验室某浓盐酸试剂瓶标签上的有关数据,试 根据标签上的有关数据回答下列问题。
盐酸 分子式:HCl 质量分数为36.5% 相对分子质量:36.5 密度:1.19g/cm3
(1)该浓盐酸中HCl的物质的量浓度为 ______mol•L-1
例:如图为实验室某浓盐酸试剂瓶标签上的有关数据,试
例:如图为实验室ห้องสมุดไป่ตู้浓盐酸试剂瓶标签上的有关数据,试
根据标签上的有关数据回答下列问题。
盐酸 分子式:HCl 质量分数为36.5% 相对分子质量:36.5 密度:1.19g/cm3
(3)该同学将所配置 的0.400mol/L的盐酸溶液加到
10mL0.5mol/L的Na2CO3溶液中,产生气体体积最大时,加入
5.定容
向容量瓶中加入蒸馏水,在 距离刻度1~2cm时,改用胶 头滴管滴加蒸馏水至刻度线。 (液体凹液面最低处与刻度 线相切)
醋酸缓冲溶液的配制与计算

醋酸缓冲溶液配制醋酸盐缓冲液(pH3.5) 取醋酸铵25g,加水25ml溶解后,加7mol/L盐酸溶液38m l,用2mol/L盐酸溶液或5mol/L氨溶液准确调节pH值至3.5(电位法指示),用水稀释至100ml, 即得。
醋酸-锂盐缓冲液(pH3.0) 取冰醋酸50ml,加水800ml混合后,用氢氧化锂调节pH值至3.0,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.6) 取醋酸钠5.1g,加冰醋酸20ml,再加水稀释至250ml, 即得。
醋酸-醋酸钠缓冲液(pH3.7) 取无水醋酸钠20g,加水300ml溶解后,加溴酚蓝指示液1ml及冰醋酸60~80ml,至溶液从蓝色转变为纯绿色,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.8) 取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液0.5ml,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.5) 取醋酸钠18g,加冰醋酸9.8ml,再加水稀释至1000ml, 即得。
醋酸-醋酸钠缓冲液(pH4.6) 取醋酸钠5.4g,加水50ml使溶解,用冰醋酸调节pH值至4.6,再加水稀释至100ml,即得。
醋酸-醋酸钠缓冲液(pH6.0) 取醋酸钠54.6g,加1mol/L醋酸溶液20ml 溶解后,加水稀释至500ml,即得。
醋酸-醋酸钾缓冲液(pH4.3) 取醋酸钾14g,加冰醋酸20.5ml,再加水稀释至1000ml,即得。
醋酸-醋酸铵缓冲液(pH4.5) 取醋酸铵7.7g,加水50ml溶解后,加冰醋酸6ml与适量的水使成100ml,即得。
醋酸-醋酸铵缓冲液(pH6.0) 取醋酸铵100g,加水300ml使溶解,加冰醋酸7ml,摇匀,即得。
以上是中国药典中收录的,当然也可以自己设计浓度,pH,但是注意低于3以后醋酸缓冲容量就小了。
用醋酸和醋酸钠配制的缓冲溶液的PH=PKa+lg[C(NaAc)/C(HAc)](在此,C(HAc)指醋酸的浓度,C(NaAc)指醋酸钠的浓度,Ka是醋酸的解离常数=1.8*10-5(1.8乘10的-5次方),PKa=-lgKa=4.75,将PH=5.5代入,可得C(NaAc)/C(HAc)=5.6 通常我们配制时会使C(HAc)=0.1mol/L,或是C(HAc)=0.2mol/L等。
实验溶液的配制和稀释

实验一溶液的配制一、实验目的1、掌握物质的量浓度配制的一般方法、步骤及所需的各种仪器2、初步学会吸量管、移液管、容量瓶的使用方法。
二、实验用品仪器:台秤、烧杯、玻棒、量筒或量杯(50ml)、滴管、吸量管(5ml和10ml)、20ml移液管、容量瓶(50ml、100ml)、洗耳球、角匙药品:固体氯化钠、浓盐酸、1mol/L乳酸钠溶液、药用酒精(øB=0.95)三、实验内容与实验步骤(一)溶液的配制1、质量浓度溶液的配制:配制ÞB=9g/L氯化钠溶液50ml(1)计算。
算出配制质量浓度为9g/L NaCl溶液50ml所需固体NaCl的克数。
(2)称量。
用托盘开平称量所需NaCl放入50ml烧杯中。
溶解。
用量筒取20ml蒸馏水倒入烧杯中,用玻璃棒搅拌使NaCl完全溶解。
(3)转移。
将烧杯中的NaCl溶液用玻璃棒引流入100ml量筒中,再用少量蒸馏水洗烧杯1-2次,洗涤液注入量筒中。
(4)定容。
继续往量筒中加入蒸馏水,当加到接近50ml刻度线时,改用滴管滴加蒸馏水,至溶液凹液面底部与50ml刻度线相切。
用玻璃棒搅匀,即得50ml质量浓度为9g/L NaCl溶液。
将配制好的溶液倒入指定的回收瓶中。
2、物质的量浓度溶液的配制:用浓盐酸配制0.2mol/L盐酸100ml(1)计算。
算出配制0.2mol/L HCl溶液100ml需用质量分数wB=0.37、密度Þ密=1.19Kg/L 浓盐酸的毫升数。
(2)移取。
用5ml吸量管吸取所需浓盐酸,并移至100ml容量瓶中。
(3)定容。
往容量瓶中加蒸馏水至离标线约1cm处,改用滴管滴加蒸馏水至100ml。
盖好瓶塞,将溶液混匀。
将配制好的溶液倒入指定的回收瓶中。
(二)、溶液的稀释1、用1mol/L乳酸钠溶液稀释成1/6mol/L乳酸钠溶液50ml。
(1)计算。
算出配制1/6mol/L乳酸钠溶液50ml需用1mol/L乳酸钠溶液的体积。
(2)移取。
溶液的稀释(或浓缩)和配制(或混合)的计算

溶液的稀释(或浓缩)和配制(或混合)的计算[学习要点]1。
掌握有关溶液稀释(或浓缩)、溶液混合的计算。
2。
掌握有关溶液配制的计算.[教学点拨]1。
在进行溶液的混合、稀释(或浓缩)的计算时,必须遵循两条原则:即在混合、稀释(或浓缩)前后:(1)物质的总质量不变; (2)溶质的总质量也不变.2。
两种溶液(特别是密度相差很大的两种溶液)混合,它们的溶质质量可以相加,但体积不能相加。
混合溶液的体积必须通过它们的质量和密度求得。
[典型例题]例 将20毫升98%的浓硫酸(ρ=1。
84克/厘米3)稀释成40%的稀硫酸(ρ=1.3克/厘米3),问加水多少毫升?可配制多少毫升的稀硫酸?解析 这类问题实际上是用水稀释浓溶液的计算。
解题的关键是稀释前后溶质质量不变,应注意溶液密度、质量、体积的换算及水的体积与质量的关系。
因为水的密度一般均看成1克/厘米3,所以水的克数即相同于水的毫升数.设需要加水x 毫升,20×1。
84×98%=(20×1。
84+x)×40%x=53.35(毫升)可配制成40%的稀硫酸体积为20 1.8453.35169.341.3⨯+⨯=(毫升)[强化训练]一、选择题1.若将100克20%的某溶液的浓度降低到5%,需加水 ( )(A )150克 (B )200克 (C)300克 (D )400克2.含氨15%的氨水2千克,稀释到含氨0。
3%时,需要加水 ( )(A)98千克 (B )100千克 (C )102千克 (D)104千克3。
用质量分数为60%的酒精溶液A 与质量分数为25%的酒精溶液B 配成质量分数为45%的酒精溶液。
所用A 、B 溶液的质量比为 ( )(A )1:2 (B)2:3 (C)4:3 (D)3:14.有食盐水a 克,其质量分数为m%,若将其浓度稀释到n%时,应加水的质量是( )(A)m n a -克 (B )()a m n m -克 (C )()a n m m -克 (D )()a m n n-克 5.有一瓶质量分数为20%的某溶液,倒出3/4体积后,再加水到原来的质量;又倒出2/3体积,最后剩余溶液的质量分数为 ( )(A )6% (B )5% (C )4% (D )3%6.要使x 克15%的硝酸钠溶液浓度增大一倍,可采用的方法是 ( )(A )蒸发掉2x 克水 (B)蒸发掉2x ·15%克水 (C)加x 克硝酸钠 (D )加15100x 克硝酸钠7.在4℃时,V 升水中溶解质量分数为c %的浓盐酸A 毫升(浓盐酸的密度为ρ克/厘米3),则稀释后盐酸的质量分数为 ( ) (A)100%100AV ρ⨯⨯ (B )%100%A c V cρρ⨯+ (C )%100%100()c V A ρρ⨯ (D)%100%1000Ac V Aρρ⨯+ 8。
分子生物学实验常用缓冲液的配制方法
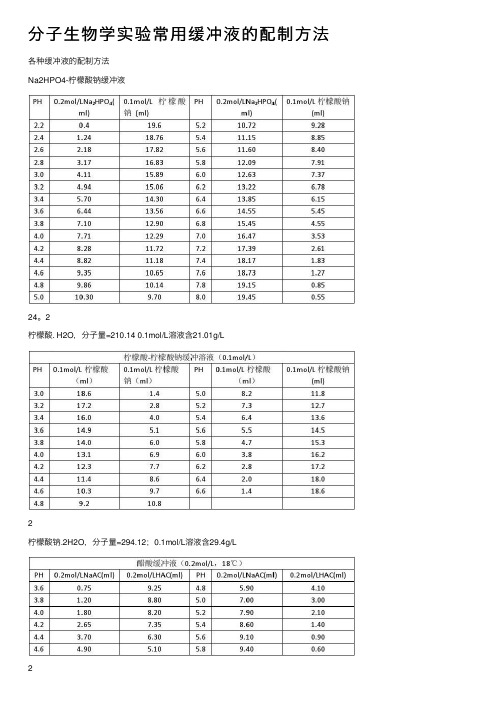
分⼦⽣物学实验常⽤缓冲液的配制⽅法各种缓冲液的配制⽅法Na2HPO4-柠檬酸钠缓冲液24。
2柠檬酸. H2O,分⼦量=210.14 0.1mol/L溶液含21.01g/L2柠檬酸钠.2H2O,分⼦量=294.12;0.1mol/L溶液含29.4g/L2(1)醋酸盐溶液的配制:醋酸-醋酸钠缓冲液(pH3.6)取醋酸钠5.1g,加冰醋酸20ml,再加⽔稀释⾄250ml,即得。
醋酸-醋酸钠缓冲液(pH3.7)取⽆⽔醋酸钠20g,加⽔300ml溶解后,加溴酚蓝指⽰液1ml及冰醋酸60~80ml,⾄溶液从蓝⾊转变为纯绿⾊,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.8)取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液0.5ml,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.5)取醋酸钠18g,加冰醋酸9.8ml,再加⽔稀释⾄1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.6)取醋酸钠5.4g,加⽔50ml使溶解,⽤冰醋酸调节pH值⾄4.6,再加⽔稀释⾄100ml,即得。
醋酸-醋酸钠缓冲液(pH6.0)取醋酸钠54.6g,加1mol/L醋酸溶液20ml溶解后,加⽔稀释⾄500ml,即得。
⽤醋酸和醋酸钠配制的缓冲溶液的PH=PKa+lg[C(NaAc)/C(HAc)](在此,C(HAc)指醋酸的浓度,C(NaAc)指醋酸钠的浓度,Ka 是醋酸的解离常数=1.8*10-5(1.8乘10的-5次⽅),PKa=-lgKa=4.75,将PH=5.5代⼊,可得C(NaAc)/C(HAc)=5.6 通常我们配制时会使C(HAc)=0.1mol/L,或是C(HAc)=0.2mol/L等。
若是配制C(HAc)=0.1mol/L,则C(NaAc)=0.56mol/L 称量醋酸钠固体质量为82*0.56=46克量取冰醋酸体积为0.1*1000/17.5=5.7mL。
溶液配置

0.05g/ml
0.05g指示剂加入0.05mol/l氢氧化钠1.6ml,加水溶解到 100ml
稀硝酸 氯化物
标准氯化钠溶液 硝酸银
10.50%
量取105ml浓硝酸用水稀释至1000ml
1.65% 0.1mol/l
称取0.165g氯化钠溶解到1000ml.临用前取10ml加水稀释 到100ml
取17.5g硝酸银加水稀释至1000ml
称取1.5g氯化亚锡,加水10ml,再加少量盐酸溶解即得。现用现配。
二、药用辅料异丙醇产品分析所用试剂
分析项目 所用试剂
碘试液
鉴
别 NaOH试液
重铬酸钾试液
浓度
配置方法
0.05mol/L
取13g碘,加36g碘化钾,与50ml水溶解后加3滴盐 酸然后用水稀释至1000ml,存放在棕色玻璃瓶中。
4.30%
甲基红 酸碱滴定指示剂 1g/L 取0.1g甲基红,溶于乙醇,用乙醇稀释到100ml。
甲基橙 酸碱滴定指示剂 1g/L 取0.1g甲基橙,溶于70℃水中,冷却,用水稀释到100ml。
淀粉
专属指示剂
10g/L
取1.0g淀粉,加5ml水调成糊状,在搅拌下加入90ml沸腾的水中,煮沸 1-2min,冷却,稀释至100ml.
称取0.1g酚酞溶于乙醇,并用乙醇稀释成100ml
取高锰酸钾3.2g,加水1000ml,煮沸15分钟,密塞, 静置2日以上用垂熔玻璃器滤过,摇匀。
取氢氧化钾33g溶于100ml水中,摇匀。
三、常用指示剂配置
试剂名称
分析项目
浓度
配制方法
酚酞 酸碱滴定指示剂 10g/L 取1.0g酚酞,溶于乙醇,用乙醇稀释到100ml。
人教版初三下册溶液配制和稀释典型习题+详解

溶液配制练习一、固-水例1:配制50 g质量分数为5%的氯化钠钠溶液,需要氯化钠多少克?水多少亳升?解析:这是溶液配制最基本、最典型的类型。
可由公式:溶质质量=溶液质量×溶质质量分数;溶剂质量=溶液质量—溶质质量和体积=质量/密度直接计算。
氯化钠质量=50 g×5%=2.5 g 水的质量=50 g—2.5 g =47.5 g水的体积=47.5 g/1 g/ ml=47.5 ml例2:配制500 ml质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm3)需要氢氧化钠和水的质量各多少?解析:此题涉及溶液密度,要注意转化成质量来计算。
溶液中只有质量有加和关系,体积不能直接进行和差计算。
氢氧化钠溶质质=500 ml1.1 g/cm310%=55 g水的质量=500 ml1.1 g/cm3—55 g=495 g(不要计算成500—55=445)二、液-水例3:用25%的氯化钠溶液和水配制30kg10%的食盐溶液。
需要25%的氯化钠溶液和水各多少kg?解析:紧紧抓住配制前后的等量关系是关键。
可以利用配制前后溶质、溶剂的相对应相等来列方程解决。
设需要25%的氯化钠溶液和水质量为x和y25%x=30k g10%,解得x=12k g;Y=30k g—12k g=18k g例4:某工厂化验室配制5000 g20%的盐酸,需要38%的盐酸(密度为1.19 g/cm3)和水各多少毫升?解析:可以直接利用质量列方程计算。
设需要30%的盐酸体积为x,水的体积为y,5000 g×20%=x×1.19 g/cm338% 解得x=2212 mlY=5000 g—2212 ml×1.19 g/cm338% =2453 ml三、液-液例5:要配制20%的食盐溶液100 g,需要10%和50%的食盐溶液各多少亳升?解析:此题可根据溶液配制前后的溶质、溶剂、溶液相等来列出议程组解决。
溶液配比浓度问题总结

溶液配比浓度问题总结1、溶液重量(盐水)=溶质重量(盐)+溶剂重量(水)溶质重量(盐)=溶液重量(盐水)×浓度2、溶液问题:浓度=溶质/溶液溶液= 溶质+溶剂溶液重量 = 溶质重量+溶剂重量!浓度=(溶质重量)/溶液重量溶液重量=(溶质重量)/浓度溶质重量= 溶液重量×浓度3、“稀释”问题-------特点是加“溶剂”,解题关键是找到始终不变的量(溶质)。
例:要把30克含盐16%的盐水稀释成含盐0.15%的盐水,须加水多少克?分析:设须加水x克,列表分析等量关系:解:设须加水x 克,由题设得:30×16%=(30+x )·0.15%x ⇒=3170,。
∴须加水3170克。
浓度应用题只要抓住“不变”量或“变化量”之间的联系即可准确迅速推出解法。
4、“浓缩”问题-----特点是减少“溶剂”的量或者增加“溶质”的量,解题关键是紧紧抓住不变的量,构建等量关系。
例:在含盐0.5%的盐水中蒸去了236千克水,就变成了含盐30%的盐水,问原来的盐水是多少千克?解:设原来的盐水是x 千克,列表分析等量关系:、⇒=240,解:设原来的盐水是x千克,由题设:x×0.5%=(x-236) ·30%x∴原来的盐水是240千克。
※不变的量是溶质,围绕这一点构建等量关系从而解题。
例:有含盐8%的盐水40千克,要配制成含盐20%的盐水,须加盐多少千克?分析:设须加盐x千克,列表分析等量关系:解:设须加盐x千克,由题设:40(100%-8%)=(40+x)·(100%-20%)6⇒=x {∴须加盐6千克。
※不变的量是溶剂,围绕这一点构建等量关系从而解题。
5、先“稀释”后“浓缩”-----将整个的过程分为两个阶段,抓住每个阶段的不变量,从而解决问题。
例:在浓度为30%的酒精溶液中加入5千克水,浓度变为20%,再加入多少千克酒精,浓度变为50%?6:配制问题---是指两种或者两种以上的不同浓度的溶液混合配制成新溶液,解题关键是分析所取原溶液的溶质与成品溶质不变及溶液前后质量不变,找到两个等量关系。
一定浓度盐酸溶液的配制

一定浓度盐酸溶液的配制浓度是指溶液中溶质的质量或摩尔数与溶液总体积的比值。
在配制一定浓度的盐酸溶液前,我们需要了解一些基本的概念与计算方法。
首先,我们需要明确所需盐酸溶液的浓度单位。
盐酸溶液的浓度可以用质量分数、摩尔浓度或体积浓度等表示。
在实际操作中,一般常用摩尔浓度来表示盐酸溶液的浓度。
摩尔浓度是指溶质的摩尔数与溶液的体积的比值,通常用单位摩(mol/L)来表示。
其次,我们需要了解一些基础化学知识,如摩尔质量和溶液配制中的溶液密度。
摩尔质量是指溶质的摩尔质量与溶质的质量之比,通常用单位克/摩(g/mol)来表示。
例如,盐酸(HCl)的摩尔质量为36.46 g/mol。
溶液密度是指溶液的质量与溶液的体积之比,通常用单位克/升(g/L)来表示。
下面,我们以配制1 mol/L(1 M)盐酸溶液为例,来说明如何进行溶液的配制计算。
第一步,计算所需盐酸的摩尔质量。
盐酸(HCl)的摩尔质量为36.46 g/mol。
第二步,计算所需溶质(盐酸)的质量。
例如,如果我们想配制100 mL的1 M盐酸溶液,根据摩尔质量的计算公式(质量=摩尔浓度×摩尔质量×体积),可以得到所需的盐酸质量为1 mol/L × 36.46g/mol × 0.1 L = 3.646 g。
第三步,计算所需的稀释剂(水)的体积。
由于我们想要得到100 mL的盐酸溶液,因此稀释剂的体积为(最终体积-盐酸体积)= 100 mL - 0.1 L = 99.9 mL = 99.9 cm³。
第四步,将上述计算得到的盐酸质量和稀释剂的体积按比例混合。
首先,在一个干净的量筒或容量瓶中,量取99.9 mL的稀释剂(水),然后将3.646 g的盐酸加入其中。
搅拌溶解,确保溶解均匀。
第五步,完成配制后,用量筒或容量瓶等器皿将溶液转移到存储瓶中,并标明盖子上的标签,注明浓度和配制日期等重要信息。
此外,还应该在实验室记录本上记录所配制出的溶液的详细信息。
补液

3:2:1含3份5%葡萄糖,2份生理盐水,l份1.4%碳酸氢钠。
此液为1/2张力3:2:1液的计算:10%葡萄糖250ml :5%碳酸氢钠12ml :10%氯化钠8ml250ml的液体除以6,一分差不多40ml,所以1.4%的碳酸氢钠应该给40ml,折算成5%碳酸氢钠就是:1.4% * 40= X * 5% X=12ml0.9%氯化钠折算成10%氯化钠就是:0.9% * 40 * 2 = X * 10% X= 8ml2∶1 等张液是抢救休克时扩容的首选溶液,其有固定组份,由2 份等渗盐溶液+1份等渗碱溶液配制而成临床上没有现成的2∶1 等张液的时候,常常采用你所说的快速临时配制法,实际上这也只是一个★★粗略折算性质的计算法。
其中的10%GS只是作为稀释液(5%GS等渗不等张,虽然可以用,但一般不采用)2∶1 等张液300ml,实际应该是200ml的0.9%NaCl+100ml的1.4%SB。
精确的计算应该是:①10%NaCl=0.9%*200/10%=18ml(相当于200ml的0.9%NaCl)②5%NaHCO3=1.4%*100/5%=28ml(相当于100ml的1.4%SB)③10%GS=300-18-28=254ml (作为稀释液补足至300ml)50kg病人生理需要量:2500---3000ml1.体温>37摄氏度,每升高1度多补3—5ml/kg2.根据体重补液3.胃肠减压.腹泻、肠瘘、胆汁引流、各种引流管、呼吸机支持(呼吸道蒸发)糖:葡萄糖—50-300g 盐:氯化钠—4-5g 钾:氯化钾—3-4g 一般禁食3天内不用补蛋白,脂肪。
大于3天要补合并糖尿病、心功能不全、肾功能不全、肝功能不全调整补液量低血压,尿量少,等低容量时注意改善循环根据白蛋白、钠、钾、钙补电解质禁食大于3天,每天补20%脂肪乳250ml老年人没糖尿病的加胰岛素(按5:1加,因为手术是个刺激,会有胰岛素抵抗血糖升高);有糖尿病的按4:1抵消糖,再升高如3:1可以降糖补液(1)制定补液计划。
磷酸盐缓冲溶液ph计算公式

磷酸盐缓冲溶液ph计算公式磷酸盐缓冲溶液在化学实验和生物研究中经常会被用到,而计算它的 pH 值就需要用到特定的公式。
先来说说啥是磷酸盐缓冲溶液。
它通常是由磷酸二氢盐和磷酸氢盐组成的混合溶液。
比如说,磷酸二氢钾(KH₂PO₄)和磷酸氢二钾(K₂HPO₄)混合在一起,就可以配制成磷酸盐缓冲溶液。
那磷酸盐缓冲溶液 pH 的计算公式是啥呢?这得从化学平衡的角度来理解。
我们有个公式:pH = pKa + log₁₀([A⁻]/[HA]),这里的 pKa 是磷酸的解离常数的负对数,[A⁻]是磷酸氢根离子的浓度,[HA]是磷酸二氢根离子的浓度。
比如说,咱们在实验室里要配制 pH 为 7.0 的磷酸盐缓冲溶液。
已知磷酸二氢钾(KH₂PO₄)的浓度是 0.1mol/L,磷酸氢二钾(K₂HPO₄)的浓度是 0.2mol/L。
磷酸的 pKa₂(就是磷酸二氢根离子解离的常数)是 7.21。
那咱们就可以代入公式算啦:pH = 7.21 + log₁₀(0.2/0.1) = 7.21 + log₁₀2 ≈ 7.51 。
哎呀,这可不对呀,咱们要的是 pH 为 7.0 的缓冲溶液呢。
这时候就得调整两种盐的浓度比例啦。
经过多次尝试和计算,最终发现当磷酸二氢钾的浓度是 0.2mol/L,磷酸氢二钾的浓度是 0.1mol/L 时,算出来的 pH 值就接近 7.0 啦。
我还记得有一次在实验室里,我带着几个学生一起配制磷酸盐缓冲溶液。
有个学生特别心急,没等我讲完就开始动手,结果浓度都弄错了,算出来的 pH 值偏差特别大。
我就耐心地跟他说:“别急别急,化学实验可不能马虎,咱们得一步一步来,先把公式和原理搞清楚。
”最后,在大家的共同努力下,终于成功配制出了所需 pH 值的磷酸盐缓冲溶液,学生们也都对这个公式有了更深刻的理解。
总之,要想准确计算磷酸盐缓冲溶液的 pH 值,就得搞清楚各种离子的浓度,选对合适的 pKa 值,然后认真代入公式计算。
溶液的配制

9. 定匀摇匀后,静止时发现液面低于刻度线,再加 水到刻度线( 偏低 )
10. 定容时加水过量越过刻度线,又取出部分溶液, 使液面降至刻度线( 偏低)
规律总结 实验误差分析的理论依据
C =
n
溶质的物质的量 固体:称质量 溶液:c(浓)×v
V
溶液的体积 用容量瓶标定
三、配制50g质量分数为5%的食盐溶液。 实验目的: 实验器材和用品:托盘天平、药匙、量筒、 胶头滴管 、烧杯、玻璃棒、 NaCl。 步骤:1、计算需NaCl的质量为2.5g,H2O的体积为 47.5ml;2、称量、量取:用托盘天平称量2.5g NaCl倒入烧杯中,用量筒量取47.5ml水;3、把量 取好的水倒入盛有NaCl的烧杯中,并用玻璃棒搅拌 ,加速NaCl溶解;4、把配好的溶液装入试剂瓶中 ,盖好瓶塞并贴上标签保存。
溶液的配制
一、配置步骤 (1)计算:按配置要求计算出所需的溶质和溶剂 的量(固体计算出质量、液体计算处体积) ; (2)称量和量取:称量是指称量出固体质量,量 取是指量取液体物质的体积; (3)溶解:把溶质和溶剂混合,搅拌至充分溶解 即可;
二、所用器材:托盘天平、药匙、量筒、 胶头 滴管、烧杯、玻璃棒。
四.溶液配制的误差分析
下列操作对溶液浓度造成的误差是
1.天平的砝码上占有其他物质或已锈蚀( 偏高 )
2.试剂与砝码的左右位置搞错( 可能偏低 ) 3.量取液体溶质时,俯视读数( 4.定容时俯视刻度线( 偏高 ) 偏低 )
5.所配溶液未冷却至室温即转入容量瓶定容(
偏高 )
6. 转移溶液时不洗涤烧杯与玻璃棒或未将洗涤液转 入容量瓶( 偏低 ) 7. 溶解、转移、洗涤时有溶液流出容器外,使溶质 偏低 ) 减小( 8. 容量瓶在使用前,用蒸馏水洗净,在瓶内有少 量水残留( 无影响)
17%盐酸配制方法?

17%盐酸配制方法?求助
这种计算方法称为十字交叉法。
这种方法很容易掌握,可用下面的式子表示:
(配成溶液的浓度-稀溶液的浓度)/(浓溶液的浓度-配成溶液的浓度)=浓溶液的质量/稀溶液的质量
上式简化一下:(配成-稀液)/(浓液-配成)=浓质量/稀质量
这里的浓溶液可以是100%,即纯物质,稀溶液可以是0,即是水
计算过程可以把百分号去掉,即都扩大100倍。
例如如果原有20%的盐酸,如何配制15%盐酸溶液。
这显然是用20%的盐酸与水配制15%盐酸溶液。
则20%的盐酸与水的质量比是
(17-0)/(20-150=3/1
如果题目是这样的:现有30%的盐酸和10%的盐酸,如何配制17%盐酸溶液
20%与10%盐酸的质量比
(17-10)/(30-17)=7/13
再有就是如何利用求出的质量比,
例如:现有30%的盐酸和10%的盐酸,用来配制17%盐酸溶液。
问
1,如果现有50克30%的盐酸与10%的盐酸可以配制多少克17%的盐酸?50×3/1
2,如果现有50克10%的盐酸与30%的盐酸可以配制多少克15%的盐酸?50×7/13
另外,如果知道了两种溶液的质量求配成溶液的浓度的方法如下:
例题:30%的盐酸25克与10%的盐酸10克混合,得到的溶液的浓度是?
两者的质量比是25/10=5/2
得到的溶液浓度是(30×5+10×2)/(5+2)=24.3(%)。
