地球化学第七章同位素地球化学
同位素地球化学

同位素地球化学
同位素地球化学是以同位素的分布特征为研究对象,研究地球内部和表面形成过程和变化的一门重要的地学分支。
它利用稳定同位素的比值来研究地球的演化及其在时空尺度上的变化。
同位素地球化学既是一门独立的学科,也是地球科学中的多学科交叉学科。
它将地球科学、核物理学、化学和生物学等多学科有机地结合在一起,研究地球中某种物质的原始成分,以及它们在地球内部、大气中等不同环境中的运动、改变和转化过程,以及由此引起的地球演化过程。
同位素地球化学的研究方法有多种,其中最重要的是测量和分析地球表面、地壳、地幔和地球内部的同位素比例。
它的研究重点是地球作为一个整体的演化过程,以及地球内部物质的原始成分、流动性和转化过程,以及它们如何影响地球表面和大气环境的演变。
一般而言,同位素地球化学的研究不仅要研究地球表面和内部的同位素含量,还要研究其分布特征。
通常情况下,同位素的分布特征受到地壳、地幔和地球内核的影响,它们的分布特征各不相同。
在同位素地球化学的研究中,要根据地球的特定环境对同位素的分布特征进行分
析,可以深入地理解地球的演化过程、结构特征以及其影响因素。
在实际应用中,同位素地球化学已经成为地质勘查、矿物开采、矿产评价以及环境保护等领域的重要手段之一。
人们可以利用同位素地球化学的结果,对潜在的矿产资源进行定量评估,进而提高地质勘查的准确性和效率。
此外,同位素地球化学还可以用来研究地表微生物的活动、空气污染的源头和扩散趋势,以及地表水的污染特征等。
总之,同位素地球化学是地球科学研究的一个重要分支,它结合了多学科的知识,为地质勘查、矿产开发、环境保护和其他领域的实践活动提供了有效的技术支持。
几种年代学方法介绍——同位素地球化学课件PPT

Lu-Hf同位素测年
测试仪器
• 在Re-Os 年代学研究的早期,二次离子质谱、共 振离子质谱、加速器质谱、电感耦合等离子体质谱 (ICP-MS)都曾用于Re-Os 同位素的测定研究
• 近些年来,随着质谱技术及分析方法的发展,负离 子热表面电离质谱(NTIMS)已逐渐成为Re-Os年 代学研究尤其是Os 同位素比值测定的主要工具
几种年代学方法介绍
Re-Os法,Sm-Nd法, Lu - Hf法
Re-Os法
铼与锇
• Re,分散元素,不形成独立矿物,与Mo地 球化学相似性
• 地幔部分熔融时,中等不相容元素Re趋于进 入岩浆,而相容元素Os则趋于保留在地幔中。 因此,富集不相容元素的流体对地幔岩石的 交代作用通常难以对地幔岩石中Os的同位 素组成造成明显的影响。居于此原因,该体 系已被广泛地用于研究大陆岩石圈地幔的形 成和演化
天然同位素
• Re有两种天然同位素
– 185 -37.398%, – 187 -62.602%
• Os有七种天然同位素
– 184-0.02%, – 186-1.6%, – 187-1.6%, – 188-13.3%, – 189-16.1%, – 190-26.4%, – 192-41%
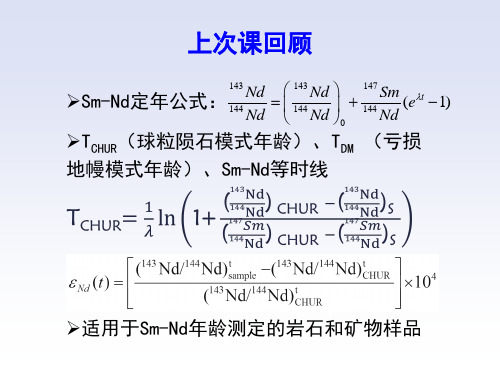
年龄公式
Re-Os法定年问题讨论
• 有些金属矿床辉钼矿的Re-Os 年龄高于其赋矿围 岩,原因不清;
• 黄铁矿等多数硫化物含Re-Os 量明显偏低,并含 有普通Os ,对样品化学制备过程中低本底的要求 很高,一般实验室难以达到,普通Os 也难以准确 扣除;
同位素地质年代学与同位素地球化学

同位素地质年代学与同位素地球化学嘿,伙计们!今天我们要聊聊一个非常有趣的话题——同位素地质年代学与同位素地球化学。
这可是一个让我们大开眼界的领域,让我们一起来看看吧!咱们来聊聊什么是同位素地质年代学。
简单来说,就是通过研究地球上的岩石和化石,了解地球的历史。
这些岩石和化石都有一个共同的特点,那就是它们里面含有各种各样的同位素。
同位素就是原子核中质子数相同,但中子数不同的原子。
这些同位素在自然界中的含量是有限的,而且它们的半衰期也是不同的。
所以,通过测量这些同位素的相对含量,我们就可以推算出这些岩石和化石形成的时间。
那么,同位素地球化学又是什么呢?它其实是同位素地质年代学的一个分支,主要研究的是地球上的物质是如何随着时间的推移而发生变化的。
这个领域的研究对象包括了大气、水、土壤等等。
通过对这些物质中的同位素进行分析,我们就可以了解到地球历史上的各种事件,比如火山喷发、气候变化、生物进化等等。
现在,让我们来举个例子,看看同位素地质年代学是如何帮助我们了解地球历史的。
假设我们发现了一块来自几千万年前的岩石样本,这块岩石中的碳-12同位素含量比现代岩石中的高很多。
根据我们的知识,我们知道这个时期的地球上还没有出现大量的树木,所以这块岩石很可能来自一个没有大量植物生长的时期。
通过这个例子,我们就可以看出同位素地质年代学对于我们了解地球历史的重要性。
接下来,我们再来聊聊同位素地球化学。
这个领域的研究对象非常广泛,包括了大气、水、土壤等等。
其中,大气同位素地球化学是一个非常有趣的领域。
我们知道,大气中的氮气、氧气、二氧化碳等气体都是由氮、氧、碳等元素组成的。
但是,这些气体中的氮、氧、碳原子却有着不同的同位素。
通过研究这些同位素的相对含量,我们就可以了解到大气中的气体是如何随着时间的推移而发生变化的。
例如,我们可以通过测量大气中甲烷(CH4)和二氧化碳(CO2)的同位素含量,来了解过去的气候变化。
如果甲烷的同位素比例较高,那么说明过去的气候比较温暖;反之,如果甲烷的同位素比例较低,那么说明过去的气候比较寒冷。
同位素地球化学

研究分析表稳定同位素组成常用δ值表示,δ值指样品中某元素的稳定同位素比值相对标准(标样)相应比 值的千分偏差。其公式为□δ值能清楚地反映同位素组成的变化,样品的δ值愈高,反映重同位素愈富集。样品 的δ值总是相对于某个标准而言的,同一个样品,对比的标准不同得出的δ值各异。所以必须采用同一标准;或 者将各实验室的数据换算成国际公认的统一标准,这样获得的δ值才有实际应用价值。比较普遍的国际公认标准 为:①SMOW,即标准平均海洋水,作为氢和氧的同位素的国际统一标准;② PDB,是美国南卡罗来纳州白垩系皮 狄组地层内的似箭石,一种碳酸钙样品,用作碳同位素的国际统一标准,有时也作为沉积碳酸盐氧同位素的标准; ③CDT,是美国亚利桑纳州迪亚布洛峡谷铁陨石中的陨硫铁,用作硫同位素的国际统一标准。稳定同位素实验研究 表明,大多数矿物对体系(矿物-矿物)或矿物-水体系,在有地质意义的温度范围内,103ln□值与T 2成反比,T 为绝对温度。
模型③利用放射性同位素的衰变定律建立一套有效的同位素计时方法,测定不同天体事件的年龄,并作出合 理的解释,为地球和太阳系的演化确定时间坐标。
根据同位素的性质,同位素地球化学研究领域主要分稳定同位素地球化学和同位素年代学两个方面。稳定同 位素地球化学主要研究自然界中稳定同位素的丰度及其变化。
分馏系数
稳定同位素地球化学
稳定同位素地球化学:
同位素地球化学的一个研究领域。主要研究自然界中稳定同位素的丰度及其变化规律,并用来解决地质问题。 稳定同位素包括放射衰变成因的和非放射成因的,如206Pb、207Pb、208Pb、87Sr和143Nd就是分别由238U、 235U、232Th、87Rb和147Sm放射衰变而形成的稳定同位素;而H、C、O、S的同位素如1H、2H、12C、13C、16O、 17O、18O、32S、33S、34S、36S则是天然稳定同位素。由于H、C、O、S的原子序数小于20,所以其同位素又可 称为轻稳定同位素。稳定同位素丰度发生变化的主要原因是同位素的分馏作用。
同位素地球化学

# prot ons
U
Th
23 6 23 5
#
144 145 146 # neutrons
e cl u n
s n o
Example: 238U -> 234Th + 4He Mass-energy budget: 238U 238.0508 amu 234Th –234.0436 4He –4.00260 mass defect 0.0046 amu = 6.84x10-13 J/decay = 1.74x1015 J/kg 238U = 414 kilotons/kg
放射性衰变
自然界中部分核素在能量上处于不稳定状 态,自发地从某一核素衰变成为另一核素, 并伴随各种粒子形式的能量释放的过程称为 放射性衰变。 发生放射性衰变的同位素称放射性同位素, 或母体同位素(radioactive parent nucleus )。 放射性衰变过程中及最终形成的稳定同位 素称为放射成因同位素或子体同位素 (radiogenic daughter nuclei) 。
23 8 23 7 4
This is the preferred decay mode of nuclei heavier than 209Bi with a proton/neutron ratio along the valley of stability
23
b-decay
Emission of an electron (and an antineutrino) during conversion of a neutron into a proton
放射性同位素衰变方式
• Nuclei can spontaneously transform to lower mass nuclei by one of four processes – a-decay – b-decay – electron capture – spontaneous fission • Each process transforms a radioactive parent nucleus into one or more daughter nuclei.
地球化学中的同位素分析

地球化学中的同位素分析地球化学是研究地球化学成分、地球化学过程、地球化学循环和地球化学环境的一门学科。
其中的同位素分析是地球化学中的重要分支之一。
同位素是指具有相同原子序数但不同质量数的单质,在自然界中广泛存在。
同位素分析可用来研究岩石、矿物、水体、大气等自然现象,也可用来解决环境、生物和人类问题。
同位素分析的原理是依据同位素在化学和物理活动中的差异性。
同一元素的同位素化学性质相同,但物理性质不同。
例如,具有同位素^12C和^13C的二氧化碳分子在光谱分析技术中可以被分辨,从而得到不同的信号。
利用这些信号,就可以分析样品中同位素的含量和同位素比值。
同位素分析的方法主要包括质谱法、光谱法、放射性测量法等。
其中,质谱法是同位素分析中最常用的方法之一。
该方法基于质谱仪的原理,利用精确的磁场和电场对离子进行分析,得出不同离子的质量-电荷比,从而测定样品中的同位素含量。
同位素分析在地球化学中有许多应用。
以下介绍几个例子:1.同位素示踪法同位素示踪法是同位素分析中使用最广泛的应用之一。
当同位素被注入到一个系统中时,同位素浓度会随着时间变化而发生变化。
通过测量不同时间点的同位素浓度,可以了解系统中各种物质的来源、分布和移动方式。
地球化学中常用的同位素示踪法包括放射性示踪法和稳定同位素示踪法。
放射性示踪法是将一种有放射性同位素标记注入样品中,通过测量标记同位素的衰变速率和产生的辐射量来示踪样品中物质的分布和运动。
稳定同位素示踪法则是利用稳定同位素测定样品中物质的来源、变化和转移。
2.同位素地球化学同位素地球化学是利用同位素在地球科学中的广泛应用,包括地质学、气候学、生物学和环境科学。
通常情况下,地球化学家使用不同的同位素分析方法来研究样品的化学成分和样品的起源。
例如,根据岩石中铀、钍、锶等放射性同位素的衰变速率,研究岩石的时代和成因;利用碳同位素分析技术,研究生物的食物链变化和生物地球化学过程;通过测量气体中气体同位素的含量和同位素比值,可以研究大气的物理和化学特性。
同位素地球化学

C16O2 (气) +2H218O (液) ≒C18O2 (气) +2H216O (液) , 在 0℃:α=1.064, 23℃:α=1.059;327℃:α=1.014, 可见高温越高,α →1 。
地质体中共存相之间同位素分馏系数α可以通过实测两相δ值结 果用下列公式逼近:
3)半衰期与平均寿命 半衰期(T1/2):放射性母体同位素的原子数衰减到原有 数目的一半所需要的时间。特征常数 平均寿命:放射性母体同位素在衰变前所存在的平均时间。
4)放射性衰变的类型 单衰变 连续衰变与衰变系列:
一个放射性母体、若干个放射性中间子体和一个最终稳定 子体所形成的衰变链称衰变系列 分支衰变:放射性同位素同时存在两种或多种衰变方式, 形成不同的稳定子体。
αA-B=RA/RB=(1+δA/1000)/(1+δB/1000) lnαA-B=ln(1+δA/1000)-ln(1+δB/1000) 通常α是接近于1的数值,
α=1.00χ-1.0χ0 数学上可证明: 1000ln(1.00χ)≈χ
则下式是方便的近似计算式: 1000lnαA-B=δA-δB=ΔA-B 1000lnαA-B=1000ln(1+δA/1000)-1000ln(1+δB/1000)= δA-δB=ΔA-B (同位素分馏值)
1.02000
10.00 5.0
5.00
4.96
1.00498
20.00 15.0
5.00
4.91
1.00493
30.00 20.0
10.00 9.76
1.00980
地球化学中的稳定同位素

地球化学中的稳定同位素稳定同位素是指在自然界中,核外电子数量相同,但质子数或中子数不同的同一元素的不同类型。
在地球化学中,稳定同位素可以用于探究地球和生命的起源和演化,研究大气、水体和岩石圈的物质循环和生态系统的结构与功能。
下面本文将探讨稳定同位素在地球化学中的应用和意义。
一、稳定同位素的定义和特征同一元素的同位素结构、化学性质近似,只有不同中子数的核能够区分它们。
一般地,同位素的质量数是它的质子数和中子数的和,所以同位素的质量通常都不是整数。
而稳定同位素是相对于不稳定同位素而言的。
稳定同位素相对不稳定同位素,在核的构成上有较高的稳定性以及质量数成正比增大。
在地球化学中,常用稳定同位素作为指示地球环境的工具。
其主要特征是原子核中的质子和中子的比值稳定,不会发生α、β、γ衰变。
二、稳定同位素在地球化学中的应用地球化学中的很多研究都需要利用稳定同位素进行探究。
如下是一些稳定同位素在地球化学中的应用:1.碳同位素碳由两种同位素构成,即碳-12和碳-13,其中碳-12占总碳的98.9%。
在生态系统中,生物体对不同碳同位素的利用、转换过程与环境变化密切相关,因此,研究碳同位素在生态系统中的地位和作用,可对生态学、环境保护和气候变化等问题提供重要的参考。
2.氧同位素氧同位素主要包括氧-16、氧-17和氧-18。
在水文地球化学中,氧同位素是水循环研究中的重要因素。
依据氧同位素的比例、分布可以判断水来源,搞清水的运移路径。
同时因为不同温度条件下氧同位素比例存在一定的差异,所以也可以在探究过去的气候变化时提供参考。
3.硫同位素硫同位素有三种,分别为硫-32、硫-33和硫-34。
硫有广泛的利用价值,包括石油和天然气、硫酸等化工品生产,和生物活性。
硫同位素对矿床研究也有很大的帮助。
4.氢同位素常见的氢同位素有氢-1、氘和氚。
氢同位素的存在可以反映一些重要环境参数,如降水来源、植物的水分来源等。
同时,氢同位素还可以用于考察化石水的来源和多层储层的性质等。
地球化学中的元素和同位素地球化学

地球化学中的元素和同位素地球化学地球化学是一个研究地球物质中元素、同位素分布和演化的学科。
元素是构成地球物质的基本物质,同位素则是同一元素中质量数不同的不同原子核。
元素和同位素的地球化学分析可以帮助我们了解地球的演化历史、地球环境变化、地质过程等多个方面。
一、元素的地球化学元素是地球化学研究的基本单位,地球上的元素分布受制于地球的演化历史和物质组成。
总体而言,地球表层分布的元素可以分为地壳元素、海洋元素和大气元素。
地壳元素是地壳中丰富的元素,包括氧、硅、铝、铁、钙等等,它们占到地壳质量的99%以上。
其中最丰富的是氧元素,它占地壳中质量的46.6%,其次是硅元素,占28.2%。
地壳元素的绝大部分都是宇宙尘埃在地球形成过程中沉积下来的,也有部分来自于岩浆的分异作用和地球内部的物质漏失。
海洋元素主要包括钠、氯、镁、钙等,以及微量元素如铬、钴、铜、锌、铅等。
这些元素常常被沉积在海洋底部的海底泥中,它们的含量一般很低且难以采集分析。
大气元素包括氢、氧、氮、碳以及其他的惰性气体。
其中氧和氮占了大气元素的绝大部分,占比分别为21%和78%。
大气元素是通过地球大气层的物理、化学和生物过程不断循环传输的,它们对地球环境的影响也很大。
二、同位素地球化学同位素是同一元素中质量数不同的不同原子核,同位素地球化学就是研究地球物质中同位素分布和演化的学科。
同位素地球化学的核心是同位素分析技术,它包括同位素质谱分析、放射性同位素年代学和同位素示踪技术。
同位素质谱分析是一种高精度的技术手段,它可以对地球物质中同位素的含量进行精确定量分析。
例如,氧同位素的分析可以用来研究古气候变化,硫同位素的分析可以用来追踪地球物质的来源和演化历史,铅同位素的分析可以用来研究地球内部物质演化和大气污染状况等。
放射性同位素年代学是利用放射性同位素的半衰期来测定物质年龄的技术手段。
不同放射性同位素的半衰期不同,因此可以用来测定不同时间尺度的物质年龄,例如,碳-14同位素可以用来测定古代有机物的年代,铀-铅同位素可以用来测定地球地质历史上的时间尺度。
第七讲 同位素地球化学Re-Os同位素体系

0.02 1.59 1.96 13.24 16.15 26.26 40.78
其中187Os和186Os分别为187Re和190Pt的衰变子体。
Re-Os同位素地球化学特征
187Re的半衰期为约42 Ga(= 1.666 10-11 a-1),且Re的 地球化学性质与钼元素十分相近,因此 Re-Os体系作为 定年(如辉钼矿)和示踪研究方法较早得到了地质应用;
Table 1 Osmium isotope ratios and isotope percentage for the University of Maryland at College Park (UMCP) Johnson-Matthey Os standarda
Isotopic ratio Measured value Isotope
Percentage composition
184Os/188Os 0.0013313 ± 13 184Os
0.0177
186Os/188Osb 0.119848 ± 8
186Os
1.593
187Os/188Osb 0.113791 ± 15 187Os
1.513
189Os/188Os 1.21967 ± 14
0.075
Picrite, Basalt
Olivine
20
5
Picrite, Basalt
Sulfide
2000000
Synth MORB Olivine
Experimental Experimental phenocryst-matrix phenocryst-matrix 0.001 Experimental
Vanwestrenen et al. 2000
Rb-Sr——同位素地球化学课件PPT

• 数据点拟合程度的好坏,也是检验所有样品是否一 直保持封闭的一个尺度
0.710 0.708
t>0
87Sr/86Sr
0.706
t=0
0.0
0.5
1.0
1.5
2.0
2.5
3.0
87Rb/86Sr
同源岩浆岩石Rb-Sr同位素演化和等时线图
等时线 的拟合
• 最常用的是双误差最小二乘回归法进行拟合。
• 实际观测也表明,矿物中的Rb—Sr衰变图确 实受到影响 。
基本假设
• 假设在区域变质或接触变质过程中, 87Sr的变 化仅仅是由于放射性同位素87Rb的衰变导致的, 而矿物中铷和锶的浓度基本上保持不变
• 如果在热变质过程中,矿物发生了同位素均匀 化,一般手标本大小的全岩样品都保持着封闭 体系,则可以计算矿物等时年龄(内等时线), 代表变质年龄,而全岩年龄代表成岩年龄
未受变质的沉积岩的年龄测定
• 沉积岩中的含铷矿物,既可以是自生的,也 可以是它地生成的和碎屑的
• 自生的有海绿石、钾盐、光卤石等 • 海绿石较好,可以反映沉积年龄 • 蒸发岩矿物不够稳定,所测年龄不可靠
小结
• 铷和锶是分散元素,它们在火成岩、沉积岩和 变质岩中的浓度从小于几ppm到大于几百ppm。
挑选单矿物时,除了含钾矿物以外,通常还 会挑选一种富钙贫钾矿物,如磷灰石、榍石 等。它投点基本落在纵轴上。
变质岩的年龄测定
变质岩的年龄测定
• 变质作用可以是热变质,也可以有流体的参 与,结果使岩石的总体化学组成和微量元素 成分都可能发生变化。
• 可以预料,变质作用对岩石中存在的天然放 射性元素的母体和子体的关系将产生深刻影 响。
第七章 稳定同位素地球化学

第七章稳定同位素地球化学稳定同位素地球化学研究自然界稳定同位素的丰度及其变化。
同位素丰度发生变化的主要原因是同位素的分馏作用,即轻同位素和重同位素在物质中的分配发生变化,造成一部分物质富集轻同位素,另一部分富集重同位素。
同位素及其化合物在物理或化学性质上的差异叫做同位素效应。
同位素效应的产生从根本上讲是由于同位素在质量上的差异引起的,同位素质量差越大,所引起的物理化学性质上的差异也就越大。
因此,对质量较轻的元素,其同位素的相对质量差异较大。
如H与D 质量差100%,O16和18O质量差12.5%,而204Pb和206Pb质量差仅1%,在目前技术条件下,能测量到的由于同位素效应所造成的自然界同位素丰度变异仅限于质量数小于40的元素内。
这就是稳定同位素地球化学目前所涉及的同位素仅限于元素氢(H/D)、碳(14C/13C)、氧(18O/16O)、和硫(34S/32S)以及硼(11B/10B)、氮(15N/14N)的原因所在。
7.1 同位素分馏和组成的表示7.1.1同位素分馏由于同位素效应所造成的同位素以不同比例在不同物质或不同相之间的分配称为同位素分馏。
这里需引入二个概念。
同位素比值:定义为单位物质中某元素的重同位素和轻同位素的原子数之比,如在陨石中硫同位素比值为:R=34S/32S=1/22.22当我们谈论同位素比值时,总是指重同位素和轻同位素之比。
同位素分馏系数:定义为在平衡条件下,经过同位素分馏之后二种物质(或馏份)中某元素的相应同位素比值之商。
设某二种物质为A,B,某元素的同位素比值为R A,R B,则同位素分馏系数为:所以当我们讨论同位素分馏系数时,必须指明是那种物质对那种物质。
一般α值为接近1的一个数字,离1愈远,同位素分馏就愈大,α=1表示物质间无同位素分馏。
R值可通过具体对象的测定而获得,某种物理化学环境下的α值则可通过实验过程确定。
把R和α两者联系起来,可用来探讨地质过程的物理化学状况。
18-同位素地球化学PPT课件
235U → 207Pb + 7 + 4 - + E
t1/2 = 704 106yr 2= 9.8485 10-10yr-1
232Th 228 Ra ...... 224 Ra 220 Rn ...... 212 Pb ...... 208 Pb
Pb Pb
207 204
Pb Pb
i
235U 204 Pb
(e235t
1)
208 Pb 204 Pb
208 204
Pb Pb
i
232Th (e232t 204 Pb
1)
11
U-Th-Pb同位素体系
由于U-Th-Pb体系可构成相互独立的衰变体系,原理上 对同一地质体进行同位素分析,可获得三个独立的年龄 值。如所分析样品符合等时线前提,238U-206Pb、235U207Pb、232Th-208Pb体系应该给出一致的年龄(相对误差 小于或等于10%);然而,由于U、Pb的易活动性,在 风化作用和低级变质作用,常可导致体系U-Pb同位素组 成不能保持封闭,往往得不到一致年龄,因此用等时线 法成功获得有意义年龄的实例相对有限。
20
谐和曲线
假如矿物形成于3.0Ga,则 其具谐和年龄的207Pb/235U、
206Pb/238U比值将分别为 18.1902和0.59249
21
如果样品铅丢失或铀获得,则坐标点落在一致曲线下方;
如果样品铅获得或铀丢失,则坐标点落在一致曲线上方.
若样品形成后丢失部分放射成因铅,随后又封闭,那么 一组经历相同的样品,在207Pb*/ 235U和 206Pb*/ 238U为横 纵坐标的图上的数据点就构成了一条直线,即不一致线。
地球化学中的同位素分析技术

地球化学中的同位素分析技术地球化学是研究地球物质成分、构成和演化规律的一门学科。
同位素分析技术作为地球化学研究的重要手段,可以用于各种矿物的研究,例如岩石、水和大气等自然物质。
同位素是同一元素但原子核中质子数不同的不同种态形式,它们所属的元素拥有相同的原子序。
同位素具有相同的化学性质和电子结构,但是由于核外电子数量的不同会导致不同的物理性质。
有些同位素还会发生不稳定性衰变,因此也被称为放射性同位素。
同位素分析技术就是利用这种同位素的特性进行研究的。
同位素的分析方法主要有质谱法和放射性测定法。
其中,质谱法是利用同位素在不同质谱分子间互相转化的特性,进行同位素分离和分析的方法。
其实质是在质谱分析仪中,将样品中的同位素分子通过不同的方法分离出来,然后进行计数和分析。
这种方法特别适合分析矿物、岩石和水等地质样品中的稳定同位素和放射性同位素。
放射性测定法则是利用同位素自然放射性衰变所释放出来的放射性粒子信息作为分析元素的依据。
利用同位素放射性的特性,可以用气流计数仪或液体闪烁计数器等装置对样品进行测量,测定其放射性活度。
这种方法常用来测定重要地球元素的同位素含量,例如铀、钍和钾等元素,以及它们在地球物质中的分布规律。
同位素分析技术在地球化学研究中应用广泛,例如:1. 在水文地球化学中,通过同位素分析技术,可以测定各种水体中的同位素含量,进而推断各种水体的成因、运动和分布等信息。
2. 在矿床地球化学中,同位素分析技术可以研究矿物的成因和变质作用,帮助提高矿集区的勘查效率。
3. 在环境地球化学中,同位素分析技术可以探究大气、水体、土壤和生物等介质中的物质交换过程,以及其对环境变化的响应等。
总的来说,同位素分析技术在地球化学研究中具有不可替代的作用,可以为研究人员提供高精度、高分辨率的实验数据,进而深入理解地球物质的成分和演化规律。
同位素地球化学复习资料

14、硫、碳同位素分馏作用? 答:Ⅰ、S ⑴、化学动力学分馏:主要指硫在氧化-还原反应过程中所产生的硫同位素分馏; ⑵、生物动力学分馏:自然界硫同位素组成变化重要原因之一是厌氧细菌引起硫酸盐离子的还原作 用; ⑶、平衡分馏:高氧化的硫富34S,SO42- >SO32- >SO2 >Sx > H2S > S2-(原因:键强)。 Ⅱ、C ⑴、氧化-还原反应:CH4 +2H2O <=> CO2+4H2 ⑵、光合作用:6CO2 +6H2O => C2H12O6+6O2(有机物中将富集 12C) ⑶、同位素交换反应:13CO2(气) +12CO32-(液) <=> 12CO2(气) +13CO32-(液) 一般规律: δ13C‰:CO<CH4<C<CO2<CO32-即:还原态、有机物富集12C, 氧化态、无机物富集13C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(5)核素具有放射性:所谓放射性即不稳定核素通 过放射出粒子及辐射能量,而自发地调整核内 的组成和结构,转变为稳定的核素的现象,称 为放射性衰变。放射性衰变的结果,使核素的 质量、能量和核电荷 数都发生变化,从而变为 另外一种元素。
(二) 同位素分类
(1)核素具有电荷:一个质子带有一个 单位的正电荷,原子的核电荷数等于质子 数,并由此决定原子的核外电子数。核电 荷数一旦改变就变成了另外一种元素,同 时核电荷数也影响着核的组成及结构,即 决定核的稳定性。
(2)核素具有质量:核素因含有不同数 量的质子和中子,而具有不同的质量,较 轻元素的同位素之间因质量差别导致在地 质作用中的分异,这样,使得不同产状的 地质体中同位素间的相对丰度发生变化。
例如:氧同位素有两种制样方法:
(1)还原法: 高温条件下与C还原成CO;
(2)氧化法: 用F或卤化物氧化,生成O2(精度 高)。
2.质谱仪测定:
质谱仪是目前同位素成分测定的主要 手段(MAT—261,MAT—251)。其工 作原理是:把待测元素的原子或分子正 离子化,并引入电场和磁场中运动,带 正电的质点因质量不同而被分离测定。
(三) 同位素成分的测定及表示方法
一般来说质量数A<209的同位素大部分是稳定 的,只有少数是放射性的,如14C,40K,87Rb;而质 量数大于209的同位素全部属于放射性同位素。 一种元素可由不同数量的同位素组成。自然界中
同位素最多的是Sn元素,有10个同位素: 112,114,115,116,117,118,119,120,
(3)核素具有丰度:自然界的核素具有两种丰度。
一是核素的绝对丰度,是指自然界各种核素存在的 总量,它与组成核素的核子数量和结构有关,反映核 素的稳定性。
当原子序数Z<20时,N/P=1,核素最稳定,绝对 丰度高;
当20<Z<83时,N/P=1.5,最稳定;
当Z>83时,N/P偏离1或1.5,核素不美国南卡罗莱纳州,皮迪组的 美洲箭石(已耗尽)
2)示踪作用:同位素成分的变化受到作 用环境和作用本身的影响,为此,可利用 同位素成分的变异来指示地质体形成的环 境条件、机制,并能示踪物质来源。
3)测温作用:由于某些矿物同位素成分变 化与其形成的温度有关,为此可用来设计各 种矿物对的同位素温度计,来测定成岩成矿 温度。
另外亦可用来进行资源勘查、环境监测、 地质灾害防治等。
3.同位素成分表示方法:
1)绝对比率(R):用两个同位素比值直 接表示,例如32S/34S,12C/13C等;
2)对标准样品R的绝对比率差(ΔR)
ΔR = R样品 - R标准;
3)样品相对于标准样品R的偏离程度的 干分率:
δ‰=(R样—R标)/R标×1000
=(R样/R标—1) ×1000
例如对34S/32S相对于标准样品的富集程度,
二是核素的相对丰度,是指元素同位素所占总质量 的百分数,例如大气中三个氧同位素的相对丰度是: 16O:99.763%; 17O:0.0375%;18O:0.1995% 。
(4)核素具有能量:原子核聚集高质量的粒子于一 个极小的体积内,因此,原子核内孕含着巨大 的能量,即核能,也称“结合能”。结合能越 高核素越稳定;结合能低(如H、N、Li、Be及 高质量 数的核素)的核素不稳定。在核衰变过
一、自然界引起同位素成分变化的原因
(一)核素的性质 1.什么叫核素?
由不同数量的质子和中子按一定结构组成各种 元素的原子核称为核素,任何一个核素都可以用 A=P+N这三个参数来表示。
而具有相同质子数,不同数目中子数所组成的 一组核素称为同位素。
O的质子数P=8,但中子数分别为8、9、10, 因此,氧有质量数分别为16O、 17O、18O三个同位 素。
即以 δ34S‰ 来表示: δ34S‰=[((34S/32S)样/(34S/32S)标)-1] ×1000
习惯上把微量(较小相对丰度)同位素放 在R的分子上,这样可以从样品的δ值,直 接看出它含微量同位素比标准样品是富集 了,还是贫化了。
δ>0表示34S比标准样品是富集了;
δ<0表示34S比标准样品是贫化了。
从核素的稳定性来看,自然界存在两大类同位 素:
一类是其核能自发地衰变为其它核的同位 素,称为放射性同位素;
另一类是其核是稳定的,到目前为止,还 没有发现它们能够衰变成其它核的同位素,称为 稳定同位素。
然而,核素的稳定性是相对的,它取决于 现阶段的实验技术对放射性元素半衰期的检出范 围,目前一般认为,凡是原子存在的时间大于 1017年的就称稳定同位素,反之则称为放射性同 位素 。
122,124 Sn
自然界也存在只有一种同位素单独组成的元素:
Be、F、Na、Al、P等27种。其余大多数由2-5种同 位素组成。
一个完整的同位素样品的研究包括样品的采 集、加工、化学制样、测定及结果的计算和解释 等环节。下面简单介绍一下化学制样及质谱仪测 定方法。
1.制样
将地质样品分解,使待测元素的同位素转化为在 质谱仪上 测定的化合物,轻稳定同位素一般制成 气体样品。
地球化学
第七章 同位素地球化学
陈远荣
2011 年 11月
桂林理工大学地球科学学院
本章内容
自然界引起同位素成分变化 的原因 同位素年代学 稳定同位素地球化学
同位素地球化学是研究地壳和地球
中核素的形成、丰度及其在地质作用中 分馏和衰变规律的科学。
同位素地球化学在解决地学领域问题的独 到之处:
1)计时作用:每一对放射性同位素都 是一只时钟,自地球形成以来它们时时刻 刻地,不受干扰地走动着,这样可以测定 各种地质体的年龄,尤其是对隐生宙的前 寒武纪地层及复杂地质体。
4)同位素标准样品 同位素分析资料要能够进行世界范围内
的比较,就必须建立世界性的标准样品。 世界标准样品的条件: ①在世界范围内居于该同位素成分变化的 中间位置,可以做为零点;
②标准样品的同位素成分要均一;
③标准样品要有足够的数量;
④标准样品易于进行化学处理和同位素测 定。
元素
标准样
缩写
H、O
大洋水平均
