烃及烃的衍生物之间转化关系详图
高三有机化学中有机物间相互转化关系图

一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
(完整版)总结烃及烃的衍生物之间转化关系

烃及烃的衍生物之间转化关系注意从原子个数、结构差异、官能团、反应条件去分析每一种情况的转化,有一种反应联想到一类反应:332CH 3① CH 2=CH 2+H 2 CH 3CH 3 注:加成H 2时Ni 作催化剂;题目中若出现Ni ,应想到加② CH 2=CH 2+HBr CH 3CH 2Br 注:反应类型:加成反应。
③ CH 3CH 2Br +H 2O CH 3CH 2OH +HBr 注:卤代烃水解生成醇,条件为NaOH 水溶液,OH -时反应最完全。
反应类型:取代反应或水解反应。
④ 2CH 3CH 2OH +O 22CH 3CHO +2H 2O注:醇被氧化生成醛,Cu 或Ag 作催化剂,加热。
反应类型:氧化反应。
⑤ 2CH 3CHO +O 2 2CH 3COOH 注:醛被氧化生成羧酸;若题目中出现一步“氧化”或连续的两步“氧化”,应想到是醇、醛到羧酸的转化。
反应类型:氧化反应。
银镜反应:2[Ag(NH 3)2OH]+R -CHO R -COONH 4+2Ag↓+H 2O +3NH 3↑新制Cu(OH)2:R -CHO +2Cu(OH)2R -COOH +Cu 2O +2H 2O⑥ CH 3COOH +CH 3CH 2CH 3COOCH 2CH 3+H 2O 注:酸和醇发生酯化反应,条件为浓H 2SO 4、加热,注意“,别忘记H 2O ”。
反应类型:取代反应或酯化反应。
⑦ CH 3COOCH 2CH 3+H 2O CH 3COOH +CH 3CH 2OH“NaOH 、H +”是先生成Na +盐,再生成酸。
另外,-CONH -是肽键,也能水解,同样碱性条件反应最完全。
反应类型:取代反应。
⑧CH 3CHO +H 2CH 3CH 2OH 注:醛和H 2反应生成醇;若题目中出现一步“还原”,应想到是醛到醇的转化。
类型:还原反应、加成反应。
注:羧基(-COOH )、酯基(-COO -)和H 2不反应。
烃及其衍生物之间的相互转化关系
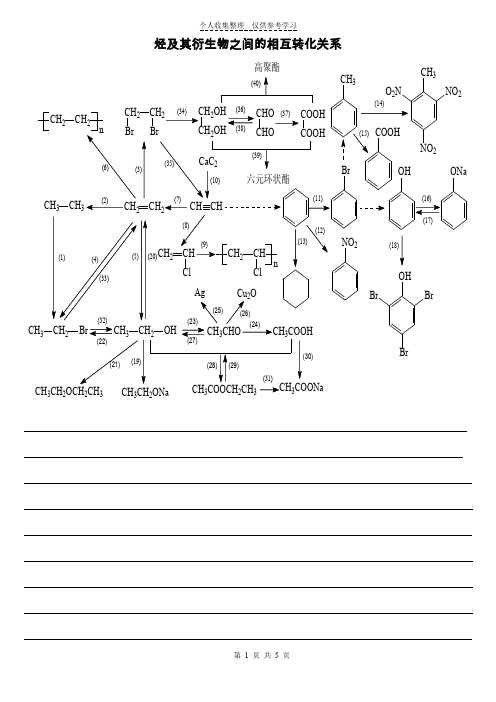
个人收集整理 仅供参考学习第 1 页 共 5 页烃及其衍生物之间的相互转化关系CH CH 3323高聚酯CH 3CH 2ONaCH 3CH 2OCH 2CH 33个人收集整理仅供参考学习第 2 页共5 页个人收集整理仅供参考学习第 3 页共5 页个人收集整理 仅供参考学习第 4 页 共 5 页(1)CH 3CH 3+Br 2光照CH 3CH 2Br+HBr (2)CH 2=CH 2+H 2催化剂△CH 3CH 3 (3)CH 2=CH 2+Br 2CH 2BrCH 2Br (4)CH 2=CH 2+HBr CH 3CH 2Br(5)CH 2=CH 2+H 2O 浓H 2SO 4CH 3CH 2OH(6)n CH 2=CH 2催化剂CH 2CH 2n(7)CH ≡CH+H 2催化剂△CH 2=CH 2(8)CH ≡CH+HCl催化剂△CH 2=CHCl(9)CH 2CH Cl2CH Cln n(10)CaC 2+2H 2O CH ≡CH ↑+Ca(OH)2(11) + Br 2催化剂Br+HBr(12)+ HO -NO 22SO 4△NO 2+ H 2O(13)+3H 2催化剂△(14)CH 3+ 3HO -NO 22SO 4△CH 3O 2N 2NO 2+3H 2O(15)CH 34或酸性K 2Cr 2O 7COOH(16)2OH +2Na 2ONa +H 2↑OH +NaOHONa +H 2OOH +Na 2CO 3ONa +NaHCO 3(17)ONa +HCl OH +NaClONa +CO 2+H 2O OH +NaHCO 3(18)OH+3Br 2OHBrBr↓+3HBr(19)2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑ (20)CH 3CH 2OH2SO 40CH 2=CH 2↑+H 2O个人收集整理 仅供参考学习第 5 页 共 5 页(21)C 2H 5-OH+HO -C 2H 5浓H 2SO 40C 2H 5-O -C 2H 5+H 2O (22)CH 3CH 2OH+HBr △CH 3CH 2Br+H 2O (23)2CH 3CH 2OH+O 2催化剂△2CH 3CHO+2H 2O CH 3CH 2OH+CuO△CH 3CHO+Cu+H 2O (24)2CH 3CHO+O 2催化剂△2CH 3COOH(25)CH 3CHO+2Ag(NH 3)2OH △CH 3COONH 4+2Ag ↓+3NH 3+H 2O(26)CH 3CHO+2Cu(OH)2△CH 3COOH+Cu 2O ↓+2H 2O(27)CH 3CHO+H 2催化剂△CH 3CH 2OH(28)CH 3COOH+HOC 2H 5浓H 2SO 4△CH 3COOC 2H 5+H 2O (29)CH 3COOC 2H 5+H 2O稀H 2SO 4△CH 3COOH+C 2H 5OH(30)2CH 3COOH+2Na2CH 3COONa+H 2↑ 2CH 3COOH+Na 2O 2CH 3COONa+H 2O CH 3COOH+NaOH CH 3COONa+H 2O2CH 3COOH+Na 2CO 32CH 3COONa+H 2O+CO 2↑ CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑(31)CH 3COOC 2H 5+NaOH△CH 3COONa+C 2H 5OH (32)CH 3CH 2Br+NaOH △水CH 3CH 2OH+NaBr (33)CH 3CH 2Br+NaOH △乙醇CH 2=CH 2↑+NaBr+H 2O(34)CH 2BrCH 2Br + 2NaOH△水CH 2OH CH 2OH+2NaBr(35)CH 2BrCH 2Br+2NaOH△乙醇CH ≡CH ↑+2NaBr+2H 2O(36)CH 2OH 2OH+O 2催化剂△CHO +2H 2O(37)CHO +O 2催化剂△COOH(38)CHO+2H 2催化剂△CH 2OH CH 2OH(39)COOH +CH 2OH CH 2OH浓H 2SO 4△C O C O OO CH 2CH 2+2H 2O(40)n COOH+n CH 2OH CH 2OH 浓H 2SO 4△C HO O C OO CH 2CH 2O H n+(2n -1)H 2O。
烃的衍生物 PPT

CH2OH
2) 根据醇分子结构中羟基的数目,醇可分为一
元醇、二元醇、三元醇……
CH
C3 H C2 H C2 H OH
2-OH
丙醇(一元醇)
CH 2OH
乙二醇(二元醇)
CH 2 -OH CH-OH 丙CH三醇2 O(H三元醇)
饱和一元醇通式:CnH2n+1OH或CnH2n+2O
乙二醇和丙三醇都是无色、黏稠、有甜味的液
4、化学性质 1)弱酸性
苯酚能与碱反应,体现出它的弱酸性。因此, 苯酚俗称石炭酸。
ONa
OH
+CO2+H2O
+NaHCO3
说明:苯酚酸性很弱,比碳酸还弱。
2)与溴反应 (可用于苯酚定性检验与定量测定)
OH
OH
+ 3Br2
Br
Br↓+3HBr
Br
①浓溴水与苯酚在苯环上发生取代反应。这说明 羟基对苯环产生了影响,使取代更易进行。 ②溴取代苯环上羟基的邻、对位。(与甲苯相似) ③该反应很灵敏,可用于苯酚的定性检验 ④不能用该反应来分离苯和苯酚
69《烃的衍生物》
据我国《周礼》记载,早在周朝就有酿酒 和制醋作坊,可见人类制造和使用有机物有很 长的历史。
从结构上看,酒、醋、苹果酸、柠檬酸等 有机物,可以看作是烃分子里的氢原子被含有 氧原子的原子团取代而衍生成的,它们被称为 烃的含氧衍生物。
烃的含氧衍生物种类很多,可分为醇、酚、 醛、羧酸和酯等。烃的含氧衍生物的性质由所含 官能团决定。利用有机物的性质,可以合成具有 特定性质而自然界并不存在的有机物,以满足我 们的需要。
体,都易溶于水和乙醇,是重要的化工原料。
乙二醇可用于汽车作防冻剂,丙三醇可用于配 制化妆品。
化学课件《烃》优秀ppt的含氧衍生物》ppt6 人教课标版

·
专
题
对
章末复习提升课(三)
点 演
练
真 题 体 验
一、烃的衍生物
二、烃及其衍生物的转化关系
【答案】 一、①—X ②—OH ③不能 ④—CHO ⑤—COOH
⑥
二、①CH≡CH+H2―N△―i→CH2===CH2 ②CH2===CH2+H2―N△―i→C2H6 ③C2H6+X2―光―→C2H5X+HX ④C2H5X+NaOH―醇 △―→CH2===CH2↑+NaX+H2O ⑤CH2===CH2+HX―→C2H5X ⑥CH2===CH2+H2O―→C2H5OH
(3)先占位后移除 在芳香族化合物的苯环上,往往先引入一个基团,让它占 据苯环上一定的位置,反应完毕后再将该基团除去。这也是有 机合成中常用的一种策略。
2.有机推断题的常见“突破口”
专题对点演练 点击图标进入…
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
(1)先消去后加成 使官能团转换位置或数目增多一般都采取先消去后加成的 方法,可以由醇或卤代烃先发生消去反应,再与HX、X2或H2O 发生加成。这是有机合成中一种常用的策略。 (2)先保护后复原 在进行有机合成时经常会遇到这种情况:欲对某一官能团 进行处理,其它官能团可能会受到“株连”而被破坏。我们可 以采用适当的措施将不需转变的官能团暂时先“保护”起来, 当另一官能团已经转变后再将其“复原”。这是有机合成中又 一种常用的策略。
重要烃及烃的衍生物性质及转化关系
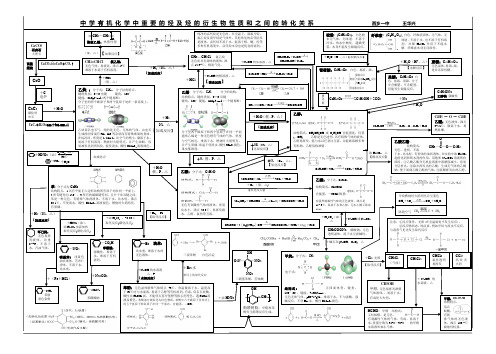
:正四面体型;键角:109°28';键能:413KJ/mol 。
无色无味气体,p=0717g/L ,难溶于水,不与强酸、强碱反应,不使Br 2水、酸性KMn04褪色。
键角:120°键能:615kJ/mol(一个键易断分子里两个碳原子和四个氢原子在同一平面通常乙烯是一种无色稍有气味的气体,密度与空气相近,难溶于水。
燃烧时火焰明亮,并产生黑烟。
常温下使溴水、酸性KMnO 甲烷燃烧时火焰明亮并呈蓝色注意:①反应条件:光照(在室温暗处不发生反应);②反应物状态:纯卤素,例如甲烷与溴水不反应,与溴蒸气见光发生取代反应分子里的两个碳原子和两个氢原子处在一条直线上。
乙炔俗名电石气,纯的是无色、无味的气体,由电石生成的因常混有PH 3、H 2S 等杂质而有特殊难闻的臭味。
在标况时,密度是1.16g/L ,比空气的稍小,CH具有平面正六边形结构所有原子均在同一平面上;所有的碳碳键等同,且介于单双键之间。
苯是一种无色、有特殊气味的液体,不溶于水,比水轻,沸点KMn0溶液褪色。
燃烧时火焰明亮,乙醛:分子式:C 2H 4O无色有刺激性气味的液体,密度比水小,沸点20.8℃,易挥发跟水、乙醇、氯仿等互溶。
羧基)有强烈刺激性气味的无色液体,沸点是易溶于水和乙醇。
无水乙酸又称冰乙醇:结构简式:CH 3CH 2OH 或C 2H 5OH 官能团是:羟基(—OH) 乙醇是无色透明、具有特殊气味的液体,CH 2CH 纤维素:(C 6H 10O 5⎪⎪⎩⎪⎪⎨⎧C 6H 12O 6−−催化剂酒化结构式:有刺激性气味的气体、有毒、易溶于结构特点: 蚁酸, 味的无色液体,沸点100.7℃腐蚀性较强。
三溴苯酚 白色沉淀OH+Br 水C 2H 5OH +3O 2−−→−点燃2CO 2+3H 2O。
高三有机化学中有机物间相互转化关系图

一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
高中化学《烃及其衍生物转化关系图》优质课PPT课件
已知:化合物A、B、F互为同分异构体。
NH2 O=CH
(1)下列说法不正确的是 A
A.化合物C能发生氧化反应,不发生还原反应
B.化合物D能发生水解反应
C.化合物E能发生取代反应
D. 化合物F能形成内盐
合成染料中间体X和医药中间体Y。 ?
已知:化合物A、B、F互为同分异构体。
(2) B+C→D的化学方程式是
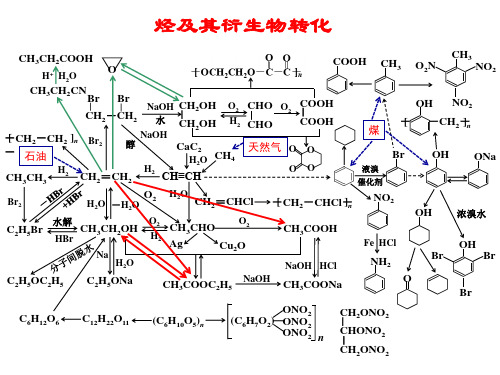
天然气 O O
OO
OH NO2 煤 -[ -CH2-]n
Br
液溴 催化剂
OH ONa
Br2
C2H5Br
H2O -H2O O2
水解
HBr CH3CH2OH
O2 H2
Na H2O
H2O CH2=CHCl
CH3CHO
O2
Ag
Cu2O
-[ CH2-CHCl-]n NO2
CH3COOH
NaOH HCl
Fe HCl
烃及其衍生物转化
-- - -
-
CH3CH2COOH
H+ H2O
O
COOH
CH3
O2N
CH3 NO2
CH3CH2CN Br Br CH2-CH2
NaOH CH2OH 水 CH2OH
O2 CHO O2 COOH
H2 CHO
COOH
-[ CH2-CH2 ]n - 石油
Br2
NaOH
醇
CaC2
H2O
CH4
CH3CH3 H2 CH2=CH2 H2 CH≡CHΒιβλιοθήκη NH2OH 浓溴水
OH
Br
Br
C2H5OC2H5 C2H5ONa
CH3COOC2H5 NaOH CH3COONa
2007-06-烃与烃的衍生物的相互转化(公开课课件)

CnH2n+2
取代
CnH2n+1X
水解
取代
CnH2n+1OH
醇的催化氧化特点
• 与羟基(-OH)相连碳原子上有两个氢原子的醇(即 羟基在碳链末端,碳原子为伯碳原子)的醇被氧化成醛 Cu 2RCH2OH + O2 2RCH2CHO + 2H2O.
△
· 与羟基(-OH)相连碳原子上有一个氢原子的(即羟基
示范课
有机物之间的衍变关系 -----以卤代烃(化学性质) 为纽带的烃与烃的衍生物
间相互转化关系的复习
察布查尔县第一中学 2007年4月10日
贺红岩
教学要求及课时分配
• 方法目的:澄清和熟悉各官能团的特征 和典型物质的转变关系,提高学习效率。 • 复习课时:二课时 • 复习要求:课前完成相关知识点的预习 以及学案中的例题习题。
常见烃的衍生物及其能发生的化学反应类型: RX 卤代烃 CnH2n+1X 水解(取代) 、消去 ROH 醇 CnH2n+2O 取代、氧化、消去、酯化 RCHO 醛 CnH2nO 加成(还原)、氧化 RCOOH 羧酸 CnH2nO2 酸的通行、酯化 RCOOR`酯 CnH2nO2 水解(取代) 特别提醒:要求会书写课本中最熟悉最基本的化学 反应方程式
一、回归课本复习基础知识
• 常见的官能团 官能团:决定化合物特殊性质的原子或 原子团 识别常见的官能团: “C=C”、“C≡C、卤原子(-X) 羟基(-OH) 醛基(-CHO) 羰基(-CO) 羧基(-COOH) 酯基(-COO-)硝基(-NO3 ) 氨基(-NH2 ) 肽键(-CONH- )
常见饱和一元的烃的衍生物 及其通式和其化学反应类型
△
高三有机化学中有机物间相互转化关系图

一、有机物间相互转化关系二、能与溴水发生化学反响而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃〔烯烃、炔烃、二烯烃等〕⑵ 不饱和烃的衍生物〔烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等〕 ⑶ 石油产品〔裂化气、裂解气、裂化汽油等〕⑷ 含醛基的化合物〔醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等〕 ⑸ 天然橡胶〔聚异戊二烯〕 2、无机物:⑴ -2价的S 〔硫化氢及硫化物〕⑵ + 4价的S 〔二氧化硫、亚硫酸及亚硫酸盐〕 ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3+ 2FeBr 3 6FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 3 2FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2 ⑷ Zn 、Mg 等单质 如⑸ -1价的I 〔氢碘酸及碘化物〕变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O变色Mg + Br 2 === MgBr 2 〔其中亦有Mg 与H +、Mg 与HBrO 的反响〕△HBrO + Na2CO3 = NaBrO + NaHCO3三、能萃取溴而使溴水褪色的物质上层变无色的〔ρ>1〕:卤代烃〔CCl4、氯仿、溴苯等〕、CS2等;下层变无色的〔ρ<1〕:直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃〔如己烷等〕等四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴不饱和烃〔烯烃、炔烃、二烯烃等〕⑵不饱和烃的衍生物〔烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等〕⑶石油产品〔裂化气、裂解气、裂化汽油等〕⑷醇类物质〔乙醇等〕⑸含醛基的化合物〔醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等〕⑹天然橡胶〔聚异戊二烯〕⑺苯的同系物2、无机物:⑴氢卤酸及卤化物〔氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物〕⑵ + 2价的Fe〔亚铁盐及氢氧化亚铁〕⑶-2价的S〔硫化氢及硫化物〕⑷ + 4价的S〔二氧化硫、亚硫酸及亚硫酸盐〕⑸ 双氧水〔H 2O 2〕五、常见的各类有机物的官能团,构造特点及主要化学性质(1)烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 构造特点:键角为109°28′,空间正四面体分子。
有机官能团转化规律

NO2
1
官能团转化与引入关系图
1. CH3—CH2 OH ( 消去反应
浓硫酸 170℃
) CH2=CH2
(加成反应)
CH2—CH2 Cl Cl
(水解或取代)
CH2—CH2 OH OH
(氧化反应 )
酯化
H—C—C—OH O O
(氧化 )
缩聚
HO—C—C—OH O O
生物发酵
葡萄糖 2. CH3—CH2 Cl
光合作用
[CH2—CH2—O]n CO2+H2O ) CH2=CH2 (加成反应 )
(加聚反应)
CH2—O—C=O
CH2—CH2 O ) CH2=CH Cl
OO HOCH2CH2-O-C-C-OH [OCH2CH2OCOCO]n
CH2—O—C=O
(消去反应
CH2—CH2 Cl Cl
(消去反应
(加成反应 )
CH2—CH—Cl Cl Cl
(加成反应 ) (水解或取代) CH2—CH—Br Br Cl 3. CH2=CH2 5. CH≡CH
3 分子成环 硝化取代 —NO2 加成 HCN
(水解或取代) CH2—CH OH O
加成 HCN
氧化
CH2—C—OH OH O CH2 = CH COOH
4. CH3—CH2 CN
CH3—COOH
CH2=CH—Cl
[CH2—CHCl]n
油 脂
动 植 物
蛋 白 质
CH3
H2 Ni 浓 H2SO4 HNO3 Cl —OH OH 浓 H2SO4 HNO3 CH3 浓 H2SO4 HNO3 O2N— —NO2 NO2 O2N— —NO2 —NO2 Fe 稀盐酸 —NH2
烃的衍生物知识总结 PPT2 苏教版

(1)氧化反应 (2)还原反应
—COOH R—COOH CH3COOH CnH2nO2
(1)具有酸性 (2)酯化反应
—COO— RCOOR` CH3COOC2H5 CnH2nO2
水解反应
•
15、如果没有人为你遮风挡雨,那就学会自己披荆斩棘,面对一切,用倔强的骄傲,活出无人能及的精彩。
•
16、成功的秘诀在于永不改变既定的目标。若不给自己设限,则人生中就没有限制你发挥的藩篱。幸福不会遗漏任何人,迟早有一天它会找到你。
•
17、一个人只要强烈地坚持不懈地追求,他就能达到目的。你在希望中享受到的乐趣,比将来实际享受的乐趣要大得多。
•
18、无论是对事还是对人,我们只需要做好自己的本分,不与过多人建立亲密的关系,也不要因为关系亲密便掏心掏肺,切莫交浅言深,应适可而止。
醇 △
CH2==CH2
+ NaBr
卤代烃
卤代烃中卤素原子的检验: 取少量卤代烃,加NaOH溶液,一 段时间后加HNO3酸化后再加 AgNO3,如果有白色沉淀说明有Cl¯, 如有浅黄色沉淀则有的衍生物
卤代烃
醇类
醛类
羧酸
酯
酚
通式:R—OH,饱和一元醇CnH2n+1OH
烃的衍生物
卤代烃
醇类
醛类
羧酸
酯
酚
通式:R—COOH,一元饱和酸CnH2n+1COOH,
羧
分子式CnH2nO2
酸
(1)具有酸的通性(羧酸盐几乎
代表物
CH3COOH HCOOH
化性
全溶于水) (2)与醇酯化成酯(酸脱羟基醇脱氢)
烃及烃的衍生物之间转化关系详图

烃及烃的衍生物之间转化关系注意从原子个数、结构差异、官能团、反应条件..................去分析每一种情况的转化,有一种反应联想到一类反应:CHCH 23CHO CH 32CH 3① ⑤⑥① CH 2=CH 2+H 2 CH 3CH 3 注:加成H 2时Ni 作催化剂;题目中若出现Ni ,应想到加成反应。
反应类型:加成反应或还原反应。
② CH 2=CH 2+HBr CH 3CH 2Br 注:反应类型:加成反应。
③ CH 3CH 2Br +H 2O NaO H CH 3CH 2OH +HBr 注:卤代烃水解生成醇,条件为NaOH水溶液,可以加热或不加热;水解在OH -时反应最完全。
反应类型:取代反应或水解反应。
④ 2CH 3CH 2OH +O 2 催化剂 △2CH 3CHO +2H 2O注:醇被氧化生成醛,Cu 或Ag 作催化剂,加热。
反应类型:氧化反应。
⑤ 2CH 3CHO +O 2 催化剂△2CH 3COOH 注:醛被氧化生成羧酸;若题目中出现一步“氧化”或连续的两步“氧化”,应想到是醇、醛到羧酸的转化。
反应类型:氧化反应。
银镜反应:2[Ag(NH 3)2OH]+R -CHO △R -COONH 4+2Ag↓+H 2O +3NH 3↑新制Cu(OH)2:R -CHO +2Cu(OH)2△R -COOH +Cu 2O +2H 2O⑥ CH 3COOH +CH 3CH 2OH △浓硫酸CH 3COOCH 2CH 3+H 2O 注:酸和醇发生酯化反应,条件为浓H 2SO 4、加热,注意“,别忘记H 2O ”。
反应类型:取代反应或酯化反应。
⑦ CH 3COOCH 2CH 3+H 2O △CH 3COOH +CH 3CH 2OH注:酯的水解,酸性、碱性条件均可,碱性条件水解最完全。
题目中出现“NaOH 、H +”是先生成Na +盐,再生成酸。
另外,-CONH -是肽键,也能水解,同样碱性条件反应最完全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烃及烃的衍生物之间转化关系
注意从原子个数、结构差异、官能团、反应条件..................去分析每一种情况的转化,有一种反应联想到一类反应:
CH
23CHO CH 32CH 3
⑤
⑥
① CH 2=CH 2+H 2 CH 3CH 3 注:加成H 2时Ni 作催化剂;题目中若出现Ni ,应想到加成反应。
反应类型:加成反应或还原反应。
② CH 2=CH 2+HBr CH 3CH 2Br 注:反应类型:加成反应。
③ CH 3CH 2Br +H 2O NaO H CH 3CH 2OH +HBr 注:卤代烃水解生成醇,条件为NaOH
水溶液,可以加热或不加热;水解在OH -
时反应最完全。
反应类型:取代反应或水解反应。
④ 2CH 3CH 2OH +O 2 催化剂 △
3CHO +2H 2O
注:醇被氧化生成醛,Cu 或Ag 作催化剂,加热。
反应类型:氧化反应。
⑤ 2CH 3CHO +O 2 催化剂
△2CH 3COOH 注:醛被氧化生成羧酸;若题目中出现一步“氧化”或连续的两步“氧化”,应想到是醇、醛到羧酸的转化。
反应类型:氧化反应。
银镜反应:2[Ag(NH 3)2OH]+R -CHO △
R -COONH 4+2Ag↓+H 2O +3NH 3↑
新制Cu(OH)2:R -CHO +2Cu(OH)2△
R -COOH +Cu 2O +2H 2O
⑥ CH 3COOH +CH 3CH 2OH △浓硫酸
CH 3COOCH 2CH 3+H 2O 注:酸和醇发生酯化反
应,条件为浓H 2SO 4、加热,注意“,别忘记H 2O ”。
反应类型:取代反应或酯化反应。
⑦ CH 3COOCH 2CH 3+H 2O △CH 3COOH +CH 3CH 2OH
注:酯的水解,酸性、碱性条件均可,碱性条件水解最完全。
题目中出现“NaOH 、H +”是先生成Na +
盐,再生成酸。
另外,-CONH -是肽键,也能水解,同样碱性条件反应最完全。
反应类型:取代反应。
⑧CH 3CHO +H 催化剂
△CH 3CH 2OH 注:醛和H 2反应生成醇;若题目中出现一步“还原”,应想到是醛到醇的转化。
类型:还原反应、加成反应。
注:羧基(-COOH )、酯基(-COO -)和H 2不反应。
⑨CH 3CH 2OH +HBr △ CH 3CH 2Br +H 2O 注:HBr 通常用1:1的硫酸和NaBr 代替。
反应类型:取代反应。
而制取HBr 气体或氢溴酸,是用浓磷酸和NaBr 固体加热反
应,保证HBr 逸出。
⑩CH 3CH 2Br NaOH 醇
△ CH 2=CH 2+HBr 注:卤代烃在NaOH 醇溶液条件下生成烯,
注意和NaOH 水溶液区别。
反应类型:消去反应。
11
CH 2=CH 2+H 2O
催化剂
加热加压
CH 3CH 2OH 注:反应类型:加成反应。
12
CH 3CH 2OH 浓硫酸 170℃
CH 2=CH 2+H 2O 注:必须写出具体的反应条件,其它醇消去反应的条件写“浓硫酸、加热”即可。
反应类型:消去反应。
13 CH 3CH 3+Br 2光CH 3CH 2Br +HBr 注:题目中出现“光”或“光照”,应想到烷烃的取代,要求反应物为气态。
反应类型:取代反应。
此外,注意加聚反应和缩聚反应,以及加聚产物、缩聚产物单体的判断。
有机合成解题注意事项
1. 记牢反应条件
(1)“浓硫酸、△”:(浓硫酸、170℃特指乙醇制乙烯)
-CH -- C =C +H 2O 消去反应
OH
-COOH +HO -COO -+H 2O 酯化反应(取代反应)
近几年高考题中出现“H 2SO 4,△”或“H +,△”也表示酯化反应。
-CH -CH 2-COOH -CH —CH 2 +H 2O 酯化反应
O C =O
[ ]OH nCH 3CHCOOH H -O -CH --OH +(n-1)H 2O 缩聚反应
n O
OH
(2)“NaOH (水)溶液,△”:(X 表示—Cl 、—Br 等卤素原子)
-C -X +NaOH -C -OH +NaX 水解反应(或取代反应)-C -X +H 2O C -OH +HX ,HX +NaOH =NaX +H 2O
-C -O -+NaOH -COONa +HO - 水解反应(或取代反应)O
或“H 2SO 4,△”或“H +,△”也表示酯类水解,生成—COOH 和—OH 。
—CONH — + NaOH →—COOH + —NH 2 蛋白质或肽也能发生水解反应。
(3)“NaOH 醇溶液,△”或“NaOH ,C 2H 5OH ,△”:(X 表示—Cl 、—Br 等卤素原子)
-CH -- C =C +HX HX +NaOH =NaX +H 2O 消去反应X
X
-CH -C - C =C +NaX +H 2O
NaOH +或
有NaOH 的反应,若问涉及的反应类型,则要把“中和反应”也答上。
(4)“Cu (Ag ),△”:
2-CH 2-OH +O 2 2-CHO +2H 2O 氧化反应
2-CH -OH +O 2 2-C =O +2H 2O 氧化反应
-C -OH +O 2 此情景下不能发生氧化反应,但能燃烧,就是氧化反应。
A −→−2
O B −→−2
O C 是—CH 2—OH → —CHO → —COOH
(5)“光”:指气态烷烃和卤素单质的取代反应CH 4−
→−光
CH 3Cl + HCl
2. 牢记官能团的性质:
“H 2、催化剂、△”:C =C 、-C C -、—CHO 、-C -O
、(不属于官能团),加成反应(或还原反应)。
注意—COOH 、—COO —不能和H 2反应。
(3)“溴水、溴的四氯化碳溶液”: C =C 、-C C -,加成反应,不是还原反应。
(4)“银氨溶液,△” 或“Ag(NH 3)2+、△”:—CHO 、HCOOH 、HCOO —、葡萄糖,氧化反应。
(5)“新制Cu(OH)2悬浊液、△”:—CHO 、HCOOH 、HCOO —、葡萄糖。
现象为红色沉淀或砖红色沉淀,氧化反应。
(6)
-OH 和浓溴水生成白色沉淀
,和FeCl 3发生显色反应,紫色溶液。
OH
-Br Br -
(7)和Na 反应:—OH (酚和醇)、—COOH ,通常指的是醇—OH 。
和Na 2CO 3反应:酚—OH 、—COOH ;酚—OH 只能生成NaHCO 3,—COOH 生成NaHCO 3或CO 2。
和NaHCO 3反应:—COOH ,放出CO 2。
和NaOH 反应:酚—OH 、—COOH 、—COO —、—X 。
(8)形成高聚物通常是:=C 加聚反应,—OH 和—COOH 缩聚反应、—NH 2和—COOH 缩聚反应
3. 同分异构体的书写:
(1)碳链异构:C —C —C —C C —C —C —C —C 和 、C —C —C
C C。
(2)官能团位置异构:C =C -C -C 和C -C =C -C C -C -C -OH 和C -C -C OH
-CH 3-OH
-CH 3-CH 3
HO -
(3)官能团类别异构:
CH 2=CH -CH 3和 和
-CH 3
-OH -CH 2OH
CH ≡C -CH 2-CH 3和CH 2=CH -CH =CH 2 CH 3CH 2CH 2CHO 和CH 2=CH -CH 2-CH 2OH 等
CH 3CH 2OH 和CH 3-O -CH 3(醚也能水解生成两分子醇)
CH 3COOH 和HCOOCH 3(甲酸甲酯有时也写成CH 3OOCH 或CH 3-O -CHO )
(1)“苯环上一氯代物只有两种”通常是苯环上两个侧链、对位。
(2)“苯环上二氯代物只有三种”、“苯环上一氯代物只有一种”通常是苯环上两个相同侧链、对位。
(3)“苯环上一氯代物只有三种”通常是苯环上两个相同侧链,间位。
(4)两个C =C 不能相连,C =C=C 。
(5)一个C 原子不能有两个羟基,
-C -OH CHO +H 2O
OH。
(6)C =C 不能连-OH ,C =C -OH -CH -C =O。
(7)CH 2=CH -CH =CH 2和H 2、Br 2加成时,通常是1、4位加成CH 3-CH =CH -
CH3。
若明确指出以物质的量之比1:1反应,1、4位加成;
若明确指出以物质的量之比1:2反应,都加成CH3-CH2-CH2-CH3。
(8)“x元环状化合物”,通常是一种有机物既有-OH,又有-COOH,可以分子内,也可以分子间酯化反应。
2-CH-CH2-COOH -CH-CH2-C=O +2H2O
O O
O=—CH2 —-
有NaOH参与的反应,通常生成-COONa或-ONa,银镜反应生成-COONH4,要得到-COOH、或-OH,需加稀H2SO4(或H+)。
(10)葡萄糖的结构简式:CH2-CH-CH-CH-CH-CHO
OH OH OH OH OH或CH2OH(CHOH)4CHO。
