有机化学:第十五章 - 重排反应
《有机化学反应类型》重排反应揭秘

《有机化学反应类型》重排反应揭秘在有机化学的广阔领域中,重排反应宛如一场神秘而精彩的分子舞蹈。
它们以独特的方式改变着分子的结构,为我们展现出化学变化的奇妙与多样性。
什么是重排反应呢?简单来说,重排反应是指有机分子中的某些原子或基团从一个位置迁移到另一个位置,从而导致分子结构发生改变的反应。
这种迁移可不是随意的乱动,而是遵循着一定的规律和机制。
重排反应的种类繁多,其中较为常见的有亲核重排、亲电重排和自由基重排。
亲核重排就像是分子内部的一场“友好交流”。
在这类反应中,亲核试剂会进攻分子中的某个部位,引发原子或基团的迁移。
比如,在WagnerMeerwein 重排中,碳正离子会发生重排,通常是烷基或氢原子从一个碳迁移到相邻的碳上。
这一过程就像是在调整分子内部的结构,以达到更稳定的状态。
亲电重排则像是分子对外来“侵略者”的应对策略。
亲电试剂的进攻导致分子中的电子云发生重新分布,从而引发原子或基团的迁移。
例如,在 FriedelCrafts 烷基化反应中,烷基正离子会进攻苯环,导致苯环上的取代基发生重排。
自由基重排相对来说较为少见,但同样具有重要的意义。
自由基的特殊性质使得这类重排反应具有独特的特点。
重排反应的发生往往有着明确的驱动力。
分子总是趋向于更稳定的状态,这是化学反应的一个基本原则。
通过重排,分子可以降低能量、增加共轭、改善电子分布等,从而变得更加稳定。
为了更好地理解重排反应,让我们来看几个具体的例子。
在 pinacol 重排中,1,2-二醇在酸的催化下会发生重排,生成羰基化合物。
在这个过程中,羟基会先质子化,然后发生碳碳键的断裂和基团的迁移。
另一个经典的例子是Beckmann 重排。
肟在酸的作用下会发生重排,生成酰胺。
这一反应在有机合成中有着广泛的应用,是制备酰胺类化合物的重要方法之一。
重排反应在有机合成中具有不可忽视的重要性。
它们可以帮助我们合成一些难以通过直接反应得到的化合物,为有机合成提供了更多的可能性和策略。
有机重排反应详尽总结
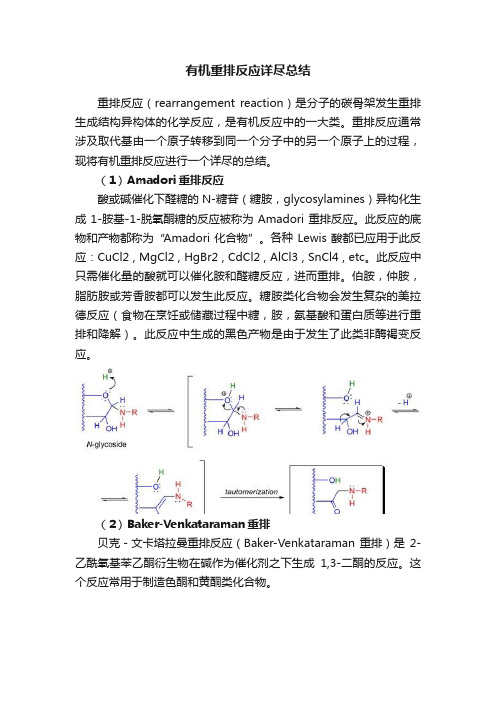
有机重排反应详尽总结重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程,现将有机重排反应进行一个详尽的总结。
(1)Amadori重排反应酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。
此反应的底物和产物都称为“Amadori化合物”。
各种Lewis酸都已应用于此反应:CuCl2 , MgCl2 , HgBr2 , CdCl2 , AlCl3 , SnCl4 , etc。
此反应中只需催化量的酸就可以催化胺和醛糖反应,进而重排。
伯胺,仲胺,脂肪胺或芳香胺都可以发生此反应。
糖胺类化合物会发生复杂的美拉德反应(食物在烹饪或储藏过程中糖,胺,氨基酸和蛋白质等进行重排和降解)。
此反应中生成的黑色产物是由于发生了此类非酶褐变反应。
(2)Baker-Venkataraman重排贝克-文卡塔拉曼重排反应(Baker-Venkataraman重排)是2-乙酰氧基苯乙酮衍生物在碱作为催化剂之下生成1,3-二酮的反应。
这个反应常用于制造色酮和黄酮类化合物。
(3)Bamberger RearrangementN-芳基羟胺在强酸水溶液作用下重排为氨基苯酚的反应。
(4)Beckmann Rearrangement贝克曼重排反应(Beckman rearrangement)指醛肟或酮肟在酸催化下生成N-取代酰胺的亲核重排反应,反应中起催化作用的酸常用五氯化磷。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名。
(5)Brook RearrangementC-Si→O-Si的离子性重排反应,从羟基硅烷到硅醚的转化。
Brook 重排反应的推动力是产物中键能较高的 Si-O 键的生成。
有机化学中重排反应

有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4三、亲电重排第一步是在亲核试剂作用下,离去基脱离形成富电中心,离去基以氢及金属原子居多;第二步是迁移基团留下一对成键电子,以正离子的形式向富电中心迁移,重排结果是形成新的富电中心。
有机化学基础知识芳香化合物的重排反应和异构化反应

有机化学基础知识芳香化合物的重排反应和异构化反应有机化学基础知识之芳香化合物的重排反应和异构化反应芳香化合物是有机化学中重要的一类化合物,具有独特的芳香香味和稳定的分子结构。
在有机合成和药物研发领域,芳香化合物的合成和转化是非常重要的。
本文将讨论芳香化合物的重排反应和异构化反应,以及它们在有机合成中的应用。
一、芳香化合物的重排反应1. 环移重排反应环移重排反应是芳香环上原子或基团的重新排列,形成新的芳香环的反应。
主要有酚的甲基或烷基的Meisenheimer重排反应、羧酸的重排反应、苯酚的Claisen重排反应等。
例如,酚的甲基重排反应如下:[化学反应方程式]2. 氢迁移重排反应氢迁移重排反应是芳香环中氢原子或基团的迁移,生成新的芳香化合物的反应。
常见的有1,2-氢迁移、1,3-氢迁移和1,4-氢迁移等。
例如,1,2-氢迁移重排反应如下:[化学反应方程式]二、芳香化合物的异构化反应芳香化合物的异构化反应是指同一分子内芳香环中原子或基团的位置改变,形成不同结构的芳香化合物。
1. 互变异构反应互变异构反应是在特定条件下,同一个分子内两个相邻的芳香环中的原子或基团进行位置交换,形成异构体的反应。
例如,酚醛的互变异构反应如下:[化学反应方程式]2. 氢化异构反应氢化异构反应是芳香环中芳香基与氢气反应,发生氢化和异构化的反应。
例如,苯的氢化异构反应如下:[化学反应方程式]三、重排反应和异构化反应的应用1. 药物合成重排反应和异构化反应在药物合成中具有重要的应用价值。
通过利用这些反应,可以合成具有特定药效的化合物,并提高合成效率。
2. 功能材料合成重排反应和异构化反应在功能材料合成方面也起着关键作用。
通过合理设计反应路径,可以合成具有特定功能的材料,如光电材料、催化剂等。
3. 天然产物合成许多天然产物的结构复杂且具有重要的药理活性。
利用重排反应和异构化反应,可以模拟天然产物的合成路径,从而合成具有类似活性的人工合成天然产物。
重排反应

+
OH
COCH3
这两个产物能否用水蒸汽蒸馏分离?为什么? 为什么在低温时(25℃)以生成对位异构体为主,高温时 (165℃)以生成邻位
光学活性的R-2-溴丙酸与稀的NaOH水溶液反应生 成光学活性的R-2-羟基丙酸钠,在反应过程中手性碳 原子的构型保持,为什么?
C8H10O (-) N
1) potassium 2) C2H5I
C6H5CHCH3(OC2H5) (-) M
问题5-3 推导(–)E的绝对构型,画出中间产物(J-O) 的立体结H H OH HO H OH HO H OH H H H H OH H H H O O CH CN O O CH 2
OC C H COOC2H5
NaNH2 C CH3 Cl
-
O
+
ClCH2COOC2H5 O C CH3 O C CHCOOH C H3 CH COOC2H5
-
OH
C H3 Cl O C CHCOONa C H3
H3O+
CH CHO CH3
醋酸苯酯在AlCl3存在下进行Fries重排变成邻或对羟基苯乙 酮:
H2C HC H2C
OOC(CH2)7 OOC(CH2)7
(CH2)7CH3 cis CH2 CH=CH
(CH2)4CH3
OOC(CH2)16CH3
a.S有几种对映异构体?如果有,用星号(*)标出分子中的手性中心。 b.S用甲醇钠处理得到3种甲酯的混合物。给出它们的名称,必要时用Z 、E符号来标记。 c.为确定双键在分子中的位置,不饱和甲酯用臭氧处理后用锌处理,画 出这四种含有醛基的化合物。用IUPACA法命名。 d.水解1g油脂所需要的氢氧化钾的毫克数称为油脂的皂化值。人们用该 数值对比油脂的相对分子质量(相对摩尔质量)。计算将10.0g S皂化 所需要的0.996M氢氧化钾的体积。 e.求S的皂化值。 f.与100g油脂发生加成反应所需的碘I2的克数称为油脂的碘值。计算S 的碘值。
《重排反应》PPT课件

P C H3OC 6H5 Ph
H 2S O 4
P C H3OC 6H5 C C Ph
OH OH
P C H3OC 6H5
P C H3OC 6H5 C C Ph Ph O
72%
+ Ph
P C H3OC 6H5 C C Ph
28%
O整理课件C 6 H 5 O C H 3 P
9
Ph Ph C
CH3 C CH3
第四章 重排反应
定义:受试剂或介质的影响,同一有机分子内的一个基团 或原子从一个原子迁移到另一个原子上,使分子构架发生 改变而形成一个新的分子的反应称为重排反应。
重排反应类型(按终点原子电荷分) 缺电子重排 富电子重排 自由基重排
• 从碳原子到碳原子的重排 • 从碳原子到杂原子的重排 • 从杂原子到碳原子的重排 • -键迁移重排
关注1,2重排 烯丙基结构 构型保留
R
碱B R
机理
YC H
BH
YC
R YC
整理课件
51
一、Stevens重排
季铵盐分子中连于氮原子的碳原子上具有吸电子的 基团取代时,在强碱性条件下,可重排生成叔胺的 反应称为Stevens重排反应。
RC H C O H2O RC H2C O O H
COCl
1. C H 2 N 2 2. P h C O O A g /E tO H /T E A
C H2C O O C 2H5
84~92%
整理课件
28
Arndt-Eistert同系列羧酸的合成反应
Arndt-Eistert合成是将一个酸变成它的高一级同系 物或转变成同系列酸的衍生物,(如酯或酰胺)的反 应。该反应可应用于脂肪族酸和芳香族酸的制备。
高等有机重排反应机理

O
OH
(3)类似的反应如溴代环醇与格氏试剂(起碱的作用)反应消去OH中的质子,加热环扩 大。
OH
Br C
iso-PrMgBr
O Br
C
O R'
R' R
R' R
R
同样,环丙基碳上产生卡宾或类卡宾会使环扩大。
CH2
一些脂肪族伯胺与亚硝酸作用发生类似重排。
CH3 CH3 C CH2 NH2
CH3 HNO2 CH3 C CH2 N N
羧酸的反应首先酰基正离子,后面的重排反应类似于Curtius重排,不同的 是发生重排的是质子化的叠氮化物。
O H+
R C OH
O R C OH2
O
RC
HN3
OH
OH
RCNNN
-N2
C N R 水解 RNH2 + CO2
酮与叠氮酸的重排反应的历程如下:首先形成碳正离子,叠氮酸加成,失去水分子 然后重排,新的碳正离子中心加成,失去氢离子,产生可以互变的酰胺结构。
RG = rearrangement groups
RG AB
RG AB
分
类
(1) 位置
1,2重排和非1,2重排:多数重排是从一个原子向邻近原子迁移---1,2迁移。 长距离迁移很少。
(2) 反应历程 带着电子对迁移,可以称为亲核或阴离子重排,可看作亲核试剂。
不带电子对迁移,可以称为亲电或阳离子重排,迁移氢叫做质子转移重排。
这个变化涉及仲碳正离子和伯碳正离子的互变。
NH2 CH2NH2
HNO2
OH +
CH2OH
CH2
(1)C3到C8的环扩大已实现,小环产率高,因为角张力的解除提供动力,环缩小已用 于四员环和C6到C8的环,环戊基阳离子缩小成环丁基体系,由于张力增大而行不通。
有机化学:第十五章 - 重排反应

5、弗里斯(Fries)重排--分子间重排
酚酯催化加热,酰基迁移到邻位或对位
O
O C CH3 AlCL3
OH COCH3
OH
heat
COCH3
25oC H3COC
OH
OOCCH3
H3C
H3C
165oC H3C
COCH3
OH
O OCR
+ AlCl3
AlCl3 O COR
Cl3Al O
+R C O
Cl3Al O
C6H5 > (CH3)3C >(CH3)2CH >C2H5 >CH3
H3CO
CC OH OH
H+
OCH3
1,2-二苯基-1,2-二(对甲氧基苯基)乙二醇
CC O
OCH3
OCH3
主要产物
分析
C6H5
C6H5 C6H5 C1 C2 CH3
OH OH
形成C+离子稳定性C1>C2 C2上取代基迁移苯基>甲基
O
(C6H5)3C C CH3
分析
H3C
CH3
CH CH3
H3C
C 1
C
2
CH2 CH3
OH OH
• 形成C+离子稳定性C1>C2 • C2上取代基迁移乙基>甲基
H3C
CH3
CH CH3
H3C C C O
C2H5
HO OH
(d)
R 羟基位于脂环上的连乙二醇
R
OH Ph
Ph
O Ph Ph
2、蒂芬欧-捷姆扬诺夫(Tiffeneau-Demjanov)重排
质子化
[理学]15第十五章 分子重排反应
![[理学]15第十五章 分子重排反应](https://img.taocdn.com/s3/m/7309e39bc77da26925c5b0f6.png)
Advanced Organic Chemistry
亲电重排 (Electrophilic rearrangement)
Ph CH2 O CH3 PhLi C6H6
+ Li Ph CH O CH3
CH3 - + H2O Ph CH O Li
CH3 Ph CH OH
高 等 有 机 化 学
Advanced Organic Chemistry
高 等 有 机 化 学
Advanced Organic Chemistry
什么是分子重排反应? 分子中共价键结合顺序发生改变的反应。
这种改变可导致重键位置的转移、官能团的转移、 扩环/缩环或基本碳架的改变等等。
从形式上看,某些周环反应也可以看作是重排反应。
高 等 有 机 化 学
Advanced Organic Chemistry
高 等 有 机 化 学
Advanced Organic Chemistry
亲核重排 (Nucleophilic rearrangement)
+ H CH3CH2CH2CH2OH
CH3CH2CH2CH2OH2
H2O
H CH3CH2CHCH2
CH3CH2CH+CH3 H+
CH3CH=CHCH3
高 等 有 机 化 学
Advanced Organic Chemistry
2. 按反应历程分类
按照迁移基团的电性分类:
亲核重排
亲电重排 自由基重排
M A B Y
Y Y Y
M A M A M A B B B A A A
M B M B M B (亲核重排) (亲电重排) (自由基重排)
《有机化学重排反应》课件

THANKS
感谢观看
详细描述
重排反应通常涉及分子内部的重排,包括电子、质子和原子的重新排列,这种 重排可以发生在分子内或分子间,并伴随着键的断裂和形成。重排反应通常伴 随着键能的变化,需要一定的活化能来启动反应。
重排反应的重要性
总结词
重排反应在有机化学中具有重要的意义,它涉及到许多有机化合物的合成、转化和降解过程。
详细描述
重排反应的动力学与热力学
动力学研究
分析重排反应的动力学特征,如反应 速率常数、活化能等,以及如何影响 反应进程。
热力学研究
探讨重排反应的热力学性质,如反应 熵变、焓变等,以及与反应条件的关 系。
重排反应的历程与过渡态
历程研究
揭示重排反应的具体步骤和中间体,以及各 步骤之间的相互转化。
过渡态研究
分析重排反应过程中的过渡态结构,以及如 何影响反应活化能和产物形成。
贝克重排反应是一种有机化学反应,涉及环丙烷环系的重排过程。在反应中,环丙烷环系通过加热或 其他能量源的激发,发生重排,生成新的化合物。
沃尔夫-凯惜纳重排反应
总结词
涉及芳香族化合物的重排反应
详细描述
沃尔夫-凯惜纳重排反应是一种有机化学反应,涉及芳香族化 合物的重排过程。在反应中,芳香族化合物通过加热或其他 能量源的激发,发生重排,生成新的化合物。
计算化学的应用
利用计算化学方法预测和优化 重排反应的途径和产物,提高
反应效率。
06
参考文献
参考文献
《有机化学重排反应》第二版,作者
01
XXX,出版社:XXX。
《有机化学重排反应》第三版,作者
02
XXX,出版社:XXX。
"有机化学重排反应研究进展",作者
有机化学所有的重排反应(详细的PPT)~~~~~~~~考研用得着的43页PPT

谢谢!
36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯
39、勿问成功的秘诀为何,且尽全力做你应该做的事吧。——美华纳
有机化学所有的重排反应(详细的 PPT)~~~~~~~~考研用得着的
51、没有哪个社会可以制订一部永远 适用的 宪法, 甚至一 条永远 适用的 法律。 ——杰 斐逊 52、法律源于人的自卫本能。——英 格索尔
53、人们通常会发现,法律就是这样 一种的 网,触 犯法律 的人, 小的可 以穿网 而过, 大的可 以破网 而出, 只有中 等的才 会坠入 网中。 ——申 斯通 54、法律就是法律它是一座雄伟的大 夏,庇 护着我 们大家 ;它的 每一块 砖石都 垒在另 一块砖 石上。 ——高 尔斯华 绥 55、今天的法律未必明天仍是法律。 ——罗·伯顿
40、学而不思则罔,思而不学则殆。——孔子
有机化学重排反应讲解
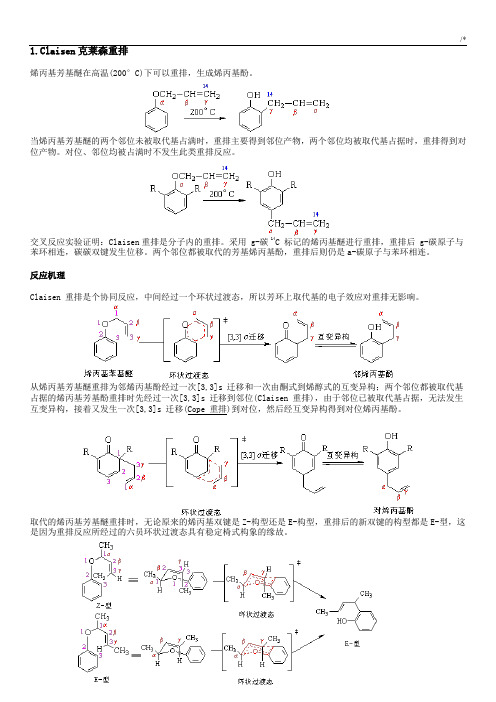
1.Claisen克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
反应实例Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:反应实例3.Bamberger,E.重排苯基羟胺(N-羟基苯胺)和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基(或甲氧基)苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
有机化学基础知识点整理官能团的重排反应和转位反应

有机化学基础知识点整理官能团的重排反应和转位反应有机化学基础知识点整理:官能团的重排反应和转位反应导言:有机化学是研究含有碳元素的化合物的科学,是化学的一个重要分支。
在有机化学中,官能团的重排反应和转位反应是常见的重要反应类型之一。
本文将围绕这一主题展开讨论,介绍官能团的重排反应和转位反应的基本概念、机理以及相关实例。
一、官能团的重排反应1.1 概念官能团的重排反应是指有机化合物中某个官能团经过原子或原团的重新排列,从而形成新的有机化合物的反应过程。
这一过程通常伴随着键的断裂和形成。
1.2 机理官能团的重排反应的机理多样,总体可分为以下几种类型:1) 亲核取代反应:亲核试剂通过攻击一个键,使之断裂并形成新键,从而导致重排反应的发生。
2) 质子化/去质子化反应:质子的加入或脱离导致官能团成键重组,从而改变分子结构。
3) π电子迁移:电子云的重分布引发重排反应。
1.3 实例1) 醇的重排反应:醇可以发生缩醛和醚的转化反应。
例如,2-甲氧基乙醇在酸性条件下可以发生重排反应生成乙醚和甲醛。
2) 烯烃的重排反应:均相或异相环加成反应中,烯烃经过质子化后发生重排反应,生成稳定的胺、酮或醇等产物。
二、官能团的转位反应2.1 概念官能团的转位反应是指有机化合物中一个官能团与另一个官能团的位置互换,形成新的有机化合物的反应过程。
转位反应常涉及原子或原团的重新排列。
2.2 机理官能团的转位反应机理多种多样,常见的机理包括:1) 质子转移:质子从一个官能团转移到另一个官能团上,形成新的分子结构。
2) 共轭体系的重建:通过改变共轭体系的结构,使得官能团发生位置变化。
2.3 实例1) 羧酸的转位反应:在质子辅助下,羧酸可以发生转位反应,生成相应的酰胺。
例如,苯甲酸经过转位反应可以生成苯乙酰胺。
2) 稀土元素催化下的转位反应:稀土金属催化剂的存在可以促进官能团的转位反应,例如酮的转位反应。
结论:官能团的重排反应和转位反应是有机化学中常见的重要反应类型。
考研,有机化学反应机理-重排反应0.

-R´´COO- , -H+
O R-C-OR'
R3C- > R2CH- ,
>
CH2 >
>RCH2- > CH3-
(6) 霍夫曼重排
酰胺与次卤酸盐的碱溶液(或卤素的氢氧化钠溶液) 作用时,放出二氧化碳,生成比酰胺少一个碳原子的一 级胺的反应。
O
H2O
RCNH2 + Br2 + NaOH
RNH2 + CO2 + 2NaBr
R' C=N-R H2O
+
-H+
R' C=N-R O
互变异构
C
O R'-C-NHR
H
(4)法沃斯基重排
XO
R' O
R-CH-C-R'
Y - R-CH-C-Y
乙醇或乙醚
Y=OH, OR, NR2
在醇钠或氢氧化钠或氨基钠等碱性催化剂存在下,-卤
代酮(氯代酮或溴代酮)失去卤原子,重排成具有相同碳原 子的羧酸酯、羧酸、酰胺的反应。
工业制法和反应机理
+ CH3CH=CH2 AlCl3
CH(CH3)2
O2
自动氧化
C(CH3)2
H+
O OH
C(CH3)2 -H2O O OH2
+
C(CH3)2 O+
重排
+ O C(CH3)2
+ O
C(CH3)2 H2O
亲核加成
+OH2 -H+
O C(CH3)2
OH O CH(CH3)2 C-O键断裂
烯丙基苯基醚
O
H
有机化学基础知识羧酸的缩合反应和重排反应

有机化学基础知识羧酸的缩合反应和重排反应羧酸的缩合反应和重排反应有机化学中,羧酸是一类含有羧基(-COOH)的化合物。
羧酸分子中的羧基可以发生缩合反应和重排反应,这些反应在有机合成中具有重要的应用价值。
一、缩合反应缩合反应是指羧酸分子中两个羧基之间发生反应,生成酰亚胺、酰胺或酯类化合物的过程。
在缩合反应中,羧基的羰基碳与另一个羧基的氧原子发生亲核加成反应,产生一个中间稳定的羧酐(酸酐)中间体,并释放出一个分子的水。
1. 缩合反应的机制缩合反应的机制可以分为两步:先是羧酸的质子化、离子化,形成羧酐(酸酐)中间体;然后,羧酐中间体与另一个羧基之间发生亲核加成反应,生成缩合产物。
2. 缩合反应的应用(1)酰亚胺的合成:缩合反应可以用于合成酰亚胺。
酰亚胺是一类含有C=O和N-C键的化合物,广泛应用于农药、医药等领域。
(2)酰胺的合成:缩合反应也可用于合成酰胺。
酰胺是一类含有C=O和N-C键的化合物,具有广泛的应用价值。
(3)酯的合成:羧酸的缩合反应还可以用于合成酯类化合物。
酯是一类含有酯基(-COOR)的化合物,常用作溶剂、润滑剂、香料等。
二、重排反应重排反应是指羧基在分子内发生骑烷、迁移、酸/碱催化等过程,导致化学结构发生重新排列的反应。
重排反应通常以供体-受体的形式进行,其中供体是指具有反应活性的结构单元,受体是指接受供体中活性基团的结构单元。
1. 重排反应的机制重排反应的机制多种多样,常见的机制包括酸催化重排、碱催化重排、骑烷重排等。
重排反应的机理复杂,需要根据具体的反应条件和反应物的特性来进行分析。
2. 重排反应的应用重排反应在有机合成中有重要的应用价值。
通过重排反应,可以合成具有特定功能和生物活性的有机化合物,如生物活性物质和药物分子等。
总结:羧酸的缩合反应和重排反应是有机化学中重要的反应类型。
缩合反应能够合成酰亚胺、酰胺和酯类化合物,具有广泛的应用前景;重排反应能够合成具有特殊功能和生物活性的有机化合物,对有机合成研究和药物发现具有重要意义。
有机化学中的重排反应

氮烯
R NH COOH
异氰酸酯
CO2 + RNH2
• 经过Nitrene的重排 • 酰胺重排生成少一个碳的胺 • Hoffmann重排:RCOOH→RCONH2→RNH2
二元酸的酰亚胺:
O C C O O C NH2 NH
NaOCl
NH2 COOH
COOH
更多例见后
(1) (CH3)3C-CH2CONH2
CH2CH2CO2H H SO + HN3 2 4 CH2CH2CO2H
羧酸可以是直链脂肪族的一元或二元羧酸、脂环酸、芳香 酸等;与Hoffmann重排、Curtius反应相比,本反应胺的 收率较高。
例:
⑷.贝克曼(Beckmann)重排
①定义:醛或酮肟在 酸性条件下,重 排生成酰胺的反 应。(质子酸
基团迁移活泼性顺序如下: 对甲氧基苯基 > 对甲基苯基 > 苯基 > 对溴苯基 > 烷 基>氢
(c) 结构不对称的二醇的重排,可由生 成的碳正离子的稳定性来判断那一个羟基 是离去基团。
R' R R' C C R
OH OH
C CH2OH
H+
_
_
H+
C CHO H 主要
C CH2OH OH
H2O
_
C CH2
0
O OK NH2
H+3O
O OH NH2
-aminoacid
⑵. Curtius (库尔悌斯)重排:
酰基叠氮化合物也发生类似的重排:
R C O
N N N
O C N R +N2
H2O
RNH2 + CO2
有机化学重排反应总结

有机化学重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)3C-CH 2(CH 3)3C-CH-CH 3H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。
有机化学重排反应机理

有机化学重排反应机理嘿,朋友!咱来说说有机化学里那些有趣的重排反应机理哈。
首先呢,就像一场魔法秀里的大变活人,频哪醇重排。
这个频哪醇分子就像一群小伙伴手拉手围成的圈,本来好好的。
结果呢,在酸性条件下,就像来了个严厉的老师,其中一个小伙伴被批评得“离家出走”,形成了一个相对稳定的碳正离子。
然后其他小伙伴赶紧重新排列组合,就像在玩抢椅子游戏一样,最后形成了频哪酮。
这整个过程啊,就像是一场混乱又有序的闹剧。
再说说瓦格纳 - 梅尔外因重排。
这个反应的分子就像一列小火车,原本车厢们都按顺序排列得好好的。
可是呢,当受到某些条件影响,就像是火车轨道突然出故障了。
有个车厢就开始脱离原来的顺序,带着其他车厢一起重新组合,车头变成了车尾,车尾又变成了车头,完全打乱了之前的秩序,最后形成了一个全新的列车形状,也就是新的分子结构。
贝克曼重排也很有意思。
分子像是一群小动物排着队,有个特定的小动物突然被施了魔法,它就开始往队伍中间挤。
周围的小动物们只好给它腾地方,然后整个队伍的形状就发生了巨大的改变,从一种整齐的排队方式变成了另一种完全不同的排列,就像从方阵变成了圆形队列一样,最后得到了重排后的产物。
克莱森重排就像是一场分子内部的接力赛。
一个基团就像拿着接力棒的运动员,在合适的条件下,它要把接力棒传给另一个位置上的小伙伴。
然后这个小伙伴又继续传递,整个分子的结构就像运动员们在跑道上跑来跑去重新站位一样,发生了重排,形成了新的化合物。
霍夫曼重排就像一场分子的减肥计划。
原本分子里有个比较臃肿的部分,在特定的反应条件下,就像有个健身教练在旁边监督。
这个臃肿的部分开始不断甩掉一些“赘肉”,分子结构不断调整,最后变成了一个身材更加“苗条”、结构完全不同的分子,就像从一个大胖子变成了身材匀称的帅哥或者美女。
弗里斯重排就像是分子在搬家。
原本分子里的某些基团住在特定的位置,就像住在房子里的住户。
可是在酸性条件下,就像来了个强行拆迁队,这些基团不得不搬到新的位置去,整个分子的布局就完全改变了,从旧的结构变成了新的重排后的结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2O
OH2
_ H+
R C OR
R
OH R C OR
R
OH
H+
R C OR RH
OH R C R + HOR _ H+
O R C R + HOR
断O-O,重排,夺羟,夺H+,断C-O
一、经过正离子重排
1、片呐醇 (Pinacol) 重排——邻二醇——酸 2、蒂芬欧-捷姆扬诺夫 (Tiffeneau-Demjanov) 重排——邻氨基醇——亚硝酸 3、贝克曼 (Beckmann) 重排——羟肟——酸或PCl5、RCOCl 4、氢过氧化物 (Baeyer-Villiger) 重排——过氧酸——酸
第十五章
分子骨架的重排反应 Skeletal-Rearrangement Reaction
Skeletal-Rearrangement Reaction
it refers those reactions in which the carbon skeleton or the position of functional group changed
---分子内C→C重排
CH3 CH3 H3C C C CH3
NH2 OH
HNO2
CH3 H3C C C CH3
CH3 O
反应机理
CH3 CH3 H3C C C CH3
NH2 OH
HNO2
CH3 CH3
-N2
H3C C C CH3
+ N2 OH
CH3 CH3
H3C
C +
C CH3 OH
CH3 + H3C C C CH3
C6H5 > (CH3)3C >(CH3)2CH >C2H5 >CH3
H3CO
CC OH OH
H+
OCH3
1,2-二苯基-1,2-二(对甲氧基苯基)乙二醇
CC O
OCH3
OCH3
主要产物
分析
C6H5
C6H5 C6H5 C1 C2 CH3
OH OH
形成C+离子稳定性C1>C2 C2上取代基迁移苯基>甲基
OH
H2SO4 乙醚
n-Bu C H
N H
C
CH3
例2
NO2
NO2
NO2
C
N OH
PCl5
NC OH
HN C O
不同催化剂,产物形成的中间过程稍微有所不同。 酸催化质子化脱水后重排 酰卤催化剂则是将羟基酯化后脱去酰氧基
R
OH R''COCl
CN
R'
O
R C
O N
C R'' -CH3COO-
R'
在酸性催化剂作用下,酮肟转变为酰胺
R1
H+
C N OH
O H
R1 C N R2
R2
—分子内C→N重排
机理
R
OH H+
CN
R'
R C N R'
迁移基团处于羟基的反式位置
R
+OH2
CN
R'
R C N R'
H2O R C N R' OH2
-H+
R C N R' 互变异构
R C NH
OH
O R'
脱羟、重排、夺羟、互变
OH OH
CH3CH3
Ph
Ph C C Ph H2SO4 Ph C C CH3
OH OH
冷却
CH3O
迁移基团电荷密度越高越有利于迁移
(c)不对称?
(1)哪个碳生成碳正离子? (2)哪个基团迁移?
---不对称的取代乙二醇中,两个羟基中电子云密度大的那个 首先质子化。
C CH2OH OH
+
H质子化
1,1-二苯基乙二醇
2、按照所经历的活泼中间体或历程分类: ---经过正离子重排 ---经过负离子重排 ---经过卡宾Carbene、氮宾Nitrene重排 ---周环重排反应—Pericyclic ---自由基重排—Radical
本章主要内容 按活泼中间体或机理进行分类讲解
一、经过正离子重排 二、经过负离子重排 三、经过卡宾Carbene、氮宾Nitrene重排 四、s-迁移反应(属于周环重排)
[ R C N R'
R C N R' ]
H2O
R C NH R' O
4、氢过氧化物(Baeyer-Villiger)重排
---分子内C→O重排 氢过氧化物在酸的作用下发生O-O键断裂,同时烃基从碳 原子上迁移到氧原子上
机理:
R R C O OH
R
R
H+
_ H2ORR C O来自OH2RCOR
R
R C OR R
一、经过正离子重排
1、片呐醇(Pinacol)重排---分子内C→O重排 在酸的作用下,连有羟基的碳原子上的基团带着一对电 子转移到失去羟基的碳正离子上,生成酮的反应。
RR H+
RCCR OH OH
R R C CR
OR
机理:
四取代乙二醇
(a)四个取代基相同,单一产物
R1 R1
(b)对称 R2 C C R2 得单一产物
质子化
H+
: :
:: :
H
_ H2O
C CH OH 负氢迁移 OH2
C CH OH H 主要产物
: :
C CH2 :OH
_ H2O
OH2 苯基迁移
C CH2 OH
次要产物
---质子化以后,亲核性强的基团优先迁移,总体的迁移基团迁移活 泼性顺序如下:
对甲氧基苯基 > 对甲基苯基 > 苯基 > 对溴苯基 > 烷基 > 氢
CH3CH2CH=CH2 H3PO4 CH3CH=CHCH3
CH3 CH3 C CH2OH
CH3
H+ H2O
CH3C=CHCH3 CH3
重排反应的分类
1、按照分子内或分子间进行分为: 分子内重排——发生重排的原子或原子团始终没有脱离原 来的分子 分子间重排——迁移的原子或原子团在没有重排到新的位 置前,就完全与原来的分子脱离 以上两种历程可以通过不同底物的交叉实验得以判别
O
(C6H5)3C C CH3
分析
H3C
CH3
CH CH3
H3C
C 1
C
2
CH2 CH3
OH OH
• 形成C+离子稳定性C1>C2 • C2上取代基迁移乙基>甲基
H3C
CH3
CH CH3
H3C C C O
C2H5
HO OH
(d)
R 羟基位于脂环上的连乙二醇
R
OH Ph
Ph
O Ph Ph
2、蒂芬欧-捷姆扬诺夫(Tiffeneau-Demjanov)重排
酰胺
(1)催化剂:质子酸 H+, H2SO4, HCl, H3PO4 非质子酸PCl5, SOCl2, TsCl, AlCl3
(2)肟的结构 迁移基团是手性碳原子时,其构型保持不变 脂环酮肟发生扩环反应生成内酰胺
O
HO N
CH3 H2NOH
CH3 H
O
NH CH3
Et
Et
O
例1
n-Bu C H
Me C N
CH3 OH
CH3
-H+
H3C C C CH3
CH3 OH +
CH3 H3C C C CH3
CH3 O
Cl
OH
C
H C
Ph
HNO2
Cl
OH
H
C C Ph
Cl
O H
C C Ph
Ph NH2
Ph
Ph
试分析
---1-氨甲基环烷醇与亚硝酸反应可以得到环增大一个碳 的环酮,是制备C5—C9环酮的方法。
3、贝克曼(Beckmann)重排---分子内C→N重排
