肿瘤坏死因子-α(TNF-α)生物学活性测定
肿瘤坏死因子的检测

肿瘤坏死因子的检测一、生物学检测法TNF的主要生物学活性之一就是对某些肿瘤细胞的细胞毒作用。
根据这一特点,可利用TNF敏感的靶细胞测定TNF活性,根据细胞死亡得出TNF的相对活性。
该法的关键是选择敏感特异的靶细胞。
靶细胞可以是长期传代培养的细胞系,也可以是新鲜分离的原代细胞(如瘤细胞)。
现以贴壁生长的L929细胞为例,简述TNF活性的检测原则。
两种TNF均可伤体外培养的L929细胞,细胞死亡率与TNF活性成正比。
某些染料如中性红、结晶紫等能使活细胞染上相应颜色,再用脱色液将染料脱出,通过测定其吸亮度值间接监没细胞存活状态。
试验原则是收集对数生长期的L929细胞,用培养液调细胞至适当浓度,加入培养板小孔中,置37℃,5%CO2温箱中培养16~24h,换液后,在各孔中加入不同稀释度的待检样品,再加适当浓度的放线菌素D和适量培养液,继续温育16~24h,弃培养液,经Hanks液洗涤后,每孔加入适当浓度的结晶紫染色液,37℃培养1h,使活细胞充分着色。
然后各孔加1%SDS短时温育使染色细胞溶解,再以酶标测定仪测各孔A 570nm值。
每次检测均设培养液(阴性)对照和不同浓度的rTNF(阴性)对照。
以使阴性对照50%细胞溶解的标本最大稀释倍数为TNF活性单位,以u/ml表示。
由于放线菌素D能抑制DNA的合成、降低靶细胞对损伤的修复机制,因而在检测中加入放线素D可使靶细胞对TNF的敏感性增高10~200倍。
二、免疫学检测法通常采用ELISA,该法特异性高、敏感性强且快速使捷,而且能够区别TNFα和TNFβ,为临床检测病人血清中TNF水平的有效方法,但不能反映TNF活性。
三、其它检测法检测TNF还可用生物发光法及NAG微量酶反应比色法。
这类方法是应用生化技术检测细胞内代谢的变化,从而推知靶细胞功能变化及死亡情况。
其优点是不仅反映细胞的死亡情况,而且能反映细胞的功能变化。
此外,还具有快速、方便、微量的特点。
肿瘤坏死因子TNFα

人肿瘤坏死因子α(TNF-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,细胞上清及相关液体样本中肿瘤坏死因子α(TNF-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α,再与HRP标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的人肿瘤坏死因子α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:450pg/ml0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
人肿瘤坏死因子α(TNF-α)说明书
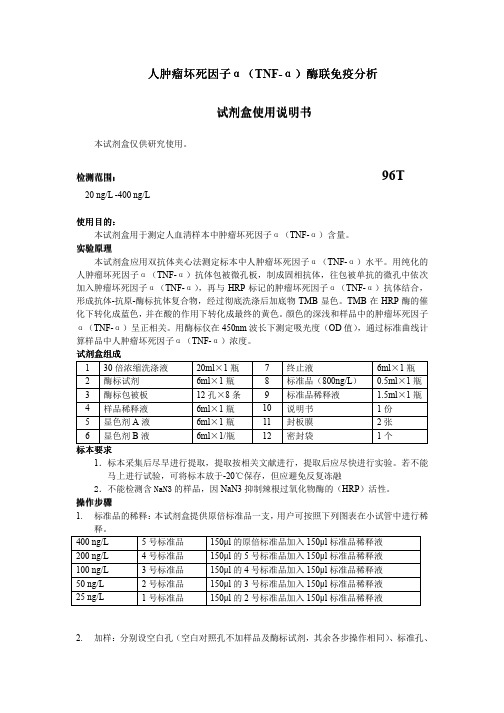
人肿瘤坏死因子人肿瘤坏死因子αα(TNF-α)酶联免疫酶联免疫分析分析分析试剂试剂盒使用说明书盒使用说明书盒使用说明书本试剂盒仅供研究使用。
检测范围检测范围:: 96T20 ng/L -400 ng/L使用目的使用目的::本试剂盒用于测定人血清样本中肿瘤坏死因子α(TNF-α)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人肿瘤坏死因子α(TNF-α)水平。
用纯化的人肿瘤坏死因子α(TNF-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入肿瘤坏死因子α(TNF-α),再与HRP 标记的肿瘤坏死因子α(TNF-α)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的肿瘤坏死因子α(TNF-α)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中人肿瘤坏死因子α(TNF-α)浓度。
试剂盒组成 1 30倍浓缩洗涤液 20ml ×1瓶 7 终止液6ml ×1瓶 2 酶标试剂 6ml ×1瓶 8 标准品(800ng/L ) 0.5ml ×1瓶 3 酶标包被板 12孔×8条 9 标准品稀释液 1.5ml ×1瓶 4 样品稀释液 6ml ×1瓶 10 说明书 1份 5 显色剂A 液 6ml ×1瓶 11 封板膜 2张 6显色剂B 液6ml ×1/瓶12密封袋1个标本标本要求要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP )活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
肿瘤坏死因子的研究进展

参考内容
摘要
肿瘤坏死因子(TNF)是一种重要的细胞因子,在免疫应答和炎症反应中发 挥关键作用。近年来,关于TNF的研究已取得显著进展,本次演示将重点其生物 学功能及其在临床应用中的前景。通过综述最新的研究结果,我们将有助于更深 入地了解TNF的生物学功能及其潜在应用。
引言
肿瘤坏死因子是一种能够诱导肿瘤细胞凋亡的细胞因子,其在免疫应答和炎 症反应中发挥关键作用。自TNF发现以来,大量研究致力于探讨其生物学功能和 临床应用。尽管TNF在某些情况下可促进肿瘤生长,但其主要作用仍是抑制肿瘤 细胞生长和诱导细胞凋亡。本次演示将重点综述TNF的生物学功能及其在临床应 用中的前景,以期为相关研究提供参考。
研究成果
虽然TNF在肿瘤治疗中的直接作用尚不清晰,但其与免疫反应的调控密切相 关。研究表明,TNF可以激活免疫细胞,促进肿瘤细胞的凋亡和坏死,进而诱导 抗肿瘤免疫反应。然而,过度的TNF活化也可能导致炎症反应和免疫病理损伤。 因此,针对TNF的免疫调节作用进行深入研究可能为肿瘤治疗提供新的策略。
历史回顾
自TNF被发现以来,其在肿瘤治疗领域的作用一直是研究的热点。早期的研 究主要集中在TNF-α,其在体外实验中具有显著的抗肿瘤活性。然而,临床试验 中,TNF-α的抗肿瘤效果并不显著,部分原因是其在体内的半衰期短,同时缺乏 特异性肿瘤靶向性。随后,TNF-β(也称为淋巴毒素)的研究也逐渐受到重视。 与TNF-α不同,TNF-β主要在淋巴细胞中表达,但其抗肿瘤作用却十分显著。
然而,TNF在肿瘤治疗中也存在一些挑战。例如,一些研究表明,长期使用 TNF可能会导致免疫抑制和炎症反应加重等问题。因此,针对TNF治疗肿瘤的研究 仍需权衡其利弊,以确定最佳治疗方案。
2、抗病毒治疗
免疫法血清tnf-α正常水平

免疫法血清tnf-α正常水平
TNF-α即肿瘤坏死因子α,是一种具有广泛生物学活性的细胞因子,在机体的免疫调节、炎症反应、细胞凋亡等过程中发挥重要作用。
血清TNF-α的正常水平可能因不同的检测方法、试剂盒和实验室而有所差异。
一般来说,血清TNF-α的正常水平在健康人体内通常较低,一般在1-2pg/ml 之间。
需要注意的是,血清TNF-α水平的正常范围可能受到多种因素的影响,如年龄、性别、身体状况、炎症性疾病等。
在某些疾病状态下,如炎症性肠病、类风湿关节炎、自身免疫性疾病等,血清TNF-α水平可能升高。
血清TNF-α水平的检测结果应结合临床表现、其他实验室检查和影像学检查等综合评估,以确定疾病的诊断和治疗方案。
小鼠肿瘤组织中tnfa含量

小鼠肿瘤组织中tnfa含量摘要:本研究旨在探讨小鼠肿瘤组织中TNF-α(肿瘤坏死因子-α)的含量,并分析其与肿瘤发生发展的关系。
通过使用ELISA(酶联免疫吸附试验)方法,我们检测了小鼠肿瘤组织中TNF-α的含量。
实验结果显示,小鼠肿瘤组织中TNF-α含量显著高于正常组织。
这一结果提示,TNF-α可能在小鼠肿瘤发生发展中发挥重要作用。
一、引言肿瘤坏死因子-α(TNF-α)是一种具有广泛生物活性的细胞因子,参与免疫应答、炎症反应等多种生理过程。
近年来研究表明,TNF-α在肿瘤发生发展中也发挥重要作用。
然而,关于小鼠肿瘤组织中TNF-α含量的研究尚不多见。
因此,本研究旨在通过实验方法检测小鼠肿瘤组织中TNF-α的含量,并探讨其与肿瘤发生发展的关系。
二、材料与方法1.实验动物与肿瘤模型2.选取健康成年小鼠作为实验对象,建立小鼠肿瘤模型。
将实验小鼠随机分为两组:对照组(未接种肿瘤细胞)和实验组(接种肿瘤细胞)。
3.样本采集与处理4.采集实验小鼠肿瘤组织及对应正常组织样本,处理后保存待测。
5.TNF-α含量检测6.采用ELISA方法检测小鼠肿瘤组织中TNF-α的含量。
按照试剂盒说明书操作,测量各样本的吸光度值,计算TNF-α浓度。
7.数据分析8.使用统计软件对实验数据进行处理和分析,比较两组间TNF-α含量的差异,分析其与肿瘤发生发展的相关性。
三、结果实验数据显示,实验组小鼠肿瘤组织中TNF-α含量明显高于对照组正常组织(P<0.05)。
具体数据如表1所示:表1:小鼠肿瘤组织与正常组织中TNF-α含量比较为实验组平均TNF-α含量;Y1为对照组平均TNF-α含量。
图1:小鼠肿瘤组织与正常组织中TNF-α含量柱状图【请在此处插入柱状图】四、讨论本研究结果表明,小鼠肿瘤组织中TNF-α含量显著高于正常组织,提示TNF-α可能参与了肿瘤的发生发展过程。
这与其他相关研究的结果一致,表明TNF-α在肿瘤发展中的重要作用。
ELISA法检测人血清血浆样本中肿瘤坏死因子α TNF-α的浓度

双抗体夹心ELISA法检测样本中TNF-α的浓度TNF-α简介:肿瘤坏死因子(TNF-α)是由单核细胞和巨噬细胞产生的多肽类细胞因子,在炎症反应、免疫系统的发展、细胞程序性死亡和脂代谢中起重要的作用。
其功能主要是在免疫反应中是一个多功能的调节器甚至作为一个强烈的热原性物质刺激中性粒细胞,改变血管内皮细胞的特性,调节其它组织的代谢活性。
TNF-α也可通过抑制脂蛋白脂肪酶的活性而导致恶液病。
爱泼斯坦病毒引起的细胞活化也可被TNF-α所抑制。
巨噬细胞表面的淋巴因子和肉毒素也可介导包括上皮细胞、内皮细胞和肿瘤细胞等产生TNF-α。
据报道干扰素能显著提高TNF-α的分泌量。
TNF-α在关节炎和其它组织的炎症的发病机理中起重要作用。
TNF-α也参与了包括哮喘、克罗恩氏病、类风湿性关节炎、神经性疼痛、肥胖症、 型糖尿病、自身免疫病和肿瘤等疾病的发生检测原理:本试剂盒采用双抗体夹心ELISA法检测样本中TNF-α的浓度。
TNF-α捕获抗体已预包被于酶标板上,当加入标本或参考品时,其中的TNF-α会与捕获抗体结合,其它游离的成分通过洗涤的过程被除去。
当加入生物素化的抗人TNF-α抗体后,抗人TNF-α抗体与TNF-α接合,形成夹心的免疫复合物,其它游离的成分通过洗涤的过程被除去。
随后加入辣根过氧化物酶标记的亲合素。
生物素与亲合素特异性结合,亲合素连接的酶就会与夹心的免疫复合物连接起来;其它游离的成分通过洗涤的过程被除去。
最后加入显色剂,若样本中存在TNF-α将会形成免疫复合物,辣根过氧化物酶会催化无色的显色剂氧化成蓝色物质,在加入终止液后呈黄色。
通过酶标仪检测,读其450nm处的OD值,TNF-α浓度与OD450值之间呈正比,通过参考品绘制标准曲线,对照未知样本中OD值,即可算出标本中TNF-α浓度。
实验过程需自备的材料:1.不同规格的加样枪及相应的枪头;2.酶标仪;3.自动洗板机; 4.去离子水或双蒸水;标本收集:1.标本的收集请按下列流程进行操作:A.细胞上清标本离心去除悬浮物后即可;B.血清标本应是自然凝固后,取上清,避免在冰箱中凝固血液;C.血浆标本,推荐用EDTA的方法收集;D. 若待测样本不能及时检测,标本收集后请分装,冻存于-20℃,避免反复冻融。
山羊肿瘤坏死因子α(TNF-α)ELISA检测试剂盒说明书
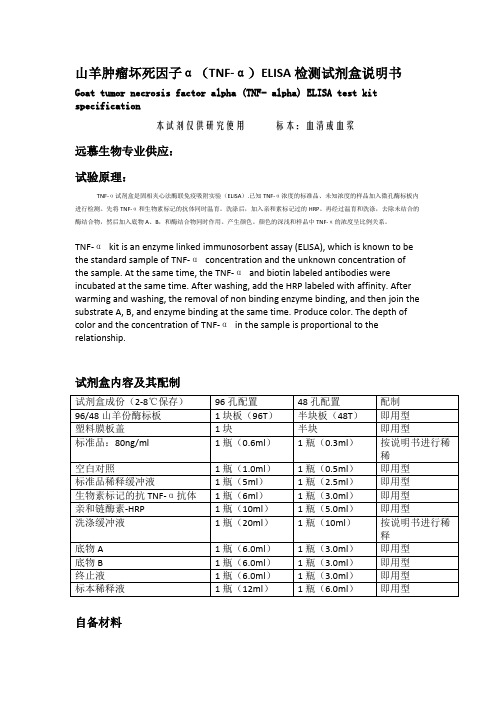
山羊肿瘤坏死因子α(TNF-α)ELISA检测试剂盒说明书Goat tumor necrosis factor alpha (TNF- alpha) ELISA test kitspecification本试剂仅供研究使用标本:血清或血浆远慕生物专业供应:试验原理:TNF-α试剂盒是固相夹心法酶联免疫吸附实验(ELISA).已知TNF-α浓度的标准品、未知浓度的样品加入微孔酶标板内进行检测。
先将TNF-α和生物素标记的抗体同时温育。
洗涤后,加入亲和素标记过的HRP。
再经过温育和洗涤,去除未结合的酶结合物,然后加入底物A、B,和酶结合物同时作用。
产生颜色。
颜色的深浅和样品中TNF-α的浓度呈比例关系。
TNF-αkit is an enzyme linked immunosorbent assay (ELISA), which is known to bethe standard sample of TNF-αconcentration and the unknown concentration ofthe sample. At the same time, the TNF-αand biotin labeled antibodies wereincubated at the same time. After washing, add the HRP labeled with affinity. After warming and washing, the removal of non binding enzyme binding, and then join the substrate A, B, and enzyme binding at the same time. Produce color. The depth ofcolor and the concentration of TNF-αin the sample is proportional to the relationship.试剂盒内容及其配制试剂盒成份(2-8℃保存)96孔配置48孔配置配制96/48山羊份酶标板1块板(96T)半块板(48T)即用型塑料膜板盖1块半块即用型标准品:80ng/ml 1瓶(0.6ml)1瓶(0.3ml)按说明书进行稀稀空白对照1瓶(1.0ml)1瓶(0.5ml)即用型标准品稀释缓冲液1瓶(5ml)1瓶(2.5ml)即用型生物素标记的抗TNF-α抗体1瓶(6ml)1瓶(3.0ml)即用型亲和链酶素-HRP 1瓶(10ml)1瓶(5.0ml)即用型洗涤缓冲液1瓶(20ml)1瓶(10ml)按说明书进行稀释底物A 1瓶(6.0ml)1瓶(3.0ml)即用型底物B 1瓶(6.0ml)1瓶(3.0ml)即用型终止液1瓶(6.0ml)1瓶(3.0ml)即用型标本稀释液1瓶(12ml)1瓶(6.0ml)即用型自备材料1.蒸馏水。
肿瘤坏死因子-α

蛋白质的一级结构特点
蛋白质的一级结构特点
二级结构预测
三级结构预测
蛋白(TNFR-1) (p60) 在所 有细胞类型上表达,是启动 TNF-α 大部分生物活性的关键。
➢ 而TNF受体2 (TNFR-2) (p80) 只 在免疫细胞中表达。
➢ 只有TNFR-1即具有转导细胞 存活信号的能力亦有诱导细胞 凋亡能力,但这种生死信号调 节的作用机制至今也未被透彻 理解。
TNFR2复合物,从而促进细胞的存活。 ➢ 筛选TNFR2的拮抗剂,可以抑制Treg,可以被开发为抗肿瘤药物。
感谢聆听!
武汉轻工大学
肿瘤坏死因子-α
主讲:XXX
专业:
时间:
概述
肿瘤坏死因子(tumor necrosis factor,TNF),又称恶液质素。TNF主要由活化的巨 噬细胞,NK细胞及T淋巴细胞产生,其中,巨噬细胞产生的TNF命名为TNF-α,T淋巴细 胞产生的淋巴毒素(lymphotoxin,LT)命名为TNF-β。TNFα的生物学活性占TNF总活性 的70%~95%,因此目前常说的TNF多指TNF-α。TNF-α作为主要的炎性介质在多种肿瘤 中表达。TNF-α一方面可以通过诱导癌细胞凋亡去抑制肿瘤细胞生长,另一方面也刺激大 多数对TNF诱导的细胞毒性具有抗性的癌细胞的增殖、存活、迁移和血管生成,从而导致 肿瘤的发展发生。
潜在价值
在关节炎或炎症性肠道疾病中,需要增强TNF-α合成来达到抗炎治疗目的;在自 身免疫病中,需要抑制TNF-α的作用,以便减轻炎症因子对自身细胞的攻击。
值得注意的是,TNF-α是人体正常的免疫分子之一。因此,未来的研究可能会开 发出一种保护细胞免疫系统但选择性阻断TNF-α作用的药物组合,以便在长期内克 服抗TNF-α治疗的副作用。
肿瘤坏死因子与肿瘤的研究进展

肿瘤坏死因子与肿瘤的研究进展摘要:肿瘤坏死因子(TNF-α)是一种由单核一巨噬细胞系统分泌产生的多功能细胞因子, 具有调节机体的免疫功能和导致肿瘤细胞坏死的特性。
近年来, TNF-α在抗肿瘤中的作用引起国内外学者的高度关注。
本文通过对TNF-α与肿瘤的研究做一综述,为生物学和医学提供参考依据。
【关键词】肿瘤坏死因子;肿瘤坏死因子受体;肿瘤;关系1. TNF-α的分子结构人的TNF-α基因长约2.76kb,小鼠为2.78kb,结构非常相似,均由4个外显子和3个内含子组成,分别定位于第6对和第17对染色体短臂上。
2. TNF-α的分布TNF-α来源非常广泛,如单核-巨噬细胞系统、淋巴细胞、内皮细胞、平滑肌细胞等。
TNF-α在体内以两种形式存在:可溶性的TNF-α(sTNF-α)和膜相关的TNF-α(mTNF-α)。
3. TNF-α的生物学活性TNF-α是一种多功能的细胞因子,具有广泛的生物学特性。
TNF-α不仅对肿瘤细胞具有细胞毒性和生长抑制作用;同时在机体的细胞功能调节、免疫和炎症反应等过程中起重要作用[1]。
4. TNF-α与肿瘤TNF-α是迄今发现的抗肿瘤活性最强的细胞因子。
它在体内、体外均对肿瘤细胞有明显的细胞毒性,能特异性杀伤或抑制肿瘤细胞,而对正常细胞无毒性作用[2]。
近年来,越来越多的国内外学者开始研究肿瘤的发生机制,期望能够找到癌症作用过程的关键靶点,从而实现肿瘤的预防及治疗。
4.1 TNF-α与皮肤癌目前,许多致癌化合物被广泛应用于建立各个靶器官的肿瘤模型,进而研究人类肿瘤发生发展过程中的关键分子机制。
Masami Suganuma等学者建立了小鼠皮肤癌的模型。
同时Marques CM等学者对TNF-α在皮肤黑色素瘤发生发展中的影响进行了研究[3]。
他们的研究表明, TNF-α在小鼠皮肤癌的发生发展过程中起到非常关键的作用,提示TNF-α很可能在人类癌症发生过程中也起到相同的作用。
肿瘤坏死因子测定

肿瘤坏死因子测定
一概述
肿瘤坏死因子(TNF)是一类能直接造成肿瘤细胞死亡的细胞因子,根据其来源和结构分为两种,即TNF-α和TNF-β。
前者由单核巨噬细胞产生;后者由活化的T细胞产生,又名淋巴毒素。
TNF除有杀肿瘤细胞作用外,还可引起发热和炎症反应,大剂量TNF-α可引起恶液质,呈进行性消瘦,因而TNF-α又称恶液质素。
TNF具有多种生物效应,主要是介导抗肿瘤及调节机体的免疫功能,也是炎症反应介质之一,参与炎症病变的多方面病理变化。
检验方法主要用酶联免疫吸附测定(ELI SA)或放射免疫分析(RIA)。
二临床意义
测定血清或其他体液中TNF浓度,对原发性或继发性肾小球疾病、器官移植性排异、肿瘤、重症感染等疾病有诊断意义。
1.肿瘤:许多肿瘤细胞可产生TNF,因此在多种肿瘤时机体内TNF表达明显升高。
TNF又可通过细胞毒作用,杀死肿瘤细胞或抑制某些肿瘤细胞增殖。
2.风湿性关节炎患者的滑膜中有大量TNF。
3.在脓毒败血症、感染性肺炎等严重炎性疾病时血清中TNF含量明显增高。
许多寄生虫病患者中TNF也显著改变。
艾滋病患者体液中TNF也高于正常人。
疟疾抗原、病毒和细菌均可诱导TNF产生,TNF又反过来具有抗病毒、抗细菌、抗疟疾作用。
4.TNF与移植排斥反应密切相关,在患者的血清或尿液中TNF的表达与排斥反应程度呈正相关。
三正常值参考范围
4.3±2.8ng/ml。
小鼠肿瘤坏死因子αTNFα酶联免疫分析ELISA

小鼠肿瘤坏死因子αTNFα酶联免疫分析ELISA小鼠肿瘤坏死因子α(TNFα)是一种重要的炎症细胞因子,参与了多种生物学过程,包括免疫应答、炎症反应和细胞凋亡。
因此,检测和量化小鼠体内TNFα浓度对于研究炎症性疾病、免疫反应以及药物开发等方面具有重要意义。
TNFα的酶联免疫分析(ELISA)是一种常用的测量方法。
它基于抗体的特异性结合能力,能够定量检测样品中的TNFα浓度。
下面将介绍ELISA的基本原理、步骤以及实验注意事项。
ELISA的基本原理如下:1.酶标记体制造:选择特异性抗体对TNFα进行捕获,并与酶(如辣根过氧化物酶-HRP)结合,形成酶标记的抗体。
2.样品制备:样品可以是小鼠外周血、血清、组织提取物等。
样品需要经过预处理,如稀释、处理以去除干扰物质。
3.包被阶段:将TNFα特异性的捕获抗体稀释在特定的固相免疫板上,使其吸附在孔底。
然后通过洗涤去除未结合的抗体。
4.结合阶段:将处理过的样品和酶标记的抗体加入到包被的固相免疫板中,使其与TNFα结合。
经过一段时间的孵育,将未结合物洗涤干净。
5.检测阶段:加入底物溶液(一般是含有染色物质的底物)。
当TNFα与抗体结合的复合物与底物结合时,酶催化会引起颜色的变化。
反应停止后,测定吸光度,与TNFα的浓度成正比。
实验步骤:1.准备工作:将所需试剂和材料准备好,包括免疫板、稀释液、洗涤缓冲液、抗体和底物。
2.包被阶段:将包被抗体稀释在稀释液中,然后加入到免疫板的孔中,孵育一段时间(通常为1-2小时),去除未结合的抗体。
3.样品处理:将样品预处理,如稀释或加入处理溶液以去除干扰物质。
4.结合阶段:将样品加入到包被的免疫板孔中,孵育一段时间(通常为1-2小时),使其与捕获抗体结合。
然后进行洗涤,以去除未结合的物质。
5.检测阶段:加入酶标记的抗体,与TNFα结合。
经过孵育和洗涤,加入底物溶液,孵育一段时间后,停止反应。
6.测定吸光度:使用酶标仪测定底物产生的吸光度,与TNFα浓度成正比。
细胞因子生物学活性检测

细胞因子生物学活性检测细胞因子水平测定是细胞免疫功能检测的一个重要组成部分。
由于许多细胞因子cDNA 克隆和表达的成功,给细胞因子单克隆抗体制备、生物学功能的鉴定提供必要条件。
目前检测细胞因子水平主要包括两类方法:一是生物学活性的检测,这类方法是利用细胞因子某一特定的生物学作用所设计的检测方法,如IL-2维持活化T细胞的增殖,IFN能保护病毒对正常细胞的感染,TNF-α选择性杀某些肿瘤细胞等,因此敏感性也较高;二是定量的检测,常用酶联免疫吸附试验(ELISA),如多克隆抗体与单克隆抗体,识别不同表位两种单克隆抗体的双抗体夹心法,生物学和定量的检测方法各有优缺点,在必要时可同时进行检测。
一、白细胞介素1(IK-1)生物学活性测定白细胞介素1是一种重要的细胞因子,主要由单核-巨噬细胞产生,IL-1不仅对多种免疫活性细胞有重要的调节功能,而且与发热、炎症发生以及某些疾病的病理变化有关。
目前对IL-1产生水平的检测主要应用生物学活性检测的方法。
ConA刺激小鼠胸腺细胞检测IL-1生物学活性(一) 原理小鼠胸腺细胞在丝裂原刺激下表达IL-1受体,在有IL-1同时存在的条件下,IL-1可协同丝裂原促T细胞的增殖作用。
根据加入IL-1后增殖水平(3H-TdR掺入率)的增加可计算出样品中IL-1的活性单位,或计算出刺激指数。
(二) 操作步骤取6~8周龄C57BL16小鼠,拉颈处死,无菌取胸腺置不锈钢网筛上,用注射器针蕊研磨成细胞悬液调整细胞数为1.5×107/ml↓细胞悬液内加入ConA,使终浓度为3μg/ml,在96孔培养板中加100μl(1.5×106细胞)↓加入不同稀释度待测样品和IL-1标准品100μl/孔(ConA终浓度为1.5μg/ml)↓37℃ CO2孵箱 66h每孔加3H-TdR 0.5μci孵箱 6h多头细胞收集仪收获于9999型玻璃纤维纸上↓烤干,移入液闪瓶中,加适量闪烁液,于液闪仪上测β计数计算:1. 从IL-1标准曲线上测得IL-1的活性单位2. 也可用刺激指数(SI)表示实验组cpmSI=──────×100%对照组cpm(三) 试剂和器材1. 10% FCS RPMI1640,96孔培养板,孵箱2. 标准IL-1,ConA3. 3H-TdR,PPO、POPOP,二甲苯4. 9999型玻璃纤维滤纸,细胞收集仪5. β液闪计数仪(四) 注意事项1. 不同品系小鼠对IL-1的反应性有差异,据国内资料报道以C57BL为好。
CCK-8检测肿瘤坏死因子生物学活性

CCK-8法检测肿瘤坏死因子α生物活性的研究赵海丹(哈药集团生物工程有限公司,黑龙江,哈尔滨,150025)摘要:以小鼠成纤维细胞L929作为研究对象,探讨了CCK-8法、MTT法和XTT法的检测范围。
CCK-8适宜细胞数量范围为8×102—l×105个。
在检测肿瘤坏死因子α(TNF-α)对小鼠成纤维细胞L929的杀伤活性的实验中,发现CCK-8法测得数据的线性相关性优于MTT法和XTT法,并且数据偏差小。
实验结果表明CCK-8法是一种灵敏度高,准确性好的检测细胞活性的方法。
关键词:CCK-8;MTT;XTT;杀伤作用Research of biological activity of tumor necrosis factor-α with CCK-8ZhaoHaidan(Harbin Pharmaceutical Group Bioengineering Co., Ltd.,Heilongjiang,Harbin 150025) Abstract:As L929 mouse fibroblast cells to the research object,Discuss the detection range of CCK-8,MTT and XTT.The suitable number of cells of CCK-8 is 8 × 102—1× 105.In the detection of tumor necrosis factor α (TNF-α) on the mouse fibroblasts L929 cytotoxicity experiments, found that CCK-8 method to measure the linear correlation of data is superior to MTT and XTT,and the data deviation is small . The results show that CCK-8 is a high sensitivity, good accuracy method in cell activity assays.Key words:CCK一8;MTT;XTT;cytotoxicityCell Counting Kit-8简称CCK-8试剂盒[1],是一种新型的检测细胞活性的方法。
肿瘤坏死因子-α(TNF-α)生物学活性测定

肿瘤坏死因子-α(TNF-α)生物学活性测定肿瘤坏死因子-α(TNF-α)是一种主要由单核-吞噬细胞产生的单核因子,不仅具有选择性地杀伤某些肿瘤细胞,而且有多种免疫调节作用。
其检测方法主要包括生物学活性测定和免疫学检测方法。
其中细胞毒生物学检测方法敏感性较高,最为常用;免疫学检测方法包括酶联免疫吸附试验(ELI…肿瘤坏死因子-α(TNF-α)是一种主要由单核-吞噬细胞产生的单核因子,不仅具有选择性地杀伤某些肿瘤细胞,而且有多种免疫调节作用。
其检测方法主要包括生物学活性测定和免疫学检测方法。
其中细胞毒生物学检测方法敏感性较高,最为常用;免疫学检测方法包括酶联免疫吸附试验(ELISA)和放射免疫测定法。
(一)原理:TNF-α受体广泛地分布于多种肿瘤细胞和血细胞,根据TNF-α与相应靶细胞结合后引起不同的生物学效应,建立了多种检测TNF-α生物学活性方法。
某些肿瘤细胞膜表面的TNF-α受体与TNF-α结合后,可导致这些肿瘤细胞的死亡,可通过检测对肿瘤细胞的杀伤能力,来反映TNF-α的生物学活性。
若这种肿瘤细胞先用3H-TdR标记,则被杀伤后3H-TdR 释放至细胞外,牽I通过测定肿瘤细胞释放3H-TdR的量来反映TNF-α的杀伤活性。
(二)操作步骤:0.25%胰蛋白酶消化处于对数生长期的L929细胞↓用RPMI1640洗涤细胞后,调整细胞浓度至2×106/ml↓加入3H-TdR,20μci/ml↓置37℃,5%CO 培养箱中2~3h,摇动1次/30min↓用RPMI1640洗涤2次,800rpm×5min/次↓调整细胞浓度至2~3×105/ml后,加入96孔培养板中,100μl/孔↓加入不同稀释度的待测样本(设三个重复孔)↓加入放线菌素D,使放线菌素D最终浓度至1μg/ml用时设放线菌素、完全培基阴性对照和rTNF-α标准品阳性对照↓37℃, 5%CO 培养中24h加入3%胰蛋白酶和0.25%DNA酶各10μl/孔↓37℃,30min用DYQ-Ⅱ型多头细胞收集器收集样品于"9999"型玻璃纤维滤纸上↓烤干后,进行β计数结果判定:1.TNF-α作用24h后,在倒置显微镜下判定50%L929细胞杀伤的稀释度即为1个TNF-α活性单位。
病毒性心肌炎肿瘤坏死因子-α的检测及意义

病毒性心肌炎肿瘤坏死因子-α的检测及意义目的:探讨病毒性心肌炎患者血清肿瘤坏死因子-α(TNF-α)的变化及临床意义。
方法:采用酶联免疫吸附试验(ELISA)法测定44例病毒性心肌炎患者血清TNF-α,并与正常对照组30例进行比较。
结果:病毒性心肌炎患者急性期TNF-α明显高于恢复期及正常对照组;急性期血清TNF-α水平与磷酸肌酸激酶同工酶(CK-MB)、乳酸脱氢酶同工酶(LDH1)呈正相关,恢复期血清TNF-α水平与CK-MB、LDH1无相关性。
结论:血清TNF-α与VMC的心肌损害过程及病情程度密切相关,TNF-α检测可作为判断VMC患者病情及预后的指标之一。
标签:病毒性心肌炎;肿瘤坏死因子;TNF-α病毒性心肌炎(viral myocardtis,VMC)是由于病毒在心肌细胞内复制从而引起细胞溶解并引发一系列心肌组织的自身免疫反应,造成了病毒对心肌细胞的直接损伤和继发的自身免疫反应对心肌组织的持续损害。
细胞因子在VMC的不同发病期起着重要的作用,且随着病情的发展,细胞因子所起的作用也有所不同[1]。
本研究通过检测VMC患者肿瘤坏死因子-α(TNF-α)的变化,探讨其临床意义,报道如下:1资料与方法1.1一般资料2007年3 ~12月心脏内科临床确诊的病毒性心肌炎患者44例为观察组,其中,男21例,女23例,年龄15~67岁;发病1~4周前均有上呼吸道感染史,病程在6个月及以内者35例,6个月以上者9例。
剔除既往有心、脑血管疾病及关节疾病的患者。
恢复期18例,急性期26例,其中,20例患者柯萨奇病毒B 组(coxB)特异性IgM阳性,其他6例为阴性。
挑选30例正常健康体检者为正常对照组,其中男14例,女16例,年龄14~59岁,且近2周内无感染性疾病发生。
两组患者年龄、性别及来源比较无显著性差异(P>0.05),具有可比性。
1.2 TNF-α、CK-MB及LDH1测定抽取静脉血3 ml,分离血清,部分新鲜血清进行CK-MB及LDH1测定,采用迈克公司试剂,在日立7180型全自动生化分析仪上测定。
小鼠肿瘤坏死因子α(TNF-α)ELISA 实验说明书

小鼠肿瘤坏死因子α (TNF-α)酶联免疫试剂盒使用说明书【预期应用】ELISA法定量测定小鼠血清、血浆、细胞培养物上清、组织裂解液中TNF-α含量。
【产品性能指标】1、检测范围:15.6 pg/ml-1000 pg/ml2、灵敏度:3.9 pg/ml3、精密度:批内差CV%<8%,批间差CV%<10%4、特异性:本试剂盒特异性检测小鼠TNF-α,且与其他相关蛋白无交叉反应。
【实验原理】用纯化的抗体包被微孔板,制成固相载体,往包被抗TNF-α抗体的微孔中依次加入标本或标准品、生物素化的抗TNF-α抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样本中的TNF-α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样本浓度。
【试剂盒组成成分】组份96T酶标板(Assay plate) 12条×8孔标准品(Standard) 2瓶(冻干品)生物素标记抗体(Biotin-antibody) 1 x 120 μl/瓶(100×)辣根过氧化物酶标记亲和素(HRP-avidin) 1 x 120 μl/瓶(100×)生物素标记抗体稀释液(Biotin-antibody Diluent) 1 x 15 ml/瓶辣根过氧化物酶标记亲和素稀释液(HRP-avidin Diluent) 1 x 15 ml/瓶样本稀释液(Sample Diluent) 1 x 50 ml/瓶浓洗涤液(Wash Buffer) 1 x 20 ml/瓶(25×)底物溶液(TMB Substrate) 1 x 10 ml/瓶终止液(Stop Solution) 1 x 10 ml/瓶板贴 4【存储条件及有效期】未开封试剂盒试剂盒避光保存于2-8℃。
有效期为六个月。
请在试剂盒标注的有效日期内使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
响。因为 TNF-β 细胞毒生物学作用等很多生物学效应均与 TNF-α 相似。
肿瘤坏死因子-α(TNF-α)是一种主要由单核-吞噬细胞产生的单核因子,不仅具有选择性 地杀伤某些肿瘤细胞,而且有多种免疫调节作用。其检测方法主要包括生物学活性测定和免 疫学检测方法。其中细胞毒生物学检测方法敏感性较高,最为常用;免疫学检测方法包括酶 联免疫吸附试验(ELISA)和放射免疫测定法。
(一) 原理: TNF-α 受体广泛地分布于多种肿瘤细胞和血细胞,根据 TNF-α 与相应靶细胞结合后引 起不同的生物学效应,建立了多种检测 TNF-α 生物学活性方法。某些肿瘤细胞膜表面的 TNF-α 受体与 TNF-α 结合后,可导致这些肿瘤细胞的死亡,可通过检测对肿瘤细胞的杀伤 能力,来反映 TNF-α 的生物学活性。若这种肿瘤细胞先用 3H-TdR 标记,则被杀伤后3H-TdR 释放至细胞外,牽 I 通过测定肿瘤细胞释放3H-TdR 的量来反映 TNF-α 的杀伤活性。 (二) 操作步骤:
用 DYQ-Ⅱ型多头细胞收集器收集样品于 "9999"型玻璃纤维滤纸上
↓ 烤干后,进行 β 计数
结果判定:
1. TNF-α 作用 24h 后,在倒置显微镜下判定 50%L929 细胞杀伤的稀释度即为1个
TNF-α 活性单位。
2. 根据测得的 cpm 值按下列公式计数活性单位:
TNF-α 活性单位(U/ml)
对照组 cpm 值。
3. 胰蛋白酶和 DNA 酶浓度和消化时间要严格控制,犆?批酶均要摸索最适浓度和时间。
否则,消化时间过长或过短者会影响实验结果。
4. 为了增强检测系统的敏感性,在测定系统中加入放线菌素 D,但浓度不宜过大,一
般最终浓度为 0.5~1μg/ml。
5. 在测定 PHA 等丝裂原诱导的 PBMC 培养上清时,要注意排除 TNF-β(淋巴毒素)的影
放线菌素 D 对照组 cpm-实验组 cpm
=──────────────× 标准品活性单位× 待测样品稀释倍数
放线菌素 D 对照组 cpm-标准品 cpm
(三) 试剂和器材:
1. 鼠成纤维细胞(L929)
2. rTNF-α 和待测样品
3. 放线菌素、DNA 酶、胰蛋白酶
4. 10%FCS RPMI1640,RPMI1640
5. 3H-TdR,PPO,POPOP、二甲苯,玻璃加样器和加样器头
7.
培养箱、倒置显微镜、超净台等
(四) 注意事项:
1. 用于标记3H-TdR 的 L929 细胞要处于对数生长期,否则3H-TdR 掺入率低,影响
实验结果。
2. 标记后的 L929 细胞应充分洗涤,以洗掉游离的3H-TdR,牱 q 则会影响完全培基
0.25%胰蛋白酶消化处于对数生长期的 L929 细胞 ↓
用 RPMI1640 洗涤细胞后,调整细胞浓度至 2× 106/ml ↓
加入3H-TdR,20μci/ml ↓
置 37℃,5% 培养箱中 2~3h,摇动 1 次/30min ↓
用 RPMI1640 洗涤 2 次,800rpm× 5min/次 ↓
肿瘤坏死因子-α(TNF-α)生物学活性测定
肿瘤坏死因子-α(TNF-α)是一种主要由单核-吞噬细胞产生的单核因子,不仅具有选择性地杀伤某些肿 瘤细胞,而且有多种免疫调节作用。其检测方法主要包括生物学活性测定和免疫学检测方法。其中细胞毒 生物学检测方法敏感性较高,最为常用;免疫学检测方法包括酶联免疫吸附试验(ELI…
调整细胞浓度至 2~3× 105/ml 后,加入 96 孔 培养板中,100μl/孔
↓ 加入不同稀释度的待测样本(设三个重复孔)
↓ 加入放线菌素 D,使放线菌素 D 最终浓度至 1μg/ml 用时设放线菌素、完全培基阴性对照和 rTNF-α 标准
品阳性对照 ↓37℃, 5% 培养中 24h
加入 3%胰蛋白酶和 0.25%DNA 酶各 10μl/孔 ↓37℃,30min
