化学中常用符号
化学常用符号与图标

化学常用符号与图标一、化学式氢气式H2水式H2O 氯化氢式HCl 硝酸式HNO3次氯酸式HClO 硫亚酸式H2SO3硫酸式H2SO4磷酸式H3PO4碳酸式H2CO3硫化氢式H2S 磷化氢式PH3氨式NH3甲烷式CH4硅烷式SiH4水双氧式H2O2偏硅酸式硅酸式H2SiO3硅原酸式H4SiO4氯气式Cl2溴单式Br2碘单式I2氧化钠式Na2O氧过化钠式Na2O2氧化镁式MgO氧化铝式Al2O3氧化铁式Fe2O3氧亚铁式FeO四氧化三铁式Fe3O4氧化钙式CaO二氧化硫式SO2三氧化硫式SO3四氧化二氮式N2O4二氧化氮式NO2一氧化氮式NO氧化铜式CuO氧化银式Ag2O二氧化碳式CO2一氧化碳式CO氢离子式H+钠离子式Na+钾离子式K+银离子式Ag+铵离子式NH+4二氨银式[Ag(NH3)2]+钙离子式Ca2+镁离子式Mg2+铜离子式Cu2+钡离子式Ba2+铁亚离子式Fe2+锌离子式Zn2+铁离子式Fe3+铝离子式Al3+氟离子式F-氯离子式Cl-溴离子式Br-碘离子式I-硝酸根式NO-3硫氢根式HS-碳酸氢根式HCO-3硫亚氢根式HSO-3 硫酸氢根式HSO-4乙酸根式CH3COO-偏铝酸根式AlO-2次氯酸根式ClO-3碘酸根式IO-3氯次酸根式ClO-氢氧根式OH-硫亚酸根式SO2-3 碳酸根式CO2-3 硫酸根式SO2-4 硅酸根式SiO2-3 磷酸根式PO3-4 PO2-3硫离子式S2-硅原酸根式SiO3-4 氧氢化钠式氢氧钠式NaOH 氯钠式NaCl 溴钠式NaBr 碘钠式NaI 硝酸钠式NaNO3乙酸钠式CH3COONa 硫氢钠式NaHS 亚硫钠式NaHSO3碳酸氢钠式NaHCO3偏铝酸钠式NaAlO2次氯酸钠式NaClO 氯酸钠式NaClO3硫酸氢钠式NaHSO4碘酸钠式NaIO3硫酸钠式Na2SO4硫亚酸钠式Na2SO3硅酸钠式Na2SiO3碳酸钠式Na2CO3硫化钠式Na2S 硅原酸钠式Na3SiO4磷酸钠式Na3PO4氧氢化钾式氢氧钾式KOH 氯化钾式KCl 溴化钾式KBr 碘化钾式KI 碘酸钾式KNO3乙酸钾式CH3COOK 硫氢钾式KHS 亚硫钾式KHSO3碳酸氢钾式KHCO3偏铝酸钾式KAlO2次氯酸钾式KClO 氯酸钾式KClO3硫酸氢钾式KHSO4硫酸钾式K2SO4硫亚酸钾式K2SO3硅酸钾式K2SiO3碳酸钾式K2CO3硫化钾式K2S硅原酸钾式K3SiO4磷酸钾式K3PO4氯化银式AgCl 氯化银沉淀式AgCl↓溴化银式AgBr碘化银式AgI 硝酸氨银Ag(NH3)2(NO3)2氯化铵式NH4Cl溴化铵式NH4Br 碘化铵式NH4I 一水合氨式NH3·H2O 硝酸铵式NH4NO3磷酸铵式(NH4)3PO4氧氢化钙式Ca(OH)2氯化钙式CaCl2CaBr2碘化钙式CaI2碳酸钙式CaCO3钙盐:CaSO3CaSO4CaSiO3Ca3(AlO3)2Ca(HCO3)2Ca(HSO3)2Ca(HSO4)2Ca(ClO)2CaSO4 Ca3(PO4)2CaHPO4Ca(H2PO4)2镁盐:MgCl2、MgI2、Mg(NO3)2、MgSiO3、Mg(HSO3)2、Mg3(PO4)2、Mg(H2PO4)2、Mg3N2Cu(OH)2CuCl2CuBr2CuI2CuCO3Cu(NO3)2CuSO3Cu2(OH)2(CO3)2CuSO4Ba(OH)2BaCl2BaBr2BaI2BaCO3Ba(NO3)2BaSO3BaSO4BaSiO3Ba(HCO3)2Ba(HSO3)2Ba(HSO4)2 Ba3(PO4)2BaHPO4Ba(H2PO4)2Fe(OH)2FeCl2FeBr2FeI2Fe(NO3)2FeSO4Zn(OH)2ZnCl2ZnBr2ZnI2ZnCO3ZnSO4Zn(NO3)2Fe(OH)3FeCl3FeBr3Fe(NO3)3硫酸铁式Fe2(SO4)3Al(OH)3AlCl3AlBr3Al(NO3)3硫酸铝式Al2(SO4)3188O二、符号单等 —— 加热等 △—— 一定条件等 一定条件═══ 浓硫酸等 浓硫酸═══ 催化剂等 催化剂═══浓加等 浓硫酸═══加热 高高催等 高温高压═══催化剂 二氧化锰等 二氧化锰═══ 二氧化锰加热等 二氧化锰═══△高温等高温═══ 催加等催化剂═══△ 闪电══单号─→ 加热号△─→ 浓硫酸号浓硫酸───→ 一定条件号一定条件───→ 催化剂号催化剂───→ 浓加号浓硫酸───→△制乙烯号浓硫酸───→170℃ 制乙醚号浓硫酸───→140℃ 二氧化锰号二氧化锰───→ 催化剂───→加压、加热 燃烧═══燃烧══ 电解══ 一定条件逆催化剂逆浓硫酸逆高高逆可逆号浓硫酸△催化剂△ 高温高压△ 高温高压催化剂加热逆 催加逆催化剂△ 浓加逆浓硫酸△ 高高加逆高温高压△期望产物的总质量 ───────生成物的总质量高高催逆 高温高压催化剂H 2OH 2OH 2OH 2O 高温══ 高温─→ 点燃─→ 光照─→ 单逆号 ←─前聚合号——[ 后聚合号——] n 双键号 C —C 叁键号 C ——C 侧二甲苯 ─CH 3─CH 3三甲苯 H 3C ─ ─CH 3| CH 3 三硝基甲苯 ∣CH 3O 2N ─ ─NO 2 | NO 2右斜甲苯 CH3╱ CH3╱ CH3╱ CH3╱ H3C╲H3C ╲左斜甲苯H3C ╲ 竖二甲苯 OH | | CH3羰基式 —O ‖C — 醛基式 —O ‖C —H 羟基式 —OH 羧基式 —O ‖C —OH三、电子式镁电子式 ·Mg · 铝电子式 ··Al · 碳电子式 ··C ·· 氮电子式 · ·· N ·· 氧电子式 · ··O ·· ·氯右电子式 :·· Cl ·· · 氯左电子式 ··· Cl ·· :八电子结构 :··Cl ··: 氨电子式H ·· H :N·· :H :·· Cl ·· :·· Cl ·· : H :·· Cl ·· : 氢左电子式 ·H 氢右电子式 H ·C12 12C C60 12C C 60 碳六十式 C612 126C 碳十二式 沉淀淀↓ 气体体↑二氧化碳电子式 :·· O ·· ::C ::·· O ·· : 氧化钠电子式 Na +[: ·· O·· :]2-Na + 过化钠电子式Na +[: ·· O ·· : ·· O·· :]2-Na +氮气电子式 :N ······N : :·· O ·· ::C ::·· O ·· :Na +[: ·· O ·· :]2-Na + Na +[: ·· O ·· : ·· O ·· :]2-Na+ Na +[: ·· O ·· :H]-Na +[:·· Cl ·· :]-H : ·· O ·· :H :·· Cl ·· ::·· Cl ·· :C :··Cl ··::·· Cl ·· : H 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2O氧氢化钠电式 Na +[: ·· O ·· : H]- 氯化钠电子式 Na +[:·· Cl ·· :]- 水电H ∶‥O ‥∶ HH ∶‥O ‥∶ H:·· Cl ·· ::·· Cl ·· :C :·· Cl ··::··Cl ·· : 四氯化碳电式:·· Cl ·· ::·· Cl ·· :C :·· Cl ··::·· Cl ·· : 左电子转移号 ·+ · 右电子转移号 · + · 氨电式 H ..H:N ..:H 铵根电式H ·· [H :N ·· :H]+H [:·· Cl ··:]- H | [H -N| -H]+HF ╲F ╱C -F·H H · Na · K · ·Mg ··Ca ···Al ···C ····Si ·· ‥·O · ‥ ···S ·· · ··N ..· ··· Cl ·· : ·· :Cl ···Na ·+ ··· Cl ·· :─→ Na +[:·· Cl ·· :]- 氯钠生式·· Br ·· ·· I ·· ·· O ·· Na ·+ ··· Br ·· : ─→ Na +[:·· Br ··:]- Na · + ··· I ·· : ─→ Na +[:·· I ··:]- CNa · + · ·· O ·· · + ·Na ─→ Na +[:·· O ·· :]2-Na +Na · + · ·· S ·· · + ·Na ─→ Na +[: ·· S ·· :]2-Na +H ·+··· Cl ·· : ─→ H :·· Cl ·· :H · +‥·O · ‥+·H ─→ H :·· O ··: H:·· Cl ·· · + ·Mg · + ··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]-H 2OH 2OH 2O·+ · · + · K · + ··· Cl ·· : ─→ K +[:··Cl ·· :]- 氯钠生式K · + ··· Br ·· : ─→ K +[:··Br ·· :]-K · + ··· I ·· :─→ K +[:··I ··:]-K · + ‥·O · ‥ +·K ─→ K +[:·· O ·· :]2-K +K · + · ·· S ·· · +·K ─→ K +[: ·· S ·· :]2-K + H · +··· Cl ·· : ─→ H :··Cl ·· :H · +··· Br ·· : ─→ H :··Br ·· :H · +··· I ·· : ─→ H :··I ··:H · +‥·O · ‥+·H ─→ H :·· O ··: H:·· Cl ·· ·+·Mg ·+··· Cl ·· :─→ [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- [:·· Cl ·· :]-Mg 2+ [:·· Cl ·· :]- :·· I ·· ·+·Mg ·+··· I ·· :─→ [:·· I ·· :]-Mg 2+ [:··I ·· :]- :·· Br ·· ·+·Mg ·+··· Br ·· :─→ [:·· Br ·· :]-Mg 2+ [:··Br ·· :]- :·· Cl ·· ·+·Ca ·+··· Cl ·· :─→ [:·· Cl ·· :]-Ca 2+ [:··Cl ··:]-:·· I ·· ·+·Ca ·+··· I ·· :─→ [:·· I ·· :]-Ca 2+ [:··I ·· :]- :·· Br ·· ·+·Ca ·+··· Br ·· :─→ [:·· Br ·· :]-Ca 2+ [:··Br ·· :]-氯气电式 :·· Cl ·· :·· Cl ·· : :·· Br ·· :·· Br ·· :溴单电式 :·· Br ·· :·· Br ·· : 碘单电式 :·· I ·· :··I ·· : 氮气电式 :N ······N : 氢气电式 H :H Cl 2氯化氢电式 H :·· Cl ·· : H ..H:N ..:H H .. [H :N ..:H]+H 甲烷电式 H ..H :C ..:H H H ..H :Si ..:H HH ·· H :N ·· :H H ·· [H :N ·· :H]+HH ·· H :N ··:H H ·· [H :N ·· :H]+HH | [H -O -H]+电子转移式 2e —∣─────────────↓S + O 2 ═ SO 2 电子转移式2e —∣─────────────↓ S + O 2 ═ SO 2一层结构○+1 )1 ) 二层结构○+1 )2 ))8 ) ○+1 )1 ) ○+1 )2 ))8 ) —CH —∣NH 2CH 2-∣OH ∣CH 2-OH 上CH 2-∣OH∣CH 2-OH 三、 有机域上结构 CH 3—CH —COOH ∣NH 2 —CH —∣NH 2下结构 CH 2-∣OH CH 2-∣OH CH 2-∣OH CH 2-∣OH上下构结 CH -∣OH ∣NH 2 CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH∣NH 2中结构 ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH署名结构 (C 6H 10O 5)n 纤维素 (C 6H 10O 5)n 淀粉 (C 6H 12O 6)n 葡萄糖 (C 6H 12O 6)n 果糖 (C 12H 22O 11)n 麦芽糖 (C 12H 22O 11)n蔗糖(C 6H 10O 5)n 纤维素分子式结构 HNO 3 C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯分子结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2三层结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2反应示意图结构 H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O2D B H +ENa 2O 2⎩⎨⎧→G 过量CO 2白色沉淀H→F S 点燃I H 2SO 4△水解液NaOH 溶液中和液⎩⎨⎧银氨溶液微热生成银镜碘水无现象 C 6H 5— HO —CH —NH —C ‖O —C 6H 5CH -COOH ∣+H 2O 无机酸C 6H 5— HO —CH —NH 2CH -COOH ∣羟基酸羟基酯结构 CH 3CH ╱╲COO╲OOC╱CHCH 3 CH 3CH ╱╲COO ╲OOC ╱CHCH 3CH 3CH ╱╲COO ╲OOC╱CHCH 3双键结构 H 3C ╲H 3C ╱C =C ╱CH 3╲CH 3 H 3C ╲H 3C ╱C = C ╱╲ C ╱╲ CH 3CH 3 C ╱CH 3╲CH 3横上苯 - 横下苯- - 竖右苯竖左苯对二甲苯 CH 3 -CH 3 CH 3- -CH 3竖苯酚 -OH 横苯酚 OH 竖苯酚 竖方程组结构 竖甲苯竖苯酚 OH |竖苯甲酸COOH|竖甲苯 CH 3|上甲基 CH3| 下甲基 | CH3 右斜甲苯CH3╱ CH3╱ CH3╱ CH3╱ ╱H3C H3C ╲ H3C ╲竖对二苯基 OH || CH3横对二苯基 ——-CH 3-CH 3平二苯基H 3C ──CH 3-CH 3-CH 3 侧二苯基-CH 3-CH 3 三苯基 H 3C ──CH 3| CH3三硝基甲苯 CH3|O 2N ─ ─NO 2 | NO2白藜芦醇 HO - -CH =CH - ╱CH 3╲CH 3横右三甲苯CH - ╱CH 3╲CH 3横左三甲苯 H3C ╲ ╱H3C-CH 3 CHH3C ╲ ╱H3C竖三甲苯 CH3| H 3C ──CH 3 三溴苯酚 Br ─ ─Br | Br双键号 —— 叁键号——合成结构(C 6H 10O 2N 2)C 适当条件CH 3-CH -COOH ∣NH 2↓Na ↓HClA B HHHNO 2D 浓硫酸(C 6H 8O 4)E四、方程组结构 ytxs⎩⎪⎨⎪⎧x ═1y ═2z ═3m ═4 ⎩⎪⎨⎪⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10⎩⎪⎨⎪⎧2x +3y +9z +5m ═55……………………①2×(x +y +z +2m )═28……………………② ⎩⎪⎨⎪⎧x ═ 1y ═ 2⎩⎨⎧银氨溶液微热生成银镜碘水无现象⎩⎨⎧银氨溶液微热生成银镜碘水无现象 银氨溶液微热生成银镜碘水无现象⎩⎨⎧银氨溶液微热生成银镜碘水无现象 同醛基式 -O ║C —H双尖前域⎩⎪⎨⎪⎧x +y ═x +y ═双尖后域⎭⎪⎬⎪⎫x +y ═x +y ═3、⎩⎨⎧x +y ═x +y ═x +y ═4、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═x +y ═x +y ═双平前域⎣⎢⎡x +y ═x +y ═双平后域⎦⎥⎤x +y ═x +y ═前聚合号——[ 后聚合号 ——] n 聚合号 ——[——] n左合右号 ――――――⎦⎥⎤――― 左分右号 ――――⎣⎢⎡-→-→HO — —∣OH CH 2CH -∣NH 2O -O ║C —HHO - -CH =CH - ╱CH 3╲CH 3 白黎芦醇 HO - -CH =CH - ╱CH 3╲CH 3环氧乙烷O╱ ╲H 2C ――CH 2有机结构域应用 [—]—n C ‖O —NHCH 3CH ╱╲COO ╲OOC╱CHCH 3CHOOCR'∣CH 2OOCR ∣CH 2OOCR'' CHOOCR ∣CH 2OOCR ∣CH 2OOCR CHOOCC 17H 31∣CH 2OOCC 17H 31∣CH 2OOCC 17H 31 催化剂加热、加压CHOOCC 17H 35∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35HO —NO 2硝酸浓硫酸C 2H 5O —NO 2硝酸乙酯227×15.86%12 227×(100%-15.86%-2.20%-18.50%)16CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2CH —OH ∣CH 2—OH ∣CH 2—OH —C — ∣CH 3 ∣ CH 3中间结构CH —O —C ‖O—R 2∣CH 2—O —C ‖O —R 1∣CH 2—O —C ‖O —R 3H 2SO 4 CH —OH ∣CH 2—OH ∣CH 2—OHCH —OH ∣CH 2—OOCCH 3∣CH 2—OH 和CH —OOCCH 3∣CH 2—OH ∣CH 2—OH10 g2 0003 g ·mol —1∶12 g 1002 g ·mol —1═①CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31 ②CH 2∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35 ③CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2Cu(OH)2 KMnO 4 I 2 mol ·L -1 C 17H 35CHOOCC 17H 35∣CH 2OOCC 17H 31∣CH 2OOCC 17H 35 B.CHOOCC 17H 33∣CH 2OOCC 17H 33∣CH 2OOCC 17H 35 C.CHOOCC 17H 33∣CH 2OOCC 17H 33∣CH 2OOCC 17H 31 D.CHOOCC 15H 31∣CH 2OOCC 15H 29∣CH 2OOCC 15H 29—C ‖O —R 被 -P -O ‖O ∣OH 1230 ⎩⎨⎧加碘水溶液变蓝色加C 溶液单质沉淀 加A 溶液△ H -C -H |H ∣H⎩⎨⎧银氨溶液微热生成银镜碘水无现象 ONO 2ONO 2OH⎩⎪⎨⎪⎧→D→C(密度最小的单质)→EC 6H 5— HO —CH —NH —C ‖O —C 6H 5CH -COOH∣C 6H 5— HO —CH —NH 2CH -COOH∣H 2N —CH ∣R 1—C ‖O —N ∣H —CH ∣R 2—C ‖O —N ∣H —CH ∣R 3—C ‖O —N ∣H —CH ∣R 4—C ‖O —OH甘氨酸(C 2H 5NO 2)CH 2—COOH NH 2∣丙氨酸(C 3H 7NO 2)CH 3—CH —COOH ∣NH 2 ,—C ‖O —N ∣H —谷氨酸(C 5H 9NO 4)HOOC —CH 2—CH 2—CH —COOH ∣NH 2⎩⎪⎨⎪⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10 解得⎩⎪⎨⎪⎧x ═1y ═2z ═3m ═4(C 6H 7O 2)—ONO 2ONO 2OH n—NH -↓A CH ∣R -↓B C ‖O -↓CNH -CH ∣R'—C -‖→D OR -CH —C ‖O —OH ∣NH 2+HNO 2R -CH —C ‖O —OH ∣OH+N 2↑+H 2(C 6H 10O 2N 2)C 适当条件CH 3-CH -COOH ∣NH 2↓Na ↓HClA B HHHNO 2D 浓硫酸(C 6H 8O 4)EHS -CH 2—CH —COOH ∣NH 2 HS -CH 2—CH —C ‖O —O -S -CH 2—CH —COOH ∣NH 2∣NH 2 HS -CH 2—CH —COONH 4∣NH 2A.H -C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C —C ‖O —H ∣H ∣OHB.H -C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C —C ‖O —H ∣H ∣NH 2C.H -C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C -∣H ∣NH 2C —C —‖NH H ∣H ∣NH 2D.H -C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C -∣H ∣OH C —C —‖NH H ∣H ∣OHCH 2—COOH ∣NH 2、CH 3—CH —COOH ∣NH 2、CH 3—CH 2-CH —COOH ∣NH 2A. CH 2—COOH ∣NH 2B.CH 3—CH —COOH ∣NH 2╲C ‖O ╱ ╲C ‖O ╱ CH 2-CH 2∣ C ——∣H N ∣ CH 2CH 2∣(C 6H 7O 2)—ONO 2OH OH n (C 6H 7O 2)—ONO ONO 2ONO nC. D.HOOC —CH 2—CH 2—CH —COOH ∣NH 2B.C. ——HHD. (C 6H 7O 2)—ONO 2ONO 2OHCH 2-∣OH CH -∣OH CH -∣OH CH -∣OH CH -∣OHCHO 甲CH 2-∣OH CH —CH -∣OH CH -∣OH CH -∣OH CH ∣OH 乙H 2O ⎩⎪⎨⎪⎧CO 2叶绿素A 酶B O 2催化剂C O 2D B H +E Na 2O 2⎩⎨⎧→G 过量CO 2白色沉淀H →F S 点燃I[— [—CH —∣CH 3CH ]—n ∣COOH②CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31+HO -P -OH ‖O ∣OH CHOOCC 15H 31∣CH 2O -P -OH ‖O ∣OH ∣CH 2OOCC 15H 31+C 15H 31COOH ③CHOOCC 15H 31∣CH 2O -P -OH ‖O ∣OH ∣CH 2OOCC 15H 31+2NaOH CHOOCC 15H 31∣CH 2O -P -ONa ‖O ∣ONa ∣CH 2OOCC 15H 31+2H 2O(说明:-P -O ‖O ∣OH H 也可代替CHOOCC 15H 31∣CH 2OOCC 15H31∣CH 2OOCC 15H 31中间的—C ‖O—C 15H 31基团。
常用化学元素符号表

常用分子式氮气:N2氢气:H2甲烷:CH4氧气:O2氨:NH3水:H2O 一氧化碳:CO 二氧化碳:CO2硫:S 二氧化硫:SO2硫代硫酸钠:Na2S2O3铁:Fe 二价铁离子:Fe2+三价铁离子:Fe3+硫酸钠:Na2SO4磷酸三钠:Na3PO4碳酸钠:Na2CO3碳酸钙:CaCO3碳酸氢钠:NaHCO3氢氧化钠:NaOH盐酸:HCL 碳酸氢铵:NH4HCO3硝酸:HNO3精品硫酸:H2SO4尿素:CO(NH2) 碳酸:H2CO3化学需氧量:COD 高锰酸钾:KMnO4锰酸钾:K2MnO4缩二尿:NH2CONHCONH2硝酸银:AgNO3硫酸铜:CuSO4碳酸丙稀脂(碳丙液):C3H6CO3甲醇:CH3OH 乙醇:CH3CH2OH 甲醛:HCHO 一甲氨:NH2CH3二甲氨:NH(CH3)2 三甲氨:N(CH3)3三氧化二铝:AL2O3三氧化二铁:Fe2O3 氧化铜:CuO 氯化钠:NaCL一、初中化学常见混合物的重要成分1、空气:氮气(N2)和氧气(O2)2、水煤气:一氧化碳(CO)和氢气(H2)3、煤气:一氧化碳(CO)4、天然气:甲烷(CH4)5、石灰石/大理石:(CaCO3)6、生铁/钢:(Fe)7、木炭/焦炭/炭黑/活性炭:(C)8、铁锈:(Fe2O3)二、初中化学常见物质俗称1、氯化钠(NaCl):食盐2、碳酸钠(Na2CO3) :纯碱,苏打,口碱3、氢氧化钠(NaOH):火碱,烧碱,苛性钠4、氧化钙(CaO):生石灰5、氢氧化钙(Ca(OH)2):熟石灰,消石灰6、二氧化碳固体(CO2):干冰7、氢氯酸(HCl):盐酸8、碱式碳酸铜(Cu2(OH)2CO3):铜绿9、硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾10、甲烷(CH4):沼气11、乙醇(C2H5OH):酒精12、乙酸(CH3COOH):醋酸13、过氧化氢(H2O2):双氧水14、汞(Hg):水银15、碳酸氢钠(NaHCO3):小苏打三、物质的除杂1、CO2(CO):把气体通过灼热的氧化铜,2、CO(CO2):通过足量的氢氧化钠溶液3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体4、CuO(C):在空气中(在氧气流中)灼烧混合物5、Cu(Fe) :加入足量的稀硫酸6、Cu(CuO):加入足量的稀硫酸精品7、FeSO4(CuSO4): 加入足量的铁粉8、NaCl(Na2CO3):加入足量的盐酸9、NaCl(Na2SO4):加入足量的氯化钡溶液10、NaCl(NaOH):加入足量的盐酸11、NaOH(Na2CO3):加入足量的氢氧化钙溶液12、NaCl(CuSO4):加入足量的氢氧化钡溶液13、NaNO3(NaCl):加入足量的硝酸银溶液14、NaCl(KNO3):蒸发溶剂15、KNO3(NaCl):冷却热饱和溶液。
化学符号

化学用语复习一、元素和原子均用元素符号表示:二、离子符号(用元素符号及所带的电荷数来表示)三、化学式1.单质:非金属:氢气、氧气、臭氧、氮气、氯气、碳、硫、磷、碘、、、、、、、、:He、Ne、Ar金属:钠、钾、镁、铝、钙、锌、铁、铜、金、银、汞、锰2.氧化物:非金属氧化物:一氧化碳、二氧化碳、二氧化硫、三氧化硫、一氧化氮、二氧化氮、五氧化二氮、五氧化二磷、水、过氧化氢、二氧化硅氧化铝、氧化铁、氧化亚铁、四氧化三铁、氧化亚铜3.酸:盐酸、硝酸、硫酸、碳酸、醋酸4.氢氧化物:氢氧化钠、氢氧化镁、氢氧化钙、氢氧化铜、氢氧化铝、氢氧化铁5.氯化物:氯化钠、氯化镁、氯化钙、氯化铜、氯化锌、氯化铝、氯化铁、氯化亚铁硝酸铁、硝酸汞7.硫酸盐:硫酸钠、硫酸镁、硫酸钙、硫酸铜、硫酸锌、硫酸铝、硫酸铁、硫酸亚铁9.其它:氯酸钾、高锰酸钾、锰酸钾、甲烷、酒精、氨气、氯化氢、硫化氢[巩固练习]1.说出下列数字“2”的含义2Hg N23CO22O3 2Fe3+S2-3Mg2+2.按下列要求用元素符号及数字来表示:三个铁原子n个水分子两个镁离子m个氢氧根离子________ 正2价的镁元素__ _ 负二价的硫元素氧化铝中铝的化合价__ ____两个氮原子______ 三个氯分子____ __ 三个氧离子________ 两个硝酸根离子________ 四个亚铁离子___ ____ 硫酸铁中铁元素的化合价_____三个碳酸分子____ ____硫化钠_____ ___ 氯化银氯化铵硝酸铵二个铵根离子____ _ _四个硫酸根离子____ _ 五个碳酸根离子___ _ _ 锰酸根离子_____课后练习3. 据报道,用于清洗龙虾的“洗虾粉”中含有柠檬酸钠、亚硫酸钠(Na2SO3)等物质,可能对人体的健康产生危害。
Na2SO3中S元素的化合价为()A.+6B.+4C.+2D.-24. (13个钠离子。
(2)原子在化学反应中容易(填“得到”或“失去”)2个电子。
化学常用符号与图标

域的应用一、化学式氢气式H 2 水式 H 2O 氯化氢式 HCl 硝酸式 HNO 3 次氯酸式 HClO 硫亚酸式 H 2SO 3 硫酸式 H 2SO 4 磷酸式 H 3PO 4 碳酸式 H 2CO 3 硫化氢式 H 2S 磷化氢式 PH 3 氨式 NH 3 甲烷式 CH 4 硅烷式 SiH 4 水双氧式 H 2O 2 偏硅酸式 硅酸式 H 2SiO 3 硅原酸式 H 4SiO 4 硅酸式 氯气式 Cl 2 溴单式Br 2 碘单式 I 2氧化钠式 Na 2O 氧过化钠式 Na 2O 2氧化镁式 MgO 氧化铝式 Al 2O 3氧化铁式 Fe 2O 3氧亚铁式 FeO四氧化三铁式 Fe 3O 4氧化钙式 CaO 二氧化硫式 SO 2三氧化硫式 SO 3四氧化二氮式 N 2O 4二氧化氮式 NO 2 一氧化氮式NO 氧化铜式 CuO 氧化银式 Ag 2O 二氧化碳式 CO 2一氧化碳式 CO氢离子式 H + 钠离子式 Na +钾离子式 K + 银离子式 Ag + 铵离子式 NH +4二氨银式 [Ag(NH 3)2]+ 钙离子式 Ca 2+镁离子式 Mg 2+铜离子式 Cu 2+钡离子式 Ba 2+铁亚离子式 Fe 2+ 锌离子式 Zn 2+ 铁离子式Fe 3+ 铝离子式 Al 3+氟离子式 F - 氯离子式 Cl - 溴离子式 Br - 碘离子式 I -硝酸根式NO -3 硫氢根式 HS -碳酸氢根式 HCO -3 硫亚氢根式 HSO -3 硫酸氢根式 HSO -4 乙酸根式 CH 3COO - 偏铝酸根式 AlO -2 次氯酸根式 ClO -3 碘酸根式 IO -3 氯次酸根式 ClO - 氢氧根式 OH - 硫亚酸根式 SO 2-3 碳酸根式 CO 2-3 硫酸根式SO 2-4 硅酸根式 SiO 2-3磷酸根式PO 3-4 PO 2-3 硫离子式 S 2- 硅原酸根式 SiO 3-4氧氢化钠式 氢氧钠式 NaOH 氯钠式 NaCl 溴钠式 NaBr 碘钠式 NaI 硝酸钠式 NaNO 3乙酸钠式CH 3COONa 硫氢钠式 NaHS 亚硫钠式NaHSO 3 碳酸氢钠式 NaHCO 3 偏铝酸钠式 NaAlO 2 次氯酸钠式 NaClO 氯酸钠式 NaClO 3 硫酸氢钠式 NaHSO 4 碘酸钠式 NaIO 3 硫酸钠式 Na 2SO 4 硫亚酸钠式Na 2SO 3 硅酸钠式 Na 2SiO 3 碳酸钠式 Na 2CO 3 硫化钠式 Na 2S 硅原酸钠式Na 3SiO 4 磷酸钠式Na 3PO 4氧氢化钾式 氢氧钾式 KOH 氯化钾式 KCl 溴化钾式 KBr 碘化钾式 KI 碘酸钾式KNO 3 乙酸钾式CH 3COOK 硫氢钾式KHS 亚硫钾式 KHSO 3 碳酸氢钾式 KHCO 3 偏铝酸钾式 KAlO 2 次氯酸钾式 KClO 氯酸钾式KClO 3 硫酸氢钾式 KHSO 4硫酸钾式K 2SO 4硫亚酸钾式 K 2SO 3 硅酸钾式 K 2SiO 3 碳酸钾式 K 2CO 3 硫化钾式K 2S 硅原酸钾式 K 3SiO 4 磷酸钾式 K 3PO 4氯化银式 AgCl 氯化银沉淀式 AgCl ↓ 溴化银式 AgBr 碘化银式 AgI 硝酸氨银 Ag(NH 3)2(NO 3)2 氯化铵式 NH 4Cl 溴化铵式 NH 4Br 碘化铵式NH 4I 一水合氨式 NH 3·H 2O 硝酸铵式NH 4NO 3磷酸铵式 (NH 4)3PO 4氧氢化钙式 Ca(OH)2 氯化钙式 CaCl 2 CaBr 2 碘化钙式 CaI 2碳酸钙式 CaCO 3 Ca(NO 3)2 CaSO 3CaSO 4 CaSiO 3 Ca 3(AlO 3)2 Ca(HCO 3)2 Ca(HSO 3)2 Ca(HSO 4)2 Ca(ClO)2 CaSO 4 Ca 3(PO 4)2 CaHPO 4 Ca(H 2PO 4)2 Fe(OH)3FeCl 3FeBr 3Fe(NO 3)3硫酸铁式Fe 2(SO 4)3Al(OH)3AlCl 3AlBr 3Al(NO 3)3硫酸铝式Al 2(SO 4)3 188O二、符号单等 ———— 加热等 △———— 一定条件等 一定条件═══ 浓硫酸等 浓硫酸═══ 催化剂等 催化剂═══浓加等 浓硫酸═══加热 高高催等 高温高压═══催化剂 二氧化锰等 二氧化锰═══ 二氧化锰加热等 二氧化锰═══△高温等高温═══ 催加等催化剂═══△闪电══单号─→ 加热号△─→ 浓硫酸号浓硫酸───→ 一定条件号一定条件───→ 催化剂号催化剂───→ 浓加号浓硫酸───→△制乙烯号浓硫酸───→170℃ 制乙醚号浓硫酸───→140℃ 二氧化锰号二氧化锰───→ 催化剂───→加压、加热 燃烧═══燃烧══ 电解══一定条件逆 催化剂逆浓硫酸逆高高逆 可逆号加热逆催加逆催化剂△浓加逆浓硫酸△高高加逆高温高压△期望产物的总质量───────生成物的总质量高高催逆高温高压催化剂H 2OH 2OH 2OH 2O 高温══ 高温─→ 点燃─→ 光照─→单逆号 ←─前聚合号——[后聚合号——] n 双键号 C ——C 叁键号 C ———C 侧二甲苯─CH 3─CH 3三甲苯H 3C ──CH 3| CH 3 三硝基甲苯∣CH 3O 2N ──NO 2 |N O 2右斜甲苯CH 3╱CH 3╱ CH 3╱ CH 3╱ H 3C ╲H 3C ╲左斜甲苯H 3C ╲ 竖二甲苯 OH || CH羰基式 —O ‖C — 醛基式 —O ‖C —H 羟基式 —OH 羧基式 —O ‖C —OH三、电子式镁电子式 ·Mg · 铝电子式 ··Al · 碳电子式 ··C ·· 氮电子式· ··N ·· 氧电子式 · ··O ···氯右电子式 :··Cl ···氯左电子式··· Cl ·· :八电子结构 :··Cl ··: 氨电子式 H ··H :N ··:H :·· Cl ·· :·· Cl ··: H :··Cl ··:氢左电子式 ·H 氢右电子式 H ·C12 12C C60 12C C 60 碳六十式 C612 126C 碳十二式 沉淀淀↓ 气体体↑二氧化碳电子式 :··O ··::C ::··O ··: 氧化钠电子式 Na +[: ··O ··:]2-Na + 过化钠电子式Na +[: ·· O ·· : ··O ··:]2-Na +氮气电子式 :N ······N : :·· O ·· ::C ::·· O ·· :Na +[: ·· O ·· :]2-Na + Na +[: ·· O ·· : ·· O ·· :]2-Na + Na +[: ·· O ·· :H]-Na +[:·· Cl ··:]-H : ·· O ·· :H :··Cl ·· ::··Cl ··:C :··Cl ··::·· Cl ·· : H 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2OH 2O氧氢化钠电式 Na +[: ··O ··: H]-氯化钠电子式 Na +[:··Cl ··:]-水电H ∶‥O ‥∶ H H ∶‥O ‥∶ H四氯化碳电式:·· Cl ··::·· Cl ··:C :··Cl ··::··Cl ··: 左电子转移号 · + · 右电子转移号 ·+ · 氨电式 H ..H :N ..:H 铵根电式H ·· [H :N ·· :H ]+H [:·· Cl ·· :]- H | [H -N | -H ]+HF ╲F╱C -F·H H · Na · K · ·Mg ··Ca ···Al ···C ····Si ·· ‥·O ·‥···S ··· ··N ..· ··· Cl ··:··:Cl ···Na ·+ ··· Cl ··:─→ Na +[:··Cl ··:]-氯钠生式·· Br ·· ·· I ·· ··O ··Na ·+ ···Br ·· : ─→ Na +[:··Br ··:]-K · + ··· Cl ·· : ─→ K +[:·· Cl ·· :]- 氯钠生式 K · + ··· Br ·· : ─→ K +[:·· Br ·· :]- K · + ··· I ·· :─→ K +[:·· I ··:]- K · + ‥·O ·‥ +·K ─→ K +[:·· O ·· :]2-K +K · + · ·· S ·· · +·K ─→ K +[: ··S ·· :]2-K +H · +··· Cl ·· : ─→ H :··Cl ··:CH · +··· Br ·· : ─→ H :··Br ··:H · +··· I ·· : ─→ H :··I ··:H · +‥·O ·‥+·H ─→ H :··O ··: H:·· Cl ·· ·+·Mg ·+··· Cl ·· :─→ [:··Cl ·· :]-Mg 2+ [:··Cl ·· :]-[:··Cl ·· :]-Mg 2+ [:··Cl ··:]-:·· I ·· ·+·Mg ·+··· I ·· :─→ [:·· I ·· :]-Mg 2+ [:·· I ·· :]-:·· Br ·· ·+·Mg ·+··· Br ·· :─→ [:·· Br ·· :]-Mg 2+ [:·· Br ·· :]-:·· Cl ·· ·+·Ca ·+··· Cl ·· :─→ [:·· Cl ·· :]-Ca 2+ [:·· Cl ·· :]-:·· I ·· ·+·Ca ·+··· I ·· :─→ [:·· I ·· :]-Ca 2+ [:·· I ·· :]-:·· Br ·· ·+·Ca ·+··· Br ·· :─→ [:·· Br ·· :]-Ca 2+ [:·· Br ··:]-氯气电式 :·· Cl ·· :·· Cl ··: :·· Br ·· :·· Br ··:溴单电式 :·· Br ·· :··Br ··: 碘单电式 :·· I ·· :··I ··: 氮气电式 :N ······N : 氢气电式 H :H Cl 2氯化氢电式 H :··Cl ·· : H ..H :N ..:H H .. [H :N ..:H ]+H 甲烷电式 H ..H :C ..:H H H ..H :Si ..:H H H ·· H :N ··:H H ·· [H :N ·· :H ]+H电子转移式 2e—∣↓S + O 2 ═ SO 2 电子转移式2e—∣↓S + O 2 ═ SO 2一层结构○+1 )1 ) 二层结构○+1 )2 ))8 ) ○+1 )1 ) ○+1 )2 ))8 )—CH —∣NH 2CH 2-∣OH ∣CH 2-OH 上CH 2-∣OH∣CH 2-OH三、 有机域上结构 CH 3—CH —COOH ∣NH 2 —CH —∣NH 2下结构 CH 2-∣OH CH 2-∣OH CH 2-∣OH CH 2-∣OH上下构结 CH -∣OH ∣NH 2 CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2CH -∣OH ∣NH 2中结构 ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH ∣CH 2-OH署名结构 (C 6H 10O 5)n 纤维素(C 6H 10O 5)n 淀粉(C 6H 12O 6)n 葡萄糖(C 6H 12O 6)n 果糖(C 12H 22O 11)n 麦芽糖(C 12H 22O 11)n 蔗糖(C 6H 10O 5)n 纤维素分子式结构 HNO 3 C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯C 2H 5O —NO 2硝酸乙酯分子结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2三层结构 CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2反应示意图结构 H 2O⎩⎨⎧CO 2叶绿素A酶BO 2催化剂CO 2DBH +E Na 2O 2⎩⎪⎨⎪⎧→G 过量CO 2白色沉淀H→F S点燃IH 2SO 4△水解液NaOH 溶液中和液⎩⎪⎨⎪⎧银氨溶液微热生成银镜碘水无现象C 6H 5— HO —CH —NH —C ‖O—C 6H 5CH -COOH ∣+H 2O 无机酸C 6H 5— HO —CH —NH 2CH -COOH∣羟基酸羟基酯结构 CH 3CH ╱╲COO╲OOC╱CHCH 3 CH 3CH ╱╲COO ╲OOC ╱CHCH 3 CH 3CH ╱╲COO ╲OOC ╱CHCH 3双键结构 H 3C ╲H 3C ╱C =C ╱CH 3╲CH 3 H 3C ╲H 3C ╱C = C ╱╲ C ╱╲ CH 3CH 3 C ╱CH 3╲CH 3横上苯 - - 横下苯- - 竖右苯竖左苯对二甲苯 CH 3--CH 3 CH 3- -CH 3竖苯酚-OH 横苯酚-OH 竖苯酚 竖方程组结构 竖甲苯 竖苯酚 OH |竖苯甲酸 COOH|竖甲苯 CH 3|上甲基 CH | 下甲基 | CH 右斜甲苯CH 3╱CH 3╱ CH 3╱ CH 3╱╱H 3C H 3C ╲H 3C╲ 竖对二苯基 OH || CH横对二苯基 ——-CH 3-CH 3平二苯基H 3C ─CH 3-CH 3-CH 3侧二苯基-CH 3-CH 3 三苯基H 3C ──CH 3|CH三硝基甲苯 CH |O 2N ──NO 2|N O白藜芦醇 HO-CH =CH - ╱CH 3╲CH 3横右三甲苯CH -╱CH 3╲CH 3 横左三甲苯H 3C ╲╱H 3C-CH 3CHH 3C ╲╱H 3C竖三甲苯CHH 3C ──CH 3三溴苯酚 Br ──Br| Br双键号 —— 叁键号——合成结构四、方程组结构 ytxs 同醛基式 -O║C —H双尖前域⎩⎨⎧x +y ═x +y ═双尖后域⎭⎬⎫x +y ═x +y ═3、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═4、⎩⎪⎨⎪⎧x +y ═x +y ═x +y ═x +y ═x +y ═双平前域⎣⎢⎡x +y ═x +y ═双平后域⎦⎥⎤x +y ═x +y ═前聚合号——[ 后聚合号 ——] n 聚合号 ——[——] n左合右号――――――⎦⎥⎤――― 左分右号 ――――⎣⎢⎡-→-→ HO --CH =CH -╱CH 3╲CH 3白黎芦醇 HO --CH =CH -╱CH 3╲CH 3环氧乙烷O╱ ╲H 2C ――CH 2有机结构域应用 [—]—nCH —OH ∣CH 2—OH ∣CH 2—OH —C — ∣CH 3 ∣ CH 3中间结构 CH —OH ∣CH 2—OOCCH 3∣CH 2—OH 和CH —OOCCH 3∣CH 2—OH ∣CH 2—OH10 g2 0003g ·mol —1∶12 g 1002 g ·mol —1═①CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31 ②CH 2∣CH 2OOCC 17H 35∣CH 2OOCC 17H 35 ③CH —ONO 2∣CH 2—ONO 2∣CH 2—ONO 2—C ‖O —R 被 -P -O ‖O ∣OH 1230 ⎩⎪⎨⎪⎧加碘水溶液变蓝色加C 溶液单质沉淀 加A 溶液△ H -C -H |H ∣HH 2N —CH ∣R 1—C ‖O —N ∣H —CH ∣R 2—C ‖O —N ∣H —CH ∣R 3—C ‖O —N ∣H —CH ∣R 4—C ‖O —OH (C 6H 7O 2)—ONO 2ONO 2OHn(C 6H 7O 2)—ONO 2OHOHn (C 6H 7O 2)—ONO ONO 2ONOn,—C ‖O —N ∣H —⎩⎨⎧2x +3y +9z +5m ═555x +7y +11z +9m ═882×(x +y +z +2m )═28 x +y +z +m ═10 解得⎩⎨⎧x ═1y ═2z ═3m ═4R -CH —C ‖O —OH ∣NH 2+HNO 2R -CH —C ‖O —OH ∣OH +N 2↑+H 2CH 2—COOH ∣NH 2、CH 3—CH —COOH ∣NH 2、C. D.(C 6H 7O 2)—ONO 2ONO 2OH②CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31+HO -P -OH ‖O ∣OHCHOOCC 15H 31∣CH 2O -P -OH‖O ∣OH∣CH 2OOCC 15H 31+C 15H 31COOH ③CHOOCC 15H 31∣CH 2O -P -OH‖O∣OH∣CH 2OOCC 15H 31+2NaOH CHOOCC 15H 31∣CH 2O -P -ONa‖O ∣ONa∣CH 2OOCC 15H 31+2H 2O (说明:-P -O ‖O ∣OH H 也可代替CHOOCC 15H 31∣CH 2OOCC 15H 31∣CH 2OOCC 15H 31中间的—C ‖O —C 15H 31基团。
初中必背32个元素符号

初中必背32个元素符号在化学学习中,了解元素符号是非常重要的。
元素符号是化学元素的简化表示,由一个或两个字母组成。
初中阶段,掌握并记忆32个常见元素符号,对建立化学知识的基础非常关键。
下面,我们将逐一介绍这些符号,并提供简明的说明。
1. H(氢)氢是宇宙中最轻的元素,它的化学符号是H,来自拉丁文的“hydrogenium”。
氢气无色、无味,广泛应用于工业生产和火箭燃料。
2. He(氦)氦是地壳中的第二种元素,化学符号为He。
氦气是一种无色、无味、不可燃的气体,广泛用于气球和气体制冷。
3. Li(锂)锂的化学符号是Li,来自希腊文的“lithos”(石头)。
锂是一种金属元素,具有低密度、良好的导电性和热传导性能,常用于电池制造。
4. Be(铍)铍的化学符号为Be,来自希腊文的“beryllium”。
铍是一种轻质金属元素,具有高的熔点和导热性能,在核能领域有重要应用。
5. B(硼)硼的化学符号是B,来自阿拉伯文的“buraq”。
硼是一种非金属元素,常见于矿石中,广泛应用于玻璃、陶瓷和农业领域。
6. C(碳)碳的化学符号是C,来自拉丁文的“carbo”。
碳是生命的基础,广泛存在于地球上的有机化合物中,是地球上最丰富的元素之一。
7. N(氮)氮的化学符号是N,来自拉丁文的“nitrogenium”。
氮是大气中的主要成分,具有广泛的应用,例如制备化肥和氨基酸。
8. O(氧)氧的化学符号是O,来自希腊文的“oxygenium”。
氧是生命维持必需的元素,广泛用于呼吸、燃烧和氧化反应。
9. F(氟)氟的化学符号是F,来自拉丁文的“fluor”。
氟是一种非常活跃的元素,常用于制备氟化物,具有杀菌和防蛀的作用。
10. Ne(氖)氖的化学符号为Ne,来自希腊文的“neon”。
氖气是一种无色、无味的惰性气体,在霓虹灯制造和气体激光器中具有广泛应用。
11. Na(钠)钠的化学符号是Na,来自拉丁文的“natrium”。
钠是一种常见的金属元素,具有良好的导电性和化学反应性,在食盐中存在。
初中化学常用元素符号及化学式

初中化学常用元素符号及化学式化学是一门比较特殊的科学,而元素符号和化学式是我们打开化学这扇神秘大门的钥匙!掌握元素符号和化学式的知识是我们学好化学的基础。
下面给大家带来一些关于初中化学常用元素符号及化学式,希望对大家有所帮助。
一.元素符号前20号元素:氢H 、氦He、锂Li、铍Be、硼B、碳C、氮N、氧O、氟F、氖Ne、钠Na、镁 Mg、铝Al、硅Si、磷P、硫S、氯Cl、氩Ar、钾K、钙Ca、锌 Zn、铁Fe、铜 Cu、汞Hg、银Ag。
二.化学式单质:氢气H2、氮气N2、氧气O2、氯气Cl2、氦He、碳C 、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氩Ar、钾K、钙Ca、锌Zn、铁Fe、铜Cu、汞Hg、银Ag。
非金属氧化物:水H2O、二氧化碳CO2、一氧化碳CO、五氧化二磷P2O5、二氧化硫SO2、三氧化硫SO3、过氧化氢(双氧水)H2O2、二氧化氮NO2。
金属氧化物:氧化铁Fe2O3(赤铁矿,铁锈的主要成分)、四氧化三铁 Fe3O4(磁铁矿的主要成分)、氧化铝 Al2O3(铝土矿的主要成分)、氧化铜CuO、氧化钙CaO、二氧化锰MnO2、氧化镁MgO。
酸:盐酸HCl(胃酸的主要成分)、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、乙酸CH3COOH(俗称醋酸)。
碱:氢氧化钠NaOH(俗称火碱、烧碱、苛性钠,易溶于水)、氢氧化钡Ba(OH)2(易溶于水)、氢氧化钙 Ca(OH)2(俗称熟石灰、消石灰。
微溶于水,水溶液俗称澄清石灰水)、氢氧化镁Mg(OH)2(不溶于水,白色沉淀)、氢氧化铁 Fe(OH)3(不溶于水,红褐色沉淀)、氢氧化铜 Cu(OH)2(不溶于水,蓝色沉淀)、一水合氨NH3?H2O(水溶液俗称氨水)。
盐:氯化钠NaCl(食盐的主要成分,易溶于水)、氯化钾KCl(易溶于水)、氯化钡BaCl2(易溶于水)、氯化钙CaCl2(易溶于水)、氯化亚铁FeCl2(易溶于水,形成浅绿色溶液)、氯化铁FeCl3(易溶于水,形成黄色溶液)、氯化银AgCl(不溶于水,不溶于酸,白色沉淀)、硫酸钠Na2SO4(易溶于水)、硫酸钙CaSO4(微溶于水)、硫酸钡BaSO4(不溶于水,白色沉淀)、硫酸锌ZnSO4(易溶于水)、硫酸亚铁FeSO4(易溶于水,形成浅绿色溶液)、硫酸铁Fe2(SO4)3(易溶于水,形成黄色溶液)、硫酸铜CuSO4(易溶于水,形成蓝色溶液)、碳酸钠Na2CO3(俗称纯碱、苏打,易溶于水)、碳酸钙CaCO3(大理石、石灰石的主要成分,不溶于水,白色固体)、碳酸钡BaCO3(不溶于水,白色沉淀)、硝酸钠NaNO3(易溶于水)、硝酸钾KNO3(易溶于水)、硝酸铵NH4NO3(易溶于水)、硝酸钡Ba(NO3)2(易溶于水)、硝酸银AgNO3(易溶于水)、碳酸氢钠NaHCO3(俗称小苏打,易溶于水)、高锰酸钾 KMnO4(暗紫色晶体)、锰酸钾K2MnO4、氯酸钾KClO3(白色粉末状固体)、亚硝酸钠NaNO2(工业用盐,有毒,易溶于水)。
化学符号含义汇总

化学符号含义汇总化学符号是一种用于代表化学元素的标记系统。
每个化学元素都有一个独特的符号,可以用来表示元素的名称和特定的性质。
这些符号的设计是基于元素的拉丁名称的首字母(有时也是拉丁名称的前两个字母)。
下面是一些常用的化学符号及其含义的汇总:1.H-氢。
氢是宇宙中最常见的元素之一,它以H的符号表示。
2.He-氦。
氦是第二个周期中的一种稀有气体,具有惰性和透明的性质。
3.Li-锂。
锂是一种轻金属元素,具有较低的密度和高的电导率。
4.Be-铍。
铍是一种碱土金属元素,具有高熔点和高的硬度。
5.B-硼。
硼是一种非金属元素,具有低密度和高熔点。
6.C-碳。
碳是生命的基本元素之一,它的存在形式包括石墨、金刚石和纳米管等。
7.N-氮。
氮是大气中最主要的成分之一,也是许多有机物和生命体所需的元素。
8.O-氧。
氧是生命的必需气体,也是许多无机和有机化合物的组成部分。
9.F-氟。
氟是最活跃的非金属元素之一,常以气体或氟化物的形式存在。
10.Ne-氖。
氖是一种稀有气体,具有高度惰性。
11.Na-钠。
钠是一种常见的金属元素,它的化合物广泛应用于工业和生活中。
12.Mg-镁。
镁是一种轻金属元素,具有较低的密度和良好的热导性。
13.Al-铝。
铝是一种常见的金属元素,具有较低的密度和良好的延展性。
14.Si-硅。
硅是地壳中第二丰富的元素,它广泛应用于电子和半导体工业。
15.P-磷。
磷是一种非金属元素,存在于DNA、RNA和ATP等生物大分子中。
16.S-硫。
硫是一种常见的非金属元素,广泛应用于制药和化工工业。
17.Cl-氯。
氯是最常见的卤素元素之一,广泛用作消毒剂和消毒剂。
18.Ar-氩。
氩是大气中第三丰富的元素,广泛用作气体填料和防护氛围中。
19.K-钾。
钾是一种碱金属元素,常以离子形式存在于生物体内。
20.Ca-钙。
钙是骨骼和牙齿中重要的金属元素,也在神经传导中起重要作用。
这里列举了一些常见的化学元素的符号和含义。
还有许多其他的化学元素和它们的符号,每个符号都对应着独特的元素特性和化学行为。
常用化学符号及化学式

常用化学符号:1 1H 氢2 5B 硼6C 碳7N 氮8O 氧9F 氟10Ne 氖3 11Na 钠12Mg 镁13Al 铝14Si 硅15P 磷16S 硫17Cl 氯18Ar 氩4 19K 钾20Ca 钙...氧气O 2氢气H2水H2O氧化汞HgO氯酸钾KClO3二氧化锰(MnO2高锰酸钾KMnO4锰酸钾:K2MnO4一氧化碳CO二氧化碳c盐酸(HCL硫酸(H2SO4五氧化二磷P2O5四氧化三铁Fe3O4SO2(二氧化硫)、氧化钠(NaO2铁Fe铜的化学符号是Cu铝Al钙化学符号是Ca氯化钡BaCl2氯化钠NaCl氯化银AgCl氯化亚铁FeCl2氯化钙CaCl2氯化钾KClHCl 氯化氢氢氧化钠NaOH氢氧化钙Ca(OH)2氢氧化铜Cu(OH)2硫酸铜CuSO4硫酸钠Na2SO4硫酸钡BaSO4硫酸亚铁FeSO4碳酸钠Na2CO3碳酸钙CaCO3碳酸铝Al2(CO3)3碳酸钾K2CO3硝酸铵NH4NO3硝酸银AgNO3硝酸铜Cu(NO3)2常用方程式:一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O (3)氧气的来源:13.玻义耳研究空气的成分实验2HgO 加热Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水:H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃CO224.木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃CO227.煤炉的中层:CO2 + C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水:H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO235.一氧化碳的可燃性:2CO + O2 点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + O2 点燃2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O442. 铜在空气中受热:2Cu + O2 加热2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质+ 酸-------- 盐+ 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg (3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸+ 金属-------- 盐+ 氢气(见上)(2)酸+ 金属氧化物-------- 盐+ 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O (2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ (3)盐+ 碱-------- 另一种碱+ 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (4)盐+ 盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3 78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl。
化学中常用符号
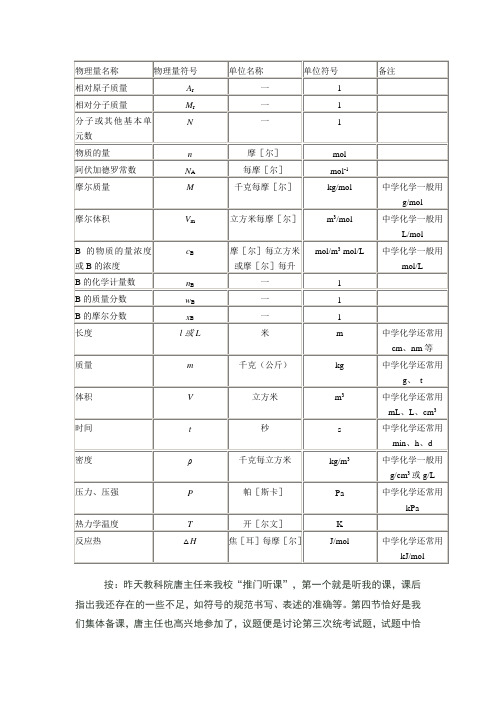
物理量名称物理量符号单位名称单位符号备注相对原子质量A r一1相对分子质量M r一1分子或其他基本单元数N一1物质的量n摩[尔]mol阿伏加德罗常数N A每摩[尔]mol-1摩尔质量M千克每摩[尔]kg/mol中学化学一般用g/mol摩尔体积V m立方米每摩[尔]m3/mol中学化学一般用L/molB的物质的量浓度或B的浓度c B摩[尔]每立方米或摩[尔]每升mol/m3 mol/L中学化学一般用mol/LB的化学计量数n B一1B的质量分数w B一1B的摩尔分数x B一1长度l或L米m中学化学还常用cm、nm等质量m千克(公斤)kg中学化学还常用g、t体积V立方米m3中学化学还常用mL、L、cm3时间t秒s中学化学还常用min、h、d密度ρ千克每立方米kg/m3中学化学一般用g/cm3或g/L 压力、压强P帕[斯卡]Pa中学化学还常用kPa热力学温度T开[尔文]K反应热△H焦[耳]每摩[尔]J/mol中学化学还常用kJ/mol 按:昨天教科院唐主任来我校“推门听课”,第一个就是听我的课,课后指出我还存在的一些不足,如符号的规范书写、表述的准确等。
第四节恰好是我们集体备课,唐主任也高兴地参加了,议题便是讨论第三次统考试题,试题中恰好有一个化学用语规范表述的试题,我笑着说,“此题不是考学生,更是考我们老师!”因为我们很多老师平时都没有注意这个问题,从对学生终生负责的角度出发,我认为这还真不是一个小问题,因为他们今后将会从事科研或教学工作,意义深远。
说者无心,听者有意。
事后唐主任用邮件的形式给我发来此文,一则教育本人,二来以正视听。
一、物理量符号1、一般物理量的符号只有一个字母构成,但也有由几个字母构成的。
不管由几个字母构成,不论大写还是小写,一律用斜体字母表示。
只有pH例外,用正体。
物理量质量密度摩尔质量体积质量数质子数溶液酸度正确写法mρM V A Z pH 错误写法m ρM V A Z pH 2、物理量符号的下标。
初中化学常用元素符号及化学式

初中化学常用元素符号及化学式化学是一门比较特殊的科学,而元素符号和化学式是我们打开化学这扇神秘大门的钥匙!掌握元素符号和化学式的知识是我们学好化学的基础。
下面给大家带来一些关于初中化学常用元素符号及化学式,希望对大家有所帮助。
一.元素符号前20号元素:氢H 、氦He、锂Li、铍Be、硼B、碳C、氮N、氧O、氟F、氖Ne、钠Na、镁 Mg、铝Al、硅Si、磷P、硫S、氯Cl、氩Ar、钾K、钙Ca、锌 Zn、铁Fe、铜 Cu、汞Hg、银Ag。
二.化学式单质:氢气H2、氮气N2、氧气O2、氯气Cl2、氦He、碳C 、钠Na、镁Mg、铝Al、硅Si、磷P、硫S、氩Ar、钾K、钙Ca、锌Zn、铁Fe、铜Cu、汞Hg、银Ag。
非金属氧化物:水H2O、二氧化碳CO2、一氧化碳CO、五氧化二磷P2O5、二氧化硫SO2、三氧化硫SO3、过氧化氢(双氧水)H2O2、二氧化氮NO2。
金属氧化物:氧化铁Fe2O3(赤铁矿,铁锈的主要成分)、四氧化三铁 Fe3O4(磁铁矿的主要成分)、氧化铝 Al2O3(铝土矿的主要成分)、氧化铜CuO、氧化钙CaO、二氧化锰MnO2、氧化镁MgO。
酸:盐酸HCl(胃酸的主要成分)、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、乙酸CH3COOH(俗称醋酸)。
碱:氢氧化钠NaOH(俗称火碱、烧碱、苛性钠,易溶于水)、氢氧化钡Ba(OH)2(易溶于水)、氢氧化钙 Ca(OH)2(俗称熟石灰、消石灰。
微溶于水,水溶液俗称澄清石灰水)、氢氧化镁Mg(OH)2(不溶于水,白色沉淀)、氢氧化铁 Fe(OH)3(不溶于水,红褐色沉淀)、氢氧化铜 Cu(OH)2(不溶于水,蓝色沉淀)、一水合氨NH3?H2O(水溶液俗称氨水)。
盐:氯化钠NaCl(食盐的主要成分,易溶于水)、氯化钾KCl(易溶于水)、氯化钡BaCl2(易溶于水)、氯化钙CaCl2(易溶于水)、氯化亚铁FeCl2(易溶于水,形成浅绿色溶液)、氯化铁FeCl3(易溶于水,形成黄色溶液)、氯化银AgCl(不溶于水,不溶于酸,白色沉淀)、硫酸钠Na2SO4(易溶于水)、硫酸钙CaSO4(微溶于水)、硫酸钡BaSO4(不溶于水,白色沉淀)、硫酸锌ZnSO4(易溶于水)、硫酸亚铁FeSO4(易溶于水,形成浅绿色溶液)、硫酸铁Fe2(SO4)3(易溶于水,形成黄色溶液)、硫酸铜CuSO4(易溶于水,形成蓝色溶液)、碳酸钠Na2CO3(俗称纯碱、苏打,易溶于水)、碳酸钙CaCO3(大理石、石灰石的主要成分,不溶于水,白色固体)、碳酸钡BaCO3(不溶于水,白色沉淀)、硝酸钠NaNO3(易溶于水)、硝酸钾KNO3(易溶于水)、硝酸铵NH4NO3(易溶于水)、硝酸钡Ba(NO3)2(易溶于水)、硝酸银AgNO3(易溶于水)、碳酸氢钠NaHCO3(俗称小苏打,易溶于水)、高锰酸钾 KMnO4(暗紫色晶体)、锰酸钾K2MnO4、氯酸钾KClO3(白色粉末状固体)、亚硝酸钠NaNO2(工业用盐,有毒,易溶于水)。
化学符号大全

化学符号大全化学符号是化学元素的标识,它们是化学式和方程式的基础,也是化学理论和实验的基础。
化学符号的使用使得化学家们能够更加简洁和准确地表达化学概念和化学实验结果。
下面我们将介绍一些常见的化学符号,希望能够帮助大家更好地理解化学元素和化学反应。
1. 氢(Hydrogen)。
符号,H。
原子序数,1。
氢是最简单的元素,也是宇宙中含量最丰富的元素之一。
在化学反应中,氢气通常以H2的形式出现。
2. 氦(Helium)。
符号,He。
原子序数,2。
氦是一种稀有气体,常用于充气球和气球中。
它是地球上唯一一种不会在常温下凝固成固体的元素。
3. 钠(Sodium)。
符号,Na。
原子序数,11。
钠是一种常见的金属元素,它在自然界中以氯化钠的形式存在,即食盐。
钠在化学反应中通常以Na+的形式出现。
4. 氧(Oxygen)。
符号,O。
原子序数,8。
氧气是生物呼吸的必需气体,也是许多燃烧反应的必需气体。
在化学式中,氧通常以O2的形式出现。
5. 氮(Nitrogen)。
符号,N。
原子序数,7。
氮气是大气中的主要成分之一,也是许多化合物的组成部分。
在化学式中,氮通常以N2的形式出现。
6. 碳(Carbon)。
符号,C。
原子序数,6。
碳是生命的基础元素,它是有机化合物的主要组成部分。
在化学式中,碳通常以C的形式出现。
7. 铁(Iron)。
符号,Fe。
原子序数,26。
铁是一种常见的金属元素,它在地壳中含量丰富。
在化学反应中,铁通常以Fe2+或Fe3+的形式出现。
8. 铜(Copper)。
符号,Cu。
原子序数,29。
铜是一种重要的工业金属,它具有良好的导电性和导热性。
在化学反应中,铜通常以Cu+或Cu2+的形式出现。
9. 锌(Zinc)。
符号,Zn。
原子序数,30。
锌是一种重要的合金元素,它常用于镀锌和合金制备。
在化学反应中,锌通常以Zn2+的形式出现。
10. 氟(Fluorine)。
符号,F。
原子序数,9。
氟是一种非常活泼的卤素元素,它在自然界中以氟化物的形式存在。
化学符号含义汇总

化学符号含义汇总化学符号是化学中用于表示化学元素和化合物的简洁标识。
它们有助于化学家们理解化学方程式、式子和反应过程。
下面是一些常用的化学符号及其含义的汇总。
1.化学元素符号:化学元素符号是在元素周期表中每个元素的化学符号。
它由一个或两个字母组成,如H表示氢、C表示碳、Na表示钠等。
这些符号用于表示元素的属性和性质。
2.反应条件符号:-(s)表示固态,例如CaCO3(s)表示固态的碳酸钙。
-(l)表示液态,例如H2O(l)表示液态的水。
-(g)表示气态,例如CO2(g)表示气态的二氧化碳。
- (aq) 表示溶于水中的化合物,例如NaCl(aq)表示溶于水中的氯化钠。
3.物质状态符号:- ↓ 表示沉淀形成,例如AgNO3(aq) + NaCl(aq) → AgCl↓ + NaNO3(aq),其中AgCl↓表示白色沉淀物。
- ↑ 表示气体释放,例如2H2O2(aq) → 2H2O(l) + O2(g),其中O2↑表示氧气气体的释放。
-→或箭头表示反应方向,例如2H2(g)+O2(g)→2H2O(l),表示氢气和氧气生成水。
-⇌或双箭头表示平衡反应,例如N2(g)+3H2(g)⇌2NH3(g),表示氮气和氢气生成氨气的可逆反应。
4.离子符号:-+表示阳离子,例如Na+表示钠离子。
--表示阴离子,例如Cl-表示氯离子。
-2+表示双正离子,例如Cu2+表示铜离子的二价形式。
5.反应速率符号:-Δ表示温度,例如ΔH表示反应的热变化。
-→表示反应速率,例如A→B表示物质A转变为物质B的反应速率。
6.能量符号:-E表示能量,例如ΔE表示能量的变化。
-h表示普朗克常数,用于计算能量单位。
-γ表示光子,用于描述光的行为和相互作用过程。
7.离子化程度符号:- aq 表示水溶液中的离子,例如NaCl(aq)表示溶于水中的氯化钠。
8.其他符号:-℃表示温度,例如25℃表示摄氏温度25度。
- atm 表示压强,例如1 atm表示标准大气压。
常用化学元素符号表

常用分子式氮气:N2氢气:H2甲烷:CH4氧气:O2氨:NH3水:H2O 一氧化碳:CO 二氧化碳:CO2硫:S 二氧化硫:SO2硫代硫酸钠:Na2S2O3铁:Fe 二价铁离子:Fe2+三价铁离子:Fe3+硫酸钠:Na2SO4磷酸三钠:Na3PO4碳酸钠:Na2CO3碳酸钙:CaCO3碳酸氢钠:NaHCO3氢氧化钠:NaOH盐酸:HCL 碳酸氢铵:NH4HCO3硝酸:HNO3硫酸:H2SO4尿素:CO(NH2) 碳酸:H2CO3化学需氧量:COD 高锰酸钾:KMnO4锰酸钾:K2MnO4缩二尿:NH2CONHCONH2硝酸银:AgNO3硫酸铜:CuSO4碳酸丙稀脂(碳丙液):C3H6CO3甲醇:CH3OH 乙醇:CH3CH2OH 甲醛:HCHO 一甲氨:NH2CH3二甲氨:NH(CH3)2 三甲氨:N(CH3)3三氧化二铝:AL2O3三氧化二铁:Fe2O3 氧化铜:CuO 氯化钠:NaCL .一、初中化学常见混合物的重要成分1、空气:氮气(N2)和氧气(O2)2、水煤气:一氧化碳(CO)和氢气(H2)3、煤气:一氧化碳(CO)4、天然气:甲烷(CH4)5、石灰石/大理石:(CaCO3)6、生铁/钢:(Fe)7、木炭/焦炭/炭黑/活性炭:(C)8、铁锈:(Fe2O3)二、初中化学常见物质俗称1、氯化钠(NaCl):食盐2、碳酸钠(Na2CO3) :纯碱,苏打,口碱3、氢氧化钠(NaOH):火碱,烧碱,苛性钠4、氧化钙(CaO):生石灰5、氢氧化钙(Ca(OH)2):熟石灰,消石灰6、二氧化碳固体(CO2):干冰7、氢氯酸(HCl):盐酸8、碱式碳酸铜(Cu2(OH)2CO3):铜绿9、硫酸铜晶体(CuSO4 .5H2O):蓝矾,胆矾10、甲烷(CH4):沼气11、乙醇(C2H5OH):酒精12、乙酸(CH3COOH):醋酸13、过氧化氢(H2O2):双氧水14、汞(Hg):水银15、碳酸氢钠(NaHCO3):小苏打三、物质的除杂1、CO2(CO):把气体通过灼热的氧化铜,2、CO(CO2):通过足量的氢氧化钠溶液3、H2(水蒸气):通过浓硫酸/通过氢氧化钠固体4、CuO(C):在空气中(在氧气流中)灼烧混合物5、Cu(Fe) :加入足量的稀硫酸6、Cu(CuO):加入足量的稀硫酸7、FeSO4(CuSO4): 加入足量的铁粉8、NaCl(Na2CO3):加入足量的盐酸9、NaCl(Na2SO4):加入足量的氯化钡溶液10、NaCl(NaOH):加入足量的盐酸11、NaOH(Na2CO3):加入足量的氢氧化钙溶液12、NaCl(CuSO4):加入足量的氢氧化钡溶液13、NaNO3(NaCl):加入足量的硝酸银溶液.14、NaCl(KNO3):蒸发溶剂15、KNO3(NaCl):冷却热饱和溶液。
高中常见化学符号大全
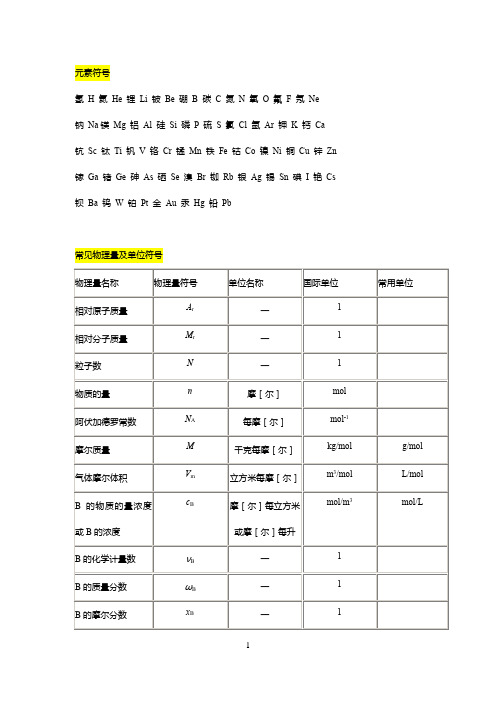
元素符号
氢H 氦He 锂Li 铍Be 硼B 碳C 氮N 氧O 氟F 氖Ne
钠Na镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 钾K 钙Ca 钪Sc 钛Ti 钒V 铬Cr 锰Mn 铁Fe 钴Co 镍Ni 铜Cu 锌Zn 镓Ga 锗Ge 砷As 硒Se 溴Br 铷Rb 银Ag 锡Sn 碘I 铯Cs 钡Ba 钨W 铂Pt 金Au 汞Hg 铅Pb
常见物理量及单位符号
常见反应条件
点燃、△、高温、电解、催化剂、一定条件、放电、光、浓H2SO4、稀H2SO4…
常见物质名称及化学式
稀有气体:He、Ne、Ar等
单质金属:Mg、Al、Zn、Fe、Cu、Hg
非金属:气体:H2、O2、N2、Cl2
液体:Br2
固体:C、S、P、(碘:I2)
盐:
常见有机物化学式
甲烷:CH4乙烷:C2H6丙烷:C3H8 n烷:C n H2n+2苯:C6H6乙烯:C2H4乙炔:C2H2丙烯:C3H6甲醇:CH3OH 乙醇:C2H5OH 丙醇:C3H7OH
丙三醇(甘油):C3H8O3苯酚:C6H5OH 甲酸:HCOOH
乙酸:CH3COOH 乙酸乙酯:CH3COOC2H5 苯甲酸:C6H5COOH
甲醛:HCHO 乙醛:CH3CHO 一氯甲烷:CH3Cl 二氯甲烷:CH2Cl2
三氯甲烷(氯仿):CHCl4 四氯化碳:CCl4
葡萄糖(果糖):C6H12O6蔗糖:C12H22O11纤维素(淀粉):(C6H10O5)n
常见的离子:
能级符号s、p、d、f
常见杂化:sp、sp2、sp3、sp3d、sp3d2原子结构示意图。
化学符号大全

化学符号大全化学符号是一种描述化学元素、化合物和反应的图形语言。
其通过简练的图形表示符号来传达化学信息。
化学符号的使用已经成为当今化学研究不可缺少的一部分。
本文将介绍常见元素、化合物和反应的化学符号。
1. 常见元素符号元素是组成化合物的基本单位。
下面是常见元素的符号及其含义:H - 氢(Hydrogen),原子序数为1,可用于通风等。
He - 氦(Helium),原子序数为2,可用于泄露检测、照明等。
Li - 锂(Lithium),原子序数为3,常用于锂电池等。
Be - 铍(Beryllium),原子序数为4,常用于核反应堆中。
B - 硼(Boron),原子序数为5,常用于半导体材料制造等。
C - 碳(Carbon),原子序数为6,是人类生命体的重要组成元素。
N - 氮(Nitrogen),原子序数为7,常用于制造氨气等。
O - 氧(Oxygen),原子序数为8,是人类生命体的重要组成元素。
F - 氟(Fluorine),原子序数为9,常用于电视管、炭氟材料等。
Ne - 氖(Neon),原子序数为10,常用于电子学、激光器等。
Na - 钠(Sodium),原子序数为11,常用于制造含钠离子溶液等。
Mg - 镁(Magnesium),原子序数为12,常用于合金、电池等。
Al - 铝(Aluminum),原子序数为13,常用于包装、建筑等。
Si - 硅(Silicon),原子序数为14,常用于半导体、集成电路制造等。
P - 磷(Phosphorus),原子序数为15,常用于化肥、防火器材等。
S - 硫(Sulfur),原子序数为16,常用于制造硫酸等。
Cl - 氯(Chlorine),原子序数为17,常用于消毒、制造氯仿等。
K - 钾(Potassium),原子序数为19,常用于制造肥料等。
Ca - 钙(Calcium),原子序数为20,是人类骨骼的主要组成元素。
Fe - 铁(Iron),原子序数为26,是人类血液和生物大分子中必需的组成元素。
化学符号及常用缩写

1 Hydrog en 氢 H ['haidri dʒən]2 Helium氦He ['hi:liəm]3 Lithiu m 锂Li['liζiəm]4 Beryll ium 铍Be [be'riliəm]5 Boron硼B ['bɔ:rɔn]6 Carbon碳C ['kɑrbən]7 Nitrog en 氮 N ['naitrədʒən]8 Oxygen氧O ['ɔksidʒən]9 Fluori ne 氟F ['fluəri:n]10 Neon 氖Ne ['ni:ɔn]11 Sodium钠Na ['səudiəm]12 Magnes ium 镁Mg [mæg'ni:ziəm]13 Alumin ium 铝Al [ælju'miniəm]14 Silico n 硅 Si ['silikən]15 Phosph orus磷P ['fɔsfərəs]16 Sulfur硫S ['sʌlfə]17 Chlori ne 氯Cl ['kləuri:n]18 Argon氩Ar ['ɑ:gɔn]19 Potass ium 钾K [pə'tæsiəm]20 Calciu m 钙 Ca ['kælsiəm]第01 号元素: 氢[化学符号]H, 读“轻”,[英文名称]Hydrog en 第02 号元素: 氦[化学符号]He, 读“亥”,[英文名称]Helium第03 号元素: 锂[化学符号]Li, 读“里”,[英文名称]Lithiu m第04 号元素: 铍[化学符号]Be, 读“皮”,[英文名称]Beryll ium 第05 号元素: 硼[化学符号]B, 读“朋”,[英文名称]Boron第06 号元素: 碳[化学符号]C, 读“炭”,[英文名称]Carbon第07 号元素: 氮[化学符号]N, 读“淡”,[英文名称]Nitrog en 第08 号元素: 氧[化学符号]O, 读“养”,[英文名称]Oxygen第09 号元素: 氟[化学符号]F, 读“弗”,[英文名称]Fluori ne第10 号元素: 氖[化学符号]Ne, 读“乃”,[英文名称]Neon第11 号元素: 钠[化学符号]Na, 读“纳”,[英文名称]Sodium第12 号元素: 镁[化学符号]Mg, 读“美”,[英文名称]Magnes ium 第13 号元素: 铝[化学符号]Al, 读“吕”,[英文名称]Alumin um第14 号元素: 硅[化学符号]Si, 读“归”,[英文名称]Silico n第15 号元素: 磷[化学符号]P, 读“邻”,[英文名称]Phosph orus第16 号元素: 硫[化学符号]S, 读“流”,[英文名称]Sulfur第17 号元素: 氯[化学符号]Cl, 读“绿”,[英文名称]Chlori ne第18 号元素: 氩[化学符号]Ar,A, 读“亚”,[英文名称]Argon第19 号元素: 钾[化学符号]K, 读“甲”,[英文名称]Potass ium第20 号元素: 钙[化学符号]Ca, 读“丐”,[英文名称]Calciu m第21 号元素: 钪[化学符号]Sc, 读“亢”,[英文名称]Scandi um 第22 号元素: 钛[化学符号]Ti, 读“太”,[英文名称]Titani um第23 号元素: 钒[化学符号]V, 读“凡”,[英文名称]Vanadi um第24 号元素: 铬[化学符号]Cr, 读“各”,[英文名称]Chromi um 第25 号元素: 锰[化学符号]Mn, 读“猛”,[英文名称]Mangan ese 第26 号元素: 铁[化学符号]Fe, 读“铁”,[英文名称]Iron第27 号元素: 钴[化学符号]Co, 读“古”,[英文名称]Cobalt第28 号元素: 镍[化学符号]Ni, 读“臬”,[英文名称]Nickel第29 号元素: 铜[化学符号]Cu, 读“同”,[英文名称]Copper第30 号元素: 锌[化学符号]Zn, 读“辛”,[英文名称]Zinc第31 号元素: 镓[化学符号]Ga, 读“家”,[英文名称]Galliu m第32 号元素: 锗[化学符号]Ge, 读“者”,[英文名称]German ium第33 号元素: 砷[化学符号]As, 读“申”,[英文名称]Arseni c第34 号元素: 硒[化学符号]Se, 读“西”,[英文名称]Seleni um第35 号元素: 溴[化学符号]Br, 读“秀”,[英文名称]Bromin e第36 号元素: 氪[化学符号]Kr, 读“克”,[英文名称]Krypto n第37 号元素: 铷[化学符号]Rb, 读“如”,[英文名称]Rubidi um第38 号元素: 锶[化学符号]Sr, 读“思”,[英文名称]Stront ium第39 号元素: 钇[化学符号]Y, 读“乙”,[英文名称]Yttriu m第40 号元素: 锆[化学符号]Zr, 读“告”,[英文名称]Zircon ium第41 号元素: 铌[化学符号]Nb, 读“尼”,[英文名称]Niobiu m第42 号元素: 钼[化学符号]Mo, 读“目”,[英文名称]Molybd enum第43 号元素: 碍[化学符号]Tc, 读“得”,[英文名称]Techne tium第44 号元素: 钌[化学符号]Ru, 读“了”,[英文名称]Ruthen ium 第45 号元素: 铑[化学符号]Rh, 读“老”,[英文名称]Rhodiu m第46 号元素: 钯[化学符号]Pd, 读“巴”,[英文名称]Pallad ium第47 号元素: 银[化学符号]Ag, 读“银”,[英文名称]Silver第48 号元素: 镉[化学符号]Cd, 读“隔”,[英文名称]Cadmiu m第49 号元素: 铟[化学符号]In, 读“因”,[英文名称]Indium第50 号元素: 锡[化学符号]Sn, 读“西”,[英文名称]Tin第51 号元素: 锑[化学符号]Sb, 读“梯”,[英文名称]Antimo ny第52 号元素: 碲[化学符号]Te, 读“帝”,[英文名称]Tellur ium第53 号元素: 碘[化学符号]I, 读“典”,[英文名称]Iodine第54 号元素: 氙[化学符号]Xe, 读“仙”,[英文名称]Xenon第55 号元素: 铯[化学符号]Cs, 读“色”,[英文名称]Cesium第56 号元素: 钡[化学符号]Ba, 读“贝”,[英文名称]Barium第57 号元素: 镧[化学符号]La, 读“蓝”,[英文名称]Lantha num第58 号元素: 铈[化学符号]Ce, 读“市”,[英文名称]Cerium第59 号元素: 镨[化学符号]Pr, 读“普”,[英文名称]Praseo dymiu m第60 号元素: 钕[化学符号]Nd, 读“女”,[英文名称]Neodym ium第61 号元素: 钷[化学符号]Pm, 读“颇”,[英文名称]Promet hium第62 号元素: 钐[化学符号]Sm, 读“衫”,[英文名称]Samari um第63 号元素: 铕[化学符号]Eu, 读“有”,[英文名称]Europi um第64 号元素: 钆[化学符号]Gd, 读“嘎(二声)”,[英文名称]Gadoli nium第65 号元素: 铽[化学符号]Tb, 读“特”,[英文名称]Terbiu m第66 号元素: 镝[化学符号]Dy, 读“滴”,[英文名称]Dyspro sium第67 号元素: 钬[化学符号]Ho, 读“火”,[英文名称]Holmiu m第68 号元素: 铒[化学符号]Er, 读“耳”,[英文名称]Erbium第69 号元素: 铥[化学符号]Tm, 读“丢”,[英文名称]Thuliu m第70 号元素: 镱[化学符号]Yb, 读“意”,[英文名称]Ytterb ium第71 号元素: 镥[化学符号]Lu, 读“鲁”,[英文名称]Luteti um第72 号元素: 铪[化学符号]Hf, 读“哈”,[英文名称]Hafniu m第73 号元素: 钽[化学符号]Ta, 读“坦”,[英文名称]Tantal um第74 号元素: 钨[化学符号]W, 读“乌”,[英文名称]Tungst en第75 号元素: 铼[化学符号]Re, 读“来”,[英文名称]Rheniu m第76 号元素: 锇[化学符号]Os, 读“鹅”,[英文名称]Osmium第77 号元素: 铱[化学符号]Ir, 读“衣”,[英文名称]Iridiu m第78 号元素: 铂[化学符号]Pt, 读“博”,[英文名称]Platin um第79 号元素: 金[化学符号]Au, 读“今”,[英文名称]Gold第80 号元素: 汞[化学符号]Hg, 读“拱”,[英文名称]Mercur y第81 号元素: 铊[化学符号]Tl, 读“他”,[英文名称]Thalli um第82 号元素: 铅[化学符号]Pb, 读“千”,[英文名称]Lead第83 号元素: 铋[化学符号]Bi, 读“必”,[英文名称]Bismut h第84 号元素: 钋[化学符号]Po, 读“泼”,[英文名称]Poloni um第85 号元素: 砹[化学符号]At, 读“艾”,[英文名称]Astati ne第86 号元素: 氡[化学符号]Rn, 读“冬”,[英文名称]Radon第87 号元素: 钫[化学符号]Fr, 读“方”,[英文名称]Franci um第88 号元素: 镭[化学符号]Ra, 读“雷”,[英文名称]Radium第89 号元素: 锕[化学符号]Ac, 读“阿”,[英文名称]Actini um第90 号元素: 钍[化学符号]Th, 读“土”,[英文名称]Thoriu m第91 号元素: 镤[化学符号]Pa, 读“葡”,[英文名称]Protac tiniu m 第92 号元素: 铀[化学符号]U, 读“由”,[英文名称]Uraniu m第93 号元素: 镎[化学符号]Np, 读“拿”,[英文名称]Neptun ium 第94 号元素: 钚[化学符号]Pu, 读“布”,[英文名称]Pluton ium第95 号元素: 镅[化学符号]Am, 读“眉”,[英文名称]Americ ium第96 号元素: 锔[化学符号]Cm, 读“局”,[英文名称]Curium第97 号元素: 锫[化学符号]Bk, 读“陪”,[英文名称]Berkel ium第98 号元素: 锎[化学符号]Cf, 读“开”,[英文名称]Califo rnium第99 号元素: 锿[化学符号]Es, 读“哀”,[英文名称]Einste inium第100 号元素: 镄[化学符号]Fm, 读“费”,[英文名称]Fermiu m第101 号元素: 钔[化学符号]Md, 读“门”,[英文名称]Mendel evium第102 号元素: 锘[化学符号]No, 读“诺”,[英文名称]Nobeli um第103 号元素: 铹[化学符号]Lw, 读“劳”,[英文名称]Lawren cium第104 号元素: 钅卢[化学符号]Rf, 读“卢”,[英文名称]Ruther fordi um 第105 号元素: 钅杜[化学符号]Db, 读“杜”,[英文名称]Dubniu m第106 号元素: 钅喜[化学符号]Sg , 读“喜”,[英文名称]Seabor gium第107 号元素: 钅波[化学符号]Bh, 读“波”,[英文名称]Bohriu m第108 号元素: 钅黑[化学符号]Hs, 读“黑”,[英文名称]Hassiu m第109 号元素: 钅麦[化学符号]Mt, 读“麦”,[英文名称]Meitne rium第110 号元素: 钅达[化学符号]Ds, 读“达”,[英文名称]Darmst adtiu m 第111 号元素: 钅仑[化学符号]Rg, , 读“伦”,[英文名称]Roentg enium 第112 号元素: Uub Ununbi um第113 号元素: Uut Ununtr ium第114 号元素: Uuq Ununqu adium第115 号元素: Uup Ununqu adium第116 号元素: Uuh Ununhe xium第117 号元素: Uus Ununse ptium (Not synthe sized to Jan.2009) 第118 号元素: Uuo Ununoc tium-acetal缩醇acid酸-al醛alcoho l醇-aldehy de醛-aldech ydicacid醛酸-amarim e(或-marine)苦苷-amic acid酰胺酸-amide酰胺-amideacid (=amic acid)酰胺酸-amidin e脒-amidox ime脒肟-amidra zone脒腙-amine胺-ane烷anhydr ide -ic anhydr ideanil缩苯胺-anilic acid酰苯胺酸-anilid e酰苯胺-anisid e酰茴香醛-arsine胂-arsini c acid[美国名指]次胂酸-arsino us acid[美国名和英国名均指]卑胂酸-arsino xide胂氧-arsoni c acid[美国名和英国名均指]胂酸-arsono us acid[美国名指]亚胂酸-ase酶-azide叠氮-azine连氮-betain e内胺盐-biarsi ne联胂bi...oyl di..oyl-bistib ine联锑bi...yl联...-borane硼烷-borini c acid 二取代硼酸-boroni c acid硼酸-bromoh ydrin溴醇-cacody l 卡可基-cain(e) 卡因-carbam ic acid氨甲酸-carbaz inicacid肼甲酸-carbin ol甲醇-carbod ithio ic acid二硫代羧酸carboh ydraz ide N-酰基卡巴肼-carboh ydrao xamam ide甲肟胺-carboh ydrox amicacid羧肟胺-carbon amidi ne甲脒-carbon itril e甲腈-barbon yl羰基-carbot hioic acid羧硫代酸-carbot hioli c acid甲硫羟酸-carbot hioni c acid甲硫羰酸-carbox aldeh yde甲醛-carbox amide甲酰胺-carbox amidi ne 甲脒-carbox amido xime甲胺肟-carbox imidi c acid甲亚胺酸-carbox ylicacid羧酸-carbyl amine胩-cene并...苯-chloro arine氯胂-chloro hydri n氯醇-chrysi ne柯因-cyanam ide氨腈-cyanhy drin氰醇-cyanoa rsin氰胂-diarsi ne联胂-diazon ium重氮-dicarb oximi de二甲酰亚胺-dichlo roars ine二氯胂-diimid e联亚胺-din(e)定;啶di...(o)yl联…酰-disulf ide二硫-dithio carba mic acid氨基二硫代羧酸-di...ylene联二…亚基-drin(e)君[俗名词尾]-e-裂[嵌在末一音节之前,指分裂后之产物]-ene烯-ester酯-etane丁环-ete丁-etene丁亭[4元无氮一烯环,中文中与-etine不分] -ether醚-etidin e丁啶-etine丁亭[4元含氮饱和环]-florin e花精-follin叶素-folin叶素-form仿gen精-genin配基-german onicacid基锗酸-gin精-glycol二醇-hemiac etal缩一醇-hydraz idc酰肼-hydraz idine肼定-hydraz ine肼-hydraz one腙-hydrin醇hydrog en ester氢酯hydros ulfam ine巯胺-hydrox amami de肟胺-hydrox amicacid羟肟酸-hydrox ylami ne胲-ic anhydr ide酸酐-ic semial dehyd e醛酸-ide酰胺-il 偶酰-imide酰亚胺-imidic acid亚胺酸-imine亚胺-in精-inium-onium-iodohy drin碘醇-irane丙烷-irene丙烯-iridin e丙啶-irine丙因-isothi ourca异硫脲-isourc e异脲-ite糖醇-itol 糖醇-ium -onium-ketal酮缩醇-ketene乙烯酮-ketazi ne酮连氮-ketimi de酮亚胺-ketol乙酮醇-ketone酮-ketoxi me甲酮肟-lactam内酰胺-lactim内酰亚胺-lacton e内酯-lin灵-lin(e)灵-lysin溶素-mercap tal醛缩硫醇-mercap tan硫醇-mereap tole酮缩硫醇-methin e甲碱-methyl ene亚甲基-min明-morpho lideN-酰基吗啉-naphth alide N-酰基萘胺-naphth one酰萘-nin(e)宁-nitram ine硝胺-nitril e腈-nitrol ic acid硝肟酸-nitros amine亚硝胺-nitros ate硝酯肟酸-nitros olicacid亚硝肟酸-nitros ite亚硝酯肟酸-oic acid酸-oin偶姻-ol醇-ole脑,醚-olic acid醇酸;脑酸;油酸;炔酸-olid(e)交酯-olidin e烷[5元含氮饱和杂环]-oline啉[5元一烯杂环]-onane壬环[9元饱和杂环]-one酮-ionicacid 酮酸-ionicacid 糖酸-onium钅翁-o... one...酰...酮-or脑-orthos ilico nic acid原硅酸-osan聚糖-osazon e脎-ose糖-oside糖苷-oxide氧化物-oxime肟-oyl酰-oyl halide酰卤-ozonid e臭氧-peroxi de过氧-phene芬-phine粉;芬-phenet idide酰基苯乙定-phenon e酰苯-phosph ine膦-phosph inicacid次磷酸-phosph inous acid卑磷酸-phosph onicacid磷酸-phosph onous acid亚磷酸-phylli n(e)非灵;植素-picrin苦碱-pin(e)品-pinaco l频哪醇-pinaco lin(e)频哪酮-pinaco lone频哪酮-pinaco ne -pinaco l-piperi dineN-酰基哌啶-plumbo nic acid铅酸-quine奎-rin扔,苷-rufin绛酚saccha ric acid糖质酸saccha rinic acid糖精酸-sapege nin皂萆配基-saponi ne皂萆苷-selene nic acid次硒酸-seleni nic acid亚硒酸-seleno l硒醇-seleno nic acid硒酸-semiac etal醛缩一醇semial dehyd e-ic semial dehyd e -semica rbazo ne缩氨脲-semica rbazi de氨脲-semiox amazo ne缩半萆肼-silico nic acid硅酸-sin僧;素-st-甾-stanno nic acid锡酸-stibin e月弟-stibin ic acid次锑酸-stibin ous acid卑锑酸stibon ic acid锑酸-stibon ium锑-stibon ous acid亚锑酸sulfen amide次磺酰胺-sulfen ic acid次磺酸-sulfid e硫-sulfil imine硫亚胺-sulfin amide亚磺酰胺-sulfin ic acid亚磺酸-sulfon amide磺酰胺-sulfon e砜-sulfon ic acid磺酸-sulfox ide亚砜-sultam磺内酰胺-sulton e磺内酯-tanin单宁-tannin单宁-tellur inicacid亚碲酸-tellur onicacid碲酸-thetin(e)噻亭-thin质thioac etal醛缩硫醇-thioca rbazo ne硫卡巴腙-thiohy droxy lamin e硫胲-thioic acid 硫代酸-thioke tene乙烯硫酮-thiol硫醇-thiola ctone硫代内酯-thiose micar bazon e缩胺基硫脲-thioli c acid硫羟酸-thione硫酮-thioni c acid硫羰酸-thiono thiol ic acid二硫代羧酸-thiour ea硫脲-tin亭-toluid e N-酰基甲苯胺-toxin(e) 毒-trin醇-trisul fide三硫-tropin托品-ulose酮糖-area脲-uretha n(e)尿烷-urethy lan(e)尿基烷-uric acid尿酸-uronic acid糖醛酸,糖酮酸-xanthi n黄质-xantho genic acid黄元酸-xylide N-酰二甲苯胺-yl 基-ylene亚基-yl halide卤代物-yliden e亚基-ylidyn e次基-ylium钅翁-yne炔Aacetal- 乙酰alkali- 碱alkoxy- 烷氧基-amide酰胺amino-氨基的anilin o- 苯胺基aquo- 含水的azo- 偶氮Bbi- 在盐类前表示酸式盐bis- 双bromo-溴Ccenti- 10-2chloro- 氯代cis- 顺式cyclo-环Ddeca- 十dodeca- 十二Eepi- 表epoxy-环氧ethoxy- 乙氧基Ffluoro- 氟代Hhemi- 半hendec a- 十一hepta-七heptad eca- 十七hexa- 六hexade ca- 十六hydro-氢或水hypo- 低级的,次Iiodo- 碘代iso- 异,等,同Kketo- 酮Mmega- 106meta- 间,偏methox y- 甲氧基methyl甲基micro- 10-6milli- 10-3mono- ( mon-) 一,单Nnano- 10-9nitro-硝基nitros o- 亚硝基nona- 九nonade ca- 十九Oocta- 八octade ca- 十八ortho-邻,正,原oxa- 杂oxo- 酮oxy- 氧化Ppenta-五pentad eca- 十五per- 高,过 petro-石油phenol苯酚 phenyl苯基pico- 10-12 poly- 聚,多Qquadri- 四 quinqu e- 五Ssemi- 半 septi-七sesqui一个半sexi- 六sulfa-磺胺sym- 对称syn- 顺式,同,共ter- 三Ttetra-四 tetrad eca- 十四tetrak is- 四个thio- 硫代trans-反式,超,跨tri- 三tridec a- 十三tris- 三个Uundeca- 十一uni- 单,一unsym-不对称的,偏位-yl 基罗马字母读法1 Αα alphaa:lf 阿尔法角度;系数2 Ββ beta bet 贝塔磁通系数;角度;系数3 Γγ gammaga:m 伽马电导系数(小写)4 Γδ deltadelt 德尔塔变动;密度;屈光度5 Δε epsilo n ep`silon伊普西龙对数之基数6 Εδ zeta zat 截塔系数;方位角;阻抗;相对粘度;原子序数7 Ζε eta eit 艾塔磁滞系数;效率(小写)8 Θζ thet ζit 西塔温度;相位角9 Ηη iot aiot 约塔微小,一点儿10 Κθ kappakap 卡帕介质常数11 ∧ ι lambda lambd兰布达波长(小写);体积12 Μκ mu mju 缪磁导系数;微(千分之一);放大因数(小写)13 Νλ nu nju 纽磁阻系数14 Ξμ xi ksi 克西15 Ον omicro n omik`ron 奥密克戎16 ∏ π pi pai 派圆周率=圆周÷直径=3.141617 Ρξ rho rou 肉电阻系数(小写)18 ∑ ζ sigma`sigma西格马总和(大写),表面密度;跨导(小写)19 Τη tau tau 套时间常数20 Υυ upsilo n jup`silon宇普西龙位移21 Φθ phi fai 佛爱磁通;角22 Φχ chi phai 西23 Χψ psi psai 普西角速;介质电通量(静电力线);角24 Ψω omegao`miga 欧米伽欧姆(大写);角速(小写);角希腊字母读法Αα:阿尔法 AlphaΒβ:贝塔 BetaΓγ:伽玛 GammaΓδ:德尔塔 DelteΔε:艾普西龙 Epsilo nδ:捷塔 ZetaΕε:依塔 EtaΘζ:西塔 ThetaΗη:艾欧塔 IotaΚθ:喀帕 Kappa∧ι:拉姆达 LambdaΜκ:缪 MuΝλ:拗 NuΞμ:克西 XiΟν:欧麦克轮 Omicro n∏π:派 PiΡξ:柔 Rho∑ζ:西格玛 SigmaΤη:套 TauΥυ:宇普西龙 Upsilo nΦθ:fai PhiΦχ:器 ChiΧψ:普赛 PsiΨω:欧米伽 Omega实验室最危险的17种物质。
化学符号大全

化学符号大全化学符号是化学元素的标识,它们是用来代表元素的简写形式,通常由一个或两个拉丁字母组成。
化学符号是化学元素的独特标识,它们在化学方程式、化学式和其他化学公式中起着重要的作用。
下面将介绍一些常见的化学符号,以便大家更好地了解和掌握化学知识。
1. 氢(Hydrogen)的化学符号是H,它是地球上最丰富的元素之一,也是化合物中最常见的元素之一。
氢气是一种无色、无味、无毒的气体,它在自然界中广泛存在,是水和许多有机化合物的组成部分。
2. 氦(Helium)的化学符号是He,它是一种无色、无味、无毒的惰性气体,常用于充气球和气球中。
氦气是地壳中第二丰富的元素,但由于其轻量和不活泼的特性,它通常以气态形式存在于大气中。
3. 锂(Lithium)的化学符号是Li,它是一种银白色的金属元素,常用于制造锂电池和合金。
锂在自然界中较为稀有,主要存在于矿石中。
4. 氮(Nitrogen)的化学符号是N,它是地球大气中最丰富的元素之一,占据大气中78%的体积比例。
氮气是一种无色、无味、无毒的气体,广泛用于制造氮肥和氮化合物。
5. 氧(Oxygen)的化学符号是O,它是生命中不可或缺的元素之一,是维持生命的重要物质。
氧气是一种无色、无味、无毒的气体,它能够支持燃烧和呼吸,是地球上最常见的元素之一。
6. 钠(Sodium)的化学符号是Na,它是一种银白色的金属元素,常用于制造食盐和碱金属化合物。
钠在自然界中广泛存在,主要以盐矿的形式存在。
7. 镁(Magnesium)的化学符号是Mg,它是一种银白色的金属元素,常用于制造轻合金和防腐蚀材料。
镁在自然界中较为丰富,主要存在于矿石和盐湖中。
8. 铝(Aluminum)的化学符号是Al,它是一种银白色的轻金属元素,常用于制造铝合金和包装材料。
铝是地壳中第三丰富的元素,主要存在于矿石中。
9. 硅(Silicon)的化学符号是Si,它是一种灰白色的半金属元素,常用于制造硅片和半导体材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理量名称物理量符
号
单位名称单位符号备注
相对原子质
量
A r一 1
相对分子质
量
M r一 1
分子或其他
基本单元数
N一 1
物质的量n摩[尔]mol
阿伏加德罗
常数
N A每摩[尔]mol-1
摩尔质量M千克每摩
[尔]kg/mol 中学化学
一般用
g/mol
摩尔体积V m立方米每
摩[尔]m3/mol 中学化学
一般用
L/mol
B的物质的量浓度或B 的浓度c B摩[尔]每
立方米或
摩[尔]每
升
mol/m3
mol/L
中学化学
一般用
mol/L
B的化学计
量数
n B一 1
B的质量分
数
w B一 1
B的摩尔分
数
x B一 1
长度l或L米m 中学化学
还常用
cm、nm
等
质量m千克(公
斤)kg 中学化学
还常用g、
t
体积V立方米m3中学化学
还常用
mL、L、
cm3
时间t秒s 中学化学
还常用
min、h、d 密度ρ千克每立kg/m3中学化学
方米一般用
g/cm3或
g/L 压力、压强P帕[斯卡]Pa 中学化学
还常用
kPa 热力学温度T开[尔文]K
反应热△H焦[耳]每
摩[尔]J/mol 中学化学
还常用
kJ/mol
按:昨天教科院唐主任来我校“推门听课”,第一个就是听我的课,课后指出我还存在的一些不足,如符号的规范书写、表述的准确等。
第四节恰好是我们集体备课,唐主任也高兴地参加了,议题便是讨论第三次统考试题,试题中恰好有一个化学用语规范表述的试题,我笑着说,“此题不是考学生,更是考我们老师!”因为我们很多老师平时都没有注意这个问题,从对学生终生负责的角度出发,我认为这还真不是一个小问题,因为他们今后将会从事科研或教学工作,意义深远。
说者无心,听者有意。
事后唐主任用
邮件的形式给我发来此文,一则教育本人,二来以正视听。
一、物理量符号
1、一般物理量的符号只有一个字母构成,但也有由几个字母构成的。
不管由几个字母构成,不论大写还是小写,一律用斜体字母表示。
只有pH例外,用正体。
物理量质
量
密
度
摩尔
质量
体
积
质量
数
质子
数
溶液
酸度
正确
写法
m ρM V A Z pH 错误
写法
m ρM V A Z pH
2、物理量符号的下标。
下标一般用正体,大小写与原符号相同。
物理量相对
分子
质量
阿伏加
德罗常
数
摩尔
体积
半期水的
离子
积
反应
热
正确
写法
M r N A V m T1/2K w∆H1错误
写法
M r N A V m T1/2K w∆H1
3、物理量符号不是纯数,不应将物理量符号作纯数使用。
也不应将化学元素符号作为物理量符号使用。
物理量物
质
的
量
温度差MnO2的
含量
碳氢原子
个数比
氢气与氧气
体积比
正确写法
物
质
的
量
为n
t-10 ℃ω(MnO2
)
= 20%
N(C)∶N
(H)
= 1∶2
V(H2)∶V(O2
)
= 2∶3
错误用法
物
质
的
量
为n
(t-10)℃ MnO2 %
= 20 %
C∶H=1∶
2
H2∶O2=2∶
3
mo
l
4、用具体物质的化学符号作下标时,将化学符号置于与主符号齐线的括号中。
物理量相对分子质
量摩尔质量物质的量浓
度
正确写法M r(Cl2) M(H2) c(H2SO4)
错误写法M r(Cl2)M(H2)c( H2SO4)
5、物理量符号的组合与运算
1.5.1同类物理量可以相加减,不同物理量不能相加减。
例如:m = m1 + m2V = V1 + V2
1.5.2不同类物理量可以相乘除。
6、物理量的表示法
1.6.1 物理量值的表示
数值在前,单位在后,数值与单位之间留有空隙(半个字的距离)。
十进制法定单位表示物理量值时,一个物理量值只能有一个单位;非十进制法定单位表示
物理量值时,一个物理量值单位可多于一个;表示量纲为一的物理量值时,单位1不必写出,可只用数值表示,或用实际上等于1的单位表示。
物
理量
质量温度长度时间角度质量分数
正确写法1.24 g 20 ℃1.70 m 1
min
30 s
或1.5
min
104.50
或
104030′
ω(MnO2)
= 0.20
=20 %
错误
写法
1.24g 200 C 1m70cm
1.6.2物理量的和或差的表示
应写成各个量值的和或差,或将数值组合并加圆括号,置共同的单位符号与全部数值之后。
物理量质量温度
正确写m = 12 g + 5 t= 27.6 ℃ ±
法g
或m = (12 +
5) g
0.2 ℃
或t= (27.6 ± 0.2) ℃
错误写法m = 12 + 5 g t= 27.6 ±
0.2 ℃
1.6.3物理量范围的表示
表示物理量范围时,两量之间要用波浪号“~”隔开,不用直线“—”。
物理量质量
范围
温度范围质量分数范
围
数范围
正确写法2 g~
3 g
20 ℃~30 ℃ 0.31~0.62
或
31 %~
62 %
2×10-6~5×10-6
错2-3 20-30 ℃31-61 % 2-5×10-6
误写法
g
或2
g—3
g
或
20 ℃—30 ℃
或
0.31—0.62
或
2×10-6—5×10-6
二、法定计量单位
2.1 单位名称的使用规则
2.1.1有全称,也有简称。
全称摩[尔] 安[培] 米千克
简称摩安米千克
2.1.2 单位名称一般用于口头表达,也可用于叙述性文字,但不用于公式运算、图表中。
例如:c(NaOH) = 0.5 mol/L,不写成c(NaOH) = 0.5 摩尔/升。
密度/ (g.L-1) 沸点/℃体积/L
O2 1.429 -182.97 3.8
H20.089 9 -252.87 4.61
2.2 单位符号的使用规则
2.2.1 中文符号只在小学、初中教科书的普通书刊中必要时使用,高中教科书、科技书刊中不允许使用中文符号,应用国际符号。
2.2.2 国际单位符号使用规则
2.2.2.1国际单位符号一律用正体小写字母表示,但升的符号例外;如单位符号来源于人名时,第一个字母要大些,第二个字母(不是下角标)依然小写。
单位米摩升毫升安帕赫
正确写法m mol L mL A Pa Hz
错误写法M moL l ml a pa HZ
2.2.2.2由两个以上单位相除所构成的组合单位,其符号可用下列两种形式之一:kg/m3或kg•m-3
2.2.2.3在用斜线表示相除时,单位符号的分子和分母都与斜线处于同一行内。
当分母中包含两个以上单位符号时,整个分母一般应加圆括号。
在一个组合单位的符号中,除加括号避免混淆外,斜线不得多于一条。
例如:化学反应速率单位mol/(L·s),不能写成
mol/L/s。
2.2.2.4 其他
几个物理量值互相加、减、乘、除时,每个量的单位都应写出。
2.2.2.5一些单位名称的读法
全称温度阿伏加德
罗常数
浓度速率
单位符号20℃mol-12mol/L 3mol/(L·s)
单位名称读法
20
摄氏度
6.02×2023
每摩
2摩每升 3摩每升秒
错误读法摄氏
20度
6.02×2023
个每摩
每升2摩
3摩每升每
秒
2.2.3词头的使用规则
词头本身不是单位,将其加在SI单位前,构成该单位的倍数单位。
词头表示等于或大于106时,用大写字母,表示小于106时,用小写字母。
词头与单位是一个整体,之间不留空隙。
词头与单位具有相同的幂次。
例如:
正确写法103 g = 1
kg 10-9 m =
nm
106mol =
Mmol
5 g/cm3
错误写法103 g
=Kg 10-9 m =
Nm
106mol =
mmol
5 g/c m3。
