河北科技大学药物合成期末复习
药物合成反应的知识点复习

化学药物是指凡具有预防、治疗、缓解、诊断疾病或调节机体功能化学物质。
(绪论)按照药物合成反应机理,卤化反应包括亲电加成(大多数不饱和烃的卤加成反应),亲电取代(芳烃和羰基α位的卤取代反应),亲核取代(醇羟基、羧羟基和其他官能团的卤置换反应),自由基反应(饱和烃、苄位和烯丙位的卤取代反应,某些不饱和烃的卤加成反应以及羧基、重氮基的卤置换反应)。
(第一章卤化反应p1)不对称烯烃与溴化氢的加成会产生过氧化物效应(加成方向符合反马氏规则)(第一章卤化反应p11)。
卤化剂氯化亚砜的分子式是 SOCl2(第一章卤化反应 p36)在卤化氢对醇羟基的置换卤化反应中,各种醇的反应活性顺序是: 叔醇>仲醇>伯醇) (第一章卤化反应 p27)发生烃化反应的化合物称为被烃化物, 常见的被烃化物有: 醇,酚 (在羟基氧上引入烃基), 胺类 (在氨基氮上引入烃基) 和活性亚甲基,芳烃(在碳原子上引入烃基)。
(第二章烃化反应 p44)请写出制备伯胺的任意两种方法:过量的氨与卤代烃反应、 Gabriel(加布里)反应、改良的Gabriel反应(三氟甲磺酰胺法)、 Délépine(德莱潘)反应、利用二苯硫基胺制备伯胺、还原烃化法。
(第二章烃化反应p56-57)环氧乙烷是羟乙基化试剂 (第二章烃化反应p50)在用卤代烃作烃化剂的Friedel—Crafts烃化反应中,下列卤代烃(氯甲烷仲卤代烃伯卤代烃一氯苄)活性最大的是:一氯苄(第二章烃化反应 p65)为催化剂时,下列酰化剂(酰氯酰Friedel—Crafts酰化反应中,以AlCl3溴酰氟酰碘)活性最大的是酰碘(第三章酰化反应 p111 )伯胺和仲胺, 脂肪胺和芳香胺类药物与相同的酰化试剂发生酰化反应,其反应的难易程度顺序:脂肪胺>芳香胺伯胺>仲胺(第三章酰化反应p104)酰化反应中,常用的酰化剂为酰卤、羧酸、酸酐及酰胺等,上述的几种物质酰化能力大小顺序为酰卤>酸酐>羧酸>酰胺(第三章酰化反应p88)在有机物分子结构中的碳、氮、氧原子上导入酰基的反应称为酰化反应,相应的酰化反应的产物分别为: 酮(醛) , 酰胺 , 酯。
河北科技大学药物合成期末复习

三) Sharpless不对称环氧化反应
11
三、Oppenauer氧化
R
H C
O R ' + CH3CCH3 Al(O-iPr)3 R C
R ' + H3C
H C
CH3
HO
O
OH
反应可逆,加大丙酮量(既作溶剂又作氧化剂) 氧化特点:
a)烯丙位易氧化 b)甾醇烯丙位氧化,双键位移
O
O
O
CH3CCH3
27
第七章 酰化反应 N-酰化
3. 酸酐作为酰化试剂
酸酐的酰化活性比较强,反应是不可逆的,可加入催化量的酸或碱催化反应。
OO
CC R OR
+
R'NH2
OO RCOCR
NH2R'
O R NHR'
O + R OH
阿莫西林的工业生产:
OCH3
O H
N H O
OO HO
Dan's salt
..
HO
H2N
S CH3
R N CHO + POCl3
R
R N CH Cl
R'
R R' N CHO-----POCl2 Cl
RH N C O POCl2
R' Cl
R N CH Cl
R'
OPOCl2
NR"2 _ OPOCl2
NR"2 H
CH NRR'
Cl
NR"2
NR"2
_H
H C NRR' Cl
H2O
_ HNRR'.HCl
药物合成反应本科复习题
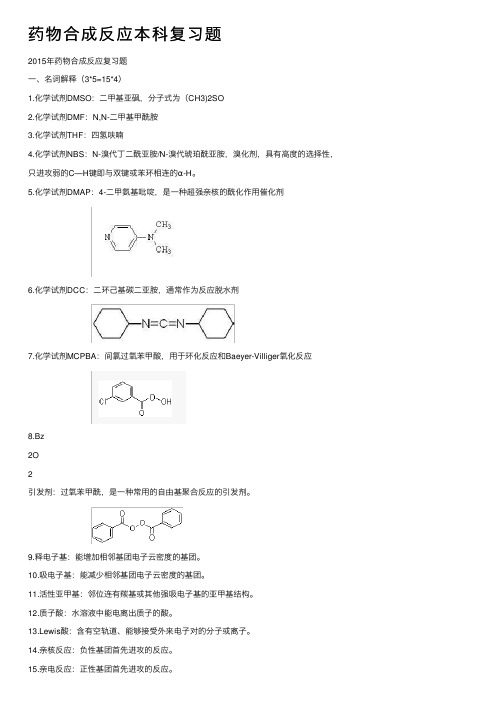
药物合成反应本科复习题2015年药物合成反应复习题⼀、名词解释(3*5=15*4)1.化学试剂DMSO:⼆甲基亚砜,分⼦式为(CH3)2SO2.化学试剂DMF:N,N-⼆甲基甲酰胺3.化学试剂THF:四氢呋喃4.化学试剂NBS:N-溴代丁⼆酰亚胺/N-溴代琥珀酰亚胺,溴化剂,具有⾼度的选择性,只进攻弱的C—H键即与双键或苯环相连的α-H。
5.化学试剂DMAP:4-⼆甲氨基吡啶,是⼀种超强亲核的酰化作⽤催化剂6.化学试剂DCC:⼆环⼰基碳⼆亚胺,通常作为反应脱⽔剂7.化学试剂MCPBA:间氯过氧苯甲酸,⽤于环化反应和Baeyer-Villiger氧化反应8.Bz2O2引发剂:过氧苯甲酰,是⼀种常⽤的⾃由基聚合反应的引发剂。
9.释电⼦基:能增加相邻基团电⼦云密度的基团。
10.吸电⼦基:能减少相邻基团电⼦云密度的基团。
11.活性亚甲基:邻位连有羰基或其他强吸电⼦基的亚甲基结构。
12.质⼦酸:⽔溶液中能电离出质⼦的酸。
13.Lewis酸:含有空轨道、能够接受外来电⼦对的分⼦或离⼦。
14.亲核反应:负性基团⾸先进攻的反应。
15.亲电反应:正性基团⾸先进攻的反应。
16.马⽒规则:当发⽣亲电加成反应时,亲电试剂中的正电基团总是加在取代最少的碳原⼦上,⽽负电基团则会加在取代最多的碳原⼦上。
17.卤化反应:有机化合物分⼦中建⽴碳—卤键的反应。
18.烃基化反应:有机分⼦中氢原⼦被烃基取代的反应。
19.Williamson反应:卤代烃和醇在碱的存在下⽣成醚的反应。
20.Gabriel反应:邻苯⼆甲酰亚胺和卤代烃在碱性条件下反应,然后肼解得伯胺的反应。
21.Leuckart还原反应:⽤甲酸及其铵盐对醛酮进⾏还原烃化反应22.Fridel-Crafts烷基化反应:在三氯化铝的催化下,卤代烷和芳烃反应在环上引⼊烃基的反应。
23.酰化反应:有机物分⼦中氢原⼦被酰基取代的反应。
24.Fridel-Crafts酰基化反应:酰氯、酸酐等酰化剂在Lewis酸或质⼦酸催化下,对芳烃进⾏亲电取代⽣成芳酮的反应。
制药工艺期末复习资料整理

制药工艺期末复习知识点总结第一章绪论“三废”:废气、废水、废渣第二章药物制备工艺路线的设计和选择1.药物制备工艺路线的设计方法:类型法反应法、分子对称法、逆合成法、模拟类推法、光学异构体拆分法。
2.全合成(概念):以结构简单的化工产品为起始原料,经一系列化学反应和物理处理过程制备的方法。
3.半合成(概念):由具有一定基本结构的天然产物经化学结构改造和物理处理过程制备的方法。
4.逆合成法(概念):从药物本身出发,一步步倒推出合成此药物的各种合成路线和起始原料,也就是我们通常所说的逆合成法。
5.逆合成转化的一般顺序(简答):①由目标分子结构和反应性决定逆合成顺序。
②从合成角度考虑合成转化顺序。
③从合成反应优化合成转化顺序。
6.分子对称法(概念):具有分子对称性的化合物往往可由两个相同的分子经化学合成反应制得,或在同一步反应中将分子的相同部分同时构建起来,这就是分子对称法。
7. 药物制备工艺路线的考察、选择①化学反应的选择平顶型——易于控制尖顶型直线型装配方式汇聚型装配方式——一般多选汇聚型,此类型收率较高。
③原辅料供应基本要求是价廉易得,利用率高。
第三章药物工艺路线反应条件研究1.内因(概念):主要指参与反应的分子中原子的结合状态、键的性质、立体构型和构象、功能基的活性、各种原子和功能基之间的相互影响及其物理性质等,它们都是设计和选择合成路线的理论依据。
2.外因(概念):主要指反应时的配料比、温度、溶剂、pH值、压强、反应时间、反应终点控制、产品后处理和设备状况等。
3 .简单反应(概念):由一个基元反应组成的化学反应。
4.复杂反应(概念):由两个或两个以上基元反应构成的化学反应。
如可逆反应、平行反应和连续反应等。
5.双分子反应(概念):即二级反应,是分子碰撞时相互作用产生的反应,其反应速率与反应物浓度的乘积成正比。
6. 平行反应:又称竞争反应,是一种复杂反应,即在同一个反应物系统中同时进行着几种不同的化学反应,生成不同的产物。
药物化学期末考试复习提纲

药物化学期末考试复习提纲一、熟练掌握以下专业术语的定义:1. Prodrug(p489):前体药物,将药物分子经结构修饰后,使其在体外活性较小或无活性,进入体内后经酶或非酶作用,释放出原药物分子发挥作用,这种结构修饰后的药物称作前体药物,简称前药。
(p489)2. Soft drug:软药,体内有一定生物活性,容易代谢失活的药物,使药物在完成治疗作用后,按照预先规定的代谢途径和可以控制的速率分解、失活并排出体外,从而避免药物的蓄积毒性。
这类药物称为“软药”。
3. Lead compound(p484):先导化合物,又称原型药,是指通过各种途径和方法得到的具有独特结构且具有一定生物活性的化合物。
4. Pharmacophoric conformation (p482):药效构象,它是当药物分子与受体相互作用时,药物与受体互补结合时的构象,药效构象并不一定是药物的优势构象。
5. 抗代谢学说:所谓代谢拮抗就是根据相关联物质可能具有相反作用的理论,设计与生物体内基本代谢物的结构,有某种程度相似的化合物,使之与基本代谢物发生竞争性拮抗作用,或干扰基本代谢物被利用,或掺入生物大分子的合成中形成伪生物大分子导致“致死合成”,抑制或杀死病原微生物或使肿瘤细胞死亡。
6. Bioisosters(p488):生物电子等排体, 具有相似的物理及化学性质的基团或分子会产生大致相似或相关的或相反的生物活性。
分子或基团的外电子层相似,或电子密度有相似分布,而且分子的形状或大小相似时,都可以认为是生物电子等排体。
7. Structurally specific drugs (p478):结构特异性药物,药物的作用与体内特定受体或酶的相互作用有关。
其活性与化学结构的关系密切。
药物结构微小的变化则会导致生物活性的变化。
8. Structurally nonspecific drugs (p478):结构非特异性药物,药理作用与化学结构类型的关系较少,主要受药物理化性质影响的药物。
期末药物合成总结

期末药物合成总结一、药物合成的基本原理和方法药物合成的基本原理是根据目标药物的结构和活性,合理设计合成路线和反应条件,从而实现目标化合物的合成。
合成路线通常包括若干个中间体,以及一系列反应步骤。
药物合成的方法多种多样,常见的包括有机合成、糖化学合成、无机合成等。
1. 有机合成:有机合成是药物合成中最常见的方法之一。
它利用有机化学反应,通过建立碳-碳、碳-氧、碳-氮等键进行分子的合成。
常用的有机合成反应包括酯化、酰化、醚化、烯烃加成等。
2. 糖化学合成:糖化学合成是合成天然产物和药物中不可或缺的一部分。
它通过利用糖的化学性质和反应特点,合成具有生物活性的化合物。
糖化学合成常用的反应有保护基的加入与脱除、糖苷键的形成与断裂等。
3. 无机合成:无机合成主要利用无机化学原理,在药物合成中也有一定的应用。
例如,无机合成可以用于合成金属配合物药物,通过改变配体结构和金属中心的性质,调控药物的活性和稳定性。
二、药物合成的新技术与挑战随着科学技术的不断进步,药物合成领域也出现了一些新的技术和挑战。
1. 绿色合成:绿色合成是近年来的研究热点之一。
它通过减少或消除有毒、有害的反应物和副产物的生成,减少对环境的污染,实现药物的可持续合成。
常见的绿色合成方法包括微波辐射、超声波辐射、催化反应等。
2. 生物合成:生物合成是利用生物体自身的代谢途径合成目标化合物。
它通过工程化生物体的基因组和代谢途径,调控药物合成中的关键酶和途径,实现高效、可控的合成。
生物合成可以利用真菌、细菌、植物等各种生物体,也可以利用合成生物学的方法构建新的微生物生产系统。
3. 多步合成:多步合成是合成复杂化合物和天然产物的一种常用方法。
它需要经过多个反应步骤,对反应条件和中间体的控制要求较高。
由于步骤较多,不同反应的耐受性和选择性可能产生问题,因此需要合理设计合成路线和优化条件。
三、总结药物合成是药学研究的重要内容之一,通过合理设计合成路线和反应条件,人工合成目标药物,并不断改进合成方法和开发新的技术,是实现药物研发和临床应用的关键。
药物合成综合复习题

药物合成综合复习题一、填空题1. 能在生物机体内以有效方式改变某些疾病过程的化合物称为( )。
药物合成是( )领域的一个重要分支。
2. 苯与3-氯丙烯在质子酸的催化下主要生成( ),在BF 3或ZnCl 2路易斯酸的催化下主要生成( )。
3. 合成 的起始原料为( )。
4. 与在NaCN 催化下发生Benzoin 缩合主 要生成( )。
5. 维生素 A 的前体是:( ),该前体可由( )与( )反应获得。
6. 在EtOK 的催化下主要生成( ), 该反应属于( )反应。
7. 与HN 3/H 2SO 4试剂反应生成( ),其产物酸性水解后再与HN 3/H 2SO 4试剂反应生成( )。
8. 用H 2NNH 2-Cu 2+-空气还原主要生成( ),该反应属于( )选择性反应。
9. %e.e >0的反应称为( )合成反应。
PhC(CO 2Et)2Et Me 2N CHO CHO CH 2OHN EtO 2CCH 2CO 2Et OCOOH O t-Bu 10.用NaBH 4还原主要生成?( );11. CH 3-CH =CH-COCH 3与CH 3Li 反应主要生成( )。
12.与EtMgBr 反应遵循( )规则,主要生成 ( )-4-甲基-3-庚醇。
13. 苯与3-氯丙烯在质子酸的催化下主要生成( ),在BF 3或ZnCl 2等路易斯酸的催化下主要生成( )。
14. 合成 的起始原料为( )。
15. 与在NaCN 催化下发生Benzoin 缩合主 要生成( )。
16. 9-BBN 的结构式为( )。
17.化合物与EtMgBr 反应遵循( )规则,主要生成( ),化合物A 可由( )和( )共热获得。
18. 在EtOK 的催化下主要生成( ),该反应属于( )反应。
19. 与H 2SO 4共热生成( ),其产物再与RCOOOH 反应主要生成( )。
20. 用H 2NNH 2-Cu 2+-空气还原主要生成( ),Me 2N CHO CHO N EtO 2CCH 2CO 2Et OHOHO O C H O 3该反应属于( )选择性反应。
制药工艺学期末复习题 docx.

(一)、选填部分1、浸提过程的原理是(相似相溶)2、浸提(或者提取)的三个阶段分别是(浸润与渗透阶段,解吸与溶解阶段,浸出成分扩散阶段)3、浸提影响因素有(药材粉碎度,浸提温度,浸提时间,浸提压力,药材的干燥程度,浸提溶剂)4、浸提的方法有(煎煮法,浸渍法,渗漉法,回流法,水蒸气蒸馏法,超临界流体提取法,超声提取法,微波提取法,酶提取技术,半仿生提取法)5、影响液液萃取效果的因素(溶剂PH的影响,温度的影响,无机盐的影响)6、合成子可分为(离子合成子,自由基合成子,周环反应合成子)7、药物分子的合成设计的三个步骤(分子考察,逆合成分析,正向检查)8、逆合成分析的一般顺序(由目标分析结构和反应性决定逆合成顺序,从分子中间分拆,多键分拆,尝试联接与重排)9、按溶剂发挥氢键给体作用的能力,可将溶剂分为(质子性溶剂)和(非质子性溶剂)两大类10、生物药物的原料来源有(人体来源的原料资源,动物来源的原料资源,植物来源的原料资源,微生物来源的原料资源,海洋生物来源的原料资源,其他来源的原料资源)11、生物制药的常用技术(生化工程技术,发酵工程技术,酶工程技术,细胞工程技术,基因工程技术,蛋白质工程技术,抗体工程技术)12、氨基酸根据R基的化学结构不同可以分为(脂肪族氨基酸,芳香族氨基酸和杂环族氨基酸)13、根据氨基酸分子中氨基和羧基的数目不同可以分为(酸性氨基酸,碱性氨基酸和中性氨基酸)14、蛋白质水解方法包括(酸水解法,解水解法和酶水解法)15、由15个氨基酸残基组成的肽称为(寡肽),含15~50个氨基酸残基的肽称为(多肽)含超过50个氨基酸的肽衍生物则常定义为(蛋白质)(数字也要背)16、核酸类药物常用的制备方法有(直接提取法,水解法,化学合成法,酶合成法,微生物发酵法)17、常见的单糖有(葡萄糖,果糖,甘露糖,木糖,半乳糖,山梨醇)18、酯类药物根据化学结构分为(脂肪类,磷脂类,糖苷脂,萜式脂类,固醇及类固醇,其他)19、脂肪类药物有(亚油酸,亚麻酸,花生四烯酸,22碳六烯酸)20、固醇及类固醇类药物有(胆固醇,胆酸,胆汁酸,蟾毒配基)21、酯类药物的制备方法有(直接抽提法,水解法,化学全合成或半合成法,生物转化法)22、酯类药物的分离精制方法有(溶解度法,色谱分离法,结晶与重结晶法)23、化学药的制备工艺要求(简单高效,成本低,污染小)(老师没划,我押的,爱背不背)(二)、名词解释1、浸提辅助剂:浸提辅助剂是指能增加浸提成分的溶解度,增加制剂的稳定性,提高浸提效能,以及除去或减少某些杂质,特在浸提溶剂中加入的物质。
药物合成期末辅导

药物合成期末辅导试题类型:一、名词解释(5小题15分)二、写出下列缩写所代表的结构式或名称(5小题15分)三、简答题(4小题20分)四、完成化学反应(15小题30分)五、药物合成(5小题20分)一、名词解释1 Lindler催化剂:组成为Pd/BaSO4/喹啉等的催化剂,毒剂使催化剂中毒,则中毒的催化剂称Lindlar 催化剂2 相转移催化剂可以帮助反应物从一相转移到能够发生反应的另一相当中,从而加快异相系统反应速率的一类催化剂3 官能团保护;当分子中有多个官能团,想在某一官能团进行转换反应,为了不使其他官能团影响反应,需对这些官能团进行衍生化,称官能团的保护。
4 Williamson 反应卤代烃与醇钠在无水条件下反应生成醚的反应5 Adol 羟醛缩合反应两分子醛在碱的催化下亲核加成生成羟基醛然后失水形成α,β不饱和醛或酮的反应6 Wolff-Kishner-黄鸣龙还原反应羰基化合物(醛或酮)在高沸点溶剂如一缩二乙二醇中与肼和氢氧化钾一起加热反应,羰基还原为亚甲基的反应。
7 Clemmensen 反应;在酸性条件下,用锌汞齐或锌粉还原醛基、酮基为甲基或亚甲基的反应称Clemmensen反应8 重排反应;重排反应是指在同一分子内,某一原子或基团从一个原子迁移至另一原子而形成新分子的反应。
9 Oppenauer氧化是二级醇与丙酮(或甲乙酮、环己酮)在碱存在下一起反应,醇被氧化为酮,同时丙酮被还原为异丙醇的反应10 Hofmann 重排(Hofmann 降解)酰胺用溴(或氯)在碱性条件下处理转变为少一个碳原子的伯胺11 Pinacol 重排1,2-二醇在酸催化下发生分子内重排脱水,生成羰基化合物(醛或酮)的反应.12 Darzens缩合醛或酮在强碱(如醇钠、醇钾、氨基钠等)作用下与α-卤代羧酸酯发生缩合反应,生成α,β-环氧羧酸酯13 Friedel-Crafts反应芳烃在Lewis酸(无水氯化铝、氯化锌、三氯化铁、三氟化硼等)存在下发生的酰基化和烷基化反应。
药物合成反应复习资料

药物合成反应复习资料第一章绪论1、药物合成反应中反应类型有哪些?①按有机分子的结构变换方式分:新基团的导入反应;取代基的转化反应;有机分子的骨架。
②按反应机制分:极性反应(a.亲核试剂、b.亲电试剂);自由基反应;协同反应2、药物合成反应主要研究对象:化学合成药物3、化学品的安全使用说明书——MSDS4、原子经济性反应:“原子经济性”是指在化学品合成过程中,合成方法和工艺被设计成能把反应过程中使用的所有原料尽可能多的转化到最终产物中。
5、三废:废气、废水、废渣第二章硝化反应1、混酸硝化试剂的特点有哪些?①硝化能力强;②氧化性较纯硝酸小;③对设备的腐蚀性小2、硝化试剂的活泼中间离子为:硝酰正离子NO2○+3、桑德迈尔反应定义及应用定义:在氯化亚铜或溴化铜的存在下,重氮基被氮或溴置换的反应;重氮基被氰基置换:将重氮盐与氰化亚铜的配合物在水介质中作用,可以使重氮基被氰基置换,该反应也称Sandmeyer反应。
应用:CuX+Ar-N2X Ar-X+N2 (X:Cl,Br,-CN)4、常用的重氮化试剂一般是由盐酸、硫酸、过氯酸和氟硼酸等无机酸与亚硝酸钠作用产生。
5、硝化反应定义:指向有机分子结构中引入硝基(—NO2)的反应过程,广义的硝化反应包括生产(C—NO2、N—NO2和O—NO2)反应。
6、重氮化反应定义:含有伯氨基的有机化合物在无机酸的存在下与亚硝酸钠作用生成重氮盐的反应。
7、硝化剂:单一硝酸、硝酸和各种质子酸、有机酸、酸酐及各种Lewis酸的混合物。
8、生成硝基烷烃的难易顺序:卤代烃中卤素被取代的顺序:9、DMF:DMSO:10、常用的重氮化试剂有哪些?NaNO2+HCl/H2SO4第三章卤化反应1、Ph上取代基对卤化反应的影响③反应温度的影响;④卤化剂的影响;⑤反应溶剂影响2、醇与HCl 发生卤置换反应活性顺序醇羟基的活性顺序:叔(苄基、烯丙基)醇>仲醇>伯醇氢卤酸的活性顺序:HI >HBr >HCL 3、NBS 的应用(N —溴代丁二酸亚胺) ①N —卤代酰胺与不饱和烃的卤取代反应机制:RCH 2CH=CH 2+NBS RCHBrCH=CH 2本反应属自由基型反应,可在光照下引发自由基②N —卤代酰胺与不饱和烃的加成反应:在质子酸(醋酸、溴氢酸、高氯酸)的催化下,N —卤代酰胺与烯烃加成易制备—卤代醇的重要方法。
新药设计与合成复习资料

新药设计与合成复习资料软药是容易代谢失活的药物,使药物在完成治疗作用后;前药将药物经过化学结构修饰后得到的在体外无活性或;硬药是指具有发挥药物作用所必需的结构特征的化合物;软药与前药的异同点:都是进入体内后都可按预期方式;先导化合物简称先导物,是通过各种途径和手段得到的;的化合物,用于进一步的结构改造和修饰,是现代新药;先导优化方法:经结构剖析与改造,确定与药理活性有;定量构效关。
软药是容易代谢失活的药物,使药物在完成治疗作用后,按预先设定的代谢途径和可以控制的速率分解、失活并迅速排出体外,从而避免药物的蓄积毒性,这类药物被称为软药。
前药将药物经过化学结构修饰后得到的在体外无活性或或性较小、在体内经酶或非酶的转化释放出活性药物而发挥药效的化合物,称为前体药物,简称前药。
硬药是指具有发挥药物作用所必需的结构特征的化合物,该化合物在生物体内不发生代谢或转化,可避免产生某些毒性代谢产物。
软药与前药的异同点:都是进入体内后都可按预期方式发生代谢。
区别在于软药本身有活性,代谢的结果是失活;而前药本身无或低活性,代谢的目的是活化。
软药与硬药都是有效药物,不同的是软药在体内呈现药理作用后,极易被代谢失活(毒),避免出现不良反应和毒性;而硬药基本不经历代谢过程以原形排出。
先导化合物简称先导物,是通过各种途径和手段得到的具有某种生物活性和化学结构的化合物,用于进一步的结构改造和修饰,是现代新药研究的出发点。
先导化合物的优化:因先导化合物存在着某些缺陷,如活性不够高,化学结构不稳定,毒性较大,选择性不好,药代动力学性质不合理等等,需要对先导化合物进行化学修饰,进一步优化使之发展为理想的药物,这一过程称为先导化合物的优化。
先导优化方法:经结构剖析与改造,确定与药理活性有关的药效基团,根据不同的目的,(改善药效学或药动学性质),通过生物电子等排体,前药原理,拼合原理以及类似物和拟肽设计等进行构效关系,定量构效关系或三维定量构效关系研究,可发现一大批具有相同基本结构的优良药物。
药物合成学知识点总结

药物合成学知识点总结一、药物合成的基本原理1. 药物分子结构药物分子结构通常由多个不同的基团组成,这些基团之间通过共价键相连。
药物分子的结构对其性质和活性具有重要影响,因此药物合成学需要对药物分子结构进行深入了解。
2. 药物合成的原则药物合成的原则包括高效性、高选择性、高产率、经济性和环境友好性等。
在药物合成的过程中,需要考虑不同反应条件下的选择性和产率,同时也需要考虑合成路线的经济性和环境友好性。
3. 药物合成的途径药物合成的途径包括经典合成路线和生物合成路线。
经典合成路线是通过有机合成化学反应来合成药物,而生物合成路线是利用生物体内的代谢路径来合成药物。
不同的药物可能采用不同的合成途径,具体选择取决于药物的结构和性质。
二、药物合成的方法1. 化学合成化学合成是通过有机合成化学反应来构建药物分子结构的方法。
化学合成通常包括多步合成和单步合成两种方式,多步合成是将多个中间体依次合成成目标药物,而单步合成是通过一步反应直接合成出目标药物。
2. 生物合成生物合成是利用微生物或细胞工程的方法来合成药物的过程。
通过基因工程技术,可以将特定的代谢途径转移到合成目标药物的细胞中,从而实现药物的生物合成。
3. 多相合成多相合成是指在反应物和催化剂之间存在两种或两种以上的相(固体/气体,固体/液体,液体/气体),以及两种或两种以上的相之间存在物质传递的化学反应。
4. 固相合成固相合成是一种在固体载体上进行的合成方法,最典型的代表就是固相多肽合成和固相有机合成。
其基本原理是将一个端点固定在多孔固体材料上。
反应后,将未反应物通过化学方法从载体上分离出来,得到纯的目标产物。
5. 模板合成模板合成就是在与基底特异性相互作用后使得合成物的分子结构在空间上受到限制,并最终得到所选择的结构,这种合成方法叫做模板合成。
三、药物合成的应用1. 创新药物发现药物合成学在创新药物发现过程中具有重要作用。
通过对药物分子结构和性质的深入研究,可以设计出更高效、更安全的药物分子结构,从而为新药物的发现提供理论基础和技术支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水解方式:(1)酸性条件水解;(2)水合肼肼解
18
三、芳烃的Friedel-Crafts烃基化反应
概念:反应是在路易斯酸或质子酸催化下完成的,烃基化剂可 以是卤代烃、醇或不饱和烃等。 反应通式:
19
四、 Grignard试剂为烃基化剂 概念:有机卤化物与金属镁在无水乙醚中反应生成有机镁化合 物,即Grignard试剂。 反应通式:
O R O O R + N
O OH O O H2SO4 OH O O
CHO O O OH
O-酰化
RCOO N COR
R'OH R
O + OR' N H
O
O
CH3 AlCl3 160~165° 3 h C, CH3 98%
O CHO O O 91%
OH
O CH3
OH
77%
NaOH, H 2O, r.t., 1 h
复习
1
第一章 卤化反应
一、烯丙型、苄基型化合物自由基卤化反应 卤化试剂:NBS 、卤素 溶剂:CCl4、氯仿、苯、石油醚或反应底物自身
Br O OEt NBS Br O OEt
CH3 Br
hv / Br2 160 ~ 180oC 85%
Br Br
2
二、芳香环上的亲电卤化反应
+ Cl2
FeCl3 PhH
.
RCOOR'
+ N HCl
.
HN
26
第七章 酰化反应
N-酰化
第二节 氮原子上的酰化反应
胺类化合物(脂肪胺或者芳胺) 可以采用羧酸、羧酸酯、
酸酐、酰氯、烯酮酰化,氨基氮上的电子云密度越大、空间 位阻越小,反应的活性就越强。 1. 羧酸为酰化剂
O + R OH R'R''NH R O OH NHR'R'' R O NR'R'' + H 2O
Cl
+
HCl
CONMe2 TBHP / HCl MeOH / reflux
CONMe2 + MeO Cl 35 : 65
CONMe2 Cl 50%
MeO
MeO
H3C
H3CO
S
NXS / solvent 70% HClO4
H3C
H3CO
S
X
X = Cl 94% Br 83%
Cl
t-BuOCl / (C2H5)3N-3HF 0oC / CH2Cl2
结论:醇在碱的条件下与卤代烷生成醚
16
二、卤代烃作为烃基化试剂的N-烃化
反应通式:
R可以是脂肪基、脂环基或芳香基,X为卤素(Cl、Br、I)。
17
• Gabriel 反应
概念:以邻苯二甲酰亚胺和烃基化剂为原料,在碱性条件下 经N-烃基邻苯二甲酰亚胺,再水解形成伯胺。
反应通式:
R为烷基、烯丙基、苄基等, X为卤素(Cl、Br、I)、OTf、OMs等。
..
N S CH 3 CH3 COOH Cat.
HO O H2N NH N O S CH3 CH 3 COOH
N
H O
HO
Dan's salt
也可以使用混合酸酐如羧酸-羧酸酐、羧酸-磺酸酐、羧酸-磷酸 酐以及羧酸-碳酸酐等作为酰化剂。
28
第七章 酰化反应 4. 酰卤作为酰化试剂
N-酰化
常用的酰卤是酰氯,活性高,酰化反应进行很剧烈。 一般
二、酯缩合反应 酯与具有活性甲基、亚甲基的化合物在碱催化剂下缩
合,脱去一分子醇,生成β-羰基类化合物的反应称为酯缩合
反应,又称Claisen酯缩合反应。
33
三、 Michael反应
活性亚甲基化合物在碱性催化剂存在下,与α,β-不饱和
羰基类化合物之间发生的共轭加成反应称为Michael反应。
34
四、 Robinson环化反应
反应机理:
20
第七章 酰化反应
O-酰化
1. 羧酸为酰化剂
Cat.
R'OH
+ RCOOH
RCOOR'
+
H2O
采用质子酸、Lewis酸、强酸型离子交换树脂或者负载 Lewis酸的树脂进行催化。属可逆反应,应除生成之水。
21
第七章 酰化反应 2. 羧酸酯为酰化剂
O-酰化
酯可以与醇、羧酸和酯发生交换反应,与醇的交换反应称
O-酰化
O R O O R' R''
R'O R
O O R''
RCOOR' + R''OH
RCOOR'' + R'OH (醇解)
一般要求R’OH的酸性比R’’OH的酸性强。 各类醇的相对酸性强度:甲醇 > 一级醇 > 二级醇 > 三级醇
23
第七章 酰化反应
O-酰化
3.酸酐为酰化剂
酸酐为一强酰化剂,多用在反应困难或位阻较大的醇羟
NR" 2 CHO
31
第八章 缩合反应
一、Aldol 缩合反应 含有活性α-氢的醛或酮,在碱或酸的催化下发生自身 缩合,或与另一分子的醛或酮发生交叉缩合,生成β-羟基 醛或β-羟基酮的反应,称Aldol缩合(醛醇缩合,羟醛缩合 )。β-羟基醛或β-羟基酮不稳定,易脱水生成α,β-不饱和 醛或酮。
32
Cl + H3CO 65% 4%
3
三、芳香烃卤甲基化反应(Blanc反应 ) 卤甲基化试剂:甲醛-卤化氢、多聚甲醛-卤化氢、卤甲醚等。 质子酸:硫酸、磷酸、乙酸和Lewis acid等均可催化反应。
ZnCl2 + HCHO + HCl Cl
四、不饱和烃与卤素的亲电加成反应
4
Br2/AcOH/AcONa HO
R N CHO R + POCl3 R R' N CHO-----POCl2 Cl H N C O POCl2 R' Cl R
NR" 2
R N CH Cl R'
R N CH Cl R' OPOCl2 _
NR"2 OPOCl2
H CH NRR' Cl
_
NR"2 H H C NRR' Cl _ H2 O HNRR' . HCl
10
三) Sharpless不对称环氧化反应
11
三、Oppenauer氧化
R H C HO O R ' + CH3CCH3
Al(O-iPr)3
R C O
H ' + H3C C CH3 R OH
反应可逆,加大丙酮量(既作溶剂又作氧化剂) 氧化特点:
a)烯丙位易氧化 b)甾醇烯丙位氧化,双键位移
O O CH3CCH3 60% Al(O-ipr)3 HO O Al(O-ipr)3 83% O 黄体酮
脂环酮与α,β-不饱和酮在碱催化下,通过Micheal加成 、Aldol缩合以及脱水消去等3步反应,在原来环结构基础上 引入一个新环,此反应称为Robinson环化反应。
35
五、Knoevenagel反应 醛或酮与含有活性亚甲基的化合物在氨、胺或它们的羧酸
盐等弱碱催化下,发生缩合反应,脱水而生成α,β-不饱和化合 物的反应称为Knoevenagel反应。
一、芳烃的C-酰化
1. Friedel-Crafts酰化反应 酰化剂在质子酸或Lewis酸催化下对芳烃进行亲电取代形 成芳酮的反应。
COR + RCOZ Lewis 酸
Z = Hal, R'COO, R'O, OH
30
第七章 酰化反应 4. Vilsmeier-Haauc反应
C-酰化
以N-取代的甲酰胺为甲酰化剂在三氯化氧磷的作用下,在 芳环或芳杂环上引入甲酰基的反应。
Me H H Et Cl Me H 52% 69%
Br HO Br
rt.
Cl H Et Cl + Me H
AcOH/Cl2 LiCl LiCl
Cl AcO H Me + H Et Et 13% 33% 8% 21%
OAc H
五、不饱和烃与卤化氢、氢卤酸的亲电加成
无过氧化物 CH3CHBrCH3 CH3CH=CH2 过氧化物 CH3CH2CH2Br Markovnikov加 成 反Markovnikov加 成
基酰化上,反应时常用酸或碱进行催化。
O R'OH + R O R O Cat. R O O R' + R O OH
酸催化:
O R O O R H R O H O O R R O O H O R ROH
..
R O
H R' O O R H O
O RCOOH R O H R' R
O O R' + H
24
第七章 酰化反应 碱催化:
为醇解。
RCOOR' + R''OH
酸催化的反应机理:
O R O R' OH R O R' R'' OH2 OH R O R'' H R O O R''
RCOOR'' + R'OH (醇解)
H
R''OH
O R' O H R
R'OH
22
第七章 酰化反应 碱催化的反应机理:
O R O R' + R''O
