第五章 表面活性剂的分散与絮凝作用
表面活性剂的分散和絮凝作用

CH3 CH3
2.阴离子型高分子絮凝剂
H CH2 CH n H H CH2 CH n CH2
COONa
COONa
CH H
m
CONH2
3.非离子型高分子絮凝剂
合成非离子型高分子絮凝剂的单体一般有丙烯酰胺、乙
烯基吡咯烷酮、乙烯基甲基醚、环氧乙烷以及乙酸乙烯酯 (共聚合后的水解物为聚乙烯醇)等。其中,最常用的是 聚丙烯酰胺。
H CH2 CH n CH2 CONH2
CH H
m
CONHCH2CH2CH2N(CH3)3Cl
H CH2 CH
CH2CH
n
CHCH2 H
m
H CH2CH
CHCH2 H
m
CONH2
CH2 CH2
N Cl
CH3 CH3
H2
C
H CH2CH
CH H
n
CH2 CH2 N Cl
CH3 CH3
CH2 CH2
N Cl
2.表面热力学电位是通过粒径a对排斥位能影响的。 a愈小,Ψ0愈大,排斥位能愈大,电位能垒则愈高。 微粒在分散介质中对外显示电性的是滑移界面 上的动电位,该动电位除了与电解质浓度有关外, 还与stern电位有关。
3.在本体相中加入电解质,双电层厚度K-1被压缩。 结果排斥位能减小,总位能曲线上的位能垒Emax 也降低。 但是,表面活性剂离子的作用不仅限于此,如前 所述,它不仅会压缩双电层,而且会显著影响表 面电位。
表面活性剂分散与絮凝的对象是固体微粒。 固体微粒在液体中的分散,即由固体为分散相,液体为分
散介质的分散系统是一种多相分散的热力学不稳定系统。 在生产、生活中,有时需要固体微粒均匀、稳定地分散在
表面活性剂解析

表面活性剂:是一种加入很少即能明显降低溶剂(通常为水)的表面(或界面张力),改变物系的界面状态,能够产生润湿、乳化、起泡、憎溶及分散等一系列作用,从而达到实际应用的要求的精细化学品。
在结构上至少存在亲水基和疏水基两种基团,一个分子中可以同时存在多个亲水基,多个疏水基。
分类:(1)按离子类型分类:1)非离子型表面活性剂2)离子型表面活性剂:阴离子、阳离子、两性(2)按表面活性剂的特殊性分类:碳氟表面活性剂、含硅表面活性剂、高分子表面活性剂、生物表面活性剂、冠醚型表面活性剂。
常见阴离子、阳离子、两性表面活性剂的中英文名、简写及结构(1)阴离子:十二烷基苯磺酸钠:Sodium dodecyl benzene sulfonate (SDBS 或LAS)弧比一 3 Na(2)阳离子:苄基三甲基氯化铵:Benzyltrimethylammonium Chloride (TMBAC )(3)非离子:脂肪醇聚氧乙烯醚:Primary Alcobol Ethoxylate (AE 或AEO)R-O-(CH2CH2O) n-H(4)两性:十二烷基甜菜碱:Dodecyl dimethyl betaine (BS-12)C12H25-N+(CH3)2CH2COO-阴离子表面活性剂的合成:(1)烷基苯磺酸盐——烷基芳烃的生产过程:a•以烯烃为烷基化试剂合成长链烷基苯: 反应历程:(质子酸做催化剂)R—CH = CH2 + H+ = R- + CH —CH3(以AlCl3作催化剂)HCl + AICI3 = H S +—Cl S - • AICI3RCh k CH2 + H S +—Cl S - • AlCl3 = R — + CH- CH V AICI4 —之后反应:R-CH-CH3 +b. 以氯代烷为烷基化试剂、三氯化铝为催化剂合成长链烷基苯:R a + AlCh R- 匸二 ft AICU或 RCHCH 2CH 2SO 3NaOHRCH J CH^CH J(3)氧磺化法生产烷基磺酸盐:(4)氯磺化法制备烷基磺酸盐:RH + SO2 + CI2 f RSO2CI + HCI TRSO2CI + 2NaOH f RSO3Na + H2O + NaCIRCH2CH^CH 2 I so 3NaOhlRCH=CHCH 2SO^JaNaOHRCHOH(CH 2h_3SO3NaRCH2CH3 + SO 2 + 扌。
表面活性剂及其作用原理

不稳定 用量少
稳定 用量多,常需使 用助表面活性剂
稳定 浓度超过临界 胶束浓度即可
表面活性剂的主要性能-分散作用
♣
分散作用:把一种物质分散于另一种物质中
以形成分散体系的作用。
♣
分散体系的分类:
粗分散体系:质点大小大于0.5µm 胶体分散体系:质点大小为0.5µm~1nm 分子分散溶液:质点大小小于1nm
表面活性剂及其作用原理 朱海洋
40
60
温度
80
离子型表面活性剂溶解度与温度的关系
非离子表面活性剂的浊点
浊点(Cloud point)
非离子表面活性剂的水溶液随温度的升高会突然出现
混浊,这时的温度称为浊点。
影响浊点的因素
表面活性剂分子结构 浓度 电解质
表面活性剂及其作用原理 朱海洋
有机添加剂
表面活性剂的主要性能-微乳液
♣
微乳液定义:
由不相混溶的油、水和表面活性剂自发形成的外观均匀、 透明、稳定的液体。
♣
微乳液与乳状液、胶团溶液性质对比
性质
外观 分散度
乳状液
乳白,不透明 大于0.1µm, 不均匀
微乳液
透明或稍带乳光 小于0.1µm,比 较均匀
胶团溶液
透明 小于0.1µm
稳定性 表面活性剂用量
a
散时,优先吸附在表面或界面上,
使表面或界面张力显著降低;当 它达到一定浓度时,在溶液中缔 合成胶团。如图中的中的c线。
表 面 张 力
b
c 溶质浓度
表面活性剂及其作用原理 朱海洋
表面活性剂分子结构特点
疏水基
亲水基
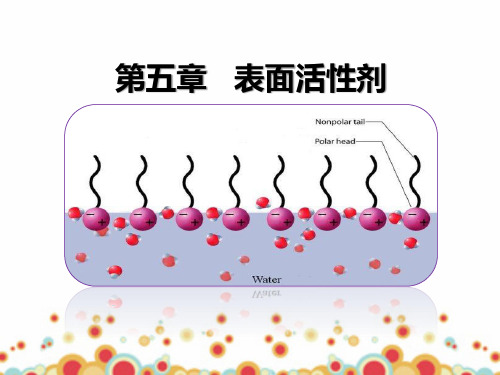
表面活性剂分子由两部分组成,一部分溶于水,具有亲水 性,称作亲水基;另一部分不溶于水而溶于油,具有亲油 性,称作亲油基,也称疏水基;
药剂学:第5章 药物微粒分散体系

内容提要
微粒分散体系的概念及基本特征 微粒分散体系的理化性质 微粒分散体系物理稳定性
1、微粒的动力学性质
微粒分散在液体分子时,液体分子的 热运动无时不刻撞击微粒。
>10-5m时,撞击可以彼此抵消; <10-7m时,撞击不能彼此抵消,布朗运 动;是微粒具有动力学稳定性的表现;
布朗运动方程---温度、粒径、粘度、 微粒数目
r愈小,介质粘度愈小,温度愈高,粒子的平 均位移愈大,布朗运动愈明显。
布朗运动:粒子永不停息的无规则的直线运动
布朗运动是粒子在每一瞬间受介质分子碰撞的 合力方向不断改变的结果。由于胶粒不停运动, 从其周围分子不断获得动能,从而可抗衡重力 作用而不发生聚沉。
2、微粒的光学性质
一束光照射到微粒分散体系时,可出 现吸收、反射和散射。 吸收----微粒的化学组成和结构; 反射、散射----微粒的大小;
子损失小等特点。在观察形态方面效果 良好,常用于研究高分子材料的制剂, 如微球等。
微粒大小与测定方法
透射电子显微镜(TEM) 是把经加速和 聚集的电子束投射到非常薄的样品上, 电子与样品中的原子碰撞而改变方向, 从而产生立体角散射。用于观察颗粒的 超微结构,分辨能力达0.1~0.2nm。
特点:常用于介质中微粒的研究。如脂 质体等。
最佳物理稳定性:
使用絮凝剂使微粒保持絮凝状态; 加入可溶性高分子材料,使微粒分散于
结构化载体体系,形成反絮凝状态; 加入絮凝剂,并与结构化载体体系进行
混合。
可溶性高分子材料(改变分散体系的黏度,减少微 粒沉降速度,保持稳定。):甲基纤维素、羧甲基 纤维素、卡波姆……
To be continue
散相称为微粒,由微粒构成的分散系统。
絮凝剂的工作原理

絮凝剂的工作原理综述:絮凝剂是一种常用的水处理药剂,用于去除水中的悬浮物、浑浊物和胶体物质。
其工作原理主要包括吸附、中和、凝聚和沉淀等过程。
本文将详细介绍絮凝剂的工作原理及其应用。
一、吸附作用:絮凝剂通过其特殊的分子结构和表面活性剂的作用,能够吸附在悬浮物和胶体物质的表面,改变其表面性质,使其互相聚集形成较大的团聚体。
这种吸附作用可以增加悬浮物和胶体物质之间的相互作用力,从而促进后续的凝聚和沉淀过程。
二、中和作用:絮凝剂中的某些成分具有电离性,可以与水中的带电颗粒发生中和反应。
当水中存在带正电荷的悬浮物或胶体物质时,絮凝剂中的阴离子成分可以与其结合,中和其表面电荷,使其失去稳定性,从而促进凝聚和沉淀。
同样,当水中存在带负电荷的悬浮物或胶体物质时,絮凝剂中的阳离子成分可以起到中和作用。
三、凝聚作用:絮凝剂中的高分子聚合物具有较大的分子量和极性基团,通过与悬浮物和胶体物质相互作用,形成较大的凝聚体。
这种凝聚作用可以增加悬浮物和胶体物质之间的相互吸引力,从而使其聚集成大的团簇。
凝聚作用的效果与絮凝剂的类型、浓度、pH值等因素有关。
四、沉淀作用:当悬浊液中的悬浮物和胶体物质发生凝聚后,其密度会增加,使其比水重,从而发生沉淀。
絮凝剂的沉淀作用可以加速悬浊液中的固体物质下沉,使其从水中分离出来。
沉淀速度与絮凝剂的类型、浓度、温度等因素有关。
五、应用:絮凝剂广泛应用于水处理、污水处理、矿山尾矿处理等领域。
在水处理中,絮凝剂可以有效去除水中的悬浮物和胶体物质,提高水的透明度和净化度。
在污水处理中,絮凝剂可以帮助沉淀和去除污水中的悬浮物和胶体物质,减少污泥生成量。
在矿山尾矿处理中,絮凝剂可以加速尾矿中的固体物质沉淀,提高尾矿的稳定性和可回收性。
六、总结:絮凝剂的工作原理主要包括吸附、中和、凝聚和沉淀等过程。
通过吸附作用,絮凝剂能够改变悬浮物和胶体物质的表面性质,促进其聚集形成较大的团聚体。
中和作用可以中和悬浮物和胶体物质的表面电荷,使其失去稳定性。
大学表面活性剂复习资料(考试用)

大学表面活性剂复习资料(考试用)表面活性剂化学复习资料名词解释题目第一章表面活性剂的概述1.表面:液体或固体和气体的接触面。
(物质和它产生的蒸汽或者真空接触的面)2. 界面:液体与液体,固体与固体或液体的接触面。
(物质相与相之间的分界面称之为界面)3. 表面张力:指垂直通过液面上任一单位长度、与液面相切的收缩表面的力(N/m)。
4. 表面自由能:指液体增加单位表面上所需做的可逆功,或恒温恒压下增加单位表面积时体系自由能的增值,或单位表面上的分子比体相内部同分子量所具有的自由能过剩值,称为表面自由能(J/m2)。
5. 表面活性:在液体中加入某种物质使液体表面张力降低的性质叫表面活性。
如肥皂中的脂肪酸钠,洗衣粉中的烷基苯磺酸钠等。
6. 表面活性剂:是指在某液体中加入少量某物质时就能使液体表面张力急剧降低,并且产生一系列应用功能,该物质即为表面活性剂。
第二章表面活性剂的作用原理1. 吸附:表面上活性剂这种从水内部迁至表面,在表面富集的过程叫吸附。
2. 低表面能固体:表面活性剂的表面能<100mJ/m2的物质3. 高表面能固体:表面活性剂的表面能>100mJ/m2的物质。
4. 胶束:两亲分子溶解在水中达一定浓度时,其非极性部分会互相吸引,从而使得分子自发形成有序的聚集体,使憎水基向里、亲水基向外,减小了憎水基与水分子的接触,使体系能量下降,这种多分子有序聚集体称为胶束。
(2)反胶束:表面活性剂在有机溶剂中形成极性头向内,非极性头尾朝外的含有水分子内核的聚集体,称为反胶团。
(3)临界胶束浓度:表面活性剂溶液的表面张力随着活性剂浓度的增加而急剧地降低,但是当浓度增加到一定值后,表面张力随溶液浓度的增加而变化不大,此时表面活性剂从分子或离子分散状态缔合成稳定的胶束,从而引起溶液的高频电导、渗透压、电导率等各种性能发生明显的突变,这个开始形成胶束的最低浓度称为临界胶束浓度(CMC)。
(4)亲水-亲油平衡值(HLB):系表面活性剂中亲水和亲油基团对油或水的综合亲合力,是用来表示表面活性剂的亲水亲油性强弱的数值。
表面活性剂的作用原理与应用

表面活性剂的作用原理与应用作者:叶聪杨飞李勇来源:《科学与财富》2019年第09期摘要:表面活性剂通过在气液两相界面吸附降低水的表面张力,也可以通过吸附在液体界面间来降低油水界面张力。
表面活性剂系统的热动力学很重要,不论是理论上还是实践上。
因为表面活性剂系统代表的是介于有序和无序物质状态之间的系统。
表面活性剂溶液可能含有有序相和无序相。
胶束——表面活性剂分子的亲脂尾端聚于胶束内部,避免与极性的水分子接触;分子的极性亲水头端则露于外部,与极性的水分子发生作用,并对胶束内部的憎水基团产生保护作用。
关键词:表面活性剂;合成;分类;作用原理近年来,表面活性剂在生命科学、能源科学、信息材料以及许多现代高新技术中发挥了重要作用。
表面活性剂一般为具有亲水与疏水基团的有机两性分子,可溶于有机溶液和水溶液。
亲水基团常为极性的基团,如羧酸、磺酸、硫酸、氨基或胺基及其盐,也可是羟基、酰胺基、醚键等;而憎水基团常为非极性烃链,如8个碳原子以上烃链。
表面活性剂分为离子型表面活性剂和非离子型表面活性剂等。
它是一大类有机化合物,他们的性质极具特色,应用极为灵活、广泛,有很大的实用价值和理论意义。
一、表面活性剂的分类表面活性剂的分类方法很多,根据疏水基结构进行分类,分直链、支链、芳香链、含氟长链等;根据亲水基进行分类,分为羧酸盐、硫酸盐、季铵盐、PEO衍生物、内酯等;有些研究者根据其分子构成的离子性分成离子型、非离子型等,按极性基团的解离性质分类1、阴离子表面活性剂:硬脂酸,十二烷基苯磺酸钠肥皂类。
系高级脂肪酸的盐,通式:(RCOOˉ)nM。
硫酸化物RO-SO3-M。
主要是硫酸化油和高级脂肪醇硫酸酯类。
磺酸化物R-SO3-M。
属于这类的有脂肪族磺酸化物、烷基芳基磺酸化物和烷基萘磺酸化物。
2、阳离子表面活性剂:季铵化物该类表面活性剂起作用的部分是阳离子,因此称为阳性皂。
其分子结构主要部分是一个五价氮原子,所以也称为季铵化合物。
其特点是水溶性大,在酸性与碱性溶液中较稳定,具有良好的表面活性作用和杀菌作用。
表面活性剂的分散与絮凝作用

在混凝土制造过程中,使用分散剂可以改善砂石 料的分散性,提高混凝土的工作性能和耐久性。
03
CATALOGUE
絮凝作用
ቤተ መጻሕፍቲ ባይዱ
絮凝作用原理
表面活性剂的吸附
表面活性剂通过吸附在固体颗粒表面 ,降低颗粒间的界面张力,使颗粒易 于聚集。
桥联与网捕作用
絮团的稳定性
絮团在形成过程中会受到外力作用, 如搅拌、流动等,其稳定性与絮团内 部结构和表面活性剂的性质有关。
THANKS
感谢观看
化妆品
用于制作洗发水、沐浴露、护 肤品等。
医药领域
用于药物的制备和给药系统, 如乳化剂、增溶剂等。
农业领域
用于农药的分散剂、乳化剂等 ,提高农药的利用率和防治效
果。
02
CATALOGUE
分散作用
分散作用原理
降低表面张力
表面活性剂能够降低水的 表面张力,使固体颗粒更 容易分散。
形成保护膜
表面活性剂吸附在固体颗 粒表面,形成一层保护膜 ,防止颗粒间的聚集。
总结词
改善涂膜性能
详细描述
表面活性剂作为分散剂可以改善涂膜的平滑性、硬度和耐 水性等性能。它们能够将颜料和填料均匀地附着在基材上 ,形成均匀一致的涂膜。
总结词
提高生产效率和降低成本
详细描述
使用表面活性剂作为分散剂可以简化生产流程和提高生产 效率,同时降低生产成本。由于颜料和填料的分散效果好 ,可以减少研磨时间和能耗,从而降低生产成本。
表面活性剂分子在多个颗粒间形成桥 联,将颗粒连接成较大的絮团。
絮凝剂的种类与特性
无机絮凝剂
如明矾、三氯化铁等,价格便宜,但使用后易产生二次污染。
有机高分子絮凝剂
表面活性剂知识点总结(1)

知识点回顾第1章:绪论1 表面活性剂的定义:指能显著降低水的表面张力的一类物质。
从结构上看均为两亲分子,即同时具有亲水的极性基团和憎水的非极性基团。
亲水基团进入水中,憎水基团企图离开水而指向空气,在界面定向排列。
2 表面活性剂的特征:降低表面张力(能力和效率);在界面形成定向单层;超过临界浓度后形成胶束;亲水-亲油平衡值(HLB);一般分子量为300-1000。
3 表面张力、克拉夫点、浊点的定义表面张力:垂直通过液面上任一单位长度,与液面相切的收缩表面的力,简称为表面张力,其单位为mN/m克拉夫点:离子型表面活性剂在温度较低时溶解度很小,但随温度升高而逐渐增加,当到达某一特定温度时,溶解度急剧陡升,把该温度称为克拉夫点浊点:浊点是非离子表面活性剂均匀胶束溶液发生相分离的温度4 典型表面活性剂的命名、代号与结构式,比如1831,1227,BS12,LAS,SAS,AS,AEO,AES等。
5 按照应用功能可分为乳化剂、洗涤剂、润湿剂、发泡剂、消泡剂、分散剂、絮凝剂、渗透剂及增溶剂等。
按结构组合分为普通型、双子(Gemini)型、Bola型、星型等。
6 表面活性剂绿色化四大要素:原料绿色化(采用无毒无害原料,提高制造过程及产品安全性)、制备工艺绿色化(采用原子经济反应实现制造过程零排放,减少反省步骤缩短制备流程,减少过程排放)、产品性能绿色化(改变分子结构提高安全性能,开发新型温和活性剂)、应用过程绿色化(微乳农药,微乳炼油替代消耗臭氧层物质及非臭氧层有机溶剂的水基清洗剂)。
举例阐述四大要素所代表的实际意义。
7 我国表面活性剂行业的现状与发展方向。
第2章:表面活性剂的作用原理1 表面张力的表达方式(力学和能量角度)和测定方法。
力学:f=2γl能量:dG=γdA测定方法:滴重法(滴体积法)、毛细管上升法、环法、吊片法、最大气泡压力法、滴外形法2 影响表面张力的因素:分子间作用力、温度、压力。
3 临界胶束浓度的测定方法。
胶体与表面化学课程大纲及重点

胶体与表面化学第一章绪论(2学时)1.1胶体的概念什么是胶体,胶体的分类1.2胶体化学发展简史1.3胶体化学的研究对象表面现象,疏液胶体,缔合胶体,高分子溶液。
重点:胶体、分散系统、分散相、分散介质的概念。
难点:胶体与表面化学在矿物加工工程中的作用及意义。
教学方法建议:启发式教学,引导学生对胶体及表面化学的兴趣。
第二章胶体与纳米材料制备(4学时)2.1胶体的制备胶体制备的条件和方法,凝聚法原理。
2.2胶体的净化渗析、渗透和反渗透。
2.3单分散溶胶单分散溶胶的定义及制备方法。
2.4胶体晶体胶体晶体的定义及制备方法2.5纳米粒子的制备什么是纳米材料,纳米粒子的特性及制备方法重点:胶体的制备、溶胶的净化、胶体晶体的制备。
难点:胶体制备机理。
教学方法建议:用多媒体教学,注重理论联系实际。
第三章胶体系统的基本性质(8学时)3.1溶胶的运动性质扩散、布朗运动、沉降、渗透压和Donnan平衡。
3.2溶胶的光学性质丁道尔效应和溶胶的颜色。
3.3溶胶的电学性质电动现象、双电层结构模型和电动电势(。
电势)3.4溶胶系统的流变性质剪切速度越切应力,牛顿公式,层流与湍流,稀胶体溶液的黏度。
3.5胶体的稳定性溶胶的稳定性、DLVO理论、溶胶的聚沉、高聚物稳定胶体体系理论。
3.6显微镜及其对胶体粒子大小和形状的测定显微镜的类型及基本作用重点:沉降、渗透压、电泳、电渗、。
电势的计算、双电层结构模型、DLVO理论、溶胶的聚沉。
难点:双电层结构模型。
教学方法建议:多媒体教学和板书教学相结合。
第四章表面张力、毛细作用与润湿作用(6学时)4.1表面张力和表面能净吸力和表面张力的概念、影响表面张力的因素、液体表面张力和固体表面张力的测定方法。
4.2液-液界面张力Anntonff规则、Good-Girifalco公式、Fowkes理论和液-液界面张力的测定。
4.3毛细作用与Laplace公式和Kelvin公式毛细作用,Laplace公式和Kelvin公式的应用,曲界面两侧的压力差及与曲率半径的关系,毛细管上升或下降现象,弯曲液面上的饱和蒸气压。
表面活性剂
·表面活性剂 ·表面活性剂在界面上的吸附
·胶束理论
·表面活性剂亲水亲油平衡问题
·表面活性剂作用及应用
第一节 表面活性剂概述
一、溶液的表面张力
2 cos h gr
H2O
C2H5OH (aq)
NaCl (aq)
溶液的表面张力不仅与温度、压力有关, 并且还与溶液的种类和浓度有关。
(三)两性表面活性剂
• 两性表面活性剂基本不刺激皮肤和眼睛;在相当宽的pH值 范围内都有良好的表面活性作用;它们与阴离子、阳离子、 非离子型表面活性剂都可以兼容。由于以上特性,可用作 洗涤剂、乳化剂、润湿剂、发泡剂、柔软剂和抗静电剂。
• 主要品种:甜菜碱衍生物、咪唑啉衍生物等。
(四)非离子表面活性剂 • 非离子表面活性剂因在水中不电离以及能够精细地改变分 子结构而具有独特的性质。 • 非离子表面活性剂去除油性污垢的能力很强,而且具有防 止污垢在合成纤维表面再沉积的能力。它们的临界胶束浓 度也比离子型表面活性剂低一到二个数量级。
B、脂肪醇聚氧乙烯醚硫酸盐(AES) • 脂肪醇聚氧乙烯醚硫酸盐又称脂肪醇硫酸盐。由于分 子中加入了乙氧基使其具有很多优点,如抗硬水性强, 泡沫适中而稳定,溶解性好。缺点是在酸性和强碱性 条件下不稳定,易于水解。 • AES采用C12~C14的椰油醇为原料,有时也用C12~C16 醇,与2 ~4分子环氧乙烷缩合。再进一步进行硫酸化, 中和可用氢氧化钠、氨或乙醇胺。
0 与c成对数关系 0
②当浓度小时
cB / c o cB ln(1 ) a a 0 cB =b =kcB 0 a
0 与c成线性关系 0
表面活性剂的分子结构: ①具有长碳链(碳原子数大于8)的极性有机化合物。 ②从结构上看,表面活性物质是两亲分子,一端亲水(-OH, -COOH,-SO3Na等),另一端亲油(憎水)(-R等)。 虽然表面活性剂分子是两亲性分子,但并不是所有的两亲 性分子都是表面活性剂,只有亲油部分足够长的两亲性物质 才是表面活性剂。
第五章 表面活性剂
5.1.2 表面活性剂的分子结构特点
分子结构具有不对称性,由非极性的(亲油的 或疏水的)碳氢链和极性的(亲水的或疏油的)基 团两部分组成,而且两部分通常分处分子链的两端。 例如棕榈酸钠(C15H31COONa)
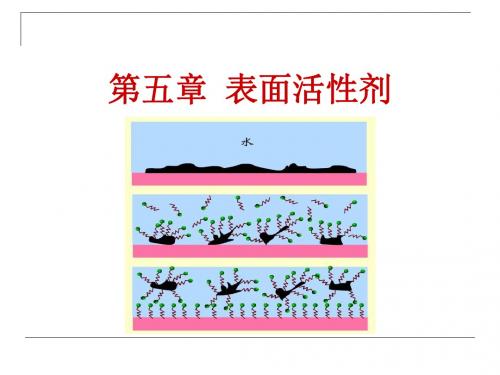
表面活性剂在水中随着浓度增大,表面上聚集 的活性剂分子形成定向排列的紧密单分子层,多余 的分子在体相内部也三三两两的以憎水基互相靠拢, 聚集在一起形成胶束,这开始形成胶束的最低浓度 称为临界胶束浓度。
==CH—
—(C3H6O)— 0.15 氧丙烯基 —CF2— 0.870 CF3—
5.2.2 相转型温度(PIT)
HLB值存在三个缺点:
一是它没有考虑到油相与水相本身的性能;
二是它没有考虑表面活性剂浓度的影响; 三是它没有考虑到温度及各相体积的影响。 针对HLB值的缺点,日本学者筱田耕三提出了相转 型温度PIT(Phase Inversion Temperature)的概念,
1.种类: 胺盐类、季铵盐类
2.结构:含有一个五价氮原子。
3.特点:水溶性大,在酸性和碱性溶液中较稳定具
有良好的表面活性和杀菌作用。 4.应用:杀菌;防腐;皮肤、粘膜手术器械的消毒。 5.常用药物:①苯扎氯铵(洁尔灭);②苯扎溴铵 (新 洁尔灭)
5.1.2.3 两性表面活性剂
分子结构上同时具有正负电荷基团的表面活性 剂,随介质的pH可成阳或阴离子型。 常用品种:卵磷脂、氨基酸型和甜菜碱型两性离子 型表面活性剂。 最大优点:适用于任何PH溶液,在等电点时也无沉 淀。 性质:碱性水溶液中呈阴离子性质,起泡性良好、 去污力亦强; 酸性水溶液中呈阳离子性质,杀菌 力很强,毒性小。
8~10 10~13 >13
在水中分散情况
第五章--表面活性剂

表面活性剂
5.1 概 述
5.1.1什么是表面活性剂
溶质的浓度对溶剂表面张力的影响有三种:
1)物质的加入会使溶剂表面张力略微升高,属于此类物 质的强电解质有无机盐、酸、碱等;
2)物质的加入会使溶剂的表面张力逐渐下降,如低碳醇、 羧酸等有机化合物; 3)物质少量加入就会使溶剂表面张力急剧下降,但降到 一定程度后,就变得很慢或几乎不下降。
1)高级脂肪醇与环氧乙烷加成物
ROH+ nCH2 CH2 O
NaOH Cat.
R O (CH2CH2O)n H
所用脂肪醇有:月桂醇、十六醇、油醇、鲸蜡醇等
2)烷基酚和环氧乙烷的加成物
R OH + nCH2 CH2 O R O (CH2CH2O)n H
所用烷基酚有:壬基酚、辛基酚、辛基甲酚等
3)脂肪酸与环氧乙烷的加成物
单酯盐 O
性质与硫酸酯盐相近,抗电解质、硬化能力较强,洗净能力 好,为低泡性表面活性剂。可作为净洗剂、润湿剂、乳化剂、 抗静电剂和抗蚀剂。缺点:污染环境、影响水质
5.1.3.2 阳离子表面活性剂
这类表面活性剂分为两类: (1)铵盐类表面活性剂,可由高级胺 (C12-18,伯、仲、叔)用盐酸或醋酸处 理而得:
特点:水溶性好,发泡能力强,去污力强;毒性低,对皮肤刺 激性小,有良好的生物降解性和抗微生物能力,优良的抗静电 性和柔软平滑性,与其它表面活性剂相容性好。但是价格较贵。
CH3 R N CH 2 COOCH3
+
5.1.3.4
非离子表面活性剂
亲水基为羟基-OH和醚键-O-
由于亲水性较弱,必须由几个羟基或醚键才能发挥
(1)按工业用途分类:
胶体与界面化学

生长过程消耗溶质量大,易形成大沉淀。 5、电动现象:①电泳:在外电场的作用下,带电胶粒在介质中定向移动②电渗:外电场作用下,分散介质通过 多孔膜或极细的毛细管而运动。 6、胶体表面电荷的来源:①电离②离子吸附③离子不等量溶解④晶格取代⑤摩擦带电 7、双电层理论:胶核的静电作用把溶液中的反离子吸附到其周围。①表面电势:②Stern 电势:stern 面的电势 ③电动电势:当分散相粒子和液体介质相对运动时,产生的电位差 8、 电势的影响因素:①无机盐浓度②PH③交换性阳离子 9、胶体的稳定性:DLVO 理论:①范得华引力势能②斥力势能 10、影响聚结稳定性的因素:反离子的价数:电解质的聚沉能力与反离子的 6 次方成反比。离子的大小:离子 半径越小,越易靠近颗粒表面,聚沉能力越强 11、空间稳定理论:颗粒表面高聚物的存在,会使颗粒间产生一种新的斥力势能,阻止胶粒聚集,称空间稳定 作用 第五章表面活性剂 1、亲水基:离子头、极性基团、EO 链。亲油基:烷基、PO 链、酯基 2、SAa 简述:I.阴离子 SAa:A:羧酸盐 B:磺酸盐 C:硫酸脂盐 D:磷酸脂盐 II.阳离子 SAaA:季铵盐 B:吡啶盐 9、临界胶团浓度是表面活性剂溶液开始大量形成胶团的浓度 10、同系物中,疏水链长增加,cmc↓ 11、无机盐使离子型 SAa 的 cmc 显著降低(反离子与胶团结合,电性的排斥作用削弱)对非离子型 SAa 的 cmc 影响不如对离子型 SAa 明显,电解质浓度较高时才产生可觉察效应。 12、HLB 值的概念:亲水亲油平衡值 (1)基团数法或基数法:HLB 值是由表面活性剂分子中各种结构基团贡献的总和,则每个基团对 HLB 值的贡献可 用数值表示,此数值称为 HLB 基团数(group number)或基数。 HLB=∑(亲水基团 HLB)-∑(亲油基团 HLB)+7 (2)质量分数法:对聚氧乙烯基的非离子型表面活性剂。计算式为: 亲水基质量 HLB= 20 亲水基质量 亲油基质量 13、Saa 的重要作用:加溶作用、润湿作用、乳化和破乳作用、分散和絮凝作用。
表面活性剂复习题

1,如何理解表面活性剂?(1)性能上:表面活性剂在加入量很少时即能明显降低溶剂(通常为水)的表面张力,能够产生润湿,乳化,起泡,增溶,分散,抗静电,柔软,聚沉,破乳,消泡等一系列作用(2)结构上:表面活性剂在结构上至少含有亲水基,连接基,亲油基,构型上:相同含量的元素,构型不同,表面活性剂性能不同(3)表面活性剂在溶液中存在状态:1)吸附现象:表面活性剂分子在稀溶液中,从体相内移动到界面,并在界面做定向排列,2)胶束现象,界面吸附和胶束的形成使的表面活性剂分子从无序变成有序状态,随着胶束的增多,溶液黏度增大,增溶,乳化,分散等能力增大2,总结磺酸盐型阴离子表面活性剂的结构与性质的关系1,烷基苯磺酸盐1,直链烷基磺酸钠,烷基取代基的碳原子数越少,烷基链越短,疏水性越差,易溶于水中,krafft点越高,2,表面张力:烷基中带有支链的表面活性剂的表面张力普遍较低A:在相同浓度下,R直链烷基,14n最低,12n其次,2—位带分支链,12v最低,14v其次,同时12个c时,12v最低,12tetra,其次<12n<12isoCmc;a,R直链烷基:16n最低(除18n外,随CH2个数升高,cmc下降b,2—位带分支链,随CH2个数增加,cmc下降C,同为12个c时,直链cmc低,有分支时,cmc较高3,润湿力:异构优于直链,亲水基位于长碳链中间更优,沉降时间越短,润湿性能越好(10n>14n>16n>18n)4,起泡性:相同浓度下,14n>12n>10n>16n>9n—6n>18n5,沉净力:随着直链烷基中碳原子数增多,洗净力逐渐提高,在各种不同异构体的12个C 中,12n洗净力最高2,α—烯烃磺酸盐1,溶解性:疏水基碳链越长,溶解度越低,含12个碳的最高,18个碳的最低2,表面张力:当含有15—18个C时,r较低,相同C时,α—烯烃磺酸盐最高3,去污力:在C>12,明显提高,在15—18内较高,>18时呈下降,直链烷烃苯基磺酸盐,含10—14个C时去污能力较高4,起泡力:含14—16个C的α—烯烃磺酸盐有较好的起泡力5,生物降解性:α—烯烃磺酸盐的生物降解性较高6,毒性:α—烯烃磺酸盐的毒性比直链的低,刺激性较小3,总结阳离子型表面活性剂的分类,性质,特点及主要应用答:分类:胺盐型、季铵盐型、杂环型、鎓盐型特性:性质:(1)溶解性一般具有较好的水溶性,a,但随烷基碳链长度的增加,水溶性呈下降趋势,b,铵盐型比阴离子型水溶性弱一些,c,季铵盐分子中,单长链:CH2个数增加,溶于酸性溶剂双长链:不溶于水,但溶于非极性溶剂(2)Krafft温度点Krafft点越高,溶解性越差,3)表面活性随着烷基碳链长度的增加,表面张力下降,且在一定范围内,表面张力随表面活性剂的浓度升高而降低,降到一定数值后又随浓度的升高而增加4)临界胶束浓度随着烷基碳链的增长,cmc降低,与阴离子更易聚集形成胶束,特点:在水溶液中呈现正电性,能形成携带正电荷的表面活性离子阳离子表面活性剂应用:用作消毒杀菌剂、腈纶匀染剂、抗静电剂、矿物浮选剂、相转移催化剂和织物柔软剂4,简述影响氧化反应的主要因素和规律影响因素1,原料的影响:a,环氧化物的影响,环氧乙烷最快,R越长,反应速率越低,b,含活泼氢原料的影响:给出氢原子的能力越弱,反应活性越高,1,碳链长度增加,醇的活性降低,反应速率减慢,2,按羟基位置不同反应速率为伯醇>仲醇>叔醇,3,在酚类反应物中,取代基的影响按下顺序递减CH3O—>CH3—>H—>Br—>—NO22,催化剂的影响:a,酸性比碱性催化时反应效率快80—100倍,b,碱性强弱会影响速率,即碱性越强,催化剂反应速率越快,不同的碱性催化剂催化下的反应速率为:KOH>CH3ONa>C2H5ONa>NaOH>K2CO3>Na2CO3, 3,一般情况下催化剂浓度增高,反应速率加快。
第五章胶体

二、电解质的聚沉作用 1、电解质的聚沉作用 电解质对溶胶的稳定性十分敏感,加入少 量的盐就会使溶胶聚沉。例如在制豆腐时, 豆浆溶胶中加入少量的石膏电解质时即形 成凝胶,凝胶压出部分水后即为豆腐。一 般情况下加入电解质与溶胶的含量不存在 化学计量关系,而是通过对溶胶扩散双电 层中离子的压缩作用,使其产生聚沉的。
2、吸附离子作用
这是由于固体表面对电解质正负离 子不等量吸附而获得电荷,有些物 质在水中不能电解,但是可以在水 中吸附H+,OH-或其它离子,从而使 粒子带电。如石墨、纤维。胶体粒 子的带电现象多数属于这类类型
影响吸附带电的因素 a 、水化离子强的离子往往留在溶液中,水化能力 弱的离子则容易被吸附于固体表面,所以固体表 面带负电的可能性较比带正电荷的可能性大 b 实验证明,凡是与胶体粒子的组成相同的离子最 容易被吸附。例如AgNO3与KBr制备AgBr溶胶时, AgBr AgBr粒子最容易表面吸附Ag+或Br-离子而对K+, Ag Br K NO3-的吸附就很弱。这是因为AgBr晶体粒子表 面上容易吸附继续形成结晶离子的离子。至于 AgBr粒子的带电性质,取决于溶液中Ag+和 Br-离子的过量情况。这种规律称为Fajans规则。
(4)离子平衡 把硝酸银溶液加入到稀的氯化物溶液中,可 生成氯化银溶胶:
AgNO3 + NaCl(稀) AgCl + NaNO3
其中AgNO3应过量,否则AgCl沉淀上无反离 子吸附。用化学凝聚法制备溶胶时不必外 加稳定剂。这是因为胶粒表面选择吸附了 具有溶剂化层的离子而带上电荷,因而变 得稳定。但溶液中离子的浓度对溶胶的稳 定性有直接的影响。如果离子的浓度过大, 反而会引起溶胶的聚沉。
第五章 胶体的制备、纯化、电学性质 第一节 胶体的制备 一、分散法 1、研磨法
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H
在质点间距离很小和很大时,相互作用能 (V)以吸引能为主,体系易形成絮凝体; 当质点间距离处于中等程度时,相互作用 能以排斥能为主,质点处于分散稳定状态。
V-H曲线上存在两个极小能量值,即第一和第二极小值 和一个势垒,势垒是质点凝聚或絮凝的最大障碍。
当粒子的动能大于势垒时方能聚沉
若要使体系处于分散稳定状态就需要设法升高此势 垒增加排斥能,加大质点间距离。反之,则增加其吸引 能而形成絮凝体。
②ζ电位的符号标志胶粒带电的性质(即电荷的正负)。 ③ζ电位值的大小还可以反映扩散层的厚度。ζ值增大,则扩 散层变厚;反之,则扩散层变薄。
④ 胶粒的电泳速率与ζ电势的关系:
E r 4
ε:分散介质的介电常数 η:分散介质的粘度 E : 外加电场强度
5.4 胶体的稳定性
胶体由于具有巨大的表面能,因此是热力学不 稳定体系,但在某些条件下,也能稳定的存在一段 时间。胶体的稳定是相对的、暂时的和有条件的, 而不稳定则是绝对的。 影响溶胶稳定性的因素
• 为了降低表面能,当两个或多个胶体粒子相互 接触时合并出成一个较大的颗粒,如此下去将 使溶胶失去原来的表观均一性而沉淀,这一过 程称为溶胶的聚沉。聚沉是胶体粒子的简单堆 积过程。
5.4.2 胶体的聚沉理论-DLVO理论 (Deijaguin-Landau-Verwey-Ovenbeek) (1) 质点间的范德华吸引能
• ζ电位是表面电位χ的一部分。ζ电位决定着胶粒带电的大 小,决定着胶粒在电场中的运动。外加电解质的种类和 浓度会明显影响ζ电位,不仅影响其大小,还会改变它的 符号。ζ电位具有以下几方面的意义:
①ζ电位值的大小是胶粒带电程度的标志。ζ值越大,表面滑 移界面处的电位与溶液内部的电位差越大,即胶粒带电量 越大;反之,ζ值越小,即胶粒带电量越小。ζ=0,胶粒 不带电,即等电状态。在等电状态,紧密层中的反离子电 荷等于表面吸附离子的电荷。
胶粒之间的相互作用可看作是分子作用的加和
若两个球形粒子体积相等
A r Va 12 H
H: 两球表面之间的最短距离 r : 胶粒半径 A:Hamaker常数 (与物质有关 10-19~10-20 J) 在介质中, 2
A ( A质点 A介质 )
ห้องสมุดไป่ตู้
(2) 双电层的排斥能 对球形粒子
Vr
关于高分子化合物对溶胶的稳定性作用,大致有以下规律:
(1)具有最少量的能盖住溶胶粒子固体表面的该分子化合物 才有稳定作用。
(2)溶胶被保护以后,它的物理化学性质与所加入的高分子 物质性质相近。
(3)因为高分子在溶胶表面上吸附要有一定时间,所以加的 方法和混合次序对溶胶稳定性都有影响。
5.5.3 表面活性剂的分散稳定作用
②同价反离子,水化离子半径越小,聚沉值越小, 即聚沉能力越大。一价正离子的聚沉能力顺序: H+>Cs+>Rb+>NH4+>K+>Na+>Li+ 一价负离子的聚沉能力顺序: F->IO3 - >H2PO4 - >BrO3 - >Cl - >ClO3 - >Br - >I 上述这种顺序称为感胶离子序。
Stern扩散双电层模型
紧密层(Stern层) + + + + + + + + + + + - - - - - - 滑移界面(Stern面)
φs
ζ
-
- - - -
φs 为Stern电势:Stern平面与 溶液内部的电势差 为电动电势:滑移面与溶液内部 的电势差
-
反离子
溶剂分子
扩散层
1947 年,格拉哈姆(D C Grahame)又作了进一步 改进。他认为离子在固体表面上还可能存在化学吸附, 被吸附后溶剂化去除,因而在电极表面上有两个赫姆霍 茨平面。
+ + + + + φ0 + ζ电势 + + +
_
_ _ _
φ0 为表面电势:带电质点表面 与溶液内部的电势差 为电动电势:滑移面与溶液内部 的电势差
_
_ _ _ _
扩散层
_
紧密层
Gouy-Chapman 扩散双电层模型
继查普曼之后,1924年,斯特恩(O.Stern)将赫姆霍茨 模型和查普曼模型结合起来,他考虑到一部分水化正离子 是以紧密吸附的形式,聚集在赫姆霍茨平面上;而其余则 形成扩散双电层。此模型与赫姆霍茨模型和查普曼模型的 一个主要区别在于它把吸附在固体表面上的离子看成是固 定在固体表面的一部分而不是流动的。同时,它考虑到离 子特别是水合离子占有一定体积而不是点电荷。
(4)晶格取代 黏土是由铝氧八面体和硅氧四面体的晶格股价组成, 其中的Al3+或Si4+往往被一部分低价的Mg2+和Ca2+所取 代,形成类质晶,结果使黏土晶格带负电,为维持电中 性黏土表面就吸附了一些正离子,而这些正离子在水中 因水化而离开表面,于是黏土粒子带负电,晶格取代是 黏土粒子带电的一种特殊情况,在其他溶胶中是很少见 的。
表面活性剂浓度较高时:在电性中和的粒子上再吸附了 第二层表面活性剂离子,固体颗粒又重新带电,静电斥力导 致固体颗粒的重新分散。
第五章 表面活性剂的分散与絮凝作用
5.1 分散体系和胶体 ( dispersed system and colloid)
一种或多种物质分散在另一种物质中所构 成的体系称为分散体系。前者称为分散相,后 者称为分散介质。
分散体系的分类:
分 散 体 系 均相分散体系 (溶液、气体混合物) 粗分散体系(d >10-7m)
5.3 扩散双电层理论
当固体表面带电以后,由于静电吸引,固体表面的电 荷吸引溶液中带相反电荷的离子,使其向固体表面靠拢。 被静电吸引的带相反电荷的离子称为反离子。反离子处在 溶液中,距固体表面一定距离,构成了所谓双电层。
最早提出见解的是赫姆霍茨(Helmholtz) 虽然这一模型在数学上较易处理,但未免过于 简化。
H 2SiO3
SiO +2H +
2_ 3
(2)胶核的选择吸附 胶核的比表面很大,很容易吸附溶液中的离子。实 验表明,与胶粒具有相同组成的离子优先被吸附。
(3)离子晶体的溶解 由离子型的固体物质所形成的溶胶具有两种电荷相反 的离子。如果这两种离子的溶解是不等量的,那么溶胶的 表面上也可以获得电荷。如果正离子的溶解度大于负离子, 则表面带负电;相反,则表面带正电。 对于金属氧化物和氢氧化物的溶胶,决定溶胶电荷性 质的主要取决于氢离子和氢氧根离子的浓度。
图上画出被化学吸附的去水化负离子,它的中心连线形成的平面称 为内赫姆霍茨平面,以 IHP 表示。而由于静电作用吸附在表面上的水化 正离子的中心连线形成的平面称为外赫姆霍茨平面,以 OHP 表示。在此 以内至电极表面称为紧密层,在此以外延伸至本体溶液,称为扩散层,扩 散双电层即由紧密层和扩散层共同构成。其电势分布如上图右所示。其中 ψ 为热力学电势,ζ(Zeta) 称为扩散层电势,(ψ-ζ) 为紧密层电势。
(5)摩擦带电 在非水介质中,溶胶粒子的电荷来源是粒子与介质 间的摩擦,就像玻璃与毛皮摩擦可以带电一样。两相在 接触时对电子有不同亲和力,这就使电子由一相流入另 一相。 一般来说,由两个非导体构成的分散体系中,介电 常数较大的相将带正电,另一相带负电。例如玻璃小球 (=5~6)在水( =81 )中带负电,在苯( =2 ) 中带正电。
64n0 k T
2 0
2
exp( H )
ze 0
0
e
ze 0
2 kT 2 kT
1 1
e
n0 : 单位体积粒子数 ε: 介电常数 ψ0:粒子表面电势 κ: 离子氛半径的倒数 r : 粒子半径 H : 离子之间的最近距离
(3) 总的势能曲线
V Va Vr
V
势垒
溶胶的相对稳定性或 聚沉取决于斥力势能和引力 势能的相对大小。当斥力势 能大于引力势能时,溶胶处 于相对稳定状态;当斥力势 能小于引力势能时,溶胶将 发生聚沉。
ζ 电位及其意义
• ζ电位的概念:胶核表面由于吸附或电离而带电,于是胶 核表面上的电位与溶液内部不同,二者之差称为表面电 位,用符号χ表示。χ只与被吸附的或从表面电离下去的 那种离子在溶液中的活度有关。紧密层随固体粒子一起 运动,所以胶粒的实际表面不在胶核表面而在紧密层的 外沿,此处是胶粒与介质相对运动的界面,称滑移界面。 滑移界面与溶液内部(胶核表面)的电位差叫ζ电位。
(1) 溶胶的动力稳定因素
(2) 胶粒带电的稳定作用 (3) 溶剂化的稳定作用
5.4.1 胶体的老化与聚沉
• 老化的概念:新制备的溶胶,固体颗粒极细。但静置一 段时间后,胶粒便会自动长大。若在高温下静置,这种 现象尤为明显。老化是小粒子溶解,越来越小,直至消 失,而大粒子越来越大的过程。这种靠小粒子溶解而使 大粒子逐渐长大的过程叫做老化。
5.5.2 高分子化合物对溶胶的稳定作用
在溶胶中加入少量高分子化合物可使溶胶聚沉,称为敏化作用 (絮凝作用)。
在溶胶中加入足够多的高分子化合物或缔合胶体,则会阻止溶胶 的聚沉,称为空间保护作用。
产生稳定作用的原因是高分子化合物吸附在溶胶粒子的表面上, 形成一层高分子保护膜,包围了胶体粒子,把亲液性基团伸向水中, 并具有一定的厚度,所以当胶体质点在相互接近时的吸引力就大为削 弱,而且有了这一层粘稠的高分子膜,还会增加相互排斥力,因此增 加了胶体的稳定性。
不足:只反映出带电质点在溶液中 的电性平衡,没有反映出溶液中离 子的热运动特性。
Helmholtz平行板电容器模型
现在的看法是形成扩散双电层,其中较紧密地固定在固体表面上 的部分称为紧密层,另外部分称为扩散层。这种“扩散双电层”的概 念最早由查普曼(chapman)提出,而在此以后逐步完善。具体图象下 图中所示。 滑移面 (切动面)
