键参数——键能键长与键角
键参数——键能、键长与键角

§2-2 键参数——键能、键长与键角【学习目标】1、初步了解键能、键长、键角的概念,能根据其数据认识共价键的强弱;2、了解键能的应用—与反应热、分子稳定性的关系。
【重、难点】键参数及其应用一、键参数包括____________、____________、________________1.键能(1)定义:___________原子形成________mol化学键释放的______能量。
(2)单位:_____________ 通常取_________如H—H键的键能是436.0kJ·mol-1,表示_______________________________________。
(3)意义①表示共价键的强弱:原子形成共价键时,轨道重叠程度______,体系能量降低______,释放出的能量_______,形成的共价键的键能_______,共价键__________。
②表示分子的稳定性:键能_________,分子越_________。
-1分解为气态原子时,需要(填)能量;2(2)1mol H2在2 mol Cl2中燃烧,放出的热量kJ;(3)由表中所列化学键形成的单质分子中,最稳定的是,最不稳定是,形成的化合物分子中,最稳定的是,最不稳定的是;(4)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是__________________________________;(5)预测1mol H2在足量F2中燃烧比在Cl2中放热。
【归纳】键能的应用——反应热与键能的关系由键能求反应热的公式为:△H =____________的键能总和—____________的键能总和2.键长:(1)概念:形成共价键的两个原子之间的________________相同原子的共价键键长的一半称为_____________(2)意义:一般来说,键长______,键能就_______,键就_______,分子就_________,受热时就________,热稳定性_________。
2020-2021学年高中化学新人教版选择性必修2 :2.1.2第二课时 键参数——键能、键长与键角

第二课时键参数——键能、键长与键角1.下列说法正确的是()A.键角决定了分子的结构B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定C.CH4、CCl4中键长相等,键角不同D.C===C键的键能是C—C键的键能的两倍2.下列说法中正确的是()A.乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍B.N—O键的极性比C—O键的极性大C.氮气分子中含有1个σ键和2个π键D.NH+4中4个N—H键的键能不同3.已知X—X、Y—Y、Z—Z键的键长分别为198 pm、74 pm、154 pm,则它们单质分子的稳定性是()A.X2>Y2>Z2B.Z2>Y2>X2C.Y2>X2>Z2D.Y2>Z2>X24.等电子体的结构相似、物理性质相似,下列各对粒子中,空间结构相似的是() A.SO2与O3B.CO2与NO2C.CS2与NO2D.PCl3与BF35.根据等电子原理,下列各组分子或离子的空间构型不相似的是()A.NH+4和CH4B.H3O+和NH3C.NO-3和CO2-3D.CO2和H2O6.三氯化磷分子的立体构型是三角锥形而不是平面正三角形。
下列关于三氯化磷分子的叙述,不正确的是()A.PCl3分子中三个共价键的键长、键角都相等B.PCl3分子中的P—Cl键属于σ键C.PCl3分子中三个共价键的键能、键角均相等D.PCl3分子中三个共价键的键角均为120°7.已知H—H键能为436 kJ·mol-1,H—N键能为391 kJ·mol-1,1 mol N2与足量H2反应放出的热量为92.4 kJ·mol-1,则N≡N键的键能是()A.431 kJ·mol-1B.945.6 kJ·mol-1C.649 kJ·mol-1D.896 kJ·mol-18.N2的结构可以表示为,CO的结构可以表示为,其中椭圆框表示π键,下列说法中不正确的是()A.N2分子与CO分子中都含有三键B.CO分子与N2分子中的π键并不完全相同C.N2与CO互为等电子体D.N2与CO的化学性质相同9.美国科学家合成了含有N+5的盐类,N+5的结构呈V形,如图所示(图中箭头代表单键)。
键参数(键能、键长与键角课件高二化学

1s2 2s2 2p6 3s2 3p5
×
×
HCl的形成的电子云描述
s轨道呈球形对称,p轨道呈哑铃形, 只有当沿着键轴方向以“头碰头”靠拢后重叠,才能实现原子轨道最大重叠。
③ p - p σ 键 Cl-Cl的 p-p σ键的形成(一个p轨道与一个p轨道重叠) 用原子轨道描述2个氯原子形成Cl2分子的过程。
自旋相反的未成对电子形成共用电子对 。
二.共价键的特征
1.饱和性 按照现代价键理论中的电子配对理论, 一个原子有几个未成对电子,
便可和几个自旋相反的电子配对成键,这就是共价键的
;如果原子没有
未成对电子,则不能形成共价键。
H· + ·H H:H H + Cl
H Cl
↑
↓
↑ ↑↓ ↑↓ ↑↓ ↓
1S
1S
原因:由于原子半径小,键长短,但由于键长短,两原子形成共价 键时,原子核之间的距离小,排斥力大,键能小
4.键长判断方法
根据原子半径判断
其他条件相同时,成键原子的半径越小,键长越短。 如键长:H-I > H-Cl>H-F;Br-Br>Cl-Cl>F-F;Si-Si>Si-C>C-C。
根据共用电子对数目判断
元素 电负性 电负性差值
非极性键
Na Cl 0.9 3.0
2.1
H Cl 2.1 3.0
0.9
CO 2.5 3.5
1
0
0.9
1.7
2.1
电负性的差值
H和Cl的电负性的差值
Na和Cl的电负性的差值
知识回顾 化学键: 元素相互化合,分子内相邻的原子之间的强烈相互作用力。
比较 类型
离子键
【化学课件】键参数—键能、键长与键角 2023-2024学年高二下学期人教版(2019)选择性必修2

注意:甲烷中四个碳氢键键能相同吗? 不同 键能数据是平均值
C—H键能 413.4 kJ·mol-1
一、键能
2.应用 (1)定量衡量共价键强弱
键能越大,共价键越牢固。EH-F>EH-Cl>EH-Br>EH-I (2)判断分子的稳定性
一般结构相似的分子,键能越大,分子越稳定。 (3)利用键能估算化学反应热效应
ΔH=反应物的总键能-生成物的总键能。
H2(g) + Cl2(g) = 2HCl(g) ΔH =436.0 kJ·mol-1 + 242.7 kJ·mol-1 -2×431.8 kJ·mol-1
= -184.9 kJ·mol-1
某些共价键键能/kJ·mol-1
一、键能
思考交流
1.正误判断 (√1)N—H的键能是很多分子中的N—H的键能的平均值 (√2)O—H的键能是指在298.15 K、101 kPa下,气态分子中1 mol O—H解离成气 态原子所吸收的能量 (×3)C==C的键能等于C—C的键能的2倍 (×4)σ键一定比π键牢固
(1)1 mol H2在2 mol Cl2中燃烧,放出热量__1_8_4_._9__kJ。 (2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多 到少的顺序是__a__(填字母)。
a.Cl2>Br2>I2
b.I2>Br2>Cl2
c.Br2>I2>Cl2
预测1 mol H2在足量F2中燃烧比在Cl2中燃烧放热_多___(填“多”或“少”)。
思考交流
二、键长
1.概念 构成化学键的两个原子的核间距; 原子半径决定共价键的键长,原子半径越小,共价键的键长越短。
二、键长
2.应用 一般键长越短,键能越大,表明共价键越稳定,反之亦然。
键参数—键能、键长与键角课件-高二化学人教版(2019)选择性必修2

【问题引入】 1.分析下表:1000℃时,卤化氢分解率,你能得出什么结论?
结论:HCl、HBr、 HI越来越易分解
卤化氢
HCl
HBr
HI
分解的百分数/%
0.0014
0.5
33
说明:①卤化氢的热稳定性大小为:
HCl>HBr > HI
②H-Cl、H-Br、H-I中的 σ键牢固。
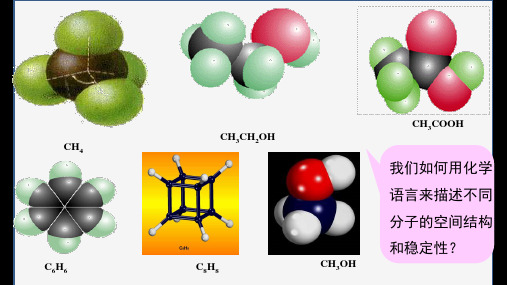
2.共价键的强弱用什么来衡量?我们如何用化学语言来描述不同分子
如分子的稳定性:HF>HCl>HBr>HI。
(3)判断化学反应中的能量变化
∆H=∑E(反应物键能)-∑E (生成物键能
)
ΔH<0时,放热反应;ΔH>0时,吸热反应
课堂练习1.根据下表中的H—X键的键能回答下列问题:
共价键
H—F H—Cl
键能/kJ·mol-1
568
431.8
H—Br
H—I
366
298.7
B.键长越短,键能越大
C.成键所用的电子数越少,键能越小
D.成键时电子对越偏移,键能越大
课堂练习4.有关化学键的键能如表所示,简要分析和解释下列有关事实:
化学键
键能/
(kJ·mol-1)
C—C N—N O—O O==O O—H S—H Se—H N—H As—H
347.7
193
142
497.3 462.8 363.5
—
≡
—
≡
193
946
197
489
从能量角度看,氮以 、而白磷以 (结构式可表示为
)形式
存在的原因是:______________
1molN≡N 键能大于3molN-N键能之和,而1molP≡P键能小于3molP-P键能
键参数——键能、键长与键角
归纳总结
共价键稳定性强弱的判断方法 (1)根据原子半径和共用电子对数目判断:成键原子的原子半径 越小,共用电子对数越多,共价键越牢固,含有该共价键的分 子越稳定。 (2)根据键能判断:共价键的键能越大,共价键越牢固,破坏共 价键消耗的能量越多。 (3)根据键长判断:共价键的键长越短,共价键越牢固,破坏共 价键所消耗的能量越多。
2.N2、O2、F2与H2的反应能力依次增强,从键能的角度如何理解这一化 学事实。(利用课本P37表2-1的相应数据分析)
已 知 N—N 、 N==N 和 N≡N 的 键 能 之 比 为 1.00∶2.17∶4.90 , 而 C—C 、 C==C、C≡C的键能之比为1.00∶1.77∶2.34。如何用这些数据理解氮分 子不容易发生加成反应而乙烯和乙炔容易发生加成反应?
CH4 C6H6
CH3CH2OH C8H8
CH3OH
CH3COOH
我们如何用化学 语言来描述不同 分子的空间结构 和稳定性?
第二章
键参数——键能、键长与键角
1Байду номын сангаас键能
一、键参数——键能、键长与键角
键能是气态分子中断裂1 mol化学键解离成气态原子所吸收的能量。 或气态基态原子形成1 mol化学键释放的最低能量。键能通常取正值,单 位是kJ/mol。键能通常是298.15 K、101 kPa条件下的标准值。
键能可用于估算化学反应的热效应,如H—H键、F—F键、H—F键的 键能分别为436 kJ·mol-1、157 kJ·mol-1、568 kJ·mol-1,则H2与F2反应是放热 反应。
2.键长
键长是指形成共价键的两个原子之间的核间距。因此原子半径决定化 学键的键长,原子半径越小,共价键的键长越短。 化学键的键长与键能是相关的。例如,C—C键、C=C键、C≡C键的键长分 别为154 pm、133 pm、120 pm,键长越来越小,它们的键能分别为347.7 kJ·mol-1、615 kJ·mol-1和812 kJ·mol-1,越来越大。 共价键的键长越短,往往键能越大,表明共价键越稳定。
第一节 共价键第2课时 键参数——键能、键长与键角

第一节共价键第2课时键参数——键能、键长与键角1.下列事实不能用键能的大小来解释的是()A.N元素的电负性较大,但N2的化学性质很稳定B.稀有气体一般难发生化学反应C.HF、HCl、HBr、HI的热稳定性逐渐减弱D.F2比O2更容易与H2反应答案B解析由于N2分子中存在三键,键能很大,破坏共价键需要很大的能量,所以N2的化学性质很稳定;稀有气体都为单原子分子,分子内部没有化学键;卤族元素从F到I原子半径逐渐增大,其氢化物中的化学键键长逐渐变长,键能逐渐变小,所以热稳定性逐渐减弱;由于H—F的键能大于H—O的键能,所以二者相比较,更容易生成HF。
2.下列说法正确的是()A.在分子中,两个原子间的距离叫键长B.非极性键的键能大于极性键的键能C.键能越大,表示该分子越容易受热分解D.H—Cl的键能为431 kJ·mol-1,H—I的键能为297 kJ·mol-1,这可说明HCl分子比HI分子稳定答案D解析形成共价键的两个原子的核间距为键长,A项不正确;键能的大小取决于成键原子的电负性,与键的极性无必然联系,B项不正确;键能越大,分子越稳定,C项不正确、D项正确。
3.下列单质分子中,键长最长,键能最小的是()A.H2B.Cl2C.Br2D.I2答案D解析键长与原子的半径有关,原子半径越大,形成的分子的键长越长;键能与得失电子的难易有关,得电子越容易,键能越大。
四种原子中,I的原子半径最大,且得电子最难,故D 项正确。
4.关于键长、键能和键角,下列说法错误的是()A.键角是描述分子空间结构的重要参数B.键长是形成共价键的两原子的核间距C.键能:H—I>H—Br>H—ClD.键角的大小与键长、键能的大小无关答案C解析键角是描述分子空间结构的重要参数,如CO2中的2个C==O的键角为180°,故分子为直线形分子,A正确;键长是形成共价键的两个原子的核间距,B正确;键角的大小取决于成键原子轨道的夹角,D正确。
键参数

CO2,键角:180°,直线型 分子
5/16/2013
H2O,键角;105°,V形分 子
CH4,键角: 109°28′,正四面体 形分子
NH3,键角:107°18′,三棱锥形分子
5/16/2013
键角是描述分子立体结构的重要参数。多原分 子的键角一定,表明共价键具有方向性(共价 键的方向性是指原子之间按照一定的方向形成 作用力)。 规律:三原子分子的立体结构有直线形 和V形两种; 四原子分子大多采取平面三角形和 三角锥形两种立体结构; 五原子分子最常见的立体结构是四 面体形。
二、键长 概念:形成共价键的两个原子之间的核间距。除 了键能,键长也能衡量共价键的稳定性。
键 键长(pm) 键能 (kJ/mol) 键 键长(pm) 键能 (kJ/mol)
H-H
74
436.0
C-C
154
347.7
F-F
Cl-Cl Br-Br I-I
5/16/2013
141
198 228 267
157
形成1mol N=O键释放的最低能量为607kJ 这些能量就是相应化学键的键能,如H-H键的键 能为 436kJ/mol,N=O键的键能是 607kJ/mol 键能的单位是 kJ/mol ,且键能通常为正值。
5/16/2013
某些共价键的键能
键 键能(kJ/mol) 键 键能(kJ/mol)
H-H F-F Cl-Cl Br-Br I-I C-C C=C C≡C C=O N=N 5/16/2013
5/16/2013
等电子原理
5/16/2013
等电子原理:原子数相同、价电子总数相同的 分子、离子戒基团(即等电子体),具有相似 的化学键特征,它们的许多化学性质相近,我 们把这一原理叫做等电子原理。
高二化学键参数2
3.通过上述例子,你认为键长、键能对分子的 化学性质有什么影响?
汇报
1.形成2 mo1HCl释放能量: 2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ 形成2 mo1HBr释放能量: 2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ HCl释放能量比HBr释放能量多,因而生成的HCl更
则 N N键能为946 kJ/mol
某些共价键的键能
•[观察分析]键能大小与化学键稳定性的关系?
键能越大,化学键ቤተ መጻሕፍቲ ባይዱ稳定
2. 键长:形成共价键的两个原子之间的核间距
某些共价键键长
•1pm=10-12 m
[观察分析]键长与键能的关系?
键长越短,键能越大,共价键越稳定。
;温州乐清包船捕鱼 温州乐清包船捕鱼 ;
3. 键角:两个共价键之间的夹角称为键角。
分子的形状有共价键之间的夹角决定如:三原子分子CO2的结 构式为O=C=O,它的键角为180°,是一种直线形分子;如, 三原子分子H20的H—O—H键角为105°,是一种 V形分子。
多原子分子的键角一定,表明共价键具有方向性。键角是描述 分子立体结构的重要参数,分子的许多性质都与键角有关。
键参数——键能、 键长与键角
二、键参数:键能、键长、键角
1. 键能: 气态基态原子形成l mol化学键释放的最低能量。 通常取正值。单位:kJ/mol
如,形成l mol H—H键释放的最低能量为436.0 kJ,
则 H—H键能为436.0 kJ/mol
形成1 molN N键释放的最低能量为946 kJ
键参数

键角一定,表明共价键具有方向性。键角是描述分子 立体结构的重要参数,分子的许多性质与键角有关。
小 结
键参数对分子性质的影响
课堂练习 1.能够用键能解释的是( ) A.常温常压下,溴呈液体,碘为固体 B.氮气的化学性质比氧气稳定 C.稀有气体一般很难发生化学反应 D.硝酸易挥发,硫酸难挥发
2、规律
(1)同种类型的键,成键原子半径越小,键 能越大,键越牢固。 (2)相同的成键元素之间形成的键越多,键能 越大。
3、键能的运用
(1)通过键能判断物质反应活性
思考:为什么非金属性N强,但N2却很稳定? 思考:34页 习题4
思考:利用键能,解释乙烷、乙烯、乙炔的 反应活性?
C-C 154 347 C=C 134 598 C≡C 120 820
性质
相近
2、常见的等电子体: N2 SO2 CO O3 C22NO2CN-
书写等电子体方法: 等量代换
(1)同族代换 (2)同周期代换:注意“+e- ”“- e- ”
2、常见的等电子体: N2 SO2 SO3 C 6H 6 CO O3 NO3B 3N 3H 6 C22NO2SiO32CN-
NO2
键长( pm ) 键能( kJ/mol )
(2)求近似反应热。
思考:32页思考交流 1、2
(二)键长:
1、定义:形成共价键的两个原子的核间距。 思考:从以下数据中可以得到什么结论:
¼ ü ¼ ¤¼ ¨ pm ¼ ¼ ü ¼¼ ¨ kJ/mol ¼ H-F 92 567 H-Cl 128 431 H-Br 141 366 H-I 161 298
键长( pm ) 键能( kJ/mol )
C-C 154 347
高二化学键参数2
共价半径: 相同原子的共价键键长的一半称为共价半径。
思考与交流
1. 试利用表2—l的数据进行计算,1 mo1 H2分 别跟l molCl2、lmolBr2(蒸气)反应,分别形成2 mo1HCl分子和2molHBr分子,哪一个反应释放的能 量更多?如何用计算的结果说明氯化氢分子和溴化 氢分子哪个更容易发生热分解生成相应的单质?
稳定,即HBr更容易发生热分解生成相应的单质. 2. 键能大小是:F-H>O-H>N-H 3. 键长越长,键能越小,键越易断裂,化学性
质越活泼。
CO分子和N2分子的某些性质
等电子原理:
原子总数相同、价电子总数相同的分子具有 相似的化学键特征,它们的许多性质是相近 的
3. 键角:两个共价键之间的夹角称为键角。
分子的形状有共价键之间的夹角决定如:三原子分子CO2的结 构式为O=C=O,它的键角为180°,是一种直线形分子;如, 三原子分子H20的H—O—H键角为105°,是一种 V形分子。
多原子分子的键角一定,表明共价键具有方向性。键角是描述 分子立体结构的重要参数,分子的许多性质都与键角有关。
;
够抵御的风险毕竟有限,世上无法预计的灾难却是无限的。战胜灾难靠的更多的是临门一脚,先前的惴惴不安帮不上忙。 当风暴的尾巴终于远去,我们守住零乱的家园。气还没有喘匀,新的提醒又智慧地响起来,我们又开始对未来充满恐惧的期待。 人生总是有灾难。其实大多 数人早已练就了对灾难的从容,我们只是还没有学会灾难间隙的快活。我们太多注重了自己警觉苦难,我们太忽视提醒幸福。请从此注意幸福!幸福也需要提醒吗? 提醒注意跌倒……提醒注意路滑……提醒受骗上当……提醒荣辱不惊……先哲们提醒了我们一万零一次,却不提醒我 们幸福。 也许他们认为幸福不提醒也跑不了的。也许他们以为好的东西你自会珍惜,犯不
课件 键参数——键能、键长与键角

知识总结
键能 键参数 键长
键角
决定 分子的稳定性 决定
分子的空间结构
决定 分子的性质
键参数对分子性质的影响: 相同类型的共价化合物分子,成键原子半径 越小,键长越短,键能越大,分子越稳定。
效果反馈
1.下列说法中,错误的是 ( B ) A.键能是衡量化学键稳定性的参数之一,键能越大,化学键越牢固 B.键长与共价键的稳定性没有关系 C.键角是两个相邻共价键之间的夹角 D.共价键是通过原子轨道重叠并共用电子对而形成的,所以共价键有饱和性
3.定性判断键长的方法 (1)根据原子半径进行判断。在其他条件相同时,成键原子的半径越小,键 长越短。
(2)根据共用电子对数判断。相同的两原子形成共价键时,单键键长>双键 键长>三键键长。
三、键角
1.概念 在多原子分子中,两个相邻共价键之间的夹角称为键角。
2.意义 键角可反映分子的空间结构,是描述分子空间结构的重要参数,分子的许多 性质都与键角有关。 多原子分子的键角一定,表明共价键具有方向性。
3.氰气的化学式为(CN)2,结构式为N≡C—C≡N,性质与卤素相似。下列叙述 正确的是 ( A ) A.分子中既有极性键,又有非极性键 B.分子中N≡C键的键长大于C—C键的键长 C.分子中含有2个σ键和4个π键 D.不和氢氧化钠溶液发生反应
4.下列说法正确的是 ( B ) A.分子的结构是由键角决定的 B.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定 C.CF4、CCl4、CBr4、CI4中C—X(X=F、Cl、Br、I)的键长、键角均相等 D.H2O分子中两个O—H的键角为180°
6.碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 键能kJ·mol-1
键参数—键能、键长与键角+2023-2024学年高二下学期化学人教版(2019)选择性必修2

1.正误判断
解题规律:键能越大→共价键越牢固→分子越稳定
√ (1)共价键的键能越大,共价键越牢固,由该键形成的分子越稳定( )
√ (2)N—H的键能是很多分子中的N—H的键能的平均值( )
(3)O—H的键能是指在298.15 K、100 kPa下,1 mol气态分子中1 mol O—
√ H解离成气态原子所吸收的能量( )
提示:断开CH4中的4个C—H,所需能量并不相等,因此,CH4中的C— H只能是平均值,而表2-1中的C—H键能是更多分子中的C—H键能的 平均值。
6、键能规律:
①相同原子间的键能:单键<双键<三键
某些共价键的键能(kJ·mol-1)
②EC-C<EC=C<EC≡C ,(且不存在倍数关系) σ键键能>π键键能
3.根据键能数据估算CH4(g)+4F2(g)═CF4+4HF(g)的反应热△H为( A )
化学键
C-H
C-F
H-F
F-F
键能(KJ/mol) 413
489
568
157
A.﹣1948kJ/mol C.﹣485kJ/mol
B.+1948kJ/mol D.+485kJ/mol
二、键长
1、概念:构成化学键的两个原子的核间距。不过,分子中的原子始终 处于不断振动之中,键长只是振动着的原子处于平衡位置时的核间距。
112 b=628
其中x、y的键能数据尚未测定,但可根据规律推导键能大小的顺序是
b>a>y>x,该规律性是( B )
A.成键时,电子数越多,键能越大 B.键长越短,键能越大 C.成键所用的电子数越少,键能越小 D.成键时电子对越偏移,键能越大
第二课时键参数——键能、键长与键角课件-【新教材】人教版高中化学选择性必修2

必备知识
正误判断
课前篇素养初探
1.甲烷分子为正四面体结构,键角是109°28'。
2.F、Cl、Br、I原子半径逐渐增大,F2、Cl2、Br2、I2与氢气反应越 来越难,HF、HI、HBr、HI的稳定性逐渐减弱。
-3-
课前篇素养初探
知识铺垫
必备知识
正误判断
1.键参数——键能、键长与键角 (1)键能。 键能是气态分子中断裂1 mol化学键解离成气态原子所吸收的能量。 键能可用于估算化学反应的热效应,如H—H键、F—F键、H—F键 的键能分别为436 kJ·mol-1、157 kJ·mol-1、568 kJ·mol-1,则H2与F2 反应是放热反应(填“放热”或“吸热”)。 (2)键长。 键长是指形成共价键的两个原子之间的核间距。化学键的键长与 键能是相关的。例如,C—C键、C=C键、C≡C键的键长分别为154 pm、133 pm、120 pm,键长越来越小,它们的键能分别为347.7 kJ·mol-1、615 kJ·mol-1和812 kJ·mol-1,越来越大。
课堂篇素养提升
2.1 第二课时 键参数——键能、键长与键角 课件-【新教材】人教版(2019)高中化 学选择 性必修 2(共26 张PPT)
-9-
2.1 第二课时 键参数——键能、键长与键角 课件-【新教材】人教版(2019)高中化 学选择 性必修 2(共26 张PPT)
探究
素养脉络
随堂检测
课堂篇素养提升
提示:N原子的半径比P原子的半径小,故键长N—H键比P—H键小,
则N—H键的键能比P—H键的键能大,N—H键更难被破坏,NH3更 难分解。
2.1 第二课时 键参数——键能、键长与键角 课件-【新教材】人教版(2019)高中化 学选择 性必修 2(共26 张PPT)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 键角:两个共价键之间的夹角称为键角。
多原子分子的键角一定,表明共价键具有方向性。键角是描述 分子立体结构的重要参数,分子的许多性质都与键角有关。
共价半径: 相同原子的共价键键长的一半称为共价半径。
思考与交流 1. 试利用表 2—l 的数据进行计算, 1 mo1 H2 分 别跟 l molCl2 、 lmolBr2( 蒸气 ) 反应,分别形成 2 mo1HCl分子和2molHBr 分子,哪一个反应释放的能 量更多?如何用计算的结果说明氯化氢分子和溴化 氢分子哪个更容易发生热分解生成相应的单质? 2. N2、02、F2跟H2的反应能力依次增强,从键能 的角度应如何理解这一化学事实? 3 .通过上述例子,你认为键长、键能对分子的 化学性质有什么影响?
汇报
1.形成2 mo1HCl释放能量: 2×431.8 kJ -(436.0kJ+242.7kJ)= 184.9 kJ 形成2 mo1HBr释放能量: 2×366kJ -(436.0kJ+193.7kJ)= 102.97kJ HCl释放能量比HBr释放能量多,因而生成的HCl更 稳定,即HBr更容易发生热分解生成相应的单质. 2. 键能大小是:F-H>O-H>N-H 3. 键长越长,键能越小,键越易断裂,化学性 质越活泼。
CO分子和N2分子的某些性质
等电子原理:
原子总数相同、价电子总数相同的分子具有 相似的化学键特征,它们的许多性质是相近 的
科学视野: 用质谱仪测定分子结构
现代化学常利用质谱仪测定分子的结构。它的基本 原理是在质谱仪中使分子失去电子变成带正电荷的分子 离子和碎片离子等粒子。由于生成的分子离子、碎片离 子具有不同的相对质量,它们在高压电场加速后,通过 狭缝进入磁场分析器得到分离,在记录仪上呈现一系列 峰,化学家对这些峰进行系统分析,便可得知样品分子 的结构。例如,图2—7的纵坐标是相对丰度(与粒子的 浓度成正比),横坐标是粒子的质量与电荷之比(m/e) ,简称质荷比。化学家通过分析得知,m/e=92的峰是 甲苯分子的正离子(C6H5CH3+),m/e=91的峰是丢失一 个氢原子的的C6H5CH2+ ,m/e=65的峰是分子碎片…… 因此,化学家便可推测被测物是甲苯。
键参数——键能、 键长与键角
二、键参数:键能、键长、键角
1. 键能:
气态基态原子形成l mol化学键释放的最低能量。 通常取正值。单位:kJ/mol
如,形成l mol H—H键释放的最低能量为436.0 kJ,
则 H—H键能为436.0 kJ/mol
形成1 molN
则 N
N键释放的最低能量为946 kJ
N键能为946 kJ/mol
某些共价键的键能
•[观察分析]键能大小与化学键稳定性的关系?
键能越大,化学键越稳定
2. 键长:形成共价键的两个子之间的核间距
某些共价键键长
•1pm=10-12 m
[观察分析]键长与键能的关系?
键长越短,键能越大,共价键越稳定。
分子的形状有共价键之间的夹角决定如:三原子分子CO2的结 构式为O=C=O,它的键角为180°,是一种直线形分子;如, 三原子分子H20的H—O—H键角为105°,是一种 V形分子。
