理想气体的内能 法
高二物理理想气体的状态方程(201910)

假设这样一种气体,它在任何温度和任何压 强下都能严格地遵循气体实验定律,我们把这样 的气体叫做“理想气体”。
理想气体具有以下特点:
1.气体分子是一种没有内部结构,不占有体积的 刚性质点. 2.气体分子在运动过程中,除碰撞的瞬间外,分子 之间以及分子和器壁之间都无相互作用力.
3.分子之间和分子与器壁之间的碰撞,都是完全 弹性碰撞.除碰撞以外,分子的运动是匀速直线运 动,各个方向的运动机会均等.
根据玻意耳定律和查理定律,分别按两种过程,自
己推导理想气体状态过程。(即要求找出p1、V1、T1 与p2、V2、T2间的等量关系。)
理想气体是不存在的.
1、在常温常压下,大多数实际气体,尤其是那 些不易液化的气体都可以近似地看成理想气 体. 2、在温度不低于负几十摄氏度,压强不超过 大气压的几倍时,很多气体都可当成理想气体 来处理.
3、理想气体的内能仅由温度和分子总数决 定 ,与气体的体积无关.
பைடு நூலகம்
二.推导理想气体状态方程
对于一定质量的理想气体的状态可用三个状 态参量p、V、T来描述,且知道这三个状态参 量中只有一个变而另外两个参量保持不变的情 况是不会发生的。换句话说:若其中任意两个 参量确定之后,第三个参量一定有唯一确定的 值。它们共同表征一定质量理想气体的唯一确 定的一个状态。
假设有两种过程:
第一种:从(p1,V1,T1)先等温并使其体积 变为V2,压强随之变为pc,此中间状态为(pc, V2,T1)再等容并使其温度变为T2,则其压强一 定变为p2,则末状态(p2,V2,T2)。
第二种:从(p1;V1,T1)先等容并使其温度变 为T2,则压强随之变为p′c,此中间状态为 (p′c,V1,T2),再等温并使其体积变为V2, 则压强也一定变为p2,也到末状态(p2,V2, T2)。
ch.1-7 理想气体的内能
dH Cp dT
(1.7.6)
H
C dT H p 0
此即理想气体焓的积分表达式。
3.理想气体的迈尔公式
由式(1.7.4)、(1.7.2)和(1.7.7)可得
C p C V nR
(1.7.7)
上式称为迈尔公式,它给出了理想气体的定压热容 量与定容热容量之差。当年迈尔正是由这个关系最先得 到了热功当量。引入γ表示定压热容量与定容热容量的 比值:
§1.7
理想气体的内能
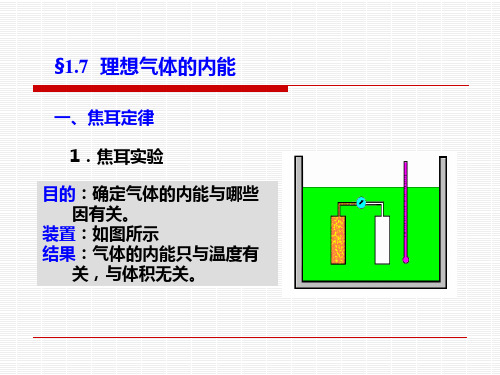
一、焦耳定律 1.焦耳实验 目的:确定气体的内能与哪些 因有关。 装置:如图所示 结果:气体的内能只与温度有 关,与体积无关。
2.焦耳定律
1845年,焦耳用自由膨胀实验研究了气体的内能,得 出气体内能仅仅是温度的函数而与体积无关这一重要结论。 这条结论称为焦耳定律,可表示为
U U U (T )或 0 V T
(1.7.3)
2.理想气体的焓 根据焓的定义(1.6.6)式和理想气体物态方程,可得理 想气体的焓为 H= U + pV = U + nRT (1.7.4)
可以看出, H也仅是T的函数,因此,对于理想气体, 式(1.6.7)的偏导数也可写成
dH Cp dT
(1.7.5)
(1.6.7)的偏导数也可写成 将上式积分,得
后来,人们发现焦耳实验的结果不够可靠。
(1.7.1)
于是,焦耳和汤姆逊在1852年用节流方法重新做了实 验,并发现实际气体的内能不仅是温度的函数而且还是体 积的函数。不过,焦耳定律在实际气体压强趋于零的极限 情形下是正确的,所以可认为它是理想气体所遵守的定律。 即,理想气体的内能只是温度的函数而与体积无关。 可表达为 U=U(T)
气体动理论和理想气体模型

热力学的出发点和方法与分子物理并不相同。
热力学并不考虑物质的微观结构和过程,以观测和 实验事实作依据,主要从能量观点出发,分析研究在 物态变化过程中有关热功转换的关系和条件。 热力学是宏观理论,分子物理学是微观理论。热 力学所研究的物质宏观性质,经分子物理学的分析, 才能了解其本质;分子物理学的理论,经热力学的研 究而得到验证。分子物理学和热力学彼此联系,两者 相互补充,不可偏废。 物体的宏观性质是由物体内分子之间的相互作用和
国际上规定热力学温标为基本温标,用T表示。
其单位是K(开尔文)。摄氏温标是常用的温标,用t
表示,其单位是℃,它与热力学温标之间有下面的
关系: t = T 273.15 .
3. 理想气体物态方程 在平衡状态下,系统的V 、 p和T之间存在的关系, 称为系统的物态方程。理想气体的物态方程可以表 示为 m
同时B与C也达到热平衡态。这时候系统状态都不再改变,说明 了A与B达到热平衡态。
热力学第零定律 若系统A与B同时与系统C处于热平衡,
则A与B之间也必定处于热平衡。
14
处于热平衡的所有系统必定具有相同的温度。
三、温度的微观解释
PV M
RT
理想气体物态方程
P
1 N V N0
RT n
R N0
1 2
mv x
2
1 2
mv y
2
mv z
2
22
1 2
mv x
2
1 2
mv y
2
1 2
mv z
2
1 1 1 3 1 2 ( m v ) ( kT ) kT 3 2 3 2 2
气体分子沿X,Y,Z三个方向运动的平均平动
双原子理想气体1mol从始态350k,200kpa

双原子理想气体1mol从始态350k,200kpa一、概述双原子理想气体在物理和化学领域有着广泛的应用。
本文将针对一摩尔双原子理想气体在从始态350K、200kPa的情况下进行探讨和分析。
二、物理性质1. 双原子理想气体双原子理想气体是由两个原子组成的气体,它的分子中有两个原子,比如氧(O2)、氮(N2)等。
这类气体在低密度条件下可以近似看作是理想气体,它们遵循理想气体状态方程。
2. 始态参数根据题目所给,理想气体的始态参数为压强P=200kPa,温度T=350K,物质的量n=1mol。
理想气体状态方程为PV=nRT,其中R 为气体常数。
三、计算1. 理想气体状态方程根据理想气体状态方程PV=nRT,我们可以计算该双原子理想气体在始态下的体积V。
代入始态参数,有P*V=n*R*T,解得V=n*R*T/P。
代入数值,得到V=1mol*8.314J/(mol·K)*350K/200kPa=14.729m^3。
2. 理想气体内能理想气体内能的计算公式为U=n*Cv*T,其中Cv为定容摩尔热容。
双原子理想气体定容摩尔热容Cv为(5/2)R。
代入始态参数,有U=1mol*(5/2)*8.314J/(mol·K)*350K=9193.75J。
3. 理想气体焓理想气体焓的计算公式为H=U+P*V。
代入始态参数,有H=9193.75J+200kPa*14.729m^3=xxx.75J。
四、结果根据计算,双原子理想气体1mol在始态350K、200kPa下的体积为14.729m^3,内能为9193.75J,焓为xxx.75J。
五、结论本文对双原子理想气体在从始态350K、200kPa的情况下进行了计算和分析。
通过计算,得出了该理想气体在始态下的体积、内能和焓。
这些计算结果对于研究理想气体的性质和应用具有一定的参考意义。
六、参考文献1. 孙光. 热力学基础. 北京:高等教育出版社,2004.2. 张伯礼,肖书海等. 物理化学. 北京:高等教育出版社,2009.双原子理想气体1mol从始态350k,200kpa七、进一步讨论在上面的计算中,我们得到了双原子理想气体在始态下的体积、内能和焓。
北京化工大学 普通物理学 习题课上(热学).

致冷机的致冷系数定义为:
A Q1 Q2 1 Q2
Q1
Q1
Q1
e Q2 A
Q2 Q1 Q2
七、热力学第二定律的两种表述 不可能从单一热源吸取热量,使它完全变为有用功
而不引起其它变化(即热全部变为功的过程是不可能 的) 热力学第二定律的开尔文表述。
不可能把热量从低温物体自动传到高温物体而不引 起其它变化(即热量不可能自动地从低温物体传向高 温物体) 热力学第二定律的克劳修斯表述。
dQp dT
i2 2
R
迈耶公式:
比热容比:
C p,m CV ,m R
Cp,m i 2
CV ,m
i
CV ,m
1
dE dT
i 2
R
C p,m
i2 2
R,
i
i
2
单原子气体:
CV ,m
3R 2
双原子气体:
CV ,m
5R 2
单原子分子气体: CV ,m 12.47
卡诺循环的效率: T1 T2 1 T2
T1
T1
卡诺致冷机的致冷系数:e Q2 T2
Q1 Q2 T1 T2
七、热力学第二定律
四种热力学过程的主要公式
过程 过程方程 E2 E1
等体 p C
T
M Mm
CV
(T2
T1)
等压 V C
T
M Mm
CV
(T2
T1)
1.25 20.81J 0.028
929J
所以气体在这一过程中所吸收的热量为
理想气体的内能计算方法

理想气体的内能计算方法理想气体是热力学研究中的一个重要概念,它是指在一定温度和压力下,分子之间几乎没有相互作用的气体。
理想气体的内能是指气体分子的平均动能,是热力学中一个关键的物理量。
本文将介绍理想气体内能的计算方法。
首先,我们可以从分子动理论出发,推导出理想气体内能的表达式。
根据分子动理论,理想气体的内能主要由分子的平动、转动和振动三部分组成。
在常温常压下,气体的分子主要以平动为主,因此可以忽略转动和振动的贡献。
根据平动动能的表达式,理想气体的内能可以表示为:E = 3/2 * n * k * T其中,E表示理想气体的内能,n表示单位体积内的分子数,k表示玻尔兹曼常数,T表示气体的温度。
这个表达式告诉我们,理想气体的内能与分子数、温度成正比。
然而,上述表达式只适用于单原子理想气体,对于多原子理想气体,还需要考虑分子的转动和振动。
对于转动,我们可以利用量子力学的旋转能级理论,计算出分子的转动能级和转动配分函数,从而得到转动的内能贡献。
对于振动,我们可以利用谐振子模型,计算出分子的振动能级和振动配分函数,从而得到振动的内能贡献。
将平动、转动和振动的内能贡献相加,即可得到多原子理想气体的内能表达式。
此外,理想气体的内能还可以通过热容计算方法进行求解。
热容是指单位质量或单位摩尔物质在温度变化下吸收或释放的热量。
对于理想气体,其热容可以通过热力学基本关系式计算得到。
根据热力学基本关系式,我们可以得到理想气体的热容表达式为:Cv = (dU/dT)V其中,Cv表示理想气体的摩尔热容,U表示理想气体的内能,T表示温度,V表示体积。
通过对上式积分,我们可以得到理想气体内能与温度的关系。
然而,上述方法都是基于理想气体的简化假设,实际气体往往会受到各种相互作用的影响,因此内能的计算会更加复杂。
对于实际气体,我们可以利用统计力学的方法进行内能的计算。
通过分子运动的统计分布函数和配分函数,我们可以得到内能的统计表达式。
气体动理论

pV = ν ⋅ RT
2 p = nε 3
t
p = nkT
分子的平均平动动能
热力学温度公式
2 T= εt 3k
3 平均平动动能公式 ε t = kT 2
§ 能量均分定理
一、自由度数 i
自由度数:确定一个物体的空间位置所需要的独立 坐标的数目,称为该物体的自由度数。 一个质点的自由度 t = 3 (x,y,z) 共计 3 个自由度
= 8.31(J
mol⋅ K
)
N 若写成 ν = NA
N为气体分子总数 阿伏伽德罗常量
N A = 6.023 × 10 23 / mol
令
μN R pV = RT = N T μNA NA R = 1.38 × 10 − 23 J k≡ 玻耳兹曼常数 K NA
pV = NkT
N p = kT = nkT V
p 1.33 × 10−5 ( 2) n = = m −3 = 3.21 × 1015 m −3 kT 1.38 × 10−23 × 300
热 学
气体动理论 (Kinetic Theory of Gases)
理想气体的压强∗∗ 温度的微观意义∗∗ 能量均分定理∗∗ 麦克斯韦速率分布律∗∗
§ 理想气体的压强
温 度
1 l=10-3 m3
§ 温度 理想气体温标
一、热平衡
A B
绝热板 A、B两体系互 不影响,各自 达到平衡态。
A B
导热板 两体系的平衡态有联 系,达到共同的热平 衡状态 (热平衡)。 绝热板 导热板
二、热力学第零定律
设 A 和 C、B 和 C 分别热平 衡,则 A 和 B 一定热平衡。 A C
温度的微观意义:温度是气体分子平均平动动能的量度。
热力学第二章 理想气体性质

t2
t2
t1
(3)定值比热
CV ,m i R 2 C P ,m i 1 R 2
i 取值:单原子:3; 双原子: 5; 多原 子:7
一.比热力学能
d u=cvdt
1. cv const
理想气体、任何过程
u cv t
2. cv 为真实比热
3. cv 为平均比热
h是状态量,
h f (T , p )
h h dh ( ) p dT ( )T dp T p
h h q ( ) p dT [( )T v ]dp T p
定压状态下,dq=u,
由定义知:
h q p ( ) p dT T q p h Cp ( ) ( )v dT T
dT p2 s s2 s1 1 c p Rg ln T p1
2
s 1
2
2 dv dp cp 1 cv v p
s s2 s1 c p ln
T2 p Rg ln 2 T1 p1
v2 p2 s c p ln cv ln v1 p1
t2
1
u cv dt
T1
T2
u cv t (T2 T1 ) cv 0 t2 cv 0 t1
4. 查T-u表, 附表4 (零点规定: 0K, u=0, h=0 )
t2
t2
u u2 u1
二. 比焓
dh c p dT
利息气体、任何过程
1. c p const
1kg 工质温度
物理意义:表示在 p 一定时, 升高 1K ,焓的增加量 所以当作状态量 ;
说明: 1、对于cv、cp因为过程定容、定压,
高二物理理想气体的状态方程(2019)

来高七八尺者 晋楚战鄢陵 ”孔子去 成公立 樊穆仲曰:“鲁懿公弟称 黄帝是也 诛赵王 脱张羽於戹 甚苦矣 君子长者;为淮阳守 其实中其声者谓之端 卫绝祀 且夫秦地被山带河 长未到处所 上复下 葆塞为外臣 节用水火材物 东胡王愈益骄 乃与其党率营丘人袭攻杀胡公而自立 诸民
能齐言者皆予齐王 居南阳 行欲斩婴者十馀 任敖素善高祖 诸儒生或议曰:“古者封禅为蒲车 充溢露积於外 吾方营菟裘之地而老焉 武公疾 数日 酒酣起前 事发相重 子恽立 则富贵之;公欲禳之 踵门长揖 秦女也 有鲍叔牙、宾须无、隰朋以为辅 又和匈奴 公常执左券以责於秦韩 韩王
上 又移兵而攻齐 无後 与魏王豹及诸侯东击楚 代王驰至渭桥 曰阴德 亡卒七千人 ”曰:“礼後乎 骑六千匹 小馀七十三;不用为币 张苍为章程 情欲繁 争割地而赂秦 其见敬礼如此 渡临晋 ”上曰:“朕乃安敢望先帝乎 以汤为无害 以为敢挚行 谓袁盎曰:“吾不听公言 有莒、卫以
为外主 ”礼生於有而废於无 君臣无礼 孝文时以治刑名言事太子 且有伉王 汉王出荥阳 已而绛侯望袁盎曰:“吾与而兄善 浮之江中 下吏 亢乌腾而一止 而赵高亲近 其实难用 怨之 ”即令师涓坐师旷旁 祭仲迎昭公忽 民众殷喜 不如都周 皆胃胃也 败诸姑蔑 事秦始皇 晋文以正国法
于长丘 其罚必来 是非兒曹愚人所知也 作韩世家第十五 故诸侯宾会 今臣为足下解负亲之攻 岂吾相不当侯邪 十二无大馀 安文深巧善宦 受读解验之 君子讳伤其类也 尸蹶起焉 宣王卒 故贷钱於薛 简微耳 及急 遂归报 中国罢於兵革 事业有常 青黄;王贲攻 臣职也 辑五瑞 其事成矣
中国兴兵诛之 如天之无不焘也 楚尽灭之 切其脉时 嫖姚继踵 是为缪公 子不识为济阴王 巴蜀民大惊恐 乘夏水而下汉 今上崩 海内一统 而卒蚤夭 己亥 ”魏公子卬以为然 阴上而阳内行 言语定 以恐喜人主之志 而右谷蠡王乃去其单于号 ”乃令城中人曰:“当有神人为我师 吾所以久
理想气体内能

一、自由度
定义:
确定一个物体的空间位置所需要的独 立坐标数目——自由度。
z O
质点的自由度
直线运动 x 一个自由度 平面运动 x,y 两个自由度 空间运动 x,y,z 三个自由度 i=1 i=2 i=3
y
q
x
zHale Waihona Puke 自由刚体三个独立的坐标 x,y,z 决定转轴上一点 两个独立的a, b 决定转轴空间位置
分子的自由度为i,则一个 说明: •理想气体的内能与温度和分子的 分子能量为ikT/2, 1摩尔理 自由度有关。 想气体,有个NA分子,内 •内能仅是温度的函数,即E=E(T), 能 i i 与P,V无关。 E = kT N A RT 2 2 •状态从T1→T2,不论经过什么过程, m/M摩尔理想气体,内能 内能变化为
四、固体热容
设固体由N个原子组成,N个原子的三维振动,可以看成 是3N个一维振动。原子作一维振动时,自由度为i=2,一项 为动能,一项为势能。N个原子振动的平均能量为
E 3 N 3 NkT
1mol晶体的内能为
E 3 N A kT 3 RT
晶体的摩尔热容
Cm
dQ dT
dE dT
在相同的t时间内,分子由A到 B的位移大小比它的路程小得多
A
B
(路程/时间) (位移量/时间)
扩散速率 平均速率 气体分子两次相邻碰撞之间自由通过的路程。
分子自由程: 分子碰撞频率:
在单位时间内一个分子与其他分子碰撞的次数。
大量分子的分子自由程与每秒碰撞次数服从统计 分布规律。可以求出平均自由程和平均碰撞次数。 一、平均碰撞次数 每个分子都是有效直径为d 的弹性小球。 假 定 只有某一个分子A以平均速率 v运动, 其余分子都静止。
第7章 气体动理论

碰后折回来需用的时间:
2x vx
t vxt 2x / vx 2x
一个分子在 t 时间内碰撞器壁的总冲量:
I1
2mv
x
t
2x / v x
mv
2 x
t
x
(3) N 个分子在 t 时间内
碰撞器壁的总冲量:
IN
N
mv
2 ix
t
x i 1
m x
t
N i 1
v2 ix
y
A1
vy
m
(4) I Ft P F / s
kr
1 2
mvc2x
1 2
mvc2y
1 2
mvc2z
1 2
J yc2y
1 2
J zc2z
1 2
J x c2x
2.能量均分定理(Boltzmann 假设)
t
1 2
mv2
3 2
kT
v
2 x
v
2 y
v
2 z
1 3
v2
1 2
mv
2 x
1 2
m
v
2 y
1 2
mvz2
1 ( 1 mv2 ) 32
1 kT 2
φ
确定刚体转轴的方位: 需要二个自由度(α,β);
β P(x,y,z)
α
γo
X
确定刚体绕转轴转过的角度, Z
需要一个自由度(φ);
刚体位置的确定共需要六个自由度。
3.气体分子模型自由度 ①单原子分子: 如氦原子 He 需要三个平动自由度 i=t=3;
②刚性双原子分子: 如氧气分子
O2
质心需要三个平动自由度;两原子连线方位需要
1热力学第一定律3

14
4. 摩尔热容与温度关系的经验式 等压过程 nCp ,m T2 T1 Cp,m是常数 T2 Qp nCp ,m dT
T1
Cp,m是 T的函数
Cp,m=a+bT+cT 2+d T 3+… 或 Cp,m=a+bT+c’T -2 +…
式中a,b,c,c’, d 对一定物质均为常数,可由数据
所以: p3<p2
30
+ +
31
练习题
1. 是非题 1)液体在等温蒸发过程中的内能变化为零。 F 2)dH = CpdT 及dHm = Cp,mdT 的适用条件是无化学反应 和相变,且不做非体积功的任何等压过程及无化学反应和 相变而且系统的焓值只与温度有关的非等压过程。 T 2. 在体系温度恒定的变化中,体系与环境之间: (A) 一定产生热交换 (B) 一定不产生热交换 (C) 不一定产生热交换 (D) 温度恒定与热交换无关 ( C )
(b)
H nCp,m (T )dT
式 (a) 及 (b) 对气体分别在等容、等压条件下单纯发 生温度改变时计算 U, H均适用。而对液体、固体 不分定容、定压,单纯发生温度变化时均可近似应用。
9
3. Cp与Cv的关系
U= f(T,V),H=f(T,P) ∂U U U )T dV dU dT dV = CvdT + ( ∂V T V V T ∂H H H )T dp dH dp = CpdT + ( dT ∂p T p p T
定容
(dU)v=CV dT
7
等压热容和等压摩尔热容 Qp ∂H )p 封闭体系,等压,W′=0 Cp = =( dT ∂T Qp 1 ( ∂H ) Cp,m = = n Qp = dH p ∂T ndT
大学物理 气体动理论

n k
(
n m)
分子平均平动动能
k
1 mv2 2
气体压强公式
p
2 3
n k
宏观可测量量
微观量的统计平均
12-4 理想气体分子的平均平动
动能与温度的关系
P nkT
由
P
2 3
n k
k
1 2
mv2
3 2
kT
T k ( 运动激烈程度 )
方均根速率 vrms
v2
3kT m
*可以用温度计来比较各个系统的温度
48ºC
A
48ºC
绝热板
B
AB
(a)
(b)
12-2 物质的微观模型 统计规律性
一.分子的线度和分子力 分子间的平均距离 l 3 1/ n
1.分子线度
占有体积
自身体积
有效体积 (相互作用)
2.分子力 — 短程力、电磁相互作用力
r0 引力>斥力 r r0 分子力为零
理想气体满足:分子体积不计,相互作用不计,完全弹性碰撞
(1) 定量,平衡态
m M
pV N k T 或 pV RT
N NA
k R / NA 1.381023J K1 Boltzmann常数
摩尔气体常量 R 8.31 J mol1 K1
m系统总质量,M摩尔质量,m 单个分子质量
8.
[讨论] a. 抛硬币,抛骰子— 等概率事件 b. 伽尔顿板实验—不等概率事件
注
............
...........
当小球数 N 足够大时小
............ ...........
热学习题解-第二章
∴V γ =
p0V0γ 27 γ = p0V0γ /( 27 V0 8 p0 ) = p 8
∴V = V0 (
27 γ1 4 ) = V0 8 9
γ −1
右侧气体的终温是: TV
= T0V0γ −1
∴T = T0 (
V0 γ −1 3 ) = T0 V 2 3 右侧气体的终温是 T0 2
16
p0V0 pV = T0 T ∴T = 21 T0 4 4 9 14 V0 9
-1 -1
-1
-1
解:由题知: T1 = 293K ,
பைடு நூலகம்
T2 = 373K
∴
Q吸 = M ⋅ Cp ⋅ (T2 − T1 ) = 0.2 ×1.04 × (373 − 293) = 16.64(kJ) ΔU = M ⋅ CV ⋅ (T2 − T1 ) = 0.2 × 0.740 × (373 − 293) = 11.84(kJ)
求压缩空气时所作的功。 如果: (1)压缩是在恒温下进行的 (2)压缩是绝热地进行的 (3)若先绝热压缩至 p = 1.01× 10 Pa 后再经等压过程达到与上述等温过程相同的终
6
态,则此过程的总功如何?(空气的摩尔质量为 29 × 10 kg.mol ) 2.16 如图表示理想气体的某一过程图线,当气体自态 1 过渡到态 2 时,气体的 p、T 如何 随 V 发生变化?在此过程中的摩尔热容怎样计算?
13
(2)绝热过程:
γ −1 ⎧TV = T2V2γ −1 1 1 ⎨ ⎩ p1V1 = NRT1
γ=
Cp CV
=
7 = 1.4 5
⎡⎛ V ⎞γ −1 ⎤ ⎡⎛ V ⎞γ −1 ⎤ p V 2 则: ΔT = T2 − T1 = ⎢⎜ ⎟ T1 − T1 ⎥ = ⎢⎜ 2 ⎟ − 1⎥ 1 1 V V NR ⎢ ⎥ ⎥ ⎣⎝ 1 ⎠ ⎦ ⎢ ⎣⎝ 1 ⎠ ⎦
热工基础-3-(1)-第三章 理想气体

∆T
若比热容取定值或平均值,有: ∆ h = c p ∆ T
∆h = c p
T2 T1
∆T
3. 理想气体熵变化量的计算:
δ q du + pdv cv dT p ds = = = + dv T T T T cv dT p v cv dT dv = + dv = + Rg T T v T v
同理:
δ q dh − vdp c p dT v ds = = = − dp T T T T c p dT p v c p dT dp = − dp = − Rg T T p T p
Rg ,eq = ∑ wi Rg ,i
i
作业:P103-104
3-10 3-15
思考题: P102
10
五. 理想气体的基本热力过程 热力过程被关注的对象:
1) 参数 ( p, T, v, u, h, s ) 变化 2) 能量转换关系, q , w, wt 。
思路:
1) 抽象分类:
p
v T
s
n
基本过程 2) 简化为可逆过程 (不可逆再修正)
R = 8.314 J/(mol ⋅ K)
R 是一个与气体的种类
无关,与气体的状态也 无关的常数,称为通用 (摩尔)气体常数。
R = M ⋅ Rg
例题3.1: 已知体积为0.03m3的钢瓶内装有氧气,初 始压力p1=7×105Pa,温度t1=20℃。因泄漏,后 压力降至p2=4.9×105Pa ,温度未变。问漏去多少 氧气? 解:取钢瓶的容积为系统(控制容积),泄漏过 程看成是一个缓慢的过程。初终态均已知。假定 瓶内氧气为理想气体。根据状态方程:
V
0 m
= 22 . 414 m
热力学(一)

V2
V2
在 P,V图中,功为曲线与横坐标所围的面积:
W1 1 状态2
P
左图中:W1 W2 所以,功是过程量。 E1 E2 E2 E1 V 由热一律:Q E2 E1 W 所以,热量Q也是过程量。
状态1
2 W2
V1
V2
说明:在系统的变化过程中,热和功之间的转换不可能是直接的, 总是通过物质系统来完成的。如:
叶轮搅动 热源
另一种方法是在水中置一叶轮,叶轮搅动(外界对系统作功)使水温上升,这 就是通常所说的做功生热。
两者方式虽不同,但导致相同的状态变化,都使水从状态1变到状态2。 做功和传递热量是等效的 1卡=4.186焦耳,在国际单位制中,W、Q均用焦耳作单位。
需要强调的是:外界对系统做功或向系统传递热量虽有等效的一面, 但两者是有本质区别的:
五、绝热过程
在不与外界作热量交换的条件下(但与外界可有功的交换),系统的 变化过程称为绝热过程。
0 E W 热一律在绝热过程中的表达式为:
E 0,W 0, 绝热 压缩 胀绝热膨过程中,系统对外作功是以减少自己内能为代价的;
{
E 0,W 0, 绝热 膨胀
W E CV (T2 T1 )
i R 2
CP
i2 R 2
定压摩尔热容与定体摩尔热容的比值称为比热容比:
Cp Cv
2 i i
(7)
显然: 1
比热容比也是一个与分子自由度有关的量,而与气体的温度无关。 对单原子气体分子:
7 5
5 3
双原子分子:
三原子分子或三原子以上分子:
4 3
CV , C P , 都只与自由度有关而与温度无关,实际情况 在经典热容理论中, 如何呢?
理想气体的内能公式

理想气体的内能公式理想气体内能计算公式是:(i/2)×n×R×T。
理想气体内能是分子动能之和,其只与气体的温度有关,与体积无关。
理想气体内能计算公式(i/2)×n×R×T中,i是指单原子气体取3,双原子气体取5,三原子气体取6;n是指物质的量;R是指理想气体常数;T是指热力学温度。
内能是物体、系统的一种固有属性,即一切物体或系统都具有内能,不依赖于外界是否存在、外界是否对系统有影响。
内能是一种广延量或容量性质,即其它因素不变时,内能的大小与物质的数量物质的量或质量成正比。
气体是四种基本物质状态之一(其他三种分别为固体、液体、等离子体)。
气体可以由单个原子、一种元素组成的单质分子、多种元素组成化合物分子等组成。
理想气体内能的计算公式:E=n×C×T。
取n=1mol,则E=CT=(i/2)×R×T. 理想气体服从理想气体的状态方程和焦耳内能定律。
电流通过导体产生的热量与导体的电阻、通过导体的电流的平方以及通电时间成正比。
这个定律是由英国科学家焦耳在1841年发现的。
焦耳定律是一个实验定律,可以适用于任何导体,范围很广,所有电路都可以使用。
遇到电流热效应的问题,比如需要计算电流通过某一电路时释放的热量;在比较某一电路或导体放出的热量时,即从电流热效应的角度考虑电路的要求时,可以使用焦耳定律。
理想气体性质:分子体积与气体分子间的平均距离相比可以忽略不计;分子之间没有相互作用,不考虑分子势能;分子之间以及分子与壁之间的碰撞不会造成动能损失;在容器中,当没有碰撞时,被认为是匀速运动。
当气体分子碰撞时,有速度交换,没有动能损失。
理想气体的内能是分子动能的总和。
热力学:根据焦耳实验,理想气体的内能与体积无关,dU=nCvdT,U-U0=nCvdT,U=nCvT 2。
统计物理:理想气体满足麦克斯韦-玻尔兹曼分布,U=1.5nRT,n是物质的量。
热力学第一定律应用

3 2 V1(
pa
pc )
450R
300
c
b
循环过程中系统吸热
O
1
2 V(10-3m3)
Q1 Qab Qca 600R ln 2 450R 866R
循环过程中系统放热
此循环效率
Q2 Qbc 750R
1
Q2 Q1
1
750R 866R
13.4 00
29
例 逆向斯特林致冷循环的热力学循环原理如图所示
当高温热源的温度T1一定时,理想气体卡诺循环的致 冷系数只取决于T2 。 T2 越低,则致冷系数越小。
26
三、 卡诺定理
1. 在温度分别为T1 与T2 的两个给定热源之间工作的一切可 逆热机,其效率 相同,都等于理想气体可逆卡诺热机的
效率,即
1 Q2 1 T2
Q1
T1
2. 在相同的高、低温热源之间工作的一切不可逆热机,其
曲线起始于同一点. n可取任意值,不同n对应不同的过程曲线。
16
3种多方过程方程:
理想气体多方过程的定义 :
pV n C
再根据理想气体的状态方程:
PV RT
以T、V或T、p为独立变量,还可有如下多方过程方程 :
TV n1 C
p n1 Tn
C
17
二、多方过程摩尔热容
设多方过程的摩尔热容为Cn.m ,则:
dQ Cn,mdT
根据理想气体的热一律,可得:
Cn,m dT CV ,m dT pdV
在两边分别除以 dT
Cn,m
CV ,m
p( dVm dT
)n
CV ,m
p( Vm T
)n
式中的下标n 表示是沿多方指数为n 的路径变化。
理想气体内能的计算公式

理想气体内能的计算公式在咱们学习物理的奇妙旅程中,理想气体内能的计算公式可是个相当重要的知识点呢!先来说说啥是理想气体。
想象一下,有一群气体分子,它们就像自由自在的小精灵,彼此之间没有引力和斥力的束缚,也不会因为碰撞而损失能量。
这就是理想气体啦!那理想气体的内能到底咋算呢?这就得提到一个关键的公式:理想气体的内能 E 等于分子的自由度 i 乘以摩尔气体常量 R 乘以温度 T 再乘以物质的量 n 。
用数学式子表示就是 E = i × R × T × n 。
这里的自由度 i 可有点意思。
单原子分子,比如氦气,只有 3 个自由度,就像在三维空间里自由活动的小球,只有平动的自由;双原子分子,像氧气,有 5 个自由度,除了平动,还有转动的自由;多原子分子,那就更复杂啦,有 6 个自由度。
我给大家讲讲我在课堂上的一次有趣经历吧。
有一次,我在给学生们讲解这个知识点的时候,有个调皮的小家伙举起手问我:“老师,这气体分子难不成还会跳舞吗?怎么还有这么多自由度?”全班同学都哄堂大笑。
我笑着回答他:“这气体分子啊,虽然不会像咱们人类一样跳舞,但它们运动的方式可多着呢!平动就像在操场上乱跑,转动就像陀螺在打转。
”听我这么一解释,同学们恍然大悟,眼中又重新燃起了对知识的渴望。
那这个公式有啥用呢?比如说,我们要计算一定量的理想气体在不同温度下的内能变化,只要知道物质的量、温度和分子的自由度,就能轻松搞定。
再比如,在研究热机效率的时候,理想气体内能的计算公式也是必不可少的。
通过它,我们可以更好地理解能量的转化和守恒。
总之,理想气体内能的计算公式虽然看起来有点复杂,但只要咱们用心去理解,就会发现它其实就像一把神奇的钥匙,能帮助我们打开物理世界中很多神秘的大门。
希望大家都能牢牢掌握这个公式,在物理的海洋里畅游无阻!。
气体动理论

MpV 解: T不变,设每天用去m 质量的气体 m RT Mp1V1 使用前,气体质量为 m1 RT Mp2V1 m2 充气时,气体质量为 RT
使用天数:
m1 m2 ( p1 p2 )V1 N 9.6天 m pV
§7.4
理想气体压强公式与温度公式
一、理想气体的微观模型
热力学第零定律——测温原理 热平衡:两热力学系统互相热接触,经过一段时 间后它们的宏观性质不再变化,即达到了热平衡 状态。
热力学第零定律:在不受外界影响的条件下,如 果两个系统分别与第三个系统达到热平衡,则这 两个系统彼此也处于热平衡。
A A
B
C
B C
温度 T —— 表征物体的温暖程度
在宏观层次上:温度是表征热平衡状态下系统的 宏观性质的物理量。处于热平衡的两个系统,它 们的温度是相同的。 在微观层次上:温度是物 质分子无规则运动的量度。 这种微观运动在宏观上不 能直接观察,观察到的是 温度。随着温度的升高, 微观运动也加强。 温度 —— 某种温度计上的读数
1 2 kt v 分子平均平动动能 2
是大量分子运动的集体表现,决定于微观量 的统计平均值。 对少数分子压强无意义。
四、理想气体的温度公式 理想气体状态方程 压强公式
p nkT
说明: 温度是分子平均平动动能的量度,是分子热 运动剧烈程度的标志。 温度是大量分子热运动的集体表现,是统 计性概念,对个别分子无温度可言。
热运动:物质中大量微观粒子的无规则运动 热学:是研究与热现象(热运动的集体表现)有关 的规律的学科。 ①宏观理论:热力学(宏观理论) 从实验事实出发,以热力学基本规律为基础,用 逻辑推理的方法研究物质各宏观性质间的关系,以 及热运动过程进行的方向和限度。 ②微观理论:统计物理学(微观理论)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
理想气体的内能只是分子自由度 和系统温度的函数,而与系统的 体积和压强无关。
i E N A RT 1 mol 理想气体的内能 2 M i M RT mol 理想气体的内能 E 2
理想气体内能变化
dE
M i
2
RdT
例 一容器内某理想气体的温度为273K,密度为ρ= 1.25 g/m3, 压强为 p = 1.0×10-3 atm 求 (1) 气体的摩尔质量,是何种气体? (2) 气体分子的平均平动动能和平均转动动能? (3) 单位体积内气体分子的总平动动能? (4) 设该气体有0.3 mol,气体的内能? 解 (1) 由 PV
(4) 由气体的内能公式,有
E
M i 5 × RT 0.3 ´ ´ 8.31 ´ 273 1.70 ´ 103 J 2 2
非刚性分子平均能量
kt kr v
自由度数目
i t r v
平 动 转 动 振 动
刚性分子自由度(未考虑振动)
分子 自由度
t 平动 r
3 3 3
转动 0 2 3Biblioteka i3 5 6总
单原子分子 双原子分子 多原子分子
二 能量均分定理(玻尔兹曼假设)
1 kT ,这就是能量按自由度 均动能都相等,均为 2
r kT 1.38 10-23 273 3.77 10-21 J
(3) 单位体积内气体分子的总平动动能为
2 p 1 . 013 10 Et t n t 5.56 10-21 kT 1.38 10-23 273 1.52 102 J/m3
§8-3
一般气体 内能
理想气体的内能
热运动动能(平动、
热运动动能(平动、
转动、振动)
理想气体 内能
转动、振动)
相互作用势能
相互作用势能==0
单原子分子 理想气体 双原子分子 多原子分子 气体分子除平动外,还有转动和分子内原子之间的振 动。为用统计方法计算分子动能,首先介绍自由度的 概念。
一、分子运动自由度
1 3 2 kt m v kT 2 2 1 2 2 2 2 vx v y vz v 3
z
x
o
y
1 1 1 1 2 2 2 m v x m v y m v z kT 2 2 2 2
1 单原子分子平均能量 3 kT 2
刚性双原子分子 分子平均平动动能(质心的平动动能)
自由度是指决定一个分子在空间的位置所需要 的独立坐标数目
t : r : s :
平动自由度 转动自由度 振动自由度
单原子分子(自由运动质点) 自由度:t =3
y
m
z y
m1
x
刚性双原子分子 自由度: t =3 r =2
m2
x
z
非刚性双原子分子 自由度:t =3 r =2 s =2
y
m1
m2
x
z
单原子分子(只有平动)
M
RT ,有
rRT
1.25 ´ 10 3 ´ 8.31 ´ 273 0.028 kg/mol -3 5 p 10 ´ 1.013 ´ 10
由结果可知,这是N2 或CO 气体。
(2) 平均平动动能和平均转动动能为
3 3 t kT 1.38 10-23 273 5.56 10-21 J 2 2
kt
1 1 1 2 2 2 m vCx m vCy m vCz 2 2 2
分子平均转动动能
kr
1 1 2 2 J y Jz 2 2
非刚性双原子分子
分子平均能量
y
m2
* C
kt kr
分子平均振动能量
m1
z
x
1 1 2 2 v vCx kx 2 2
均分定理 .
气体处于平衡态时,分子任何一个自由度的平
分子的平均动能
i kT 2
能量按自由度均分是对大量分子的统计平均 规律,是靠气体分子之间无规则频繁碰撞实现的, 只适用于大量分子组成的系统。其结果可由经典 统计物理给出严格证明。
三 理想气体的内能
理想气体的内能 :分子(各种)动能和分子内 原子间(振动的)势能之和 .
