物理化学4
物理化学第四章-化学平衡

平衡 正向自发
ii (产物) ii (反应物) 逆向自发
自发变化的方向:反应总是从化学势较高的一边流向化 学势较低的一边。
1. 化学反应的限度
所有的化学反应既可以正向进行亦可以逆向进行, 且反应正向进行和逆向进行均有一定的程度,反应 物不会完全转化为产物。
典型例子:
H2(g)+I2(g)↔2HI C2H5OH(l)+CH3COOH(l)↔CH3COOC2H5+H2O
任意化学反应: rGm rGm RT ln Qa
rGm ii (产物) jj (反应物)
(化学反应的吉布斯自由能改变量)
rGm
i
i
(产物)
jj (反应物)
(化学反应的标准吉布斯自由能改变量)
1.rGm 是任意反应系统的吉布斯自由能变化
rGm 是任意反应系统的标准摩尔吉布斯自由能变化
rGm 指产物和反应物都处于标准态时,产物的吉布
斯函数与反应物的吉布斯函数总和之差,称为化学
反应的“标准摩尔Gibbs 自由能变化值”,只是温
度的函数。
平衡时Leabharlann gGhHa
A
b
B
r Gm
若上述反应在定温定压下进行,其中各分压是任意的而 不是平衡时的分压,此时反应的吉布斯函数变化为:
非平衡时
rGm gG hH (aA bB )
B
B
RT
ln( PB
/
P )
g[G
RT
ln(
pG
/
p
)]
h[
H
RT
ln(
pH
/
p
)]
a[
A
RT
ln(
物理化学 第4章化学平衡

当 B 0 时 K Kc Kn K y
1/31/2020
祝大家学习愉快,天天进步!
17/114
§4.2-3.有纯态凝聚相参加的理气反应 K
ΔrGm RTln K
J p
B (g)
pB p
(g)
νB(g)
K
B(g)
peq B(g) p
结论:化学反应方程中计量系数呈倍数关系,Δ r Gm
的值也呈倍数关系,而 K 值则呈指数的关系。
1/31/2020
祝大家学习愉快,天天进步!
15/114
§4.2-2.理想气体反应的 K K c K y Kn
气体的组成可用分压力,摩尔分数,浓度表 示,故平衡常数也有不同的表示方法.
K
B
2
(g)
CO
2
(g)
Δ G r m,2 RT lnK 2
(3) CO 2 (g) C(s) 2CO(g) Δ G r m,3 RT lnK3 例 4.5.1
因为: (3) = (1) 2(2)
pB p
B
e
pB yB p
K
B
pB p
B
e
B
yB p
p
B
e
B
y B B
e
B
p
p
B
Ky
p p
B
1/31/2020
祝大家学习愉快,天天进步!
16/114
§4.2—2.理想气体反应的 K K c K y Kn
物理化学:第4章_多组分系统热力学_
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
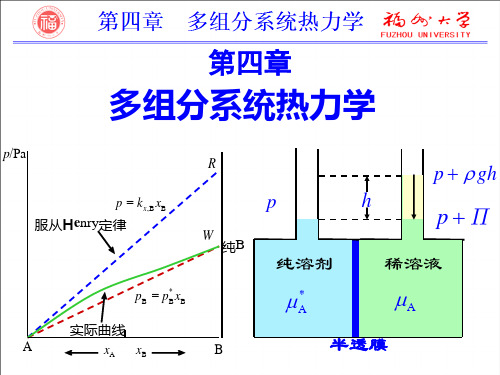
《物理化学第4版》第四章4-3 拉乌尔定律和亨利定律ppt课件

亨利定律只适用于平衡系统; 对于公式中的 k[%],B 冶金系统广泛应用, 我们称之为百分之一亨利系数。但是,冶 金行业仍称之为亨利系数。
13
三、 拉乌尔定律和亨利定律的应用 1、应用拉乌尔定律测定溶剂的相对蒸 气压下降 2、利用亨利定律求难溶气体的溶解度
3、计算挥发性溶质在平衡气相的组成
14
1、文字叙述:定温下,稀溶液中溶剂的蒸 气压pA等于纯溶剂的蒸气压pA*乘以溶液中 溶剂的摩尔分数xA。 2、数学表达式:
pA pA* xA
2
(1)式中的各量均指平衡状态下的性 质; (2)适用于稀溶液中的溶剂,xA1时 严格适用;一般而言,溶液愈稀愈接近 实际(分压)。
3
(3)对于双组分系统, xA =1 -xB, 则 pA= pA* xA= pA*(1-xB)
1、文字叙述:一定温度 下,微溶气体B在溶液中 的平衡组成xB与该气体在 气相中的平衡分压pB成正 比。即亨利定律。
pB g xB l
7
2、数学表达式:
pB=kx,BxB
式中, xB是挥发性溶质(即所溶解的气 体B) 在溶液中的摩尔分数. pB是平衡时液面上该气体的分压. kx,B 溶质组成用摩尔分数表示时的 亨利系数. 是一个常数,其数值与T、p 及溶剂、溶质的性质有关.
§4-3 拉乌尔定律和亨利定律
研究溶液中组分的热力学, 如化学 势,采用的基本方法仍然是研究与液相 组分呈平衡的气体的化学势. 因此,必须 知道液相组成与平衡气相分压有何关 系?这一关系由两个经验定律来描述.
1
一、拉乌尔定律
(法国化学家F.M.Raoult)
在溶剂中加入非挥发性溶质后,溶剂的 蒸气压降低, 1887年发表了定量关系.
bB (40
物理化学4 多组分体系热力学 1

几点说明
(1)偏摩尔量只对体系中某组分才具有的,对整体而 言无所谓偏摩尔量的概念; (2)只有体系的广度性质才有偏摩尔量(质量除外) ; (3)偏摩尔量本身是强度性质; (4)注意右下角标的条件; (5)任何偏摩尔量都是T、p、组成的函数; (6)纯物质的偏摩尔量就是摩尔量; (7)偏摩尔量可能是负值。 (8)偏摩尔量是1mol B对整体热力学性质的贡献量, 而不应该理解为它在混合体系中所具有的量。
分类
气态混合物:空气 混合物液态混合物:甲醇 + 乙醇 固态混合物:Cu + Ni 气态溶液:萘溶解于高压CO 2中 非电解质溶液:糖水 − − − 本章 溶液液态溶液 电解质溶液:盐水 - - -电化学 固态溶液:单体溶解于聚合物中 − − − 又称固溶体
§4-2 化学势 化学势μ μB
• 4-2-1 化学势定义 • 4-2-2 平衡判据与平衡条件 • 4-2-3 理想气体的化学势表达式
4-2-1 化学势定义
混合物或溶液中,组分B的偏摩尔吉布斯函数 GB在化学热力学中有特殊的重要性,又把它叫 做化学势,用符号μB表示。
∂G µ B = GB = ∂nB T , p ,nc≠B
dX = ∑ X B dnB
B =1 k
( 2)
• 可得Gibbs-Duhem方程:
∑ n dX
B B=1
k
B
=0
∑ x dX
B B=1
k
B
=0
Gibbs-Duhem方程的意义: (1) 某一偏摩尔量的变化可从其它偏摩尔量的变 化中求得。 (2) 对一个含有K个组分的均相体系,K个偏摩 尔量Xi中,只有 K-1个是独立的。
如果在溶液中不按比例地添加各组分,则溶液浓 度会发生改变,这时各组分的物质的量和偏摩尔量均 会改变。 根据集合公式
物理化学 第四章 多组分系统热力学

Vm
T,p一定
V*m,C VC
V*m,B VB
d c· b·
0 B
a xC
C
图4.1.2 二组分液态混合物的 偏摩尔体积示意图
若B,C形成真实液态混合物: 则混合物体积为由V*m,B至V*m,C的曲线。对于任一 组成a时,两组分的偏摩尔体积可用下法表示: 过组成点a所对应的系统体积点d作Vm-xC曲线的 切线,此切线在左右两纵坐标上的截距即分别 为该组成下两组分的偏摩尔体积VB,VC。
B
系统中各广度量的偏摩尔量: 对于多组分系统中的组分B,有: 偏摩尔体积: VB=(ƽV/ƽnB)T,p,n C 偏摩尔热力学能: UB=(ƽU/ƽnB)T,p,n C 偏摩尔焓: HB=(ƽH/ƽnB)T,p,n C 偏摩尔熵: SB=(ƽS/ƽnB)T,p,n C 偏摩尔亥姆霍兹函数:AB=(ƽA/ƽnB)T,p,n C 偏摩尔吉布斯函数: GB=(ƽG/ƽnB)T,p,n
C
几点说明: (1)偏摩尔量为两个广度性质之比,所以为强度 性质; (2)偏摩尔量的定义中明确是在恒温、恒压及系 统组成不变的条件下,偏导数式的下标为T,p 时才是偏摩尔量; (3)同一物质在相同温度、压力但组成不同的多 组分均相系统中,偏摩尔量不同; (4)若系统为单组分系统,则该组分的偏摩尔量 与该组分的摩尔量相等,即: XB=X*B,m
C
=VB (数学知识:二阶偏导与求导的顺序无关) 得证。
4.2化学势 4.2化学势
1.化学势的定义 混合物(或溶液中)组分B的偏摩尔吉布斯函数GB 定义为B的化学势,用符号μB表示:
μB = GB=(ƽG/ƽnB)T,p,n
def
C
对于纯物质,其化学势等于它的摩尔吉布斯函 数。
物理化学第四章课后答案完整版

第四章多组分系统热力学4.1有溶剂A与溶质B形成一定组成的溶液。
此溶液中B的浓度为c B,质量摩尔浓度为b B,此溶液的密度为。
以M A,M B分别代表溶剂和溶质的摩尔质量,若溶液的组成用B的摩尔分数x B表示时,试导出x B与c B,x B与b B之间的关系。
解:根据各组成表示的定义4.2D-果糖溶于水(A)中形成的某溶液,质量分数,此溶液在20℃时的密度。
求:此溶液中D-果糖的(1)摩尔分数;(2)浓度;(3)质量摩尔浓度。
解:质量分数的定义为4.3 在25℃,1 kg 水(A )中溶有醋酸(B ),当醋酸的质量摩尔浓度b B 介于和之间时,溶液的总体积求:(1) 把水(A )和醋酸(B )的偏摩尔体积分别表示成b B 的函数关系。
(2)时水和醋酸的偏摩尔体积。
解:根据定义当时4.460℃时甲醇的饱和蒸气压是84.4 kPa ,乙醇的饱和蒸气压是47.0 kPa 。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60℃时此混合物的平衡蒸气组成,以摩尔分数表示。
解:甲醇的摩尔分数为58980049465004232500423250....x B =+=4.580℃时纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80℃时气相中苯的摩尔分数,求液相的组成。
解:4.6在18℃,气体压力101.352 kPa下,1 dm3的水中能溶解O2 0.045 g,能溶解N2 0.02 g。
现将 1 dm3被202.65 kPa空气所饱和了的水溶液加热至沸腾,赶出所溶解的O2和N2,并干燥之,求此干燥气体在101.325 kPa,18℃下的体积及其组成。
设空气为理想气体混合物。
其组成体积分数为:,解:显然问题的关键是求出O2和N2的亨利常数。
4.7 20℃下HCl 溶于苯中达平衡,气相中HCl 的分压为101.325 kPa 时,溶液中HCl 的摩尔分数为0.0425。
物理化学 4第四章 化学平衡

第四章 化学平衡内容提要1、反应进度反应进度描述了化学反应体系的状态,反应进度的变化表示为: Δξ=B∨∆Bn (4-1)当ξ =1时,就表示按给定的反应式进行了一个完整反应,也称发生了一个单位反应。
对于同一反应方程式,可以用任一反应物或任一产物表示反应进度ξ,与物质的选择没有关系;当化学反应方程式的写法不同时,反应进度ξ的数值不同。
2、吉布斯自由能变在等温等压、W '=0时,一定组成、无限大量的体系中,体系的吉布斯自由能随反应进度而改变的变化率表示为:Δr G m =P T ∂∂,)(ξG=∑νB μB (4-2) Δr G m 是反应系统在任意情况下的吉布斯自由能变化,是强度性质,与体系物质的量无关,单位为 J/mol 或kJ/mol 。
对同一反应来讲,Δr G m 的具体数值与化学方程式的写法有关。
Δr G m 值可以表明反应的自发方向和进行趋势的大小,具有化学反应推动力的含义。
当Δr G m <0时,反应物化学势高,反应能自发地由左向右进行; 当Δr G m >0时,产物化学势高,反应不能自发地由左向右进行; 当Δr G m =0时,产物和反应物的化学势相等,反应体系处于平衡状态。
在温度T 时,把物质的化学势µ B=OB μ + RTlna B代入式(4-2),得:Δr G m =∑νB OB μ + RTlnQa(4-3)3、化学平衡的条件化学平衡的条件为:等T 、等P 、W '=0 时, Δr G m =p T G,)(ξ∂∂=∑νB μB =0 (4-4) 4、化学平衡常数在一定条件下,当化学反应达到平衡时,产物活度的计量系数次方幂的乘积与反应物活度的计量系数次方幂的乘积的商为一常数,称为化学平衡常数(equilibrium constant)。
标准平衡常数(standard equilibrium constant) 表示反应所能达到的最大限度,单位是1,用OK(上角标“Ө”表示处于标准态)表示,也称为热力学平衡常数,表达式为:OK = (Q a )eq = (d Da A r Rg G a a a a ⋅⋅)eq (4-5)O K 越大,则反应进行的程度越大。
物理化学练习题4及参考答案

《 物理化学 》练习题4注意事项:1. 考前请将密封线内容(特别是姓名和班内编号)填写清楚; 2. 所有答案请直接答在试卷上; 3.考试形式:闭卷;4. 本试卷共 三 大题,满分100分, 考试时间120分钟。
一、选择题(10题,每题2分,共20分)1. 下述说法哪一种不正确: ( ) (A )一定量理想气体自由膨胀后,其∆U = 0 (B )非理想气体经绝热自由膨胀后,其∆U ≠0 (C )非理想气体经一不可逆循环,其∆U = 0 (D )非理想气体自由膨胀,气体温度略有变化2. 水在 100℃、101325Pa 下沸腾时,下列各量何者增加?(A) 系统熵 (B) 汽化焓 (C) Gibbs 函数 (D) 蒸气压 3. 不挥发的溶质溶于溶剂中形成稀溶液之后,将会引起( )(A) 凝固点升高 (B) 沸点升高 (C) 蒸汽压升高 (D) 总是放出热量 4. 对于理想气体之间的任意一个化学反应,影响标准平衡常数K 的因素是( ) (A) 浓度 (B) 压力 (C) 温度 (D) 催化剂5. 固体Fe ,FeO ,Fe 3O 4与气体CO ,CO 2达到平衡时其组分数C 和自由度数F 分别为( )。
(A) C = 2, F = 0 (B) C = 1, F = 0 (C) C = 3, F = 1 (D) C = 4, F = 26.科尔劳施从实验中总结出电解质溶液的摩尔电导率与其浓度成线性关系m m ΛΛ∞=-,这一规律适用于( )(A) 弱电解质(B) 强电解质的稀溶液(C) 无限稀溶液(D) 浓度在一定范围的溶液7. 反应的标准平衡常数与温度T的关系为dln K /d T = ∆r H m /RT2,则( )(A) K 必随温度升高而加大(B) K 必随温度升高而减小(C) K 必随温度升高而改变(D) 随温度升高,K 可增大、减少或不变8. 一定体积的水,当聚成一个大水球或分散成许多水滴时,在同温度下,两种状态相比,以下性质保持不变的有( )(A) 表面能(B) 表面张力(C) 比表面(D) 液面下的附加压力9.某零级反应A = B+ C开始时反应物浓度为0.2 mol·dm-3,其速率常数k为1.25×10−5 mol·dm-3·s-1,则其反应完成所耗时间t为(A) 8000 s (B) 12000 s (C) 16000 s (D) 18000 s10.在一个绝热的刚性容器中发生一个化学反应,使系统的温度升高和压力增大,则有(A) Q>0,W<0,∆U < 0 (B) Q=0,W=0,∆U = 0(C) Q=0,W<0,∆U < 0 (D) Q>0,W=0,∆U > 0二、计算题(6题,共60分)1. 298 K,101.3 kPa下,Zn 和CuSO4溶液的置换反应在可逆电池中进行,做出电功200 kJ,放热6 kJ,求该反应的Δr U,Δr H,Δr S,Δr A,Δr G(设反应前后的体积变化可忽略不计)。
物理化学第四版课后答案

第一章气体的pVT性质1.1物质的体膨胀系数与等温压缩率的定义如下试推出理想气体的,与压力、温度的关系。
解:根据理想气体方程1.5两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。
若将其中的一个球加热到100 C,另一个球则维持0 C,忽略连接细管中气体体积,试求该容器内空气的压力。
解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。
标准状态:因此,1.9 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体。
(1)保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试求两种气体混合后的压力。
(2)隔板抽取前后,H2及N2的摩尔体积是否相同?(3)隔板抽取后,混合气体中H2及N2的分压立之比以及它们的分体积各为若干?解:(1)等温混合后即在上述条件下混合,系统的压力认为。
(2)混合气体中某组分的摩尔体积怎样定义?(3)根据分体积的定义对于分压1.11 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。
重复三次。
求釜内最后排气至恢复常压时其中气体含氧的摩尔分数。
解:分析:每次通氮气后至排气恢复至常压p,混合气体的摩尔分数不变。
设第一次充氮气前,系统中氧的摩尔分数为,充氮气后,系统中氧的摩尔分数为,则,。
重复上面的过程,第n次充氮气后,系统的摩尔分数为,因此。
1.13 今有0 C,40.530 kPa的N2气体,分别用理想气体状态方程及van der Waals 方程计算其摩尔体积。
实验值为。
解:用理想气体状态方程计算用van der Waals计算,查表得知,对于N2气(附录七),用MatLab fzero函数求得该方程的解为也可以用直接迭代法,,取初值,迭代十次结果1.16 25 C时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压)总压力为138.7 kPa,于恒定总压下冷却到10 C,使部分水蒸气凝结为水。
物理化学第四章

• 但碳的相图中最多只能三相共存,不可能四相共存.
一.克-克方程(Clausius-Clapeyron equation)
• 当单组分体系两相共存时,自由度f=3-2=1, 体系只有一个自由度。 • 单组分的相变温度与压力之间存在一定的关 系, 此关系即为克-克方程. • 设一纯物质在T,p下达两相平衡:
相图:表示体系状态变化的图形
•
• 相(phase): 体系内物理性质和化学性质
完全均匀的部分. • 均匀的要求: •
均匀到分子水平
• 一个体系中可以含有多个相,这些相与相 之间一般存在明显的界面,界面处体系的 热力学性质是间断的.
气体:凡气体成一相.
气体体系无论有多少种气体,一般都达到分子水 平的混合,故为一相。
• (3)式称为克拉贝龙方程. • 克拉贝龙方程适用于纯物质任何平衡相变过 程,应用范围很广.
• 1. 气-液,气-固两相平衡:
• 纯物质的两相平衡中有一相为气相,另一相必为 凝聚相. 以气-液平衡为例,有: • dp/dT=Hm/TVm= Hm/T(Vm,g-Vm,l) (4) • ∵ Vm,g>>Vm,l • ∴ Vm,g-Vm,l≈ Vm,g=RT/p • 代入(4)式: • dp/dT= Hm/[T(RT/p)] •
• 体系的独立变量数f(即自由度)应该等于总变量 数减去关系式总数: • 总变量数:S+2 • 关系式数:+S(-1) • •
f = S+2--S+S
f = S- + 2
(1)
• (1)式就是相律的数学表达式. • 相律的物理含义是:
体系的自由度等于体系的物种数S减去相 数再加上环境变量数2(温度和压力).
物理化学 第四章 第四节 部分互溶和完全不互溶

如果两种液体在性质上差别很大,它们间 的相互溶解度很小,这样的体系可看作完全 不互溶的双液系。在这种体系中任一液体的 蒸气压与同温度单独存在时完全一样,并与 两种液体存在的量无关。溶液的总蒸气压就 等于各个液体单独存在时蒸气压之和。
P= P*A+P*B
由于体系的总蒸气压P大于任一纯组分
1. 具有最高临界溶解温度的类型
此类型即系统温度高于最高临界溶解温度时在任意浓度范围
内都为均匀一相,系统温度低于最高临界溶解温度时一定浓 度范围内溶液分层。 T-x相图如下:
t C
t1 a
l1
d
l2 b
tC tC:最高临界溶解温度 帽形线ACB:相分界线
帽形线外:为均匀一相
帽形线内:溶液分层
,
mH 2O mB
M H2O
P* H 2O
MB
PB*
m P M H2O
* H 2O
H 2O
mB
PB*M B
式中称水蒸气消耗系数,即蒸出单位质量有机物所 需水蒸气的量。
二、完全不互溶双液系
水 蒸 气 发 生 器 水蒸气蒸馏
不互溶的双液体系
液体在液体中的溶解也适用相似相溶的规律,凡 是组成、结构和极性近似的液体往往可以互溶。例 如乙醇和水,甲醇和乙醇等均是无限互溶的体系。
t
C
tC
t1 a l1 d l2 b
w 水 Aw1 w2 B 酚
W酚%
系统无变量,压力、温度确定,两相组成也定(为该温度、 压力下各自的饱和溶解度),帽形线以下为两相平衡区,杠 杆规则可计算两相的相对量。
当温度 t 升至 tC (最高临界溶解温度)及 tC 以上,系统为均 匀一相。
《物理化学第4版》第四章4-1 多组分系统组成表示法ppt课件

1. 混合物及溶液的分类
多组分系统
非均相(多相) 均相(单相)
混合物 溶液
1
(i) 对混合物中的各组分不区分为溶 剂及溶质,对各组分均选用同样 的标准态;
(ii) 对溶液中的各组分区分为溶剂 及溶质,并选用不同的标准态加 以研究。
2
按聚集状态不同,
气态混合物如空气;
混合物液态混合物如苯和甲苯;
固态混合物如粘土和沙石。 液态溶液如Mn Fe液态合金;
溶液 固态溶液(固溶体黄铜 青铜等);
3
液态溶液— 简称溶液电非解电质解溶质液溶如 液食 (盐 分水 子溶 溶液液; 如高分子溶液)
非电解质溶液:蔗糖水溶液; 氧O2溶于水; 乙醇水溶液 H2O(l)—— C6H5NH3(l)溶液;
金属溶液: Fe(l)—— Mn(l)溶液; Cu(l)——Zn(l)溶液。
MA
bB
MA
17
def cB nB /V
SI单位:moldm-3
8
五、溶质B的质量摩尔浓度 溶质B的物质的量与溶剂的质量之比。
bB 或mB def nB / mA
用于液态或固态溶液的溶质,也可 以用下式定义:
bB 或mB def nB /(nAM A )
SI 单位:molkg-1 9
由于溶质B的质量摩尔浓度与温度无 关,在热力学处理中比较方便。在电 化学中也主要采用该浓度表示电解质 的浓度。
12
x1 = n1 / (n1 + n2 )= 0.321 mol / (0.321 mol+0.652 mol) = 0.329 b1= n1 /m2 = 0.321 mol / 30.0 10-3 kg = 10.7 molkg-1 w1 = m1 / ( m1+ m2 ) = 25.0 g / (25.0+30.0) g = 0.455
物理化学 第四章 多组分系统热力学

AB
( nB
)T , p ,nC
G
GB
( nB
)T , p ,nC
注意:偏摩尔量的下脚标为:T,P,C(C≠ B)
使用偏摩尔量时应注意: 1.偏摩尔量的含义是:在等温、等压、保持B物质 以外的所有组分的物质的量不变的条件下,广度性 质X的随组分B的物质的量的变化率。
2.只有广度性质才有偏摩尔量,而偏摩尔量是强度 性质。
六、偏摩尔量之间的函数关系
对于组分B:VB、UB、HB、SB、AB、GB之间的关系:
HB= UB +PVB ,
AB= UB -TSB
GB = HB -TSB= UB +PVB -TSB UB =AB+PVB
(
GB P
)T
,nA
VB
(
GB T
)
P,nA
SB
( GB )
[T T
]P,nB
3.纯物质的偏摩尔量就是它的摩尔量。
4.任何偏摩尔量都是T,p和组成的函数。
偏摩尔量的集合公式
设一个均相体系由1、2、 、k个组分组成,则体 系任一广度量Z应是T,p及各组分物质的量的函数,即:
X X (T , p, n1, n2,, nk )
在等温、等压条件下:
X
X
dX
( n1
···········
dG= dG(α) + dG(β) +·········
恒T,p时 dG SdT Vdp
B
dnB
B
同理,有
dU TdS pdV B ( )dnB ( ) B
dH TdS Vdp B ( )dnB ( ) B
物理化学第四章化学平衡练习题及答案

第四章 化学平衡练习题一、判断与问答题:1.反应的吉布斯函数变就是反应产物与反应物之间的吉布斯函数的差值。
2.在恒定的温度和压力条件下,某化学反应的∆r G m 就是在一定量的系统中进行1mol 的 化学反应时产物与反应物之间的吉布斯函数的差值。
3.因为m rG ∆= -RT ln K ,所以m r G ∆是平衡状态时的吉布斯函数变化。
4.m rG ∆是反应进度的函数。
5.在等温等压条件下,∆r G m > 0的反应一定不能进行。
6.∆r G m 的大小表示了反应系统处于该反应进度ζ时反应的趋势。
7.任何一个化学反应都可以用m rG ∆来判断其反应进行的方向。
8.在等温、等压、W’ = 0的条件下,系统总是向着吉布斯函数减小的方向进行。
若某化 学反应在给定条件下∆r G m < 0,则反应物将完全变成产物,反应将进行到底。
9.在等温、等压不作非体积功的条件下,反应的∆ r G m < 0时,若值越小,自发进行反应 的趋势也越强,反应进行得越快。
10.某化学反应的∆ r G m 若大于零,则K 一定小于1。
11.理想气体反应 A + B = 2C ,当p A = p B = p C 时,m r G ∆的大小就决定了反应进行方向。
12.标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。
13.在给定温度和压力下发生的PCl 5的分解反应,只须测定平衡时混合气体的密度就可 以求知平衡常数了。
14.因 K = f (T ),所以对于理想气体的化学反应;当温度一定时,其平衡组成也一定。
15.若已知某气相生成反应的平衡组成,则能求得产物的m rG ∆。
16.温度T 时,若K = l ,说明这个反应在此温度,压力为100kPa 的条件下已达到平衡。
17.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。
18.因K = ∏(a B ν) ,所有化学反应的平衡状态随化学反应计量系数而改变。
大学物理化学4-多组分体系热力学课后习题及答案

多组分体系热力学课后习题一、是非题下述各题中的说法是否正确?正确的在题后括号内画“√”,错的画“⨯”1. 二组分理想液态混合物的总蒸气压大于任一纯组分的蒸气压。
( )2. 理想混合气体中任意组分B 的逸度B ~p 就等于其分压力p B ~。
( )3.因为溶入了溶质,故溶液的凝固点一定低于纯溶剂的凝固点。
( ) 4.溶剂中溶入挥发性溶质,肯定会引起溶液的蒸气压升高。
( ) 5.理想溶液中的溶剂遵从亨利定律;溶质遵从拉乌尔定律。
( ) 6. 理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p 与液相组成x B 呈线性关系。
( )7. 如同理想气体一样,理想液态混合物中分子间没有相互作用力。
( )8. 一定温度下,微溶气体在水中的溶解度与其平衡气相分压成正比( )9. 化学势是一广度量。
( )10. 只有广度性质才有偏摩尔量( )11. )B C C,(,,B ≠⎪⎪⎭⎫⎝⎛∂∂n V S n U 是偏摩尔热力学能,不是化学势。
( ) 二、选择题选择正确答案的编号,填在各题题后的括号内1. 在α、β两相中都含有A 和B 两种物质,当达到相平衡时,下列三种情况, 正确的是:( )。
(A)ααμ=μB A ; (B) βαμ=μA A ; (C) βαμ=μB A 。
2. 理想液态混合物的混合性质是:( )。
(A)Δmix V =0,Δmix H =0,Δmix S >0,Δmix G <0;(B)Δmix V <0,Δmix H <0,Δmix S <0,Δmix G =0;(C)Δmix V >0,Δmix H >0,Δmix S =0,Δmix G =0;(D)Δmix V >0,Δmix H >0,Δmix S <0,Δmix G >0。
3. 稀溶液的凝固点T f 与纯溶剂的凝固点*f T 比较,T f <*fT 的条件是:( )。
(A )溶质必需是挥发性的;(B )析出的固相一定是固溶体;(C )析出的固相是纯溶剂;(D )析出的固相是纯溶质。
南京大学物理化学4

3.A和G的计算 (1)一般方法 A=U-TS A= U- (TS) = U+T1S1-T2S2 定温A= U- TS 理想气体定温过程A= - TS G=H-TS G= H- (TS) = H+T1S1-T2S2 定温G= H- TS 理想气体定温过程G= - TS = A G=H-TS=U+pV-TS=A+pV dG=dA+pdV+Vdp 或G=A+p2V2-p1V1
(4)p,V,T都变化的过程 只做体积功的可逆过程 dU=δQR-pdV =TdS-pdV 故dS=dU/T+pdV/T 理想气体 dS=nCV,mdT/T+nRdV/V S=nCv,mln(T2/T1)+nRln(V2/V1) S= nCp,mln(T2/T1)-nRln(p2/p1) S= nCv,mln(p2/p1)+nCp,mln(V2/V1) (5)可逆相变 QR=H(相变潜热) S= H/T=n Hm/T
3化学势
(1)化学势的定义及多组分系统的热力学基本方程 (aG/anB)T,p,nC≠nB=B B叫做组分的B化学势,它是组分B的偏摩尔吉布斯能. dG=-SdT+Vdp+∑BdnB ① dU=TdS-pdV+ ∑BdnB ② dH=TdS+Vdp+ ∑BdnB ③ dA=-SdT-pdV +∑BdnB ④ ①②③④为多组分系统热力学基本方程,适用于变组成的封闭系统, 也适用于开放系统,也可用于组成可变的多相多组分系统的每一 相,∑BdnB代表定温定压下,当系统中由于加入或减少某些组分的 物质的量使系统组成变化时,引起吉布斯能的改变值. dG=-SdT+Vdp+∑B(α)dnB (α) ⑤ dU=TdS-pdV+ ∑B (α) dnB (α) ⑥ ⑦ dH=TdS+Vdp+ ∑B (α) dnB (α) dA=-SdT-pdV+ ∑B (α) dnB (α) ⑧ ⑤⑥⑦⑧用于多组分,多相系统的热力学基本方程.
物理化学第4章-2 化学平衡

1化学反应速率与化学平衡34.3.1 可逆反应与化学平衡(一)化学反应的可逆性和可逆反应绝大多数化学反应都有一定可逆性:例如:N 2 (g) + 3 H 2 (g) 2 NH 3 (g)只有极少数反应是不可逆的:例如: 2 KClO 3(s) =2 KCl (s) + 3 O 2 (g)可逆反应:在同一条件下,能同时向两个相反方向进行的反应。
4(二)化学平衡化学平衡的特征:(1)系统的组成不随时间而改变;(2)化学平衡是动态平衡。
(3)平衡状态与达到平衡的途径无关;定义:可逆反应在一定条件下,正反应速率等于逆反应速率时,反应体系所处的状态。
4.3.1 可逆反应与化学平衡5在373 K 恒温槽中反应一段时间后,达到平衡,测得平衡时N 2O 4和NO 2 浓度。
0.1600.100NO 2开始0.370.0700.100N 2O 4从反应混合物0.0720.100NO 2开始0.370.0140N 2O 4从产物0.1200NO 2开始0.360.0400.100N 2O 4从反应物c 2(NO 2)/c (N 2O 4)平衡浓度起始浓度N 2O 4-NO 2体系的平衡浓度(mol/L )(373K )化学平衡的实例N 2O 4 (g) 2 NO 2(g)无色红棕色64.3.2 平衡常数1. 定义:在一定温度下,可逆反应达到平衡时,产物浓度的方程式计量系数次方的乘积与反应物浓度的方程式计量系数次方的乘积之比,为一常数,称为“平衡常数”。
用K 表示。
2. 意义:表示在一定条件下,可逆反应能进行的极限。
K 越大,正反应进行得越彻底。
7有关化学平衡常数的说明①化学平衡常数K 只是温度的函数。
②平衡常数不涉及时间概念,不涉及反应速率。
例如:N 2O 4(g) 2 NO 2(g)T /K 273 323 373K 5×10-4 2.2×10-2 3.7×10-12SO 2(g) + O 2(g) 2SO 3(g) K =3.6 ×1024(298K)K 很大,但常温下反应速率很小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华东理工大学《物理化学》(上)单元测试卷(四)相平衡一、选择题(每小题1分,共30分)1. 只要知道纯物质的饱和蒸汽压与温度的定量关系,即可得到二元混合物气液平衡相图的是 。
A :实际溶液;B :理想溶液;C :理想稀溶液2. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :液相线示意了溶液的蒸气压随液相组成的变化关系;B :液相线为直线是理想混合物的一个特征;C :液相线为泡点线3. 对于二元理想混合物的气液平衡相图(恒温),以下说法不正确的是 。
A :气相线示意了溶液的蒸气压随气相组成的变化关系;B :气相线为曲线;C :气相线为露点线4. 对于二元理想混合物的气液平衡相图(恒压),以下说法不正确的是 。
A :液相线为泡点线,气相线为露点线;B :液相线示意了沸点随液相组成的变化;C :液相线为直线5. 如二元混合物气液平衡相图中出现正偏差时,下列正确的说法是 。
A : i i i x p p *<;B :正偏差强烈时,可形成最高恒沸混合物;C :正偏差强烈时,可形成最低恒沸混合物6. 如二元混合物气液平衡相图中出现负偏差时,下列正确的说法是 。
A : *i i i p p x >;B :负偏差强烈时,可形成最低恒沸混合物;C :负偏差强烈时,可形成最高恒沸混合物7. 二元混合物气液平衡相图中出现正偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :第二种物质的加入使分子的缔合程度降低;C :溶液中不同组分分子间的相互吸引比纯物质弱8. 二元混合物气液平衡相图中出现负偏差的原因,不正确的说法是 。
A :溶液中不同组分分子间相互作用较强;B :不同组分间生成氢键而相互缔合;C :溶液中不同组分分子间的相互吸引比纯物质弱9. 关于恒沸混合物,不正确的说法是 。
A :恒沸混合物是一种具有确定组成的化合物;B :恒沸混合物并不是一种具有确定组成的化合物;C :在恒沸点,泡点线与露点线重合10. 二元系的气液平衡相图(恒压)中,恒沸点的自由度为 。
A :0;B :1;C :211. 已知苯的沸点是353.3 K ,乙醇为351.6 K 。
两者可形成共沸物,其组成为含乙醇47.5%(摩尔分数),共沸点为341.2 K 。
今有含乙醇77.5%的苯溶液,当达到气液平衡后,气相中含乙醇为y 2,液相中含乙醇为x 2。
下列结论正确的是 。
A :y 2>x 2;B :y 2=x 2 ;C :y 2<x 212. 已知苯的沸点是353.3 K ,乙醇为351.6 K 。
两者可形成共沸物,其组成为含乙醇47.5%(摩尔分数),共沸点为341.2 K 。
今将含乙醇77.5%的苯溶液进行精馏,则能得到 。
A :纯苯和恒沸混合物;B :纯乙醇和恒沸混合物;C :纯乙醇13. 物质A 和B 形成理想混合物。
在温度T 时A 和B 的饱和蒸气压分别为*A p 和*B p ,并且**>BA p p ,气相的平衡蒸气总压为p ,下列关系式正确的是 。
A :**>>B A p p p ; B :**>>BA p p p ;C. p p p >>**B A 14. 物质A 和B 形成具有最高恒沸点的系统。
精馏分离时,塔顶将得到 。
A :沸点较低的纯物质;B :纯物质A 或B ,视原始混合物组成而定;C :恒沸混合物15. 物质A 和B 形成部分互溶的两个液相α和β,在温度T 时,其平衡气相总压为p 1。
今设法将α相和β相分开,温度仍为T ,二者的平衡气相总压分别为p 2和p 3。
则p 1,p 2,p 3之间的关系是 。
A :123p p p >=;B :123p p p =+;C :321p p p ==16. 在一定温度下,纯物质A 和B 的饱和蒸气压分别为*A p 和*B p ,二者形成理想溶液。
当处于气液平衡时,气相组成y B 与液相组成x B 之间的函数关系为 。
A :B B B A B A B ()p x y p p p x ****=+-; B :B B B y p x *=;C :B B B A B A B()p x y p p p x ****=++ 17. 定压下,物质A 和B 的液态混合物升温到300K 时达到气液平衡,此时气相组成B y =0.850,液相组成B x =0.350。
现对原始组成o B x 的不同混合物升温到300K 并达到气液平衡,要求平衡时B y =0.850, B x =0.350,则o B x 的取值要求是 。
A :oB x >0.850; B :0.850 ≥o B x ≥0.350;C :o B x <0.35018. 要使具有上部会溶点的两组分液-液平衡系统成为单相,可采取的措施是 。
A :升高温度;B :降低温度;C :升高压力19. 要使具有下部会溶点的两组分液-液平衡系统成为单相,可采取的措施是 。
A :升高温度;B :降低温度;C :升高压力20. 在NaCl 饱和水溶液中,固体NaCl 的化学势 溶液中NaCl 的化学势相比。
A :大于;B :等于;C :小于21. 在A 和B 两组分系统的液固平衡相图中,如A 和B 形成3种稳定化合物,并且固相A 固相B 以及固相化合物之间彼此完全不互溶,则在A 和B 完整的液固平衡相图中最低共熔点有 个。
A :2;B :3 ;C :422. 在A 和B 两组分系统的液固平衡相图中,如A 和B 可形成1种稳定的化合物, A 和B以及固态化合物彼此完全不互溶,则在液固平衡相图中最低共熔点有 个。
A :2;B :3;C :423. Bi-Cd 液固平衡相图属于固相完全不互溶、液相完全互溶的类型。
含30%Cd 的Bi-Cd 混合物的步冷曲线在T 1出现水平线段,含70%Cd 的Bi-Cd 混合物的步冷曲线在T 2出现水平线段,则T 1 T 2。
A :>;B :=;C :<24. 水和异丁醇的液相部分互溶,在101.325kPa 下,其气液液平衡相图中单相区有 个。
A :1;B :2;C :325. 273.15K 时两杯由A 和B 形成的理想溶液,甲杯中溶液组成为x A =0.1,乙杯中溶液组成x A =0.2。
现将两个杯子放在同一密闭容器中,经足够长的时间,则甲杯中A 的量和B 的量发生的现象是。
A:A增加,B降低;B:A降低,B增加;C:A增加,B不变26.压力增加时,单组分的熔点。
A:只能降低;B:只能升高;C:视具体物质可升高或降低27.水蒸气蒸馏通常适用于某有机物与水组成的。
A:液相完全互溶系统;B:液相部分互溶系统;C:液相完全不互溶系统28.金(熔点1063℃)与银(熔点961℃)形成没有最高或最低共熔点的固相完全互溶的液固相图,取质量分数50%的合金溶液冷却,首先析出的固熔体含金量50%。
A:大于;B:等于;C:小于29.水中含有碘,在恒温下加入CS2液体,平衡后,水相中碘的化学势CS2中碘的化学势。
A:大于;B:等于;C:小于30.Au-Ag两组分系统液固平衡相图中固相为混合物。
将含一定量Ag的熔融混合物冷却,则析出的晶体是。
A:纯金属Au;B:纯金属Ag;C:固体混合物二、(每小题5分,共10分)1.硝基苯和水组成的系统可看作完全不互溶双液系,在101.325 kPa下,其沸点为372.15 K,已查得372.15 K时水的饱和蒸气压为97.730 kPa。
若将混有杂质的硝基苯进行水蒸气蒸馏以除去不溶性杂质,试求馏出物中硝基苯所占的质量分数。
2.若在合成某一化合物后,进行水蒸气蒸馏,混合物的沸腾温度为368.15 K,当天的气压为99.190 kPa。
馏出物经分离、称量后知水的质量分数为0.45,试估计此化合物的摩尔质量。
已知水在368.15 K时的饱和蒸气压为84.526 kPa。
三、(此题总分10分)下图为A-B二元混合物的气液平衡相图(恒压)。
完成以下选择题。
1.将组成x B = 0.30 的液态溶液进行一次简单蒸馏—加热到100℃停止蒸馏,则平衡气相与液相的组成分别是(大致估计,后同)。
A:y B = 0.49,x B = 0.25;B:y B = 0.60,x B = 0.20;C:y B = 0.49,x B = 0.152.将(1)所得的液相重新加热到105℃时平衡的液相组成x B ,以及将(1)所得的气相冷凝到95℃时平衡的气相组成y B 分别是。
A:x B = 0.25,y B = 0.65;B:x B = 0.14,y B = 0.65;C:x B = 0.10,y B = 0.493. 将x B =0.40的液态溶液加热到95℃恰好出现气泡时,气泡组成y B = 。
A :0.65;B :0.55;C :0.754. 将组成y B =0.60气体混合物冷却到97℃恰好出现液滴时,液滴组成x B = 。
A :0.55;B :0.45;C :0.355. 1mol 组成为x B =0.50的液态混合物加热到95 ℃达到平衡时,n V /n L = 。
A :1/1;B :1/2;C :2/36. 组成为x B =0.90的混合物的泡点和露点温度分别是 。
A :t 泡=82℃,t 露=85℃;B :t 泡=85℃,t 露=82℃;C :t 泡=80℃,t 露=110℃7. 物质A 和B 的沸点分别是 。
A :t A =111℃,tB =80℃; B :t A =80℃,t B =111℃;C :无法确定8. 采用精馏的方法分离A 和B 的混合物时,塔顶可得到 。
A :纯A ;B :纯B ;C :无法确定9. 当系统压力增加时,发生的现象是 。
A :气相线和液相线均上移;B :气相线和液相线均下移;C :气相线上移、液相线均下移10. 在气相线与液相线围成的中间区域,系统的自由度等于 。
A :0;B :1;C :2四、(此题总分10分)二元混合物的液固平衡相图如下图所示,试根据相图回答下列问题:1. 试写出相图上各相区的相态。
① ;② ; ③ ; ④ ; ⑤ ;⑥ ;⑦ ; ⑧ ; ⑨ ; ⑩2. 化合物C 和D ,何者是稳定化合物?3. 分别计算相区①、⑦、⑧的自由度;4. 相图中,过E 1的水平线上,平衡的相态分别是什么?5. 如果化合物C 的组成28.0B =w ,最低共溶点1E 处组成为01.0B ='w ,现将1kg 组成为18.0=o w 的混合物O 冷却,使其析出化合物C ,问最多可析出多少纯化合物C ?6. 在相图右面的温度-时间坐标内,绘出系统由O 点开始的冷却曲线。
五、(此题总分10分)下图是物质M 和N 的液固平衡相图。
