锂电池的一些基本知识
锂电池入门知识

锂电池入门知识点锂电池的定义:由锂金属或锂合金作为负极材料,使用非水电解质溶液的电池。
1.锂电池的分类:锂电池大致可以分为锂金属电池和锂离子电池。
锂离子电池不含有金属态的锂,并且是可以充电的。
锂离子电池的电化学原理:以采用钴酸锂为正极材料,石墨为负极材料为例。
在充电过程中,锂离子从正极中脱出(脱嵌),然后经过电解质嵌入(插入)负极石墨材料中,形成锂离子的石墨嵌入化合物;而在放电过程中锂离子的运动方式相反。
锂离子电池充放电,正负极材料在常温常压下发生以下氧化还原反应Li1−x Co O2+Li x C6LiCoO2+6C放电过程中的电极反应为:正极(还原反应,得电子)Li1-x CoO2+xLi+e-→LiCoO2负极(氧化反应,失电子)Li x C6→6C+xLi++xe-充放电过程中的电极反应与上述式(1-2)、式(1-3)反应过程相反。
因此,当采用钴酸锂为正极材料和石墨为负极材料时,由于上述氧化还原反应具有良好的可逆性,锂离子电池循环性能优异;由于石墨嵌锂化合物密度低,锂离子电池质量比能量高;由于氧化还原对Li+/Li的电位在金属电对中最负,Li+电池的工作电压比能量高。
2.电池结构及分类锂离子电池通常包含正极、负极、隔膜、电解液和壳体等几个部分。
正负极通常采用一定空隙的多孔电极,由集流体和粉体涂覆层构成。
负极极片由铜箔和负极粉体涂覆层构成,正极极片由铝箔和正极粉体涂覆层构成,正负极粉体涂覆层由活性物质粉体、导电剂、粘结剂及其他助剂构成。
活性物质粉体间和粉体颗粒内部存在的孔隙可以增加电极的有效面积,降低电化学极化。
同时由于电极反应发生在固-液两相界面上,多孔电极有助于减少锂离子电池充电过程中枝晶的生成,有效防止短路。
3.常见的锂离子电池按照外形分为扣式电池、方形电池和圆柱形电池。
锂离子电池的分类方法:外形法分类:扣式电池、圆柱形电池和方形电池电解液法分类:凝胶电解质电池和聚合物电解质电池,正负极材料分类法:磷酸铁锂电池、三元材料电池和钛酸锂电池等壳体分类法:钢壳电池、铝壳电池和软包电池等用途分类法;3C电池和动力电池等方形电池型号:通常用厚度+宽度+长度来表示圆形柱电池:通常用直径+长度+0来表示2.锂离子电池原材料1、正极材料通常为微米级粉体材料。
锂电池需要了解的知识

锂电池需要了解的知识锂电池是一种常见的电池类型,它具有高能量密度、长寿命、轻便等优点,因此被广泛应用于移动设备、电动车、储能系统等领域。
如果你想了解锂电池,以下是一些需要了解的知识。
1. 锂电池的结构锂电池由正极、负极、电解液和隔膜组成。
正极通常是由锂化合物制成,如锂铁磷酸铁锂(LiFePO4)、三元材料(LiCoO2、LiMn2O4、LiNiCoAlO2等)等。
负极通常是由碳材料制成,如石墨、硅石墨等。
电解液是锂盐和有机溶剂的混合物,隔膜则用于隔离正负极。
2. 锂电池的工作原理锂电池的工作原理是通过正负极之间的离子传输来实现电荷和放电。
在充电时,正极材料中的锂离子会向负极移动,同时电子会从负极流向正极,这样就将电荷储存在电池中。
在放电时,正负极之间的锂离子会向正极移动,同时电子会从正极流向负极,这样就释放出储存的电荷。
3. 锂电池的优缺点锂电池具有高能量密度、长寿命、轻便等优点,因此被广泛应用。
但是,锂电池也存在一些缺点,如容易受到高温、过充、过放等因素的影响,可能会导致电池损坏、甚至爆炸。
此外,锂电池的成本较高,也需要特殊的处理方式。
4. 锂电池的维护和保养为了延长锂电池的寿命,需要注意以下几点:(1)避免过充和过放,尽量保持电池电量在20%~80%之间;(2)避免高温环境,不要将电池长时间暴露在高温环境下;(3)避免震动和碰撞,不要将电池摔落或受到强烈的震动;(4)定期充电和放电,可以保持电池的活性。
锂电池是一种重要的电池类型,具有广泛的应用前景。
了解锂电池的结构、工作原理、优缺点以及维护保养等知识,可以更好地使用和管理锂电池,延长其寿命,提高其安全性。
新能源锂电知识点总结

新能源锂电知识点总结随着全球能源危机的加剧和环境问题的日益严重,人们对新能源的需求越来越迫切。
而作为新能源的重要组成部分之一,锂电池因其高能量密度、长周期寿命以及对环境友好等优势,成为了当今最受关注的动力电池之一。
本文将详细介绍新能源锂电的相关知识点,包括锂电池的基本原理、种类、应用领域以及未来发展趋势等内容。
一、锂电池的基本原理锂电池是一种以锂离子为电极材料的电池,其基本原理是通过电化学反应将电能转化为化学能。
锂电池由正极、负极、电解液和隔膜组成。
在充电时,正极材料(如三氧化锂)释放出锂离子,负极材料(如石墨)则吸收这些锂离子。
而在放电时,正负极反应,锂离子从负极移动到正极,释放出电能。
这种电化学反应的循环便构成了锂电池的电荷与放电过程。
二、锂电池的种类1. 锂离子电池锂离子电池是目前最为常见的锂电池种类,广泛应用于电动车、手机、笔记本电脑等设备中。
它使用锂离子在正负极之间的移动来储存和释放电能,具有高能量密度、长寿命、轻便等优点。
2. 磷酸铁锂电池磷酸铁锂电池是锂离子电池的一种改进型,它使用磷酸铁锂作为正极材料,相比于传统的锂离子电池,磷酸铁锂电池具有更高的安全性、更长的寿命以及更好的耐高温性能。
3. 钛酸锂电池钛酸锂电池是一种新型的锂离子电池,它使用钛酸锂作为正极材料,可以实现更高的电池电压和更高的能量密度,具有更好的循环寿命和更快的充放电速率。
三、锂电池的应用领域1. 电动车随着全球环境问题的日益严重,电动车作为一种环保的交通工具,受到了越来越多的关注。
而锂电池由于其高能量密度和长寿命等特点,成为了电动车最常用的动力电池之一。
2. 可穿戴设备随着科技的不断进步,人们对可穿戴设备的需求也在不断增加。
而锂电池的高能量密度和轻便的特点,使得它成为了可穿戴设备的主要电池类型。
3. 储能系统随着可再生能源的不断发展,储能系统的需求也在逐渐增加。
而锂电池由于其高能量密度和循环寿命长等特点,成为了储能系统的主要选择。
锂电池安全使用及其知识培训

锂电池安全使用及其知识培训锂电池作为一种高效、环保的电源,广泛应用于各类电子设备中。
然而,由于锂电池具有较高的化学活性,使用不当可能会引发安全事故。
为此,加强锂电池的安全使用及其知识培训显得尤为重要。
本文档旨在为广大用户普及锂电池的安全使用知识,以确保用户的人身和财产安全。
一、锂电池的基本特性1.1 锂电池的组成锂电池主要由正极材料、负极材料、电解液、隔膜和外壳等部分组成。
1.2 锂电池的工作原理锂电池在工作过程中,正极材料发生氧化反应,负极材料发生还原反应,电解液作为介质传递离子,从而实现电能的储存与释放。
二、锂电池的安全使用注意事项2.1 存储安全1. 存放在干燥、通风的环境中,避免潮湿、高温、高压等恶劣条件。
2. 避免与金属物品接触,以防短路。
3. 不要将锂电池暴露在阳光下长时间,以免过热。
2.2 充电安全1. 使用符合国家标准的原装充电器进行充电。
2. 充电时,避免将电池受到剧烈震动、撞击或高温影响。
3. 充电过程中,如发现电池过热、鼓包、漏液等异常现象,请立即停止充电并妥善处理。
2.3 使用安全1. 不要超过电池的最大容量使用,避免长时间高温工作。
2. 不要将电池暴露在高温或低温环境中,以免性能受损。
3. 避免电池受到剧烈撞击、刺穿或火源烧烤。
2.4 处理废弃电池的安全1. 不要随意丢弃锂电池,应按照当地规定进行回收处理。
2. 废弃电池应避免接触到水、火源和金属物品,以免发生意外。
三、锂电池的维护与保养1. 定期检查电池外观,如有异常现象,及时处理。
2. 避免电池长时间闲置不用,建议每3个月进行一次充放电循环,以保持电池活性。
3. 不要尝试拆解、改装电池,以免造成安全事故。
四、培训内容与要求1. 了解锂电池的基本特性、工作原理和安全使用注意事项。
2. 掌握锂电池的存储、充电、使用和处理废弃电池的正确方法。
3. 提高安全意识,遇到电池相关问题时,能够及时采取正确措施。
五、培训方式与时间1. 培训方式:线上或线下授课,结合实际案例进行讲解。
锂电池基本知识

锂电池基本知识锂电池是一种以锂离子为原料的电池,被广泛应用于电子设备、电动车辆和储能系统等领域。
它具有高能量密度、长寿命、轻巧小型等优点,因此备受青睐。
1. 锂电池的构造锂电池主要由正极、负极、电解质和隔膜四部分组成。
正极通常使用锂化合物,如氧化钴、磷酸铁锂等,负极则使用碳材料。
电解质是锂离子在正负极之间传递的介质,常用液态电解质为聚合物电解质。
隔膜则起到隔离正负极的作用,防止短路。
2. 锂电池的工作原理锂电池的工作原理是通过正负极之间的锂离子传递来实现电荷和放电过程。
当充电时,锂离子从正极释放出来,经过电解质和隔膜,嵌入到负极的碳材料中。
而在放电时,锂离子从负极脱嵌,经过电解质和隔膜,重新嵌入到正极的锂化合物中。
这个过程是可逆的,因此锂电池可以反复充放电。
3. 锂电池的优点锂电池具有高能量密度,即单位重量或体积所储存的电能较高,能够提供更长的使用时间。
同时,锂电池具有较低的自放电率,即在不使用的情况下,电池自身的电量损失较小。
此外,锂电池还具有长寿命、低污染、快速充电等优点。
4. 锂电池的分类锂电池根据其正极材料的不同可以分为多种类型,常见的有锂离子电池、锂聚合物电池和锂硫电池。
其中,锂离子电池是目前最常用的,具有较高的能量密度和较长的寿命。
锂聚合物电池则因其更高的能量密度和更薄的设计,被广泛应用于便携式电子设备。
锂硫电池则具有更高的能量密度和更低的成本,但目前仍在研发阶段。
5. 锂电池的安全性锂电池在使用过程中需要注意安全性。
由于锂电池内部的锂金属非常活泼,在遇到高温或物理损伤时可能发生短路、过热甚至起火爆炸的情况。
因此,锂电池的设计中通常包含了安全防护措施,如保护电路、热敏感元件和隔热材料等。
此外,用户在使用锂电池时也要遵循正确的操作方法,避免过度充放电、避免撞击或损坏电池等。
总结:锂电池作为一种高性能的电池技术,已经广泛应用于各个领域。
它的构造简单,工作原理清晰,具有高能量密度、长寿命等优点。
锂电池百科知识

锂电池百科知识
锂电池是一种充电电池,使用锂离子在正负两极之间移动来存储和释放电能。
它是目前最常见的可充电电池之一,广泛应用于电动汽车、手机、笔记本电脑、无人机和其他便携式电子设备中。
以下是有关锂电池的一些基本知识:
1. 成分:锂电池由正极、负极、电解质和隔膜组成。
正极通常使用氧化钴、磷酸铁锂等材料,负极通常使用石墨或锂钛酸锂等材料。
2. 工作原理:锂电池的工作原理是在充电时,锂离子通过电解液中的电解质移动从正极向负极,负极材料将锂离子插入其晶格中进行储存。
在放电时,锂离子从负极移动到正极,通过外部电路释放电能。
3. 优点:锂电池具有高能量密度、长循环寿命、轻便和无记忆效应的优点。
它们还具有较低的自放电速度和较少的环境污染。
4. 缺点:锂电池的缺点包括较高的成本、安全性问题(例如过充、过放、过热可能导致爆炸或火灾)以及对稀有资源的依赖(锂)。
5. 类型:常见的锂电池类型包括锂离子电池(Li-ion)、锂聚
合物电池(Li-polymer)和锂铁磷酸电池(LiFePO4)。
Li-ion
电池是最常见的一种,具有良好的能量密度和循环寿命。
Li-
polymer电池具有更高的安全性和柔性设计能力。
LiFePO4电池具有更高的安全性和较长的循环寿命,但能量密度较低。
6. 充电和保养:为了延长锂电池的寿命,需要遵循正确的充电和使用方法,如避免过充和过放、避免长时间存储在高温环境中、使用合适的充电器等。
总之,锂电池是一种常见的充电电池,具有广泛的应用前景,并且随着技术的不断进步,它的能量密度和循环寿命还将继续改善。
锂离子电池基础知识

电池基础知识培训资料一、锂离子电池工作原理与性能简介:1、电池的定义:电池是一种能量转化与储存的装置,它通过反应将化学能或物理能转化为电能,电池即是一种化学电源,它由两种不同成分的电化学活性电极分别组成正负极,两电极浸泡在能提供媒体传导作用的电解质中,当连接在某一外部载体上时,通过转换其内部的化学能来提供能源.2、锂离子电池的工作原理:即充放电原理。
Li-ion的正极材料是氧化钴锂,负极是碳。
当对电池进行充电时,电池的正极上有锂离子生成,生成的锂离子经过电解液运动到负极.而作为负极的碳呈层状结构,它有很多微孔,达到负极的锂离子就嵌入到碳层的微孔中,嵌入的锂离子越多,充电容量越高。
同样,当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。
回正极的锂离子越多,放电容量越高。
我们通常所说的电池容量指的就是放电容量。
在Li-ion的充放电过程中,锂离子处于从正极→负极→正极的运动状态。
Li—ion就象一把摇椅,摇椅的两端为电池的两极,而锂离子就象运动员一样在摇椅两端来回奔跑。
所以,Li—ion又叫摇椅式电池。
通俗来说电池在放电过程中,负极发生氧化反应,向外提供电子;在正极上进行还原反应,从外电路接收电子,电子从负极流到正极,而电流方向正好与电子流动方向相反,故电流经外电路从正极流向负极。
电解质是离子导体,离子在电池内部的正负极之间定向移动而导电,阳离子流向正极,阴离子流向负极。
整个电池形成了一个由外电路的电子体系和电解质的离子体系构成的完整放电体系,从而产生电能。
正极反应:LiCoO2==== Li1-xCoO2+ xLi+ + xe负极反应:6C + xLi+ + xe—=== Lix C6电池总反应:LiCoO2 + 6C ==== Li1-xCoO2 + LixC63、电池的连接:根据电池的电压与容量的需求,可以把电池做串联、并联及混连连接。
a、串联:电压升高,容量基本不变;b、并联:电压基本不变,容量升高;c、混联:电压与容量都会升高;4、化学电池的种类:锂离子电池按电池外形来分类,可分为圆柱形、方形、钮扣形和片状形等。
锂电池安全现场培训

锂电池安全现场培训锂电池在现代社会得到了广泛应用,但其安全性问题也备受关注。
为了提高工作人员对锂电池的安全意识和应急处置能力,进行锂电池安全现场培训是非常必要的。
本文将从锂电池的基本知识、安全操作规范和事故应急处置等方面进行阐述,以期增强读者对锂电池安全的认识和应对能力。
一、锂电池的基本知识1. 锂电池的构成:锂电池由正极、负极、电解质和隔膜等组成。
正极材料多为氧化物,负极材料多为碳或锂合金。
电解质是传递离子的介质,隔膜则起到隔离正负极的作用。
2. 锂电池的种类:常见的锂电池有锂离子电池、锂聚合物电池和锂金属电池等。
其中,锂离子电池使用最广泛,具有高能量密度和长循环寿命等优点。
3. 锂电池的工作原理:锂电池通过锂离子在正负极之间的迁移来实现电荷和放电过程。
充电时,锂离子从正极迁移到负极,放电时则相反。
二、安全操作规范1. 锂电池的存放:要将锂电池存放在通风良好、干燥、温度适宜的环境中,避免与易燃易爆物质接触。
同时,要避免锂电池受到挤压和外力冲击,以防发生短路或泄漏。
2. 锂电池的充放电:在充电过程中,要选择合适的充电器,并遵守充电器的使用说明。
在放电过程中,要避免过度放电,以免损害锂电池性能。
同时,不要将充电和放电过程中的锂电池长时间无人看管。
3. 锂电池的运输:在运输过程中,要将锂电池包装牢固,并将正负极与导体隔离,以避免短路。
同时,要遵守相关运输法规,避免与易燃易爆物质混运。
三、事故应急处置1. 电池短路:如果发生电池短路,应立即将电池放置在安全地点,并迅速与专业人员联系。
切勿用湿毛巾或水扑灭电池,以免引发更严重的事故。
2. 电池过热:如果电池过热,应立即停止使用,并将电池放置在通风处,避免继续发热。
切勿将过热的电池放入水中,以防发生爆炸。
3. 电池泄漏:如果发现电池发生泄漏,应迅速戴上防护手套,用塑料袋将电池包裹起来,并将其放置在通风处。
切勿直接接触泄漏的电池液。
通过以上的培训内容,相信大家对锂电池的安全性问题有了更深入的了解。
锂电池基础知识培训

锂电池基础知识培训锂电池是一种常见的电池类型,广泛应用于移动设备、电动车辆和可再生能源存储等领域。
本文将为大家介绍锂电池的基础知识,包括锂电池的结构、工作原理、充放电特性、安全性等方面。
一、锂电池结构锂电池通常由正极、负极、电解质和隔膜组成。
正极材料一般使用氧化物,如钴酸锂(LiCoO2)、磷酸铁锂(LiFePO4)等。
这些正极材料能够释放或吸收锂离子,实现电池的充放电过程。
负极材料通常采用石墨,能够嵌著锂离子形成锂插层化合物。
电解质是锂离子的传导介质,一般采用液态或聚合物电解质。
液态电解质具有高离子传导性和低内阻,而聚合物电解质则具有良好的安全性能。
隔膜用于隔离正负极,防止短路。
二、锂电池工作原理锂电池的工作原理是基于锂离子在正负极材料之间的嵌脱插过程。
充电时,外部电源提供电流,使得正极材料氧化,负极材料脱锂。
锂离子在电解液中移动,通过隔膜到达负极,嵌入到负极材料中。
放电时,锂离子从负极材料脱出,通过隔膜到达正极,嵌入到正极材料中。
同时,电子通过外部电路流动,产生电流,为外部设备供电。
锂电池的充放电过程是可逆的,可以循环多次使用。
三、锂电池充放电特性锂电池的充放电特性与其正负极材料有关。
充电时,锂电池通常采取恒流充电和恒压充电两个阶段。
恒流充电阶段中,电流保持不变,直到电池电压达到设定的峰值电压;恒压充电阶段中,电流逐渐减小,直到电池容量充满,电压保持恒定。
放电时,锂电池的电压会随着放电过程逐渐下降,当电压达到一定程度时需要停止放电,以避免过放。
锂电池的容量可以通过充放电循环实验来测试,常用的容量单位是安时(Ah)。
四、锂电池的安全性锂电池具有较高的能量密度,因此在不正确使用或存储时存在一定的安全风险。
首先,要注意避免过充和过放。
过充会造成电池内部压力过高,甚至发生爆炸;而过放会导致电池无法再次充电,损坏电池。
其次,在存储和携带锂电池时,应注意避免与金属物品短路,避免受到外力撞击。
此外,锂电池在高温环境下的使用会降低其寿命和安全性能,因此要避免长时间暴露在高温环境中。
超详细的锂电池知识介绍

超详细的锂电池知识介绍目录一、锂电池基础知识 (3)1.1 电池的基本概念 (4)1.2 锂电池的历史与发展 (5)二、锂电池的工作原理 (7)2.1 锂电池的化学原理 (8)2.2 锂电池的工作过程 (10)三、锂电池的结构与材料 (11)3.1 锂电池的基本结构 (12)3.2 锂电池的关键材料 (13)四、锂电池的性能特点 (15)4.1 锂电池的能量密度 (17)4.2 锂电池的功率密度 (18)4.3 锂电池的循环寿命 (19)五、锂电池的应用领域 (21)5.1 锂电池在手机领域的应用 (22)5.2 锂电池在笔记本电脑领域的应用 (23)5.3 锂电池在电动汽车领域的应用 (25)5.4 锂电池在储能系统领域的应用 (27)六、锂电池的制造工艺 (29)6.1 锂电池的制造流程 (31)6.2 锂电池的生产设备 (32)6.3 锂电池的质量控制 (33)七、锂电池的回收与再生 (35)7.1 锂电池的回收方法 (36)7.2 锂电池的再生技术 (37)7.3 锂电池回收再利用的意义 (39)八、锂电池的未来发展趋势 (40)8.2 锂电池的市场前景 (43)8.3 锂电池的环境挑战 (44)九、锂电池的安全问题及应对措施 (45)9.1 锂电池的安全隐患 (46)9.2 锂电池的安全防护措施 (48)9.3 锂电池的安全标准与规范 (49)十、锂电池的标准化与政策法规 (51)10.1 锂电池的标准化组织 (52)10.2 锂电池的政策法规 (53)10.3 锂电池产业的政策支持与监管 (54)一、锂电池基础知识电池种类:锂电池是一种依靠锂离子在正极和负极之间移动来进行储能和释放能量的电化学设备。
根据不同的分类标准,锂电池可以分为锂离子电池、锂聚合物电池、锂铁磷电池、锂铁锰电池等。
工作原理:锂电池的工作原理基于锂离子的嵌入和脱嵌过程。
在充电过程中,锂离子从正极材料中脱出,经过电解质传输至负极,然后嵌入负极材料;在放电过程中,锂离子从负极中脱出,经过电解质传输至正极,然后嵌入正极材料。
锂电电池知识点总结

锂电电池知识点总结锂电池是一种将化学能转换为电能的充电式电池。
它采用了锂盐作为电解质,以及正极和负极之间的锂离子传输来实现充电和放电。
锂电池的高能量密度、长循环寿命和较低的自放电率使其成为电子产品、电动工具和电动汽车等广泛应用的首选电池类型。
以下是一些关于锂电池的知识点总结:1. 锂电池的类型- 锂离子电池(Li-ion):是最常见和广泛应用的锂电池类型,常见于手机、笔记本电脑、电动汽车等产品中。
- 锂聚合物电池(LiPo):与锂离子电池类似,但使用的是固态聚合物电解质,相比锂离子电池更轻薄,适用于一些特殊场合的产品。
2. 锂电池的构成- 正极材料:常用的正极材料包括三元材料(如锂钴氧化物)、磷酸铁锂、锰酸锂等,它们影响了电池的能量密度和循环寿命。
- 负极材料:一般采用石墨材料,用于吸附和释放锂离子。
- 电解质:通常是一种含有锂盐的有机溶液,用于传导锂离子。
- 隔膜:用于隔离正负极材料,防止短路。
3. 充放电原理- 充电:在充电过程中,正极材料释放出锂离子,通过电解质传输至负极材料并嵌入其中。
- 放电:在放电过程中,负极材料释放出锂离子,通过电解质传输至正极材料并嵌入其中,同时释放电能。
4. 充放电性能- 能量密度:指单位重量或体积的电池可存储的能量,是衡量电池性能的重要指标。
- 循环寿命:指电池循环充放电的次数,影响电池的使用寿命。
- 自放电率:指电池在不使用的情况下自行放电的速率,较低的自放电率可以延长电池的储存寿命。
5. 锂电池的安全性- 过充电保护:采用电池管理系统(BMS)进行电池充电控制,避免过充电导致安全风险。
- 过放电保护:同样采用BMS进行电池放电控制,避免过放电导致安全风险。
- 过热保护:采用温度传感器进行监控,一旦温度超过安全范围,将自动停止充放电。
6. 锂电池的环境影响- 电池回收:为了减少对环境的影响,应该将废旧的锂电池送至专门的回收中心进行处理和回收利用。
- 资源稀缺性:锂是一种有限资源,长期大规模使用可能会引发资源短缺问题,因此应该重视电池的循环利用和节约能源。
锂电池基础知识
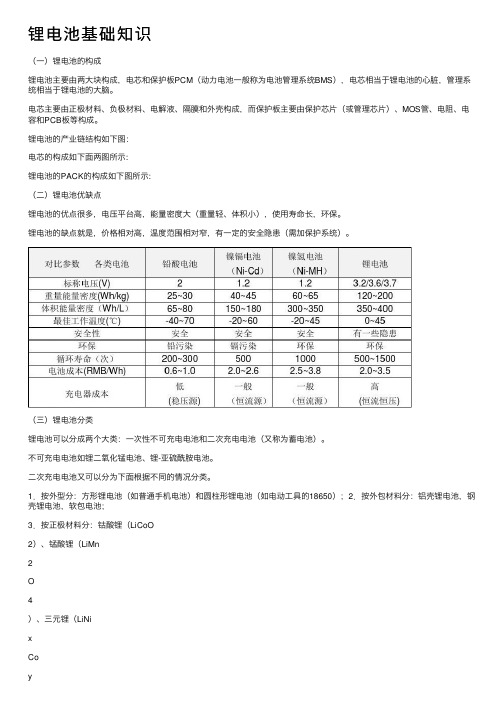
锂电池基础知识(⼀)锂电池的构成锂电池主要由两⼤块构成,电芯和保护板PCM(动⼒电池⼀般称为电池管理系统BMS),电芯相当于锂电池的⼼脏,管理系统相当于锂电池的⼤脑。
电芯主要由正极材料、负极材料、电解液、隔膜和外壳构成,⽽保护板主要由保护芯⽚(或管理芯⽚)、MOS管、电阻、电容和PCB板等构成。
锂电池的产业链结构如下图:电芯的构成如下⾯两图所⽰:锂电池的PACK的构成如下图所⽰:(⼆)锂电池优缺点锂电池的优点很多,电压平台⾼,能量密度⼤(重量轻、体积⼩),使⽤寿命长,环保。
锂电池的缺点就是,价格相对⾼,温度范围相对窄,有⼀定的安全隐患(需加保护系统)。
(三)锂电池分类锂电池可以分成两个⼤类:⼀次性不可充电电池和⼆次充电电池(⼜称为蓄电池)。
不可充电电池如锂⼆氧化锰电池、锂-亚硫酰胺电池。
⼆次充电电池⼜可以分为下⾯根据不同的情况分类。
1.按外型分:⽅形锂电池(如普通⼿机电池)和圆柱形锂电池(如电动⼯具的18650);2.按外包材料分:铝壳锂电池,钢壳锂电池,软包电池;3.按正极材料分:钴酸锂(LiCoO2)、锰酸锂(LiMn2O4)、三元锂(LiNixCoyMnzO2)、磷酸铁锂(LiFePO4);4.按电解液状态分:锂离⼦电池(LIB)和聚合物电池(PLB);5.按⽤途分:普通电池和动⼒电池。
6.按性能特性分:⾼容量电池、⾼倍率电池、⾼温电池、低温电池等。
(四)常⽤术语解释1.容量(Capacity)指⼀定的放电条件下可以从电池锂获得的电量。
我们在⾼中学物理是知道,电量的公式为Q=I*t,单位为库伦,电池的容量单位规定为Ah (安时)或mAh(毫安时)。
意思是1AH的电池在充满电的情况下⽤1A的电流放电可以放1个⼩时。
以前的NOKIA的⽼⼿机的电池(像BL-5C)⼀般是500mAh,现在的智能⼿机电池800~1900mAh,电动⾃⾏车⼀般都是10~20Ah,电动汽车⼀般都是20~200Ah等。
2.充放电倍率(Charge-Rate/Discharge-Rate)表⽰以多⼤的电流充电、放电,⼀般以电池的标称容量的倍数为计算,⼀般称为⼏C。
锂电池基础知识三篇

锂电池基础知识三篇篇一:锂电池基础知识配料基础知识一、电极的组成:1、正极组成:a、钴酸锂:正极活性物质,锂离子源,为电池提高锂源。
b、导电剂:提高正极片的导电性,补偿正极活性物质的电子导电性。
提高正极片的电解液的吸液量,增加反应界面,减少极化。
c、PVDF粘合剂:将钴酸锂、导电剂和铝箔或铝网粘合在一起。
d、正极引线:由铝箔或铝带制成。
2、负极组成:a、石墨:负极活性物质,构成负极反应的主要物质;主要分为天然石墨和人造石墨两大类。
b、导电剂:提高负极片的导电性,补偿负极活性物质的电子导电性。
提高反应深度及利用率。
防止枝晶的产生。
利用导电材料的吸液能力,提高反应界面,减少极化。
(可根据石墨粒度分布选择加或不加)。
c、添加剂:降低不可逆反应,提高粘附力,提高浆料黏度,防止浆料沉淀。
d、水性粘合剂:将石墨、导电剂、添加剂和铜箔或铜网粘合在一起。
e、负极引线:由铜箔或镍带制成。
二、配料目的:配料过程实际上是将浆料中的各种组成按标准比例混合在一起,调制成浆料,以利于均匀涂布,保证极片的一致性。
配料大致包括五个过程,即:原料的预处理、掺和、浸湿、分散和絮凝。
三、配料原理:(一)、正极配料原理1、原料的理化性能。
(1)钴酸锂:非极性物质,不规则形状,粒径D50一般为6-8μm,含水量≤0.2%,通常为碱性,PH值为10-11左右。
锰酸锂:非极性物质,不规则形状,粒径D50一般为5-7μm,含水量≤0.2%,通常为弱碱性,PH值为8左右。
(2)导电剂:非极性物质,葡萄链状物,含水量3-6%,吸油值~300,粒径一般为2-5μm;主要有普通碳黑、超导碳黑、石墨乳等,在大批量应用时一般选择超导碳黑和石墨乳复配;通常为中性。
(3)PVDF粘合剂:非极性物质,链状物,分子量从300,000到3,000,000不等;吸水后分子量下降,粘性变差。
(4)NMP:弱极性液体,用来溶解/溶胀PVDF,同时用来稀释浆料。
2、原料的预处理(1)钴酸锂:脱水。
锂电基础知识

锂电池是一种以锂离子嵌入和脱嵌过程为基础的可充电电池技术,广泛应用于移动设备、电动汽车和储能系统等领域。
以下是一些关于锂电池的基础知识:结构组成:锂电池由正极、负极、电解质和隔膜组成。
正极通常由锂化合物(如锰酸锂、钴酸锂、磷酸铁锂等)构成,负极通常由石墨材料构成,电解质通常是有机溶液或固体电解质,而隔膜则用于阻止正负极之间的直接接触。
工作原理:锂电池的工作原理是在充放电过程中锂离子在正负极之间进行嵌入和脱嵌。
在充电过程中,锂离子从正极释放并嵌入负极,负极材料形成锂化合物。
在放电过程中,锂离子从负极脱嵌并移回正极,正极材料再次形成锂化合物。
这个嵌入和脱嵌过程导致了电流的流动,实现了能量的存储和释放。
优点:锂电池具有高能量密度、较高的电压稳定性、低自放电率、长寿命、无记忆效应和环境友好等优点。
它们也具备快速充电和较高的放电能力,适用于许多应用领域。
类型:常见的锂电池类型包括锂离子电池(Li-ion)、锂聚合物电池(Li-polymer)和锂铁磷酸电池(LiFePO4)。
锂离子电池是最常见的类型,具有高能量密度和较高的电压稳定性。
锂聚合物电池相对较薄且灵活,适用于一些特殊形状的设备。
锂铁磷酸电池具有更高的安全性和较长的寿命,但能量密度相对较低。
使用和维护注意事项:锂电池在使用和维护时需要注意一些事项。
避免过度充放电、高温环境和深度放电是保持锂电池寿命和安全性的关键。
正确的充电器和充电方法也非常重要,以避免过度充电和过充电的情况发生。
总的来说,锂电池是一种重要的可充电电池技术,广泛应用于各种电子设备和交通工具中。
了解锂电池的基础知识有助于正确使用和维护这种电池,并充分发挥其性能和寿命。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、电池的化学知识物质发生化学反应的种类有多种,其中一种是氧化还原反应,在这种反应中,实际是电子在反应物中的转移过程。
通常把提供电子的物质叫还原剂,接受电子的物质叫氧化剂。
在电池体系里,一般把这些还原剂或氧化剂统一称作活性物质,活性物质在电池体系中发生的氧化还原反应就是电池反应。
原剂或氧化剂和导电骨架加工在一起,便成了电极,其中,还原剂电极发生电池反应时是失去电子,叫负极,而由氧化剂组成的电极在反应中则得到电子,叫正极,对于可充电的电池,正极又叫阴极,负极又叫阳极。
当电极插入到相关的溶液时,便获得了一电势,一般称为电极电位.正极,负极处于一相同溶液体系之下是否有电位差,是能否发生电池反应的必要条件。
1.1. 电池的工作原理和分类电池是将物质的化学能转变成电能的一种装置。
电池工作时,负极(阳极)发生化学反应,给出电子,电子通过外部电子通道传到正极(阴极)并被其消耗,就这样,电池工作时,电子会源源不断的从负极(阳极)跑出来,通过外部电路到达正极(阴极),直到两电极中某一方被消耗完,电子才会停止转移。
电子的定向流动便成为电流,最终获得电能。
1.2. 电池的组成要使电池能连续工作,必需包含以下部分:电极,电解质,隔离物以及电池外壳。
1.2.1 电极一般由活性物质和导电骨架组成,如前所述,又分为正(阴)极和负(阳)极,是电池的核心部分,是电池产生电能的源泉,通过两极上活性物质和化学变化使化学能转变为电能,导电骨架主要起着传导电子和支撑活性物质的作用,又叫集流体。
1.2.2 电解质的一般作用是完成电池放电时的离子导电过程。
电池工作时,负极提供的电子通过电池体系的外部电路到达正极从而提供电能,要实现这个能量转换过程,还必需要有一个内部离子导电过程以完成电流回路。
离子的正向移动产生电流,电解质的导电就是通过其内部体系的离子迁移从而实施离子导电。
1.2.3 隔离物能常是指置于电池正负极之间的材料,其作用是阻止正、负极活性材料的直接接触,防止电池的内部短路,并能阻挡两极粉状物质的透过。
对隔离物的要求必需是电子的良好绝缘体,并具足够过高的化学稳定性,但对离子的迁移阻力应尽可能的小。
1.2.4 电池的外壳是贮存电池其他组成部分的容器,起到保护和容纳其他组成部分的作用(有的电池是用电池活性材料做成,还参加电池反应)。
所以一般要求壳体有足够的机械性能,且壳体材料不影响电池的其他组成部分,为防止壳体免受其他组成部分的影响,一般要求壳体材料有足够高的化学稳定性。
1.2.5聚合物电池的工作原理锂离子电池用两种不同的锂离子嵌入化合物组成,充电时,锂离子从正极脱嵌经过电解质嵌入负极,负极处于富锂态,正极处于贫锂态,同时电子的补偿电荷从外电路供给到负极,保证负极的电荷平衡。
放电时则相反,锂离子从负极脱嵌,经过电解质嵌入正极。
在充放电过程中,就是锂离子不断在阴、阳极之间穿行过程(嵌入和脱嵌),就象摇椅在摇一样,因此被形象称为“摇椅电池”。
二、基本术语2.1一次电池(Primary battery): 电池仅能放电,当电池电力用尽时,无法再充电的电池.市售的碱性电池,锰干电池,水银电池等,皆属一次电池。
2.2二次电池(Rechargeable battery): 电池电力用完后,可经由充电重复使用之电池,如:铅酸,镍氢,锂离子电池等。
2.3额定容量(Nominal Capacity): 一般电池的蓄电量,会以mAH-毫安小时或AH-安培小时来表示,二次电池当电池充饱电后,按指定的电流放电至截止电压时,所能取出之电量,就是此电池的容量。
2.4额定电压(Nominal Voltage): 电池正负极材料,因化学反应,所造成之电位差高低,利用呕鳒Y,所产生的电压,称为额定电压.不同的正负极材料,产生的电压不同,如: 铅酸电池-2V/cell,镍氢电池1.2V/cell,锂离子电池3.6V/cell。
2.5内阻: 电池为许多化学材料组成,其都有一定的阻抗,电池的高低内阻往往影响充放电的特性。
2.6正极(Positive Electrode): 符号为+,电位较负极高。
2.7负极(Negative Electrode): 符号为- ,电位较正极低。
2.8电解质(Electrolyte): 当正负极间引起化学反应时,可使离子移动之离子导电体,而不是电子导电体,主要在传递整个电化学反应离子的传导工作。
2.9隔离膜(Separator): 置于正负极板中,为一微孔性及多孔性之薄膜,材质以PP,PE为主,主要在隔离正负极板,防电子短路,可使离子通过,并具保持电解液的功能。
2.10 C-rate: 用来表示电池充放电时电流大小的比率单位. 如: 容量1600mAh的电池,0.2C 代表以320mA的电流来进行充电或放电,1C代表以1600mA. 此比率单位C-rate 对于二次电池是重要的观念。
2.11放电截止电压(Cut-off discharge voltage): 电池在放电试验时,到达终点的电压。
一般Ni-MH电池设定为1.0V,Li-ion电池设定在3.0V或2.75V.2.12开路电压(Open circuit voltage,OCV): 指电池在无负载的情况下,电池正负极之间的电压。
2.13过放电(Over discharge): 超过电池放电截止电压值,若继续放电则可能造成电池漏液或劣化。
2.14放电深度(Depth of discharge,DOD): 与电池额定容量比较,放电电量的比率。
2.15过充电(Over charge): 电池到达饱充状态后,再继续充电的程度大小,过度充电可能会使电池劣化。
2.16能量密度(Energy density): 表示方法有两种,一为体积能量密度(Wh/l),另一为重量能量密度(Wh/kg),用以表示单位体积或单位重量能取出的能量.常用于表示各种化学材料所能提供能量的参考。
2.17自我放电(Self discharge): 电池在储存过程中,电池蓄电容量会逐渐减少的现象,所以一般储存电池时都有一储存温度范围,过高的温度会加速电池的自我放电。
2.18循环寿命(Cycle life): 二次电池在反复充放电的使用下,电池容量会逐渐下降,通常以该电池的额定容量作标准,电池容量降至其80%或60%时的充放电次数,称为循环寿命。
2.19记忆效应(Memory effect): 电池在没有放完电的情况下,若施以充电,则电池容量可能无法回到原有的水准,但若施以强制深度放电后在充电,容量可能就能回复,通常此种现象常发生于镍镉电池上。
2.20恒电流(Constant current,CC): 以固定的电流对电池充电或放电。
2.21恒电压(Constant voltage,CV): 以固定的电压对电池充电,充电电流会随着电压值接近而下降,对于Li-ion电池充电,一般使用CC-CV充电模式,前段采用CC,当电池电压到达4.2V,转用CV充电。
2.22涓流充电(Trickle charge): 以一微小的电流对电池充电,常用于对电池开始充电前或充饱电后。
2.23串并联(Series and parallel): 电池串联来提高电压,以并联来提高电池容量,如: Notebook电池,用12颗Li-ion 电池,以4串3并的组合,来符合Notebook的工作电压及延长操作时间。
三. 电池发展历史在过去的几十年,再充电电池在高容量和小型化方面的改进比较缓慢。
与微电子等巨大进步的领域相比较,电池技术明显的缺乏进步。
想一下六十年代的计算机存储芯片,和它与现代的具有相同计算字节的微芯片比较。
现代的微芯片将一个立方体的脚放入一个很微小的芯片里。
类似的尺寸上的减少简直就是将一个重型汽车的电池压缩进一枚硬币大小的尺寸里。
因为电池仍然是以电化学过程为基础的,一个硬币大小的汽车电池,以我们目前的技术不可能生产出来。
研究已经带来了很多种制造电池的化学品,每一种都能够提供各自独特的优点,但是没有哪一种能够体构一个完全满意的解决方案。
当然,随着现在可选择性的增加,最佳的选择可以适用特殊用户的应用要求。
例如,消费市场要求高的能量密度和小型化的电池。
主要是用来维持便携设备的适当的使用时间,这些设备愈加变得功率更大而且耗能更多。
不断的减小便携设备的尺寸,迫使电池生产商开发更小的电池。
但是这必须以不牺牲使用使用时间为前提的。
将更多的能量包裹再一个包里,其他的一些特质通常就被牺牲了,其中一个就是电池寿命。
镍镉系电池被发现具有长的循环寿命和可预见的小内阻,但是,这种化学物质正在被替代,在那些能应用提供长的使用时间体系的地方。
另外,对公开的记忆现象和涉及废弃后的毒性的问题持否定的观点,使得生产商寻求其他的选择。
曾经作为超级电池体系而受到欢迎的镍氢电池已经不能提供21世纪所有的电池解决方案了,比期望寿命短,是主要的问题所在。
以锂为基础的电池可能是最佳的选择,特别是在快速移动的商业市场。
免维护而且可靠,由于锂离子电池能够提供小型化和长的使用时间,使得它成为了很多领域的首选。
但是这种电池体系也不是没有问题。
即使是电池不使用时,相对较快的老化作用限制了电池的寿命在两到三年。
另外,限流保护电流限制了放电电流,致使锂离子电池不适合重负荷要求的应用。
锂离子聚合物电池也表现了与锂离子电池相同的特性。
这种体系主要的突破性进展还没有取得。
确实它能够提供非常小的电池,但是这是以换取更小的能量密度来实现的。
随着今天技术的快速发展,不使用镍,铅和锂的电池体系会很快变成现实。
燃料电池,能够通过连续的补充燃料而不间断的工作,这可以解决未来便携能源的需求。
用户使用瓶装的液体能量代替充电。
这种电池或许真的可以改变我们的生活和工作方式。
本电池知识论述主要针对最普通的消费者和工业上使用的镍镉、镍氢、铅酸和锂离子/聚合物电池。
也包括可循环使用的碱性电池来对比。
为了清楚的原因,其他的可充电电池体系没有包含在里面。
那些超乎寻常的和奇妙的新电池的发明只能存在于实验室。
其他的也许被用在特殊的应用领域,例如军事和航空上。
因为本知识论述是针对非专业人士的,所以希望尽可能的将事情简单化。
电池是什么时候发明的?最近400年里,最重要的,最新颖的发现之一就是电的发现。
有人会问:“电的发现有如此长的时间吗?”答案是肯定的,而且或许更长。
但是实际对电的使用仅仅是从18世纪中叶到晚期才被我们所支配,而且开始只是有限的方式应用。
例如,1900年的巴黎世界展览会上,最主要的具有吸引力的事情之一就是架在塞纳河上的电灯桥。
最早的产生电的方式是产生静电荷。
在1660年,奥特.格里科创造了第一个电的装置,这个装置包括了一个大的硫磺球,当旋转荷摩擦时,这个硫磺球能吸引羽毛和小纸片。
格里科能够证明产生的火星真的是电的。
