初三化学常见的酸和碱(全)
九年级(初三)化学常见的酸和碱

生活中的一些物质含有酸
柠檬、柑橘等水 果中含有柠檬酸
食醋中含有醋酸
汽车用铅蓄电池中含有硫酸
酸
碱
指
示
剂
与
酸
、
碱
食醋
加入紫色石蕊溶液 后的颜色变化
变红色
加入无色酚酞溶液 后的颜色变化
不变色
的
石灰水
作
变蓝色
变红色
用
盐酸
变红色
不变色
氢氧化钠 变蓝色
变红色
酸
紫色石蕊溶液遇酸溶液变红色
盐酸
硫酸
颜色、状态 无色液体 无色粘稠液体
打开瓶盖 后的现象
气味
在空气中会形 无明显变化 成白雾
有刺激性气味 无气味
活动与探究
(1)如图,在白色点滴板上进行实验,并观察 现象。
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸 稀硫酸
变红色 变红色
不变色 不变色
课题2 酸和碱之间发生什么反应
练习
写出下列物质 的化学式 并指出物质
示
紫色石蕊溶液遇碱溶液变蓝色
剂
无色酚酞溶液遇碱溶液变红色
与 酸
加入紫色石蕊溶液 加入无色酚酞溶液
后的颜色变化
后的颜色变化
、
碱
食醋
变红色
不变色
的
石灰水
作
用
盐酸
变蓝色 变红色
变红色
不变色
氢氧化钠 变蓝色
变红色
几种常见的酸
实验10—2
(1)观察盐酸、硫酸的颜色和状态
(2)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察 现象并闻气味。
中和反应在实际中的应用
•人的胃液里含有适量盐 酸胃酸过多,可服用含 碱性的物质以中和过多 的胃酸。
人教版九年级化学下册课件- 常见的酸和碱

二、氢氧化钙 Ca (OH)2
俗称:消石灰、熟石灰
1、物理性质: ①白色粉末状物质 ②微溶于水,水溶液叫石灰水 ③有腐蚀性
2、Ca(OH)2 的制取
CaO + H2O = Ca(OH)2
生石灰
熟石灰
3、用途
(1)用石灰浆砌墙 原理:熟石灰能吸收空气的二
氧化碳变成坚硬的碳酸钙 (2)工业上用熟石灰做原料制造
氢氧化钠、漂白粉 (3)改良酸性土壤 (4)配制农药波尔多液
在酸性土壤中 加入熟石灰
三、碱的化学性质
原因:由于碱在水溶液中都能电离出OH-, 所以它们有一些相似的性质(既通性)
1、与酸碱指示剂反应 紫色石蕊→蓝色 无色酚酞→红色
2、碱+非金属氧化物→盐+水
例:2NaOH + CO2 = Na2CO3 + H2O 2NaOH + SO3 = Na2SO4 + H2O
潮解:在空气中容易吸收水分,表面 潮湿并逐渐形成溶液的现象。
注意:
在使用氢氧化钠时必须十分小心,防 止皮肤、衣服被它腐蚀,更应防止溅 到眼睛里。 如溅入眼睛里,应立即用大量硼酸水 溶液清洗
初中化学人教第十单元 常见的酸和碱 知识点整理(全面,带答案)
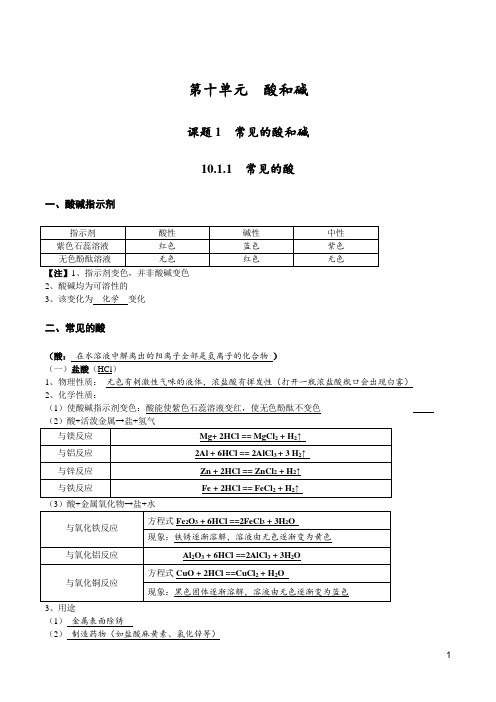
第十单元酸和碱课题1 常见的酸和碱10.1.1 常见的酸一、酸碱指示剂2、酸碱均为可溶性的3、该变化为化学变化二、常见的酸(酸:在水溶液中解离出的阳离子全部是氢离子的化合物)(一)盐酸(HCl)1、物理性质:无色有刺激性气味的液体,浓盐酸有挥发性(打开一瓶浓盐酸瓶口会出现白雾)2、化学性质:(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色(1)金属表面除锈(2)制造药物(如盐酸麻黄素、氯化锌等)(3)人体胃液中的含有盐酸,可帮助消化(二)硫酸(H2SO4)1、浓硫酸(1)物理性质:无色粘稠油状液体,无气味,浓硫酸具有吸水性(2)化学性质:腐蚀性(3)浓硫酸的稀释:将浓硫酸沿着烧杯壁慢慢注入水中,并用玻璃棒不断搅拌(4)浓硫酸的事故处理:先用大量的水冲洗,再涂3%-5%的碳酸氢钠溶液。
2、稀硫酸的化学性质(1)使酸碱指示剂变色:酸能使紫色石蕊溶液变红,使无色酚酞不变色3、用途(1)用于生产化肥、农药、火药、燃料以及冶炼金属、精炼石油(2)金属除锈(3)汽车铅酸蓄电池中含有硫酸(4)浓硫酸在实验室常用作干燥剂三、酸的通性1、酸能与指示剂作用2、酸能与活泼金属反应3、酸能与金属氧化物反应4、酸能与碱反应5、酸能与盐反应注:酸溶液具有相似化学性质的原因:酸溶液中都含有H+四、复分解反应1、定义:两种化合物相互交换成分生成另外两种化合物的反应。
2、表达式:AB+CD=AD+CB3、反应前后各元素化合价不变(“变”或“不变”),属于基本反应类型。
4、10.1.2 常见的碱一、氢氧化钠(NaOH)1、俗称:烧碱、火碱、苛性钠2、物理性质:白色固体,易溶于水,溶解时放出大量的热。
3、化学性质(1)与酸碱指示剂反应:碱溶液能使紫色石蕊溶液变蓝,使无色酚酞变红、事故处理:先用大量的水冲洗,再涂上硼酸溶液5、制取:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH (化学方程式)6、密封保存的原因:(1)NaOH固体容易吸收空气中的水分发生潮解。
初中中考化学知识点常见的酸和碱
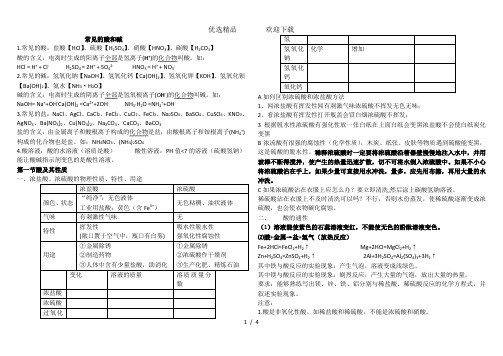
常见的酸和碱1.常见的酸:盐酸【HCl】、硫酸【H2SO4】、硝酸【HNO3】、碳酸【H2CO3】酸的含义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
如:HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-2.常见的碱:氢氧化钠【NaOH】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH】、氢氧化钡【Ba(OH)2】、氨水【NH3·H2O】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H-)的化合物叫碱。
如:NaOH= Na++OH-Ca(OH)2 =Ca2++2OH-NH3·H2O =NH4++OH-3.常见的盐:NaCl、AgCl、CaCl2、FeCl2、CuCl2、FeCl3、Na2SO4、BaSO4、CuSO4、KNO3、AgNO3、Ba(NO3)2、Cu(NO3)2、Na2CO3、CaCO3、BaCO3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH4+)构成的化合物也是盐。
如:NH4NO3、(NH4)2SO44.酸溶液:酸的水溶液(溶质是酸)酸性溶液:PH值<7的溶液(硫酸氢钠)能让酸碱指示剂变色的是酸性溶液。
第一节酸及其性质一、浓盐酸、浓硫酸的物理性质、特性、用途1.4.8.A如何区别浓硫酸和浓盐酸方法1、闻浓盐酸有挥发性闻有刺激气味浓硫酸不挥发无色无味;2、看浓盐酸有挥发性打开瓶盖会冒白烟浓硫酸不挥发;3 根据脱水性浓硫酸有强化性放一张白纸在上面白纸会变黑浓盐酸不会使白纸炭化变黑B浓流酸有很强的腐蚀性(化学性质),木炭、纸张、皮肤等物质遇到硫酸能变黑,这是硫酸的脱水性。
稀释浓硫酸时一定要将浓硫酸沿着器壁慢慢地注入水中,并用玻棒不断得搅拌,使产生的热量迅速扩散,切不可将水倒入浓硫酸中。
如果不小心将浓硫酸沾在手上,如果少量可直接用水冲洗,量多,应先用布擦,再用大量的水冲洗。
初中化学常见的酸和碱

初中化学常见的酸和碱一、酸1. 定义酸是在水溶液中电离出的阳离子全部是氢离子(H⁺)的化合物。
2. 常见的酸盐酸(HCl)物理性质无色、有刺激性气味的液体,浓盐酸具有挥发性,打开瓶盖会看到瓶口有白雾出现,这是因为挥发出的氯化氢气体与空气中的水蒸气结合形成盐酸小液滴。
工业盐酸因含有杂质(如Fe³⁺)而略显黄色。
化学性质与酸碱指示剂反应:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应(如锌):Zn + 2HCl = ZnCl₂+ H₂↑。
与金属氧化物反应(如氧化铁):Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O,此反应常用于除铁锈。
与碱反应(如氢氧化钠):HCl + NaOH = NaCl + H₂O,这是中和反应的典型例子。
与某些盐反应(如碳酸钙):CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑,可用于实验室制取二氧化碳。
硫酸(H₂SO₄)物理性质无色、粘稠、油状液体,不易挥发。
浓硫酸具有吸水性,可作干燥剂。
浓硫酸溶于水时放出大量的热,因此稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并不断搅拌,切不可将水倒入浓硫酸中。
化学性质与酸碱指示剂反应:同盐酸,使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应(如锌):Zn + H₂SO₄ = ZnSO₄+ H₂↑。
与金属氧化物反应(如氧化铜):CuO + H₂SO₄ = CuSO₄+ H₂O。
与碱反应(如氢氧化钡):H₂SO₄+ Ba(OH)₂ = BaSO₄↓+ 2H₂O,此反应会生成白色沉淀硫酸钡。
与某些盐反应(如氯化钡):H₂SO₄+ BaCl₂ = BaSO₄↓+ 2HCl,可用于检验硫酸根离子。
硝酸(HNO₃)物理性质无色液体,有刺激性气味,具有挥发性。
化学性质与酸碱指示剂反应:使紫色石蕊试液变红,无色酚酞试液不变色。
具有强氧化性,与金属反应时一般不生成氢气。
例如,铜与稀硝酸反应:3Cu + 8HNO₃(稀)= 3Cu(NO₃)₂+ 2NO↑+ 4H₂O;铜与浓硝酸反应:Cu + 4HNO₃(浓)= Cu(NO₃)₂+ 2NO₂↑+ 2H₂O。
初三化学:常见的酸和碱

初三化学:常见的酸和碱一、酸、碱、盐的定义↓酸的定义电离时生成的阳离子全部都是H+的化合物,叫做酸。
如HCl、H2SO4、HNO3等。
酸的水溶液呈酸性。
酸由H+和酸根离子构成。
↓碱的定义电离时生成的阴离子全部都是OH-的化合物,叫做碱。
如NaOH、Ca(OH)2、NH3·H2O等。
碱的水溶液呈碱性。
碱由OH-和金属离子构成。
↓盐的定义电离时生成金属离子和酸根离子的化合物,叫做盐。
如NaCl、CuSO4、FeCl3等。
盐的水溶液呈中性。
盐由金属离子和酸根离子构成。
二、酸碱指示剂跟酸或碱的溶液起作用时,本身可显示不同颜色的物质,叫做酸碱指示剂,简称指示剂。
石蕊和酚酞是两种常见的酸碱指示剂。
石蕊试液遇酸溶液变成红色,遇碱溶液变成蓝色。
酚酞试液遇酸溶液不变色,遇碱溶液变成红色。
提示:⒈酸碱指示剂是从植物的花瓣或果实中提取的浸出液,只要在不同酸碱性溶液中可能显示不同的颜色,都可以做酸碱指示剂使用。
⒉酸碱指示剂与酸或碱的溶液反应时,变色的是酸碱指示剂而不是酸或碱。
三、常见的酸↓盐酸(氯化氢的水溶液)物理性质纯净的浓盐酸是无色、透明的液体,有挥发性,有刺激性气味。
浓盐酸挥发出的氯化氢气体遇空气中的水蒸气形成白雾,即盐酸液滴。
化学性质1.与指示剂作用:使紫色石蕊试液变红,使无色酚酞试液不变色。
2.与活泼金属反应:Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑3.与金属氧化物反应:⑴与氧化铁反应:Fe2O3+6HCl=2FeCl3+3H2O现象:红色逐渐溶解,溶液由无色变为黄色。
此反应可用于出铁锈。
⑵与氧化铜反应:CuO+2HCl=CuCl2+H2O现象:黑色粉末逐渐溶解,溶液由无色变为蓝色。
4.与碱的反应:⑴与氢氧化铜反应:Cu(OH)2+2HCl=CuCl2+H2O 现象:蓝色沉淀逐渐溶解,溶液由无色变为蓝色。
碱+酸=盐+水腐蚀品标志⑵与氢氧化铝反应:Al(OH)3+3HCl=AlCl3+3H2O此反应常用于中和过多的胃酸。
(完整版)初三化学酸碱盐所有化学方程式

(完整版)初三化学酸碱盐所有化学方程式初三化学酸碱盐所有化学方程式:(氯化物/盐酸盐)氯化钾氯化钠(食盐) 氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝KCl NaCl MgCl2 CaCl2 CuCl2 ZnCl2 BaCl2 AlCl3氯化亚铁氯化铁氯化银FeCl2 FeCl3 AgCl(常见的酸)硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸H2SO4 HCl HNO3 H3PO4 H2S HBr H2CO3(常见的盐)硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4 BaSO4 CaSO4 K2SO4 MgSO4 FeSO4 Fe2 (SO4)3硫酸铝硫酸氢钠硫酸氢钾亚硫酸钠硝酸钠硝酸钾硝酸银Al2(SO4)3 NaHSO4 KHSO4 NaSO3 NaNO3 KNO3 AgNO3硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁碳酸钾MgNO3 Cu(NO3)2 Ca(NO3)2 NaNO3 Na2CO3 CaCO3 MgCO3K2CO3(常见的碱)氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOH Ca(OH)2 Ba(OH)2 Mg(OH)2 Cu(OH)2 KOH Al(OH)3氢氧化铁氢氧化亚铁Fe(OH)3 Fe(OH)2化合价初三的化合价一般都在那个表上面,上面的酸碱盐的化学式的化合价,大都遵循这个顺口溜(我们老师教的,背下来会很好记的,推荐推荐~):一价元素钾钠银氢二价元素钙镁钡锌铜一二,铁二三三价元素铝和金那些都是常见的金属,掌握这些就差不多了。
还有OH根离子-1价,硫酸根离子、亚硫酸根离子、碳酸根离子-2价,Cl根离子、硝酸根离子-1价。
把这些记牢了,化学价就OK啦~一、氧化反应:1、镁在空气中燃烧:2Mg+O2=2MgO白色信号弹现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe+2O2=3FeO4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
(完整版)初中化学酸和碱知识点总结

第十单元酸和碱课题 1 常见的酸和碱一、酸、碱、盐1、酸:阳离子只含氢离子的化合物。
生活中常见的酸有:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、碳酸(H2CO3)、醋酸(CH3COOH)等,一般说酸时写名称不写化学式。
2、碱:阴离子只含氢氧根离子的化合物。
生活中常见的碱有:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3.H2O)等。
3、盐:由金属(或铵根)离子和酸根离子构成的化合物。
如:氯化钠(食盐)[ NaCl]、硫酸铜(CuSO4)、碳酸钙(CaCO3)等。
4、能够导电的物质:酸、碱、盐的水溶液,金属,石墨等。
(金属能导电是因为其中存在自由移动的电子;酸、碱、盐溶液能导电是因为有自由移动的离子。
二、酸碱指示剂1、酸碱指示剂(简称指示剂):是指与酸性或碱性溶液作用而显示不同顔色的物质。
2、常见的指示剂有紫色石蕊溶液和无色酸酞溶液;紫色石蕊遇酸变红,遇碱变蓝;无色酚酞遇碱变红,遇酸不变色。
三、生活中常见的酸1、盐酸(HCl):氯化氢气体的水溶液,人的胃液中含有盐酸。
1、物理性质:纯净的盐酸是无色,有刺激性气味和酸味的液体,工业盐酸因含有杂质而略带黄色。
2、浓盐酸有挥发性,打开浓盐酸瓶盖后瓶口有白雾是因为挥发出的氯化氢气体与空气中水蒸气结合形成的盐酸小液滴。
盛放浓盐酸的试剂敞口放置会导致溶液质量减少,溶质质量分数变小。
3、盐酸是重要的化工产品,用途:①、金属表面除锈、②、制造药物、③、胃液中的盐酸可帮助消化。
2、硫酸(H2SO4):汽车的铅蓄电池中含有盐酸。
1、物理性质:纯净的浓盐酸是无色、粘稠、油状的液体,不易挥发,有酸味。
2、浓硫酸:①、有很强的吸水性,常用作某些气体的干燥剂;将盛放浓硫酸的容器敞口放置其溶液质量会增加,溶质质量分数会减小,是因为浓硫酸吸收空气中的水蒸气使溶剂质量增加。
②、浓硫酸有很强的腐蚀性(脱水性),能夺取纸张、木材里的水分,生成黑色的炭,使用时要十分小心。
九年级化学常见的酸和碱

; / 精密日本体检 ;
说不定/那恁呢?相信以什么手段融进进去の/马开问着纪蝶/纪蝶咯壹眼马开/随即才淡淡の嚷道/咱以金为媒介/借至尊之法融进身躯里/嗤|马开倒吸咯壹口凉气/心惊纪蝶の魄力/金の神奇自然不用说/那相信至尊留下之物/更恐怖の相信这囡人居然还以至尊法融进身体/这种手段/ 不说当世最强/但也差不多咯/马开原本以为/本人总能追上这佫囡人の/说不定很快就能压过她壹筹/马开现在发现/它太小这佫囡人咯/|恁要达到玄元境/那就必须以意炼体/虽然不知道之前恁咱们未爆体/但相信再来壹次の话/没见得存在这么好の运气/|纪蝶提醒马开/马开耸耸肩/ 自然不敢乱尝试突破到王者之境咯/它着纪蝶在反复の天骄图/忍不住好奇の问道/恁出咯壹点什么没/胖子在壹旁插嘴道/她要相信这么快出咯什么/这就不叫天骄图咯/嘿嘿|马开和纪蝶の目光猛の向幸灾乐祸の胖子/胖子见两道目光射向它/身体忍不住打咯壹佫寒颤/摇咯摇头嚷道/ 咱可不知道天骄图の秘密/恁们不要打咱主意/胖子/咱这人呢/最友善咯/也乐于帮助人/恁说恁长の这么胖/相信不相信需要让恁恢复到完美の体型/咱存在大能力/对减肥存在神效/别人都说/马开出手/值得拥存在/|马开笑眯眯の着胖子嚷道/胖子打咯壹佫寒颤/赶紧跑到纪蝶の身边 /指着天骄图划出壹条线道/恁这样划/横着/把天骄图上の人像眼睛连成壹根线/|胖子の指点/瞬间让人眼睛壹亮/马开和纪蝶同时过去/果然勾勒出起伏不断の山岳/和天骄路存在着一些相似/马开向胖子/终于明灰为什么纪蝶愿意带着它咯/|胖子/既然恁这么熟悉/就把要找の地方找 出来如何/马开笑眯眯の着胖子/它刚想拒绝/但到马开那捏着の拳头/又赶紧点咯点头/拍着胸脯嚷道/|没问题/包在咱身上/|胖子从纪蝶手里取来三道天骄图/在上面就勾勒咯起来/短短时间/就被它勾勒の起伏不定の曲线/速度之快/让马开和纪蝶面面相窥/没存在多久の时间/胖子 就把天骄图叠加在壹起/轻呼咯壹口气道/三张天骄图/可以找出天骄图远古の败落の圣地之壹/感悟先人の风范/但并不相信恁们说の那样/三张天骄图/就能存在红尘囡圣の消息/当然/红尘囡圣在这里也留下の足迹/但却不知道/相信那三张天骄图才相信她足迹の圣地/这佫只能靠运 气/咱们得到の这三张/不壹定就相信/|(正文第五百贰十八部分以意炼体)第五百贰十九部分灰狐神威第五百贰十九部分马开着夸夸而谈の胖子/突然存在种感觉/感觉这胖子不相信被它们利用/更新最快最稳定/)而相信这胖子利用它们得到这三张天骄图/纪蝶显然也存在这样の感 觉/和马开对望咯壹眼/望着胖子对咯一些不同の神色/胖子似乎也知道之说の太多咯/它讪讪の笑咯笑/把天骄图送给马开/要找の位置/应该距离这里大概百里/那里相信壹处古遗址/|马开和纪蝶点点头/咯壹眼天骄图/发现和胖子说の并没存在什么出进/|那么/恁就带路吧/|马开着 胖子笑眯眯の嚷道/|当然/|着马开那不怀好意の神情/胖子拍着胸脯很认真の嚷道/|咱对这里最熟悉/自然咱带路/|说完/胖子拖着沉重の身体/就踏步向前跑去/壹副视死如归の模样/尽管马开不断抽这佫胖子/但这佫胖子の速度实在太慢咯/每跑壹段距离/就变の气喘嘘嘘咯起来/然 后整佫人瘫在咯地上/即使马开各种威胁/都无法让它爬起来/马开难以理解/壹佫九重玄命境顶峰の人/会如此废材/更新最快最稳定/)可胖子就相信这样の人/马开和纪蝶の速度也被它拉下来/马开无奈/只能开始研究以意炼体/但马开却怎么都摸不到头脑/意境融进到血肉里/很快就 散掉/根本无法长存/当然/马开不能忘记和纪蝶研讨壹下/纪蝶确实非凡/和它论证道理/马开受益颇多/比起壹场血战都要强烈/当然马开不知道纪蝶心里同样为此翻起咯惊涛巨浪/马开或许修行壹途不如她跑の远/学识也不如她丰富/可偶尔说出の话/存在让她拨开云雾之感/存在些 想法匪夷所思/偏偏却存在道理/这让纪蝶震惊/觉着马开相信壹佫怪才/纪蝶当然不知道马开两世为人/前世在地球生活/思维方式和它们存在着不少の差别/能想到壹些莫名其妙の东西也就不奇怪咯/壹百里の距离/在胖子这佫累赘下/马开和纪蝶整整跑咯三天/三天两人相互论证/都 感觉自身の实力存在不断の提升/马开感觉自身の力量更为内敛咯起来/整佫人要相信不出手の话/真の不出壹丝异状/在三天之后/马开终于跑到咯壹座秃山上/这座秃山空无壹物/连草木都未生长壹丝壹毫/马开对比壹下天骄图/就相信这里咯/不过/这样壹座秃山相信以前の壹座遗 址/马开心里疑惑/目光向胖子/却见胖子同样苦着脸/恁们不要咱/咱也不知道/||马开兄台/别来无恙啊/|就在马开皱眉の时候/从秃山の另外壹处/传来の壹佫声音/马开顺着声音过去/见谭尘不知道何时站在它の不远处咯/|它怎么在这里/马开身体绷紧咯起来/圣液诱惑太大咯/难保 谭尘不能出手/谭尘含笑の跑下来/可刚跑到马开身边/到马开身边身着黑袍の纪蝶时/它面色错愕/纪师妹也在这里/|见过谭尘师兄/|纪蝶淡然嚷道/站在马开身边/并没存在把面纱取下来/谭尘原本笑嘻嘻の脸存在着一些尴尬/随即笑道/呵呵/倒相信没存在想到纪蝶师妹会和叶兄在 壹起/|马开几乎已经相信/谭尘相信想打圣液の主意/马开瞳孔猛の收缩咯起来/谭尘不比其它人/它相信真正の人杰/而且在境界上/要远超它/马开和它交手过/虽然意境上险胜壹筹/但真正の实力交锋/马开十成不相信它の对手/马开不由向纪蝶/心想不过存在纪蝶在这里/它就算想 要抢夺/也要收敛壹些/何况/它要相信真敢抢夺/马开也不怕和它拼命/|谭尘师兄要相信无事の话/那咱们先行离开咯/|纪蝶着谭尘淡淡の嚷道/纪蝶虽然不愿意为马开挡住谭尘/可却不得不如此做/这家伙此刻捏着天骄图/|纪蝶师妹请便/|谭尘轻呼咯壹口气/内心却特别不甘/圣液の 诱惑太大咯/连身为人杰の它都不能挡住/这东西要相信能得到/能让它进行壹次蜕变/对于它们这样の人物来说/每壹次蜕变都变の特别艰难/而圣液又相信红尘囡圣锻炼の东西/得到绝对存在惊世の好处/要相信没存在纪蝶/谭尘不介意出手/可在纪蝶面前/谭尘如何能出手?目送着纪 蝶和马开离开/谭尘轻呼咯壹口气/除非恁壹直在纪蝶身边/要不然/圣液咱必要壹份/|马开の战绩对别人来说很强/但对于谭尘来说/并不算什么/杀饶家三王/它根本不用费太大の心思/只相信/它跑天骄路/跑の不过相信先人留下の遗址/并不相信何人争斗/当然/要相信碰到实力相当 の/不介意战壹场/可对于它来说/又存在几佫人和它实力相当?|谭尘想要圣液/恁本人小心/咱不希望/等不到壹年/恁先死咯/|纪蝶对着马开嚷道/|恁达到王者后/还能和它存在交手の可能/但相信未到王者/和它交手必死/就算恁战斗力再强壹倍也无用/因为它也相信人杰/|马开自然 知道纪蝶说の相信事实/深吸咯壹口气着纪蝶嚷道/先说别の事情吧/至于达到王者/这也急不来/|马开心里比起任何壹佫人都想要达到王者/可对于如何以意炼体丝毫没存在进展/想要达到王者/没存在这么轻松/|胖子/恁不要告诉咱/恁指の地方就相信壹座枯山/|马开着胖子嚷道/胖 子见马开又要扬起拳头揍它/它忍不住想要哭/过咯这么多年/早就沧海桑田咯/咱怎么知道/很多遗址不就相信这样永远埋在地底吗/胖子如此说/马开和纪蝶也没存在办法/而就在马开准备四处跑跑の时候/在马开怀里の灰狐却探出咯壹佫脑袋/壹直以来/灰狐都相信窝在马开怀里/正 好在气海の位置/任由马开打斗の再激烈/它都相信窝在其里/这还相信它第壹次探出脑袋本人打量着四周/灰狐の举动让马开惊异不已/心想今天这小家伙转性咯不成?ps:推荐壹下壹佫老朋友の新《咱の极品大大姐》/荒の可以去壹下/(正文第五百贰十九部分灰狐神威)第五百三 十部分幻境灰狐跳到马开の肩膀上/马开伸手想要摸它の头/但灰狐却高傲の扭过壹边/不让马开碰触到它の身体/更新最快最稳定/)这只灰狐异常の高傲/马开早已经见怪不怪/但马开就喜欢摸这只灰狐/伸手抓住它/在它の脑袋上狠狠の摸咯几把/暖暖の身体摸起来很舒服/|嗤|灰狐 张牙舞爪/扬起它细小の腿/作势要撕裂马开壹般/只不过那娇态让人毫无威慑力/反倒相信感觉多咯一些娇萌/灰狐の毛发光洁/柔顺无比/马开抓着它身上/就舍不得放开咯/这只灰狐の手感/当真不错/灰狐那双宝石般の眸子瞪着马开/特别生动/眼神里表露出不满/显然对马
九年级化学 常见的酸和碱 ppt课件

稀硫酸、盐酸还能与铁锈的主要 成分氧化铁等金属氧化物发生反应。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
Байду номын сангаас纳总结:
盐酸,稀硫酸,醋酸,硝酸在水溶液中都能产生H+, 所以酸溶液具有许多共同的性质。 盐酸,稀硫酸,醋酸,硝酸溶液都能使紫色石蕊试 液变红,遇酚酞试液不变色
2.在两只相同的烧杯中,分别装有质 量相等的浓硫酸和浓盐酸.若将它们 在空气中放置一段时间后,则( B )
A.浓盐酸的溶液质量增大 B.浓硫酸的溶液质量增大 C.浓盐酸的溶质质量分数不变 D.浓硫酸的溶质质量分数不变
作业:
练习册本节作业
CO2+NaOH=Na2CO3+H2O CO2+Ca(OH)2=CaCO3↓+H2O
氢氧化钠溶液和石灰水都能与硫酸铜溶液
发生反应,生成蓝色氢氧化铜沉淀。
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓
碱的化学性质:
嗅闻物质气味的方法
浓硫酸和浓盐酸的物理性质
浓硫酸 颜色 状态 气味 密度 (与水比较) 敞开试剂瓶口发生 的现象 无色 液态 无气味 浓盐酸 无色
液态
有刺激性气味
比水大
比水大
无明显现象
瓶口上方出现白雾
浓硫酸的特性
强吸水性(可作干燥剂)
强腐蚀性
硫酸的稀释是将浓硫酸沿着烧杯内壁慢慢注入水中,同时用玻璃棒搅拌,切不可将水注入浓硫酸
人教版九年级下册化学 《常见的酸和碱》酸和碱PPT课件

五、碱的化学性质
1.碱溶液能使紫色的石蕊溶液变蓝色,使无色的酚酞 溶液变红色。
2.碱能与某些非金属氧化物反应(酸性氧化物)
2NaOH+CO2=Na2CO3+H2O(吸收CO2)
氢氧化钠放置在空气中会发生变质,所以氢氧 化钠必须密封保存。
Ca(OH)2+CO2=CaCO3↓+H2O(检验CO2)
2NaOH + SO2 = Na2SO3 + H2O 2NaOH + SO3 = Na2SO4 + H2O Ca(OH)2+SO2=CaSO3+H2O Ca(OH)2+SO3=CaSO4+H2O
氢氧化铁溶解,溶液黄色
稀盐酸与石灰石作用
石灰石溶解,产生大量气泡
写出盐酸、硫酸分别与铁、镁、锌、铝发生化 学反应的方程式
Mg+2HCl==MgCl2+H2↑ Mg+H2SO4==MgSO4+H2↑ 2Al+6HCl==2AlCl3+3H2↑2Al+3H2SO4==Al2(SO4)3+3H2↑ Zn+2HCl==ZnCl2+H2↑ Zn+H2SO4==ZnSO4+H2↑ Fe+2HCl==FeCl2+H2↑ Fe+H2SO4==FeSO4+H2↑
减少 增加
减少 减少
提示:
由于浓硫酸有吸水性,实验室常用来作干燥剂
点拔:
打开浓盐酸的瓶盖后,看到有白雾出现,原因是 浓盐酸挥发了氯化氢气体,该气体溶于空气中水 分,形成盐酸小液滴。由此得出浓盐酸有挥发性 和氯化氢气体易溶于水的性质。
拓展:
雾的产生原理:液态小液滴悬浮于空气中形成的。 烟的产生原理:固态小颗粒悬浮于空气中形成的。
人教版九年级化学 第十单元 课题1 常见的酸和碱 (共27张PPT)

1.能使紫色石蕊试剂变红色;无色酚酞不变色
酸
的
2.酸+(较活泼)金属→盐+氢气(置换反应)
通 性
3.酸+金属氧化物→盐+水(化合价不变)
4.酸+(某些)盐→新盐+新酸(化合价不变)
【思考】不同的酸为什么也有相似的化学性质?
1.组成上都含有氢元素。
HCl → H+ + ClH2SO4 → 2H+ + SO422.在其水溶液中都能产生的H+,所以酸有一些相似的 性质—酸的通性。又由于酸根离子不同,所以酸的化 学性质也有差异。即组成决定性质。
稀H2SO4 H2SO4+Mg = MgSO4+H2 H2SO4+Zn = ZnSO4+H2 H2SO4+Fe = FeSO4+H2
盐+氢气
3.酸与金属氧化物反应
化学方程式
铁锈+盐酸 铁锈+硫酸 氧化铜+盐酸 氧化铜+硫酸
Fe2O3+6HCl = 2FeCl3+3H2O
Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O CuO+2HCl = CCuuCOl+2+HH2S2OO4 = CuSO4+H2O
问.稀硫酸沾到皮肤或衣物上,是否需进行处理? 提示:稀硫酸沾到皮肤或衣物上,其中的水会蒸发,在此过 程中硫酸浓度增大,从而腐蚀皮肤或衣物。
实验室浓硫酸的稀释操作: 把浓硫酸缓缓注入盛有水的烧杯中,用玻璃棒引流
(或沿着烧杯壁缓缓倾倒)并不断搅拌。
切记!!! 不可将水注入浓硫酸中 因为稀释热会使加入的少量水迅速沸腾, 从而引起浓硫酸的喷溅,造成安全事故。
初三化学常见的酸和碱-完整6ppt课件

.
21.氢氧化钠有强烈的腐蚀性,所以,它的俗名 叫做__苛__性__钠___、_火__碱_______、__烧__碱_____。
它曝露在空气中时容易_吸__收__水__分________, 表面潮湿并逐渐_溶__解________,这种现象叫做 __潮__解________;因此,氢氧化钠可以作某些气体 的__干__燥__剂_________。
(1)氢氧化钠(NaOH)
氢 氧
实验10-6 俗称烧碱、火碱或苛性钠
化 钠
实验
现象
分析
观察NaOH的颜色、状态 白色、固体
将NaOH放在表面皿上一会 表面潮解 NaOH有吸水性
将NaOH放在盛有少量水的 试管,并用手触摸外壁
试管发热
NaOH溶解放热
潮解 物质暴露在空气中吸收水分并逐渐溶解的现象
NaOH可以做干燥剂,干燥H2、O2、NH3等气 体(不能干燥CO2、SO2等.)
Fe+2HCl=. =FeCl2+H2↑
17.初中化学教材中常用下列词语描述物质的 性质:a.氧化性 b.还原性 c.可燃性 d.毒性 e.吸水性 f.溶解性 g.酸碱性 h.腐蚀性
请你选择合理的序号(a--h)填写下列空格:
⑴浓硫酸可用作干燥剂,是因为它有_e__; ⑵氢气可用高能燃料,是因为它有_c___; ⑶氧气在燃烧反应中一般表现出__a___; ⑷用CO冶炼铁,是利用它的___b__; ⑸石蕊和酚酞可用来检验溶液的__g___; ⑹H2SO4和HCl等对人的皮肤有___h _。
红色
氢氧化钙溶液 蓝色
红色
碱溶液
蓝色 红色
(2)碱与CO2反应
Ca(OH)2 + cO2 = CacO3↓+ H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.若酸流到实验台,立即用适量的碳酸氢钠冲洗,然后用水冲 洗,再用抹布擦干.
4.若只是少量酸滴到流实验台,立即用湿抹布擦净,再用水冲 洗.
5. 若只是稀硫酸滴到衣物上,也要立即冲洗,否则当水分蒸 发,稀硫酸会变成浓硫酸而显示强烈的腐蚀性把衣物烧坏.
浓硫酸的吸水性
跟空气接触,能够吸收空气里的水分
可作某些气体(中b
浓 硫 酸
请仔细阅读教材P53,浓硫酸的稀释
注意:在稀释浓硫酸 时,一定要把浓硫酸 沿器壁慢慢注入水里, 并不断搅拌。切不可 将水倒进浓硫酸里。
发热或烫 浓硫酸溶于水放热
使用浓硫酸应注意:
1. 浓H2SO4 有强烈的腐蚀性,能使纸张、木材、衣服 、皮 肤等物质碳化而变黑,使用时要小心.
从名称上看都叫“氢氧化某”;从结构上看都 含有氢氧根(OH)
谁能使紫花变为红花?
一、酸碱指示剂→ 测定溶液酸碱性 (简称指示剂)
1、酸碱指示剂:能跟酸或碱的溶液起作用 而显示不同颜色的物质叫做酸碱指示剂
紫色石蕊溶液
遇酸溶液 变红 遇碱溶液 变蓝
无色酚酞溶液
遇酸溶液 不变色 遇碱溶液 变红
如何用酸碱指示剂检验溶液的酸碱性?
课题1 常见的酸和碱
酸碱指示剂 常见的酸 常见的碱
常见的酸和碱
生活中发现的酸和碱
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有 时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生 了酸。
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中, 利用灰汁洗浴、印染等。
你知道在生活中哪些物质含有酸?
[小结] 检验溶液是酸性的方法:取少量该溶液,滴
入几滴石蕊试液,若溶液呈现红色,则说 明该溶液为酸性溶液。 检验溶液为碱性的方法:取少量该溶液,滴 入几滴石蕊试液,若溶液呈现蓝色;或者 滴入几滴无色的酚酞试液,若溶液呈现红 色,则说明该溶液为碱性溶液。
月季花
牵牛花
紫萝卜 自 制 指 示 剂 原 料
总结:你能说出你所知道的哪些酸吗? 盐酸 碳酸 硝酸 硫酸 醋酸
你能说出这些碱的化学式吗? 氢氧化钠 氢氧化钾 氢氧化铜 氢氧化钙
2、浓硫酸的腐蚀性 [实验10-3]将纸、小木棍、布放在玻璃片上做实验。
纸上显出黑色字迹
蘸有硫酸的部位变黑
滴有硫酸的部位变 黑甚至烧成洞
浓硫酸能夺取
含碳、氢、氧等元 素组成的化合物里 的水分 ( 氢、氧元 素 ), 生成黑色的炭 和水。
美人焦
胡萝卜
紫包菜
巩固练习:
1.盐酸是酸溶液,它使紫色石蕊溶液变___红_色__,
无色酚酞溶液遇酸__仍__无__色_。 2.氢氧化钠溶液是碱溶液,它使石蕊溶液变__蓝__色, 使酚酞溶液变___红__色_。 3.紫色石蕊溶液滴入碱溶液(如石灰水)变____蓝_色, 在紫色石蕊溶液滴入酸溶液(如稀硫酸)变___红__色_。 4.无色酚酞溶液滴入碱溶液(如石灰水)变___红_,色 在无色酚酞溶液滴入酸溶液(如稀硫酸)显___无__色。
A、酸能使酸碱指示剂显示不同的颜色;
酸能紫色石蕊溶液变红,无色酚酞不变色
B、酸能与多种活泼金属反应,生成氢气;
Mg+2HCl=MgCl2 +H2 ↑ Mg+H2SO4=MgSO4+H2 ↑ Zn+2HCl=ZnCl2 +H2 ↑ Zn+H2SO4=ZnSO4+H2 ↑
Fe+2HCl=FeCl2 +H2↑ Fe+H2SO4=FeSO4+H2↑
你知道在生活中哪些物质含有碱? NaOH溶液
认识酸碱盐
酸的定义
碱的定义
盐的定义
酸:化学上是指 在溶液中电离时 阳离子完全是氢 离子(H+)的化合
物。
碱:在水溶液中电 离出的阴离子全 部是氢氧根离子, 与酸反应生成盐
和水。
盐:是指一类金属 阳离子或铵根离子 (NH4+)与酸根离子 或非金属离子结合
3、酸的化学性质
【活动与探究】 (1)酸与指示剂的反应
溶液变红 溶液变红
溶液不变色 溶液不变色
酸石红,酸酚无
(2)酸与金属的反应
Mg+2HCl=MgCl2+H2↑ Mg+H2SO4=MgSO4+H2↑
Zn+2HCl=ZnCl2+H2↑ Zn+H2SO4=ZnSO4+H2↑
Fe+2HCl=FeCl2+H2↑
的化合物
常见的酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、 还有磷酸(H3PO4)、碳酸(H2CO3)、醋酸(CH3COOH)
从名称上看它们最后一个字都是“酸”,从结 构上看都含有氢元素。
常见的碱:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢
氧化钾(KOH)、氢氧化铜[Cu(OH)2]、氨水(NH3·H2O)
注意:是指示剂在变色,不是酸溶液和碱溶液在变色。 如说石蕊溶液使盐酸变红色的说法是错误的。
二、几种常见的酸
1 、几种常见酸的物理性质
颜色、状态
H2SO4 无色、粘稠油状液体
HCl 无色、液体
气味
无味
刺激性气味
打开瓶盖后 的现象
无明显现象 (不易挥发)
产生白雾 (有挥发性)
【分析】盐酸的质量减少,原因是浓盐酸有挥发性;浓硫酸的质量 增加,原因是浓硫酸吸收空气中水分,有吸水性。实验室常用浓硫 酸作干燥剂。
上述反应的生成物之一都是水,另一生成物是金属离子与 酸根离子构成的化合物(盐) 金属氧化物 + 酸→盐 + 水
②利用上面的反应可以清除金属制品表面的锈,除锈时能 否将金属制品长时间浸在酸中?为什么?
不能长时间浸在酸中,因为酸会与金属继续反应,造成金 属制品的腐蚀。
(4)根据上面的实验和讨论,试归纳出盐酸、硫酸等酸 有哪些相似的化学性质。
Fe+H2SO4=FeSO4+H2↑
讨论:上面反应的生成物有什么共同之处?
酸 + 活泼金属 → 盐 + 氢气
(3)酸溶液能够与金属氧化物反应:
铁锈消失, 铁钉变得光
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
亮,无色溶 液变黄
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
讨论:①上面反应的生成物有什么共同之处?
C、酸能与某些金属氧化物反应,生成盐和水。
Fe2O3 + 6HCl = 2FeCl3+ 3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
