与氮素同化相关酶及测定方法汇总
过量施氮条件下水稻氮素同化关键酶活性与叶色变化的关系

Ab ta t sr c :T o r v a he d a i ha ge o ie c no e fc l r a t nh r nt hy i o i a e e lt yn m c c n f rc a py l a o ou nd is i e e p sol g c l m e ha s u e t e on to o s p r l o nir e f r iia i n,t e c nim nd r h c dii n f u e fu us tog n e tlz to h SPA D a nir e nd tog n m e a ols y e z t b im ke n ym e i fe e sto o e ve e e s u i d s n d o on c ( a e s n dif r nt po ii ns f la s w r t d e u i g hy r p i s w t r
摘 要 :为 明 确 过 量 施 氮 条 件 下 水 稻 冠 层 叶 色 的 变 化 动 态及 其 内在 生 理 机 制 , 水 培 条 件 下 , 个 生 在 整 育期 维 持 8 / 氮 素 浓 度 , 步 测 定 水 稻 地 上 部 不 同 叶 位 叶 片 的 S AD 值 和 氮 代 谢 关 键 酶 活性 O mg L 同 P 的 变化 。 结 果 表 明 , 氮 素 过 量 条 件 下 , 一 叶 、 二 叶 S AD 值 与 其 当 周 谷 氨 酸 合 成 酶 活 性 均 呈 在 顶 顶 P 显 著 正 相 关 , 三 叶 、 四 叶 S AD 值 与 其 当周 谷 氨 酰 胺 合 成 酶 活 性 分 别 呈 极 显 著 、 著 正 相 关 。 顶 顶 P 显 关 键 词 : 稻 ;氮素 ;叶 色 ;谷 氨 酸 合 成 酶 ; 氨 酰 胺 合 成 酶 水 谷
【国家自然科学基金】_氮素同化_基金支持热词逐年推荐_【万方软件创新助手】_20140802
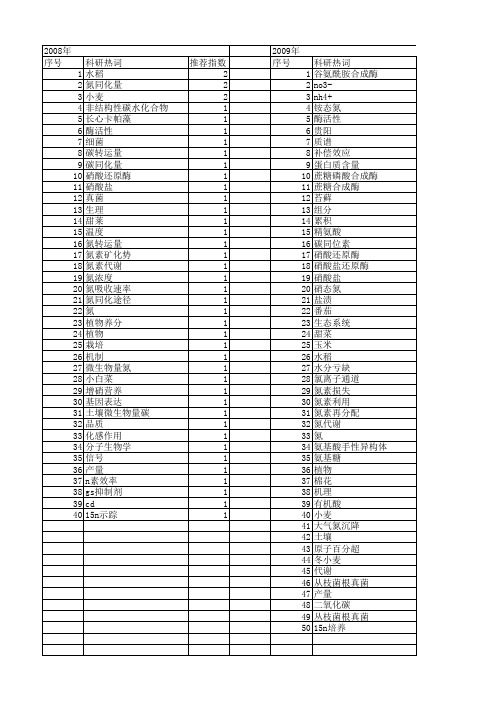
推荐指数 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50
2014年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
2014年 科研热词 高级醇 灌溉 沙拐枣幼苗 水稻产量 水稻 氮素回收效率 氮素吸收 氮素利用效率 氮素利用 氮素分配 枣酒 干物质 固态发酵 可同化氮素 推荐指数 1 1 1 1 1 1 1 1 1 1 1 1 1 1
推荐指数 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 ቤተ መጻሕፍቲ ባይዱ0 11 12 13 14
2011年 科研热词 遗传修饰 花铃期 能量转化 群落生产力 红松幼苗 积雪 生物量 水解氮 氮素代谢 氮吸收 氮同化酶 氮代谢 棉花 根系 弱光 基因工程 基因 厌氧氨氧化菌 养分循环 作物产量 主茎功能叶 nh4+/no3-配比 co2同化 推荐指数 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
推荐指数 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
硝酸还原酶的测定

硝酸还原酶的测定一、实验目的和要求掌握体内法测定植物组织中硝酸还原酶的原理和方法,阐明诱导酶的含义。
2、实验内容与原则硝酸还原酶(nr)是植物氮素同化的关键酶,与作物吸收和利用氮肥有关。
它催化植物体内的硝酸盐还原为亚硝酸盐:--产生的NO2可以从组织渗透到外部溶液中,并在溶液中累积。
NO2含量的增加表明酶的活性增加。
装no2含量的测定用磺胺比色法。
在酸性溶液中产生的亚硝酸盐与对c氨基苯磺酸(或对c氨基苯磺酰-订线(胺)反应生成重氮,然后与αC萘胺(或萘基乙二胺)反应生成紫红色偶氮化合物。
生成的红色偶氮化合物在540nm波长处有最大吸收峰,可通过分光光度法测定。
溶液中NO2-的含量可用标准曲线测定。
3、主要仪器设备1、实验仪器分光光度计,真空泵,温箱,天平,2个烧杯,移液管若干,试管3支,剪刀。
2、实验试剂0.1mol/lph7.5的磷酸缓冲液,对-氨基苯磺酸溶液,α-萘胺溶液,亚硝酸钠标准液3.两组大麦幼苗在15-25℃的蒸馏水中培养一周。
一组用硝酸钾治疗,另一组用氯化铵治疗。
四、操作方法和实验步骤1.切两组新鲜叶片。
一组为0.51g处理苗,另一组为0.50g对照苗。
将叶片分别切成0.5~1cm的碎片并压实。
2、两组中各加入15ml的酶促反应液。
3.真空提取10min,充分交换细胞内外液。
4.盖上盖子,在30℃的培养箱中保存20分钟。
5、去除材料,用移液管取4ml反应液,加入2ml磺胺,加入2ml苯基,放置15min。
6、比色:在540nm的波长下分光光度测定亚硝酸的od值。
7.空白管:4ml H2O+2ml磺酰胺溶液+2ml萘乙二胺溶液?在室温下放置15分钟后,在540nm处用分光光度法测定亚硝酸的OD值。
五、实验数据记录和处理称重:处理过的幼苗0.51g;对照苗0.50god值:处理苗0.513a;对照苗0.050aNO2含量标准曲线:y=257.29x-4.8262(x=OD值;y=NO2含量(nmol))。
植物硝酸还原酶(NR)活力测定(活体法)

植物硝酸还原酶(NR)活力测定(活体法)一、原理硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对–氨基苯磺酸(或对–氨基苯磺酰胺)及α–萘胺(或萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物。
其反应如下:生成的红色偶氮化合物在540nm波长下有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般以Nμg·g-1·h-1为单位。
NR的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好二、仪器与用具分光光度计;真空抽气泵(或20ml注射器筒);天平;单面刀片;保温箱(或恒温水浴);刻度试管(15ml);移液管(5ml×2,2ml×8,1ml×2)。
三、试剂1. 亚硝酸钠标准液称取分析纯NaNO2 0.1000g水溶后定容至100ml,吸取5ml用水稀释定容至1000ml,即为每ml含NaNO2 5μg(亚硝态氮近似1μg/ml)的标准液。
2. 0.1mol/L pH7.5的磷酸缓冲液:K2HPO4 19.24g,KH2PO4 2.2g,加水溶解后定容至1000ml。
3. 1%(W/V)对-氨基苯磺酸溶液:称取10.0g加入250ml浓HCl中,用蒸馏水定容至1000ml。
4. 0.2%(W/V)α-萘胺溶液:称取2.0gα-萘胺溶于250ml冰醋酸中,用蒸馏水定容至1000ml。
5. 30%三氯乙酸溶液:75.0g三氯乙酸水溶后定容250ml。
6. KNO3(0.1mol/L)、异丙醇(1% V/V)、磷酸缓冲液(0.1mol/L)混合液:称10.10g KNO3溶于1000ml 0.1mol/L的磷酸缓冲液中,再加10ml异丙醇混匀。
四、方法1. 标准曲线制作取7支洁净烘干的15ml刻度试管按表13-1顺序加试剂,即配成0-2.0μg的系列标准亚硝态氮溶液。
实验三预习报告硝酸还原酶和谷氨酰胺合成酶活性的测定

实验三预习报告硝酸还原酶和谷氨酰胺合成酶活性的测定实验三、硝酸还原酶和谷氨酰胺合成酶活性的测定一、硝酸还原酶的测定[原理]:硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对-氨基苯磺酸(或对-氨基苯磺酰胺)及α-萘胺(或萘基乙烯胺)在酸性条件下定量生成红色偶氮化合物。
生成的红色偶氮化合物在540nm有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般以每克鲜重含氮量表示,即以-1-1ug.g.h为单位。
NR的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
[试剂]1(亚硝酸钠标准溶液:准确称取分析纯NaNO0.9857g溶于去离子水后定容至1 2-1000ml,然后再吸取5ml定容至1000ml,即为含亚硝态氮1ug.ml的标准液; 2(0.1molpH7.5的磷酸缓冲液:NaHPO.12HO30.0905g与NaHPO.2HO 2422422.4965g加去离子水溶解后定容至1 000ml;-13(1%(W/V)溶液:1.0g 对氨基苯磺酸溶于100ml 3 mol.LHCL中(25ml浓-1盐酸加水定容至100ml 即为 3 mol.LHCL);(0.02%(W/V)萘基乙烯胺溶液:0.020g萘基乙烯胺溶于100ml 去离子水中,4贮于棕色瓶中;-1-15(0.1mol.LKNO溶液:2.5275g KNO溶于250Ml 0.1mol.LPh7.5的磷酸缓冲33液中; -16(0.025mol.LPh 8.7 的磷酸缓冲液:8.864 0g NaHPO12HO,0.0570g 24.2KHOP.3HO,溶于1 000ml去离子水中; 2427( 30%三氯乙酸溶液:30g三氯乙酸。
水溶后定容至100ml。
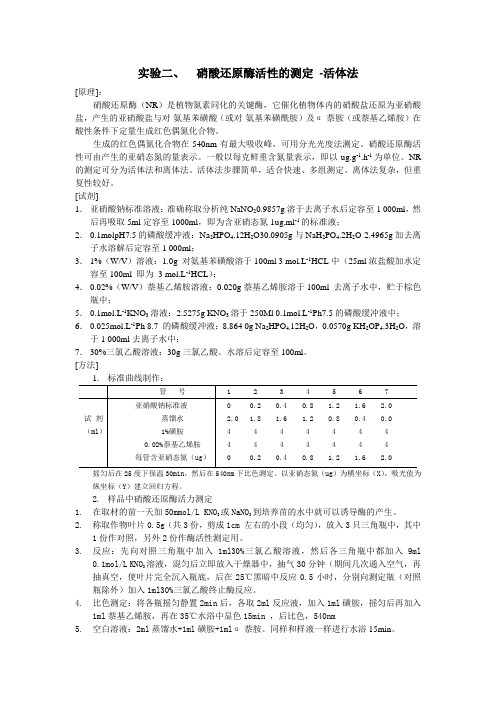
[方法];1. 标准曲线制作:管号 1 2 3 4 5 6 7亚硝酸钠标准液 0 0.2 0.4 0.8 1.2 1.6 2.0 试剂蒸馏水 2.0 1.8 1.6 1.2 0.8 0.4 0.0 (ml) 1%磺胺 4 4 4 4 4 4 40.02%萘基乙烯胺 4 4 4 4 4 4 4每管含亚硝态氮(ug) 0 0.2 0.4 0.8 1.2 1.6 2.0摇匀后在25度下保温30min,然后在540nm下比色测定。
氮素化合物的测定

氮素化合物的测定六、氮素化合物的测定Nitrogen Compound(一)水中的氮及其测定意义水中有机物包括C(carbon)、H(hydrogen)、O(oxygen)、N(nitrogen)、S(sulphur)、P(phosphorus)等化合物,其中以氮素化合物*不稳定,它们*初进入水体时,多以有机氮的形式存在,但受微生物作用后,渐渐变成简单化合物,如:有机N不断,而无机N ,在缺氧(anaerobicaddition)情况下,NH3是有机氮分解的*终产物;在有氧(aerobic addition)情况下:此时,有机氮素化合物已完成了无机化的作用。
水质分析中,测定各类氮素化合物,对于了解水源被污染的情况及目前分解的情况有很大帮忙。
河流的自净作用包括:(organic nitrogen, ammonia nitrogen,nitrite nitrogen, nitrate nitrogen)随着这个变化的进行,水中致病**渐渐削减,所以了解氮素化合物在水中的含量,有助于了解水体自净的情况。
在好氧条件下,水中N的各种形式的变化规律:**阶段(初始阶段):新进入水体中的N是有机—N,渐渐被微生物分解为NH3—N,因而随时间的上升,有机—N,NH3—N;**阶段(中心阶段):NH3—N上升到肯定的含量,又开始被好氧菌分解为NO2——N, NO2——N,而NH3—N上升到一个顶峰后开始下降,下降的原因不仅是NO2——N上升,更紧要的是此时NO2——N又开始转化为NO3——N,促进了NH3—N的转化;第三阶段(末期阶段):NH3—N,NO2——N,NO3——N。
对于氮素化合物进行监测,可以①了解水域的自净情况及水体的自净本领。
取不同河段的水样测定所含氮素的形态,若发觉上游排污地段有机氮含量较高,而下游有机氮含量低,NO3——N含量上升,则说明水域自净本领强。
②了解污染情形及污染趋势:若水中含有有机N和NH3—N,此水体刚受污染,有严重的不安全;若水中含有NO3——N,污染已久,基本得到净化,无太大影响;若水中含有NO2——N,表示有机物的分解尚未完全,若水中NO3——N,NH3—N,此时有少量NO2——N,无关紧要,若水中NO3——N少,NH3—N,此时发觉NO2——N则要警惕,由于此时已提示NO2——N 的污染即将达到峰值。
植物生理学实验考试试题 (1)

植物生理学实验考试试题一、名词解释:1、标准曲线:用标准溶液制成的曲线。
先配制一系列不同浓度的标准溶液, 在溶液吸收最大波长下, 逐一测定吸光度,然后用坐标纸以溶液浓度为横坐标, 吸光度为纵坐标作图, 若被测物质对光的吸收符合光的吸收定律, 必然得到一条通过原点的直线, 即标准曲线。
4、氮素代谢:氮素及含氮的活体物质的同化异化和排泄,总称为氮素代谢。
5、淀粉酶:是水解淀粉和糖原的酶类总称。
6、真空渗入:指将叶片打孔放入注射器中,加水浸没,排出空气后用手指堵住前端小孔,同时把活塞向外抽拉,即可造成减压而排出组织中的空气,轻放活塞,水液即进入组织的方法。
7、离心技术:是根据物质颗粒在一个离心场中的沉降行为而发展起来的。
它是分离细胞器和生物分子大分子物质必备的手段之一,也是测定某些纯品物质的部分性质的一种方法。
8、电泳:各种生物大分子在一定pH 条件下,可以解离成带电荷的颗粒,这种带电颗粒在电场的作用下向相反电极移动的现象称为电泳。
9、同工酶:凡能催化同一种化学反应但其分子结构和带电性质不同的一组酶称为同工酶10、迁移率:指带电颗粒在单位电场强度下的泳动速度。
11、聚丙烯酰胺凝胶:是一种人工合成凝胶,是以丙烯酰胺为单位,由甲叉双丙烯酰胺交联成的,经干燥粉碎或加工成形制成粒状,控制交联剂的用量可制成各种型号的凝胶。
20、超氧化物歧化酶(SOD):普遍存在动植物体内的一种清除超氧阴离子自由基O2 的酶。
21、硝酸还原还原酶:是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸。
22、诱导酶:又称适应酶,指植物体内本来不含有,但在特定外来物质的诱导下诱导生成的酶。
如硝酸还原酶可为NO3-所诱导生成。
二、填空:1、测定植物可溶性蛋白质含量时,绘制标准曲线是标准蛋白质浓度为横坐标,以吸光值为纵坐标。
2、常用的测定植物可溶性蛋白质含量的方法有:Folin-酚试剂法(Lowry 法) 、双缩脲法、考马斯亮蓝法和紫外吸收法。
硝酸还原酶活性的测定.

硝酸还原酶活性的测定一、原理硝酸还原酶是植物氮素作用中的关键性酶,与作物吸收和利用N肥有关的不同品种,年龄、器官组织以及环境条件对硝酸还原活性都有影响,硝酸还原酶作用于NO3使还原为NO2NO3⎯+NADH+H→NO2⎯+NAD+H2O产生的NO2⎯可以从组织内渗到外界溶液中,并积累在溶液中因此测定反应溶液中NO2⎯的含量的增加,即表明酶活性的大小。
NO2⎯含量的测定用对氨基苯磺酸化比色法,亚硝酸对氨基苯磺酸和α-萘胺在酸性条件下生成红色化合物,颜色在2-3小时稳定,可用比色法定量,该法非常灵敏,能测定每毫升0.5微克的Na NO2。
二、仪器和药品721型分光光度计(或其他型号比色计),剪刀,真空泵(或注射器),小天平,温箱,烧杯,移液管,小烧杯(50ml)0.2MKNO3:将20、22克KNO3溶于100ml蒸馏水中。
0.1M磷酸缓冲液(PH=7.5):将85.2%ml 1/15M磷酸氢二钠与14.8ml 1/15M磷酸二氢钾混合均匀。
1/15MNa2HPO4溶液:1000ml中含Na2HPO4•2H2O11.878克。
1/15M溶液:1000ml中含KH2PO49.078克。
对氨基苯磺酸试剂:1克对氨基苯硝酸加加25ml浓HCl,用蒸馏稀释至100ml.。
α–萘胺试剂,0.2克α–萘胺加25ml浓HCl,用蒸馏稀释至100ml。
NaNO2标准溶液:1克NaNO2用蒸馏水溶解至1000ml,然后吸取5ml,再加蒸馏水稀释成1000ml,该溶液每毫升含有NaNO2 5微克,用时稀释之。
三、实验步骤:1、将新鲜叶片(蓖麻、向日葵、小麦、棉花等),用水冲洗净,并用吸水纸吸干,用剪刀剪成小块(注意块小为宜),然后在小天平上称取等重的两份叶片,每份约0.5克。
分别置于含有下列溶液的小烧杯中。
(1)1M磷酸缓冲溶液5ml+蒸馏水5ml(2)0.1M磷酸缓冲溶液5ml+0.2M KNO35ml然后将小烧杯置于真空干燥器中,接上真空泵抽气,放气后叶片便沉于底部(如没有真空泵,也可以20ml注射器代替,将反应液及叶片一起倒入注射器使之真空,如此进行抽气、放气反复多次,溶液即可渗入叶组织内取代了叶片内的空气,叶片便沉于溶液底部),取出小烧杯置于30℃温箱中,使不见光保温作用30分钟。
植物对硝态氮的吸收、同化及其含量测定

植物对硝态氮的吸收、同化及其含量测定硝态氮是高等植物可直接利用的最重要的氮素形态之一,硝态氮和铵态氮是高等植物根系吸收无机氮的主要形态,在通气良好的旱地土壤上,即使施用的是铵态或酰铵态氮肥,NH4+在土壤中也能容易地被微生物经硝化作用很快转化为硝态氮,因此,硝酸盐对旱生植物来说尤其重要,Marschner认为植物氮素营养中硝酸盐的还原和同化与光合作用中CO2的还原和同化对植物生长发育具有同样的重要性。
植物体内硝态氮的含量往往能在一定程度上反映土壤中硝态氮的供应情况,通过测定植物体内硝态氮含量,对了解氮代谢机制及其土壤中无机氮素的丰缺有重要意义。
1 植物对NO3--N的吸收和同化1.1 植物对NO3--N的吸收根系对NO3-的吸收和运输是大多数植物氮素营养代谢的第一步。
基于H+/NO3-共运机制,即植物吸收一分子NO3-进入细胞质的同时协同吸收2个H+,维持H+梯度的ATP主要由线粒体呼吸作用提供。
对不同高等植物如玉米,大麦,烟草等的吸收动力学分析表明,不同植物中存在着两种NO3-转运系统:①高亲和吸收转运系统,这类植物在低NO3-浓度的营养介质中能保持生长。
②低亲和吸收转运系统,这类植物在较高NO3-浓度的营养介质中才能保持高的氮素吸收。
NO3-浓度对植物吸收硝态氮能力有重要影响:外界NO3-浓度较低时,植物对硝酸盐的吸收符合米切里希动力学方程,此时通过细胞膜载体上的NO3-/H+共运和NO3-/OH-逆运系统完成;当外界NO-3浓度较高时,吸收速率随浓度变化的趋势呈直线型,此时主要通过依赖于硝酸盐的专一性离子通道进行的逆电化势的运输系统完成。
植物对硝态氮的吸收与温度和pH密切联系,低温能降低植物对NO3-的吸收。
主要是由于低温影响根系呼吸和能量供给,以及细胞膜的透性减弱导致NO3-吸收缓慢。
根部介质的pH也显著影响植物对NO3-的吸收,pH值低时NO3-吸收较快。
随着pH值的升高,NO3-的吸收减少。
硝酸还原酶测定 (2)

实验5 硝酸还原酶活性的测定【实验目的】掌握硝酸还原酶活性测定的两种方法,加深对硝酸还原酶在植物体氮素代谢中作用的理解。
【实验原理】硝酸还原酶(nitrate reductase,NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,(NO3-+NADH + H+→NO2-+NAD ++H2O)。
产生的亚硝酸盐与对-氨基苯磺酸(or 对-氨基苯磺酰胺)及α-萘胺(or 萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物。
其反应如下:生成的红色偶氮化合物在540nm有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般单位鲜重以Nμg/(g﹒h)为单位。
NR的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
Ⅰ离体法【材料设备】(三)试剂1、NaNO2标准溶液:准确称取分析纯NaNO20.1g溶于无离子水后定容至100ml,然后再吸取1ml用蒸馏水稀释成1000ml,该溶液每毫升含有NaNO21μg,用时稀释之。
2、0.1mol/L PH7.5的磷酸缓冲液,Na2HPO4·12H2O 30.0905g与NaH2PO4·2H2O 2.4965g加去离子水溶解后定容至1000mL。
3、1%(m/V)对氨基苯磺酸(磺胺酸)溶液:1.0g 对氨基苯磺酸溶于100ml 3 mol/L的HCL中(25ml浓盐酸加水定容至100ml 即为 3 mol/LHCL)。
4、0.02%(m/V)萘基乙烯胺溶液:0.0200g萘基乙烯胺溶于100mL 去离子水中,贮于棕色瓶中。
5、0.1mol/L KNO3溶液:2.5275g KNO3溶于250mL 0.1mol/L Ph7.5的磷酸缓冲液中.6、0.025mol/L Ph 8.7 的磷酸缓冲液:8.8640g Na2HPO4·12H2O,0.0570g KH2PO4.3H2O,溶于1 000ml去离子水中。
转氨酶、硝态氮、铵态氮等测定方法

转氨酶、硝态氮、铵态氮等测定方法转氨酶(谷草转氨酶(GOT)和谷丙转氨酶(GPT)的测定:(2.5g样)(参考吴良欢等的《植物转氨酶(GOT和GPT)活度比色测定方法及其应用》)O.05mol/L Trs—HCL缓冲液(pH7.2):0.2mol/L三羟甲基氨基甲烷(30.25g三羟甲基氨基甲烷用蒸馏水溶解并定容至200m1)200ml和0.2mol/L HC1221ml,用蒸馏水稀释至1000ml。
0.1mol/L磷酸盐缓冲液:称取磷酸氢二钠(AR)11.928g,磷酸二氢钾(AR)2.176g,加少量蒸馏水溶解并定容至1000ml。
2,4一二硝基苯肼溶液:称取2,4一二硝基苯肼0.099g,用10mo/L HCl50ml溶解后,加蒸馏水至500rnl,保存于棕色瓶中备用,此液可保存3个月。
0.4mol/L氢氧化钠溶液:32g氢氧化钠(AR)加蒸馏水溶解并定容至2L。
lmol/L氢氧化钠溶液:10g氢氧化钠(AR)加蒸馏水溶解并定容至250ml。
丙酮酸标准液(2µmol/m1):精确称取纯丙酮酸钠0.022g于100ml容量瓶中,加0.1mol/L磷酸盐缓冲液至刻度。
此液应新鲜配制。
GOT底物液(DL一门冬氨酸200mmol/L,a一酮戊二酸2mmol/L):称取a一酮戊二酸0.073g和DL一门冬氨酸6.65g置于一小烧杯中,加入lmol/L氢氧化钠51.25ml使溶解,并校正pH至7.4,然后将溶液移入250ml 容量瓶内,用0.1mol/L磷酸盐缓冲液定容至刻度。
放置冰箱内保存。
GPT底物液:(DL一丙氨酸200mmol/L,a一酮戊二酸2mmol/L):称取a一酮戊二酸0.073g和DL--丙氨酸4.475g 置于一小烧杯中,加入0.1mol/L磷酸盐缓冲液(pH7.4)约200ml煮沸溶解后,待冷,用lmol/L氢氧化钠调pH 至7.4(约加1.25m1),再加0.1mol/L磷酸盐缓冲液至25Oml混匀,加氯仿数滴防腐,贮于冰箱内。
硝酸还原酶活性的测定
实验二、硝酸还原酶活性的测定-活体法[原理]:硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对-氨基苯磺酸(或对-氨基苯磺酰胺)及α-萘胺(或萘基乙烯胺)在酸性条件下定量生成红色偶氮化合物。
生成的红色偶氮化合物在540nm有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般以每克鲜重含氮量表示,即以ug.g-1.h-1为单位。
NR 的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
[试剂]1.亚硝酸钠标准溶液:准确称取分析纯NaNO20.9857g溶于去离子水后定容至1 000ml,然后再吸取5ml定容至1000ml,即为含亚硝态氮1ug.ml-1的标准液;2.0.1molpH7.5的磷酸缓冲液:Na2HPO4.12H2O30.0905g与NaH2PO4.2H2O 2.4965g加去离子水溶解后定容至1 000ml;3.1%(W/V)溶液:1.0g 对氨基苯磺酸溶于100ml 3 mol.L-1HCL中(25ml浓盐酸加水定容至100ml 即为 3 mol.L-1HCL);4.0.02%(W/V)萘基乙烯胺溶液:0.020g萘基乙烯胺溶于100ml 去离子水中,贮于棕色瓶中;5.0.1mol.L-1KNO3溶液:2.5275g KNO3溶于250Ml 0.1mol.L-1Ph7.5的磷酸缓冲液中;6.0.025mol.L-1Ph 8.7 的磷酸缓冲液:8.864 0g Na2HPO4.12H2O,0.0570g KH2OP4.3H2O,溶于1 000ml去离子水中;7.30%三氯乙酸溶液:30g三氯乙酸。
水溶后定容至100ml。
[方法]摇匀后在25度下保温30min,然后在540nm下比色测定。
以亚硝态氮(ug)为横坐标(X),吸光值为纵坐标(Y)建立回归方程。
2.样品中硝酸还原酶活力测定1.在取材的前一天加50mmol/L KNO3或NaNO3到培养苗的水中就可以诱导酶的产生。
第五讲 植物体氮的同化

第五讲
植物体内氮的同化
自 然 界 中 N 素 循 环
一. 硝酸盐还原
1、硝酸盐还原为亚硝酸盐 这一过程是在细胞质中进行的,催化这一反应的硝酸还原 酶为钼黄素蛋白,含有FAD、Cytb和Mo,还原力为NADH+H+,
硝酸还原酶是一种诱导酶,亦叫适应酶。所谓 诱导酶或适应酶是指植物本来不含某种酶,但 在特定的外来物质(如底物)的影响下,可以生 成这种酶。 2、亚硝酸盐还原为氨 NO3-还原为NO2-后,NO2-被迅速运进质体即根中 的前质体或叶中的叶绿体,并进一步被亚硝酸 还原酶(NiR)还原为NH3或NH4+。
第四节合理施肥的生理基础
一、作物的需肥特点 1、不同作物需肥不同 禾谷类作物需要氮肥较多,同时又要供给 足够的P、K,以使籽粒饱满;豆科能固空气 中的N,需P、K多,叶菜类多施N。 2、同一作物不同生育时期需肥不同
二、合理施肥的指标 、合理施肥增产的原因 满足了作物的需肥要求
图3-20在叶 中的硝酸还 原 DT. 双 羧 酸 运 转 器 ; FNR.Fd NADP 还 原 酶 ; MDH: 苹果酸脱氢 酶 ; FRS.Fd 还原系统
图3-21在根中的硝酸还原 NT.硝酸运转器
二、氨的同化
①谷氨酰胺合酶;②谷氨酸合酶;③天冬酰胺合酶;④转氨酶; ⑤PEP羧化酶
三、酰胺的生理功能 谷酰胺和天冬酰胺是植物体内两种重要的酰胺。 谷酰胺的存在是植物健康的标志,天冬酰胺的存 在是植物不健康的象征。 两种酰胺的主要功能是氮素运输、氨的解毒与贮 藏,以及含氮物质合成进行氮素供应。天冬酰胺 常常与蛋白质分解代谢反应有关,而谷酰胺则常 常与合成代谢和生长有关。
氮素相关测定方法(精)

二.亚硝态氮、硝态氮、铵态氮、尿素测定1.硝态氮测定(紫外分光光度校正因数法)1.约测:吸取水样(土壤浸提液)注入1cm光径石英比色杯中,以浸提剂为参比,在210nm波长处约测吸收值。
根据约测结果,测定浸出液应予稀释的倍数,使吸收溶液吸收值在0.1~0.8之间。
2.测定:水样(浸出液)稀释一定倍数后,吸取25ml放入50ml三角瓶中,加入1.00ml 1:9硫酸溶液,摇匀。
装入1cm光径石英比色杯在紫外分光光度计上分别于210nm和275nm处测定吸光度A210和A275,以同样稀释酸化后的饱和硫酸钙溶液为参比溶液,调节仪器的零点。
3.工作曲线绘制:吸取10mg/LNO3—N标准溶液0.00、1.00、2.00、4.00、6.00、8.00ml于50ml容量瓶中,(加一定体积浸提剂)定容。
即得0.00、0.20、0.40、0.80、1.20、1.60mg/LNO3—N标准溶液。
各取25.00mL于50ml三角瓶中,加1.00ml1:9硫酸溶液,摇匀。
装入1cm光径石英比色杯在紫外分光光度计上分别于210nm和275nm处测定吸光度A210和A275。
4.结果计算:ΔA= A210-A275f其中f为校正因数,在土壤有机质含量小于50g/kg时,f可取2.2,若大于土壤有机质含量大于50g/kg,需重新测定。
硝态氮含量(mg/kg)=c*V*D/m其中c为溶液中硝态氮浓度(mg/L),V为浸提液体积(mL),m为烘干土样质量(g),D为浸出液稀释倍数,不稀释时为1。
2.亚硝酸根的测定(重氮化耦合分光光度法)吸取50mL水样于100mL容量瓶中,加4mL对氨基苯磺酸显色剂及4mLa-萘胺显色剂,加蒸馏水至刻度摇匀。
放置20min后在分光光度计上用530nm波长进行比色,读取透光度。
绘制标准曲线:吸取亚硝酸盐标准溶液0、0.5、1、3、5mL,分别放入100mL容量瓶中,此标准系列含亚硝酸根分别为0、0.05、0.1、0.3、0.5mg/L,与待测水样同样条件进行比色,绘制标准曲线。
甜菜谷氨酸合成酶(GOGAT)酶学特性及氮素对其酶活性的调控

ammonia nitrogen,the activity
1:2(N03。咖.
soon as
with the increase of NH4+content,the maximal value Was
The sugar content lowered while the root yield
increased
activity in the leaf
showed the same trend
as
well
Fd.GOGAT,but its
maximal activity Was with
2:1烈03。:NH4十).111e NADH-GOGAT
enhanced
activity in
roots was sensitive to
isozyme of GOGAT(Fd—GOGAT and NADH-GOGAT)were purificated and separated in order to further know about nitrogen
assimilation
mechanism in sugar beet,by using three-steps method,
increase the root yield,the
sugar yield achieved the maximal value at
2:1(N03’:NH4十).
sucrose
There
■,I
(Beta
L.)
Glutamate
synthase(GOGAT),a key enzyme in nitrogen assimilation
process in sugar beet
土壤酶活性测定方法

土壤酶活性测定方法
土壤酶活性测定方法,主要用于评估土壤中各种酶的活性水平,以了解土壤肥力、有机质分解和养分循环等生态过程的状况。
常见的土壤酶活性测定方法包括呼吸酶活性、脲酶活性、过氧化氢酶活性、过氧化物酶活性等。
以下是常用的几种土壤酶活性测定方法:
1.呼吸酶活性测定法
呼吸酶活性是衡量土壤微生物活性和有机质分解的一种指标。
方法基于土壤微生物呼吸作用的过程,通过测定土壤呼吸二氧化碳释放速率来评估土壤微生物活性。
常用的测定方法有浸提法、插管法和接触式法等。
2.脲酶活性测定法
脲酶在土壤中参与尿素的分解过程,是一个重要的氮素转化酶。
脲酶活性的测定方法通常利用碳酸二乙酯在酶的作用下水解成二乙酰胺,通过测定产物的吸光度或荧光强度来评估脲酶活性。
3.过氧化氢酶活性测定法
过氧化氢酶是土壤中对过氧化氢具有催化降解作用的一种酶。
测定过氧化氢酶活性的方法常采用比色法或荧光法。
其中,比色法是通过过氧化氢与乳酸铁催化反应产生的底物和酶催化下的反应速率相关的颜色变化来测定酶活性。
而荧光法则是通过过氧化物与具有荧光基团的底物反应产生荧光信号来测定酶活性。
4.过氧化物酶活性测定法
过氧化物酶包括过氧化物歧化酶和过氧化氢酶,是土壤中分解有毒过氧化物的关键酶。
测定该酶活性的方法主要有过氧化氢法和氧化还原法。
过氧化氢法利用过氧化氢催化底物的氧化反应来测定过氧化物酶活性,而氧化还原法则是通过直接测定底物与过氧化物酶反应后产生的电流或电势差来评估酶活性。
以上是常见的几种土壤酶活性测定方法,通过测定土壤中相关酶活性的变化,可以评估土壤生物学特性并指导土壤改良和管理措施的制定。
几种酶的测定方法

各种酶的测定方法:土壤脲酶测定方法(靛酚比色法)根据脲酶水解时生成的氨与苯酚钠及次氯酸钠反应,形成兰色靛酚这一原理。
试剂配制:1.甲苯(分析纯)2.10%尿素:尿素(分析纯)10克溶于100毫升蒸馏水中。
(当天做当天配)3.柠檬酸盐缓冲液:368克柠檬酸(分析纯)溶于600毫升蒸馏水中;295克氢氧化钾溶于水;将二种溶液合并,调pH至6.7,并用水稀释至2升。
4.苯酚钠溶液:A.62.5克苯酚溶于少量95%乙醇,加2毫升甲醇和18.5毫升丙酮,用乙醇稀释至100毫升。
B.27克氢氧化钠溶于100毫升水中。
将二溶液保存在冰箱里。
使用前,将溶液A、B各吸取20毫升混合,用蒸馏水稀释至100毫升。
5.次氯酸钠溶液:用蒸馏水稀释试剂,至活性氯浓度为0.9%。
(次氯酸钠活性氯浓度为5.2%)。
标准溶液:称0.4717克硫酸铵(105℃烘干)溶于水,稀释至1升(1毫升含100微克氮)即100ppm。
将100ppm的标准溶液稀释为10ppm。
分别吸取0、0.5ml、1.5ml、2.5ml、3.5ml、4.5ml、5.5ml、6.5ml、7.5ml于50毫升容量瓶或刻度试管中,加入试剂,最后定容至50毫升使溶液浓度为:0、0.1ppm、0.3ppm、0.5ppm、0.7ppm、0.9ppm、1.1ppm、1.3ppm、1.5ppm。
分析步骤:称2~5克过20目风干土于50毫升磨口三角瓶中,加5~10滴甲苯,盖好,15分钟后加10毫升10%尿素和20毫升pH6.7柠檬酸盐缓冲液,摇匀后,在30℃恒温箱中培养24小时,过滤。
取滤液1~3毫升(视样品浓度定)于50毫升刻度试管中,加入4毫升苯酚钠溶液和3毫升次氯酸钠溶液,边加边摇匀。
20分钟后定容,在分光光度计波长578nm处比色(1cm比色杯)。
反应生成的靛酚兰能在60分钟以内稳定。
每一土样设置用水代替基质(即尿素)的对照,以除掉土壤中氨态氮引起的误差。
还需减去无土基质(尿素+柠檬酸盐)。
硝酸还原酶活性的测定(活体法)

主要试剂
• 0.1mol/L pH7.5磷酸缓冲液 • 0.2mol/L KNO3 • 磺胺试剂 • α-萘胺试剂 • 亚硝酸钠标准液
实验器材
• 天平 • 真空泵 • 分光光度计 • 恒温箱 • 剪刀 • 试管 • 小烧杯 • 移液管
取材
1. 取十棵小麦,称量叶片1.2克,用剪刀将叶片剪成0.2-0.5cm 小段,在A4纸上混匀。
9 ml
10-3 10-4 10-5
9ml蒸馏水作对照
步骤
在每一皿中放一张滤纸→整齐放入 20粒种子→中缝朝向滤纸,加盖→ 放入25℃温箱中→三天后测定不同 处理中的平均根数。(3勺种子)
意义
盐类或有机物从细胞中渗出,进入周围环 境中。通过电导度的测量,可以测知物质 的外渗,表明植物受害的情况。
实验器材
电导仪,冰 箱, 恒温箱,恒温 水浴器,量筒, 烧杯,镊子,玻 棒等。
实验步骤
1. 豆芽30株,切取中段1-2cm 长(用刀片),10株一组,分 三组,分别放于小烧杯内。
2.处理 60℃ 温箱、 -20 ℃ 冰箱(放在白瓷盘内,
在520nm波长下读取光密度。
用什么溶液调100%?
对比标准曲线,查出亚硝态氮的含量。
• 以亚硝酸钠量( µg )为横坐标,以光密度为纵坐标, • 绘制光密度-含量标准曲线。
根据标准曲线计算反应液中所产生的亚硝态氮量。
X × V1/V2
样品中酶活性 (ug / g·h)=
反应时间(0.5hr)×样品重量(g)
硝酸还原酶活性的测定(活体法) 不良环境对植物的伤害
生长素类物质对根芽生长的影响
张晓燕
中国农业大学生物学院
1. 每 两 组 取 十 株 小 麦 , 用 剪 刀 将 叶 片 剪 成 小 于 0.5cm小段,在A4纸上混匀。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CHNH2 │
谷 氨
CH2 │
酰 CH2
胺│
CONH2
NADH
铁氧还蛋白 COOH
2H+,2e—
│
C=O
│
CH2 │ຫໍສະໝຸດ CH2 │COOH
谷氨酸合成酶
NH3 NADH
谷氨酸 脱氢酶
COOH
│
CHNH
2
│
CH2 │
CH2 │
COOH 谷氨酸
COOH
│
CHNH2 │
CH2 │
CH2 │ COOH
转氨基 含氮化
NO2-
NiR,Fe、Mn 根、叶绿体
NH3
NR:硝酸还原酶(nitrate reductase) NiR:亚硝酸还原酶(nitrite reductase)
氨的同化
植物吸收铵盐以后,或当植物所吸收的硝酸盐被 还原成氨后,氨必须立即被同化成氨基酸,否则就会 毒害植物。因为氨可能抑制呼吸过程中的电子传递系 统。 氨的同化方式为:进入谷氨酸合成酶循环。 作用酶类: GOGAT:谷氨酸合成酶;存在于叶绿体。 GS:谷氨酰胺合成酶;存在于叶绿体和细胞质中。 GDH:谷氨酸脱氢酶;存在于线粒体中。
谷丙转氨基作用 (2)生物体内两种重要的转氨基作用
谷草转氨基作用
①谷丙转氨基作用
H
CH3 C NH2 COOH
+
COOH CCHH22
谷丙转氨酶 ( GPT)
CH3
C=O
C=O 磷酸吡 COOH 哆醛
COOH
+
COOH CCHH22 H-C-NH2 COOH
②谷草转氨基作用
COOH CH2 H-C-NH2
2. 氨基态氮(amino nitrogen) 可直接吸收,效果因种类而异
第一类 效果 > 硫酸铵:如甘氨酸、天门冬酰胺等 第二类,尿素 < AA效果 < 硫酸铵:如天门冬氨酸等 第三类,效果 < 尿素:如脯氨酸、缬氨酸等 第四类,有抑制作用:如蛋氨酸
植物转氨酶(GOT和GPT)活度比色测定方法及其应及GOGAT酶活 性的测定
与氮素同化相关酶及测定方法
自然界中N素循环
一、植物体内氮的含量与分布 含量:占植物干重的0.3~5%。
植物种类:豆科植物>非豆科植物 品种:高产品种>低产品种 器官:种子>叶>根>茎秆
二、氮的生理功能
1. 氮是蛋白质的重要成分(蛋白质含氮16~18%) 2. 氮是核酸和核蛋白的成分(核酸中的氮约占植
意义:①贮存氨基;
②解除氨毒;
③参与代谢。
(二)植物对有机氮的吸收与同化
1. 尿素 urea(酰胺态氮 amide nitrogen)
(1) 吸收:根、叶均能直接吸收
(2) 同化:
①脲酶途径:尿素 脲酶
水解
NH3
②非脲酶途径:直接同化
氨基酸
尿素 氨甲酰磷酸 瓜氨酸 精氨酸
尿素的毒害:当介质中尿素浓度过高时,植物 会出现受害症状
COOH
+
COOH CCHH22 C=O
COOH
谷草转氨酶 ( GOT)
磷酸吡 哆醛
COOH
CH2 C=O COOH
COOH + CCHH22
H-C-NH2 COOH
3. 酰胺(amide)的形成及意义
形成:NH3+
谷氨酸(Glu) 酰胺合成酶 天门冬氨酸(Asp) ATP
谷氨酰胺(Gln) 天门冬酰胺(Asn)
谷氨酸 作用 合物
图1 氨的同化途径的模式
反应式:
NH3+谷氨酸+ATP 谷氨酰胺合成酶 谷氨酰胺+ADP+Pi
谷氨酸合成酶
谷氨酰胺+α-酮戊二酸+2e-+2H+
2谷氨酸
转氨酶
合成
谷氨酸+17酮酸
17种氨基酸
蛋白质
转氨基作用(transamination)
(1)定义:是指一种α-氨基酸和α-酮酸在转氨酶的作 用下生成相应的α-酮酸和新的氨基酸的过程。
(5)1mol/L氢氧化钠溶液:40g氢氧化钠(AR)加蒸馏水溶解并定容至 1000ml。 (6)丙酮酸标准液(2μmol/ml):精确称取纯丙酮酸钠22.0mg于100ml容 量瓶中,加0.1mol/L磷酸盐缓冲液至刻度。此液应新鲜配制。 (7)GOT底物液(DL-门冬氨酸200mmol/L,α-酮戊二酸2mmol/L): 称取α-酮戊二酸29.2mg和DL-门冬氨酸2.66g置于一小烧杯中,加入 1mol/L氢氧化钠20.5ml使溶解,并校正pH至7.4,然后将溶液移入100ml 容量瓶内,用0.1mol/L磷酸盐缓冲液定容至刻度。放置冰箱内保存。 (8)GPT底物液:(DL-丙氨酸200mmol/L,α-酮戊二酸2mmol/L): 称取α-酮戊二酸29.2mg和DL-丙氨酸1.79g置于一小烧杯中,加入 0.1mol/L磷酸盐缓冲液(pH7.4)约80ml煮沸溶解后,待冷,用1mol/L氢氧 化钠调pH至7.4(约加0.5ml),再加0.1mol/L磷酸盐缓冲液至100ml混匀, 加氯仿数滴防腐,贮于冰箱内。
株全氮的7%) 3. 氮是酶的成分 4.氮是叶绿素(叶绿素a:C55H72O5N4Mg)的成分
(叶绿体含蛋白质45~60%)
5. 氮是多种维生素的成分:如维生素B1 (C12H17ON3S)、B2 (C17H18O6N4 )、B6(C6H11O3N) 6. 氮是一些植物激素的成分(如IAA、CTK) 7. 氮也是生物碱的组分(如烟碱、茶碱、可可 碱、咖啡碱、胆碱--卵磷脂(磷脂酰胆碱)
无机态: NO3--N、NH4+-N
吸收的形态
(主要)
有机态:NH2 -N、氨基酸、 核酸等 (少量)
(一)植物对硝态氮的吸收与同化 1. 吸收:旱地作物吸收NO3--N为主,主动吸收
2. 同化
(1) NO3--N的还原作用(nitrate reduction)
过程:
NO3-
NR,Mo 根、叶细胞质
过程(1)GDH(谷氨酸脱氢酶)途径
氨
酮酸
酮戊二酸 谷氨酸脱氢酶 谷氨酸 氨 酰胺
各
转氨基作用
种 新 的 氨 基 酸
• (2)GS-GOGAT途径
• (谷氨酰胺合成酶-谷氨酸合成酶)
• 是高等植物同化氨的主要途径
谷氨酰胺 合成酶
ATP
NH3
NH4+吸收 NO3—还原 N2固定 光呼吸
COOH
│
主要试剂 (1)0.05mol/L Tris-HCL缓冲液(pH7.2):0.2mol/L三羟甲基氨基甲烷 (24.2g三羟甲基氨基甲烷用蒸馏水溶解并定容至200ml)50ml和 0.2mol/L HCl44.2ml,用蒸馏水稀释至200ml。 (2)0.1mol/L磷酸盐缓冲液:称取磷酸氢二钠 (AR)11.928g,磷酸二氢钾 (AR)2.176g,加少量蒸馏水溶解并定容至1000ml。 (3)2,4-二硝基苯肼溶液:称取2,4-二硝基苯肼19.8mg,用10mol/L HCL10ml溶解后,加蒸馏水至100ml,保存于棕色瓶中备用,此液可保存 3个月。 (4)0.4mol/L氢氧化钠溶液:16g氢氧化钠(AR)加蒸馏水溶解并定容至 1000ml。
氮素通常被称为生命元素
三、植物对氮的吸收(adsorption)与同化
(assimilation)
植物从外界环境获得N主要是通过 3条途径, 通过NO3- 还原把无 机氮转化为生命体可用的有机氮, 通过固氮菌对 N2的固定, 直接吸 收土壤中的铵或有机氮。
植物的氮源主要是铵盐和硝酸盐,占土壤含氮的1%-2%。
