HQ30d便携式多参数测定仪
便携式多参数仪技术参数

便携式多参数仪技术参数1 适合水体:地表水、地下水、废污水;2 工作温度:-5~50℃;3 通讯端口:RS-232/SDI-12;4 工作软件:适用于Windows2000/XP;5 温度传感器:测量范围-5~+50℃,分辨率优于(含,下同)0.01℃,准确度优于±0.15℃6 pH传感器:测量范围0~14,分辨率优于0.01units,准确度优于±0.2 units;7 电导率传感器:测量范围0~100mS/cm,分辨率可优于0.001 mS/cm,准确度优于±0.5%mS/cm;8 (光学)溶解氧传感器:测量范围0~20mg/L,分辨率优于0.01 mg/L,准确度优于±0.2mg/L;9 浊度传感器:测量范围宽于0~1000NTU,,分辨率优于0.1NTU,准确度优于0.5NTU或2%;10 叶绿素A传感器:测量范围0~400μg/L,分辨率优于0.1μg/L,检出限优于0.1μg/L;11 主机上配备至少三个光学传感器接口,传感器在工作现场可根据情况方便更换;光学传感器自带清洁刷,能有效消除气泡、沾污对测量的影响,并不受外界光线干扰;12 仪器能耗低,内置电池使用寿命长(按每15min采集一次数据,可用连续使用30天以上);13 有足够的内存(按每15min采集一次数据,至少可存储连续使用30天所采集的全参数测量数据),并保证在断电的情况数据不会丢失。
14 主要配置14.1 多参数监测仪主机14.2 数据传出系统屏幕尺寸:13" (39.6cm)处理器型:第二代智能英特尔®酷睿™i7-2670QM 处理器处理器主:3.10GHz内存容量:8GB DDR3 1333MHz硬盘容量:1TB 7200转显卡芯片:2GB NVIDIA® GeForce® GT 540M graphics,含Optimus光驱类型:DVD刻录机支持DVD Sup无线网卡:集成10/100/1000Mbps以太网卡通讯端口:RS-23214.3 手持操作面板14.4 电缆及其数据线14.5 水温、pH、电导率、溶解氧、浊度、叶绿素a以及氧化还原电位传感器15 免费保修期一年,终身维修16 所需配套消耗品及保修期外的零配件必须以优惠价格及时供应17 进行免费安装、调试及其售后服务18 到货后,即安排工程师到甲方指定地点进行免费安装,并严格按照设备性能指标进行调试,调试合格后出具验收报告19 现场培训,培训内容(包括仪器的基本原理、操作使用及日常保养维护等)20 免费提供中、英文操作手册、维护手册。
流水槽不同区域溶氧昼夜变化测定试验
2018.7池塘工业化养殖是生态养殖的典型模式之一,具有增产增效、环境友好、质量安全、管理便捷等优点,已作为江苏省海洋与渔业局重大科技推广项目。
当前,盐城市建湖县已建成全国面积最大的池塘循环水生态养殖基地,走在全国同类养殖模式前列。
笔者曾经在基地亲身蹲点数月,参与一线的养殖过程,开展了相关试验。
本次对流水槽不同区域溶氧昼夜数据的测定,旨在追踪流水槽养殖过程中溶解氧动态变化的全程信息,为今后的系统研究积累原始资料。
一、材料与方法1.试验时间试验开展于2016年8月19日,时间选择在夏季,因为夏季溶解氧的变化尤其是垂直变化更为明显,且高温季节的溶解氧含量通常作为渔业生产最重要的限制性因子之一。
2.试验地点试验地点位于盐城建湖县的池塘循环水养殖基地,彼时已建成52条流水槽,每条流水槽长22米×宽5米×深2米,规模为全国之最。
本次试验所选择的流水槽养殖鳊鱼苗约12万尾,苗种平均规格为250尾/千克。
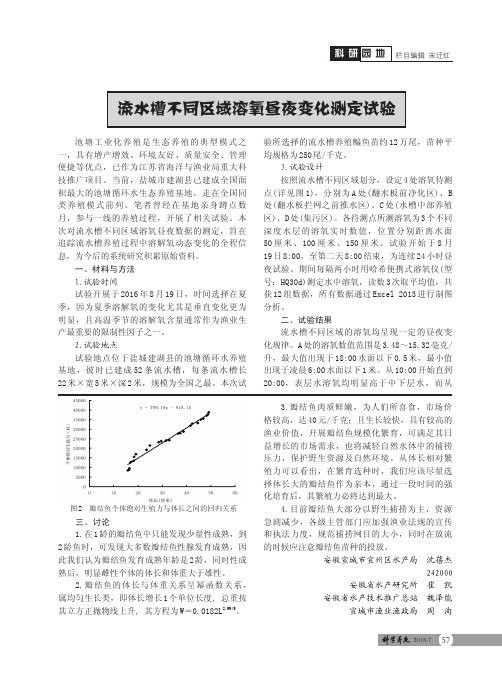
3.试验设计按照流水槽不同区域划分,设定4处溶氧待测点(详见图1),分别为A 处(翻水板前净化区)、B 处(翻水板拦网之前推水区)、C 处(水槽中部养殖区)、D 处(集污区)。
各待测点所测溶氧为3个不同深度水层的溶氧实时数值,位置分别距离水面50厘米、100厘米、150厘米。
试验开始于8月19日8:00,至第二天8:00结束,为连续24小时昼夜试验。
期间每隔两小时用哈希便携式溶氧仪(型号:HQ30d)测定水中溶氧,读数3次取平均值,共获12组数据,所有数据通过Excel 2013进行制图分析。
二、试验结果流水槽不同区域的溶氧均呈现一定的昼夜变化规律。
A 处的溶氧数值范围是3.48~15.32毫克/升,最大值出现于18:00水面以下0.5米,最小值出现于凌晨6:00水面以下1米。
从10:00开始直到20:00,表层水溶氧均明显高于中下层水,而从三、讨论1.在1龄的瓣结鱼中只能发现少量性成熟,到2龄鱼时,可发现大多数瓣结鱼性腺发育成熟,因此我们认为瓣结鱼发育成熟年龄是2龄,同时性成熟后,明显雌性个体的体长和体重大于雄性。
便携型多参数测定仪有哪些特点

便携型多参数测定仪有哪些特点
1.便携性:便携型多参数测定仪通常体积小巧,重量轻,携带方便。
可以随时随地进行测量,适用于各种环境和场合。
2.多功能:便携型多参数测定仪可以同时测量多个参数,具有多重功能。
通过选择合适的传感器和测量模式,可以测量多种物理量,并进行数据分析和处理。
3.精度高:便携型多参数测定仪通常具有较高的测量精度,可以准确地测量各种参数。
通过采用先进的传感器技术和信号处理算法,可以提高测量的准确性和稳定性。
4.易于操作:便携型多参数测定仪通常具有友好的界面和操作方式,简化了用户的操作流程。
用户只需按照提示进行操作即可完成测量,无需复杂的设置和校准过程。
5.数据记录和分析:便携型多参数测定仪通常具有数据记录和分析功能,可以将测量数据保存在内存中,并进行数据分析和处理。
用户可以通过连接计算机或其他设备,导出和分析测量数据,以便进行更深入的研究和应用。
6.高度可扩展:便携型多参数测定仪通常具有良好的可扩展性,可以连接不同类型的传感器和附件,实现更多参数的测量和功能扩展。
用户可以根据需要选择不同的传感器,并通过简单的连接方式进行组合和拓展。
7.耐用性强:便携型多参数测定仪通常采用坚固的外壳和材料,具有较高的耐用性和抗冲击能力。
可以在恶劣的环境下使用,具有较长的使用寿命。
总结来说,便携型多参数测定仪具有便携性、多功能、高精度、易操作、数据记录和分析、可扩展性和耐用性强等特点,适用于各种领域的测量和应用需求。
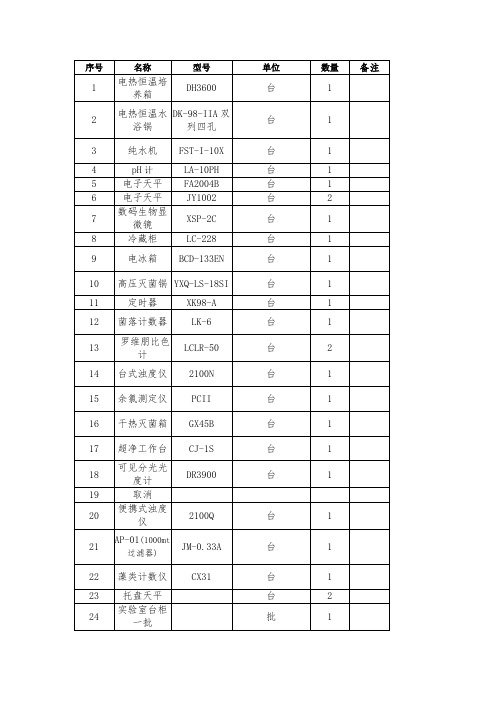
饮用水水质化验42项所需仪器清单
YXQ-LS-18SI
台
1
11
定时器
XK98-A
台
1
12
菌落计数器
LK-6
台
1
13
罗维朋比色计
LCLR-50
台
2
14
台式浊度仪
2100N
台
1
15
余氯测定仪
PCII
台
1
16
干热灭菌箱
GX45B
台
1
17
超净工作台
CJ-1S
台
1
18
可见分光光度计
DR3900
台
1
19
取消
20
便携式浊度仪
2100Q
序号
名称
型号
单位
数量
备注
1
电热恒温培养箱
DH3600
台
1
2
电热恒温水浴锅
DK-98-IIA双列四孔
台
1
3
纯水机
FST-I-10X
台
1
4
pH计
LA-10PH
台
1
5
电子天平
FA2004B
台
1
6
电子天平
JY1002
台
2
7
数码生物显微镜
XSP-2C
台
1
8
冷藏柜
LC-228
台
1
9
电冰箱
BCD-133EN
台
1
10
台
1
21
AP-01(1000mt过滤器)
JM-0.33A
台
1
22
藻类计数仪
CX31
(完整版)HQ30d便携式多参数测定仪

HQ30d便携式多参数测定仪1 用途:HQ 30d便携式测定仪在与IntelliCAL 电极一起使用时,可以连接超纯电极、标准电极以及野外使用的坚固型电极,测定多种参数,例如pH 值、ORP、电导率、盐度、总溶解固体、溶解氧和钠离子等。
可用于市政污水、工业污水、饮用水、环境监测、教育、科研等领域的水质分析。
2 HQ系列数字化分析仪2。
1 工作条件2.1.1电源要求:两种供电模式(1) AA 碱性电池或镍氢电池(4个)(2)外置的 USB/DC 电源适配器:100–240 V, 50/60 Hz输入; 4.5~ 7.5 V (7 VA)输出(外置电源及USB适配器需要选配)2.1.2 存储温度:–20 ~+60 °C2。
1.3 操作温度: 0 ~+60 °C操作湿度: 90% (无冷凝)2.2技术性能指标2.2。
1 语言:支持多国语言★2。
2.2显示:可显示1个或2个电极的读数(1)pH电极:pH、mV、温度(2)电导率电极:电导率、盐度、总溶解固体、温度(3)溶解氧电极:溶解氧、压力、温度(4)LBOD电极:溶解氧、压力、温度(5)ORP氧化还原电位:mV、温度★2.2。
3 数据内存: 500 组数据★2.2。
4 数据存储:校准数据都存贮在日志中.在“按下即读"模式和间隔测量模式时可自动存储。
在“连续读数"模式时需手动存储.★2.2。
5 数据传输:通过USB转接下载至电脑或U盘,读数时同步传输2.2.6 温度自动修正/ 补偿2.2.7 锁定显示数据功能★2。
2。
8 自动识别校准标准:2。
2。
9 键盘:通过USB外接键盘★2.2。
10防水性:测定仪外壳可在1 米深的水中浸泡30 分钟(IP67)2.2。
11 尺寸:19。
7×9。
5厘米2。
2。
12 重量: 330 g430 g (安装了四节 AA 碱性电池)3 HQ系列IntelliCAL 电极技术性能指标3.1温度量程:—10.0~110。
HQ30d溶氧仪

文献编号:HQ40d18HQ系列便携式测定仪用户手册2006年9月,第五版Hach公司,2006年。
版权所有HACH中国公司售后服务热线电话:800-810-9290目录第一章 一般信息 (7)1.1安全信息 (7)1.1.1危害信息的使用 (7)1.1.2防护型标签 (7)1.2产品概述 (8)1.3测定仪的描述 (8)第二章 技术参数 (9)第三章 安装 (11)3.1仪器拆箱 (11)3.2交流电源和电池 (12)3.2.1使用电池供电 (12)3.2.2使用交流电源供电 (14)3.3开启和关闭测定仪 (14)3.4电极的连接 (14)3.5数据传输 (16)第四章 系统启动 (19)4.1基本的启动概述 (19)4.2测定仪的用户界面和导航 (20)4.2.1键盘的描述 (20)4.2.2显示屏描述(单通道显示和双通道显示) (21)4.2.2.1使用单通道屏幕显示方式 (21)4.2.2.2使用双通道屏幕显示方式(仅HQ40d) (21)4.3选择语言 (22)4.4设定日期和时间 (22)第五章 标准操作 (25)5.1设定样品识别和操作人员识别 (25)5.1.1样品的编号 (25)5.1.1.1创建一个新的样品编号 (25)5.1.1.2选择一个样品编号 (26)5.1.1.3删除一个样品编号 (26)5.1.2操作人员的编号 (27)5.1.2.1创建一个新的操作人员的编号 (27)5.1.2.2选择一个操作人员的编号 (27)5.1.2.3删除一个操作人员的编号 (28)5.2使用数据日志 (28)5.2.1存储数据 (28)5.2.2查看存储的数据 (28)5.2.3查看电极的数据 (29)5.2.4删除数据 (30)5.3传输数据 (31)5.3.1传输数据选项 (31)5.3.1.1选择打印报告的类型 (31)5.3.1.2在数据文件中包含栏目头 (32)5.3.2将数据发送到打印机 (33)5.3.3将数据发送到闪存装置 (33)5.3.4使用HQd PC应用软件将数据发送到计算机 (34)5.3.5发送电极校准数据 (35)5.4查看打印出来的数据日志报告 (36)5.4.1报告的名称 (36)5.4.2样品的结果 (36)5.4.2.1基本报告 (36)5.4.2.2复杂报告 (37)5.4.2.3总报告 (37)5.4.3校准结果 (38)5.4.4检查标准的结果 (39)5.5查看打印出来的校准报告 (40)5.5.1当前的校准报告 (40)5.5.2校准历史报告 (41)5.6查看下载的数据文件 (42)5.7存档并交换用户的方法 (45)第六章 pH值的操作和方法 (47)6.1校准pH电极 (47)6.1.1校准错误 (48)6.1.1.1不能识别标准 (48)6.1.1.2斜率错误 (48)6.2进行pH值测量 (49)6.3运行检查标准 (49)6.3.1自动检查标准或定期检查标准 (49)6.3.2测量检查标准 (50)6.3.3延迟检查标准 (51)6.4设定pH方法 (51)6.5修改当前的方法菜单 (52)6.5.1修改pH方法 (53)6.5.2修改pH值测量的选项 (53)6.5.3修改pH值校准的选项 (55)6.5.4修改pH值检查标准的选项 (59)6.5.4.1选择检查标准的缓冲液 (59)6.5.4.2使用定制的检查标准 (59)6.5.4.3编辑检查标准提示器选项 (60)6.5.4.4编辑检查标准认可的准则 (61)6.5.5修改pH值测量单位 (62)第七章 电导率的操作和方法 (63)7.1校准电导率电极 (63)7.2进行电导率、盐度、电阻率或总溶解固体的测量 (64)7.3手动或自动运行检查标准 (65)7.3.1 延迟校准标准 (66)7.4设置电导率方法 (66)7.5修改当前的方法菜单 (67)7.5.1修改电导率方法 (68)7.5.2修改电导率参数 (68)7.5.3修改电导率测量选项 (69)7.5.4修改电导率校准选项 (72)7.5.5修改电导率检查标准选项 (75)第八章 LDO的操作和方法 (79)8.1进行溶解氧的测量 (79)8.2校准LDO电极 (79)8.2.1 校准错误——斜率超出范围 (81)8.3设置LDO方法 (81)8.4修改当前的方法菜单 (81)8.4.1输入一个新的LDO方法 (82)8.4.2修改LDO方法 (83)8.4.3修改LDO的测量选项 (83)8.4.4修改LDO的测量单位 (86)8.4.5修改LDO的校准标准 (86)8.4.5.1选择水饱和空气做为校准标准 (86)8.4.5.2选择水样做为校准标准 (87)8.4.6选择一种LDO方法 (88)8.4.7删除一种方法 (89)第九章 高级操作 (91)9.1测定仪的选项菜单——可以完全访问 (91)9.2操作人员的测定仪选项菜单 (91)9.3使用访问控制 (92)9.3.1将访问控制打开 (92)9.3.2将访问控制关闭 (93)9.4运行检查标准 (93)9.5设定测量模式 (94)9.5.1设置自动测量周期 (95)9.5.2开始周期测量 (96)9.5.3防止数据日志溢流进入周期读数模式 (96)9.6查看仪器信息 (97)9.7设置显示选项 (97)9.8设置声音选项 (98)9.9设置日期和时间 (99)9.10更改温度单位 (99)9.11语言 (99)第十章 维护 (101)10.1测定仪的清洗 (101)10.2电极的清洗 (101)10.3电池的更换 (101)10.4升级仪器的软件 (101)第十一章 零部件和附件 (103)11.1零部件 (103)11.2附件 (103)11.3消耗品 (104)第十二章 订货指南 (107)第十三章 维护服务 (109)第十四章 认证 (111)第十五章 保修 (113)附录A 连接打印机PD-24 (115)索引 (117)第一章 一般信息1.1安全信息在拆箱、安装、操作该设备之前请务必认真阅读整篇手册。
hq30d溶解氧仪校准方法

hq30d溶解氧仪校准方法The calibration of the HQ30D Dissolved Oxygen Meter is an important process to ensure accurate and reliable measurements. Proper calibration allows the instrument to produce precise results that can be trusted for various scientific and industrial applications. One of the key methods for calibrating the HQ30D is through the use of calibration solutions with known concentrations of dissolved oxygen. These solutions serve as reference standards against which the meter's readings can be compared and adjusted accordingly.HQ30D溶解氧仪的校准是确保准确可靠测量的重要过程。
正确的校准可以使仪器产生可以信赖的精确结果,可用于各种科学和工业应用。
校准HQ30D的关键方法之一是通过使用已知溶解氧浓度的校准溶液。
这些溶液作为参考标准,衡量仪器的读数可以与其进行比较和相应地调整。
It is crucial to follow the manufacturer's instructions and guidelines for calibrating the HQ30D Dissolved Oxygen Meter to ensure the reliability of the results. The process typically involves preparing the calibration solutions, immersing the sensor in the solutions, allowing the readings to stabilize, and adjusting the instrument accordingly.Regular calibration of the meter is recommended to maintain its accuracy and performance over time, especially in critical applications where precise measurements are essential.为确保结果的可靠性,应遵循制造商的说明和指南进行HQ30D溶解氧仪的校准。
上海桃浦工业区内河道水质月动态评价及解析

上海桃浦工业区内河道水质月动态评价及解析张廷辉;黄民生;马明海;张雯;崔贺【摘要】以上海市桃浦工业区4条中小型河道为研究对象,pH值、水温(WT)、溶解氧(DO)、透明度(SD)、5日生化需氧量(BOD5)、化学需氧量(CODCr)、高锰酸盐指数(CODMn)、总有机碳(TOC)、氨氮(NH3-N)、硝态氮(NO3-N)、总氮(TN)、叶绿素a(Chl-a)、溶解性磷(DP)和总磷(TP)为水质评价因子,采用主成分分析法、综合污染指数法、综合营养状态指数法、有机污染指数法和综合水质标识指数法,评价河道水环境质量,分析水质时空变化特征,解析污染源初步解析水环境污染及其变化的成因.研究结果表明,4条河道中工业河污染最严重,小宅浜与张泾河次之,红祁河水质最好;TN和TP是河道水环境的主要污染因子;河道中的磷均以溶解性磷酸盐为主,氮均以氨氮为主.桃浦工业区内河道存在工业废水、生活污水和厨余废水直排、偷排现象,河道水环境的深化治理应在进一步控源的基础上开展原位修复.%Taking pH,WT,DO,SD,BODs,CODCr,CODMn,TOC,NH3-N,NO3-N,TN,Chl-a,DP and TP as the primary parameters,four medium or small creeks in Shanghai Taopu industry area are chosen as research rivers to evaluate the water quality,analyze temporal variation of water quality and identify pollution sources,by using analysis method such as principal component analysis,comprehensive pollution index,comprehensive nutritiveindex,organic pollution index and comprehensive water quality identification index.The research results indicate that Gongye River was the most polluted river in the four rivers,followed by Xiaozhai River and Zhangjin River,and Hongqi River was the best.TN and TP were the primary pollution parameters.DP was the main composition of TP,and NHa-N is themain composition of TN.In industry area,pollution control of small malodorous rivers should focus on source control,and take the integrative measurements like "source control and retention".【期刊名称】《华东师范大学学报(自然科学版)》【年(卷),期】2017(000)006【总页数】10页(P147-155,163)【关键词】水环境质量;中小河道;指数评价;黑臭河道;月动态【作者】张廷辉;黄民生;马明海;张雯;崔贺【作者单位】华东师范大学生态与环境科学学院,上海200062;华东师范大学生态与环境科学学院,上海200062;华东师范大学生态与环境科学学院,上海200062;黄山学院生命与环境科学学院,安徽黄山 245041;华东师范大学生态与环境科学学院,上海200062;华东师范大学生态与环境科学学院,上海200062【正文语种】中文【中图分类】X821工业区是工业化过程中国家或者地区内工业企业聚集形成的区域,如国际知名的德国鲁尔区、英国伦敦地区、法国洛林地区和国内的东北老工业基地等.工业区曾是一个地区的经济命脉[1-4],但随着工业化进程不断加快,大量未经有效处理的工业废水、生活污水排入城市河道等,造成水环境污染,严重破坏了河道生态平衡和自我修复能力,导致河道富营养化、藻类大量繁殖、水质变黑发臭、高等生物消亡、景观功能下降甚至丧失等[5-12].目前,有关工业区转型的研究很多,但涉及到转型期间工业区内河道水质变化分析的研究较少[1-2,8,13].工业区内小型河道水体既是区域水环境资源循环和调蓄的重要载体,又是区域污染物的集聚和净化场所,其水质、底质的环境质量及其变化是反映区域污染强度、污染类型的一面“镜子”.上海市普陀区桃浦工业区位于上海中心城区西北角,处于中环与外环之间,毗邻宝山和嘉定等区域,工厂密集,交通便利.从20世纪70年代开始,桃浦工业区曾是上海市西北部重要的医药和精细化工生产基地,期间,该工业区内集中了大量的制药厂、化工厂以及制笔、纺织企业,污染源类型多、排污负荷高、治理难度大,积累下了很多严重的环境问题.具体来说,桃浦工业区属于工业和居住混杂区,周边分布有企业、居民区、大学校园以及物流和集贸市场,人口密集,生产和生活活动频繁,生活污水、工业废水的排放和垃圾入河造成了工业区内(河道)水质的黑臭现象[14].2014—2015年,上海有关部门对工业河及红祁河实施了治理,主要工程措施包括底泥疏浚、护岸修整等措施[14-15].为探究工业区内河道治理后水环境变化及其成因,本文选取上海市具有代表性的桃浦工业区内4条河道(红祁河、张泾河、小宅浜及工业河)进行为期1年的水质跟踪监测,选择pH值、水温(WT)、溶解氧(DO)、透明度(SD)、氨氮(NH3-N)、总氮(TN)、硝态氮(NO3-N)、溶解性磷(DP)、总磷(TP)、化学需氧量(CODCr)、高锰酸盐指数(CODMn)、五日生化需氧量(BOD5)、总有机碳(TOC)和叶绿素a(Chl-a)等因子进行主成分分析,采用4种指数分别从富营养化、有机污染和综合水质等角度评价河道水环境周年动态变化,并进行相关性分析,以期为工业区内河道水环境质量的改善以及黑臭河道的治理、评价与管理规划提供科学依据. 本研究区域共有4条河道,分别为工业河、红祁河、小宅浜和张泾河,河道概况见表1.河道采样点位主要设置在河道交界处、厂房聚集处、河流断头处、河路交叉处及排水汇集处设置.4条河道共设置16个采样点位,具体点位布设见图1.自2015年9月至2016年8月(定3—5月为春季,6—8月为夏季,9—11月为秋季,12月、次年1月、次年2月为冬季),逐月对桃浦工业区东片4条河道进行水样采集,采样点位于河道中心,深度约为水面下15 cm,样品为3次采样混合样品.采样期间避开台风、暴雨等极端天气.水样的pH值、DO、WT和SD为现场测定,其他指标的测定于24 h内在实验室完成测试.DO和WT采用HQ30d53型便携式溶氧仪测定,pH使用HI9812-5型便携式pH计测定,TOC采用TOC-V型分析仪分析,其他指标的测定方法参考《水和废水监测分析方法》(第四版).无特别说明外,所有试剂均为分析纯,实验用水为新鲜去离子水.本研究分别采用主成份分析法[16]、综合污染指数(P)[17]、有机污染指数(A)[6]、综合营养状态指数(TLI)[18]和综合水质标识指数(Iwq)[19]对河道进行水质分析评价,各指标与指数直接的关系采用SPSS进行相关性分析,并对水质周年动态变化进行比较分析.水质综合污染指数评价法计算公式如下:式中,P为综合污染指数;Si为第i种污染物的标准指数;Ci为第i种污染物实测平均浓度,mg/L;C0i为第i种污染物评价标准值,单位为mg/L.有机污染综合评价值A按下式计算:式中,BODi、CODi、NH3-Ni和 DOi为实测值,单位为 mg/L;BOD0、COD0、NH3-N0和DO0为规定的标准值,DO饱=468/(31.6+T),单位为mg/L;T为水体实温度,单位为°C.营养状态指数评价法表达式为:式中,为第j种参数与基准参数Chla的相关系数,m为评价参数的个数,TLI(j)代表第j种参数的营养状态指数,公式中涉及的标准值根据河道所属水环境功能区选取,均为V类水标准(见表2).选取 TOC、CODCr、CODMn、BOD5、TN、NO3-N、NH3-N、TP、Chl-a、DO、WT、SD和pH共13个指标,将2015年9月至2016年8月共12个月14个采样点的各指标监测值取均值,采取SPSS中的因子分析对河道水质进行主成分分析,选取2个主成份(对应特征值均大于1),前2个主成分累积贡献率达97%以上.各水质指标与2个主成分之间的关系见表3.各指标与某一主成分的联系系数的绝对值越大,则该主成分与指标之间的联系越紧密[20].由表3可知,Chl-a与第二主成分联系较为紧密.除WT和Chl-a以外,其余11个指标均与第一主成分联系紧密,说明第一主成分可以代表这些指标反映河道整体水质状况.由SPSS计算出每条河道的2个主成分得分及综合得分见表4.主成分得分是指计算样品在各主成分上的得分,主成分得分越高,与各污染指标的“贡献”越大.由表4可以看出,4条河道中,工业河水质最差,小宅浜次之,张泾河水质较好,红祁河水质最好.图2为4条河道综合污染指数周年变化图.红祁河除2016年1月14日—3月23日外,其余月份P值处于1左右,是水质最好的.工业河P值最高,年平均P值达2.6,达到严重污染状态,这可能与里店浦附近城中村向工业河排污有关.小宅浜P值周年数值略高于张泾河,两河冬季处于重污染水平,其余各月均在中污染水平左右.小宅浜P值较高原因可能是因为其西段城中村废水直排现象严重,且该段与东段之间被桥涵阻隔,水动力条件不足.张泾河南端连通工业河西段,导致工业河严重黑臭河水入侵,水质变差.相关性分析显示,工业河与张泾河的P值周年变化显著相关(r=0.962,p<0.01).由图2可以看出,4条河道P值周年变化趋势相同且随时间变化较大,总体呈秋冬季上升、春夏季下降趋势.综合污染指数较高的几个月(2016年1、2、3月)中,氨氮对综合污染指数的贡献最大,在2016年2月中占到了73%∼77%.而在工业河中,氨氮在综合污染指数中的占比很高,在2015年9月到2016年3月达到了43%∼75%,这可能是由于冬季降水少,污径比高,而夏季降水多,污径比低,且河道内微生物活性(有机碳降解和氨氮硝化)随水温下降而降低[11].由图3可知,4条河道有机污染指数A值周年变化趋势基本相同,均在2016年2月达到最高值,原因可能是河道的冬季污径比高,A值升高.河道的夏季A值显著降低,也是由于夏季污径比低且藻类光合作用产生氧气.2016年4月,河道A值低于同年3月和5月,可能是由于2016年4月上海降雨量较大,据上海气象局资料,该月有雨天数达到17 d,高于同年3月和5月.较大的降雨量增强了河水的稀释作用,相关性分析表明,工业河与红祁河的氨氮浓度与各自A值周年动态变化存在显著正相关性(r=0.811,p<0.01;r=0.770,p<0.01).工业河A值全年均大于2,年平均A值为9.67,属于严重污染状态.红祁河A值除2015年11月外,其余各月均大于2,年平均A值为4.72,属于严重污染状态.小宅浜和张泾河年平均A值分别为6.36和6.07,均属于严重污染状态.小宅浜、工业河A值较高原因可能是因为周边存在废水直排现象.张泾河南端连通工业河西段,导致工业河严重黑臭河水入侵,水质变差.相关性分析显示,小宅浜和张泾河A值的周年变化趋势显著相关(r=0.946,p<0.01).由图4可以看出,4条河道全部达到富营养化程度,其中,工业河和小宅浜整体为重度富营养,红祁河整体为中度富营养(年TLI均值为68.8),张泾河介于中、重度富营养状态之间.4条河道的TLI值总体趋势较为一致,夏秋季节高、冬春季节低,且与浮游藻的季节消长规律一致.决定河水TLI值的水环境因子包括Chl-a、SD、TN、TP和COD,其中,TN、TP和COD也是计算P值的核心指标,河道富营养化的主要原因是氮和磷的超标.氮和磷不仅是水体富营养化的主要影响因子,同时也是河道的主要污染因子;而Chl-a和SD是计算TLI值的独有指标,Chl-a与TLI成正比(藻密度越高,富营养化程度越高),SD与TLI成反比(藻密度越高,透明度越低).这种“三同二异”是造成TLI值与P值变化规律差异的主要原因.相关性分析显示,工业河的水质富营养化周年动态变化分别与小宅浜和张泾河显著相关(r=0.835,p<0.01;r=0.766,p<0.01),小宅浜与张泾河的水质富营养化周年动态变化显著相关(r=0.834,p<0.01).以地表Ⅴ类水为水环境功能目标,计算2015年9月至2016年8月4条河道的综合水质标识数(见图5).由图5可知,工业河Iwq值除2016年4月外,其余几个月的综合水质标识指数均未达到Ⅴ类水环境功能目标;小宅浜与张泾河则分别只有两个月达到Ⅴ类水目标;红祁河年Iwq均值为5.820,总体达到Ⅴ类水环境功能目标,其余3条河道年Iwq均值均在6以上,未达到Ⅴ类水环境功能目标.其主要原因为工业河、小宅浜和张泾河TN、TP、NH3-N超标严重,其中工业河TN、NH3-N年Iwq均值分别达到14.3、11.3,各超标9个等级和6个等级,其余两条河道TN、NH3-N和TP的Iwq评级均为“劣Ⅴ类黑臭”.4条河道Iwq值总体呈冬季高、夏季低趋势,在2016年2月份达到最高.其原因是2016年2月4条河道的TN和NH3-N月Iwq值分别达到了15.8∼21.1和15.8∼22.3,氮含量超标严重.相关性分析显示,张泾河的综合水质标识指数周年动态变化分别与小宅浜和红祁河显著相关(r=0.837,p<0.01;r=0.717,p<0.01),工业河分别与小宅浜和张泾河的综合水质标识指数周年动态变化显著相关(r=0.073,p<0.05;r=0.754,p<0.05).按照《上海市水环境功能区划(2011)年修订版》选取相应水质控制标准.选取pH、SD、DO、CODCr、CODMn、BOD5、NH3-N、TN、Chl-a和TP共10个水质指标,将12个月4条河道各水质指标的全年监测值取均值后对其进行指数评价,结果见表5.综合污染指数的评价结果显示,4条河道周年整体处于污染状态,污染程度从高到低依次为工业河>小宅浜>张泾河>红祁河,由北向南逐渐加重(工业河是这个连片水系的污染源,其次是小宅浜).其主要污染因子(指标)依次为TN→NH3-N→TP,氮(特别是氨氮)、磷不仅是主导河道黑臭的因子,而且是主导河道富营养化的因子.同时,水质级别和污染类型呈现梯度分布规律(从北到南逐渐恶化):工业河-劣V类+黑臭+重度富营养→小宅浜-劣V类+不黑臭+重度富营养→张泾河-劣V类+不黑臭+重度富营养→红祁河-V类+不黑臭+中度富营养.工业河与小宅浜的污染源主要在西段且两条河道的东端(与桃浦河相接)均有1个调水泵闸,故水质也呈现由西向东逐渐好转的梯度变化规律.工业河与红祁河已经实施了底泥疏浚整治,沿岸的生活污水和初期雨水排水成为河道的主要污染源,这与现场的调查情况一致.4条河道全部富营养化,工业河兼具黑臭.在这类污染河道中,由于水体缺氧(全年或季节性,BOD耗氧+死水所致,有机物降解先于氨氮硝化)导致氨氮在总氮中的占比高(43%~74%),是治理和修复的重点任务. 工业河与红祁河已经实施了底泥疏浚整治,沿岸的生活污水和初期雨水排水成为河道的主要污染源,这与现场的调查情况一致.4条河道全部富营养化,工业河兼具黑臭.在这类污染河道中,由于水体缺氧导致氨氮在总氮中的占比高(43%~74%),是进一步治理和修复的重点任务.针对河道的主要污染因子N和P,分别对河道的TN、NH3-N、硝酸盐氮(NO-3-N)、亚硝酸盐氮(NO-2-N)、DP和TP的周年整体情况进行分析(见图7).由图7可知,河道的磷含量均以溶解性正磷酸盐为主,占总磷的百分比中张泾河最高为81.28%;氮含量主要以氨氮形式存在,工业河、小宅浜、张泾河和红祁河中氨氮分别占总氮74.40%、64.95%、60.43%和43.45%.氨氮是水体中无机氮的主要存在形式,氨氮在一定情况下会发生硝化反应,消耗大量水体溶解氧,并促进了藻类的生长[21].结合水质污染指数分析可知,河道的有机物含量均较高,消耗了水中大量DO,从而导致氨氮转化为硝酸盐氮的进程受阻.河道外源排污是影响河道水环境及其变化的重要因素.选取工业河、小宅浜两条河道的代表性点位进行研究.通过现场调查,发现:小宅浜西端河面布满浮萍,岸边垃圾随意放置,小饭店和城中村密集,偷排暗渠隐蔽,废水直排现象严重.工业河西端和里店浦与工业河连接处垃圾入河、水质浑浊,透明度常年在0.4 m以下,污水直排入河.3条河道水环境污染主要是由于外源排污,其中,工业废水是里店浦南口和工业河西端的主要污染源,生活污水和厨余废水是小宅浜西端的主要污染源.(1)4条河道中3条为劣V类,1条为V类,1条黑臭;4条全部富营养化.(2)4条河道的水环境季节性变化较明显:冬季污径比高,水质恶化;夏秋季气温高,浮游藻生长旺盛.(3)氮磷是4条河道水质污染的主要因子,其中,氨氮在总氮中占比较高,且受制于外源排污、内源释放和溶解氧竞争等多种条件,污水进入河道后,有机物降解先于氨氮硝化并快速消耗溶解氧,导致河道内氨氮的累积效应.(4)桃浦工业区内河道存在工业废水、生活污水和厨余废水直排、偷排现象,河道水环境的深化治理应在进一步控源的基础上开展原位修复.(责任编辑:张晶)【相关文献】[1] 王军,邱少男.关于老工业区改造与“转方式、调结构”的思考——德国鲁尔区经济结构调整对青岛的借鉴[J].中国发展,2012(3):12-15.[2] 夏添.跨区域老工业区与大都市老工业区转型路径对比——以上海杨浦老工业区和东北老工业区为例[J].上海经济研究,2015(6):123-129.[3] ZHENG H W,SHEN G Q,WANG H.A review of recent studies on sustainable urban renewal[J].Habitat International,2014,41:272-279.[4]BERTRAND O,MANSUV-HUAULT L,MONTARGES-PELLETIER E,et al.Molecular evidence for recent land use change from a swampy environment to apond(Lorraine,France)[J].Organic Geochemistry,2012,50:1-10.[5] 黄燕,黄民生,徐亚同,等.上海城市河道治理工程简介[J].环境工程,2007(2):85-88.[6] 阮仁良,黄长缨.苏州河水质黑臭评价方法和标准的探讨[J].上海水务,2002(3):32-36.[7] 瞿伟,包卫彬.产业结构转型为导向的我国资源型城市可持续发展模式研究——以法国洛林地区可持续发展案例为鉴[C]//中国可持续发展研究会2005年学术年会论文集(上册).上海:2005中国可持续发展论坛,2005:111-115.[8] 尹贻梅,刘志高,刘卫东,等.城市老工业区创意转型路径研究:以北京石景山为例[J].地理与地理信息科学,2011(6):55-60.[9] 邹丛阳,张维佳,李欣华,等.城市河道水质恢复技术及发展趋势[J].环境科学与技术,2007(8):99-102.[10] 何平,徐玉裕,周侣艳,等.杭州市区主要河道水质评价及评价方法的选择[J].浙江大学学报(理学版),2014(3):324-330.[11] 汪晓燕,钟声.不同季节太湖流域氨氮与总氮含量变化研究[J].安徽农业科学,2014,25:8712-8713.[12] 王英才,刘永定,郝宗杰,等.上海市几条黑臭河道治理效果的比较与分析[J].水生生物学报,2009(2):355-359.[13] 赵昊铭.区域工业循环经济发展研究——以株洲清水塘工业区为例[D].湖南株洲:湖南工业大学,2012.[14] 黄民生,马明海.城市水体环境及其治理:案例分析[M].北京:中国建筑工业出版社,2016.[15] 汪建华,王文浩,何岩,等.原位曝气修复黑臭河道底泥内源营养盐的示范工程效能分析[J].环境工程学报,2016(9):5301-5307.[16] 蔡聪,朱竟益,徐玉良,等.基于主成分分析与模糊综合评价模型的昆山市老城区河道水质评价[J].水电能源科学,2015(11):14-17.[17] 魏俊,金敏莉,杨瑾,等.杭州市市区河道水环境质量评价方法研究[J].环境工程,2015(S1):981-984.[18] 王明翠,刘雪芹,张建辉.湖泊富营养化评价方法及分级标准[J].中国环境监测,2002(5):47-49.[19] 徐祖信.我国河流综合水质标识指数评价方法研究[J].同济大学学报(自然科学版),2005(4):482-488.[20] 林海明.如何用SPSS软件一步算出主成分得分值[J].统计与信息论坛,2007(5):15-17.[21] 张小君,徐中民,宋晓谕,等.几种水环境质量评价方法在青海湖入湖河流中的应用[J].环境工程,2013(1):117-121.。
HQ11d便携式氧化还原电位使用说明

HQ11d便携式氧化还原电位使用说明产品名称:美国哈希 HQ11d pH/ORP水质检测仪产品概述:HQ11d数字化pH分析仪可与任一个标准的pH IntelliCAL电极一起使用。
HQ11d使用了很多先进的软件和技术是一种非常经济的测量方法。
校准数据和校准历史可随着每个IntelliCAL电极一起走使得操作人员可以在分析仪之间调换已校准的电极。
应该在一个可控的环境中校准电极可以在现场使用这些电极。
自动检测标准程序和校准提醒可以确保数据的准确性。
可以将每个测量的样品ID 用户ID和电极序列号联系起来一共可以存储500个数据记录。
仪器特点:一机多用一台HQd多功能水质检测仪可连接不同的电极。
用于测定pH、ORP、钠、铵、氨、氟、硝酸盐、氯、电导率、溶解氧等参数。
多种测量方式HQd便携式水质分析仪提供三种读数模式,可实现即按即读、间接读数、连续读数的测量。
大屏幕,多参数,多项目显示大号双通道显示屏,在显示测量参数的同时还可以显示电极型号,仪器电量、测量日期温度、样品及用户ID等辅助信息。
人性化校正指南HQd便携式水质分析仪的操作界面简单直观。
具有校正指引和标准规程检查,从而大大减少校正错误,且简化了操作过程。
校正状态指示灯和校正提醒保障您能获得正确的校正结果。
BOD电极LBOD10101--- 整合了搅拌器和1.8米缆线的LDO型电极HQDBOD01--- BOD系统;包括HQ40d分析仪,带1.8米缆线的LBOD电极,以及分析仪支架8505700--- BOD系统;包括HQ40d分析仪,带1.8米缆线的LBOD电极,分析仪支架,一次性BOD瓶(117/包),丙烯酸树脂塞子(25)以及BOD瓶盖(2包,6个/包)分析仪HQ40d 53000000 HQ40d双通道输入多参数分析仪(包括现场工具箱和USB/AC电源连接线)HQ30d 53000000 HQ30d单通道输入多参数分析仪HQ11d 53000000 HQ11d 便携式数字化pH/ORP分析仪HQ14d 53000000 HQ14d 便携式数字化电导率分析仪耗材类5181200LDO---传感器组件包(含一个传感器帽、存储校正数据的芯片以及密封垫圈)2965026---电极填充液,2.44M KCl(pHC281电极的内部填充液)2965126---电极填充液,0.02M NH4Cl(ISENa381电极的内部填充液)2965349---还原性溶液,ORP电极(有助于减少MTC电极在还原性样品(i.e. 缺氧区)中的响应时间)2965249---电极清洗液(用于清洗pHC,MTC和ISENa等型号的电极)2316949---ORP标准溶液,500mL(用于MTC电极的首次校正,不同于其他ORP标准溶液,它的温度补偿范围是0到30℃) 2841700---3.0M KCl,银饱和溶液,30mL(现有的pHC302和新的MTC301电极内部填充液)5838000---LBOD传感器帽的更换件(包含iButton和传感器帽)pH缓冲溶液高品质瓶装缓冲溶液,即开即用2283449--pH 4.01--红色--500mL2283549--pH 7.00--黄色--500mL2283649--pH 10.01--蓝色--500mL独立密封包装的pH粉枕。
DZB-712F型便携式多参数分析仪使用说明书

目录1仪器介绍............................................................................................... - 1 -1.1简介 .......................................................................................... - 1 -1.2技术指标 .................................................................................. - 3 -1.3主要功能 .................................................................................. - 6 -2安全提示............................................................................................... - 9 -3专业术语............................................................................................. - 10 -4仪器结构及安装................................................................................. - 12 -4.1仪器结构 ................................................................................ - 12 -4.2仪器的安装 ............................................................................ - 14 -4.2.1便携式腕带安装......................................................... - 14 -4.2.2电极的安装................................................................. - 15 -5仪器操作............................................................................................. - 17 -5.1开关机 .................................................................................... - 17 -5.2屏幕标识 ................................................................................ - 17 -5.3仪器设置 ................................................................................ - 20 -5.3.1导航式设置................................................................. - 20 -5.3.2测量参数设置............................................................. - 20 -5.3.3读数方式设置............................................................. - 22 -5.3.4pH参数设置............................................................... - 23 -5.3.5pX参数设置............................................................... - 25 -5.3.6电导参数设置............................................................. - 26 -5.3.7溶解氧参数设置......................................................... - 27 -5.3.8温度参数设置............................................................. - 28 -5.3.9数据管理设置............................................................. - 29 -5.3.10输出设置..................................................................... - 29 -5.3.11用户ID设置 .............................................................. - 29 -5.3.12系统参数设置............................................................. - 29 -5.4P H测量................................................................................... - 30 -5.4.1标定前的准备............................................................. - 30 -5.4.2pH电极的标定........................................................... - 31 -5.4.3pH的测定................................................................... - 33 -5.5离子测量 ................................................................................ - 34 -5.5.1选择离子模式............................................................. - 34 -5.5.2选择测量模式............................................................. - 35 -5.5.3标定前的准备............................................................. - 38 -5.5.4离子电极的标定......................................................... - 41 -5.5.5离子的测定................................................................. - 42 -5.6电导率测量 ............................................................................ - 44 -5.6.1输入电极常数启用新电极......................................... - 44 -5.6.2标定前的准备............................................................. - 45 -5.6.3电导电极的标定......................................................... - 45 -5.6.4电导率的测定............................................................. - 47 -5.7TDS测量................................................................................ - 48 -5.7.1低浓度简单样品的TDS测量 ....................................- 48 -5.7.2高浓度简单样品的TDS测量 ................................... - 49 -5.7.3复杂样品的TDS测量 ............................................... - 50 -5.8盐度测量 ................................................................................ - 50 -5.9电阻率测量 ............................................................................ - 50 -5.10溶解氧测量 (50)5.10.1标定前的准备............................................................. - 51 -5.10.2溶解氧电极的标定..................................................... - 52 -5.10.3溶解氧的测定............................................................. - 53 -5.11饱和度测量........................................................................... - 54 -5.12数据管理 .............................................................................. - 54 -5.12.1查阅设置..................................................................... - 55 -5.12.2查阅结果..................................................................... - 55 -5.12.3打印结果..................................................................... - 56 -6仪器维护与故障排除......................................................................... - 59 -6.1仪器的维护 ............................................................................ - 59 -6.2电极的使用和维护 ................................................................ - 59 -6.3电池使用说明和维护 ............................................................ - 59 -6.4常见故障排除 ........................................................................ - 61 -7技术支持............................................................................................. - 62 -7.1技术咨询 ................................................................................ - 62 -7.2操作指导 ................................................................................ - 62 -7.3软件下载 ................................................................................ - 62 -7.4售后服务 ................................................................................ - 63 -7.5配件采购 ................................................................................ - 63 -7.6联系方式 ................................................................................ - 64 -8附录 .................................................................................................... - 65 -附录1:P H缓冲溶液的P H值与温度关系对照表...................... - 65 -附录2:P H标准缓冲溶液的配制方法 ........................................ - 66 -附录3:电导率标准溶液.............................................................. - 67 -附录4:氟离子溶液配制方法...................................................... - 68 -附录5:串口打印机的选购.......................................................... - 69 -1仪器介绍1.1 简介DZB-712F型便携式多参数分析仪是全新开发的智能仪器,支持pH/pX、离子、电导、溶解氧、温度等相关参数的测量,可广泛应用于高校、环保、医药、食品、卫生、地质探矿、冶金、海洋探测等领域,进行酸雨检测、工业废水、地表水、饮用水、饮料、日化产品、纺织品等相关行业的测量工作。
实验室常用水质分析仪器

DR5000高精度实验室紫外分光光度计:∙触摸屏显示界面,用户操作更直观∙通用的样品托架用于5种比色瓶∙USB端口用于仪器的升级和与打印机等连接∙吸样模块和Pour-Thru单元,用于大体积的分析和痕量分析∙完整的旋转模块用于7个1-cm的矩形样品瓶∙自动方法识别,节省用户操作时间并减少误差产生的可能性(仅适用于TNTplus预装管试剂,如COD)∙5秒内10次测量吸光率并取其平均值,减少测量误差,确保测量高精度。
技术指标∙波长范围:190-1100nm∙波长精度:±1nm∙波长分辨率:0.1nm∙波长校正:自动∙波长选择:人工或自动依据分析方法选择∙扫描速度:1nm步进时每分钟可实现全波扫描∙带宽:2nm∙光度范围:± 3.0A∙精度:0.0 -0.5A时为5mA,0.5 -2.0A时为1%∙线性:2A时小于0.5%,>2A时小于或等于1%∙操作界面语言:中文、英语、日语、俄语、法语、德语、西班牙语、韩语等∙操作温度:10 - 40℃∙接口:USB1.1∙尺寸:450×200×500nm(宽、高、深)∙重量:15.5kg订购指南DR5000-02 DR/5000型紫外可见光分光光度计,1个多功能单比色池适配器,2个1英寸玻璃比色池,2个1厘米石英比色池,仪器操作手册,电源及电源线,分析操作手册(光盘),用户手册等DR2700 型可见分光光度计DR2700 型便携式分光光度计,是哈希公司最新推出的分光光度计产品。
它迎合了客户对分析仪器在价格和性能上的双重需求,在DR2800 的设计基础上开发而成,既可用于实验室分析,又可用于生产现场和野外水质测试。
DR2700外形小巧轻便,易于携带。
内置的130多条标准曲线可以满足用户对多种分析参数的测试要求,同时保证测试结果的准确性和可信度。
中文菜单的触摸屏式用户界面,便于用户操作仪器。
该仪器广泛应用于工业、市政、环保、教育等领域的水质监测。
工艺因子对于MFC中能量分配的协同效应分析

工艺因子对于MFC中能量分配的协同效应分析程本爱;贾辉;杨光;刘文斌;张宏伟;王捷【摘要】微生物燃料电池(MFC)以产电和代谢的方式利用系统能量实现有机物降解.针对运行过程中能量的不同分配需求,以pH、有机负荷、溶解氧、电导率和外电阻为工艺因子,采用正交实验方法优选最佳工艺条件,从而实现MFC能量流调控的目的.研究表明:在实验工况下,最高产电能量转化效率和生物代谢能量利用效率分别为8.74%和66.03%,负荷和外电阻对产电能量转化效率有显著影响,负荷和pH 对能量利用效率有显著影响,系统能量主要以生物代谢方式被利用.由此可见,在同等负荷条件下,若将MFC作为电转化单元时应主要控制其外电阻,若需提高MFC的有机物降解能力时pH则是首要控制因素.【期刊名称】《化工学报》【年(卷),期】2018(069)005【总页数】8页(P2242-2249)【关键词】微生物燃料电池;有机化合物;过程控制;降解;能量分配;工艺因子【作者】程本爱;贾辉;杨光;刘文斌;张宏伟;王捷【作者单位】天津工业大学分离膜与膜过程省部共建国家重点实验室,天津300387;天津工业大学环境与化学工程学院,天津300387;天津工业大学分离膜与膜过程省部共建国家重点实验室,天津300387;天津工业大学环境与化学工程学院,天津300387;天津大学环境科学与工程学院,天津300072;天津工业大学分离膜与膜过程省部共建国家重点实验室,天津300387;天津工业大学环境与化学工程学院,天津300387;天津工业大学分离膜与膜过程省部共建国家重点实验室,天津300387;天津工业大学环境与化学工程学院,天津300387;天津大学环境科学与工程学院,天津300072;天津工业大学分离膜与膜过程省部共建国家重点实验室,天津300387;天津工业大学环境与化学工程学院,天津300387【正文语种】中文【中图分类】X703.1引言微生物燃料电池(microbial fuel cell,MFC)是一种利用微生物降解有机物并将有机质转变为电能的生物电化学系统[1-3]。
多参数分析测定仪

多参数分析测定仪多参数分析测定仪是一种用于测定多种物质参数的分析仪器。
它可以同时测定多个参数,如温度、压力、流量、pH值、电导率、溶解氧和浑浊度等,可以广泛应用于医疗、环境监测、水处理、制药和食品加工等领域。
原理多参数分析测定仪基于电化学、光学、物理和化学的原理。
它通过传感器将物质参数转换成电信号,然后通过处理器进行数据分析和处理,并将结果显示在屏幕上。
多参数分析测定仪的传感器种类繁多,包括热敏电阻、压力传感器、光电二极管、pH玻璃电极、电磁流量计、溶解氧电极和浑浊度传感器等。
这些传感器可以在一体化的仪器中进行组合,实现多参数测量。
特点多参数分析测定仪具有以下特点:1.高效性:多参数分析测定仪通过一次测量,可以测量多种不同的物质参数,大大提高了工作效率和生产率,节省了成本和时间。
2.灵敏度高:多参数分析测定仪采用先进的传感器技术,能够精确测量微小的变化,可以监测到细微的温度、压力、流量和化学变化。
3.可靠性强:多参数分析测定仪采用先进的电路和处理器技术,能够准确地进行测量和分析,数据可靠性高。
4.易于操作:多参数分析测定仪具有直观的用户界面和操作简便的功能,可以帮助用户轻松完成操作,并提供实时的数据结果。
5.多功能性:多参数分析测定仪可以应用于多个领域,如医疗,环境监测,水处理,制药和食品加工等领域,具有广泛应用和适用性。
应用多参数分析测定仪可以应用于多个领域,如:1.医疗领域:多参数分析测定仪可以用于医院的手术室、床边和ICU等部位,可以测量体温、心率、血氧、呼吸等生理参数,为医生和护士提供准确的患者监测数据。
2.环境监测:多参数分析测定仪可以用于对环境中水质、空气质量、土壤污染等参数进行监测,为环保部门提供准确的数据和监测报告。
3.水处理:多参数分析测定仪可以用于对污水、饮用水等水质参数进行测量和分析,为水处理厂提供准确、可靠的数据支持。
4.制药和食品加工:多参数分析测定仪可以用于制药和食品行业中,测量温度、pH值、电导率、溶解氧等参数,为企业提供精确、可靠的数据,并确保产品质量和安全性。
MBR系统好氧反硝化效果及好氧反硝化菌的鉴定

MBR系统好氧反硝化效果及好氧反硝化菌的鉴定李晓楼【摘要】采用间歇曝气法对MBR系统好氧反硝化菌进行了培养和富集,考察了系统的好氧反硝化效果及其影响因素,并对好氧反硝化菌进行了分离和鉴定.实验结果表明:在DO为2.0~3.0 mg/L、m(C)∶m(N)为8∶1的条件下,MBR系统好氧反硝化效果较好,COD、氨氮、TN的去除率分别达到90%,90%,62%左右;从系统活性污泥中得到11株好氧反硝化性能较好的好氧反硝化菌,它们属于变形菌门,分别属于不动杆菌属、丛毛单胞菌属、气单胞菌属、假单胞菌属和噬氢菌属.【期刊名称】《化工环保》【年(卷),期】2015(035)004【总页数】5页(P339-343)【关键词】生物脱氮;膜生物反应器;好氧反硝化菌;菌种鉴定【作者】李晓楼【作者单位】四川职业技术学院建筑与环境工程系,四川遂宁629000【正文语种】中文【中图分类】X703近年来,国家对水质标准和水处理要求的提高,对生物脱氮技术的发展提出了更高要求。
传统生物脱氮技术存在较多不足之处,如硝化菌群增殖速度慢、需进行污泥和硝化液的回流、系统抗冲击能力较弱以及脱氮酸碱度需调节等[1]。
研究发现,在好氧硝化池中常有超出微生物增殖所需的氮的去除,损失的总氮量高达30%[2]。
这种好氧过程中的脱氮现象是由好氧反硝化菌引起的。
与传统生物脱氮技术相比,好氧反硝化菌脱氮具有以下优点:1)使硝化/反硝化反应在同一个反应器中进行,可大幅减少占地面积和建设资金;2)可减少调节系统pH的化学药剂用量,降低成本;3)好氧反硝化菌在处理过程中更易控制[3]。
目前,在多种生物处理系统中都发现了好氧反硝化过程的存在,如好氧曝气池和SBR系统[4-5]。
由于生长条件和竞争等因素限制,好氧反硝化菌不易筛选和富集,而采用生物固定化技术和MBR能够有效地保留和富集好氧反硝化菌[6-7]。
通过对生物处理系统中好氧反硝化菌的分离筛选和鉴定,了解系统中好氧反硝化菌的生长条件,有利于调控生物处理系统,保证好氧反硝化过程的顺利进行[8-9]。
(完整版)HQ30d便携式多参数测定仪

HQ30d便携式多参数测定仪1 用途:HQ 30d便携式测定仪在与IntelliCAL 电极一起使用时,可以连接超纯电极、标准电极以及野外使用的坚固型电极,测定多种参数,例如pH 值、ORP、电导率、盐度、总溶解固体、溶解氧和钠离子等。
可用于市政污水、工业污水、饮用水、环境监测、教育、科研等领域的水质分析。
2 HQ系列数字化分析仪2.1 工作条件2.1.1电源要求:两种供电模式(1)AA 碱性电池或镍氢电池(4个)(2)外置的USB/DC 电源适配器:100–240 V, 50/60 Hz输入; 4.5~7.5 V (7 V A) 输出(外置电源及USB适配器需要选配)2.1.2 存储温度:–20 ~+60 °C2.1.3 操作温度:0 ~+60 °C操作湿度:90% (无冷凝)2.2技术性能指标2.2.1 语言:支持多国语言★2.2.2显示:可显示1个或2个电极的读数(1)pH电极:pH、mV、温度(2)电导率电极:电导率、盐度、总溶解固体、温度(3)溶解氧电极:溶解氧、压力、温度(4)LBOD电极:溶解氧、压力、温度(5)ORP氧化还原电位:mV、温度★2.2.3 数据内存:500 组数据★2.2.4 数据存储:校准数据都存贮在日志中。
在“按下即读”模式和间隔测量模式时可自动存储。
在“连续读数”模式时需手动存储。
★2.2.5 数据传输:通过USB转接下载至电脑或U盘,读数时同步传输2.2.6 温度自动修正/ 补偿2.2.7 锁定显示数据功能★2.2.8 自动识别校准标准:2.2.9 键盘:通过USB外接键盘★2.2.10防水性:测定仪外壳可在1 米深的水中浸泡30 分钟(IP67)2.2.11 尺寸:19.7×9.5厘米2.2.12 重量:330 g430 g (安装了四节AA 碱性电池)3 HQ系列IntelliCAL 电极技术性能指标3.1温度量程:-10.0~110.0℃分辨率:0.1℃准确度:±0.3℃3.2 pH电极量程:0~14(包括标准可填充式电极和可填充式超纯电极)2~14(标准凝胶电极)分辨率:0.1/0.01/0.001可选★精度:pH超纯电极0.01pH电极0.023.3 ORP/氧化还原电位量程:-1200~+1200 mV分辨率:0.1mV3.4 钠离子电极:量程:0.023mg/L(1×106M)~23,000mg/L(1M)Na+分辨率:2/3/4选大者3.5 电导率电极电导率:量程:0.01 μS/cm ~200.0 mS/cm分辨率:0.01 μS/cm(最大0.05μS/cm)电阻率:量程:2.5~49欧姆·厘米分辨率:0.1欧姆·厘米(最大0.05欧姆·厘米)盐度:量程:0~42g/kg或‰分辨率:0.01ppt总溶解性固体:量程:0.0~50.0g/L分辨率:0.1 mg/L3.6 溶解氧量程: 0.05–20.0 mg/L1–200% 饱和度分辨率:0.01 mg/L,CDC401电极新增自动盐度校准功能(仅适用于HQ40d)溶解氧的准确度:在0.1–8 mg/L时,为±0.1 mg/L大于8.0 mg/L时,为±0.2 mg/L★3.7 BOD5/CBOD(使用荧光法溶解氧的LBOD电极):量程: 0.05–20.0 mg/L分辨率:0.01 mg/L海拔限制:最大5000米★防水性:标准电极:IP68,3米深的水中,24小时内有防水效果(可填充液电极不浸没)坚固性电极:IP68,30米深的水中,24小时内有防水效果LBOD电极:IP65★电缆长度:标准型电极(LBOD除外):1米或3米坚固性电极:5、10、15、30米LBOD电极:1.8米尺寸:标准电极(LBOD除外):长度17.8厘米坚固性电极:长度21.6厘米LBOD电极:长×宽,19.1×4.1厘米重量:标准电极(1米电缆)pHC281 76g pHC101 76g pHC301 76gMTC101 76g MTC301 76g ISENa381 76gCDC401 104g LDO101 127g坚固性电极(5米电缆)P HC101 1182g MTC101 1182gCDC401 1210g LDO101 1232gLBOD 225g4 仪器配置(HQ30d控制器+电极)4.1HQ 系列IntelliCAL 电极4.1.1系列pH电极★(1)适用于超纯水分析的pH电极:pHC28101 1 米电缆;pHC28103 3米电缆(2)标准型凝胶pH电极:pHC10101 1米电缆;pHC10103 3米电缆(3)坚固型凝胶pH电极:pHC10105 5米电缆;pHC10110 10米电缆;pHC10115 15米电缆;pHC10130 30米电缆(4)标准型可填充电极:pHC30101 1米电缆;pHC30103 3米电缆4.1.2 ORP/氧化还原单位电极(1)标准型凝胶电极:MTC10101 1米电缆;MTC10103 3米电缆(2)坚固型凝胶电极:MTC10105 5米电缆;MTC10110 10米电缆;MTC10115 15米电缆;MTC10130 30米电缆(3)标准型可填充电极:MTC30101 1米电缆;MTC30103 3米电缆4.1.3 电导率电极(1)标准型:CDC40101 1米电缆;CDC40103 3米电缆(2)坚固型:CDC40105 5米电缆;CDC40110 10米电缆;CDC40115 15米电缆;CDC40130 30米电缆4.1.4 钠离子电极(1)标准型可填充电极:ISENa38101 1米电缆;ISENa38103 3米电缆;★4.2.5 LDO(荧光法溶解氧)电极(1)标准型:LDO10101 1米电缆;LDO10103 3米电缆(2)坚固型电极:LDO10105 5米电缆;LDO10110 10米电缆;LDO10115 15米电缆;LDO10130 30米电缆(3)BOD 电极:★LBOD10101 LDO 电极带搅拌和1.8米电缆4.2 其他配件:(1)系列pH电极校准标准液、电导率电极校准标准液、溶解氧荧光帽等(2)USB适配器及电源修订日期2010-1。
反渗透海水淡化预处理工艺

CHEMICAL INDUSTRY AND ENGINEERING PROGRESS 2016年第35卷第11期·3658·化 工 进 展反渗透海水淡化预处理工艺孙永超,解利昕,高婷婷,周晓凯(天津大学化工学院,天津市膜科学与海水淡化技术重点实验室,天津300072)摘要:对不同海水预处理工艺进行了研究,对比分析了不同工艺产水浊度、化学需氧量(COD Mn )、污染密度指数(SDI 15)等参数及不同预处理工艺对超滤膜膜比通量的影响。
混凝-沉淀或气浮处理能够有效降低海水浊度,配合砂滤或纤维过滤,浊度可以降低到0.3NTU 左右。
当超滤处理海水时,无论采用何种预处理方法,其产水浊度和SDI 15都可以满足反渗透进水要求。
直接超滤时,COD Mn 去除效果较差,超滤结合混凝-沉淀或气浮处理时,COD Mn 去除率有了较大的提高。
预处理方法对超滤膜膜比通量影响较大,直接采用超滤进行处理时,超滤膜膜比通量衰减较快,经混凝-沉淀或气浮处理后,膜比通量衰减有所减缓,进一步经砂滤或纤维过滤后,膜比通量的衰减得到了较好的控制。
采用混凝-沉淀/纤维过滤预处理工艺时超滤膜膜比通量衰减最低。
关键词:反渗透预处理;混凝-沉淀;气浮;砂滤;纤维过滤;超滤中图分类号:P747+.5 文献标志码:A 文章编号:1000–6613(2016)11–3658–05 DOI :10.16085/j.issn.1000-6613.2016.11.041A study on different pretreatments process in sea water reverse osmosis(SWRO ) desalinationSUN Yongchao ,XIE Lixin ,GAO Tingting ,ZHOU Xiaokai(Tianjin Key Laboratory of Membrane Science and Desalination Technology ,School of Chemical Engineering andTechnology ,Tianjin University ,Tianjin 300072,China )Abstract :Different seawater pretreatment processes were studied in terms of comparative analysis ofturbidity ,chemical oxygen demand (COD Mn ),pollution density index (SDI 15),etc and the effects on ultrafiltration membrane flux of different pretreatment processes. Coagulation-sedimentation or air flotation process can reduce seawater turbidity effectively. With sand filtration or fibre filtration ,turbidity can be reduced to around 0.3NTU. When seawater was treated by the ultrafiltration ,regardless of the method ,the turbidity of the water and SDI 15 can meet the requirement of reverse osmosis. When ultrafiltration is adopted directly ,the removal effect of COD Mn was very bad. When ultrafiltration combines with coagulation-sedimentation or air flotation ,the removal rate of COD Mn was enhanced. Pretreament methods have a great influence on ultrafiltration membrane flux. Ultrafiltration membrane flux declined rapidly by ultrafiltration directly. Membrane flux attenuation slows by coagulation-sedimentation or air flotation. Membrane flux attenuation was well controlled after sand filtration or fibre filtration. Membrane flux attenuation is lowest by using coagulation-sedimentation/ fibre filtration.Key words :reverse osmosis pretreatment ;coagulation-sedimentation ;air flotation ;sand filtration ;fibre filtration ;ultrafiltration联系人:解利昕,研究员,主要从事化学工程及海水淡化相关领域研究。
基于孔结构调控强化BEAC工艺生物降解效能

基于孔结构调控强化BEAC工艺生物降解效能公绪金;董玉奇;李伟光【摘要】为进一步提升生物增强活性炭工艺(BEAC)中炭表面的功能菌载持量及生物降解活性,通过CO2接触氧化与深度活化相结合的压块炭制备改进工艺对煤质净水炭的孔结构进行调控.结果表明:基于改进工艺制备的XHIT型炭的中孔容积(0.7041cm3/g)及中孔容积率(63.95%)显著提高,其表面复合功能菌初始固定化生物量达到9.13mmol/g(以P计),增殖速率为2.123mmol/(g·d)(以P计).深度活化产生的高含氧量(9.96%)显著降低了XHIT型炭表面吸附作用对水中溶解氧亲和度((0.42±0.07)m g DO/L),功能菌生物降解对水中溶解氧的利用效率达到91.17%.基于XHIT型炭构建的BEAC工艺(通水倍数为39.50m3/kg)对松花江水源水中的微量有机污染物(CODMn)的平均去除率达到(70.65±15.22)%,有机污染物累积去除量达到94655.50mg CODMn/kg炭.【期刊名称】《中国环境科学》【年(卷),期】2019(039)005【总页数】8页(P1920-1927)【关键词】生物增强活性炭;生物降解;吸附;孔结构分布;生物活性【作者】公绪金;董玉奇;李伟光【作者单位】哈尔滨商业大学能源与建筑工程学院,黑龙江哈尔滨 150028;哈尔滨商业大学能源与建筑工程学院,黑龙江哈尔滨 150028;哈尔滨工业大学水资源与水环境国家重点实验室,黑龙江哈尔滨 150090【正文语种】中文【中图分类】X703;TU992.1以活性炭和高效功能菌群为核心的生物增强活性炭工艺(BEAC)已成为饮用水深度处理的关键技术之一[1-2].基础研究及工程应用均证实,兼顾吸附及功能菌载体的活性炭材料的孔结构分布特性对水中微量有机污染物的吸附及生物降解效能有重要的影响[3-5].研究表明,具有粗糙表面及中、微孔结构同步发育良好的中孔型炭,对功能菌的载持能力及生物降解效能的促进效果更佳[6-7].长期生产实践亦证实,广泛应用于我国城镇净水厂的微孔型炭材料对功能菌的生物量及生物降解活性的载持能力不足[8-9].尽管针对微孔型炭材料的表面改性可进一步提升有机污染物的吸附容量,但对于功能菌载持能力及生物降解效能的提升幅度有限,仍难以有效强化BEAC工艺效能及活性炭寿命[10-12].基于此,本课题组在前期研究成果的基础上,将CO2接触氧化和深度活化阶段引入到常规压块活性炭制备工艺中,实现了对净水用煤质活性炭中、微孔结构及表面物化特性的同步调控,获得了总孔容积及中孔率均较高的XHIT型炭.前期研究表明,XHIT型炭对水中天然有机污染物(NOM)及微量污染物的吸附效能显著提升[9],这将为进一步强化BEAC工艺效能,降低制水成本和保障城镇供水安全提供新的高效净水炭材料 [13-14].基于此,本文研究了XHIT型炭孔结构分布及表面物化特性对功能菌载持能力和生物降解活性的影响,基于中试试验研究,对比分析了XHIT型炭构建的BEAC工艺效能及炭表面功能菌生物膜特性.1.1.1 改进型净水用煤质活性炭制备在煤种复配的基础上,将CO2接触氧化和深度活化过程融合到压块炭制备中,提出了孔结构原位同步调控技术路线,研制了中、微孔结构同步发达的改进型净水煤质活性炭(XHIT型炭).XHIT型炭的主要制备过程包括[9]:(1)前体物复配成型(神府煤:大同煤:焦油=70%:25%:5%);(2)优化炭化:以6℃/min的升温速率提升炉温至(600±20)℃,在此温度下持续炭化30min.(3)CO2接触氧化:调整炉温到450℃,CO2环境中继续反应20min.(4)活化:在活化炉内以15℃/min的速率升温至(900±20)℃,维持180min,以自来水蒸气为活化剂(0.8mL/(h·g)).(5)深度活化:在(950±20)℃下,改用流量为0.6mL/(h·g)的纯净水蒸气继续活化30min后得到XHIT型净水炭.1.1.2 净水用煤质活性炭样本选取净水常用微孔型原煤破碎炭PS、柱状颗粒炭ZJ15和F400以及前期经过孔结构预调控的压块破碎炭(C-GY-1、C-GY-2、C-GY-3)等煤质炭作为参比样本,性能指标参数如表1所示.1.1.3 优势功能菌群以分离自北方以松花江为水源的某净水厂活性炭滤池内的哈尔滨不动细菌(Acinetobacter Harbinensis sp.)[15]、3株假单胞菌(Pseudomonas sp.)和1株枯草芽孢杆菌(Bacillus subtilis)构建优势功能菌群;经低温发酵罐扩培后(l09CFU/L数量级),通过循环负载固定于活性炭上,构建BEAC工艺体系.1.2.1 炭表面功能菌载持能力评价装置如图1所示,采用500mL有机玻璃锥形瓶构建炭表面功能菌载持能力评价装置,设置有曝气及功能菌液循环负载管路系统,空床接触时间为(20±2)min.进水以自来水配水(CODMn=3.0~5.0mg/L).试验过程包括:(a)优势功能菌群循环负载:共4个周期,每个周期由循环4h和静置2h构成;通入配制水样进行24h的连续流培养后取炭样测定冲洗前后炭表面生物量.(b)连续培养阶段:连续通水培养14d后,测定炭样表面的生物量和生物活性.其中,炭样表面的生物量以磷脂含量表征[2].1.2.2 生物降解溶解氧利用率分析装置图2(a)所示为生物降解过程中溶解氧利用率分析试验装置,其目的在于研究炭表面物化特性差异产生的溶解氧亲和程度对功能菌生物降解活性的影响.试验装置由吸附体系(A柱)及生物增强体系(B柱)组成. A柱和B柱的内径均为50mm,填充炭层高度为1000mm,下向流流速为1.6m/h,空床接触时间为37.5min. A和B柱内活性炭均预先经过充分清洗及高压灭菌,其区别在于B柱进行了优势功能菌群的循环负载.试验过程中,原水经紫外灭菌及充分曝气提高溶解氧(DO)后通入试验装置.原水采用自来水配水,利用乙酸钠调节水中溶解性有机碳(DOC)至(4.0±0.25)mg/L,NH4+-N调节至(0.50±0.16)mg/L.稳定运行一周后,改用去离子水配水,并考察了后续5d内的DOC、DO和NH4+-N变化情况.其中,DO采用哈希HQ30D便携式溶解氧分析仪测定.研究中以炭表面生物降解过程对水中DO的有效利用效率为评价指标,具体量化过程以A柱为参比.由于A柱运行时间较短,可以忽略炭表面的生物降解作用.因此,可以假定A柱进出水DOC变化均由吸附作用导致,并将A柱进出水DO消耗量作为吸附作用所消耗的DO量(DDOCS = DOA1-DOA2),即炭表面对水中DO的亲和度.基于上述假设,B柱内生物降解作用引起的DO消耗可表述为:式中: DDOCBio为DOC去除量,mg/L; DNBio为NH4+-N去除量,mg/L; DDOC 和DDON分别为降解DOC和NH4+-N所需DO理论量,mg/L; DDOTH和DDOR分别为B柱DO理论消耗量与实际消耗量,mg/L;PADO为生物降解过程对于水中DO的实际有效利用率,%.1.2.3 生物增强活性炭试验装置 BEAC工艺中试试验装置由3个滤柱组成(图2(b)),分别填装中孔型XHIT型炭、微孔型炭PS和ZJ15,分别记为B-XHIT、B-PS 和B-ZJ15.各炭床均以1.1.3所构建的优势功能菌群进行循环负载固定化.各滤柱规格为φ100mm×2000mm,炭床填充高度1500mm,石英砂级配承托层100mm,端部法兰密封.下降流空床接触(EBCT)18min,水洗反冲(6L/(m2·s))周期为10~15d. 中试试验用水取自松花江某取水厂,经预处理后作为中试试验装置进水,主要水质指标为:水温均值(15.4±8)℃(变化范围1.0~25.8℃),浊度均值(0.36±0.47)NTU(0.14~0.86NTU),CODMn均值为(3.28±0.47)mg/L(2.14~4.16mg/L),UV254均值(0.078±0.015)cm-1 (0.039~0.139cm-1),NH4+-N均值(0.58±0.51)mg/L (0.02~1.81mg/L).中试工艺对有机污染物的去除效能以高锰酸盐指数(CODMn)变化特性进行表征,炭表面生物膜通过电子扫描电镜(FlexSEM1000)观测.基于CODMn变化特性曲线定义了表征BEAC工艺对微量有机污染物的总量控制效能: CODMn累积去除量(QC,mg CODMn/(kg炭)). QC体现了BEAC工艺中吸附与生物降解协同效能对污染物的总量控制能力,计算公式为:式中:Qin为通水量,L/d;MAC为炭量,kg; Dti为时间间隔,d;i为运行天数,d;CODMnin,i-1和CODMnin,i为第i-1d和第id的日平均进水浓度,mg/L;CODMnout,i-1和CODMnout,i为第i-1d和第id的日平均出水浓度,mg/L.滤柱B-XHIT、B-PS和B-ZJ15对应得累积去除量分别标记为QCB-XHIT、QCB-PS和QCB-ZJ15.2.1.1 炭表面固定化功能菌生物量载持能力优势功能菌固定化可显著缩短BEAC工艺生物降解过程形成时间,提高对水中及炭表面微量有机污染物的生物降解效能.研究表明,初始固定化生物量及生物降解活性是影响BEAC工艺效能的关键因素[15-16].基于此,对比分析了不同类型活性炭的功能菌群固定化生物量及生物降解活性的变化情况.图3(a)表明,固定化时间在6~24h范围内,各炭样表面功能菌生物量(磷脂含量)总体呈上升趋势.其中,XHIT型炭表面的磷脂含量在各时间点均明显多于其他炭样.完成4个周期循环后,中孔型改进炭XHIT表面的磷脂含量达到9.13mmol/g(以P计),较微孔型炭ZJ15、PS和F400分别提高了2.87,1.61,1.51mmol/g (以P计);较前期孔结构预调炭C-GY-3、C-GY-2和C-GY-1亦存在不同程度的提升.图3(a)同时表明,5min表面冲刷过程对炭表面生物量有着重要的影响,XHIT型炭的磷脂含量降低至8.06mmol/g(以P计),损失率为11.72 %,但其剩余磷脂含量仍高于其他炭样.这表明,本文基于CO2接触氧化和深度活化制备的XHIT型炭的功能菌表面固定化生物量及稳定性均显著优于微孔型活性炭.2.1.2 负载生物量与活性炭性能参数相关性以表1所示的7种活性炭组成样本空间,并以其在24h时的循环负载生物量(BI)为基础,对比分析了各性能参数与BI的线性相关系数R2.线性拟合结果表明,相关系数(R2>0.800)顺序为:中孔容积Vmes (0.9827)>腐殖酸吸附值VHA(0.9692)>平均孔径D(0.948)>总孔容积VT(0.9323)>亚甲蓝吸附值VMB(0.8896)>表面含氧量(0.8221)>>微孔容积Vmicro (0.0011).上述拟合结果表明:炭材料的中孔结构及总孔容积的发育程度(Vmes、D、VT)(R2>0.93),中大分子吸附能力(VHA、VMB)(R2>0.88)及表面含氧量是影响功能菌固定化效果的关键因素.微孔容积Vmicro的发育程度对固定化效果的相关性较小,这合理的解释了微孔型炭在功能菌载持能力方面的不足.2.1.3 XHIT型炭表面功能菌增殖效能表面固定化是构建BEAC工艺生物降解效能的第一步,后续功能菌增殖情况对生物降解过程的影响更为突出.基于此,分析了连续流培养阶段,固定化功能菌在XHIT表面的增殖情况.此阶段试验中以固定化初始菌量较高的C-GY-3型炭为参比.如图3(b)所示,经过240h的培养,XHIT型炭表面的磷脂含量达到30.36mmol/g(以P计),增殖速率(2.123mmol/(g·d)(以P计))优于C-GY-3.结合之前对XHIT型炭的表面特性分析可知,经过孔结构调控的XHIT型炭为功能菌固定化及增值过程提供了更加适宜的孔结构及表面物化特性.综合上述分析可知,本文基于CO2接触氧化和深度活化相结合的改进工艺,在实现对XHIT型炭的孔结构调控(中孔容积率63.95%)的同时,同步促进了XHIT型炭对中大分子量有机物吸附效能和功能菌的表面固定化/增殖效能,这为后续开展BEAC 工艺效能优化研究提供了新材料.炭表面功能菌群摄取水中DO效率与生物降解效能的关系密切.相关研究表明,炭表面氧化程度影响了吸附作用对水中DO的亲和度;亲和度增大,则生物降解过程可供利用的DO量受到限制[5].炭表面含氧量亦是影响功能菌固定化效果的重要因素,本文制备的XHIT型炭的含氧量达到9.96%.基于此,为明确CO2接触氧化和深度活化过程所导致的炭表面高含氧量对于生物降解活性的影响,开展了XHIT型炭表面功能菌生物降解过程DO利用特性分析.由表2可知,A柱所构建的体系在忽略生物降解作用的前提下,各滤柱内炭表面对水中DO的亲和程度(DDOCS)存在显著差别. DDOCS与烧蚀率基本呈负相关趋势,表面烧蚀氧化程度越高, DDOCS的值越低.线性拟合结果表明, DDOCS与炭表面氧含量的线性相关度达到0.9725,亦证实了这一现象.表2表明, DDOCS越低,生物降解DOC和NH4+-N的效能便越高.其中,XHIT型炭对应的DDOCS均值仅为(0.42±0.07)mg DO/L,其对应的B柱内(BEAC体系)因炭表面功能菌降解DOC及NH4+-N所需的DO理论量DDOC和DDON分别为(4.62±0.12),(0.64±0.15)mg DO/L;两者总和占实际进出水DO变化值((5.77±0.17)mg DO/L)的91.17% (PADO).综合上述两个方面的分析可知,XHIT型炭较其他几种活性炭具有更高的生物降解活性的原因可归结为:(1)XHIT型炭经过孔结构及表面物化特性调控后,初始功能菌固定化水平及稳定性的提高,促进了后续炭表功能菌增殖及活性的发挥[17];(2) XHIT 型炭在孔结构调控过程中所形成的高烧蚀率及含氧基团含量,有效降低了DDOCS,从而提高了生物降解过程中DO的利用效率.2.3.1 有机污染物总量控制效能研究已明确XHIT型炭在NOM吸附性能及炭表面的功能菌生物降解活性等方面具有的优势.为进一步明确XHIT型炭在净化水源水过程中的表面生物增强特性,以松花江水源水为代表,考察了以XHIT为滤料的BEAC工艺效能及炭表面功能菌特性.对BEAC中试工艺体系进出水CODMn的长期追踪(245d)结果表明:通水倍数KBV小于5.00m3/kg时,B-XHIT体系内新鲜的XHIT型炭的高效吸附作用是实现有机物去除的主导机理;该阶段CODMn平均去除率高达(92.45±5.40)%.随着体系运行时间的延长,KBV介于23.30~33m3/kg区间内时,B-XHIT的工艺效能趋于稳定,CODMn出水均值稳定在(1.65±0.10)mg/L;该阶段炭表面的生物降解作用逐渐占据优势地位[18]. 245d (KBV =39.50m3/kg)的总体运行效果表明:B- XHIT对水中CODMn的去除率均值为(70.65± 15.22)%,较微孔型净水炭所构建的B-PS和B-ZJ15体系分别提高了17.78 %和41.27 %. 图4(a)表明,KBV为39.50m3/kg时,XHIT型炭对以CODMn表征的有机污染物的总量控制效能QCB-XHIT提升至94655.50mg CODMn/(kg炭),是微孔型净水炭PS和ZJ15的1.405,2.634倍.这表明,CO2接触氧化和深度活化的联合应用在实现XHIT型炭孔结构调控的同时,亦显著提升了其在BEAC工艺中的净水效能.此外,非线性拟合结果证实QCB-XHIT、QCB-PS和QCB-ZJ15与KBV均存在着良好的非线性相关性(R2>0.999),这为开展适宜于松花江水源水质特性的活性炭筛选提供了新的计算方法.2.3.2 XHIT型炭表面功能菌特性分析功能菌载持量及生物降解活性的提升是调控XHIT型炭孔结构的核心目的所在,基于此,继续考察了运行245d后(KBV=39.50m3/kg),XHIT型炭表面的磷脂含量变化特性及表面菌群形态.图4(b)表明,随着KBV的增加,各炭柱的生物量均呈持续上升的趋势,其中,B-XHIT 内炭表面的生物量达到45.6mmol/g炭(以P计),较B-PS和B-ZJ15体系分别增加了32.17%和59.44%.从磷脂含量变化角度可证实,XHIT型对功能菌的载持量更佳,这与B- XHIT发挥更高效的生物降解效能的结论相一致.采用扫描电镜继续对比分析了KBV达到39.50m3/kg时,B-XHIT,B-PS和B-ZJ15体系内炭表面的菌群形态. 由图5可知,XHIT型炭表面的生物膜完整,完全覆盖了炭表面,且功能菌群形成的菌团絮体的密度较大.PS和ZJ15型炭表面功能菌覆盖率低于XHIT型炭.此外,SEM分析中发现有少量藻类出现在XHIT型炭的内部孔道内,这也证实了XHIT型炭的内部孔道的生物增强过程[19-21],这在之前的研究中鲜有报道.而PS和ZJ15的内部孔道则未发现显著的功能菌及藻类增殖.综合以上分析可知,本文通过改进工艺制备的XHIT型炭的表面及其孔结构特性更加利于自然菌群及复合功能菌的生长及增殖.3.1 CO2接触氧化与深度活化的联用促进了XHIT型的中、微孔结构的同步发育,中孔率达到63.95%,并保持了较高的微孔容积(0.2616cm3/g).3.2 经过24h循环负载,XHIT型炭表面的磷脂含量为9.13mmol/g(以P计).连续培养240h后的磷脂含量达到30.36mmol/g(以P计).3.3 7种类型活性炭性能参数与固定化生物量之间的线性拟合表明,表征中孔及总孔结构发育程度的性能参数(Vmes、VHA、D、VT)与功能菌固定化效果有着显著的相关性(R2>0.93).3.4 XHIT型炭表面含氧量(9.96%)的增加有效降低了表面吸附的DO的亲和度(DDOCS = (0.42± 0.07)mg DO/L),生物降解过程对DO的利用率显著提升.3.5 KBV达到39.50m3/kg时,基于XHIT型炭的BEAC工艺对水中的微量有机污染物累计去除量达到94655.50mg CODMn/(kg炭),显著优于微孔型炭PS和ZJ15.生物量达到45.6mmol/g(以P计).[1] Yu F, Wu Y, Ma J. Influence of the pore structure and surface chemistry on adsorption of ethylbenzene and xylene isomers by KOH-activated multi-walled carbon nanotubes [J]. Journal of Hazardous Materials, 2012,237-238(6):102-109.[2] Wang K L, Huang B C, Liu D M, et al. Ordered mesoporous carbons with various pore sizes: Preparation and naphthalene adsorption performance [J]. Journal of Applied Polymer Science, 2012,125(5):3368-3375.[3] Redding A M, Cannon F S. The role of mesopores in MTBE removal with granular activated carbon [J]. Water Research, 2014,56:214-224. [4] Islam M S, Zhang Y, Mcphedran K N, et al. Granular activated carbonfor simultaneous adsorption and biodegradation of toxic oil sands process-affected water organic compounds [J]. Journal of Environmental Management, 2015,152:49-57.[5] Yapsakli K, Cecen F. Effect of type of granular activated carbon on DOC biodegradation in biological activated carbon filters [J]. Process Biochemistry, 2010,45(3):355-362.[6] Sakuma M, Matsushita T, Matsui Y, et al. Mechanisms of trichloramine removal with activated carbon: Stoichiometric analysis with isotopically labeled trichloramine and theoretical analysis with a diffusion-reaction model [J]. Water Research, 2014,68C:839-848.[7] Qin C, Chen Y, Gao J. Manufacture and characterization of activated carbon from marigold straw (Tagetes erecta L) by H3PO4 chemical activation [J]. Materials Letters, 2014, 135:123-126.[8] 公绪金.中孔型活性炭制备及对As(Ⅲ)/As(Ⅴ)吸附特性研究 [J]. 哈尔滨商业大学学报(自然科学版), 2018,34(3):300-306+314. Gong X J. Removal of arsenic from water by innovative coal-based mesoporous activated carbon [J]. Journal of Harbin University of Commerce (Natural Sciences Edition),2018,34(3):300- 306+314.[9] Gong X J, Li W G, Wang G Z, et al. Characterization and performance evaluation of an innovative mesoporous activated carbon used for drinking water purification in comparison with commercial carbons [J]. Environmental Science and Pollution Research, 2015,22(17):13291- 304. [10] Mercier A, Joulian C, Michel C, et al. Evaluation of three activated carbons for combined adsorption and biodegradation of PCBs in aquaticsediment [J]. Water Research, 2014,59:304-15.[11] Treguer R, Tatin R, Couvert A, et al. Ozonation effect on natural organic matter adsorption and biodegradation--application to a membrane bioreactor containing activated carbon for drinking water production [J]. Water Research, 2010,44(3):781-8.[12] Gong X, Li W, Wang K, et al. Study of the adsorption of Cr(VI) by tannic acid immobilised powdered activated carbon from micro- polluted water in the presence of dissolved humic acid [J]. Bioresource Technology, 2013,141:145-51.[13] Beatriz Acevedo, Carmen Barriocanal, Iwona Lupul, et al. Properties and performance of mesoporous activated carbons from scrap tyres, bituminous wastes and coal [J]. Fuel, 2015,151:83-90.[14] Xiao X M, Liu D D, Yan Y J, et al. Preparation of activated carbon from Xinjiang region coal by microwave activation and its application in naphthalene, phenanthrene, and pyrene adsorption [J]. Journal of the Taiwan Institute of Chemical Engineers, 2015,53:160-167.[15] 张多英,李伟光,公绪金,等.O3-BEAC-UV/Cl工艺去除低温水中氨氮的研究 [J]. 中国给水排水, 2017,33(1):1-6. Zhang D Y, Li W G, Gong X J, et al. O3-BEAC- UV/Cl Process for Removing Ammonia Nitrogen from Low Temperature Source Water [J].China Water & Wastewater, 2017,33(1): 1-6.[16] Gao Y N, Li W G, Zhang D Y, et al. Bio-enhanced activated carbon filter with immobilized microorganisms for removing organic pollutants in the Songhua River [J]. Water Science & Technology, 2010,62(12):2819-28.[17] 公绪金.适宜松花江源水特性及生物增强的活性炭优选 [J]. 水处理技术,2018,44(6):120-125. Gong X J. Optimization of Bio-enhanced Activated Carbon for Songhua River Treatment [J]. Technology of Water Treatment,2018, 44(6):120-125.[18] 秦雯,李伟光,张多英,等.异养硝化菌生物增强活性炭处理低温水的效能 [J]. 中国给水排水, 2013,29(15):34-38. Qin W, Li W G, Zhang D Y, et al. Efficiency of Heterotrophic Nitrification Bacteria in Biologically Enhanced Activated Carbon Process for Treatment of Low Temperature Water [J].China Water & Wastewater, 2013,29(15):34-38.[19] Velten S, Hammes F, Boller M, et al. Rapid and direct estimation of active biomass on granular activated carbon through adenosine tri-phosphate (ATP) determination [J]. Water Research, 2007,41(9): 1973-83.[20] 公绪金.双级生物增强活性炭工艺对低温微污染原水中氨氮的净化效能 [J]. 净水技术, 2018,37(4):71-76. Gong X J. Purification efficiency of two-stage biological enhanced activated carbon process for micro-polluted raw water treatment under low temperature [J]. Water PurificationTechnology,2018,37(4):71-76.[21] 刘璟言,卢小燕,尤作亮,等.生物活性炭老化对滤池过滤阻力和处理效果的影响[J]. 中国环境科学, 2016,36(6):1752-1756. Liu J Y, Lu X Y, You Z L, et al. Effect of aged biological activated carbon on the filtration resistance and performance of biological activated carbon filter [J]. China Environmental Science, 2016, 36(6):1752-1756.【相关文献】[1] Yu F, Wu Y, Ma J. Influence of the pore structure and surface chemistry on adsorption of ethylbenzene and xylene isomers by KOH-activated multi-walled carbonnanotubes [J]. Journal of Hazardous Materials, 2012,237-238(6):102-109.[2] Wang K L, Huang B C, Liu D M, et al. Ordered mesoporous carbons with various pore sizes: Preparation and naphthalene adsorption performance [J]. Journal of Applied Polymer Science, 2012,125(5):3368-3375.[3] Redding A M, Cannon F S. The role of mesopores in MTBE removal with granular activated carbon [J]. Water Research, 2014,56:214-224.[4] Islam M S, Zhang Y, Mcphedran K N, et al. Granular activated carbon for simultaneous adsorption and biodegradation of toxic oil sands process-affected water organic compounds [J]. Journal of Environmental Management, 2015,152:49-57.[5] Yapsakli K, Cecen F. Effect of type of granular activated carbon on DOC biodegradation in biological activated carbon filters [J]. Process Biochemistry,2010,45(3):355-362.[6] Sakuma M, Matsushita T, Matsui Y, et al. Mechanisms of trichloramine removal with activated carbon: Stoichiometric analysis with isotopically labeled trichloramine and theoretical analysis with a diffusion-reaction model [J]. Water Research, 2014,68C:839-848.[7] Qin C, Chen Y, Gao J. Manufacture and characterization of activated carbon from marigold straw (Tagetes erecta L) by H3PO4 chemical activation [J]. Materials Letters, 2014, 135:123-126.[8] 公绪金.中孔型活性炭制备及对As(Ⅲ)/As(Ⅴ)吸附特性研究 [J]. 哈尔滨商业大学学报(自然科学版), 2018,34(3):300-306+314. Gong X J. Removal of arsenic from water by innovative coal-based mesoporous activated carbon [J]. Journal of Harbin University of Commerce (Natural Sciences Edition),2018,34(3):300- 306+314.[9] Gong X J, Li W G, Wang G Z, et al. Characterization and performance evaluation of an innovative mesoporous activated carbon used for drinking water purification in comparison with commercial carbons [J]. Environmental Science and Pollution Research, 2015,22(17):13291- 304.[10] Mercier A, Joulian C, Michel C, et al. Evaluation of three activated carbons for combined adsorption and biodegradation of PCBs in aquatic sediment [J]. Water Research, 2014,59:304-15.[11] Treguer R, Tatin R, Couvert A, et al. Ozonation effect on natural organic matter adsorption and biodegradation--application to a membrane bioreactor containing activated carbon for drinking water production [J]. Water Research, 2010,44(3):781-8. [12] Gong X, Li W, Wang K, et al. Study of the adsorption of Cr(VI) by tannic acid immobilised powdered activated carbon from micro- polluted water in the presence of dissolved humic acid [J]. Bioresource Technology, 2013,141:145-51.[13] Beatriz Acevedo, Carmen Barriocanal, Iwona Lupul, et al. Properties and performance of mesoporous activated carbons from scrap tyres, bituminous wastes andcoal [J]. Fuel, 2015,151:83-90.[14] Xiao X M, Liu D D, Yan Y J, et al. Preparation of activated carbon from Xinjiang region coal by microwave activation and its application in naphthalene, phenanthrene, and pyrene adsorption [J]. Journal of the Taiwan Institute of Chemical Engineers,2015,53:160-167.[15] 张多英,李伟光,公绪金,等.O3-BEAC-UV/Cl工艺去除低温水中氨氮的研究 [J]. 中国给水排水, 2017,33(1):1-6. Zhang D Y, Li W G, Gong X J, et al. O3-BEAC- UV/Cl Process for Removing Ammonia Nitrogen from Low Temperature Source Water [J].China Water & Wastewater, 2017,33(1): 1-6.[16] Gao Y N, Li W G, Zhang D Y, et al. Bio-enhanced activated carbon filter with immobilized microorganisms for removing organic pollutants in the Songhua River [J]. Water Science & Technology, 2010,62(12):2819-28.[17] 公绪金.适宜松花江源水特性及生物增强的活性炭优选 [J]. 水处理技术, 2018,44(6):120-125. Gong X J. Optimization of Bio-enhanced Activated Carbon for Songhua River Treatment [J]. Technology of Water Treatment,2018, 44(6):120-125.[18] 秦雯,李伟光,张多英,等.异养硝化菌生物增强活性炭处理低温水的效能 [J]. 中国给水排水, 2013,29(15):34-38. Qin W, Li W G, Zhang D Y, et al. Efficiency of Heterotrophic Nitrification Bacteria in Biologically Enhanced Activated Carbon Process for Treatment of Low Temperature Water [J].China Water & Wastewater, 2013,29(15):34-38.[19] Velten S, Hammes F, Boller M, et al. Rapid and direct estimation of active biomass on granular activated carbon through adenosine tri-phosphate (ATP) determination [J]. Water Research, 2007,41(9): 1973-83.[20] 公绪金.双级生物增强活性炭工艺对低温微污染原水中氨氮的净化效能 [J]. 净水技术, 2018,37(4):71-76. Gong X J. Purification efficiency of two-stage biological enhanced activated carbon process for micro-polluted raw water treatment under low temperature [J]. Water Purification Technology,2018,37(4):71-76.[21] 刘璟言,卢小燕,尤作亮,等.生物活性炭老化对滤池过滤阻力和处理效果的影响 [J]. 中国环境科学, 2016,36(6):1752-1756. Liu J Y, Lu X Y, You Z L, et al. Effect of aged biological activated carbon on the filtration resistance and performance of biological activated carbon filter [J]. China Environmental Science, 2016, 36(6):1752-1756.Biodegradation enhancement of BEAC process based on pore structure regulation of carbons.。
硫自养微生物降解水中低浓度高氯酸盐的研究——反应器效能及微生物种群空间分布

硫自养微生物降解水中低浓度高氯酸盐的研究——反应器效能及微生物种群空间分布刘永德;王依依;万东锦;肖书虎【摘要】考察了升流式硫自养固定床反应器对水中低浓度高氯酸盐[(468.74±6.80)μg/L]的降解效能及相关机制,并利用高通量测序技术对反应器内微生物种群空间分布特性展开分析.研究发现,当HRT为4.00~0.75h时,高氯酸盐去除率达到97%以上,降解符合1/2级反应动力学模型,1/2K1/2v为39.59[μg1/2/(L1/2?h)].随着HRT由4.00h缩短至0.75h,出水SO42-增量由173.37mg/L减小至90.07mg/L,由歧化反应产生的硫酸根占90.75%~93.91%,硫歧化反应与高氯酸盐的降解同步进行,同时,该反应也是碱度过量消耗的主要因素,导致出水pH值降低.测序结果表明,随着高度的增加,反应器内菌群α 多样性降低.变形门(Proteobacteria)和绿菌门(Chlorobi)构成了反应体系的优势菌群.菌属Chlorobaculum为歧化反应菌属,是反应器内优势菌属.%Removal of perchlorate with low concentration [(468.74±6.80)μg/L] in water was investigated by an up-flow sulfur autotrophic reduction reactor. And bacterial community spatial distribution was analyzed by High-throughput sequencing method. The reactor could be operated at a hydraulic retention time (HRT) ranging in 4.00 ~ 0.75h with a remarkable removal efficiency greater than 97%. 1/2-order kinetics model fit the experimental data well; and 1/2K1/2v was 39.59 [μg1/2/(L1/2?h)]. When HRT shortened from 4.00h to 0.75h, the generated SO42- decreased from 173.37 to90.07mg/L. Sulfur (S) disproportionation was accompanied with perchlorate reduction; the proportion of SO42- generated by S-disproportionation was in range of 90.75%~93.91%. Meanwhile, S-disproportionation was the main reason for excess consumption of alkalinity, thus leading to pH decreases in effluent. The sequencing results showed that the α-biodiversity was decreased along the height of reactor. TheProteobacteria andChlorobi was observed as the major bacteria, and the Chlorobaculumwas the dominant bacteria associated with S-disproportionation.【期刊名称】《中国环境科学》【年(卷),期】2017(037)008【总页数】9页(P3142-3150)【关键词】高氯酸盐;硫自养;动力学;硫歧化反应;高通量测序;群落结构【作者】刘永德;王依依;万东锦;肖书虎【作者单位】河南工业大学化学化工与环境学院,河南郑州 450001;河南工业大学化学化工与环境学院,河南郑州 450001;河南工业大学化学化工与环境学院,河南郑州 450001;环境基准与风险评估国家重点实验室,中国环境科学研究院,北京100012【正文语种】中文【中图分类】X52高氯酸盐是一类非挥发性,易溶于水的物质,由于其性质稳定且难被土壤及矿物吸附,一旦进入环境就会随地表及地下水迁移扩散.多年来,高氯酸盐被广泛使用于烟火制造、火箭助推剂、军工、纺织、电镀、皮革等领域的工业生产中[1].中国作为烟花制造及消费的大国,存在着高氯酸盐污染水体的风险.高氯酸盐对人体的危害主要表现在抑制甲状腺对碘化物的吸收,干扰甲状腺正常功能,引发成人新陈代谢失调及阻碍儿童正常生长发育等方面[2].美国环保局(EPA)已经把ClO4-列入饮用水候补污染物清单,2005年美国EPA发布的毒理学评价草案中,规定人体参考剂量为0.7µg/kg体重,等同于饮用水中浓度为24.5µg/L[3].由于高氯酸盐在水溶液中呈现惰性,常规的给水处理技术如混凝、沉淀、过滤等单元均不能对其有效去除[4].而生物法是指微生物在缺氧或厌氧的条件下利用高氯酸盐作为电子受体,在电子供体的作用下将其转化为氯离子,该过程实现了高氯酸盐的形态转化,易实现工程应用,具有诸多优势[5].根据所需电子供体的不同,生物还原高氯酸盐分为异养和自养还原.异养还原需要加入有机物作为电子供体,有二次污染的风险.自养还原高氯酸盐所需电子供体主要包括氢气、硫磺、零价铁等无机物,因其过程友好,细菌增殖缓慢,具有独特优势[6].单质硫磺不溶于水,可直接作为微生物载体,与氢气、零价铁相比,价廉易得,逐渐受到研究者青睐.硫自养还原高氯酸盐理论方程式如下:3ClO4-+4S0+4H2O®8H++4SO42-+3Cl- (1)近年来,一些学者通过序批式研究证实了硫自养还原高氯酸盐可行性并观察到硫岐化反应[7],对硫自养反应的操作条件进行了初步优化[8],并采用PCR-DGGE技术对硫自养微生物开展分子生物学研究[9].在连续流实验方面,研究表明,当水力停留时间为13h时,硫自养固定床生物反应器可以将4~8mg/L的高氯酸盐降低至0.05mg/L以下[10].在本课题组前期研究中,发现该反应器在HRT为1h的条件下对高浓度高氯酸盐(21.07~22.40mg/L)的去除率可达99%以上[11].尽管近些年的研究已取得一定的进展,但许多研究中高氯酸盐初始浓度设置过高(mg/L级),结合实际污染情况,研究低浓度水平(ppb级)的污染十分必要.此外,对于硫自养固定床反应器来说,一些机制尚不清晰,比如:高氯酸盐的降解动力学特征,动态反应过程中硫酸盐的产生趋势,硫歧化反应的规律等问题仍需进一步明确.与此同时,在分子生物学领域,新的技术和方法也发生着巨大变革,高通量测序技术又称为下一代测序技术,在分析复杂菌群方面具有强大的优势[12],通过测定大量DNA序列,可以同时给出定性和定量结果,其是对于丰度较低(0.01%~0.1%)的菌落,该技术仍具有较强的识别能力,已成功应用于活性污泥[13]、膜生物反应器[14]等复杂环境微生物群落结构及其变化的研究中.本研究以硫自养固定床反应器为研究对象,进一步完善反应器对水中低浓度高氯酸盐的降解效能及机理研究,明确高氯酸盐的降解动力学特征,硫酸盐的产生趋势及硫歧化反应的规律,并结合反应器工况,利用高通量测序技术对反应器内微生物种群空间分布特性展开分析,为硫自养固定床反应器在降解高氯酸盐污染的应用提供理论支持.1.1 实验装置建立及启动硫自养反应器由内径为5cm,总高50cm的有机玻璃柱制成.反应器保持密闭,外部设水浴夹套,维持温度恒定(27±2℃),内装填粒径为2.5~ 3.5mm的硫磺颗粒(购自燕山石化),装填高度为40cm,空隙率32%,总有效体积为0.250L.距反应器底部10、20及30cm高度处分别设置3个取样口,取样口内径为1cm,长5cm,用于水样及生物样品采集.底部设置承托层均匀布水,水流方向自下而上,溢流出水,出水管直径为1cm,长5cm.模拟受污水采用静置过夜的自来水(郑州高新供水)加NaClO4 (468.74±6.80)µg/L、20mg/L NaHCO3和5mg/L的KH2PO4(以上药剂均为分析纯)配制而成.其他水质指标分别为:TOC 3.78~4.12mg/L; Cl-108.06~128.50mg/L;SO42- 73.35-~96.81mg/L; NO3--N 1.06~1.77mg/L.由于硫自养填充床中硫氧化菌可以直接实现缺氧状态[15],因此原水并未吹脱溶解氧,由蠕动泵(BT-100-2J,保定兰格)将模拟受污水由原水桶泵入反应器.采用郑州市五龙口污水处理厂氧化沟缺氧段活性污泥浸泡硫磺48h接种(接种量约10g MLVSS),而后将硫磺装柱开展连续流实验.1.2 实验方案本实验连续运行反应器80d,保持水力停留时间(HRT)分别为4.0、2.0、1.0、0.75h,每个HRT条件下,反应器稳定运行20d.定时测定进出水各离子浓度、pH及碱度等指标.待出水各离子浓度维持恒定(偏差小于5%)时,认为其达到稳态运行.在HRT分别为1.0和0.75h,反应器稳态运行时,于3个取样口分别取样,测定各离子浓度沿程变化,确定反应动力学及硫歧化反应发生趋势.在HRT为0.75h,系统稳态运行情况下,分别收集3个取样口的生物样品,用于高通量测序技术分析微生物种群结构及空间分布特征.1.3 分析与测定本实验中所有水样分析前均采用0.20 µm水系微孔滤膜过滤.样品中ClO4-和SO42-浓度采用美国热电ICS-600离子色谱仪分析测定,色谱条件:色谱柱型号AS-16,保护柱型号AG-16,淋洗液KOH 25mmol/L,淋洗液流速1.0mL/min,柱温30℃,每个样品分析时间30min.采用10和500µL定量环,SO42-和ClO4-最低检出限分别为0.2mg/L和10µg/L.S2-采用亚甲蓝光度法[16]测定,NO3-采用紫外分光光度法[16]测定,NO2-采用1-萘基乙二胺光度法[16]测定,分光光度计型号为北京普析TU-1900.进出水pH、ORP值采用美国HACHQ30D多参数水质分析仪测定.TOC 采用日本岛津TOC-LCPN测定.在HRT为0.75h,反应器稳态运行时,分别取自反应器底部(高度10cm)、中部(高度20cm)及上部(高度30cm)的3个生物样品DNA的提取及扩增采用已有方法[17].扩增后的DNA样本被送到生工生物工程(上海)股份有限公司进行测序,测序平台为Illumina Miseq 2×300.高质量序列去除前后引物以及标签后,利用Mothur软件对得到的全部序列进行比对,去除引物、嵌合体和长度小于200bp的序列,并在97%的相似性水平上计算序列遗传距离,该矩阵用于确定OTUs.同时基于物种丰富度的分析,使用Mothur软件计算Alpha多样性指数中的丰富度(Chao1指数、Ace指数)、多样性指数(Simpson指数和Shannon- Wiener多样性指数)和覆盖度(Coverage).此外,利用SILVA数据库进行16S rDNA基因系列比对,确定序列对应微生物的分类学地位.利用UniFrac程序基于UniFrac距离对3个生物样品进行加权的主坐标分析(Principal coordinate analysis,PCoA)和3D可视分析.2.1 反应器对高氯酸盐的处理效果及其动力学分析反应器运行期间进出水ClO4-浓度变化如图1(a)所示,可以看出,经活性污泥接种后,保持HRT为4.0h,反应器表现出很好的适应能力,挂膜十分迅速,对于进水(468.74±6.80)µg/L的ClO4-,出水ClO4-浓度于第4d降低至10µg/L以下,之后运行至第80d,始终保持较高的去除率(>97%),即使逐渐调整水力停留时间由4.00h 缩短至0.75h,出水ClO4-浓度没有出现反弹情况,表明反应器具有较强的抗冲击能力.在HRT分别为1.0和0.75h,反应器稳态运行时,于3个不同高度的取样口分别取样,测定ClO4-离子浓度沿程变化,结果如图1(b)所示.虽然硫自养固定床还原高氯酸盐的动力学相关研究较少,但围绕硫自养固定床去除硝酸盐动力学,学界已开展了大量理论及实践研究.许多研究已经证实,硫自养固定床反应器可以采用主体零级及1/2级反应动力学速率方程来描述基质去除的动力学过程[18-19].2.1.1 主体零级反应动力学假定单质硫作为底物供应充分,且基质向生物膜内的扩散没有传质限制,有:C = C0-K0vT (2)2.1.2 1/2级反应动力学当主体溶液中基质浓度不高,生物膜生长较为成熟,基质向生物膜内的扩散受传质的限制,不能穿过整个生物膜时,有:C=(C01/2-1/2K1/2vT)2 (3)式中:C0为进水ClO4-浓度,μg/L;C为接触时间为T时出水的ClO4-浓度,μg/L;Kov[μg/(L.h)]和1/2K1/2v[μg1/2/(L1/2×h)]分别为零级和1/2级反应速率常数;T为接触时间h.本研究采取上述两模型拟合ClO4-的去除实验数据,结果列于表1.可以看出,与零级动力学相比,1/2级动力学模型拟合具有较高的相关系数,模型计算出的初始浓度C0cal与实验值C0EXP非常接近,表明本反应器中,生物膜已经生长成熟, ClO4-由溶液主体透过生物膜向硫磺颗粒表面的扩散成为限制性步骤.根据1/2级动力学模型,当1/2K1/2v为39.59[µg1/2/(L1/2.h)]时,完全去除(468.74±6.80)µg/L的高氯酸盐,需要至少0.546h的接触时间,当接触时间过短时,高氯酸盐将不能被完全去除. 需要指出的是,由于配水中同时含有低浓度的硝酸盐(1.06~1.77mg-N/L,饮用水标准为10 mg-N/L),在本反应器中,也同时进行着硝酸盐的硫自养还原反应,具体方程为[18]:测定进出水硝酸盐氮及亚硝酸盐氮,结果表明,在反应器运行期间,出水硝酸盐及亚硝酸盐氮均低于检出限,动力学研究显示,硝酸盐及亚硝酸盐在最低的取样口(高度为10cm,对应接触时间为0.190h)已检测不出,这表明,低浓度的硝酸盐共存对高氯酸盐的降解基本不产生抑制作用.2.2 硫酸根的产生趋势及硫歧化反应特征硫酸根的产生是硫自养生物还原工艺中需要关注的重要方面.本研究在HRT为1.0h,反应器稳态运行时,于3个不同高度的取样口分别取样,测定SO42-及S2-离子浓度沿程变化,结果如图2(a)所示.可以看出,随着接触时间从0.25h延长至1.0h,SO42-浓度呈现持续增加的态势,产生量从74.59mg/L增加至136.06mg/L.产生的SO42-浓度来源主要包括3方面:高氯酸盐还原、硝酸盐还原和硫歧化反应.硫歧化反应理论方程为:4S0+4H2O®3H2S+SO42-+2H+ (5)为衡量各反应产生的SO42-浓度的份额,分别按照如下3式分别计算各反应所产生的SO42-占总SO42-增量的百分比,并将分析结果列于图2(a):高氯酸盐还原产生硫酸根占比:硝酸盐还原产生硫酸根占比:(7)硫歧化反应产生硫酸根占比:RS歧化=100%-RCIO4- -RNO3--N (8)其中,各离子浓度单位均为mg/L,式(6)式(7)中,系数1.29和7.18分别由式(1)和式(4)确定.可以看出,由于进水高氯酸盐与硝酸盐浓度均为低浓度,硫自养还原二者产生的SO42-占比很低,硫歧化反应则在一开始就非常显著,当接触时间为0.25h时(第一个取样口),RS歧化达到89.11%(对应SO42-净增量为66.47mg/L),随着接触时间的延长,硫歧化反应所产生的SO42-进一步增多,至1h时,硫歧化反应所产生的SO42-达到127.78mg/L,RS歧化高达93.91%,即增加的SO42-中有93.91%是由歧化反应引起.在硫自养反硝化过程中,多数学者认为,SO42-的产生与硝酸盐的去除呈一次正比关系,并未观测到过量SO42-产生[18-19].而硫自养还原高氯酸盐过程则呈现显著不同趋势,2007年Ju等[7]通过序批式实验表明,硫歧化反应主要在高氯酸盐完全去除之后发生.而本研究表明,在硫自养固定床反应器中,硫歧化反应与高氯酸盐的降解同步进行,并未在高氯酸完全去除后进行,而且歧化反应产生的硫酸根在反应刚开始(接触时间0.25h时)占比就十分显著(RS歧化为89.11%).S2-离子是歧化反应的另一主要产物,其浓度在反应器中呈现先增大再减少的趋势,通过监测反应期内各位置ORP值,发现反应器底部和中部ORP分别为-138和-235mV,而在出水口处升高至+35mV,因此推测S2-在出水口处浓度降低的原因是本反应器出水口与大气相通,空气中的氧气对S2-有氧化作用,导致S2-离子浓度在出水口降低.不同HRT条件下,反应器出水SO42-增量、份额分配及S2-浓度变化如图2(b)所示,随着HRT的延长,出水SO42-增量呈逐渐增加的趋势,当HRT由0.75h延长至4.00h,总SO42-增量由90.07mg/L增加至173.37mg/L(对应RS歧化为90.75%~93.91%),出水S2-离子浓度保持在较低水平.由RS歧化均大于90%可以推测,歧化反应是导致SO42-过量增加的主要原因.因此,为控制过量硫酸盐的生成,在保证去除率的前提下,适当缩短HRT可以避免生成过量SO42-.2.3 进出水pH值及碱度消耗情况硫自养还原过程会消耗溶液碱度,引起溶液pH值的下降,监测进出水pH值及碱度情况,如图3所示.可以看出,在反应器整个运行周期中(80d),反应器出水pH值始终低于进水.当HRT为4.00~1.0h时,总的碱度消耗约为240~280mg/L (以CaCO3计),出水pH值比进水低约0.5~1.0.当HRT缩短至0.75h时,反应体系消耗碱度有所下降,约为180mg/L(以CaCO3计),出水pH有所上升,比进水低约0.4.反应体系中碱度的消耗主要来源于3方面,高氯酸盐的还原,硝酸盐的还原和硫歧化反应.根据污染物浓度,结合反应方程(1)和(4),计算出硫自养还原污染物的理论碱度消耗量为4.77~ 7.55mg/L.而实际碱度消耗远大于该值,表明硫歧化反应成为碱度消耗的主要因素,缩短HRT,硫歧化反应发生的程度减弱,导致碱度消耗的下降.2.4 微生物种群空间分布分析2.4.1 微生物α多样性分析α多样性反映了一个生态系统中群落物种丰富度,也被称为生境内多样性,是研究群落组成及结构的重要内容,它的测度方法有多种,包括丰富度指数(Richness)、香浓指数(Shannon)、Chao 1、ACE指数等.其中,丰富度指数(Richness)用于衡量单个样品中物种种类个数,实际通过操作分类单元(OTU)的个数来计算,香农指数(Shannon)衡量群落的异质性; ACE、Chao1指数主要表示微生物种群丰度[13,17].采用Miseq 2×300测序平台对反应器不同位置的微生物群落结构进行分析,样品α多样性相关的各项指标列于表2中.可以看出,3个样品测试的原始序列均超过56000条,经过质控后,有效序列均超过51734条,为便于比较,统一为51000条,该条件下,3个样本的测序覆盖度Coverage,即最终得到的测序结果占整个基因组的比例,分别达到92.94%,93.84%和95.93%,表明测序覆盖度已基本反映样本的真实情况,样本中没有被测出的物种概率较低.随着高度的增加,反应器内菌群α多样性的各指标,如丰富度指数(Richness)、香浓指数(Shannon)、Chao 1、ACE指数均呈现逐渐减小的趋势,表明反应器底部细菌群落α多样性最高,由下至上,细菌群落α多样性逐渐降低.本反应器水流方向为自下而上,结合动力学分析,可以推测,反应器底部进行的反应主要包括污染物的硫自养降解以及硫歧化反应,对应细菌群落α多样性较高,而到反应器中部及上部时,随着污染物逐渐降解完全,反应器内开展的反应逐渐演替为硫歧化反应,反应类型变得单一,导致细菌群落α多样性降低.2.4.2 微生物β多样性分析β多样性分析主要用来度量多组样品之间的差别,本研究采用加权重的计算方式,计算不仅评估样本间物种的差异,而且加入了物种丰度作为权重.采用PCoA(主成分分析Principal co-ordinates analysis)方法分析反应器不同位置3个样品的β多样性.计算UniFrac距离结果如图4(a)所示,将分析结果以可视化3D图形式展现,如图4(b)所示.可以看出,反应器底部和中部的样品呈现较高的相似度,相似度达到91.05%,而反应器上部的样品与底部和中部的样品相比,相似度较低(约为74.65%).该结果表明,反应器内不同位置发生的反应不同,对应3个样品β多样性呈现差异性.结合动力学分析结果,当HRT为0.75h时,除了硫歧化反应之外,反应器底部和中部仍在进行着污染物的还原反应,对应高氯酸盐去除率分别为55.81%和88.81%,两位置发生的反应类似,因此两样品表现出较高的相似度.而在反应器上部,高氯酸盐低于检出限10µg/L,其去除率已达到98%以上,污染物的降解反应已进行的比较彻底,此时该位置主要发生硫歧化反应,因此,该位置细菌种群与底部及中部样品相比,相似度较低. 2.4.3 特征种群分析环境微生物通常以群落的形式存在,其结构特征描述了微生物群落成员的种类、丰度、以及演替情况.反应器内不同位置微生物群落结构的构成对于维护反应器功能非常关键.研究本反应器内群落结构的空间分布对于认识硫自养反应微生物生态学机理、优化操作条件、提升反应装置的效能具有重要作用.为进一步了解反应器内不同位置微生物群落结构,对其进行了不同分类水平的统计分析,分别在门(Phylum)和属(Genus)的水平上对各样品中菌群结构开展分析,结果如图5所示.门水平上的群落结构分析显示,变形门(Proteobacteria)和绿菌门(Chlorobi)构成了反应体系的优势菌群,变形门(Proteobacteria)菌群丰度沿反应器内高度的增加呈减少趋势,而绿菌门(Chlorobi)呈增加趋势.变形门(Proteobacteria)是细菌中最大的一门,也是活性污泥中常见的优势菌门[13,17].绿菌门(Chlorobi)细菌主要利用硫化物、硫单质作为电子供体,氧化产物为硫酸盐.属(Genus)水平上的分析结果能提供更深入更全面的菌落结构信息.菌属Chlorobaculum为反应器内优势菌属,沿反应器内高度的增加呈持续增大的趋势,在反应器底部、中部和上部的丰度分别为33.07%、50.39%和82.69%.2011年Rodrigue等研究发现绿硫菌Chlorobaculum tepidum可以氧化硫化物和硫单质,生成终产物硫酸盐[20].结合硫歧化反应的发生趋势(图2),在反应器底部歧化反应已经十分显著,产生了过量的硫酸盐,沿着反应器高度的增加,接触时间延长,歧化反应愈加显著,与Chlorobaculum菌属丰度趋势相一致,因此,判断Chlorobaculum菌属为歧化反应菌属.菌属Sulfurmonas丰度在反应器底部为1.51%,至反应器中部下降至0.24%,反应器上部为0.14%.根据已有报道,菌属Sulfurmonas为硫自养反硝化细菌[21],鉴于高氯酸盐和硝酸盐性质类似,许多细菌都能对二者去除[10],可以推测菌属Sulfurmonas在本反应器中为高氯酸盐及硝酸盐硫自养还原菌.由于硫歧化反应始终伴随着污染物的降解,在反应器底部即进行得十分充分,成为反应器内发生的主要反应,同时,污染物浓度较低,污染物的降解仅主要在反应器底部和中部进行,导致菌属Sulfurmonas丰度不高.其余菌属如Rhodopseudomonas、Acidithobacillus、Desulfocapsa和Ignavibacterium等丰度均在较低水平,功能仍有待进一步研究.3.1 升流式硫自养固定床反应器对水中的低浓度高氯酸盐[(468.74±6.80) µg/L]具有较好的降解效果,逐渐调整水力停留时间由4.0h缩短至0.75h,反应器稳态运行时,去除率较高(>97%),高氯酸盐降解符合1/2级反应动力学模型,高氯酸盐由溶液主体向生物膜内的扩散为主要限速步骤.3.2 硫歧化反应与高氯酸盐的降解同步进行,歧化反应产生的硫酸根占比十分显著,为控制过量硫酸盐的生成,在保证去除率的前提下,适当缩短HRT可以避免生成过量硫酸盐.同时,硫歧化反应是碱度过量消耗的主要因素,碱度消耗高于理论值,造成出水pH值的降低.3.3 反应期内微生物群落结构空间分布呈现规律性,反应器底部细菌群落α多样性最高,由下至上,细菌群落α多样性逐渐降低;β多样性分析结果表明反应器底部和中部样品表现出较高的相似度,达到91.05%,而反应器上部样品与之相比,相似度较低(约为74.65%).3.4 菌群组成结构分析结果表明,Sulfurmonas为硫自养还原菌,Chlorobaculum 菌属为歧化反应菌属.[1] Urbansky E T. Perchlorate chemistry: Implication for analysis and remediation [J]. Bioremediation Journal, 1998,2(2):81-95.[2] Charnley G. Perchlorate: Overview of risks and regulation [J]. Food and Chemical Toxicology, 2008,46:2307-2315.[3] Tieman M. Perchlorate contamination of drinking water: Regulatory issue and legislative actions [R]. CRS Repo ~ for Congress, Order CodeRS21961, Updated April 4, 2007.[4] Logan B E. Assessing the outlook for perchlorate remediation [J]. Environmental Science & Technology, 2001,35(23):482-487.[5] Bardiya N, Bae J H. Dissimilatory perchlorate reduction: A review [J]. Microbiological Research, 2011,166:237- 254.[6] Ju X, Sierra-Alvarez R, Field J A, et al. Microbial perchlorate reduction with elemental sulfur and other inorganic electron donors [J]. Chemosphere, 2008,71(1):114-122.[7] Ju, X, Field J A, Sierra-Alvarez R, et al. Chemolithotrophic perchlorate reduction linked to the oxidation of elemental sulfur [J]. Biotechnol. Bioeng., 2007,96(6):1073-1082.[8] 谢杰,杨志泉,陈兵,等.硫自养菌降解还原高氯酸盐的优化控制研究 [J]. 水处理技术, 2012,6(6):32-35.[9] 任云,高孟春,王子超,等.硫自养高氯酸盐还原菌和反硝化菌的培养和驯化[J]. 应用与环境生物学报, 2014,20(3):414-419.[10] Sahu, A K, Conneely T, Nüsslein K R, et al. Biological Perchlorate Reduction in Packed Bed Reactors Using Elemental Sulfur [J]. Environmental Science & Technology, 2009,43:4466- 4471.[11] 万东锦,刘永德,樊荣,等.硫自养填充床生物反应器去除水中的高氯酸盐[J]. 环境工程学报, 2015,9(11):213-218.[12] 王绍祥,杨洲祥,孙真,等.高通量测序技术在水环境微生物群落多样性中的应用 [J]. 化学通报, 77(3):196-203.[13] Zhang T, Shao M F, Ye L, et al. 454pyrosequencing reveals bacterial diversity ofactivated sludge from 14sewage treatment plants [J]. ISME Journal, 2011,6:1137–1147.[14] Ontiveros-Valencia A, Tang Y, Zhao H P, et al. Pyrosequencing analysis yields comprehensive assessment of microbial communities in pilot-scale two-stage membrane biofilm reactors [J]. Environmental Science & Technology, 2014,48:7511-7518.[15] Boles A R, Conneely T, McKeever R, et al. Performance of a pilot-scale packed bed reactor for perchlorate reduction using a sulfur oxidizing bacterial consortium [J]. Biotechnogy and Bioengineering, 2012,109(3):637-646.[16] 国家环保总局《水和废水分析监测方法》编委会.水和废水分析监测方法 [M]. 4版.北京:中国环境科学出版社, 2009.[17] Wan D, Liu Y, Niu Z, et al. Perchlorate reduction by hydrogen autotrophic bacteria and microbial community analysis using high-throughput sequencing [J]. Biodegradation, 2016,27:47-57.[18] Konenig A, Liu LH. Kinetic model of autotrophic denitrification in sulfur packed-bed reactors [J]. Water Research, 2001,35(8): 1969-1978. [19] Moon H S, Ahn K H, Lee S, Nam K, et al. Use of autotrophic sulfur-oxidizers to remove nitrate from bank filtrate in a permeable reactive barrier system [J]. Environmental Pollution, 2004,129(3):499-507.[20] Rodriguez J, Hiras J, Hanson T E. Sulfite oxidation in chlorobaculum tepidum [J]. Frontiers in Microbiology, 2011,2: 112.[21] Zhang M, Zhang T, Shao M F, et al. Autotrophic denitrification innitrate-induced marine sediment remediation and Sulfurimonas denitrificans-like bacteria [J]. Chemosphere, 2009,76(5):677-682.。
硫自养反硝化过程中含硫副产物产生规律及微生物群落结构的空间分布

硫自养反硝化过程中含硫副产物产生规律及微生物群落结构的空间分布万东锦;李琦;刘永德;肖书虎【摘要】为探究硫自养反硝化过程中含硫副产物的产生规律,建立了上流式硫自养固定床生物反应器,考察HRT(水力停留时间)对水中NO3--N去除的影响,运用零级和1/2级反应动力学模型对NO3--N还原过程进行拟合,通过测定与理论计算分析含硫副产物的产生趋势及规律,利用高通量测序技术(high-throughput sequencing)测定微生物群落结构空间分布特征.结果表明:①当进水NO3--N浓度为(30.45±0.38) mg/L,HRT为4和1h时,NO3--N去除率达到98%以上.硫自养反硝化过程符合1/2级反应动力学模型,1/2K1/2V(1/2级反应动力学速率常数)为5.69 mg1/2/(L1/2·h).②出水SO42-的产生量接近理论值,S2-在反应器中部出现微量的积累,在出水口处浓度进一步降低(<0.5 mg/L).③HRT的缩短改变了反应器内部微生物群落α多样性的变化规律;Proteobacteria成为了最主要的优势菌群,各阶段所占比例均大于59%,Sulfurimonas为最常见的反硝化菌,在HRT为1h时,反应器中部其丰度达到36%,成为反应器中的优势菌属;Desulfurella为SRB(硫酸盐还原菌),其丰度的增加与反应器内部S2-的积累一致.研究显示,硫自养反硝化过程中产生的SO42-与理论值接近,S2-产生量沿反应器高度方向呈现先增加后降低的趋势,微生物群落结构分布情况与反应器高度有关.【期刊名称】《环境科学研究》【年(卷),期】2018(031)006【总页数】8页(P1152-1159)【关键词】硫自养;反硝化;含硫副产物;高通量测序;微生物群落结构【作者】万东锦;李琦;刘永德;肖书虎【作者单位】河南工业大学化学化工与环境学院,河南郑州450001;河南工业大学化学化工与环境学院,河南郑州450001;河南工业大学化学化工与环境学院,河南郑州450001;中国环境科学研究院,环境基准与风险评估国家重点实验室,北京100012【正文语种】中文【中图分类】X52近年来,由于氮肥施用过量、养殖场畜禽粪便堆积、居民生活和工业污水的随意排放,导致地下水中NO3--N的污染状况日益加重[1-2]. 在美国、日本和韩国,饮用水中NO3--N的最大浓度不得超过10 mgL[3]. 饮用水中存在的NO3--N将对人体健康造成严重危害,可导致婴儿患高铁血红蛋白症或蓝婴综合征,成年人可能患肠胃癌[4].生物脱硝工艺具有高效率、低成本、易于工程应用等优点[5],实现了污染物形态转化,受到了众多研究者的关注. 异养反硝化需要外加碳源从而增加处理成本,且残余的有机碳源有二次污染的隐患. 自养反硝化过程能避免外加碳源带来的二次污染隐患,微生物增殖缓慢[6],过程较为友好清洁. 自养反硝化常采用氢气、单质硫或硫代硫酸盐作为电子供体,但由于氢气不易储存且成本高,通常使用单质硫作为电子供体[7]. 硫自养反硝化工艺利用脱氮硫杆菌,在缺氧条件下以单质硫作为电子供体,NO3--N作为电子受体,从而实现反硝化脱氮的过程,该工艺的原理可用式(1)表示[8].1.06NO3-+1.11S+0.3CO2+0.785H2O→0.06C5H7O2N+0.5N2+1.11SO42-+1.16H+ (1)近年来,围绕硫自养反硝化工艺的研究集中体现在HRT(水力停留时间)、共存离子等试验条件对反硝化效率的影响方面. WANG等[9]考察了填充不同纯度单质硫的完全混合反应器对NO3--N的去除效果,并对单质硫表面生物膜的生长机理进行了分析,结果表明,采用不同纯度的单质硫作为电子供体,并没有对NO3--N的还原产生明显的影响,反硝化通量受NO3--N浓度和生物膜生长的影响,生物膜厚度的增加会增大质量传递阻力. 汤丹娜等[10]考察了硫磺石灰石自养反硝化系统的脱氮性能,结果表明,当进水NO3--N质量浓度为(54.46±1.15)mgL、HRT为2.5 h时,反应器容积负荷最大,且NO3--N去除率最高,达99.93%;出水中N2O的质量浓度随着NO2--N的累积而增加. Blažkov等[11]通过序批式试验,考察了进水Fe3+浓度对NO3--N还原的影响,结果表明,以单质硫作为电子供体进行自养反硝化,当添加Fe3+质量浓度为0.1 mgL时,NO3--N的去除率有了明显的提升,但也会导致中间产物NO2--N的积累.需要指出的是,硫自养过程会产生含硫副产物如SO42-和S2-,含硫副产物的产生将对出水水质产生重要影响,直接制约着硫自养工艺在水体污染修复中的应用. 目前,大多数研究均围绕副产物SO42-展开,而针对副产物S2-开展的研究仍然十分有限. ZHANG等[12]研究结果表明,以单质硫作为电子供体、进水NO3--N 质量浓度从30 mgL增至80 mgL时,产生的副产物SO42-质量浓度从274.7 mgL增至698.4 mgL,与理论值非常接近. 笔者在硫自养还原NO3--N和ClO4-复合污染的研究中发现[13],NO3--N未被完全还原时,产生的SO42-浓度与理论值非常接近,待反硝化反应进行完全后,尤其是长HRT条件下(HRT=12 h),观测到过量的SO42-(质量浓度高达约300 mgL)和S2-(质量浓度峰值为5.06 mgL)的产生,推测是发生了硫歧化反应. 需要指出的是,该研究是在NO3--N和ClO4-同时存在的条件下开展,针对硫自养反硝化过程中含硫副产物(尤其是S2-)产生规律的研究仍需要进一步深入.与此同时,在分子生物学领域,高通量测序技术正在快速发展. 由于该技术能快速对复杂微生物群落结构进行分析,对于丰度较低的菌落仍具有较强的识别能力[14],已成功运用到活性污泥、膜生物反应器、厌氧氨氧化等复杂环境微生物群落结构的解析中[15-16]. 针对硫自养反硝化菌群结构特征,该技术的应用研究仍较为有限.基于上述研究背景,该研究以硫自养固定床反应器为研究对象,在不同HRT条件下,考察硫自养反应器脱硝效能,重点解析含硫副产物产生机制,结合反应器工况,利用高通量测序技术对反应器内微生物种群空间分布特性进行分析,为硫自养反硝化工艺的应用提供理论支持.1 材料与方法1.1 试验装置建立及启动硫自养柱由有机玻璃制成,内径为10.0 cm,总高为59.5 cm. 反应器顶部设有三相分离器,可使出水和产气分离. 整个滤柱密闭,柱上方设有排气小口(水封),以保持柱内缺氧环境. 反应器外部设有水浴加热外套,将柱温维持在(30±2)℃. 填充载体为硫磺颗粒(购自中国石化北京燕山分公司),粒径为2~5 mm,填充高度为42 cm,孔隙率为33%. 反应器总的有效容积为955 mL,沿反应器不同高度设置3个取样口,用以动力学研究及微生物取样. 反应器底部设置承托层均匀布水,水流由下至上溢流而出,出水口直径为1 cm.模拟受污原水由河南省郑州市高新区自来水,加入30 mgL NaNO3、20 mgL NaHCO3和5 mgL KH2PO4(以上药剂均为分析纯)配制而成. 该进水NO3--N、NO2--N、SO42-、DO、TOC质量浓度平均值分别为(30.45±0.38)(0.18±0.04)(142.75±66.94)(7.77±0.20)(1.22±0.31)mgL. 原水贮存于储水罐中,经蠕动泵(BT-100-2J,保定兰格恒流泵有限公司)打入硫自养反硝化滤柱. 接种污泥取自郑州市五龙口污水处理厂氧化沟缺氧段,将硫磺颗粒浸泡于活性污泥中48 h进行接种,而后将硫磺装柱开展连续性试验. 该研究中,整个反应过程在密闭反应器内进行,反应器内为缺氧状态,未对进水进行DO的吹脱[17].1.2 试验方案试验连续稳定运行40 d,HRT分别设置为4和1 h,每个HRT条件下,反应器稳定运行20 d. 定期测定进出水各离子浓度,待各离子浓度偏差小于5%即认为达到稳态运行. 当每个HRT运行阶段达到稳态时,分别对底部和中部进行微生物取样,用于微生物群落结构空间分布分析.1.3 分析与测定水样经0.22 μm滤膜过滤后测定各参数. NO3--N质量浓度采用紫外分光光度法测定,NO2--N质量浓度采用1-萘基乙二胺光度法测定,S2-质量浓度采用亚甲蓝光度法测定[18],均使用紫外可见分光光度计(TU-1900,北京普析通用仪器有限责任公司). SO42-质量采用离子色谱仪(ICS-600,美国Dionex)测定,测定条件:KOH淋洗液(25 mmolL),淋洗液流速1.0 mLmin,柱温30 ℃,采用AS16分析柱和AG16保护柱,样品测定时间为10 min. TOC质量浓度采用TOC分析仪(TOC-L CPN CN200,日本岛津)测定. ORP(氧化还原电位)采用便携式水质分析仪(HQ30d,美国HACH)测定.试验过程中取得5个生物样品,分别为接种污泥,HRT为1和4 h时,反应器底部和中部取样口处样品(样品编号记为4 h底部、4 h中部、1 h底部、1 h中部.下同). 样品取出后立即在4 ℃下保存,DNA的提取及扩增以及测序过程采用已有方法[19-20].2 结果与讨论2.1 反应器对NO3--N的去除效果及动力学分析反应器运行期间,进出水NO3--N质量浓度及去除率如图1所示. 当HRT为4 h,进水NO3--N质量浓度为(30.09±0.22)mgL,反应器稳态运行时,出水NO3--N 质量浓度始终低于检出限(0.08 mgL),去除率达到99.74%. 将HRT缩短为1 h,进水NO3--N质量浓度为(30.63±1.12)mgL时,出水NO3--N质量浓度为(0.37±0.27)mgL,去除率达98.82%. 虽然缩短HRT使NO3--N去除率略有下降,但依然实现了NO3--N的高效去除. 表明硫自养去除水中NO3--N是一种行之有效的方法,去除效率高且所需HRT较短,同时反应器具有一定的耐冲击能力.图1 进出水NO3--N质量浓度及其去除率Fig.1 Nitrate concentration in influenteffluent and removal efficiency图2 NO3--N和NO2--N质量浓度变化及NO3--N反应动力学模型拟合结果Fig.2 Nitrate and nitrite concentration and nitrate reaction kinetics fitting在HRT为1 h反应器达到稳态运行时,于3个不同高度取样口处取样,测定NO3--N及NO2--N质量浓度的变化,结果如图2所示,并采用零级和12级反应动力学模型对NO3--N还原过程进行拟合,进而描述生物膜生化反应过程中对基质去除的动力学过程[8,21].零级反应动力学模型是假设单质硫作为底物供应充足,且基质向生物膜内的扩散没有传质限制,即:C=C0-K0VT(2)12级反应动力学模型是当基质浓度不高,生物膜生长较为成熟,基质向生物膜内的扩散受传质的限制而不能穿过整个生物膜,即:C=(C012-12K12VT)2(3)式中:C0为进水NO3--N质量浓度,mgL;T为接触时间,h;C为接触时间为T时水中NO3--N质量浓度,mgL;K0V为零级反应动力学模型速率常数,mg(L·h);12K12V为12 级反应动力学模型速率常数,mg12(L12·h).采用上述两种模型对NO3--N去除试验进行拟合,结果见表1. 从表1可以看出,与零级反应动力学模型相比,12级反应动力学模型拟合具有较高的相关系数(R2>0.99),经模型计算出的初始浓度(C0cal)与试验值(C0EXP)非常接近,这说明反应器中生物膜已经生长成熟,NO3--N由溶液主体透过生物膜向硫磺颗粒表面的扩散成为限制性步骤[8]. 根据12级动力学模型,当12K12V为5.69mg12(L12·h)时,完全去除(30.63±1.12)mgL的NO3--N,至少需要0.97 h的接触时间,当接触时间过短时,NO3--N将不能被完全去除.表1 反应动力学模型拟合的相关参数Table 1 Reaction kinetics fitting parametersC0EXP∕(mg∕L)零级反应动力学模型1∕2级反应动力学模型C0cal∕(mg∕L)K0V∕[mg∕(L·h)]R2C0cal∕(mg∕L)1∕2K1∕2V∕[mg1∕2∕(L1∕2·h)]R230.63±1.1225.6725.910.903 729.145.690.993 9通过对不同高度取样口处NO2--N质量浓度的测定,发现其产生规律呈先上升后降低的趋势,在反应器底部测得其浓度为(0.39±0.17)mgL. 作为NO3--N还原过程的中间产物,出水中测得其质量浓度为(0.03±0.05)mgL,并没有检测到浓度的积累.2.2 含硫副产物的产生趋势及反应特征由式(1)可见,硫自养反硝化过程会产生SO42-,其浓度高低制约着硫自养脱硝技术的应用. 同时,S2-作为含硫副产物,其浓度高低也直接影响工艺实际应用. 因此围绕SO42-和S2-两个指标,在HRT分别为4和1 h,系统稳定运行阶段,于3个取样口处取样,测定二者产生量沿反应器高度的变化,结果如图3、4所示.注: HRT=4 h时,反应时间为0.5、2.1、3.7、4.0 h,对应反应高度分别为5、22、39、42 cm; HRT=1 h时,反应时间为0.1、0.5、0.9、1.0 h,对应反应高度分别为5、22、39、42 cm.图3 不同HRT条件下反应器内SO42-产生量Fig.3Sulfate generation in the reactor under different HRT在不同HRT条件下,SO42-的产生量(指产生的SO42-质量浓度)沿反应器高度方向均是逐渐增大的,出水SO42-产生量分别为(228.37±12.46)(HRT=4 h)和(229.58±13.10)(HRT=1 h)mgL,延长HRT并没有使SO42-产生量发生明显变化. 该研究体系中,产生的SO42-来源于两方面,NO3--N的还原和DO的消耗.NO3--N还原所产生的SO42-按式(1)进行计算,DO消耗所产生的SO42-按式(4)进行计算.2S+3O2+2H2O→2SO42-+4H+(4)图4 不同HRT条件下反应器内S2-产生量及ORP值Fig.4 Sulfide generation and ORP variation in the reactor in different HRT经过理论计算(见图3),HRT为4和1 h时,总出水中,由NO3--N还原而产生的SO42-质量浓度分别为(215.46±1.12)和(219.45±6.39)mgL,由DO消耗所产生的SO42-质量浓度分别为(13.45±0.57)和(13.13±0.26)mgL. 通过改变HRT,出水SO42-产生量分配份额并没有明显差异. 同时,当HRT为4和1 h时,反应过程中SO42-产生量的实际值与理论值十分接近,说明HRT对反硝化过程中SO42-的产生几乎不产生影响,SO42-的产生量主要与去除掉的NO3--N正相关. 由图4可见,S2-产生量(指产生的S2-质量浓度)随反应器时间的增加呈先增后减的趋势. 在反硝化进行完全后,S2-产生量达到峰值;HRT为4 h时,最大S2-产生量平均值达1.25 mgL;HRT为1 h时,最大S2-产生量平均值为0.66 mgL. 同时,试验观测到出水TOC质量浓度〔(2.37±0.82)mgL〕略高于进水〔(1.22±0.31)mgL〕,TOC质量浓度的增加主要由微生物代谢产物导致[22]. 结合TOC质量浓度数据,可以推测当NO3--N被完全还原后,由于溶液中存在微量有机物,溶液中SO42-被还原产生S2-. 随着出水口ORP的升高,S2-产生量进一步降低,测得出水口处其浓度低于0.5 mgL,其原因是反应器出水口直接与大气相连,空气中的氧气极易将S2-氧化成单质硫,导致出水S2-产生量降低[23]. 在笔者前期硫自养还原NO3--N和ClO4-复合污染研究[13]中发现,在NO3--N完全还原之后,发生了硫歧化反应,导致SO42-和S2-过量产生,且HRT越长,二者浓度越高. 而在该研究中,未观察到SO42-和S2-过量产生的现象,证明水中存在单一污染物NO3--N时,即使是在长HRT条件下,硫自养反硝化过程并不伴随硫歧化反应的发生.2.3 微生物群落分析2.3.1 菌群生物多样性动力学研究表明,反应器内主要反应在底部和中部进行,因此分别对接种污泥及不同HRT条件下,反应器底部及中部微生物进行高通量测序. 通过单样品的多样性分析,来反映微生物群落的丰度和多样性. α多样性评价方法有Shannon-Wiener 指数、Chao 1指数、ACE指数等. 评估群落分布丰度的指数为Chao 1指数和ACE指数,评估群落分布多样性的指数为Shannon-Wiener指数,其值越大,群落丰度及多样性越高. 通过OTU(操作分类单元)的个数来衡量样品中物种种类个数[15]. 表2总结了α多样性相关的参数.表2 样品α多样性相关各项指标Table 2 α-biodiversity of the samples样品序列数原始值有效值标准值OTUs个数Shannon-Wiener指数Chao 1指数ACE指数覆盖率∕%接种64 84164 36539 0002 1106.012 140.722 182.331004 h底部109 231108 85539 0006072.79782.47836.811004 h中部85 02883 35339 0006973.28930.01978.051001 h底部42 53639 497390005993.02738.88777.151001 h中部46 16346 074390004453.00635.99671.81100从表2可以看出,所有样品测试的原始序列数均超过42 000条,经过质量控制后,有效序列数均超过39 497条,为便于分析比较,将序列数统一为39 000条,在该条件下,所有样品的覆盖率均为100%,表明样本中序列均被测出,该次测序结果代表样本的真实情况. 接种污泥群落的OTUs、Chao 1指数以及ACE指数最大,表明其丰度最高,随着反应器高度的增加,不同HRT条件下群落丰度变化不同.在HRT为4 h时,群落丰度沿反应器高度方向逐渐增大,而HRT为1 h时,群落丰度逐渐降低. 通过分析Shannon-Wiener指数可以看出,接种后的污泥中微生物的多样性明显降低,且沿着反应器高度方向,不同HRT条件下群落多样性变化不同. 在HRT为4 h时,群落多样性呈逐渐增加的趋势,而在HRT为1 h时,群落多样性略微降低. 这表明,不同的HRT对微生物群落的丰度及多样性造成影响. 该研究中,在较短的HRT条件下(HRT为1 h),随着污染物浓度的降低,微生物的丰度与多样性都是逐渐降低的,但当HRT较长时(HRT为4 h),微生物群落的丰度与多样性都是逐渐增大的,推测其原因可能是:①反应器进行反硝化反应时反应类型单一,反硝化菌占优势,细菌群落的α多样性降低;②当反硝化反应进行完全时,反应器内一些不参与反硝化反应的微生物(如SRB-硫酸盐还原菌)逐渐生长,微生物群落丰度和多样性反而得到提升.β多样性指标用来比较多组样本之间的差别,图5是利用各样品序列间的进化信息,采用UniFrac距离来比较环境样品在特定的进化谱系中微生物群落的差异,以此来评估β多样性,即对样品两两之间进行比较分析,得到样品间的UniFrac距离矩阵. 从图5可以看出,4 h中部和1 h中部的样品相似度为78.23%,表明两个位置进行着相似的反应. 与动力学相结合分析,不同HRT条件下,反应器底部NO3--N还原反应进行的程度不同,反应器底部NO3--N去除率分别为89.46%(HRJ=4 h)和35.99%(HRT=1 h),二者之间的相似度较低,为70.67%.图5 反应器不同位置群落UniFrac分析Fig.5 UniFrac analyses of samples from different parts of reactor2.3.2 菌群结构空间分布门水平上对微生物分类的结果见图6. Proteobacteria,Bacteroidetes和Firmicutes成为反应体系的优势菌群. 不同的HRT条件下,Proteobacteria所占比例沿高度方向是逐渐减小的,导致这一现象发生的原因是许多已被证实的反硝化菌属于Proteobacteria,沿反应器高度方向NO3--N的浓度逐渐减低,电子受体逐渐减少,Proteobacteria所占比例也随之逐渐减小[24]. 在HRT为4 h,反应器底部及中部NO3--N已被大量去除的情况下,Firmicutes所占比例分别为13.32%和11.68%,在HRT为1 h时比例分别为0.77%和8.58%,推测当NO3--N消耗一定浓度时,Firmicutes所占比例上升. Bacteroidetes沿反应器高度方向所占比例是逐渐增大的,在HRT为4 h时所占比例从5.90%升至20.24%,HRT为1 h时所占比例从3.48%升至11.47%. Chlorobi在1 h底部丰度有明显上升,达12.17%,该细菌能参与反硝化反应[25]. ZHANG等[26]在硫自养反硝化研究中发现了Chlorobi和Chloroflexi,均与反硝化反应有关.注:丰度排前十的菌落,其余归类于others.图6 门水平各样品群落结构分析Fig.6 Taxonimic classification of the bacterial at phylum level注:丰度排前十的菌落,其余归类于others.图7 属水平各样品群落结构分析Fig.7 Taxonimic classification of the bacterial at genus level从属水平的分析可以进一步对微生物进行了解,并可以推断微生物的功能. 图7总结了最具有代表性的菌属. Thiobacillus[27]和Sulfurimonas是最常见的反硝化细菌,能利用NO3--N和NO2--N作为电子受体. Thiobacillus中包括脱氮硫杆菌(Thiobacillus denitrificans)[28],该细菌能够利用单质硫、硫化物及硫代硫酸盐来还原NO3--N[29]. 在HRT为1 h时,反应器底部正进行着反硝化反应,从图7可以看出,此时Thiobacillus丰度达到了最大值,为25.07%. 此次测定结果中,Sulfurimonas是最占优势的反硝化菌. HRT为4 h时,沿反应器高度方向Sulfurimonas丰度由22.54%降至15.31%,推测原因为NO3--N已消耗殆尽,Sulfurimonas的优势逐渐被取代. HRT为1 h时,反应器底部正发生着反硝化反应,因此能从图中看到沿反应器高度方向Sulfurimonas丰度明显上升,由23.09%升至36.02%. Fabisch等[30]在溪流沉积物中发现了Ferritrophicum,推测其可能为铁氧化细菌,在该次试验中,随着反硝化的进行,Ferritrophicum丰度最高达到7.17%,可能与反硝化反应有关. Desulfurella是一种SRB(硫酸盐还原菌)且属于Proteobacteria [31]. SRB具有把硫酸盐、亚硫酸盐、硫代硫酸盐等硫氧化物以及单质硫还原成硫化氢这一生理特性[32]. SRB还原硫化物时除了需要电子受体外,还需要有机物为其提供能量并作为生化反应的电子供体[33],反应装置运行过程中微生物的生长代谢产物为Desulfurella提供了有机碳源. 在4 h中部样品中,该细菌丰度达到最大(17.28%). 可观察到该取样口处S2-质量浓度存在积累现象,且产生量达到峰值(1.25 mgL),这与Desulfurella的丰度升高相对应(见图4). Microbacter细菌在4 h中部样品中丰度较大,对其功能的分析有待进一步研究.3 结论a) 硫自养固定床反应器对水中NO3--N〔(30.45±0.38)mgL〕有着较好的去除效果,当HRT为4和1 h 时,对应的去除率分别为99.74%和98.82%. HRT为1 h 时拟合结果表明,NO3--N的还原符合12级反应动力学模型,NO3--N由溶液向生物膜内的扩散为限制步骤.b) 反应器运行过程中产生的SO42-与理论值接近,SO42-产生量来自于NO3--N 的还原以及DO的消耗. 反应器内S2-由微生物代谢产生的微量有机物还原SO42-产生,其产生量随反应器高度呈现先增加后降低的趋势,因S2-易被空气氧化,出水中其质量浓度小于0.5 mgL.c) 微生物群落结构分布情况与反应器高度有关,HRT的缩短改变了反应器内微生物群落α多样性的变化规律;β多样性分析表明,4 h中部和1 h中部相似度为78.23%,由于反硝化进行程度不同,使得4 h底部与1 h底部相似度仅为70.67%.d) 高通量测序结果表明,Proteobacteria最具有优势,反硝化细菌Sulfurimonas丰度较高,Desulfurella是一种SRB,其丰度的增加与S2-的积累相一致.参考文献(References):【相关文献】[1] ALMASRI M N,KALUARACHCHI J J.Assessment and management of long-term nitrate pollution of ground water in agriculture-dominated watersheds[J].Journal of Hydrology,2004,295(1234):225-245.[2] YESILNACAR M I,SAHINKAYA E,NAZ M,et al.Neural network prediction of nitrate in groundwater of Harran Plain,Turkey[J].Environmental Geology,2008,56(1):19-25.[3] ZHU I,GETTING T.A review of nitrate reduction using inorganicmaterials[J].Environmental Technology Reviews,2012,1(1):46-58.[4] FONSECA A D,CRESPO J G,ALMEIDA J S,et al.Drinking water denitrification using a novel ion-exchange membrane bioreactor[J].Environmental Science & Technology,2000,34(8):1557-1562.[5] 吴芳磊.基于硫自养反硝化的深度除磷脱氮研究[D].哈尔滨:哈尔滨工业大学,2015.[6] KIMURA K,NAKAMURA M,WATANABE Y.Nitrate removal by a combination of elemental sulfur-based denitrification and membrane filtration[J].WaterResearch,2002,36(7):1758-1766.[7] ZHOU Weili,SUN Yejue,WU Bingtao,et al.Autotrophic denitrification for nitrate and nitrite removal using sulfur-limestone[J].Acta Scientiae Circumstantiae,2011,23(11):1761-1769.[8] KOENIG A,LIU L H.Kinetic model of autotrophic denitrification in sulphur packed-bed reactors[J].Water Research,2001,35(8):1969-1978.[9] WANG Yue,BOTT C,NERENBERG R.Sulfur-based denitrification:effect of biofilm development on denitrification fluxes[J].Water Research,2016,100:184-193.[10] 汤丹娜,陈莹,田晓雷,等.硫磺石灰石自养反硝化系统脱氮性能及N2O排放规律研究[J].当代化工,2016,45(12):2810-2812.TANG Danna,CHEN Ying,TIAN Xiaolei,et al.Performance of nitrogen removal and N2O emission law of sulfurlimestone autotrophic denitrification system[J].Contemporary Chemical Industry,2016,45(12):2810-2812.[11] BLAŽKOV Z,TROUSIL V,SLEHOV E,et al.Influence of Fe3+ ions on nitrate removal by autotrophic denitrification using Thiobacillus denitrificans[J].Chemical & Biochemical Engineering Quarterly,2017,31(2):167-172.[12] ZHANG Lili,ZHANG Chao,HU Chengzhi,et al.Sulfur-based mixotrophic denitrification corresponding to different electron donors and microbial profiling in anoxic fluidized-bed membrane bioreactors[J].Water Research,2015,85:422-431.[13] WAN Dongjin,LIU Yongde,WANG Yiyi,et al.Simultaneous bio-autotrophic reduction of perchlorate and nitrate in a sulfur packed bed reactor:kinetics and bacterial community structure[J].Water Research,2017,108:280-292.[14] BUERMANS H P J,DEN DUNNEN J T.Next generation sequencingtechnology:advances and applications[J].Biochimica et BiophysicaActa,2014,1842(10):1932-1941.[15] ZHANG Tong,SHAO Mingfei,YE Lin.454 Pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J].ISME Journal,2012,6(6):1137-1147. [16] ONTIVEROS-VALENCIA A,TANG Youneng,ZHAO Heping,et al.Pyrosequencing analysis yields comprehensive assessment of microbial communities in pilot-scale two-stage membrane biofilm reactors[J].Environmental Science & Technology,2014,48(13):7511-7518.[17] 万东锦,刘会娟,雷鹏举,等.硫自养反硝化去除地下水中硝酸盐氮的研究[J].环境工程学报,2009,3(1):1-5.WAN Dongjin,LIU Huijuan,LEI Pengju,et al.Study on the sulfur autotrophic denitrification of groundwater[J].Chinese Journal of Environmental Engineering,2009,3(1):1-5.[18] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.[19] WAN Dongjin,LIU Yongde,NIU Zhenhua,et al.Perchlorate reduction by hydrogen autotrophic bacteria and microbial community analysis using high-throughput sequencing[J].Biodegradation,2016,27(1):47-57.[20] 刘永德,王依依,万东锦,等.硫自养微生物降解水中低浓度高氯酸盐的研究:反应器效能及微生物种群空间分布[J].中国环境科学,2017,37(8):3142-3150.LIU Yongde,WANG Yiyi,WAN Dongjin,et al.Bio-reduction of perchlorate with low concentration in water by sulfur packed reactor and microbial community spacial distribution analysis[J].China Environmental Science,2017,37(8):3142-3150.[21] MOON H S,AHN K H,LEE S,et e of autotrophic sulfur-oxidizers to remove nitrate from bank filtrate in a permeable reactive barrier system[J].EnvironmentalPollution,2004,129(3):499-507.[22] LIU Huijuan,JIANG Wei,WAN Dongjin,et al.Study of a combined heterotrophic and sulfur autotrophic denitrification technology for removal of nitrate in water[J].Journal of Hazardous Materials,2009,169(123):23-28.[23] 万东锦,刘永德,樊荣,等.硫自养填充床生物反应器去除水中的高氯酸盐[J].环境工程学报,2015,9(11):5267-5272.WAN Dongjin,LIU Yongde,FAN Rong,et al.Sulfur-autotrophic reduction of perchlorate from aqueous solution using a packed bed reactor[J].Chinese Journal of Environmental Engineering,2015,9(11):5267-5272.[24] ZHU Yanping,WU Min,GAO Naiyun,et al.Impacts of nitrate and electron donor on perchlorate reduction and microbial community composition in a biologically activated carbon reactor[J].Chemosphere,2016,165:134-143.[25] KOENIG A,ZHANG Tong,LIU Linghua,et al.Microbial community and biochemistry process in autosulfurotrophic denitrifying biofilm[J].Chemosphere,2005,58(8):1041-1047.[26] ZHANG Lili,ZHANG Chao,HU Hengzhi,et al.Denitrification of groundwater using a sulfur-oxidizing autotrophic denitrifying anaerobic fluidized-bed MBR:performance and bacterial community structure[J].Applied Microbiology & Biotechnology,2015,99(6):2815-2827.[27] KELLY D P,WOOD A P.Confirmation of Thiobacillus denitrificans as a species of the genus Thiobacillus,in the beta-subclass of the Proteobacteria,with strain NCIMB 9548 as the type strain[J].International Journal of Systematic & EvolutionaryMicrobiology,2000,50(2):547-550.[28] ZHANG M,ZHANG T,SHAO M F,et al.Autotrophic denitrification in nitrate-induced marine sediment remediation and Sulfurimonas denitrificans-likebacteria[J].Chemosphere,2009,76(5):677-682.[29] CAPUA F D,AHORANTA S H,PAPIRIO S,et al.Impacts of sulfur source and temperature on sulfur-driven denitrification by pure and mixed cultures of Thiobacillus[J].Process Biochemistry,2016,51(10):1576-1584.[30] FABISCH M,BEULIG F,AKOB D M,et al.Surprising abundance of Gallionella-related iron oxidizers in creek sediments at pH 4.4 or at high heavy metal concentrations[J].Frontiers in Microbiology,2013,4:390.[31] 刘建丽,赵吉,武琳慧.乌梁素海湖滨湿地硫酸盐还原菌种群分布[J].农业环境科学学报,2016,35(2):358-363.LIU Jianli,ZHAO Ji,WU Linhui.Abundance and diversity of sulfate-reducing bacteria in littoral wetland of Wuliangsuhai[J].Journal of Agro-Environment Science,2016,35(2):358-363.[32] 李俊叶,黄伟波,王筱兰,等.硫酸盐还原菌的筛选及生理特性研究[J].安徽农业科学,2010,38(29):16092-16093.LI Junye,HUANG Weibo,WANG Xiaolan,et al.Research on screening and physiological characteristics of sulfate reducing bacteria[J].Journal of Anhui Agricultural Sciences,2010,38(29):16092-16093.[33] 肖利萍,张镭,李月.硫酸盐还原菌及其在废水厌氧治理中的应用[J].水资源与水工程学报,2011,22(1):45-49.XIAO Liping,ZHANG Lei,LI Yue.Application of sulfate-reducing bacteria to anaerobic wastewater treatment[J].Journal of Water Resources & Water Engineering,2011,22(1):45-49.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HQ30d便携式多参数测定仪
1 用途:
HQ 30d便携式测定仪在与IntelliCAL 电极一起使用时,可以连接超纯电极、标准电极以及野外使用的坚固型电极,测定多种参数,例如pH 值、ORP、电导率、盐度、总溶解固体、溶解氧和钠离子等。
可用于市政污水、工业污水、饮用水、环境监测、教育、科研等领域的水质分析。
2 HQ系列数字化分析仪
2.1 工作条件
2.1.1电源要求:两种供电模式(1)AA 碱性电池或镍氢电池(4个)
(2)外置的USB/DC 电源适配器:100–240 V, 50/60 Hz输入; 4.5~7.5 V (7 VA) 输出(外置电源及USB适配器需要选配)
2.1.2 存储温度:–20 ~+60 °C
2.1.3 操作温度:0 ~+60 °C操作湿度:90% (无冷凝)
2.2技术性能指标
2.2.1 语言:支持多国语言
★2.2.2显示:可显示1个或2个电极的读数
(1)pH电极:pH、mV、温度
(2)电导率电极:电导率、盐度、总溶解固体、温度
(3)溶解氧电极:溶解氧、压力、温度
(4)LBOD电极:溶解氧、压力、温度
(5)ORP氧化还原电位:mV、温度
★2.2.3 数据内存:500 组数据
★2.2.4 数据存储:校准数据都存贮在日志中。
在“按下即读”模式和间隔测量模式时
可自动存储。
在“连续读数”模式时需手动存储。
★2.2.5 数据传输:通过USB转接下载至电脑或U盘,读数时同步传输
2.2.6 温度自动修正/ 补偿
2.2.7 锁定显示数据功能
★2.2.8 自动识别校准标准:
2.2.9 键盘:通过USB外接键盘
★2.2.10防水性:测定仪外壳可在1 米深的水中浸泡30 分钟(IP67)2.2.11 尺寸:19.7×9.5厘米
2.2.12 重量:330 g
430 g (安装了四节AA 碱性电池)
3 HQ系列IntelliCAL 电极技术性能指标
3.1温度
量程:-10.0~110.0℃
分辨率:0.1℃
准确度:±0.3℃
3.2 pH电极
量程:0~14(包括标准可填充式电极和可填充式超纯电极)
2~14(标准凝胶电极)
分辨率:0.1/0.01/0.001可选
★精度:pH超纯电极0.01
pH电极0.02
3.3 ORP/氧化还原电位
量程:-1200~+1200 mV
分辨率:0.1mV
3.4 钠离子电极:
量程:0.023mg/L(1×106M)~23,000mg/L(1M)Na+
分辨率:2/3/4选大者
3.5 电导率电极
电导率:
量程:0.01 μS/cm ~200.0 mS/cm
分辨率:0.01 μS/cm(最大0.05μS/cm)
电阻率:
量程:2.5~49欧姆·厘米
分辨率:0.1欧姆·厘米(最大0.05欧姆·厘米)
盐度:
量程:0~42g/kg或‰
分辨率:0.01ppt
总溶解性固体:
量程:0.0~50.0g/L
分辨率:0.1 mg/L
3.6 溶解氧
量程: 0.05–20.0 mg/L
1–200% 饱和度
分辨率:0.01 mg/L,CDC401电极新增自动盐度校准功能(仅适用于HQ40d)
溶解氧的准确度:在0.1–8 mg/L时,为±0.1 mg/L
大于8.0 mg/L时,为±0.2 mg/L
★3.7 BOD5/CBOD(使用荧光法溶解氧的LBOD电极):
量程: 0.05–20.0 mg/L
分辨率:0.01 mg/L
海拔限制:最大5000米
★防水性:标准电极:IP68,3米深的水中,24小时内有防水效果(可填充液电极不浸没)
坚固性电极:IP68,30米深的水中,24小时内有防水效果
LBOD电极:IP65
★电缆长度:标准型电极(LBOD除外):1米或3米
坚固性电极:5、10、15、30米
LBOD电极:1.8米
尺寸:标准电极(LBOD除外):长度17.8厘米
坚固性电极:长度21.6厘米
LBOD电极:长×宽,19.1×4.1厘米
重量:标准电极(1米电缆)
pHC281 76g pHC101 76g pHC301 76g
MTC101 76g MTC301 76g ISENa381 76g
CDC401 104g LDO101 127g
坚固性电极(5米电缆)
P HC101 1182g MTC101 1182g
CDC401 1210g LDO101 1232g
LBOD 225g
4 仪器配置(HQ30d控制器+电极)
4.1HQ 系列IntelliCAL 电极
4.1.1系列pH电极
★(1)适用于超纯水分析的pH电极:pHC28101 1 米电缆;pHC28103 3米电缆
(2)标准型凝胶pH电极:pHC10101 1米电缆;pHC10103 3米电缆
(3)坚固型凝胶pH电极:pHC10105 5米电缆;pHC10110 10米电缆;pHC10115 15米电缆;pHC10130 30米电缆
(4)标准型可填充电极:pHC30101 1米电缆;pHC30103 3米电缆
4.1.2 ORP/氧化还原单位电极
(1)标准型凝胶电极:MTC10101 1米电缆;MTC10103 3米电缆
(2)坚固型凝胶电极:MTC10105 5米电缆;MTC10110 10米电缆;MTC10115 15米电缆;
MTC10130 30米电缆
(3)标准型可填充电极:MTC30101 1米电缆;MTC30103 3米电缆
4.1.3 电导率电极
(1)标准型:CDC40101 1米电缆;CDC40103 3米电缆
(2)坚固型:CDC40105 5米电缆;CDC40110 10米电缆;CDC40115 15米电缆;
CDC40130 30米电缆
4.1.4 钠离子电极
(1)标准型可填充电极:ISENa38101 1米电缆;ISENa38103 3米电缆;
★4.2.5 LDO(荧光法溶解氧)电极
(1)标准型:LDO10101 1米电缆;LDO10103 3米电缆
(2)坚固型电极:LDO10105 5米电缆;LDO10110 10米电缆;LDO10115 15米电缆;
LDO10130 30米电缆
(3)BOD 电极:
★LBOD10101 LDO 电极带搅拌和1.8米电缆
4.2 其他配件:
(1)系列pH电极校准标准液、电导率电极校准标准液、溶解氧荧光帽等
(2)USB适配器及电源
修订日期2010-1。
