极性转换及其在有机合成中的应用(俞凌翀)思维导图
有机化学基础思维导图

合成化学Chapter 2-1

34
Example 3 在合成中的应用
35
5. 芳环的烷基化反应(Alkylation of aromatic compounds) 1)芳基卤化物与烯醇盐的反应 (Reactions of aromatic halide with enolates)
Example
Mechanism
36
关键是要有形成苯炔的条件。
此类化合物比较活泼,一般用乙醇钠等中强。
Eg:
14
应用一 :制备取代丙酮(甲基酮)类化合物
单取代丙酮
二取代丙酮
15
应用二 :制备螺环化合物
16
3. 选择性 (Selectivity)
3.1 Chemoselectivity (C-alkylation & O-alkylation)
Example 1
5
6
7
稳定碳负离子的反应
在有机合成中的应用
烷基化反应: E = 烷化剂
缩合反应: E = 醛、酮、酯等
增长碳链
合成b-羟基羰基化合物 or ,b-不饱和羰基化合物
Michael 加成:E =
合成1,5-二羰基化合物
8
烷基化反应 (alkylation)
亲电试剂 (Electrophilic reagent)为烷基时与碳负离子发生的反应。
37
2)Friedel-Craft Reaction
Note: 当烷基化试剂的碳原子数在3个以上时,烷基化往往会发生异构化, 其原因是碳正离子发生重排,另外,当芳环上连有吸电子基团,烷基化 很难发生,甚至不发生。
38
6、 不对称酮的选择性烷基化反应 (Selective alkylation of asymmetric ketones)
高中化学 常见物质的相互转化思维导图

物质的相互转化和制备主要是指以氧气、氢气、碳、硫、磷等为代表的非金属单质,以铝、镁、锌、铁、铜为代表的金属单质,以一氧化碳、二氧化碳等为代表的非金属氧化物,以氧化铜、氧化铁等为代表的金属氧化物,以盐酸、硫酸、碳酸等为代表的酸,以氢氧化钠、氢氧化钙等为代表的碱,以氯化钠、碳酸钠、碳酸氢钠、碳酸钙等为代表的盐,等等物质之间的相互和制备.各类物质间的转化关系:(1)金属+金属氧化物(碱性氧化物)(2)碱性氧化物(可溶)+水碱(可溶)(3)碱(难溶)碱氧(难溶)+水(4)酸+碱盐+水;(5)非金属+非金属氧化物(酸性氧化物)(6)酸性氧化物(易溶)+水酸(易溶)(7)酸(易挥发/难溶)酸氧+水(易挥发/难溶)从纵向来看,金属碱性氧化物碱盐,其中金属元素相同。
非金属酸性氧化物酸(含氧酸)盐,其中非金属元素相同。
横向:(8)金属+非金属(无氧酸)盐(9)碱氧+酸氧(含氧酸)盐(10)含氧酸盐碱氧+酸氧(11)盐+盐两种新盐交叉:(12)酸+碱氧盐+水(13)碱+酸氧盐+水(14)酸+盐新酸+新盐;(15)碱+盐新碱+新盐(16)金属+酸盐+(17)金属+盐新盐+新金属(18)金属+盐新盐+新金属(置换反应)氢氧化钠与氢氧化钙的制备:(1)NaOH的制备方法一:Na2O+H2O==2NaOH方法二:Na2CO3+Ca(OH)2==CaCO3↓ +2NaOH (2)Ca(OH)2的制备方法:CaO+H2O==Ca(OH)2常见物质的相互转化:Na→Na2O→NaOH→Na2CO3C→CO→CO2→H2CO3Fe→Fe2O3→Fe2(SO4)3→Fe(OH)3→FeCl3S→SO2→SO3→H2SO4(单质硫不能直接转化为SO3)。
九年级化学知识点归纳 思维导图

九年级化学知识点归纳思维导图化学作为一门自然科学,研究的是物质的组成、性质以及它们之间的变化。
在九年级学习化学的过程中,我们接触到了许多重要的知识点。
为了更好地理解和记忆这些知识,我们可以使用思维导图的方法整理归纳,将复杂的概念和关系以图形化的方式呈现,提升学习效果。
以下是九年级化学知识点的思维导图。
1. 物质的分类- 纯物质和混合物- 纯物质:由同一种组分构成,具有一定的固定化学组成和独特的性质。
分为元素和化合物。
- 元素:由相同类型的原子组成,不能分解为其他物质。
- 化合物:由两种以上不同类型的原子按照一定比例结合而成,可以分解为其他物质。
- 混合物:由两种或两种以上的物质按照一定比例混合而成,可以根据混合的均匀程度分为均质混合物和非均质混合物。
2. 常见物质的性质和变化- 物质的性质:可以分为物理性质和化学性质。
- 物理性质:物质在不改变化学组成的情况下表现出来的性质,如颜色、硬度、熔点、沸点等。
- 化学性质:物质在发生化学反应时表现出来的性质,如燃烧性、氧化性等。
- 物质的变化:可以分为物理变化和化学变化。
- 物理变化:物质在不改变化学组成的情况下改变外观或状态的变化,如溶解、凝固、融化等。
- 化学变化:物质在与其他物质发生反应时改变化学组成和性质的变化,如燃烧、酸碱中和等。
3. 原子和分子- 原子:是物质的基本粒子,由质子、中子和电子组成。
- 质子:带有正电荷的基本粒子,质量约为1个原子质量单位。
- 中子:不带电荷的基本粒子,质量约为1个原子质量单位。
- 电子:带有负电荷的基本粒子,质量很轻,约为1/1836个原子质量单位。
- 分子:是原子的组合形式,是能保持化学性质的最小粒子。
4. 元素周期表- 元素周期表:是按照原子序数的大小和元素性质进行排列的表格。
元素周期表按照一定的规律分为周期和族。
- 周期:是指元素周期表中横向的行,代表了元素的原子轨道。
周期越往下,电子层越多。
- 族:是指元素周期表中纵向的列,代表了元素的化学性质。
有机化学第四版(董先明)思维导图 羧酸、羧酸衍生物和取代羧酸

酸性水解可逆
碱性水解不可逆
酯的水解。水解生成羧酸和醇。
1.水解反应
酯基所连的R基体积增大则水解活泼性下降,吸 电子效应增强,则水解活泼性提高
酸性水解:羧酸和铵盐 碱性水解:羧酸盐和胺(氨)
酰胺的水解。不可逆
水解活泼性:酰卤>酸酐>酯>酰胺
要用酚合成酯可以用酰氯来合成
酰卤的醇解:生成酯和卤化氢。
酸酐的醇解:生成酯和羧酸
酰卤,命名为某酰某卤
酸酐,根据相应羧酸命名为某酸酐
酯,某酸某醇(酚)酯,一般省略醇或酚
酰胺,命名为某酰胺,当酰胺氮原子有取代基时 将取代基名称标明出来,如N,N-二甲基苯丙酰胺
一般低级酰卤和酸酐室温下是液体,较高级的室 温下是固体。
液体酰卤和酸酐具有挥发性和刺激性气味
酰卤和酸酐
酯分子的对称性和极性都小于酰卤和酸酐
5.酯缩合反应
化学性质
羧酸衍生物的性质
烃基化产物在稀碱溶液中加热脱去羧基生成酮, 称为酮式分解
在浓碱溶液中脱去羰基生成羧酸,称为酸式分解
在强碱如醇钠的作用下生成烯醇盐,烯醇盐与卤 代烃或酰卤发生亲核取代反应,得到在α-碳原子 上的烃基化或酰基化的产物
酮式和烯醇式的互变平衡
乙酰乙酸乙酯合成法 丙二酸酯合成法
还原和氧化。用四氢硼钠把羰基酸还原为羟基 酸,用四氢铝锂将羰基酸还原为二醇。醛酸可以 氧化为二元羧酸。酮酸难以氧化
羰基酸的代表化合物
随着M增大,同系列脂肪羧酸的沸点上升,水溶 性下降
羧酸的酸性强于碳酸
连有推电子作用的烃基酸性减弱,连有吸电子基 团则相反
酸性
一元羧酸中甲酸的酸性最强
羧酸的性质
1.羧酸的酸性
乙二酸的酸性强于甲酸
合成子与极性转换

30
5.3 合成子的分类和加合
d 合成子
试剂 d0 CH3SH d1 KCN d2 CH3CH=O d3 (Li)C≡CCH2NH2 负离子 CH3S-(杂原子硫有活性) 合成子 官能团 d0合成子 -C-S-
CN-(杂原子N使C1活化) d1合成子 -CN
-CH CHO(α-C原子活化)d2合成子 2 -C≡CCH NH 2 2
5.3.1 合成子的分类
极性转换中的合成子可分为: 1. 供电子合成子(以d代表); 2. 受电子合成子(以a代表)两大类。
27
5.3 合成子的分类和加合
见下列有机分子的基本结构:
X0 1
2 4 5 3 FG
FG: 官能团; X0表示促使分子发生极性转换的金属原子或杂原子(Li, Mg等,或-O,-N,-S等)。
24
5.2 合成子极性转换的具体应用
O SH SH S S H Li THF, -40 oC O S C S Br O H CHCl3 HCl(g)
S
S
S OH
S OH
S
S
O
O OH OH
25
O
5.2 合成子极性转换的具体应用
这里:
S S
O
相当于
也是酰基负离子的等价物。
26
5.3 合成子的分类和加合
33
5.3 合成子的分类和加合
(2)烷基a合成子
如二甲硫醚与溴甲烷的加成物能起下列离子化反应:
(CH3)3SBr
(CH3)3S
+ Br
此正离子在反应中,由于甲基被活化成Me+而起了甲基化 的作用;不是a1合成子,而是烷基a合成子,产物无官能 团。
有机合成第5章

R'
R O OH S S N O R R' H3+O R O R'
Corey在前列腺素F1a, E1和A1合成中的应用
S Br S C5H11 H S C5H11 S O2N NC S C5H11 S
S S
H H
1mol BuLi THF
Cl -50oC
I
S S
H Cl
1mol BuLi THF
S S
Tetrahedron Letters, 44 (2003), 5601–5604
O
O N O O PINO
简要机理:
N OH O NHPI
O PINO R H R
O
O X R R
O X
O R X NHPI R
O X PINO
5. 4 总结
5.1 极性反转概念及意义 5.2 极性反转实现 5.3 羰基的极性反转 5.3.1 硫代缩醛衍生物1.3-二噻烷 5.3.2 其它缩醛衍生物 5.3.3 金属酰基化合物 5.3.4 烯醇缩醛衍生物 5.3.5 Stetter Reaction 5.3.6 羰基的自由基极性反转反应
作业:
掌握极性反转概念及意义
熟练掌握羰基的两种极性反转及其合成中的应用: 1.3-二噻烷和Stetter Reaction
ArCHO Ar
O
[ArCO-Ni(CO)3] -Li+
O Ar
OH Ph Ar
5.3.4 烯醇缩醛衍生物
H H O 类烯醇化 Y H 金属化 Y M 亲电反应 Y E 水解 H E O
Y= -SPh, -SEt, -SPr-i
Li SPh
D2O
H D SPh H O CO2O H D
人教版选修5第一章第一节有机化合物的分类

结构简式 答题
键线式
酯水解 酯基变为羧酸钠和醇
有H+时,羧酸 若成酚还要在消耗氢氧化钠成酚钠
醛醛加成
一个醛基断碳氧双键,一个断醛基相邻第一个碳上的碳氢键
催化剂 加热
加聚反应 通过双键或者三键来形成高聚物 镍加热 加氢气都是这个条件,如苯环加氢气 溴化铁 苯环上取代溴
按常见性质分类
羧基 -COOH 酚羟基 -OH
酯 -COO- 水解 卤代烃 -Cl 水解
都生成碳碳双键
反应类型
取代反应
酯水解 水解反应
氢氧化钠溶液,加热 稀硫酸溶液‘加热
官能团:酯基
卤代烃水解 氢氧化钠水溶液,加热 官能团:卤素原子
酯化反应 浓硫酸、加热、可逆号 官能团:羧基和羟基
溴代反应
苯环上 烷基上
溴化铁做催化剂 在光照条件下
官能团:溴原子
硝化反应 苯环上
邻位 浓硫酸 加热 对位 浓硫酸 加热
水:2n-1 二酸和二醇 水:n-1 自身有羧基和羟基
形成酯基
羧基和羟基
小分子为水 形成肽键 羧基和氨基
水:n-1 形成酚醛树脂 苯酚和甲醛
缩聚反应
反应类型
课堂小结
总结
提速
结束
书写
合成路线
个数 具体看等效氢
同分异构体
化学方程式
有机推断模 拟题
切入点
信息:醛醛加成
推断切入
官能团:三键、醛基 反应条件:氢氧化钠 反应条件:银氨溶液 反应条件:氢气、镍 反应类型:缩聚反应
醇的催化氧化
产物:羧酸 催化剂 氧气 加热
产物:羧酸 高锰酸钾等强氧化剂
产物:一水 二银 三氨气 羧酸铵 新制银氨溶液 水浴加热 产物:三水 一氧化亚铜 羧酸钠 新制氢氧化铜悬浊液 加热
《生物》必修一思维导图(思维导图)
组成元素:主要由C、H、O、N等元素组成,有些含有S、Fe等
相对分子质量:几千~100万以上,属于大分子化合物
基本单位:氨基酸,大约有20多种
结构通式
第二章:组成细胞的分子 第三章:细胞的基本结构
生命活动的主要主要承担者-蛋白质
结构特点是至少含有一个氨基(NH2和一个羧基(COOH),并且都有一个有一个 氨基(NH2和一个羧基(COOH)连接在同一个碳原子上,将氨基酸区别为不同的 种类的依据是R基(侧链基团)。
探索历程
20世纪六十年代发现细胞膜并非是静态的
1970年细胞融合等实验表明细胞膜具有流动性 1972年桑格和尼克森提出流动镶嵌模型为大多数人所接受
生物膜的流动镶嵌模型
磷脂双分子层构成了膜的基本支架,具有流功性。蛋白质 分子有的镶在磷脂双分子层表面,有的部分或全部嵌入磷 脂双分子层中有的贯穿于整个磷脂双分子层。大多数蛋白 质分子也是可以运动的。
人
多细胞
缩手反射
人
多细胞
免疫
应激性 应激性
反射等神经活动需要多种细胞的参 与
免疫作为机体对入侵病原微生物的 种防御反应,需要淋巴细胞的参与
细胞:细胞是生物体结构和功能的基本单位啊
组织:由形态相似,结构、功能相同的细胞联合在一起的细胞
器官:不同的组织按照一定的次序结合在一起而构成器官
生命系统的结构层次
(3)空间结构
一条或几条肽链通过一定的化学键互相链接在一起,形成具有复杂空间结构的蛋 白质。高温、强酸强碱和重金属都会破坏蛋白质的空间结构。
结构的多样性:
组成蛋白质的氨基酸数目不同、氨基酸的种类不同、氨基酸排列顺序不同、多肽链的盘曲、折叠方 式及其形成的空间结构千变万化
第六章 合成子与极性转换

C2-H----5精品O文档C----2--H5
• 当卤代烷分解成R+与X-时,烷基是正离子,当 它通过格式试剂再分解时,烷基就成了负离 子,这就称为极性转换;
• 同一基团既可成为正离子,也可成为负离子。
-----精品文档------
• 极性转换(英文:Umpolung),也称极性 翻转、极性反转、极性颠倒,指有机化学 中官能团极性的改变,是有机合成重要概 念之一。
R
C O + CN-
H+
R’
-----精品文档------
R
OH
C
R’ CN
• 小常识:
氰化氢有剧毒,且挥发性较大(沸点 26.5℃),故在羰基化合物与氰化氢加成时,为 了避免直接使用氰化氢,通常是把无机酸加入醛 (酮)和氰化钠水溶液的混合物中,以便HCN一生 成就立即与醛(酮)作用,但在加酸时应注意控 制溶液的pH值,使之始终偏于碱性(pH约为8), 以利于反应的进行。
RC O
• 技术关键:选用什么样的A与B? • 针对本例:B用-CN,即:
为何不用酸
O
NaOH
OH
H + HCN
CH3-CH
CN
• 问题:反应机理?
-----精品文档------
• A用:
OC2H5 -C-CH3
H
C2H5OCH=CH2
OH
+ CH3-CH
CN
O
CH3-CH CN
OC2H5 C-CH3 H
• 6.1.3 合成子与稳定性 • 先看下列分子的拆开:
R OH C
R’ X
R
C O + X- + H+
高考化学知识思维导知识关联梳理

高考化学知识思维导知识关联梳理化学是一门需要理解、掌握和应用知识的科学学科,在高考中占据了重要的地位。
为了在高考中取得好成绩,我们不仅需要对化学知识点进行系统学习,还需要培养良好的思维能力和知识间的关联性。
本文将通过思维导图的方式,梳理高考化学知识的思维导知识关联,以帮助考生更好地掌握和应用化学知识。
思维导图一:物质结构与性质在化学学科中,我们首先需要了解物质的结构与性质的关系。
物质结构的不同将决定其性质的不同。
例如,原子核中质子和中子的数量决定了元素的同位素和同位素的放射性。
电子的排布决定了物质的化学性质,如原子的化学键和分子的形状等。
思维导图二:化学反应与能量变化化学反应是物质变化的基础,不同的化学反应会伴随不同的能量变化。
化学能量和化学反应热力学是高考中的重要内容。
例如,燃烧反应的放热性质和放热量的计算、电化学反应电势和电解质量的计算等。
思维导图三:化学反应与化学平衡化学反应不仅涉及能量变化,还涉及化学平衡的问题。
平衡反应可以通过化学平衡定律和反应速率等问题来描述。
了解平衡反应的条件和影响因素,以及如何通过改变温度、压力等条件来促进或抑制反应进程,是高考中需要掌握的知识。
思维导图四:离子反应与溶液化学离子反应是溶液化学的基础,涉及了酸碱中和、盐类反应、氧化还原反应等内容。
此外,了解溶液浓度、离子平衡、溶液的酸碱性质等相关知识也是高考中的重要内容。
思维导图五:有机化学基础有机化学是高考化学的重要组成部分。
了解和掌握有机化合物的命名规则、结构特点以及它们的常见反应是必不可少的。
此外,有机合成和功能有机化合物等内容也是高考考点。
思维导图六:化学分析与实验技术高考化学中也涉及了化学分析和实验技术的内容。
化学分析包括定性分析和定量分析,需要了解分析方法和仪器的使用。
实验技术则需要了解常见的实验操作、实验室安全知识和实验结果的处理方法。
通过以上的思维导图,我们可以清晰地看到高考化学知识的思维导知识关联。
有机化学第四版(董先明)思维导图 醇、酚、醚
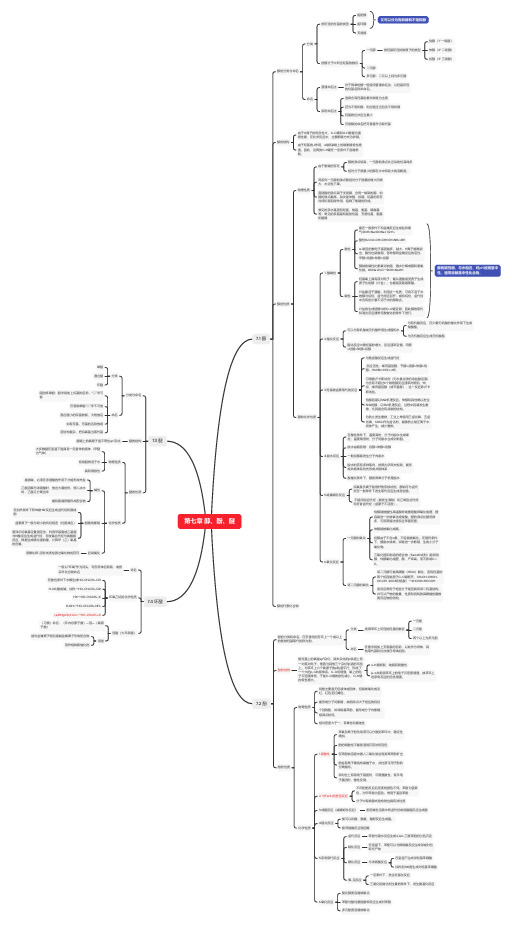
第七章醇、酚、醚7.1 醇醇的分类与命名分类按所连的烃基的类型脂肪醇脂环醇芳香醇又可以分为饱和醇和不饱和醇按醇分子中所含羟基的数目一元醇按羟基所连的碳原子的类型伯醇(1° 一级醇)仲醇(2° 二级醇)叔醇(3° 三级醇)二元醇多元醇:二元以上则为多元醇命名普通命名法对于简单的醇一般使用普通命名法,以羟基所连的烃基名称来命名。
系统命名法选择含有羟基的最长碳链为主链若为不饱和醇,则主链应当包含不饱和键羟基的位次应当最小芳香醇的命名把芳香基作为取代基醇的结构由于O原子的电负性大,C-O键和O-H键都为强极性键,在化学反应中,主要断键方式为异裂。
由于羟基的-I作用,α碳和β碳上的碳氢键极性增强。
因此,这两类C-H键在一定条件下容易断裂。
醇的性质物理性质由于氢键的存在醇的沸点较高,一元醇的沸点比近似的烃高得多相对分子质量小的醇在水中有较大的溶解度。
同系列一元醇的沸点随相对分子质量的增大而增大,水溶性下降。
直链醇的沸点高于支链醇,含同一碳架的醇,伯醇的沸点最高,其次是仲醇,叔醇。
烷基的存在对缔和有阻碍作用,阻碍了氢键的形成。
常见的亲水基团有羟基、羧基、氨基、磺酸基等;常见的亲脂基有脂肪烃基、芳香烃基、酯基和醚键醇的化学性质1. 酸碱性酸性能在一般条件下和金属反应生成盐和氢气:ROH+Na=RONa+1/2 H₂酸性H₂O>R-OH>CH≡CH>NH₃>RHα-碳连的推电子基团越多,越大,H离子越难脱出,酸性也就越弱。
各种醇同金属反应的活性:甲醇>伯醇>仲醇>叔醇醇钠的碱性比氢氧化钠强,遇水分解成醇和氢氧化钠。
RONa+H₂O→ROH+NaOH碱性羟基氧上具有孤对电子,能从强酸接受质子生成质子化的醇( 盐)。
也能接受路易斯酸。
盐能溶于强酸。
利用这一性质,可将不溶于水的醇与烷烃、卤代烃区别开,或将烷烃、卤代烃中含有的少量不溶于水的醇除去。
盐的生成使醇中的C-O键变弱,因此醇的取代和消去反应通常在酸催化的条件下进行。
第四章 有机化合物的极性转换

C3的极性转换,人们研究了很多种化合物
S S R Li H 3C H 3C S S R Li S S S Li R' S R R' S R' S Li R'=CH3 , C2H5 R R' S Li(Na) R'=CH3 , C2H5
S S
C10H21
C4H9Li
CH3 CH2 CH2 C6H5 > 95%
亚硝胺锂可以和酯肪醛酮、芳香醛酮、芳环酮发生亲核加成
NO N C6H5CHO NO N C(CH3) 3 CH SCH3 Li CH2 (CH2) 4 C O C(CH3) 3 CH SCH3 CH C6H5 OH NO N HC HO C C(CH3) 3 SCH3 (CH2)4 CH2 80% 90%
Li CH3
常用试剂: R
R
C O
N
C R
H Li
C
N C R
H Li
N3 C C 6H 5 R(ON)N
H Li
X 2P
N
CH3 CHPh Li
S C NR CH2Li
C Li
N=C C6H5 C : Li H + CO2
N=C C6H5 CHCO2Li
H2O
NH2 C6H5 CH COOH
氨基α-碳原子的极性转换试剂——亚硝胺锂 可以和卤代烷反应,生成在氨基α-碳上烷 基取代的衍生物。
CH2=CHOC2H5 R O Li
呋喃α-锂化合物可以和各种亲电试剂作用, 生成物水解得1,4-二酮
H3C O (1)C4 H9 Li (2) Br O OH O H 3C O O H
物化部分思维导图及总结
aRed aOx
对任意反应: cC dD gG hH
E
Ox|Red
()
Ox|Red
()
E
RT zF
ln
aGg aHh aCc aDd
(2)由电池电动势求反应的热力学函数
rGm zEF rGm RT ln Ka
由电动势E及其温度系数求反应的r H m和r Sm
例:习题 1 第十三章 表面物理化学
一.基本概念、基本知识
1、表面自由能 保持相应的特征变量不变,每增加单位表面积时,相应热力学函数的增
值。
U ( A )S,V,nB
H ( A )S,P,nB
F ( A )T,V,nB
G ( A )T,P,nB
表面自由能狭义定义: 保持温度、压力和组成不变,每增加单位表面积时,Gibbs 自由能
不同点:两者的物理意义不同,所用单位不同。
3、弯曲表面下的附加压力
液面水平,附加压力 Ps 等于零。
液面为凸形,附加压力 PS 大于零
液面为凹形,附加压力 PS 小于零
杨-拉普拉斯公式:
pS
2 R'
曲率半径 R’越小,附加压力越大
凸面 R’大于零,凸面下液体所受压力比平面下要大
凹面 R’小于零,凹面下液体所受压力比平面下要小 附加压力与毛细管中液面高度的关系: 2 cos gh
lg A | z z | I
离子平均质量摩尔浓度: m def (mm )1
a
m m
aB
(
m m
)
7、电导测定的应用计算
(1)计算弱电解质的解离度和解离常数
有机反应中的极性转化方法

最后是还原消除过程, 钯有机物分解, 形成新的 <— < 键, 金属钯游离出来, 完成了催化过程 ! 6-— 9:— 6-= " 6-— 6-= . 9:; 采用 @’A3B*3 反应, 通过极性转换作用, 也可以得到与 [45] 0&1&23 反应类似的偶联产物 !
!!#
卤素互换
我们知道, 有机碘化物的活性比有机溴化物强, 作者曾
! ! " #, ""二噻烃的还原反应
[’] 认为, (, )"二噻烷烃经 *+,$- .& 处理, /— 0 键被 #$%%&% 这是 氢解, 按 1234526"7+5+8&,29 反应分解成亚甲基衍生物,
代替 /3$66$,92, 或 12344"7&9:;,$5 还原羰基化合物的一种好 方法 ! 反应中酮羰基碳原子由荷正电荷, 在与 (, )"二噻烃作 用后通过极性转换, 原来羰基碳原子的正电性几乎表现不出 来, 这是由于碳原子和硫原子的电负性几乎相等 ! 当 ?, E"二溴噻吩分子中与溴相连的碳原子略显正电荷, H 与 与叔丁基锂在低温下发生反应后, 溴原子异裂 ( G5 离去) 负电荷的叔丁基形成溴化物, 锂离子取代溴原子配位芳环, 反应中心的碳原子通过极性转换由正电荷变为负电荷 ! 式左 的稳定性应该大于式右的稳定性:
与三甲基硅基乙炔锂发生离子型反应, 再经三氟乙酸处理得
[(>] 到氢化衍生物 !
与碱金属作用生成 /=> 的甲苯溶液在无氧无水条件下, 通过这种极性转换的方式, /=> 负离子, /=> 负离子与一些活泼 卤代物发生亲核取代反应得到相关衍生物:
