专题七 化学计算
2019中考化学专题七 化学式与标签计算

化学
2.(2018 绥化)我国是全球海域可燃冰试开采连续产气时间最 长的国家。已知某种可燃冰的化学式为 CH4· 8H2O,请回答下 列问题。 (1)这种可燃冰的相对分子质量是 160 。 (2)这种可燃冰中各元素的质量比为 m(C)∶m(H)∶m(O)= 3∶5∶32 (填最简整数比)。 (3)这种可燃冰中碳元素的质量分数为 7.5% 。
返回
化学
3.(2018 金平区模拟)五水合硫酸铜(化学式:CuSO4· 5H2O)也 被称作硫酸铜晶体,俗称蓝矾或胆矾,具有催吐、祛腐、治 风痰壅塞、癫痫、牙疳、口疮、痔疮、肿毒的功效,并且有 一定的副作用。
返回
化学
(1)五水合硫酸铜中由 四 种元素组成,原子个数比:N(S)∶ N(O)∶N(H)= 1∶9∶10 。 %;将 25 g 五 (2)五水合硫酸铜中硫酸铜的质量分数为 64 溶质质量分数为 12.8 %。
素。 研究表明, 成人日摄入铝量应控制在 4 mg 以下。 若每 1000 g 调和好的炸油条面中含明矾 1.58 g,每根油条用面 50 g,则 食用 2 根油条所摄入铝的质量为 9 入控制量。 mg, 超过了成人的日摄
返回
化学
图文表格型计算 例2 (2018 泰安)儿童缺锌会引起食欲不振、 发育不良等症状。 如图为某补锌口服液说明书的部分信息,图中葡萄糖酸锌化 学式已不完整,请根据相关信息回答下列问题:
返回
化学
(1)C2H5OH 中碳元素和氢元素的质量比为 4∶1 数比表示)。 (2)这瓶乙醇试剂的质量为 (用最简整
160
g。
(3)现要配制 2 000 g 溶质质量分数为 40%的乙醇溶液, 需要乙 醇试剂的质量为 800 g,需要这种乙醇试剂 5 瓶。
中考化学二轮复习专题七化学计算题

11. (2018徐州)工业上采用离子交换膜电解槽电解饱和食盐水,可得到高 浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生 产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算: (1)用37%的浓盐酸配制200 g 7.3%的盐酸,需要加水(密度为1 g·mL-1) ________mL。(计算结果保留一位小数) (2)采集该化工厂电解槽中的NaOH溶液20 g,向其中滴入所配制的盐酸, 当溶液的pH=7时,消耗盐酸100 g,判断电解槽中NaOH溶液是否达到 高浓度标准。(写出计算过程)
(1)67.5% (2)解:设100 g硫酸溶液中硫酸的质量为x
Zn+H2SO4=== ZnSO4+H2↑
98
2
x
0.25 g
98 = x
x=12.25 g
2 0.25g
硫酸溶液中硫酸的质量分数为
12.25g
×100%=12.25%
100g
答:所用硫酸溶液的溶质质量分数为12.25%。
2. (2017徐州)徐州地区石灰石资源丰富。某化学兴趣小组称取4.0 g石灰
(1)溶解时玻璃棒的作用是_________________。 (2)实验中加入过量CaCl2溶液的目的是___________________________。 (3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确 到0.1%)。 【提示】分析图中实验过程,判断“滤渣”的成分,找出代入化学方程式 计算的纯净物质量。
实验序号
①
②③Biblioteka 样品的质量/g10
20
30
生成气体的质量/g
0.1
0.2
0.25
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
2013~2014学年第一学期期末复习资料 专题七 化学计算

2013~2014学年第一学期期末复习资料专题七化学计算第Ⅰ部分(选择题)单项选择题(每题只有一个....选项符合题意。
)1.右图为市售盐酸标签的部分内容,其中36.0%~38.0%表示该盐酸中()A.氯元素含量 B. 溶质溶解度C.溶质质量分数 D. 溶质式量2.青篙素(化学式为C15H22O5)是治疗疟疾的特效药。
关于青篙素的说法正确的是()A.不属于有机物B . 28.2g 青篙素中含碳元素的质量为18gC.一个青篙素分子含有11 个氢分子D . C 、H 、O 三种元素的质量比为15 : 22 : 53.实验室需要100g 质量分数为3 %氯化钠溶液,配制过程中相关描述正确的是()A.用3g 氯化钠与100g 水配制得到B.直接用手抓取氯化钠C.氯化钠直接放于天平托盘上称取D.用50g 质量分数6%氯化钠溶液与50g 水配制得到4.右图为NaCl、KNO3的溶解度曲线,下列说法正确的是()A.KNO3的溶解度一定大于NaCl溶解度B.20℃时,50g水最多能溶解31.6gKNO3C.t℃时,NaCl和KNO3的饱和溶液的溶质质量分数相等D.50℃的NaCl饱和溶液降温到20℃时变成不饱和溶液5.2013年4月,四川雅安发生了7.0级地震。
震后灾区人民的饮用水可用漂白粉消毒。
漂白粉的制取原理为:2Cl2+x Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,此反应中x的数值为()A.1 B.2 C.3 D.46.(2013玉林)某兴趣小组的同学将一块不纯的铁片5.6g投入到足量的稀盐酸中,充分反应后生成了0.2g气体,则该铁片中混有的杂质一定不可能是()A.铝和锌B.镁和锌C.镁和铜D.锌和铜7.(2013黔东南州)图中“﹣氧原子”,“﹣氢原子”,“﹣碳原子”.根据微观粒子反应图示,下列结论不正确的是()A.物质X是由碳元素和氧元素组成B.X物质中碳、氧元素的质量比是3:8C.每个X分子由1个碳原子和2个氧原子构成D.物质X的相对分子质量是44g8.(2013宜宾)下列有关计算结果错误的是()A.K2Cr2O7中Cr元素的化合价为+6价B.NH4NO3中氮元素的质量分数为35%C.C2H4与C4H8中碳元素和氢元素的质量比相同,均为6︰2D.已知20℃时,NaCl的溶解度为36,据此计算出该温度下其饱和溶液的质量分数为26.5%9.(2013.盐城市)将7.3g已部分氧化的锌粉,加入到98g10%的稀硫酸中,恰好完全反应。
2021年中考化学(人教版)复习专题七 化学计算(34PPT)

【示范题4】2.3 g铁和M的混合物与足量的盐酸反应,生成0.2 g氢气,则M可能
是
(B)
A.镁
B.铝
C.碳
D.铜
【及时巩固】
由C、H两种元素组成的化合物叫烃,碳原子个数在4以下的烃在常温常压下通常
为气体,常温常压下有C2H4和另一种烃组成的混合气体中碳元素质量分数为87%,
则混入的烃可能是
( B)
入的杂质为 ( C )
A.碳酸镁
B.碳酸氢钠
C.碳酸钠
D.碳酸镁和碳酸氢钠
方法三:极值法
所谓“极值法”是用于混合物组成判断的题目或对数据不足时的计算,先
采用极端假设法(即为某一成分或者为恰好完全反应)以确定混合体系中各物质
的名称、质量分数、体积分数,找到极大值、中间值、极小值中的两者,来判断
出正确结果。
A.13.6 g
B.13.4 g
C.103.6 g
D.11 g
【及时巩固】
有一包Mg和MgO的混合物共12.8 g,与一定量的稀硫酸恰好完全反应,所得溶液
中溶质的质量为48 g,则原混合物中氧元素的质量为 ( B )
A.9.6 g
B.3.2 g
C.2.4 g
D.1.6 g
方法二:极端假设法
“极端假设法”主要是针对数据不足无从下手的计算,或针对混合物组成
【示范题1】(2020·青岛中考)常用的医用酒精是体积分数为75%的乙醇溶液, 可用于杀菌消毒。乙醇分子的模型如图所示,其中 代表碳原子, 代表氢原 子, 代表氧原子。下列有关乙醇的说法不正确的是( C ) A.乙醇的化学式为C2H6O B.乙醇的相对分子质量为46 C.乙醇中碳元素和氢元素的质量比为12∶1 D.乙醇是一种有机物
初中化学计算题专题复习课件大全(共54张PPT)

故氮原子个数=(400× 3.8%) ÷14=1.09,
B正确。
例3:
跟50千克硝酸铵NH4 NO3里所含 氮元素质量相等的碳酸 氢铵 NH4 HCO3的质量是多少?
解: 设碳酸氢铵的质量为 x
所含氮元素质量相等
2N N 50kg 100% x 100% NH4 NO3 NH4 HCO3 x 98.8kg
96g
<
反应后O元素质量
=88g×(32/44)+54g×(16/18)
=112g
所以M中一定含有C,H,O元素
根据化学方程式计算应注意的问题:
化学方程式要配平, 需将纯量代方程 关系式对关系量, 计算单位不能忘
关系量间成比例,
解设比答要牢记
第3课:有关溶液的计算
第1课:根据化学式的计算
有关溶液 的计算
例4:
质量相同的SO2和SO3中,
所含氧元素的质量比是: (A)2 : 3 (B)5 : 6 (C)6 : 5 (D)1 : 1
解:方法(1):
SO 2中氧元素的质量分数 50% SO 3中氧元素的质量分数 60%
SO 2 1g 50% 0.5g 5 SO 3 1g 60% 0.6g 6
所含氧元素的质量比为 5 : 6 选B。
方法(2)关系量法:
SO 2 2O 64 1 x : y 5: 6 32 x
SO 3 3O 80 1 48 y
FeO FeO3/2 FeO4/3
例 5.在FeO、Fe2 O 3 、 Fe3 O 4三种化
合物中,与等质量铁元素相结合的氧元 素的质量比为( A ) A 6∶9∶8 B 12∶8∶9 C 2∶3 ∶6 D 1∶ 3∶4
专题七化学计算公式 基础题

[Failed to download image : /ueditor/themes/default/images/spacer.gif]专题07 化学计算公式一、有关化学式的计算1、相对分子量:各元素相对原子质量与原子个数乘积之和如:CaCO3的相对分子量=钙的相对原子质量×钙原子个数+碳的相对原子质量×碳原子个数+氧的相对原子质量×氧原子个数=40+12+16×3=1002、各元素质量比:各元素相对原子质量与原子个数乘积比如:H2O中各元素的质量比=氢的相对原子质量×氢原子个数:氧的相对原子质量×氧原子个数=1×2:16×1=1:83、某元素的质量分数:如:NaOH中O的质量分数=4、某元素质量:化合物质量×化合物中该元素的质量分数如:100g氢氧化钠中氧元素的质量=100g×40%(上面已经算出氧的质量分数)=40g 二、溶液里的相关计算(一)溶液、溶质、溶剂间的关系溶质的质量分数=溶质的质量=溶液的质量×溶质的质量分数溶剂的质量=溶液的质量-溶质的质量=溶液的质量×(1-溶质的质量分数)溶液的质量=(二)溶解度的相关计算1、一定温度下,某饱和溶液溶质的溶解度(S):2、溶解度与溶质的质量分数间的关系(饱和溶液中):溶质的质量分数=3、由溶解度的定义推导的比列关系:(饱和溶液中)(三)溶液稀释的计算m(浓溶液)×ω(浓溶液)=m(稀溶液)×ω(稀溶液)m(溶液)=ρ(溶液)×V(溶液)m(加水)=m(稀溶液)-m(浓溶液)三、化学方程式的相关计算(一)根据化学方程式计算的解题步骤:①设未知量②书写出正确的化学方程式③写出有关物质的相对分子质量、已知量、未知量④列出比例式,求解⑤答。
比如:要制取4克氢气,需要多少克锌?解:设需要锌的质量为x。
2020年高考化学二轮专题复习综合训练:(七) 化学计算 Word版含答案

分别为( )
A.a=10,b=9.2
B.a<10,b>9.2
C.a>10,b<9.2
D.a>10,b=9.2
5.设 NA 为阿伏加德罗常数的值。下列说法正确的是 A.1.6 g 由氧气和臭氧组成的混合物中含有氧原子的数目为 0.1NA B.0.1 mol 丙烯酸中含有双键的数目为 0.1NA C.标准状况下,11.2 L 苯中含有分子的数目为 0.5NA D.在过氧化钠与水的反应中,每生成 0.1 mol 氧气,转移电子的数目为 0.4NA
3.设 NA 表示阿伏加德罗常数的值,下列说法正确的是
( )
A.标准状况下,22.4 L C2H2、C2H6 的混合气体与 22.4 L C2H4 中所含原子总数均为 6NA
B.标准状况下,11.2 L12C16O 和 14N2 的混合气体中所含中子数和原子数的差值为 6NA
C.常温下,1 L pH=14 的 NaOH 溶液中由水电离出的 OH-数为 NA
A.0.08 mol·L-1
B.0.04 mol·L-1
C.0.02 mol·L-1
D.0.01 mol·L-1
8.下列指定微粒的数目相等的是( )
A.等物质的量的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有的共用电子对数
C.同温、同压、同体积的 CO 气体和 NO 气体含有的质子数
D.等物质的量的铁和铝分别与足量盐酸完全反应时转移的电子数
酸溶液来说,浓度越大,密度越大,故 <1,因此 b<9.2。
5.A O2 和 O3 都只由氧元素组成,1.6 g O2 和 O3 的混合物中氧原子质量为 1.6 g,物
质的量为 0.1 mol,A 正确;丙烯酸(
中考化学化学计算题

上一页
目录
下一页
试计算: (1)生成氢气的质量; (2)粗锌中锌的质量分数; (3)恰好完全反应后所得溶液中溶质的质量分数。
上一页
目录
下一页
解:(1)根据质量守恒定律,生成氢气的质量是 8 g+93.7 g-101.5 g=0.2 g(1 分)
上一页
目录
下一页
(2)设粗锌中锌的质量为 x,充分反应后生成硫酸锌的质量为 y。
106
100
117
x
10.0 g y
110060=10.x0 g x=10.6 g(1 分) 110107=10.y0 g y=11.7 g(1 分
当恰好完全反应时,所得溶液中 NaCl 的质量分数为
11.7 g+(11.1 g-10.6 g) 11.1 g+100.0 g+98.9 g-10.0 g×100%=6.1%。(1 分)
×100%=10%(1 分)
答:C 点时所得溶液的溶质质量分数为 10%。
上一页
目录
下一页
11.(2020·十堰)称取 NaCl 和 Na2CO3 的固体混合物 11.1 g,加入 100.0 g 水配成溶液后,而其中逐渐加入一定浓度的 CaCl2 溶液。所加 CaCl2 溶液 的质量与生成沉淀的质量关系如图所示。(提示:Na2CO3+CaCl2=== CaCO3 ↓+2NaCl)
答:当恰好完全反应时,所得溶液中溶质的质量分数为 6.1%。(1 分)
上一页
目录
下一页
反应流程类 12.(2020·三市一企)鸡蛋壳中的主要成分是碳酸钙,小华为检测鸡蛋 壳中碳酸钙的含量,进行的实验及实验数据如图所示。请回答下列问题: (信息:鸡蛋壳中其他成分与稀盐酸接触不产生气体)
微专题七++电离平衡常数的计算-2024年高考化学二轮复习课件

已知:N2H5++NH3=NH4++N2H4,N2H4+CH3COOH=N2H5++CH3COO-,下列
酸性强弱顺序正确的是( D )
A.N2H5+>N2H4>NH4+ C.NH3>N2H4>CH3COO-
B.N2H5+>CH3COOH>NH4+ D.CH3COOH>N2H5+>NH4+
解析:根据复分解反应的规律,强酸能制得弱酸,根据酸碱质子理论,给出质子(H+) 的物质是酸,则反应N2H4+CH3COOH=N2H5++CH3COO-中,酸性:CH3COOH> N2H5+,反应N2H5++NH3=NH4++N2H4中,酸性:N2H5+>NH4+,故酸性:CH3COOH >N2H5+>NH4+,答案选D。
【典例研磨】
1、H2A为二元酸,其电离过程为:H2A=H++HA-,HA-=H++A2-。常温时,向20mL 0.1mol/L H2A水溶液中逐滴滴加0.1mol/L NaOH溶液,混合溶液中H2A、HA-和A2-的
物质的量分数(δ)随pH变化的关系如图所示。下列说法正确的是( C )
A. H2A的Kal的数量级为10-1
【典例研磨】
1、室温下,在1 mol·L-1的某二元酸H2A溶液中,存在HA-、A2-的物质的量分数随pH
变化的关系如图所示,下列说法错误的是( A )
A.0.1 mol·L-1 NaHA溶液中:c(OH- )>c(H+)
B.室温下,HA-=A2-+ H+的电离平衡常数Ka= 10-3 C.在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA- ) D.H2A的电离方程式为H2A=H+ +HA-,HA-=A2-+H+
2019年中考化学专题复习训练七:计算综合(无详解)
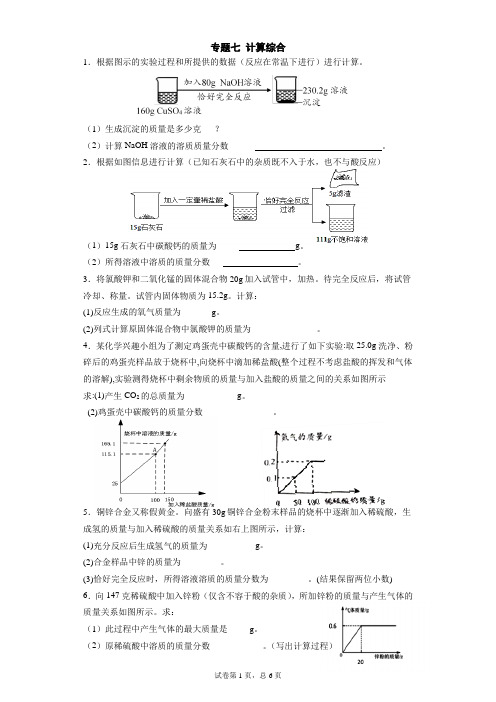
专题七计算综合1.根据图示的实验过程和所提供的数据(反应在常温下进行)进行计算。
(1)生成沉淀的质量是多少克___?(2)计算NaOH溶液的溶质质量分数______ 。
2.根据如图信息进行计算(已知石灰石中的杂质既不入于水,也不与酸反应)(1)15g石灰石中碳酸钙的质量为_____ g。
(2)所得溶液中溶质的质量分数___ 。
3.将氯酸钾和二氧化锰的固体混合物20g加入试管中,加热。
待完全反应后,将试管冷却、称量。
试管内固体物质为15.2g。
计算:(1)反应生成的氧气质量为_______g。
(2)列式计算原固体混合物中氯酸钾的质量为_______________。
4.某化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,进行了如下实验:取25.0g洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示求:(1)产生CO2的总质量为____________g。
(2)鸡蛋壳中碳酸钙的质量分数________________。
5.铜锌合金又称假黄金。
向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢的质量与加入稀硫酸的质量关系如右上图所示,计算:(1)充分反应后生成氢气的质量为___________g。
(2)合金样品中锌的质量为_________。
(3)恰好完全反应时,所得溶液溶质的质量分数为_________。
(结果保留两位小数) 6.向147克稀硫酸中加入锌粉(仅含不容于酸的杂质),所加锌粉的质量与产生气体的质量关系如图所示。
求:(1)此过程中产生气体的最大质量是_____g。
(2)原稀硫酸中溶质的质量分数____________。
(写出计算过程)7.实验室加热氯酸钾和二氧化锰的混合物28g制取氧气,完全反应后剩余固体质量为18.4g,请计算:(1)生成氧气的质量;(2)原混合物中氯酸钾的质量。
8.我市某地石灰石资源丰富,化学兴趣小组的同学为了测定该石灰石中碳酸钙的质量分数,用托盘天平称取了5份石灰石样品,分别加入各盛有200.0克稀盐酸的烧杯中充分反应(假设杂质不反应),得如下实验数据:实验编号 1 2 3 4 5 石灰石样品的质量/g 12.5 25.0 37.5 50.0 62.5生成CO2的质量/g 4.4 7.5 13.2 17.6 17.6分析上述实验数据并回答:(1)实验编号为_______的实验数据有明显错误。
有关化学计算知识点总结

有关化学计算知识点总结化学计算是化学的一个重要分支,它涉及到化学反应的定量计算、质量和体积的关系以及化学物质的摩尔计算等内容。
化学计算的重要性在于它能够帮助我们准确地预测化学反应的结果,为实验设计和数据解释提供依据。
1. 化学计算的基本概念化学计算是指利用数学方法,根据各种化学原理和规律进行化学问题的计算。
它是化学理论与实践相结合的重要环节。
2. 化学计算的基本单位在化学计算中,最基本的单位有两种,一种是质量单位,另一种是体积单位。
在质量单位中,常用的单位有克、毫克、克和千克。
其中,1克=1000毫克、1千克=1000克。
在体积单位中,常用的单位有升(L)和毫升(mL)。
其中,1升=1000毫升。
3. 物质的摩尔计算摩尔是化学中最基本的计量单位,它代表物质的量。
摩尔的定义是具有6.022×10^23个单位物质的数量,这个数量通常称为阿伏伽德罗常数。
利用阿伏伽德罗常数,可以将物质的质量和分子数之间进行转换。
具体的计算公式如下:n= m/M其中,n代表物质的摩尔数,m代表物质的质量,M代表物质的摩尔质量。
从这个公式可以看出,物质的质量和摩尔数之间是可以相互转换的。
4. 化学反应的平衡计算在化学反应中,往往需要进行平衡计算,以确定反应物的摩尔量和生成物的摩尔量。
平衡计算的基本原则是反应物和生成物的摩尔比应该符合反应方程式。
在进行平衡计算时,首先需要根据反应方程式确定反应物和生成物的摩尔比。
然后,根据已知的物质的摩尔量和摩尔比进行计算,以确定其他物质的摩尔量。
5. 化学反应的计算量化学反应的计算量包括反应物的质量、生成物的质量、反应物的摩尔量和生成物的摩尔量。
这些计算量可以根据给定的条件和反应方程式进行计算。
在进行化学反应的计算时,一般需要遵循以下步骤:(1)根据反应方程式确定反应物和生成物之间的摩尔比。
(2)根据已知的物质的摩尔量,使用平衡计算方法确定其他物质的摩尔量。
(3)根据摩尔量和摩尔质量之间的关系,计算物质的质量。
初中化学复习专题七化学计算 (总结)

专题七化学计算一、有关化学式的计算常用的计算公式(以化合物A m B n为例)1、相对分子质量=A的相对原子质量×m+B的相对原子质量×n注:计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。
×100%2、A的质量分数=注、利用上述公式计算时,某元素的原子个数应写在该元素符号前面,不能写在右下角。
3、AB元素的质量比:=注:计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
4、A元素的质量 ==化合物(A m B n)的质量×A的质量分数5、混合物中某物质的质量分数(纯度)= ×100%或== ×100%【例1】(2009·烟台)2008年下半年发生的毒奶粉事件,是不法分子在牛奶或奶粉中添加了有毒的三聚氰胺造成的。
三聚氰胺化学式为C3H6N6,是一种重要的化工原料。
(1)三聚氰胺的相对分子质量为,碳、氢、氮三种元素的质量比为,氮元素的质量分数为。
(2)检测食品中蛋白质含量的传统方法是:通过检测食品中氮元素的含量,推算其蛋白质含量。
例如,若检测到牛奶中的氮元素质量分数≥0.46%,即为蛋白质含量检测合格。
某种不合格牛奶中氮元素的质量分数为0.36%,若向1000g该牛奶中加入2g三聚氰胺,请计算此时牛奶中氮元素的质量分数,并根据计算结果说明不法分子在牛奶中添加三聚氰胺的目的。
二、有关溶液的计算1、溶液中溶质的质量分数溶质质量分数是溶质质量与溶液质量之比。
计算公式:溶质的质量分数== ×100%2、溶解度与溶质质量分数的比较溶解度溶质的质量分数意义物质溶解性的量度,受外界温度影响表示溶液中溶质质量的多少,不受外界条件影响溶剂量要求100g 无要求溶液是否饱和一定达到饱和不一定计算公式溶解度= ×100% ×100%单位克(g) 1联系饱和溶液中溶质的质量分数= ×100%3、溶质质量分数计算的类型(1)溶质、溶剂、溶液的质量与溶质的质量分数的相会换算(2)溶质的质量分数与溶液体积、密度的有关换算溶液的质量==溶液的体积×溶液的密度溶质的质量分数= ×100% (3)溶液的稀释与浓缩的计算4.425.1稀释(浓缩)前后溶质的质量不变,即:浓溶液的质量×浓溶液中溶质的质量分数==稀溶液的质量×稀溶液中溶质的质量分数 【例2】(2009·泰安)制作“叶脉书签”需要lOOg 溶质质量分数为10%的氢氧化钠溶液。
专题七 有关化学式的计算-中考化学专题复习导学案
知识像烛光,能照亮一个人,也能照亮无数的人。--培根
变式训练 II
1. 最近媒体报道油炸含有淀粉的食品会产生有毒的丙烯酰胺【化学式为 C3H5NO】,食用后有害健康。试计 算:
(1) 丙烯酰胺的相对分子质量是
。
(2) 丙烯酰胺中各元素的质量比是
。
(3) 丙烯酰胺中碳元素的质量分数是多少?(计算结果精确至 0.1%)
6. 硫酸亚铁可用于治疗缺铁性贫血。计算:
(1) 硫酸亚铁(FeSO4)中铁、硫、氧三种元素的质量比为
;
(2) 某贫血患者共需补充 1.4g 铁元素,服用的药物中相当于需要硫酸亚铁晶体(FeSO4·7H2O)多少克?
7. 一个青少年正常情况下每天约需 0.8g 钙,若每天从食物中得到 0.6g 钙,其余由吃钙片补充。求: (1) 一个青少年每天需吃钙片补充钙的质量为多少克? (2) 吃葡萄糖酸钙[ (C6 H11O 7 ) 2 Ca ]可以补充人体所需钙,葡萄糖酸钙分子由多少个原子构成?其中 C、.H、
五、自主检测
1.D 2.A 3.A 4.(1)174 (2)36:7:16:28 (3)41.4%
5. ⑴硝酸铵(NH4NO3)中氮元素的质量分数为: ⑵氮元素的质量: 60kg×35% = 21kg
6.(1) 7:4:8 (2) 设需要硫酸亚铁晶体的质量为 m
m= 6.95g
7. (1) 0.8g − 0.6g = 0.2g
O、Ca 元素的质量比是多少?葡萄糖酸钙的相对分子质量是多少?葡萄糖酸钙中钙的质量分数是多 少? (3) 一个青少年每天需吃含葡萄糖酸钙 85%的钙片多少克?
7 / 10
知识像烛光,能照亮一个人,也能照亮无数的人。--培根
专题七 有关化学式的计算
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中考复习——专题七化学计算学生姓名:﹍﹍﹍﹍﹍任课教师:﹍﹍﹍﹍﹍授课时间:﹍﹍﹍﹍﹍命题:韦日达知识点一、有关化学式的计算常用的计算公式(以化合物A m B n为例)1、相对分子质量=A的相对原子质量×m + B的相对原子质量×n注:计算结晶水合物的相对分子质量时,化学式中的“·”表示相加,而不表示相乘。
×100%2、A的质量分数=注、利用上述公式计算时,某元素的原子个数应写在该元素符号前面,不能写在右下角。
3、AB元素的质量比:=注:计算时一定要写清楚各元素质量比顺序,因顺序不同,比值也不同。
4、A元素的质量 == 化合物(A m B n)的质量×A的质量分数5、混合物中某物质的质量分数(纯度)= ×100%或== ×100%【例1】2008年下半年发生的毒奶粉事件,是不法分子在牛奶或奶粉中添加了有毒的三聚氰胺造成的。
三聚氰胺化学式为C3H6N6,是一种重要的化工原料。
(1)三聚氰胺的相对分子质量为,碳、氢、氮三种元素的质量比为,氮元素的质量分数为。
(2)检测食品中蛋白质含量的传统方法是:通过检测食品中氮元素的含量,推算其蛋白质含量。
例如,若检测到牛奶中的氮元素质量分数≥0.46%,即为蛋白质含量检测合格。
某种不合格牛奶中氮元素的质量分数为0.36%,若向1000g该牛奶中加入2g三聚氰胺,请计算此时牛奶中氮元素的质量分数,并根据计算结果说明不法分子在牛奶中添加三聚氰胺的目的。
【答案】(1)126 6∶1∶14 66.7% (2)0.49% 目的是提高牛奶中含氮量,造成牛奶中蛋白质含量高或合格的假象【解析】(1)C3H6N6的相对分子质量==12×3+1×6+14×6==126碳、氢、氮三种元素的质量比为(12×3):(1×6):(14×6)==6:1:14氮元素的质量分数==×100%=66.7(2)加入三聚氰胺后牛奶中氮元素的质量为1000g×0.36%+2g×66.7%≈4.9g×100%≈0.49%【规律小结】化学式的计算要看清元素符合右下角的数字,这些数字是解题的关键。
【变式训练一】1、酚酞是常用的酸碱指示剂,化学式为C20H14O4。
(1)酚酞是由种元素组成的;(2)酚酞分子中碳原子和氧原子的个数比是;(3)酚酞中碳、氢元素的质量比为(最简整数比)。
2、三聚氰胺化学式为C3H6N6)是一种化工原料,有轻微毒性,计算:(1) 三聚氰胺相对分子质量:(2)三聚氰胺中碳、氢、氮元素的质量比:(3)三聚氰胺中氮元素的质量分数(精确到0.1%)。
知识点二、有关溶液的计算1、溶液中溶质的质量分数溶质质量分数是溶质质量与溶液质量之比。
计算公式:溶质的质量分数== ×100%2、溶解度与溶质质量分数的比较溶解度溶质的质量分数意义物质溶解性的量度,受外界温度影响表示溶液中溶质质量的多少,不受外界条件影响溶剂量要求100g 无要求溶液是否饱和一定达到饱和不一定计算公式溶解度= ×100% ×100%单位克(g) 1联系饱和溶液中溶质的质量分数= ×100%3、溶质质量分数计算的类型(1)溶质、溶剂、溶液的质量与溶质的质量分数的相会换算(2)溶质的质量分数与溶液体积、密度的有关换算溶液的质量==溶液的体积×溶液的密度溶质的质量分数= ×100%(3)溶液的稀释与浓缩的计算稀释(浓缩)前后溶质的质量不变,即:浓溶液的质量×浓溶液中溶质的质量分数==稀溶液的质量×稀溶液中溶质的质量分数【例2】制作“叶脉书签”需要lOOg溶质质量分数为10%的氢氧化钠溶液。
请问:(1)配制时需要氢氧化钠固体的质量是 g.水的质量是 g;(2)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液质量是g。
【答案】(1)10 90 (2)50【解析】(1)氢氧化钠的质量=100g×10%=10g,水的质量=100g-10g = 90g(2)设需要20%的氢氧化钠溶液的质量为x20%x=100g×10%X=50g【规律小结】溶质的质量=溶液的质量×溶质的质量分数,解答稀释题的关键是利用稀释前后溶液中溶质的质量不变。
【变式训练二】1、2008年5月12日四川汶川大地震后,为了预防疫情,防疫人员使用了各种消毒剂对环境进行消毒。
亚氯酸钠(NaClO2)是一种重要的消毒剂。
试计算:(1)亚氯酸钠中Na、Cl、O三种元素的质量之比为_______________。
(2)现要配制质量分数为16%的亚氯酸钠消毒液1500 kg,需要亚氯酸钠________kg。
知识点三、有关化学方程式的计算1、根据化学方程式计算的一般步骤○1根据题意设未知量(用x,Y等字母表示);○2写出正确的化学方程式;○3求出有关物质间的质量比(相对原子质量和或相对分子质量和),并写在相应化学式的下边;○4把已知量和未知量写在相应质量比的下边;○5列出比例式,求未知数;○6简明写出答案。
2、常见的题型有:(1)有关纯净物的化学方程式的计算,即:○1)已知反应物(或生成物)的质量,求生成物(或反应物)的质量;○2已知一种反应物(或生成物)的质量,求另一种反应物(或生成物)的质量。
(2)含杂质(杂质不参加反应)的计算化学方程式反映的是纯净物间的质量关系,若遇到不纯物时,应先把不纯物的质量换算成纯净物质量。
纯物质的质量==不纯物质的质量×纯度=不纯物质的质量×(1-杂质的质量分数)【例3】某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠)。
参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质)。
取样品9.3 g 逐滴加入稀盐酸,生成CO 2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)(1)样品中碳酸氢钠的质量分数。
(2)恰好完全反应时,所得溶液中溶质的质量分数。
【答案】解:设样品中碳酸氢钠的质量为x, 生成氯化钠的质量为yNaHCO 3 + HCl === NaCl + CO 2↑+ H 2O (1分)84 58.5 44x y 4.4 g== x= 8.4 g== y= 5.85 g(1) 样品中碳酸氢钠的质量分数为: ×100% = 90.3%(2) 恰好完全反应时,所得溶液中溶质的质量分数为:×100% = 22.5%答:略(或其他合理解法)。
【解析】解题的关键是找到已知量(二氧化碳的质量)及反应的关键所在,从图中可知,当消耗掉25.1g 稀盐酸时,反应恰好完全,产生二氧化碳的质量为4.4g ,再根据二氧化碳的质量可以求出其它物质的质量。
【规律小结】利用化学方程式进行计算的方法与技巧1、守恒法利用化学反应前后某元素的质量守恒或某种原子(或原子团)的数目和质量守恒,可以使化学计算化难为易,收到事半功倍的效果。
在应用“守恒法”时,要注意巧妙地选择两状态中总值不变的物理8444x 4.4 g 58.544y 4.4 g 5.85 g + (9.3 g - 8.4 g) 9.3 g+25.1 g-4.4 g 8.4 g 9.3 g量建立等式,不纠缠中间过程。
只考虑始终状态,实际上是整体思维在化学中的作用。
2、差量法若题给条件不是某种始量或终量,而是过程前后始量与终量的差值,用“差量法”求解十分简便。
‘‘差量法’’的关键是分析过程前后形成差值的原因,找出差值与已知量、未知量的关系。
【变式训练三】1、取某碳酸钠样品放入烧杯中,加入95.8g 水充分溶解,再向其中加入稀硫酸,反应放出气体的总质量与所加入稀硫酸的质量关系曲线如下图所示,请根据题意解答问题: (1)当加入196g 稀硫酸时,放出气体的质量为 g 。
(2)计算加入的稀硫酸溶液溶质的质量分数为 。
(3)试通过计算求出加入98g 稀硫酸即A 点)时烧杯中溶液溶质的质量分数。
(写出计算过程......)综合检测题一、选择题(每小题4分,共40分) 1、被蚊虫叮咬后,人们往往出现皮肤肿痛。
这是因为蚊虫在皮肤内分泌出的酸性物质〔主要成分是甲酸(CH 2O 2)〕对人的皮肤有较强的刺激作用。
下面关于甲酸的说法中,错误的是( )A .甲酸是由碳、氢、氧三种元素组成的有机物B .甲酸分子中有一个碳原子、两个氢原子和两个氧原子C .甲酸中碳、氢、氧三种原子的个数比为1:2:2D .甲酸中碳、氢、氧三种元素的质量比为6:1:162、将50g20%氯化钾溶液稀释到200g ,稀释后所得溶液中溶质的质量分数是( )A .1%B .5%C .10%D .20%3、当三氧化二铁与四氧化三铁中所含铁元素质量相等时,则三氧化二铁与四氧化三铁的质量比为( )A .3:2B .1:lC .29:42D .30:294、下表是氯化铵在不同温度时的溶解度温度/℃ 20 40 60 800 98 4.4 A 。
加入稀硫酸的质放出气体的质量溶解度/g 40 50 58 68据此数据,判断下列说法正确的是()A.20℃时,氯化铵饱和溶液中氯化铵的质量分数是25%B.20℃时,70g氯化铵的饱和溶液升温至40℃得到不饱和溶液C.40℃时,75g氯化铵的饱和溶液中加入25g水后氯化铵的质量分数为30%D.80℃时,84g的氯化铵饱和溶液降温至60℃时有5g氯化铵析出5、X、Y两元素的相对原子质量之比为7:2,在它们组成的化合物中X与Y的质量比为7:3,则它们组成的化合物的化学式为()A、X2Y3B、X3Y2C、X2Y7D、X3Y76、现有50g溶质的质量分数为10%的硝酸钠溶液,要使其溶质的质量分数增大1倍,可采用的方法是( )A、蒸发掉25g水B、增加5g硝酸钠C、倒掉一半溶液D、增加50g溶液7、常用抗生素“先锋Ⅵ”为粉末状固体,每瓶含“先锋Ⅵ”0.5g,注射时应配成质量分数不高于20%的溶液,则使用时每瓶至少需加入蒸馏水()A.1mL B. 2 mL C. 3mL D. 4 mL8、某有机物在氧气中完全燃烧,生成二氧化碳和水的质量比为22:9,则该有机物可能是()A.C6H12O6B.C3H6C.C2H2D.C2H5OH9、在托盘天平两边各放一只等质量的烧杯,在两只烧杯里分别加入50g溶质质量分数为7.3%的稀盐酸,将天平调节至平衡;然后向左右两烧杯中分别加入一定质量的下列各组物质,充分反应后,天平发生偏转的是()A.1.8g铝粉和1.8g 铁粉 B.4.2g碳酸镁和2g硝酸银C.5.6g铁粉和5.6g 锌粉 D.10g碳酸钙和5.6g氧化钙10、葡萄糖、乙酸(CH3COOH)和尿素[CO(NH2)2]组成的混合物240g,在一定条件下完全燃烧,生成水的质量是()A.48g B.72g C.144g D.无法计算二、非选择题11、(9分)莽草酸(化学式:C7H10O5)是制取抗“H1N1流感”药物“达菲”的原料。
