大肠菌群检测原始记录
67总大肠菌群 大肠菌群分析原始记录

月日时分
样品编号
稀释倍数
样品接种体积ml
初发酵产酸产气管数
有典型菌落平板数
复发酵阳性管数
MPN()
备注
总大肠菌群/大肠菌群分析原始记录(续表)
项目编号: 第 页 共 页
样品编号
稀释倍数
样品接种体积ml
初发酵产酸产气管数
有典型菌落平板数
复发酵阳性管数
MPN()
备注
仪器有效期
年月日
立式压力蒸汽灭菌
YXQ -70A/ BXM -75S QH - YQ - G -114
检定 □校准
年月日
检定 □校准
年月日
初发酵培养时间
月日时分——月ห้องสมุดไป่ตู้时分
培养温度(℃)
分离培养时间
月日时分——月日时分
培养温度(℃)
复发酵培养时间
月日时分——月日时分
培养温度(℃)
温度(℃)
湿度(%)
总大肠菌群/大肠菌群分析原始记录
项目编号: 第 页 共 页
来(采)样日期
年月日
检测日期
年月日
检测项目
分析方法
《生活饮用水标准检验方法微生物指标》GB / T 5750.12-2023/5.1多管发酵法
仪器型号、名称及编号
生化培养箱SPX -150 QH - YQ - G -042
仪器溯源方式
检定 □校准
总大肠菌群原始记录表

总大肠菌群检验数据原始记录
委托书编号:委托单位:
检测项目:总大肠菌群检测依据:GB/T 5750.12-2006 2.1多管发酵法
样品名称:样品数量:
样品编号:样品状态:
收样日期:检测日期:
环境温度:环境湿度:
操作方法:
一、乳糖发酵实验
1、取10ml水样接种到10ml二倍乳糖蛋白胨培养液中,取1ml水样接种到10ml单料乳糖蛋白胨培养液中,另取1ml水样注入到9ml灭菌生理盐水中,混匀后吸取1ml (即0.1ml水样)注入到10ml单料乳糖蛋白胨培养液中,每一稀释度接种5管。对已处理过的出厂自来水,需经常检验或每天检验一次的,可直接种5份10ml水样双料培养基,每份接种10ml水样。
培养温度
培养时间
二倍浓缩乳糖蛋白胨培养液
36±1°C
24h±2h
乳糖蛋白胨培养液
36±1°C
24h±2h
EMB
36±1°C
24h±2h
观察结果
序号
样品编号
乳糖发酵
复发酵
结果报告(MPN/100mL)
10ml
1ml
0.1ml
10ml
1ml
0.1ml
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
操作人:复核人:二、分来自培养:经培养24h后,将产酸产气的发酵管,分别接种于伊红美蓝平板上,36±1°C恒温培养8h-24h,观察形态,挑取数个可疑菌落进行涂片、革兰氏染色、镜检。
总大肠菌群原始记录表

3、将接种管置36±l°C培养箱内,培养24h±2h,如所有乳糖蛋白胨培养管都不产气产酸,则可报告为总大肠菌群阴性,如有产酸产气者,则按下列步骤进行。
二、分离培养:
经培养24h后,将产酸产气的发酵管,分别接种于伊红美蓝平板上,36±1°C恒温培养8h-24h,观察形态,挑取数个可疑菌落进行涂片、革兰氏染色、镜检。
三、证实试验:
挑取可疑管接种乳糖蛋白胨培养液中,置于36±1°C愠温箱中培养24h ±2h,有产酸产气者,即证实有总大肠菌群存在。
培养基
19
20
操作人:复核人:
培养温度
培养时间
二倍浓缩乳糖蛋白胨培养液
36±1°C
24h±2h
乳糖蛋白胨培养液
36±1°C
24h±2h
EMB
36±1°C
24h±2h
观察结果
序号
样品编号
乳糖发酵
复发酵
结果报告(MPN/100mL)
10ml
1ml
0.1ml
10ml
1ml
0.1ml
1
2
3
4
5
6
7
8
9பைடு நூலகம்
10
11
12
13
14
15
16
17
18
总大肠菌群检验数据原始记录
委托书编号:委托单位:
检测项目:总大肠菌群检测依据:GB/T 5750.12-2006 2.1多管发酵法
大肠菌群、沙门氏菌GBT23780检测原始记录
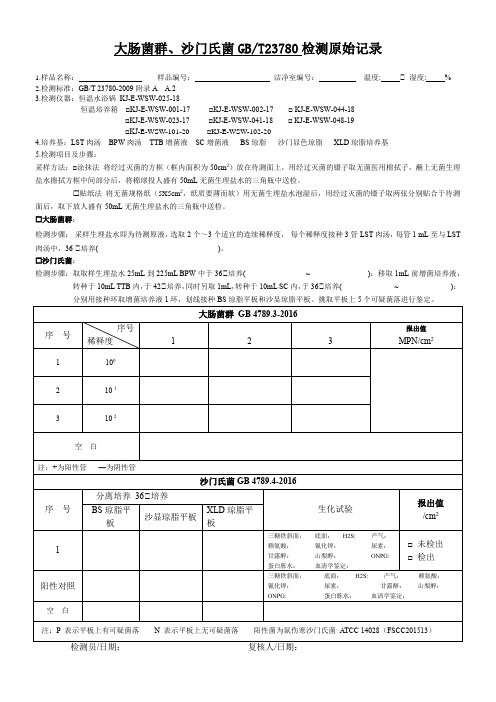
大肠菌群、沙门氏菌GB/T23780检测原始记录1.样品名称:样品编号:洁净室编号:温度: ℃ 湿度: %2.检测标准:GB/T 23780-2009附录A A.23.检测仪器:恒温水浴锅KJ-E-WSW-025-18恒温培养箱□KJ-E-WSW-001-17 □KJ-E-WSW-002-17 □ KJ-E-WSW-044-18□KJ-E-WSW-023-17 □KJ-E-WSW-041-18 □ KJ-E-WSW-048-19□KJ-E-WSW-101-20□KJ-E-WSW-102-204.培养基:LST肉汤BPW肉汤TTB增菌液SC增菌液BS琼脂沙门显色琼脂XLD琼脂培养基5.检测项目及步骤:采样方法:□涂抹法将经过灭菌的方框(框内面积为50cm2)放在待测面上,用经过灭菌的镊子取无菌医用棉拭子,蘸上无菌生理盐水擦拭方框中间部分后,将棉球投人盛有50mL无菌生理盐水的三角瓶中送检。
贴纸法将无菌规格纸(5X5cm2,纸质要薄而软)用无菌生理盐水泡湿后,用经过灭菌的镊子取两张分别贴合于待测面后,取下放人盛有50mL无菌生理盐水的三角瓶中送检。
大肠菌群:检测步骤:采样生理盐水即为待测原液,选取2个~3个适宜的连续稀释度,每个稀释度接种3管LST肉汤,每管1 mL至与LST 肉汤中,36 ℃培养( )。
沙门氏菌:检测步骤:取取样生理盐水25mL到225mL BPW中于36℃培养( ~ );移取1mL前增菌培养液,转种于10mL TTB内,于42℃培养,同时另取1mL,转种于10mL SC内,于36℃培养( ~ );分别用接种环取增菌培养液1环,划线接种BS琼脂平板和沙显琼脂平板。
挑取平板上5个可疑菌落进行鉴定。
检测员/日期:复核人/日期:。
大肠菌群检验原始记录
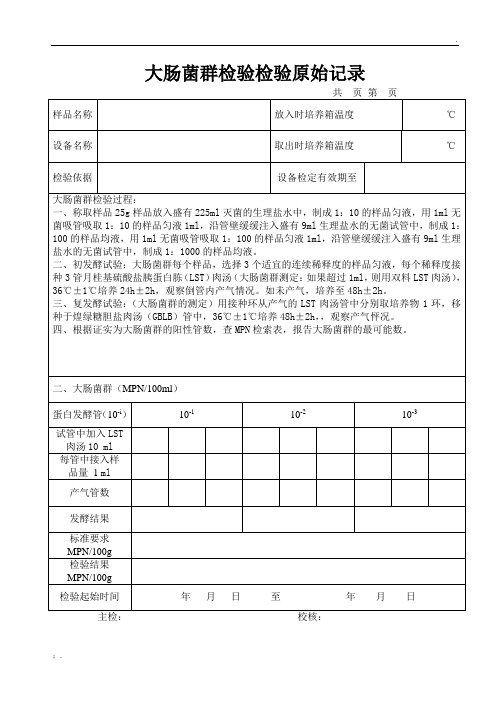
二、大肠菌群(MPN/100ml)
蛋白发酵管(10-i)
10-1
10-2
10-3
试管中加入LST肉汤10ml
每管中接入样
品量1ml
产气管数
发酵结果
标准要求
MPN/100g
检验结果MPN/100g
检验起始时间
年月日至年月日
主检:校核:
大肠菌群检验检验原始记录
共页第页
样品名称
放入时培养箱温度
℃
设备名称
取出时培养箱温度
℃
检验依据品放入盛有225ml灭菌的生理盐水中,制成1:10的样品匀液,用1ml无菌吸管吸取1:10的样品匀液1ml,沿管壁缓缓注入盛有9ml生理盐水的无菌试管中,制成1:100的样品均液,用1ml无菌吸管吸取1:100的样品匀液1ml,沿管壁缓缓注入盛有9ml生理盐水的无菌试管中,制成1:1000的样品均液。
二、初发酵试验:大肠菌群每个样品,选择3个适宜的连续稀释度的样品匀液,每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤),36℃±1℃培养24h±2h,观察倒管内产气情况。如未产气,培养至48h±2h。
三、复发酵试验:(大肠菌群的测定)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(GBLB)管中,36℃±1℃培养48h±2h,,观察产气怦况。
大肠菌群检测原始记录

吉林省昱普检测技术有限公司控制编号:YPJC-JJLS002-2016-1/0 第1页共1页
食品用水中大肠菌群检验原始记录
第页共页基本信息
报告编号:__________ 检验日期:_____________
检验依据:食品微生物学检验大肠菌群计数GB 4789.3—2010
环境温度:__________℃相对湿度:_____________%
培养温度:__________℃
实验操作
平板计数法:将样品稀释液接种到VRBA平板培养基上,置电热恒温培养箱中,培养温度℃,(应为36±1℃),培养时间至(应为24h ),计数典型和可疑菌落总数并将其接种在BGLB肉汤中,置电热恒温培养箱中,培养温度℃,(应为36±1℃),培养时间
检测人:复核人:完成日期:20 年月日。
大肠菌群检验原始记录

初发酵(月桂基硫酸盐胰蛋白胨肉汤,)支)
产气管数(支)
复发酵(煌绿乳糖胆盐
肉汤,
37℃,,48h)
产气管数(支)
10-1
10-2
10-3
检验结果
(MPN/100g)
检验人:复核人:
大肠菌群检验检验原始记录
样品名称
明胶
样品编号
样品状态
生产日期
检验依据
GB4789.3-2010
检验日期
大肠菌群检验过程:
1、称取样品25g样品放入盛有225ml灭菌的生理盐水中,制成1:10的样品匀液,用1ml无菌吸管吸取1:10的样品匀液1ml,沿管壁缓缓注入盛有9ml生理盐水的无菌试管中,制成1:100的样品均液,用1ml无菌吸管吸取1:100的样品匀液1ml,沿管壁缓缓注入盛有9ml生理盐水的无菌试管中,制成1:1000的样品均液。
2、初发酵试验:大肠菌群每个样品,选择3个适宜的连续稀释度的样品匀液,每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤),36℃±1℃培养24h±2h,观察倒管内产气情况。如未产气,培养至48h±2h,如产气着进行复发酵试验。
三、复发酵试验:(大肠菌群的测定)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。
疾病预防控制中心大肠菌群原始记录表

疾病预防控制中心
大肠菌群原始记录
UCDPC/ZYS.W42·68 第页共页
检测项目:□大肠检测依据:□GB4789.3-2010
检测环境:无菌送检日期:检验日期:
检测仪器:电热恒温培养箱□(UCDPC/YQ.C-W )□(UCDPC/YW.C-W )
培养基配制,生理盐水()蒸馏水()BGLB-肉汤()VRBA()
大肠菌群
培养时间:始末
培养时间:h 培养温度:36℃+1
固体样品:无菌称取25克样品剪碎或研磨,加入225毫升生理盐水或蒸馏水中。
备注:典型菌落数大于10个,BGLB最多接种10管。
典型菌落数小于10于,BGLB接种实际典型菌落数计算公式:大肠菌群数=可疑菌落数×BGLB阳性比例管数×稀释倍数
检验者:日期:校核者:日期:。
微生物检验原始记录(大肠菌群)

微生物检验原始记录(大肠菌群)检验原始记录编号:报告类别:微生物共页项目:大肠菌群coliforms 检验地点:样品名称:样品编号:样品状态:符合检验要求;其他境条件:实验依据及步骤GB4789.3-2016样品稀释固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。
依次进行10倍递增稀释。
液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中混匀,为1:10样品匀液。
样品匀液的ph应在6.5-7.5之间,必要时分别用1mol/lNaOH或1mol/lHcL调节。
取1mL1∶10稀释匀液沿管壁缓缓注入9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支无菌吸管反复吹打,使其混合均匀,制成1:100样品匀液。
按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。
从样品匀液制备到样品接种完毕,全过程不得超过15min。
初发酵试验(9管法)每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤)36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。
产气者进行复发酵试验,未产气则继续培养至48±2h,产期进行复发酵试验。
未产气者为大肠菌群阴性。
复发酵试验(证实试验)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。
数据分析与结果一、菌落计数根据证实为大肠菌群的阳性管数,查MPN检索表,报告大肠菌群的最可能数。
大肠菌群-原始记录

检测项目:菌落总数大肠菌群
样品名称
样品编号
样品状态和特性
生产单位
型号规格
使用仪器设备及试验环境
生化培养箱;压力蒸汽消毒锅
菌落总数
GB4789.2-2010
操作过程:
培养基
100
10—1
10—2
10—3
10—4
空白
cfu/ml(g)
平板计数琼脂培养基
注解:为进行此项目测试;+:阳性—:阴性(不产气)
微生物检验原始记录
检测项目:菌落总数大肠菌群
样品名称样品编号样品状态和来自性生产单位型号规格
使用仪器设备及试验环境
生化培养箱;压力蒸汽消毒锅
菌落总数
GB4789.2-2010
操作过程:
1、配制200mL平板计数琼脂培养基于250mL三角烧瓶中,配制0.85%的生理盐水300mL,分别吸取9mL生理盐水置于2个试管中,将三角瓶、试管加塞棉塞,用报纸包好。
煌绿乳糖胆盐肉汤
月桂基硫酸盐胰蛋白胨肉汤
煌绿乳糖胆盐肉汤
月桂基硫酸盐胰蛋白胨肉汤
煌绿乳糖胆盐肉汤
MPN/ml(g)
注解:为进行此项目测试;+:阳性—:阴性(不产气)
主检:检验日期:年月日验讫日期:年月日
6、选择样品匀液10-1、10-2、10-3,分别吸取1ml加入无菌平皿内,分别吸取1mL稀释液(无菌生理盐水)加入平皿内做空白。
7、将15-20mL冷却至46℃的平板计数琼脂培养就倾注平板内,并转动平皿,使其混合均匀,待琼脂凝固后将平皿翻转。
8、将平皿于36±1℃的生化培养箱内培养48h±2h,计数。
培养基
100
10—1
大肠菌群检验原始记录(平板计数法)

XX公司
食品微生物检验记录
检品编号:检品名称:
【大肠菌群】按GB 4789.3-2010第二法平板计数法进行检验
环境条件:温度:湿度:
仪器设备:超净工作台编号:;培养箱(36℃±1℃)编号:
电子天平编号:
培养基与试剂:(配制日期:年月日)
①结晶紫中性红胆盐琼脂(VRBA);②无菌生理盐水;③煌绿乳糖胆盐(BGLB)肉汤
样品操作
取 5 份独立包装的样品,分别取()、、、、做为测试样品,按如下述操作,测得结果;
每份测试样品加入225 mL无菌生理盐水,均质,制成1:10样品均液(调节pH值为6.5~7.5),吸取 1 mL(1:10)样品均液至9 mL灭菌生理盐水中做10倍递增稀释。
选、和稀释液检测,培养基为结晶紫中性红胆盐琼脂(VRBA),℃,培养h(从月日: 到月日: ),
挑选10个不同类型典型和可疑菌落,接种煌绿乳糖胆盐(BGLB)肉汤管,℃培养h(从月日: 到月日: )。
标准规定:(标准号:)
n=5 c= m= CFU/g(mL)M= CFU/g(mL)结论:□符合规定□不符合规定
检验者:复核者:检验日期:。
大肠菌群检验原始记录表

从VRBA平板上挑取10个不同类型的典型和可疑菌落,分别移种于BGLB肉汤管内,36℃±1℃培养24-48h,观察产气情况
。凡是BGLB肉汤管产气,即可报告为大肠菌群阳性。
操作依据
GB4789.3-2010
稀释倍数
a-10倍
b-100倍
c灭菌生理盐水对照
/6.1
VRBA平板
操作依据 GB4789.3-2010
检验日期:
2016 年 月 日
采样依据 GB4789.12010/4.1、 4.2.1二级 采样方案 (n、c、m值 5、0、0)
10的均匀稀释液,编号a 灭菌生理盐水,编号c做
、b2、c1。向上述5个平 ,依次置于36℃±1℃培
养24-48h,观察产气情况
操作依据 B4789.3-2010
/6.1 操作依据 B4789.3-2010
/8.2 操作依据 B4789.3-2010
/8.3
实试验及观察结果 依据
B4789.3-2010 /8.4
肠菌群数的计算 据GB4789.3-2010
/8.5 数据修约依据 789.来自-2010/7.2报告依据 B4789.3-2010
/8.5
培养基)
年月日
。用灭菌吸管取1mla,加入9ml灭菌生理盐水中,混合均匀做成1:100的均匀稀释液,编号b。取1ml灭菌生理盐水,编号c做
为空白对照。
从a、b、c液中,分别前后2次,各吸取1ml移液到2个灭菌平皿中,平皿编号分别为a1、a2、b1、b2、c1。向上述5个平
皿中分别注入凉至46℃的VRBA15ml,混匀待VRBA凝固后,再加3mlVRBA覆盖平板表层,翻转平板后,依次置于36℃±1℃培 养箱中,培养20h。
大肠菌群检测原始记录(平板法)

微生物检验原始记录
检测项目:□大肠菌群
样品名称样品编号样品状态和特性生产单位
使用仪器设备及实验
环境生化培养箱、压力蒸汽灭
菌器
依据GB4789.3
检测项目培养基10010-110-210-310-4空白
平板计数结晶紫中性红胆盐琼脂
证实试验
选择的平板可
疑菌落数
稀释倍数
1 2 3 4 5 6 7 8 9 10
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、
煌绿乳
糖胆盐
肉汤、大肠菌落数CFU/ml(g)
检测人:
检验日期:年月日
验讫日期:年月日。
细菌及大肠菌群检验记录
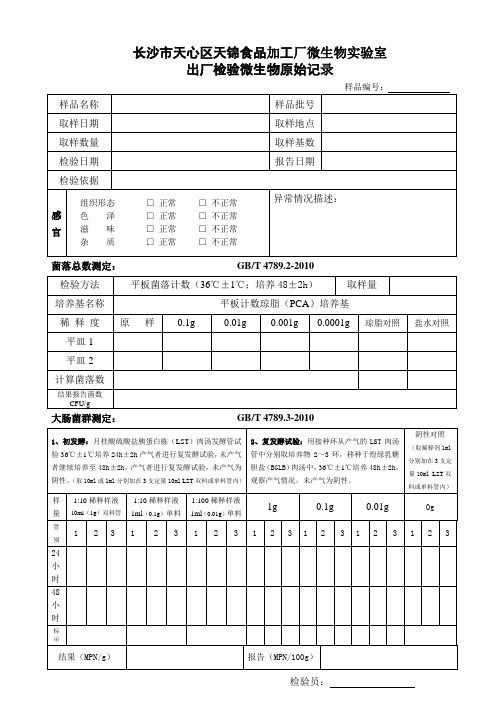
大肠菌群测定:
GB/T 4789.3-2010
2、复发酵试验:用接种环从产气的 LST 肉汤 管中分别取培养物 2~3 环,移种于煌绿乳糖 胆盐 (BGLB) 肉汤中, 36℃±1℃培养 48h±2h, 阴性对照
(取稀释剂 1ml 分别加在 3 支定 量 10ml LST 双 料或单料管内)
阴性。 (取 10ml 或 1ml 分别加在 3 支定量 10ml LST 双料或单料管内) 观察产气情况。未产气为阴性。 样 量
管 别
1:10 稀释样液
10ml(1g)双料管
1:10 稀释样液 1ml(0.1g)单料
1:100 稀释样液 1ml(0.01g)单料
1g
1 2 3 1
Байду номын сангаас0.1g
2 3 1
管 别
1:10 稀释样液
10ml(1g)双料管
1:10 稀释样液 1ml(0.1g)单料
1:100 稀释样液 1ml(0.01g)单料
1g
1 2 3 1
0.1g
2 3 1
0.01g
2 3 1
0g 2 3
1
2
3
1
2
3
1
2
3
24 小 时 48 小 时
标 示
结果(MPN/g)
报告(MPN/100g)
检验员:
0.01g
2 3 1
0g 2 3
1
2
3
1
2
3
1
2
3
24 小 时 48 小 时
标 示
结果(MPN/g)
报告(MPN/100g)
检验员:
长沙市天心区天锦食品加工厂微生物实验室 微生物检验原始记录
大肠菌群检测原始记录表(多管发酵法)
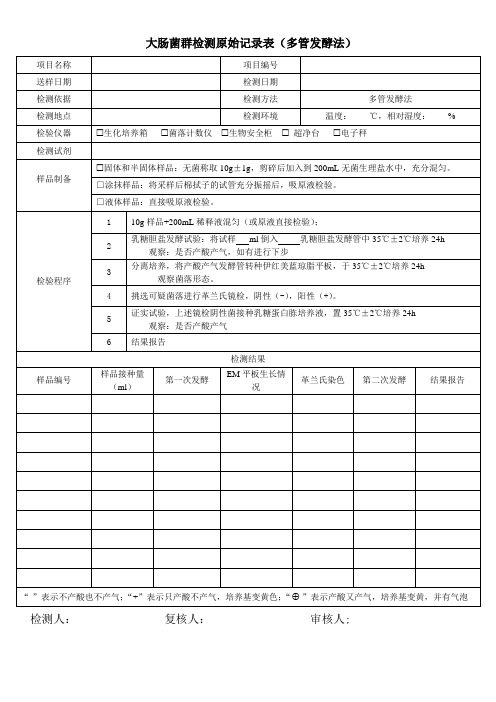
检验程序
样品编号
大肠菌群检测原始记录表(多管发酵法)
项目编号
检测日期
检测方法
多管发酵法
检测环境
温度: ℃,相对湿度: %
生化培养箱 菌落计数仪 生物安全柜 超净台 电子秤
固体和半固体样品:无菌称取 10g±1g,剪碎后加入到 200mL 无菌生理盐水中,充分混匀。 □涂抹样品:将采样后棉拭子的试管充分振摇后,吸原液检验。 □液体样品:直接吸原液检验。
1 10g 样品+200mL 稀释液混匀(或原液直接检验);
2
乳糖胆盐发酵试验:将试样 ml 倒入 乳糖胆盐发酵管中 35℃±2℃培养 24h 观察:是否产酸产气,如有进行下步
3
分离培养,将产酸产气发酵管转种伊红美蓝琼脂平板,于 35℃±2℃培养 24h 观察菌落形态。
4 挑选可疑菌落进行革兰氏镜检,阴性(-),阳性(+)。
5
证实试验,上述镜检阴性菌接种乳糖蛋白胨培养液,置 35℃±2℃培养 24h观察:是否产酸产气 Nhomakorabea6 结果报告
样品接种量 (ml)
第一次发酵
检测结果
EM 平板生长情 况
革兰氏染色
第二次发酵
结果报告
“-”表示不产酸也不产气;“+”表示只产酸不产气,培养基变黄色;“ ”表示产酸又产气,培养基变黄,并有气泡
检测人:
复核人:
审核人;
微生物检测原始记录

菌落总数与大肠菌群检验原始记录
主检:年月日校核:年月日
菌落总数和大肠菌群检测原始记录
主检:年月日校核:年月日
水质微生物检验原始记录
主检:年月日校核:年月日
乳酸菌与大肠菌群检测记录
主检:年月日校核:年月日
致病菌检验原始记录
主检:年月日校核:年月日
XXXX检测有限公司
霉菌和酵母菌检验原始记录
菌落计数:
培养温度:28±1℃培养时间:年月日时--- 年月日时
主检:年月日校核:年月日
XXXX检测有限公司
商业无菌检验原始记录
共页第页
主检:日期:校核:日期:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
发酵试验
阳性管数
报出值 MPN/ml
LST肉汤管初 BGLG肉汤管复
发酵试验
发酵试验
阳性管数
报出值 MPN/ml
LST肉汤管初 BGLG肉汤管复
发酵试验
发酵试验
阳性管数
报出值 MPN/ml
审核:
年月
日
编号: 样品名称:
检验依据:GB/T4789.3-2016 培养开始时间: 年 月 培养结束时间: 年 月
稀பைடு நூலகம்度
1
稀释度
项目 管号
1 2 3 1 2 3 1 2 3
项目 管号
2
稀释度
3
稀释度
4
稀释度
1 2 3 1 2 3 1 2 3
项目 管号
1 2 3 1 2 3 1 2 3
项目 管号
1 2 3 1 2 3 1 2 3
项目 管号
1
2
3
5
1
2
3
1
2
3
检验员:
大肠菌群检测原始记录
批次:
日时
日时
LST肉汤管初 BGLG肉汤管复
发酵试验
发酵试验
恒温时间: h 恒温温度:36℃±1℃
阳性管数
报出值 MPN/ml
LST肉汤管初 BGLG肉汤管复
发酵试验
发酵试验
阳性管数
报出值 MPN/ml
LST肉汤管初 BGLG肉汤管复
发酵试验
