石蜡切片免疫荧光染色方法审批稿
石蜡切片免疫染色实验方法 by HAN

石蜡切片免疫染色实验方法Immunostaining of Paraffin SectionsProcedure:1) Fix tissues for 3 hr on ice in 4% formaldehyde (2.5 ml of Polysciences #18814 made up to 10 ml in 80 mM NaPO4 [3.2 ml of 1 M NaPO4] pH 6.8 containing 0.2 gm of sucrose). Wash for 2 hr in several changes of cool PBS. Infiltrate and embed in paraffin (use automatic processor). Embed in flat end of capped Beem capsules2)Prepare polylysine-coated slides by immersing clean slides, via a stainless steel slide rack, in 400 ml of 50 µg/ml polylysine (Sigma #P1524; make up in 10 mM Tris, pH 8) for 30 min. Cover with foil and let dry overnight at room temperature. Polylysine solution can be stored at -20°C and reused. Store coated slides at 4°C and use within 4 wks.3) Trim away excess paraffin so that block face is 2 - 3 mm2. Set up on an ultramicrotome using glass knives or an old diamond knife with ‘boat’ filled with water. Rapidly cut away surface paraffin, then cut 1 - 2 µm sections. Sections cut easily and should form ribbons. Pickup with the point of a 25 gauge needle and transfer to a drop of water on a polylysine-coated slide. Have two groups of sections per slide. Transfer slide to a 42°C warming plate and leave overnight. [Sections prepared in this manner can also be used for in situ hybridization].4) Deparaffinize sections in xylene (2 x 10 min) using glass slide jars. Transfer to 100% EtOH (2 x5 min), and then to PBS (2 x 5 min). Insert sections in Coplin jars containing ‘TUF’ (Target Unmasking Fluid; Signet Labs [Dedham MA] #1050) preheated to 80-90°C. Incubate in TUF for 10 min at 80-90°C. Let jar cool 5 - 10 min, then rinse two times in ddH2O and two times in PBS.5) Place sections on a staining rack and block with PBS containing 1% BSA for 60 min at room temperature. Pour off, dry with kimwipe around sections. Add diluted (dilute in PBS containing1% BSA; use 10 fold dilutions at start) antibody or preimmune control in one or two drops to sections. Place slides in a closed 150 mm petri dish containing wet filter paper, and place overnight at 4°C.6) The next day, wash five times over 40 min in PBS containing 1% BSA. At this time, can immerse in Pierce ‘peroxidase suppressor’ (Pierce #35000) for 30 min at room temperature, then wash s everal times in PBS containing 1% BSA using squirt bottle to carefully wash around sections. Dry around sections, then add one or two drops of secondary peroxidase-labeled antibody diluted 1/1,000 in PBS containing 1% BSA. Incubate for 60 min at room temp on staining rack. Wash five times over 40 min in PBS using squirt bottle.7)Dry around sections, then add Pierce DAB metal concentrate (Pierce #1856090) diluted 1/10 in stable peroxide substrate buffer (Pierce #1855910). Allow reaction to go for 5 - 15 min, then wash with ddH2O using squirt bottle. Dehydrate slides in 80%, 90% and 2x 100% EtOH (1 min each), then immerse in 2 changes of xylene (1 min each). Mount cover slips on the slides using Permount (Fisher) and examine in the light microscope.2014/8/12 by HAN。
石蜡切片免疫荧光染色方法完整版

石蜡切片免疫荧光染色方法HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】对于石蜡切片:1、烤片:60℃ 60分钟2、脱蜡:二甲苯中Ⅰ脱蜡15分钟→二甲苯Ⅱ脱蜡15分钟→无水乙醇Ⅰ5分钟→无水乙醇Ⅱ5分钟→90%乙醇Ⅰ5分钟→90%乙醇Ⅱ5分钟→70%乙醇5分钟→蒸馏水5分钟→蒸馏水5分钟。
3、抗原修复:高压修复,事先烧开锅中的水,修复盒中加入l柠檬酸钠,(柠檬酸三钠 3g,柠檬酸 0.4g加入1000ml蒸馏水中),上汽后加热10分钟,关火。
修复盒取出,放入装有自来水的瓷缸中缓慢冷却至室温。
2. 去除内源性酶:玻片取出放入湿盒,加3%H2O22(2ml H2O22加入18ml蒸馏水中,现配现用,避光),室温孵育10分钟,PBS洗3次,每次5分钟。
(也可不用去除内源性酶)。
3. 封闭(Blocking)加10%正常驴血清(原液100ul+900ulPBS,1ml够用30张片子),室温孵育封闭30分钟。
如果背景较高,可以4℃封闭过夜。
不用洗,用滤纸吸干周边水分。
从封闭开始所有的步骤,一定要注意样品的保湿,避免样品的干燥,否则极易产生较高的背景。
4. 一抗孵育(Primary antibody incubation)参考一抗的说明书,按照适当比例用(10%山羊血清PBS或1%BSA-PBS)稀释一抗。
立即加入稀释好的一抗, 4℃过夜,第二天取出复温45分钟。
PBS洗3次,每次5分钟。
5. 二抗孵育(Secondary antibody inucubation)按照适当比例用稀释荧光标记的二抗,立即加入稀释好的二抗,室温或4℃在侧摆摇床上缓慢摇动孵育一小时。
PBS洗涤3次。
每次5分钟。
如果结果背景较高,可以适当延长洗涤时间并增加洗涤次数。
6. 蛋白检测(Detection of proteins)7. 复染用DAPI对细胞核进行染色,室温10分钟,PBS冲洗5分钟×3次,封片(封片剂或分析纯的甘油与碳酸缓冲液1:1混合)显微镜观察,染色后为蓝色荧光。
石蜡切片免疫组化及免疫荧光染色方法

石蜡切片免疫组化及免疫荧光染色方法
一、石蜡切片免疫组化技术
石蜡切片免疫组化方法是一种流行的染色技术,它利用抗原特异性抗
体结合抗原将一种特定蛋白质标记出来,然后对组织交叉剥离切片进行染色,得到对特定抗原的特异性染色,进而可以测定组织中其中一蛋白质的
分布情况及其表达水平。
石蜡切片免疫组化方法主要分为热稳定抗原抗体
保护法、热稳定化学法和抗原保护法三种。
1.热稳定抗原抗体保护法
热稳定抗原抗体保护法又称抗原连接法,它是最常用的一种免疫组化
技术,依赖高温对抗原的特殊保护作用。
其原理是经过化学固定的组织切片,在石蜡上产生隆起;然后用高温阳性抗体(双抗体)将抗原完全覆盖,并产生痕迹,这样便可清楚地观察抗原的分布情况;此外,在有抗原保护
的条件下,抗原保护的组织切片可以用客体抗体染色。
2.热稳定化学法
热稳定化学法是一种特殊的抗原保护法,也是最常用的石蜡免疫染色
技术。
石蜡切片免疫荧光实验步骤

石蜡切片免疫荧光实验步骤1、脱蜡至水:将组织切片室温放置10min后,依次将石蜡切片放入二甲苯3min→无水乙醇5min—85%酒精5min—75%酒精5min—ddH2O洗5min。
2、抗原修复:组织切片置于盛满柠檬酸抗原修复液(50X稀释至1X使用)的修复盒中于微波炉内进行抗原修复(中火8min—停火8min—中低火7min)。
此过程中应防止缓冲液过度蒸发,切勿干片。
自然冷却后将玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min(具体修复液和修复条件根据组织来确定)。
3、画阻水圈:切片稍甩干后用组化笔在组织周围画圈,防止液体流失。
4、BSA封闭:在圈内滴加3%-5%浓度BSA孵育30min(或二抗同源血清封闭)。
5、一抗孵育:轻轻甩干封闭液,在切片上滴加按一定比例配好的一抗(溶于血清:PBS=1:19的抗体稀释液体系中),切片平放于湿盒(内加少量水防止抗体蒸发),4°C过夜。
6、二抗孵育:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加相应的荧光二抗,覆盖组织,避光RT孵育50min。
7、DAPI染核:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加DAPI染液,避光RT孵育3-5min。
8、树脂封片:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后用树脂封片剂封片(其间可滴加少量抗荧光淬灭剂)。
9、镜检拍照:切片于荧光显微镜/confocal/活细胞工作站中观察并采集图像(DAPI紫外激发波长330-380nm,发射波长420nm,发蓝光;FITC激发波长465-495nm,发射波长515-555 nm,发绿光;CY3激发波长510-560,发射波长590nm,发橙光;CY5发红光)。
10、结果判读:DAPI染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的红光或者绿光,图片处理需使用Image J 软件。
病理切片需求申请书

病理切片需求申请书尊敬的相关部门/负责人:您好!我是申请部门/申请人,现因具体项目/研究/诊疗需求,特向您提交这份病理切片需求申请书,希望能得到您的支持和批准。
一、申请背景在当前的医疗实践和科学研究中,病理切片作为一种重要的诊断和研究工具,对于准确判断疾病的性质、类型、进展以及制定合理的治疗方案具有不可替代的作用。
我们所在的科室/研究团队正在进行的具体项目/研究/诊疗工作,涉及到了一系列复杂的病理变化,为了能够深入探究其机制并为患者提供更精准的医疗服务,对病理切片的需求迫在眉睫。
二、具体需求1、切片类型石蜡切片:需要制备具体组织/器官的石蜡切片,数量约为X张,用于常规的组织学观察和染色分析。
冰冻切片:对于一些需要快速诊断的病例,预计需要X张冰冻切片,以便在短时间内获得初步的诊断结果。
2、染色方法苏木精伊红(H&E)染色:这是病理诊断中最常用的染色方法,需要对所有的石蜡切片进行 H&E 染色,以清晰显示组织的结构和细胞形态。
特殊染色:根据具体的研究需求,还需要进行如 PAS 染色、Masson 三色染色等特殊染色,数量约为X张,以突出显示特定的组织成分或病理改变。
3、免疫组化染色针对具体的标志物/蛋白,需要进行免疫组化染色,预计染色切片数量为X张。
这些标志物对于明确肿瘤的分型、评估预后以及指导治疗具有重要意义。
4、切片质量要求切片应薄厚均匀,厚度一般控制在具体厚度微米左右,以确保良好的光学透明度和细胞形态的完整性。
组织切片应完整,无皱折、裂痕和刀痕,避免影响观察和诊断。
染色效果应清晰、鲜明,对比明显,无背景染色和非特异性染色。
三、申请理由1、临床诊疗需求在具体疾病的诊断中,常规的影像学检查和实验室检查无法明确病变的性质和程度。
通过病理切片的观察和分析,能够为临床医生提供准确的诊断依据,从而制定个性化的治疗方案,提高治疗效果,改善患者的预后。
2、科学研究需求我们正在进行的研究项目名称旨在深入探究疾病的发病机制/治疗靶点。
石蜡切片(paraffin sections)免疫组化染色步骤

石蜡切片(paraffin sections)免疫组化染色步骤1、载玻片的处理:抗原修复过程中,由于高温、高压、辐射等诸多因素的影响,极易造成脱片。
这里选用ZLI-9001 APES、ZLI- 9003 HistogripTM或ZLI-9005 Poly-L-Lysine等几种试剂,对已清洗的载玻片进行处理。
具体方法如下:(1)APES:现用现配。
将洗净的玻片放入以1:50比例丙酮稀释的APES 中,停留20~30秒钟,取出稍停片刻,再入纯丙酮溶液或蒸馏水中涮去未结合的APES,置通风橱中晾干即可。
用此载玻片捞片时应注意组织要一步到位,并尽量减少气泡的存在,以免影响染色结果。
(2)HistogripTM:将洗净的玻片放入以1:50比例丙酮稀释的Histogr ip液中,停留1~2分钟,然后用双蒸水快速清洗三次,室温干燥或60oC 烤箱烘烤一小时,装盒备用。
(3)Poly-L-Lysine:将洗净、干燥的载玻片放入以1:10比例去离子水稀释的多聚赖氨酸溶液中,浸泡5分钟,60℃烤箱烘烤一小时或室温过夜干燥。
装盒备用。
试验中使用的器具均为非玻璃制品。
2、常用酶消化:(1)胰蛋白酶:一般使用浓度为0.05%~0.1%,消化时间为37℃、10~4 0分钟,主要用于细胞内抗原的显示。
(2)胃蛋白酶:一般使用浓度为0.4%,消化时间为37℃、30~180分钟,主要用于细胞间质抗原的显示,如:Laminin(层粘蛋白),Collagen IV(IV型胶原)等。
(3)皂素(Saponin):一般使用浓度为2~10 g/ml的saponin溶液,消化时间为室温孵育30分钟。
3、抗原热修复:可根据实验室的具体条件,选用微波炉抗原修复、高压锅抗原修复或水浴高温抗原修复。
抗原热修复可选用各种缓冲液,如TBS、PBS、重金属盐溶液等,但实验证明,以0.01M枸橼酸盐缓冲液(pH6.0)效果最好。
枸橼酸盐缓冲液(粉剂)配制,取该粉剂一包溶于1000ml的蒸馏水中,混匀,其 pH值在6.0±0.1,如因蒸馏水本身造成的pH值偏差,请自行调整。
石蜡切片病理、免疫组化及免疫荧光方案

石蜡切片病理、免疫组化及免疫荧光方案石蜡标本固定、脱水、包埋方法大鼠自心脏灌注4%多聚甲醛内固定1-2h后取材:取脑出血血肿处脑组织(厚度约3mm),置于塑料盒中并浸泡在4%多聚甲醛中固定,室温中固定时间12-48h,固定好的组织脱水前应流水冲洗30min-1h左右除去固定液,取固定好的脑组织标本脱水、包埋。
具体步骤按以下方法进行:此方法参考《组织病理学技术》周庚寅北京大学出版社 2006年⏹70%: 1h-2h⏹80%: 1h-2h⏹90%: 1h-2h⏹95%: 1h-2h⏹95%: 1h-2h⏹无水Ⅰ:30min-60min⏹无水Ⅱ:30min-60min⏹二甲苯及水水酒精 1:1混合液 30min⏹二甲苯Ⅰ:30min⏹二甲苯Ⅱ:30min⏹石蜡Ⅰ: 1h⏹石蜡Ⅱ: 1h⏹石蜡Ⅲ: 1h包埋:在病理科包埋方法基础上灵活改进:在包埋铁模具上进行,融蜡-放置组织于中央-扣包埋盒4℃冷却10min-撬蜡。
注意事项:1、固定液的种类:10%中性甲醛,4%的多聚甲醛最合适,在37°或室温中固定12-48h能很好保存抗原和抗体的反应能力,实验室用的更多的是在4℃冰箱中固定24h-3d。
有人建议中性甲醛40摄氏度固定2~3小时,流水冲洗20min-30min,这样可以缩短制片的时间。
2、熔蜡温度65 ℃左右;3、严格按照预定实验步骤进行,保证脱水及透明完全,透明后见云雾状说明脱水不完全,需退回无水酒精中返工。
4、经一级二甲苯透明后检查组织是否透明,二级二甲苯透明时间以具体时间而定。
5、注意及时更换梯度酒精及二甲苯(1月)。
组织石蜡切片摘自《免疫组织化学实验技术及应用》 P12 化学工业出版社20061.载玻片的处理:采用现成的APES处理过的硅化载玻片。
2.石蜡切片注意事项:1、用于免疫组化的蜡温应为56~58℃,切片水温为40℃左右,应先置于冷水中(冷水中可参入酒精有利快速展片-见相关方法),然后再移入热水中,这样可以使切片顺利展平;2、烤片时要注意:一般在62℃烤片30-60min,抗原较强的组织可在60摄氏度烤3~8h,抗原较弱的组织可于37℃的恒温箱内过夜;3、切片如需长期保存,可置于4℃或室温下,千万不可脱蜡后4℃保存,因脱蜡后失去了对抗原决定族的保护。
石蜡切片免疫荧光染色方法

石蜡切片免疫荧光染色方法1.组织固定将待染的组织标本取出,用生理盐水或磷酸盐缓冲液进行冲洗,以去除血液和其他污染物。
然后用组织固定剂(如4%的多聚甲醛)进行固定,时间一般为12-24小时。
固定后,将组织转移到30%蔗糖缓冲液中,保持在4°C下过夜。
2.组织包埋将固定后的组织进行脱水和透明化处理。
首先用70%乙醇进行脱水,然后使用95%和100%的乙醇进行脱水,每个浓度的乙醇浸泡时间为30分钟。
接下来,用细胞脱水剂(如xylene)进行透明化处理,每次浸泡30分钟。
最后,将组织置于石蜡中,使其逐渐浸透,浸泡时间一般为12-24小时。
3.组织切片将石蜡浸透的组织取出,固定在切片架上。
使用旋转切片机将组织切成5-10微米厚的切片。
切好的切片用除去石蜡的溶剂(如xylene)处理,然后通过悬浮在磷酸盐缓冲液中移至玻璃切片上。
4.抗原修复在切片上涂抹抗原修复液,将其加热至适当温度进行修复,以恢复组织中的抗原活性。
不同的修复条件适用于不同的抗原修复液,一般修复温度为95°C,时间为20-30分钟。
修复后,将切片用磷酸盐缓冲液冲洗数次。
5.抗体染色在切片上涂抹首要抗体(抗体与所要检测的抗原有特异性结合)。
将切片置于湿润箱中,室温孵育1小时,或在4°C下孵育过夜。
然后,用PBS缓冲液冲洗切片,以去除未结合的抗体。
接下来,涂抹荧光标记的二抗(与首要抗体结合的二抗),并孵育30分钟。
6.荧光显微镜观察将切片加装到玻璃片上,并用适当的荧光封装剂封盖。
使用荧光显微镜观察切片,观察和记录荧光信号和组织结构。
注意事项:1.在操作过程中,要严格避免组织检测和悬浮液受到光照。
2.切片机和刀片必须保持清洁和尖锐,以确保切片的质量。
3.在染色过程中,要注意温度和时间的控制,以保证染色效果。
4.切片和显微镜观察时,要确保显微镜的光源和滤光片与所使用的荧光标记相匹配。
5.进行染色之前,要检查抗体的适用性和浓度,以确保染色结果的准确性和可靠性。
石蜡切片免疫组织化学染色

免疫组织化学又叫免疫细胞化学,按照失踪物可以分为免疫荧光和免疫酶等,免疫酶法;按照二抗与过氧化物酶结合的方式又分为SP法,ABC法(传统的结合方法)等(不同的试剂盒可能会开发出不同的结盒方式);根据染色步骤又可以分为直接法和间接法等。
目的:定位细胞或者组织中的抗原以及对抗原表达的相对定量对照设置:阳性对照(用已知抗原阳性的组织或者细胞同待检标本一同染色,排除假阴性)阴性对照(用于排除假阳性,一般只使用空白对照(不加一抗或者用PBS代替),)石蜡切片免疫组织化学酶法染色步骤及原理【酶法的优缺点:相比荧光标记,标本可以长期保存,普通光镜就可以操作,而且比荧光更加敏感,苏木素复染可以与形态学观察结合,对于石蜡切片更加合适;缺点是无法对两个抗原同时定位】1.脱蜡至水1)二甲苯Ⅰ15min,二甲苯Ⅱ15min【为了有更好的脱蜡效果,在脱蜡之前可以在烤箱中烤上半个小时】2)无水乙醇Ⅰ15min,无水乙醇Ⅱ15min3)3%过氧化氢—甲醇溶液,30min【过氧化氢的目的是消除内源的过氧化氢酶,否则会造成非特异性染色】4)95%乙醇5min5)80%乙醇5min6)自来水清洗5min7)蒸馏水冲洗5min2.抗原修复:用0.01M的枸橼酸缓冲液(即柠檬酸盐缓冲液)将切片全部浸泡,液面尽可能高,与微波炉中进行抗原修复,低火预热10min左右,至小沸后维持小沸5~7min,中间要随时观察,切记液体流出造成切片干燥【不同的抗原,修复的方法不同,最好按照一抗的说明书进行;原理:由于甲醛使蛋白质发生交联,在氨基酸分子间形成亚甲基桥,而造成大部分的抗原结合位店封闭,后来有人发现在酸碱溶液中煮沸组织可以使交联打开,从而拜托了抗体只能用于冰冻切切片的局面】3.冷却40min左右,(冷却到室温),蒸馏水洗三遍,PBS洗三遍4.血清封闭:10%FBS封闭20min【抗体是带有丰富电荷的大分子,而细胞中有很多物质可以与其非特异性结合,造成假阳性或者影响实验结果,封闭是利用非特异的血清中的抗体成分与组织进行非特异性结合反应】【不可以使用与一抗同一种属来源的血清】5.加一抗:滴加相应浓度的一抗湿盒中温室孵育30min,4℃过夜【至少在室温孵育半个小时,有条件的话可以37℃孵育(不耐热的抗原不可以),或者直接4℃过夜,可能不同的抗体可以使用不同的孵育方式,按照说明书推荐的时间即可,工作量大的话可以摸索一下时间】【抗体的稀释浓度直接影响染色的效果,使用一抗之前按照一抗说明说摸索最佳染色浓度,最好可以做一下阳性切片不同抗体浓度的对比染色】【阴性对照染色与实验组的不同:不加一抗】6.次日晨从冰箱中取出湿盒,恢复室温30min7.PBS洗三遍【不同的抗原分开洗】8.滴加相应的二抗室温孵育30min【标记的二抗具有广谱性,能与种属上相同的所有动物的球蛋白结合,因为抗体的种属特异性,所以二抗必须用一抗同种动物的血清球蛋白来免疫其他动物进行制备】9.DAB染色【3,3′-二氨基联苯胺,辣根过氧化物酶的显色底物,产生不溶于水,醇,二甲苯的棕色沉淀】【DAB溶液的配制:100ml PBS加50mg的DAB,充分搅拌后用滤纸过滤,使用前加两滴(大约50 l)30%的过氧化氢(过氧化物酶与过氧化氢作用产生游离氧,后者使无色的供氢体DAB氧化为棕褐色沉淀定位于过氧化物酶所在部位)】【DAB致癌,小心操作】【显色时要在显微镜下观察,控制显色时间,到出现特异性染色较强而本底着色较浅时即可冲洗;DAB显色时间很短(如几秒或几十秒)就出现很深的棕褐色,这很可能说明你的抗体浓度过高或抗体孵育时间过长,需要下调抗体浓度或缩短你的抗体孵育时间;此外,若很短时间就出现背景很深,还有可能你前面的封闭非特异性蛋白不全,需要延长封闭时间;DAB显色时间很长(如超过十几分钟)才出现阳性染色,一方面可能说明你的抗体浓度过低或孵育时间过短(最好一抗4℃过夜);另一方面就是封闭时间过长。
石蜡切片免疫荧光染色方法审批稿

石蜡切片免疫荧光染色方法审批稿摘要:免疫荧光染色是一种通过免疫反应将抗原与特异性抗体结合并用荧光标记显示的技术。
本审批稿介绍了一种使用石蜡切片进行免疫荧光染色的方法,包括样品处理、抗体选择、标记物选择等。
该方法具有操作简单、结果准确等优点,适用于石蜡切片的免疫染色分析。
关键词:免疫荧光染色、石蜡切片、抗体、标记物引言:免疫荧光染色是一种常用的细胞和组织学研究方法,通过特异性抗体与抗原结合并使用荧光标记物显示的技术。
在研究细胞或组织的分布、定位和相互关系等方面具有很高的准确性和敏感性。
然而,在使用石蜡切片进行免疫荧光染色时,存在一些挑战,包括固定、脱脂和脱水的过程对抗原的破坏,以及石蜡对抗体的影响等。
因此,合理选择方法和条件对于免疫染色的成功至关重要。
方法:1.样品处理:a.取石蜡切片,去除石蜡:将石蜡切片浸于2次苯脱蜡液中,每次15分钟b.脱水和再水化:将切片浸入浓缩乙醇(如100%和95%)并保持5分钟,然后再用蒸馏水漂洗2次c.抗原修复:将切片浸入抗原修复液中,在高压加热或微波辅助下进行抗原修复,确保切片上抗原的发现和杀伤程度小于25分钟d.脱脂和再水化:重复步骤1b中的操作2.抗体选择:a.选择特异性抗体:根据研究目的选择特定的抗体,确保免疫染色的特异性b.分辨率标记:选择合适的荧光标记物,以获得清晰的图像和高分辨率c.防止非特异性结合:添加适当的阻断缓冲液以防止非特异性抗体结合3.免疫染色:a.准备工作液:配制适当浓度的抗体溶液,并在最佳条件下进行稀释b.添加抗体:将工作液添加到处理好的石蜡切片上,并保持在适当的温度下孵育c.清洗:使用PBS或TBS缓冲液,将上述切片清洗3次d.核染色:使用DAPI等核染色剂染色,以便确定细胞核的位置e.盖玻片:将切片封装到适当尺寸的盖玻片上,并用包固定剂封装结果与讨论:结论:石蜡切片免疫荧光染色方法为免疫染色提供了一种有效的选择。
通过合理选择方法和条件,可以成功地在石蜡切片上进行免疫染色,获得准确和可靠的结果。
免疫组织荧光染色法实验操作流程
5min
100%乙醇Ⅱ
5min
95%乙醇
2min
90%乙醇
2min
80%乙醇
2min
70%乙醇
2min
蒸馏水(浸洗)
3*2min
抗原
修复
高压锅柠檬酸盐缓冲液
3min
先将柠檬酸盐缓冲液加到洗盒里,加热高压锅,待柠檬酸盐缓冲液升温至60℃左右时放入水化后的标本,盖好高压锅,不加压力阀。加热高压锅,待压力阀处冒水蒸汽时,盖上压力阀,加热三分钟。压力降到正常大气压后打开锅盖,待玻片自然冷却。
15-20min
0.3%PBST洗
5min
摇床
0.3%PBST洗
5min
封闭
5%驴血清封闭
室温1h
Ⅰ抗为兔抗鼠,Ⅱ抗就应该为**抗兔,所以我们封闭时选用被抗最少的物种,一般选用牛血清或者驴血清。再封闭时,为了防止封闭液流失,可以用pad笔在标本周围画圈,提高液体的利用度。
0.3%PBST浸洗
2*5min
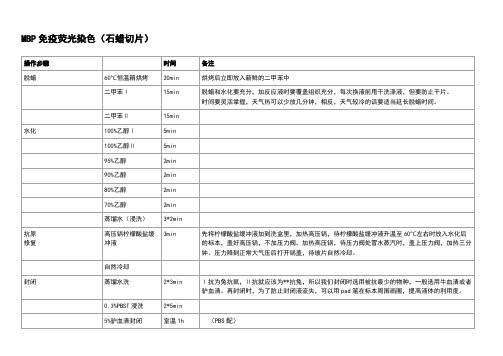
MBP免疫荧光染色(石蜡切片)
操作步骤
时间
备注
脱蜡
60℃恒温箱烘烤
20min
烘烤后立即放入新鲜的二甲苯中
二甲苯Ⅰ
15min
脱蜡和水化要充分,加反应液时要覆盖组织充分,每次换液前甩干洗涤液,但要防止干片。
时间要灵活掌握,天气热可以少放几分钟,相反,天气较冷的话要适当延长脱蜡时间。
二甲苯Ⅱ
15min
水化
自然冷却
封闭
蒸馏水洗
2*3min
Ⅰ抗为兔抗鼠,Ⅱ抗就应该为**抗兔,所以我们封闭时选用被抗最少的物种,一般选用牛血清或者驴血清。再封闭时,为了防止封闭液流失,可以用pad笔在标本周围画圈,提高液体的利用度。
石蜡切片免疫荧光实验步骤

石蜡切片免疫荧光实验步骤1、脱蜡至水:将组织切片室温放置10min后,依次将石蜡切片放入二甲苯3min→无水乙醇5min—85%酒精5min—75%酒精5min—ddH2O洗5min。
2、抗原修复:组织切片置于盛满柠檬酸抗原修复液(50X稀释至1X使用)的修复盒中于微波炉内进行抗原修复(中火8min—停火8min—中低火7min)。
此过程中应防止缓冲液过度蒸发,切勿干片。
自然冷却后将玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min(具体修复液和修复条件根据组织来确定)。
3、画阻水圈:切片稍甩干后用组化笔在组织周围画圈,防止液体流失。
4、BSA封闭:在圈内滴加3%-5%浓度BSA孵育30min(或二抗同源血清封闭)。
5、一抗孵育:轻轻甩干封闭液,在切片上滴加按一定比例配好的一抗(溶于血清:PBS=1:19的抗体稀释液体系中),切片平放于湿盒(内加少量水防止抗体蒸发),4°C过夜。
6、二抗孵育:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加相应的荧光二抗,覆盖组织,避光RT孵育50min。
7、DAPI染核:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加DAPI染液,避光RT孵育3-5min。
8、树脂封片:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后用树脂封片剂封片(其间可滴加少量抗荧光淬灭剂)。
9、镜检拍照:切片于荧光显微镜/confocal/活细胞工作站中观察并采集图像(DAPI紫外激发波长330-380nm,发射波长420nm,发蓝光;FITC激发波长465-495nm,发射波长515-555 nm,发绿光;CY3激发波长510-560,发射波长590nm,发橙光;CY5发红光)。
10、结果判读:DAPI染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的红光或者绿光,图片处理需使用Image J 软件。
石蜡切片免疫荧光实验步骤

石蜡切片免疫荧光实验步骤
一、样品处理
1、选择适当体积的样品石蜡切片,防止干燥,封好盖子到-80℃,直
到使用时将其取出变性到室温,以备后续操作。
2、室温下取出石蜡切片,施加蛋白酶将切片上原有的细胞、细胞膜
分解,具体操作步骤为:将取出的石蜡切片放入0.1%胰蛋白酶(Protease,Roche)或0.5% Triton X-100溶液中,置于37℃水浴摇床,25min后将石
蜡切片放入3mm×2mm的转移槽内,加入200ul去离子水,搅拌进行超声
处理,30s后用1000ul去离子水冲洗,放入4℃冰箱保存,以备后续操作。
二、组织切片染色
1、在刻线玻片上放入石蜡切片,用吸水棉柱将石蜡切片固定。
2、用0.1%胰蛋白酶(Protease, Roche)或0.3% Triton X-100溶液
浸泡石蜡切片,置于37℃水浴摇床,15min后去除液体,另用500μl去
离子水洗涤,将含有抗体的抗体溶液稀释至0.3μg/ml,加入石蜡切片上,放入35℃恒温箱,反应1h。
3、取出石蜡切片,加入1000μl去离子水洗涤,放入4℃冰箱保存,以备后续操作。
三、免疫荧光检测
1、把石蜡切片放入适量的去离子水中浸泡,去除多余的抗体。
2、将放入去离子水中浸泡的石蜡切片放入多孔玻片,在摇床上稀释FITC标记的抗体,加入石蜡切片上,置于37℃水浴摇床上,1h后去除液体。
石蜡切片免疫荧光组化

免疫荧光组化(IHC)1.脱蜡Ⅰ二甲苯:3 minⅡ二甲苯:3 min1:1二甲苯:无水乙醇:3 min2.复水Ⅰ无水乙醇:3 minⅡ无水乙醇:3 min95%乙醇:3 min70%乙醇:3 min50%乙醇:3 min30%乙醇:3 min3.流动的自来水冲洗:5 min(在水龙头上接一个软管,水流放慢,注意管口要放在载玻片反面)4.抗原修复:20 min用双蒸水配制新鲜的10 mM的二水柠檬酸三钠,调节PH=6,加入0.05%的吐温20,将配制好的柠檬酸盐溶液加到染色缸内,放入玻片(带架子),95℃水浴20 min。
5.室温冷却6.PBS冲洗(每次洗换新的):3X5 min将染色缸中加满PBS,放在水平摇床上,50 rpm,轻摇。
7.透明:10 min配制0.2%的Triton X-100 PBS溶液。
先将载玻片上的PBS吸净,然后用专用笔围绕组织画一个封闭的圆圈,室温晾干后,紧挨内圈再画一个封闭的外圈,室温晾干。
用移液器向封闭圈内加一定量的0.2%的Triton X-100 PBS溶液,保证液体浸没组织。
8.PBS冲洗:3X5 min同步骤6。
9.封闭:30 min(RT)配制1%马血清PBS溶液。
先将载玻片上的PBS吸净,用移液器向封闭圈内加一定量的1%马血清PBS溶液,保证液体浸没组织。
10.孵一抗:在湿盒中4℃过夜。
按比例在封闭液中稀释抗体.先将载玻片上的封闭液轻轻甩掉,将载玻片摆放在湿盒内,用移液器向封闭圈内加一定量的稀释后的抗体溶液,保证液体浸没组织。
11.PBS冲洗:3X5 min同步骤6。
12.孵二抗:30 min(RT,避光)按比例在封闭液中稀释抗体。
先将载玻片上的PBS吸净,用移液器向封闭圈内加一定量的稀释后的抗体溶液,保证液体浸没组织。
13.PBS冲洗:3X5 min同步骤6。
14.梯度脱水30%乙醇:3 min50%乙醇:3 min70%乙醇:3 min95%乙醇:3 minⅡ无水乙醇:3 minⅠ无水乙醇:3 min15.1:1二甲苯:无水乙醇:3 minⅠ二甲苯:3 minⅡ二甲苯:3 min(14-15可选)16.封片将载玻片放在白色纸盒中,在载玻片上滴加适量mounting buffer,盖盖玻片,室温水平放置,过夜后观察。
石蜡切片免疫组化实验报告(免疫组化实验报告)

石蜡切片免疫组化实验报告一、实验器材及试剂1、实验器材名称厂家型号脱水机武汉俊杰电子有限公司JJ-12J包埋机武汉俊杰电子有限公司JB-P5病理切片机上海徕卡仪器有限公司RM2016冻台武汉俊杰电子有限公司JB-L5组织摊片机浙江省金华市科迪仪器设备有限公司KD-P烤箱上海福玛实验仪器有限公司DGX-9003B载玻片及盖玻片江苏世泰实验器材有限公司10212432C微波炉格兰仕微波炉电器有限公司P70D20TL-P4脱色摇床北京市六一仪器厂WD-9405A涡旋混合器天悦电子TYXH-II移液枪Dragon KE0003087/KA0056573 组化笔Gene tech GT1001倒置荧光显微镜日本尼康NIKON ECLIPSE TI-SR 成像系统日本尼康NIKON DS-U32、主要实验试剂试剂厂家货号无水乙醇国药集团化学试剂有限公司二甲苯国药集团化学试剂有限公司EDTA抗原修复液谷歌生物PBS缓冲液谷歌生物双氧水国药集团化学试剂有限公司10011218BSA Sigma A7030苏木素染液谷歌生物盐酸国药集团化学试剂有限公司氨水国药集团化学试剂有限公司中性树胶国药集团化学试剂有限公司一抗(KI67)公司:谷歌生物货号:GB13030 稀释比:1:500 二抗:山羊抗兔/鼠通用二抗公司:DAKO 货号:K5007 稀释比:即用一抗(PCNA)公司:谷歌生物货号:GB13010 稀释比:1:300 二抗:山羊抗兔/鼠通用二抗公司:DAKO 货号:K5007 稀释比:即用一抗(Caspase3)公司:谷歌生物货号:GB13009 稀释比:1:300 二抗:山羊抗兔/鼠通用二抗公司:DAKO 货号:K5007 稀释比:即用组化试剂盒DAB显色剂公司:DAKO 货号:K5007 时间:5s左右二、石蜡切片免疫组化实验步骤1、石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ15min-二甲苯Ⅱ15min-无水乙醇Ⅰ5min-无水乙醇Ⅱ5min-95%酒精5min-90%酒精5min-80%酒精5min-70%酒精5min-蒸馏水洗。
石蜡切片及免疫荧光

一、石蜡切片1.固定:将新鲜组织切成小块,固定于4%多聚甲醛过夜。
凝固组织中的物质成分,尽可能保持其活体时的结构。
同时能使组织硬化,有利于切片的进行。
2.脱水:为了减少组织材料的急剧收缩,应使用从低浓度到高浓度递增的顺序进行经70%、85%、95%直至纯酒精(无水乙醇),每次时间为1小时。
固定后的组织材料需除去留在组织内的固定液及其结晶沉淀,否则会影响后期的染色效果。
3.透明:常用的透明剂有二甲苯,二甲苯是石蜡的溶剂。
纯酒精不能与石蜡相溶,还需用能与酒精和石蜡相溶的溶剂,替换出组织内的酒精。
材料块在透明剂浸渍过程称透明。
4.浸蜡:先把组织材料块放在熔化的石蜡和二甲苯的等量混合液浸渍1小时。
先后移入2个熔化的石蜡液中浸渍1小时左右。
5包埋:以少许热蜡液将其底部迅速贴附于包埋盒内上,然后置于速冻台,让石蜡固定。
6.切片:切片刀的锐利与否、蜡块硬度是否适当都直接影响切片质量,可将蜡块至于冷水中改变蜡块硬度。
通常切片厚度为3-5um,用毛笔轻托轻放在37度水浴中展片。
7.贴片与烤片:般使用恒温水浴锅,温度控制在37-401左右,有利于石蜡切片的展开,贴好的切片置于60^恒温箱内干燥2小时,蛋白质凝固后即可染色。
8.切片脱蜡及水化:干燥后的切片置于二甲苯中进行脱蜡,然后依次使用从高浓度到低浓度递减的顺序进行经纯酒精、95%、85%、70%进行水化。
9染色:经典的苏木精和伊红:细胞核被苏木精染成紫蓝色,多数细胞质及非细胞成分被伊红染成粉红色。
实验操作简单。
免疫组化:指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应。
二、冰冻切片1.取材:应尽可能快地采取新鲜的材料,防止组织发生死后变化。
2.速冻:1)将组织块平放于软塑瓶盖或特制小盒内(直径约2cm)。
2)如组织块小可适量加OCT包埋剂浸没组织,然后将特制小盒缓缓平放入盛有液氮的小杯内。
3)当盒底部接触液氮时即开始气化沸腾,此时小盒保持原位切勿浸入液氮中,大约10-20S组织即迅速冰结成块。
最新石蜡切片免疫组化及免疫荧光染色方法整理

石蜡切片免疫组化及免疫荧光染色方法1、组织的采集、固定和保存:采取组织后,方法一:4%多聚甲醛(4%PFA)4C 固定1小时(根据组织大小和致密程度调整固定时间)或过夜方法二:采用bouin’s固定RT 2h(6-8d tesis)or RT 过夜(成年tesis)PBS缓冲液洗三次,每次5min,4C保存于70%乙醇中。
2、组织的包埋、切片、展片及保存::固定后的样品经梯度乙醇脱水、二甲苯透明,52-54C石蜡包埋,常规切片,切片厚4 -10m,贴于处理过的干净载玻片上,37C烤片过夜,之后收集于载片盒中,RT密封保存。
石蜡包埋:保存于4C 70%乙醇中的组织样品80%乙醇15 min95%乙醇15 min100%乙醇15min 21/2乙醇1/2二甲苯15 min二甲苯透明5-10 min1/2二甲苯1/2石蜡30 min石蜡(1) 1.5hr石蜡(2) 1.5-2.5hr石蜡(3)包埋RT保存3、石蜡组织切片的免疫组化方法:密封保存于RT的组织切片二甲苯(1) 20 min二甲苯(2) 20 min100%乙醇20min95%乙醇10 min80%乙醇10 min通风橱晾干,阻水笔在组织周围画圈切片在PBS中浸泡 5 min*20.4%Tritonx RT 10 min切片在PBS中浸泡 5 min*33%H2O2 RT 10min切片在PBS中浸泡 5 min*30.25%胰酶RT 10min切片在PBS中浸泡 5 min*3Blocking buffer(3%BSA+5%NGS+0.2%Tritonx-100 in PBS) RT 60min倾去blocking buffer,勿洗一抗4C overnight in blocking buffer取出切片复温1h,切片在PBS中浸泡 5 min*3二抗in blocking buffer GAR1:200 (GAM1:100),RT 1h切片在PBS中浸泡 5 min*3DAB显色5-10min(50微升A+50微升B+900微升PBS+5微升3%H2O2)如果是增强型DAB只要1min即可。
如何用石蜡切片做出高质量组化和荧光图之经验

[原创] 如何用石蜡切片做出高质量免疫组化和免疫荧光图之经验组织病理染色是我们做研究经常需要用到的实验技术,是基本的实验室技术之一。
很多人都认为病理染色相对Western blot(之前我也专门写了一篇经验贴)来说更容易出结果,这一点我不否认,但要想做出一张漂亮的图还是有点难度的,尤其是免疫荧光。
本人在这方面算得上是有点经验,做出来的图片受到导师和同学们的一致认可。
今天我就跟大家分享一下我艰辛摸索出来的经验。
我将从取材部分开始讲,到显微镜拍片结束。
由于我是基本只做中枢神经系统的研究,所以下面以鼠脑为例。
一、取材1、物品试剂准备:生理盐水或PBS(每只小鼠80ml),4%多聚甲或者10%中性福尔马林(每只小鼠100ml),麻药,250ml玻璃烧杯两个,泡沫箱两个,泡沫箱盖子一个,1ml注射器一个,20ml注射器两个,7号头皮针一个,大头针四个,止血弯钳(12.5cm)两把,组织剪一把(25cm),眼科剪一把,眼科弯镊一把,10mlEP管若干(一个鼠脑一管,提前装好固定液)。
2、取材步骤心脏灌注首先是麻醉小鼠。
等待麻醉诱导时把两个烧杯分别装上生理盐水和多聚甲,然后将烧杯半埋在冰中预冷。
麻醉后用大头针将小鼠固定于泡沫箱盖子上(用组织剪戳个洞,用以引流灌注出来的废液至泡沫箱中),暴露小鼠胸腔和心脏(用止血钳固定,用组织剪剪皮和开胸),注意别剪破肝脏和肺脏了,暴露后持止血弯钳稍微用力夹住一点心尖部(不要锁死钳子,留出进针的缝隙),微微用力向上提,仔细看心尖两侧颜色深浅,较浅那边是左心室部分,然后用头皮针(剪断针尖斜面,以防戳穿心底,提前接上装满生理盐水的注射器并赶走导管中的气泡)从心尖沿着左心室的长轴进针,全神贯注体会手感,当刚好有突破感时再进一点点,这时锁死止血钳。
然后用眼科镊夹起右心耳,并以眼科剪剪破之,见暗红的血涌出,接着手推注射器活塞,大概半分钟推完20ml生理盐水,连推4管,这期间观察肝脏颜色、肺脏大小及口鼻有无渗液。
石蜡切片免疫组化及免疫荧光染色方法之欧阳术创编

石蜡切片免疫组化及免疫荧光染色方法时间:2021.02.02 创作:欧阳术1、组织的采集、固定和保存:采取组织后,方法一:4%多聚甲醛(4%PFA)4 C 固定1小时(根据组织大小和致密程度调整固定时间)或过夜方法二:采用bouin’s固定RT 2h(6-8d tesis)or RT 过夜(成年 tesis)PBS缓冲液洗三次,每次5min,4C保存于70%乙醇中。
2、组织的包埋、切片、展片及保存::固定后的样品经梯度乙醇脱水、二甲苯透明,52-54C石蜡包埋,常规切片,切片厚4 -10m,贴于处理过的干净载玻片上,37C烤片过夜,之后收集于载片盒中,RT密封保存。
石蜡包埋:保存于4 C 70%乙醇中的组织样品80%乙醇 15 min95%乙醇 15 min100%乙醇 15min 21/2乙醇1/2二甲苯 15 min二甲苯透明 5-10 min1/2二甲苯1/2石蜡 30 min石蜡(1) 1.5hr石蜡(2) 1.5-2.5hr石蜡(3)包埋RT保存3、石蜡组织切片的免疫组化方法:密封保存于RT的组织切片二甲苯(1) 20 min二甲苯(2) 20 min100%乙醇20min95%乙醇10 min80%乙醇10 min通风橱晾干,阻水笔在组织周围画圈切片在PBS中浸泡 5 min*20.4%Tritonx RT 10 min切片在PBS中浸泡 5 min*33%H2O2 RT 10min切片在PBS中浸泡 5 min*30.25%胰酶RT 10min切片在PBS中浸泡 5 min*3Blocking buffer(3%BSA+5%NGS+0.2%Tritonx-100 in PBS) RT 60min倾去blocking buffer,勿洗一抗4 C overnight in blocking buffer取出切片复温1h,切片在PBS中浸泡 5 min*3二抗in blocking buffer GAR1:200 (GAM1:100),RT 1h切片在PBS中浸泡 5 min*3DAB显色5-10min(50微升A+50微升B+900微升PBS+5微升3%H2O2)如果是增强型DAB只要1min即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Q
lb
YKK standardization office [ YKK5AB- YKK08- YKK2C・ YKK18]
对于石蜡切片:
1、烤片:60C° 60分钟
2、脱蜡:二甲苯中I脱蜡15分钟一二甲苯II脱蜡15分钟一无水乙醇I 5分
钟
-无水乙醇II 5分钟-90%乙醇I 5分钟-90%乙醇II 5分钟-70%乙醇5分钟
-蒸馆水5分钟一蒸馆水5分钟。
3、抗原修复:高压修复,事先烧开锅中的水,修复盒中加入1柠檬酸钠,(柠檬酸三钠3g,柠檬酸0.4g加入1000ml蒸馆水中),上汽后加热10分钟,关火。
修复盒取出,放入装有自来水的瓷缸中缓慢冷却至室温。
2.去除内源性酶:玻片取出放入湿盒,加3%比022 (2ml ^022加入18ml蒸馆
水中,现配现用,避光),室温孵育10分钟,PBS洗3次,每次5分钟。
(也可不用去除内源性酶)。
3.封闭(Blocking)
加10%正常驴血清(原液100ul+900ulPBS, 1ml够用30张片子),室温孵育封闭30分钟。
如果背景较高,可以4C。
封闭过夜。
不用洗,用滤纸吸干周边水分。
从封闭开始所有的步骤,一定要注意样品的保湿,避免样品的干燥,否则极易产生较高的背景。
4.—抗孵育(Primary antibody incubation)
参考一抗的说明书,按照适当比例用(10%山羊血清PBS或1%BSA-PBS)稀释一抗。
立即加入稀释好的一抗,4C。
过夜,第二天取出复温45分钟。
PBS洗3次,每次5分钟。
5.二抗孵育(Secondary dntibody inucubation)
按照适当比例用稀释荧光标记的二抗,立即加入稀释好的二抗,室温或4C。
在
侧摆摇床上缓慢摇动孵育一小时。
PBS洗涤3次。
每次5分钟。
如果结果背景较高,可以适当延长洗涤时间并增加洗涤次数。
6.蛋白检测(Detection of proteins)
对于免疫荧光染色,此时已经可以直接到荧光显微镜下观察。
7.复染
用DAPI对细胞核进行染色,室温10分钟,PBS冲洗5分钟X3次,封片(封片
剂或分析纯的甘油与碳酸缓冲液混合)显微镜观察,染色后为蓝色荧光。
多重荧光染色:可使用红色荧光、绿色荧光和蓝色荧光进行三重荧光染色。
例如用进行红色荧光染色,随后可以用进行绿色荧光染色,在完成上述两种染色后可以使用对细胞核进行染色,染色后为蓝色荧光。
碳酸缓冲液配方:
NaHC03 3.7g
Na2C03 0.6g
双蒸水涪解至100ml,调节pH至。
