石蜡切片免疫荧光染色方法完整版
石蜡切片免疫组化染色步骤

石蜡切片免疫组化染色步骤石蜡切片免疫组化染色是一种常用的实验技术,用于研究组织、细胞和分子的结构与功能。
它通过使用抗体与特定抗原相互结合,然后使用酶、免疫荧光等标记物来检测这种结合,从而实现可视化染色和定位目标分子的目的。
下面,我们将详细介绍石蜡切片免疫组化染色的步骤。
步骤一:蜡块去蜡石蜡切片通常是由固定的组织样本制备而成,这些样本在处理过程中会被包埋在石蜡中。
因此,第一步是将蜡块去蜡。
首先,将蜡块放在温水中加热,使蜡块软化。
然后,将蜡块用刮刀从玻片上刮下。
这样可以得到蜡块去蜡后的组织样本。
步骤二:样本再固定在蜡块去蜡后,为了更好地保持组织的完整性和稳定性,通常需要对样本进行再固定。
常用的再固定方法是将样本放入4%的中性缓冲福尔马林溶液中,在室温下固定4-24小时。
固定后,将样本从福尔马林中取出,用PBS(磷酸缓冲盐溶液)洗涤数次,以去除残余的福尔马林。
步骤三:切片制备在样本再固定后,需要将样本制备成切片。
首先,将组织样本放入甲醇中脱水,然后转移到乙醚中脱脂。
脱脂后,将样本放入苯骚酸乙酯中浸泡,使样本渗透均匀。
在苯骚酸乙酯中浸泡一段时间后,将样本转移到石蜡中浸泡。
石蜡具有很好的切片性能,可以更好地保持组织的结构。
最后,将样本放入石蜡包埋机中,进行加热和固化,制备成为石蜡块。
之后,使用旋转切片机将石蜡块切成4-6微米厚的切片。
切片后,将切片浸泡在热水中,使其展开并粘附在玻片上。
步骤四:抗原修复切片制备完毕后,需要对切片进行抗原修复。
抗原修复是为了使样本中的抗原能够更好地暴露出来,增加抗体的结合效率。
常用的抗原修复方法有热处理和化学处理两种。
热处理通常是将切片浸泡在含有缓冲盐的蒸馏水中,然后加热至高温(如95摄氏度)保持一定时间。
化学处理通常是将切片浸泡在含有抗原修复试剂的溶液中,如EDTA(乙二胺四乙酸二钠)溶液。
抗原修复的时间和条件需根据具体实验的要求来确定。
步骤五:非特异性结合阻断为了减少非特异性结合,需要对切片进行非特异性结合阻断。
石蜡切片免疫荧光染色方法完整版

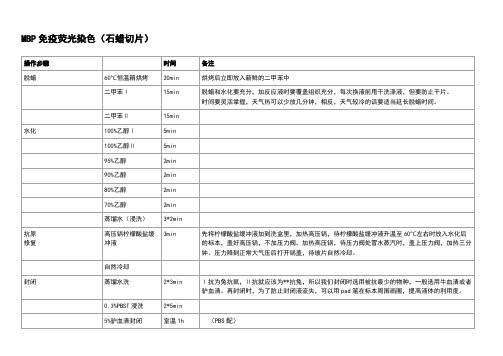
石蜡切片免疫荧光染色方法HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】对于石蜡切片:1、烤片:60℃ 60分钟2、脱蜡:二甲苯中Ⅰ脱蜡15分钟→二甲苯Ⅱ脱蜡15分钟→无水乙醇Ⅰ5分钟→无水乙醇Ⅱ5分钟→90%乙醇Ⅰ5分钟→90%乙醇Ⅱ5分钟→70%乙醇5分钟→蒸馏水5分钟→蒸馏水5分钟。
3、抗原修复:高压修复,事先烧开锅中的水,修复盒中加入l柠檬酸钠,(柠檬酸三钠 3g,柠檬酸 0.4g加入1000ml蒸馏水中),上汽后加热10分钟,关火。
修复盒取出,放入装有自来水的瓷缸中缓慢冷却至室温。
2. 去除内源性酶:玻片取出放入湿盒,加3%H2O22(2ml H2O22加入18ml蒸馏水中,现配现用,避光),室温孵育10分钟,PBS洗3次,每次5分钟。
(也可不用去除内源性酶)。
3. 封闭(Blocking)加10%正常驴血清(原液100ul+900ulPBS,1ml够用30张片子),室温孵育封闭30分钟。
如果背景较高,可以4℃封闭过夜。
不用洗,用滤纸吸干周边水分。
从封闭开始所有的步骤,一定要注意样品的保湿,避免样品的干燥,否则极易产生较高的背景。
4. 一抗孵育(Primary antibody incubation)参考一抗的说明书,按照适当比例用(10%山羊血清PBS或1%BSA-PBS)稀释一抗。
立即加入稀释好的一抗, 4℃过夜,第二天取出复温45分钟。
PBS洗3次,每次5分钟。
5. 二抗孵育(Secondary antibody inucubation)按照适当比例用稀释荧光标记的二抗,立即加入稀释好的二抗,室温或4℃在侧摆摇床上缓慢摇动孵育一小时。
PBS洗涤3次。
每次5分钟。
如果结果背景较高,可以适当延长洗涤时间并增加洗涤次数。
6. 蛋白检测(Detection of proteins)7. 复染用DAPI对细胞核进行染色,室温10分钟,PBS冲洗5分钟×3次,封片(封片剂或分析纯的甘油与碳酸缓冲液1:1混合)显微镜观察,染色后为蓝色荧光。
免疫组织荧光染色法实验操作流程
4℃过夜
加Ⅰ抗
0.3%PBST浸洗
2*5min
在加Ⅰ抗的时候,要用吸水纸吸干周围的水,用pad笔画圈,防止Ⅰ抗流失,影响效果。
驴抗兔488
1h
加Ⅱ抗
1×PBS浸洗
3*5min
室温下1h,注意要避光。如果需要进行双标,在从封闭开始进行,
含DAPI的封片液封片
封片
因封片液中含有DAPI染细胞核(蓝色),所以不用做核的染色。
自然冷却
封闭
蒸馏水洗
2*3min
Ⅰ抗为兔抗鼠,Ⅱ抗就应该为**抗兔,所以我们封闭时选用被抗最少的物种,一般选用牛血清或者驴血清。再封闭时,为了防止封闭液流失,可以用pad笔在标本周围画圈,提高液体的利用度。
0.3%PBST浸洗
2*5min
5%驴血清封闭
室温1h
(PBS配)
加Ⅰ抗
0.3%PBST浸洗
2*5min
100%乙醇Ⅰ
5min
100%乙醇Ⅱ
5min
95%乙醇
2min
90%乙醇
2min
80%乙醇
2min
70%乙醇
2min
蒸馏水(浸洗)
3*2min
抗原
修复
高压锅柠檬酸盐缓冲液
3min
先将柠檬酸盐缓冲液加到洗盒里,加热高压锅,待柠檬酸盐缓冲液升温至60℃左右时放入水化后的标本,盖好高压锅,不加压力阀。加热高压锅,待压力阀处冒水蒸汽时,盖上压力阀,加热三分钟。压力降到正常大气压后打开锅盖,待玻片自然冷却。
含DAPI的封片液封片
冰冻切片(贴片)
操作步骤(贴片)
时间
备注
操作步骤(漂片)
时间
备注
组织切片免疫荧光染色的具体步骤

组织切片免疫荧光染色的具体步骤1 直接免疫荧光法的操作步骤标本的处理:石蜡切片经脱蜡、梯度酒精脱水后,进行抗原修复,然后用0。
01M PBST漂洗5min × 3/次;• 2%BSA或10%BSA 37 C湿盒内封闭30min•抗体染色:C孵育30min;︒–在标本片上滴加适当稀释的荧光标记抗体(1:8或1:16稀释),放在湿盒中,37• 0.0lmol/L PBS(pH 7.4) 漂洗5min × 3/次,不时震荡(洗去多余游离的荧光素标记的抗体)。
•缓冲甘油封片–分析纯无荧光的甘油9份+ pH 9。
2,0.2M碳酸盐缓冲液1份配制.•镜检:在荧光显微镜下观察。
•优点:方法简便、特异性高,非特异性荧光染色少。
•缺点:敏感性偏低;而且每检查一种抗原就需要制备一种荧光抗体。
若检测多种抗原需制备多种相应的荧光标记抗体。
直接免疫荧光法的注意事项μ•对荧光标记的抗体的稀释:要保证抗体的蛋白有一定的浓度;•一般稀释度不应超过1:20,抗体浓度过低,会导致产生的荧光过弱,影响结果的观察。
•染色温度和时间需要根据各种不同的标本及抗原而变化;–染色时间:从10 min到数小时,一般30 min;C的低温,延长染色时间。
︒C可加强染色效果,但对不耐热的抗原(如流行性乙型脑炎病毒)可采用0—2︒C),高于37︒–染色温度:多采用室温(25C 30 min效果好的多。
︒–低温染色过夜较37•试验时需设置下列对照:–自发荧光对照(空白对照):标本加0。
01mol/L,pH7.4的PBS代替一抗。
–阳性对照:用已知的阳性标本加荧光标记的特异性抗体。
–特异性对照(抑制试验):标本加未标记的特异性抗体,再加荧光标记的特异性抗体.•若标本自发荧光对照和特异性对照呈无荧光或弱荧光,阳性对照和待检标本呈强荧光,则为特异性阳性染色.•一般标本在高压汞灯下照射超过3min,就有荧光减弱现象;•经荧光染色的标本最好在当天观察,随着时间的延长,荧光强度会逐渐下降。
组织多色免疫荧光方法

组织多色免疫荧光方法
组织多色免疫荧光方法是一种利用免疫荧光技术,在同一张切片上同时或依次对多个蛋白分子进行染色,展示组织原位多个蛋白标志物的空间分布的技术。
具体步骤如下:
1. 切片脱蜡:将石蜡切片依次放入二甲苯Ⅰ(20min)-二甲苯Ⅱ(20min)-二甲苯Ⅲ(20min)-无水乙醇Ⅰ(5min)-无水乙醇Ⅱ(5min)-95%酒
精(5min)-90%酒精(5min)-80%酒精(5min)-70%酒精(5min),然后蒸馏水浸洗5min。
2. 抗原修复:采用电陶炉加热对切片进行抗原修复,将配置好的修复液(Tris-EDTA缓冲液,)放置于烧杯中高火煮沸,再将脱蜡水化后的组织切片置于烧杯中的耐高温塑料切片架上,液面要浸过切片组织一定高度,此时开始计时,修复时间为15min,此过程中勿使组织干片(修复液要足量)。
到时间后将烧杯从电陶炉面板移出,室温放置40min左右冷却降温,当修
复液降至室温后取出玻片,用PBS()冲洗3遍,每次3min(冲洗过程中切勿对着组织冲洗,以免弄破组织)。
3. 多标方案建立:根据实验设计,建立多标方案。
4. 制片:按照多标方案进行制片。
5. 多靶标蛋白染色:在同一张切片上同时或依次对多个蛋白分子进行染色。
6. 拍照与扫描:对染色后的切片进行拍照和扫描。
7. HALO病理图像定量分析:利用HALO病理图像分析平台对光谱图像进行定量研究和空间位置关系分析。
以上步骤仅供参考,建议咨询专业人士获取准确信息。
石蜡切片免疫荧光实验步骤

石蜡切片免疫荧光实验步骤1、脱蜡至水:将组织切片室温放置10min后,依次将石蜡切片放入二甲苯3min→无水乙醇5min—85%酒精5min—75%酒精5min—ddH2O洗5min。
2、抗原修复:组织切片置于盛满柠檬酸抗原修复液(50X稀释至1X使用)的修复盒中于微波炉内进行抗原修复(中火8min—停火8min—中低火7min)。
此过程中应防止缓冲液过度蒸发,切勿干片。
自然冷却后将玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min(具体修复液和修复条件根据组织来确定)。
3、画阻水圈:切片稍甩干后用组化笔在组织周围画圈,防止液体流失。
4、BSA封闭:在圈内滴加3%-5%浓度BSA孵育30min(或二抗同源血清封闭)。
5、一抗孵育:轻轻甩干封闭液,在切片上滴加按一定比例配好的一抗(溶于血清:PBS=1:19的抗体稀释液体系中),切片平放于湿盒(内加少量水防止抗体蒸发),4°C过夜。
6、二抗孵育:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加相应的荧光二抗,覆盖组织,避光RT孵育50min。
7、DAPI染核:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加DAPI染液,避光RT孵育3-5min。
8、树脂封片:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后用树脂封片剂封片(其间可滴加少量抗荧光淬灭剂)。
9、镜检拍照:切片于荧光显微镜/confocal/活细胞工作站中观察并采集图像(DAPI紫外激发波长330-380nm,发射波长420nm,发蓝光;FITC激发波长465-495nm,发射波长515-555 nm,发绿光;CY3激发波长510-560,发射波长590nm,发橙光;CY5发红光)。
10、结果判读:DAPI染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的红光或者绿光,图片处理需使用Image J 软件。
石蜡组织免疫双色荧光操作步骤

石蜡组织免疫双色荧光操作步骤以下是石蜡组织免疫双色荧光的一般操作步骤:1. 组织固定:将待检测的组织标本固定在石蜡切片上,常见的固定剂包括福尔马林和乙醛。
2. 切片制备:使用组织切片机将固定的组织切割成薄片,通常厚度为4-6微米。
切片后将其放置在载玻片上。
3. 反蜡处理:将玻片连同组织切片一起放入石蜡热解蜡剂中,以去除石蜡并使组织暴露。
4. 抗原修复:根据需要,对组织切片进行抗原修复,以增强抗原的可见性。
抗原修复方法包括热处理或酶解。
5. 阻断非特异性结合:使用非特异性结合的抗体或血清对组织切片进行处理,以阻断非特异性结合位点,减少背景信号。
6. 第一次抗体孵育:将特异性的第一次抗体加入到切片上,与目标抗原结合,形成抗原-抗体复合物。
7. 洗涤:用洗涤缓冲液洗涤切片,以去除未结合的第一次抗体。
8. 第一次荧光标记:加入与第一次抗体结合的荧光标记物,以使目标抗原可视化。
9. 第二次抗体孵育:加入与第一次抗体特异性结合的第二次抗体,形成第一次抗体-第二次抗体复合物。
10. 洗涤:用洗涤缓冲液洗涤切片,以去除未结合的第二次抗体。
11. 第二次荧光标记:加入与第二次抗体结合的另一种荧光标记物,使第二次抗体可视化。
12. 核染色:如果需要,可以对细胞核进行染色,常见的核染色剂包括DAPI或荧光素。
13. 盖玻片:将一滴适当的封片剂加在载玻片上,然后用盖玻片覆盖标本。
14. 显微镜观察:使用荧光显微镜观察标本,并拍摄图像。
以上步骤是一般的操作流程,具体的步骤和试剂使用可能会根据实验的具体要求和试剂的特性而有所不同。
在进行实验之前,请确保严格按照实验室的安全操作规程和相关实验方案进行操作。
免疫荧光染色步骤

免疫组织化学染色步骤1.将石蜡切片二甲苯脱蜡(二甲苯Ⅰ20→二甲苯Ⅱ10)、入水(100%酒精Ⅰ5→100%酒精Ⅱ3→95%酒精2→80%酒精1→70%酒精1),蒸馏水冲洗后,0.01M 冲洗,5×3次;2.枸橼酸盐缓冲液微波抗原修复,加热使水温达92-96℃,维持10-15,自然冷却至室温,0.01M 冲洗,5×3次;3.32O 2溶液,37℃,20 ,以消除内源性过氧化物酶的活性,0.01M 冲洗,5×3次;4.正常羊血清封闭,37℃,30 ;5.倾去多余血清,滴加一抗,37℃2小时或者4℃过夜,0.01M 冲洗,5×3次;6.滴加二抗工作液,37℃,30 ,0.01M 冲洗,5×3次;7.滴加三抗工作液,37℃,30 ,0.01M 冲洗,5×3次;8.避光显色,显微镜下控制显色时间;9.0.01M 终止显色;10.梯度酒精脱水(70%酒精1→80%酒精1→95%酒精Ⅰ1→ 95%酒精Ⅱ1→无水酒精Ⅰ10→无水酒精Ⅱ10),二甲苯透明(二甲苯Ⅰ15→二甲苯Ⅱ10;11.中性树胶封片。
免疫荧光染色步骤(1)将组织切片脱蜡入水;(2)抗原微波修复,温度92℃-96℃,10-15,自然冷却至室温;(3)正常羊血清封闭,37℃,60 ;(4)倾去多余血清,滴加一抗,37℃2小时或者4℃过夜,冲洗,5×3次;(5)滴加荧光素标记的二抗,避光,37℃,60 ,0.01M 冲洗,5×3次;(6)防淬灭封片剂封片,4℃,避光保存。
(7)荧光显微镜观察拍照。
细胞免疫组化染色(培养板中染色)1.培养的细胞,弃去培养基,冷的洗两次,首先用4%多聚甲醛(4孔板200μl)固定10,洗2次,每次5-10分钟。
2.在含0.1% 100(4孔板200μl)的中进行10的透膜处理,洗2次,每次5-10分钟。
手动轻轻晃动数次,吸尽液体。
3.羊血清用配制成4%羊血清封闭液,室温封闭(4孔板200μl)30分钟。
石蜡切片免疫荧光染色方法

石蜡切片免疫荧光染色方法1.组织固定将待染的组织标本取出,用生理盐水或磷酸盐缓冲液进行冲洗,以去除血液和其他污染物。
然后用组织固定剂(如4%的多聚甲醛)进行固定,时间一般为12-24小时。
固定后,将组织转移到30%蔗糖缓冲液中,保持在4°C下过夜。
2.组织包埋将固定后的组织进行脱水和透明化处理。
首先用70%乙醇进行脱水,然后使用95%和100%的乙醇进行脱水,每个浓度的乙醇浸泡时间为30分钟。
接下来,用细胞脱水剂(如xylene)进行透明化处理,每次浸泡30分钟。
最后,将组织置于石蜡中,使其逐渐浸透,浸泡时间一般为12-24小时。
3.组织切片将石蜡浸透的组织取出,固定在切片架上。
使用旋转切片机将组织切成5-10微米厚的切片。
切好的切片用除去石蜡的溶剂(如xylene)处理,然后通过悬浮在磷酸盐缓冲液中移至玻璃切片上。
4.抗原修复在切片上涂抹抗原修复液,将其加热至适当温度进行修复,以恢复组织中的抗原活性。
不同的修复条件适用于不同的抗原修复液,一般修复温度为95°C,时间为20-30分钟。
修复后,将切片用磷酸盐缓冲液冲洗数次。
5.抗体染色在切片上涂抹首要抗体(抗体与所要检测的抗原有特异性结合)。
将切片置于湿润箱中,室温孵育1小时,或在4°C下孵育过夜。
然后,用PBS缓冲液冲洗切片,以去除未结合的抗体。
接下来,涂抹荧光标记的二抗(与首要抗体结合的二抗),并孵育30分钟。
6.荧光显微镜观察将切片加装到玻璃片上,并用适当的荧光封装剂封盖。
使用荧光显微镜观察切片,观察和记录荧光信号和组织结构。
注意事项:1.在操作过程中,要严格避免组织检测和悬浮液受到光照。
2.切片机和刀片必须保持清洁和尖锐,以确保切片的质量。
3.在染色过程中,要注意温度和时间的控制,以保证染色效果。
4.切片和显微镜观察时,要确保显微镜的光源和滤光片与所使用的荧光标记相匹配。
5.进行染色之前,要检查抗体的适用性和浓度,以确保染色结果的准确性和可靠性。
石蜡切片免疫组化及免疫荧光染色方法

石蜡切片免疫组化及免疫荧光染色方法1、组织的采集、固定和保存:采取组织后,方法一:4%多聚甲醛(4%PFA)4︒C 固定1小时(根据组织大小和致密程度调整固定时间)或过夜方法二:采用bouin’s固定RT 2h(6-8d tesis)or RT 过夜(成年 tesis)PBS缓冲液洗三次,每次5min,4︒C保存于70%乙醇中。
2、组织的包埋、切片、展片及保存::固定后的样品经梯度乙醇脱水、二甲苯透明,52-54︒C石蜡包埋,常规切片,切片厚4 -10μm,贴于处理过的干净载玻片上,37︒C烤片过夜,之后收集于载片盒中,RT密封保存。
石蜡包埋:保存于4︒C 70%乙醇中的组织样品↓80%乙醇 15 min↓95%乙醇 15 min↓100%乙醇 15min ⨯ 2↓1/2乙醇1/2二甲苯 15 min↓二甲苯透明 5-10 min↓1/2二甲苯1/2石蜡 30 min↓石蜡(1) 1.5hr↓石蜡(2) 1.5-2.5hr↓石蜡(3)包埋↓RT保存3、石蜡组织切片的免疫组化方法:密封保存于RT的组织切片↓二甲苯(1) 20 min↓二甲苯(2) 20 min↓100%乙醇 20min↓95%乙醇 10 min↓80%乙醇 10 min↓通风橱晾干,阻水笔在组织周围画圈↓切片在PBS中浸泡 5 min*2↓0.4%Tritonx RT 10 min↓切片在PBS中浸泡 5 min*33%H2O2 RT 10min切片在PBS中浸泡 5 min*30.25%胰酶RT 10min切片在PBS中浸泡 5 min*3Blocking buffer(3%BSA+5%NGS+0.2%Tritonx-100 in PBS) RT 60min倾去blocking buffer,勿洗一抗4︒C overnight in blocking buffer取出切片复温1h,切片在PBS中浸泡 5 min*3二抗in blocking buffer GAR1:200 (GAM1:100),RT 1h切片在PBS中浸泡 5 min*3DAB显色5-10min(50微升A+50微升B+900微升PBS+5微升3%H2O2)如果是增强型DAB只要1min即可。
石蜡切片免疫荧光技巧

石蜡切片免疫荧光技巧
石蜡切片免疫荧光技术是一种常用的免疫组织化学方法,用于检测或定位特定抗原在组织样本中的分布情况。
以下是石蜡切片免疫荧光技术的步骤:
1. 组织固定和包埋:将组织样本固定在含有4%的缓冲甲醛中,以保持其形态和结构。
之后,将组织样本包埋在去离子石蜡中,以增加其硬度和切片的稳定性。
2. 去除蜡并切片:用刀片将固定和包埋的组织样本切割成薄片,通常为4-10微米厚。
3. 抗原解蜡:将蜡切片浸泡在去蜡溶液中,以去除蜡,并将其进行再水化,以恢复组织的水合状态。
4. 抗原检测:用适当的抗体与特定的抗原结合。
首先,用一种可以结合到抗原的初级抗体处理组织切片。
然后,使用荧光标记的二级抗体结合到初级抗体上,从而使标记可见。
5. 荧光显微镜观察:使用荧光显微镜观察组织切片,并通过选择合适的滤光片来检测和分析特定抗原的荧光信号。
不同的荧光染料可用于标记不同的抗原,以实现多重标记和多抗体检测。
石蜡切片免疫荧光技术具有高度的灵敏性和特异性,可用于检测和研究生物标志物在各种疾病和组织中的分布和表达水平。
石蜡切片免疫荧光实验步骤

石蜡切片免疫荧光实验步骤1、脱蜡至水:将组织切片室温放置10min后,依次将石蜡切片放入二甲苯3min→无水乙醇5min—85%酒精5min—75%酒精5min—ddH2O洗5min。
2、抗原修复:组织切片置于盛满柠檬酸抗原修复液(50X稀释至1X使用)的修复盒中于微波炉内进行抗原修复(中火8min—停火8min—中低火7min)。
此过程中应防止缓冲液过度蒸发,切勿干片。
自然冷却后将玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min(具体修复液和修复条件根据组织来确定)。
3、画阻水圈:切片稍甩干后用组化笔在组织周围画圈,防止液体流失。
4、BSA封闭:在圈内滴加3%-5%浓度BSA孵育30min(或二抗同源血清封闭)。
5、一抗孵育:轻轻甩干封闭液,在切片上滴加按一定比例配好的一抗(溶于血清:PBS=1:19的抗体稀释液体系中),切片平放于湿盒(内加少量水防止抗体蒸发),4°C过夜。
6、二抗孵育:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加相应的荧光二抗,覆盖组织,避光RT孵育50min。
7、DAPI染核:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后在圈内滴加DAPI染液,避光RT孵育3-5min。
8、树脂封片:玻片置于PBS中在脱色摇床上晃动洗涤3次,每次5min。
切片稍甩干后用树脂封片剂封片(其间可滴加少量抗荧光淬灭剂)。
9、镜检拍照:切片于荧光显微镜/confocal/活细胞工作站中观察并采集图像(DAPI紫外激发波长330-380nm,发射波长420nm,发蓝光;FITC激发波长465-495nm,发射波长515-555 nm,发绿光;CY3激发波长510-560,发射波长590nm,发橙光;CY5发红光)。
10、结果判读:DAPI染出来的细胞核在紫外的激发下为蓝色,阳性表达为相应荧光素标记的红光或者绿光,图片处理需使用Image J 软件。
免疫荧光-石蜡切片

石蜡切片免疫荧光操作规程试剂1)二甲苯2)PBS缓冲液3)0.01mol/L柠檬酸盐缓冲液(CB,pH6.0,1000ml):柠檬酸三钠3g,柠檬酸0.4g。
4)goat血清5)一抗稀释液:3%BSA in TBS,pH7.4操作流程1.脱蜡和水化脱蜡前,应将组织切片在室温中放置60min或60℃恒温箱中烘烤20min。
1)组织芯片置于二甲苯中浸泡10min,更换二甲苯后再浸泡10min;2)无水乙醇中浸泡5min;3)95%乙醇中浸泡5min;4)70%乙醇中浸泡5min;2.PBS洗两次各5min。
3.抗原修复,用于福尔马林固定的石蜡包埋组织芯片。
煮沸热修复电炉或者水浴锅加热0.01M枸橼酸钠缓冲溶液(pH6.0)至95℃左右,放入组织芯片加热10~15min,必须等缓冲液冷却后,方能将切片取出。
4.PBS洗5min。
5.滴加5%正常山羊血清,室温封闭30min,甩去多余液体。
6.滴加一抗,室温1小时或者4℃过夜或者37℃1小时(4℃过夜后在37℃复温45min)。
7.PBS洗3次每次5min。
8.滴加荧光标记的二抗,室温避光孵育1h。
(注意抗体针对的种属,使用浓度:Alexa488、Alexa555为1:1000,Cy3、FITC为1:200,用锡箔纸包住培养板放在抽屉中避光。
)9.PBS洗3次每次5min。
10. Hoechst染色:把1000×Hoechst用PBS稀释,50ul/片,染色10min。
11. PBS洗3次每次2 min。
12.封片:Mounting Medium封片,等Mounting Medium凝固后再拍照。
石蜡切片免疫荧光实验步骤

石蜡切片免疫荧光实验步骤
一、样品处理
1、选择适当体积的样品石蜡切片,防止干燥,封好盖子到-80℃,直
到使用时将其取出变性到室温,以备后续操作。
2、室温下取出石蜡切片,施加蛋白酶将切片上原有的细胞、细胞膜
分解,具体操作步骤为:将取出的石蜡切片放入0.1%胰蛋白酶(Protease,Roche)或0.5% Triton X-100溶液中,置于37℃水浴摇床,25min后将石
蜡切片放入3mm×2mm的转移槽内,加入200ul去离子水,搅拌进行超声
处理,30s后用1000ul去离子水冲洗,放入4℃冰箱保存,以备后续操作。
二、组织切片染色
1、在刻线玻片上放入石蜡切片,用吸水棉柱将石蜡切片固定。
2、用0.1%胰蛋白酶(Protease, Roche)或0.3% Triton X-100溶液
浸泡石蜡切片,置于37℃水浴摇床,15min后去除液体,另用500μl去
离子水洗涤,将含有抗体的抗体溶液稀释至0.3μg/ml,加入石蜡切片上,放入35℃恒温箱,反应1h。
3、取出石蜡切片,加入1000μl去离子水洗涤,放入4℃冰箱保存,以备后续操作。
三、免疫荧光检测
1、把石蜡切片放入适量的去离子水中浸泡,去除多余的抗体。
2、将放入去离子水中浸泡的石蜡切片放入多孔玻片,在摇床上稀释FITC标记的抗体,加入石蜡切片上,置于37℃水浴摇床上,1h后去除液体。
石蜡切片免疫荧光组化

免疫荧光组化(IHC)1.脱蜡Ⅰ二甲苯:3 minⅡ二甲苯:3 min1:1二甲苯:无水乙醇:3 min2.复水Ⅰ无水乙醇:3 minⅡ无水乙醇:3 min95%乙醇:3 min70%乙醇:3 min50%乙醇:3 min30%乙醇:3 min3.流动的自来水冲洗:5 min(在水龙头上接一个软管,水流放慢,注意管口要放在载玻片反面)4.抗原修复:20 min用双蒸水配制新鲜的10 mM的二水柠檬酸三钠,调节PH=6,加入0.05%的吐温20,将配制好的柠檬酸盐溶液加到染色缸内,放入玻片(带架子),95℃水浴20 min。
5.室温冷却6.PBS冲洗(每次洗换新的):3X5 min将染色缸中加满PBS,放在水平摇床上,50 rpm,轻摇。
7.透明:10 min配制0.2%的Triton X-100 PBS溶液。
先将载玻片上的PBS吸净,然后用专用笔围绕组织画一个封闭的圆圈,室温晾干后,紧挨内圈再画一个封闭的外圈,室温晾干。
用移液器向封闭圈内加一定量的0.2%的Triton X-100 PBS溶液,保证液体浸没组织。
8.PBS冲洗:3X5 min同步骤6。
9.封闭:30 min(RT)配制1%马血清PBS溶液。
先将载玻片上的PBS吸净,用移液器向封闭圈内加一定量的1%马血清PBS溶液,保证液体浸没组织。
10.孵一抗:在湿盒中4℃过夜。
按比例在封闭液中稀释抗体.先将载玻片上的封闭液轻轻甩掉,将载玻片摆放在湿盒内,用移液器向封闭圈内加一定量的稀释后的抗体溶液,保证液体浸没组织。
11.PBS冲洗:3X5 min同步骤6。
12.孵二抗:30 min(RT,避光)按比例在封闭液中稀释抗体。
先将载玻片上的PBS吸净,用移液器向封闭圈内加一定量的稀释后的抗体溶液,保证液体浸没组织。
13.PBS冲洗:3X5 min同步骤6。
14.梯度脱水30%乙醇:3 min50%乙醇:3 min70%乙醇:3 min95%乙醇:3 minⅡ无水乙醇:3 minⅠ无水乙醇:3 min15.1:1二甲苯:无水乙醇:3 minⅠ二甲苯:3 minⅡ二甲苯:3 min(14-15可选)16.封片将载玻片放在白色纸盒中,在载玻片上滴加适量mounting buffer,盖盖玻片,室温水平放置,过夜后观察。
石蜡切片及免疫荧光

一、石蜡切片1.固定:将新鲜组织切成小块,固定于4%多聚甲醛过夜。
凝固组织中的物质成分,尽可能保持其活体时的结构。
同时能使组织硬化,有利于切片的进行。
2.脱水:为了减少组织材料的急剧收缩,应使用从低浓度到高浓度递增的顺序进行经70%、85%、95%直至纯酒精(无水乙醇),每次时间为1小时。
固定后的组织材料需除去留在组织内的固定液及其结晶沉淀,否则会影响后期的染色效果。
3.透明:常用的透明剂有二甲苯,二甲苯是石蜡的溶剂。
纯酒精不能与石蜡相溶,还需用能与酒精和石蜡相溶的溶剂,替换出组织内的酒精。
材料块在透明剂浸渍过程称透明。
4.浸蜡:先把组织材料块放在熔化的石蜡和二甲苯的等量混合液浸渍1小时。
先后移入2个熔化的石蜡液中浸渍1小时左右。
5包埋:以少许热蜡液将其底部迅速贴附于包埋盒内上,然后置于速冻台,让石蜡固定。
6.切片:切片刀的锐利与否、蜡块硬度是否适当都直接影响切片质量,可将蜡块至于冷水中改变蜡块硬度。
通常切片厚度为3-5um,用毛笔轻托轻放在37度水浴中展片。
7.贴片与烤片:般使用恒温水浴锅,温度控制在37-401左右,有利于石蜡切片的展开,贴好的切片置于60^恒温箱内干燥2小时,蛋白质凝固后即可染色。
8.切片脱蜡及水化:干燥后的切片置于二甲苯中进行脱蜡,然后依次使用从高浓度到低浓度递减的顺序进行经纯酒精、95%、85%、70%进行水化。
9染色:经典的苏木精和伊红:细胞核被苏木精染成紫蓝色,多数细胞质及非细胞成分被伊红染成粉红色。
实验操作简单。
免疫组化:指带显色剂标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应。
二、冰冻切片1.取材:应尽可能快地采取新鲜的材料,防止组织发生死后变化。
2.速冻:1)将组织块平放于软塑瓶盖或特制小盒内(直径约2cm)。
2)如组织块小可适量加OCT包埋剂浸没组织,然后将特制小盒缓缓平放入盛有液氮的小杯内。
3)当盒底部接触液氮时即开始气化沸腾,此时小盒保持原位切勿浸入液氮中,大约10-20S组织即迅速冰结成块。
石蜡冰冻片免疫荧光染色程序

1.石蜡片二甲苯、酒精梯度脱蜡复水;2.透化。
0.25%TritonX-100处理细胞10-30分钟;3.抗原修复。
微波热修复(柠檬酸盐修复液或EDTA抗原修复液)6分钟两次,中间间隔5分钟。
冷却至室温。
4.滴加与二抗同源的正常血清封闭(如10%山羊血清),室温20分钟。
甩去多余液体,不洗。
5.滴加适当稀释的一抗,37C1~2小时或4℃过夜。
0.01MPBS洗2分钟×3次。
6.滴加一抗相对应的荧光素标记二抗,37℃避光孵育30-60分钟。
0.01MPBS洗2分钟×3次。
7.DAPI染细胞核2-5分钟,清洗。
8.抗荧光衰减封片剂封片。
荧光显微镜观察。
1.冰冻片从冰箱取出后PBS浸泡恢复至室温;2.透化。
0.25%TritonX-100处理细胞10-30分钟;3.抗原修复。
预实验可以尝试不修复,若结果不理想可尝试蛋白酶消化10分钟(为主),或微波热修复(柠檬酸盐修复液或EDTA抗原修复液)6分钟两次,中间间隔5分钟。
冷却至室温。
4.滴加与二抗同源的正常血清封闭(如10%山羊血清),室温20分钟。
甩去多余液体,不洗。
5.滴加适当稀释的一抗,37℃1~2小时或4C过夜。
0.01MPBS洗2分钟×3次。
6.滴加一抗相对应的荧光素标记二抗,37℃避光孵育30-60分钟。
0.01MPBS洗2分钟×3次。
7.DAPI染细胞核2-5分钟,清洗。
8.抗荧光衰减封片剂封片。
荧光显微镜观察。
最新石蜡切片免疫组化及免疫荧光染色方法整理

石蜡切片免疫组化及免疫荧光染色方法1、组织的采集、固定和保存:采取组织后,方法一:4%多聚甲醛(4%PFA)4C 固定1小时(根据组织大小和致密程度调整固定时间)或过夜方法二:采用bouin’s固定RT 2h(6-8d tesis)or RT 过夜(成年tesis)PBS缓冲液洗三次,每次5min,4C保存于70%乙醇中。
2、组织的包埋、切片、展片及保存::固定后的样品经梯度乙醇脱水、二甲苯透明,52-54C石蜡包埋,常规切片,切片厚4 -10m,贴于处理过的干净载玻片上,37C烤片过夜,之后收集于载片盒中,RT密封保存。
石蜡包埋:保存于4C 70%乙醇中的组织样品80%乙醇15 min95%乙醇15 min100%乙醇15min 21/2乙醇1/2二甲苯15 min二甲苯透明5-10 min1/2二甲苯1/2石蜡30 min石蜡(1) 1.5hr石蜡(2) 1.5-2.5hr石蜡(3)包埋RT保存3、石蜡组织切片的免疫组化方法:密封保存于RT的组织切片二甲苯(1) 20 min二甲苯(2) 20 min100%乙醇20min95%乙醇10 min80%乙醇10 min通风橱晾干,阻水笔在组织周围画圈切片在PBS中浸泡 5 min*20.4%Tritonx RT 10 min切片在PBS中浸泡 5 min*33%H2O2 RT 10min切片在PBS中浸泡 5 min*30.25%胰酶RT 10min切片在PBS中浸泡 5 min*3Blocking buffer(3%BSA+5%NGS+0.2%Tritonx-100 in PBS) RT 60min倾去blocking buffer,勿洗一抗4C overnight in blocking buffer取出切片复温1h,切片在PBS中浸泡 5 min*3二抗in blocking buffer GAR1:200 (GAM1:100),RT 1h切片在PBS中浸泡 5 min*3DAB显色5-10min(50微升A+50微升B+900微升PBS+5微升3%H2O2)如果是增强型DAB只要1min即可。
免疫荧光染色步骤

免疫组织化学染色步骤1.将石蜡切片二甲苯脱蜡(二甲苯Ⅰ20min→二甲苯Ⅱ10min)、入水(100%酒精Ⅰ5min→100%酒精Ⅱ3min→95%酒精2min→80%酒精1min→70%酒精1min),蒸馏水冲洗后,0.01M PBS冲洗,5min×3次;2.枸橼酸盐缓冲液微波抗原修复,加热使水温达92-96℃,维持10-15min,自然冷却至室温,0.01M PBS冲洗,5min×3次;3.3%H2O2溶液,37℃,20 min,以消除内源性过氧化物酶的活性,0.01M PBS 冲洗,5min×3次;4.正常羊血清封闭,37℃,30 min;5.倾去多余血清,滴加一抗,37℃2小时或者4℃过夜,0.01M PBS冲洗,5min×3次;6.滴加二抗工作液,37℃,30 min,0.01M PBS冲洗,5min×3次;7.滴加三抗工作液,37℃,30 min,0.01M PBS冲洗,5min×3次;8.DAB避光显色,显微镜下控制显色时间;9.0.01M PBS终止显色;10.梯度酒精脱水(70%酒精1min→80%酒精1min→95%酒精Ⅰ1min→95%酒精Ⅱ1min→无水酒精Ⅰ10min→无水酒精Ⅱ10min),二甲苯透明(二甲苯Ⅰ15min →二甲苯Ⅱ10min;11.中性树胶封片。
免疫荧光染色步骤(1)将组织切片脱蜡入水;(2)抗原微波修复,温度92℃-96℃,10-15min,自然冷却至室温;(3)正常羊血清封闭,37℃,60 min;(4)倾去多余血清,滴加一抗,37℃2小时或者4℃过夜,PBS冲洗,5min×3次;(5)滴加荧光素标记的二抗,避光,37℃,60 min,0.01M PBS冲洗,5min×3次;(6)防淬灭封片剂封片,4℃,避光保存。
(7)荧光显微镜观察拍照。
细胞免疫组化染色(培养板中染色)1.培养的细胞,弃去培养基,冷的PBS洗两次,首先用4%多聚甲醛(4孔板200μl)固定10min,PBS洗2次,每次5-10分钟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
石蜡切片免疫荧光染色
方法
HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
对于石蜡切片:
1、烤片:60℃ 60分钟
2、脱蜡:二甲苯中Ⅰ脱蜡15分钟→二甲苯Ⅱ脱蜡15分钟→无水乙醇Ⅰ5分钟→无水乙醇Ⅱ5分钟→90%乙醇Ⅰ5分钟→90%乙醇Ⅱ5分钟→70%乙醇5分钟
→蒸馏水5分钟→蒸馏水5分钟。
3、抗原修复:高压修复,事先烧开锅中的水,修复盒中加入l柠檬酸钠,(柠檬酸三钠 3g,柠檬酸 0.4g加入1000ml蒸馏水中),上汽后加热10分钟,关火。
修复盒取出,放入装有自来水的瓷缸中缓慢冷却至室温。
2. 去除内源性酶:玻片取出放入湿盒,加3%H
2O2
2
(2ml H
2
O2
2
加入18ml蒸馏水
中,现配现用,避光),室温孵育10分钟,PBS洗3次,每次5分钟。
(也可不用去除内源性酶)。
3. 封闭(Blocking)
加10%正常驴血清(原液100ul+900ulPBS,1ml够用30张片子),室温孵育封闭30分钟。
如果背景较高,可以4℃封闭过夜。
不用洗,用滤纸吸干周边水分。
从封闭开始所有的步骤,一定要注意样品的保湿,避免样品的干燥,否则极易产生较高的背景。
4. 一抗孵育(Primary antibody incubation)
参考一抗的说明书,按照适当比例用(10%山羊血清PBS或1%BSA-PBS)稀释一抗。
立即加入稀释好的一抗, 4℃过夜,第二天取出复温45分钟。
PBS洗3次,每次5分钟。
5. 二抗孵育(Secondary antibody inucubation)
按照适当比例用稀释荧光标记的二抗,立即加入稀释好的二抗,室温或4℃在侧摆摇床上缓慢摇动孵育一小时。
PBS洗涤3次。
每次5分钟。
如果结果背景较高,可以适当延长洗涤时间并增加洗涤次数。
6. 蛋白检测(Detection of proteins)
7. 复染
用DAPI对细胞核进行染色,室温10分钟,PBS冲洗5分钟×3次,封片(封片剂或分析纯的甘油与碳酸缓冲液1:1混合)显微镜观察,染色后为蓝色荧光。
多重荧光染色:可使用红色荧光、绿色荧光和蓝色荧光进行三重荧光染色。
例如用进行红色荧光染色,随后可以用进行绿色荧光染色,在完成上述两种染色后可以使用对细胞核进行染色,染色后为蓝色荧光。
碳酸缓冲液配方:
NaHCO3 3.7g
Na2CO3 0.6g
双蒸水溶解至100ml,调节pH至。
