滴定分析的计算
滴定分析的计算

0.5000×V+0.09760×4800 = 0.1000 ×(4800+V)
V=28.80mL
2. 标定溶液浓度的有关计算
基本公式:
mA a cBVB MA b
例1: 称取邻苯二甲酸氢钾(KHP)基准物质0.4925
克,标定NaOH溶液,终点时用去NaOH溶液 23.50mL,求NaOH溶液的浓度。MKHP=204.2 解: NaOH + KHP = NaKP + H2O
已知:M(KHP)=204.22 g.mol-1,
M(H2C2O4.2H2O)=126.07 g.mol-1
解:以邻苯二甲酸氢钾(KHP)为基准物质, 其滴定反应为: KHP + NaOH = KNaP + H2O 即 nKHP nNaOH
mKHP (cV )NaOH M KHP
V=20 mKHP=0.10 g.mol-1 2010-3L204.22 g.mol-1=0.40g V=25 mKHP=0.10 g.mol-1 2510-3L204.22 g.mol-1=0.50g
3.被测物质的质量和质量分数的计算
基本公式:
a m A cBVB M A b m A a cBVB M A wA mS b mS
例1: 测定工业纯碱Na2CO3的含量,称取
0.2560g试样,用0.2000mol.L-1 HCl标液滴
定,若终点时消耗HCl标液22.93mL,计 算试样中Na2CO3的百分含量。
解: Ca2+ + C2O42- = CaC2O4
CaC2O4 + H2SO4 = CaSO4 + H2C2O4 = 10CO2 +2MnSO4+K2SO4 + 8H2O
第三节 滴定分析的计算

n
A
t
n
T
例如:已知基准物质的质量mT,求被滴定溶液的浓 度CA ,则用:nA = CA VA nT = mT/MT
即:
am CV t M
A A
T
T
本节小结
1、滴定液配制的计算 配置前物质的状态是固体: CTVT = mT/MT 配置前物质的状态是液体: C1V1 = C2V2 2、滴定分析的计算 反应式:aA + tT cC + dD A为待测物质,T为滴定液 基本计算公式:aA = a/t ·nT ①若待测物A为液体,滴定剂B为液体,即液-液反应,则:
C1V1=C2V2
一、滴定液配制的计算 (二)应用实例 例1 准确称取基准K2Cr2O7 5.001g,溶解后稀释至1000ml 的容量瓶中,则配成的K2Cr2O7浓度是多大? C(K2Cr2O7) = m/MV = 0.01670 mol/L 例2 欲配制浓度为0.1mol/L盐酸溶液1000ml,应取浓度为 12mol/L的浓盐酸的体积为多少毫升? VHCI = C2V2/C1 = 8.3(ml) 例3 市售浓盐酸密度为1.19g/ml,质量分数为0.37,求浓 盐酸物质的量浓度。 1000ρω
V(NaOH) = 23.80(ml) 2、滴定液的标定 (1)用基准物质标定滴定液 例2 为标定HCI溶液,去硼砂(Na2B4O7· 10H2O) 0.4709g,用HCI滴定至化学计量点,消耗HCI25.20ml,求 HCI溶液的物质的量浓度。 C(HCI)=0.09803(mol/L)
例1
(二)应用实例 2、滴定液的标定 (2)用另一已知准确浓度的滴定液标定 例3 20.00ml未知浓度的NaOH溶液,用0.09984mol/L的 HCI滴定液滴定,达到计量点时用去22.40ml HCI溶液,计 算此NaOH溶液的物质的量浓度。 3、含量计算 C(NaOH)= 0.1118(mol/L)
分析化学第三章第三节滴定分析中的计算

VT TT / B B% 100% ms
14
3. 待测物质质量和质量分数的计算
设试样的质量为ms,则待测组分B在试样中的质量分数wB 为:
mB b cTVT M B wB ms t ms 若用百分数表示质量分数, 则将质量分数乘以100即可。
15
6、计算实例
例1 配0.01000mol/L K2Cr2O7标准溶液250.0mL,求m?
TT / B
mB VT cT cT 1000 mB TT / B M B VT M B
nT cT VT t 又 nB b mB M B TT / B cT M B b 1000 t
!
(3.9)
注:TT/B单位为[g/mL]
13
(3)被测物质百分含量的计算
当滴定剂的浓度用滴定度TT/B表示时,则被测组分B的 百分含量可由下式求得:
22
例:称取铁矿样 0.5000g ,溶解还原成 Fe 2 + 后,用 T(K2Cr2O7/Fe)=0.005022g· mL-1的重铬酸钾标准溶
液滴定,消耗25.10mL,求T(K2Cr2O7/Fe3O4) 和试
样中以Fe、Fe3O4表示时的质量分数。
解Cr2O72-+6Fe2++14H+→2Cr3++6Fe3++7H2O
0.0002 Er 0.08% 0.1% 0.25
为使称量误差在±0.1%以内,可以称取10 倍量的K2Cr2O7 (即0.25g左右)
溶解并定容在250ml 容量瓶中,然后用移液管移取25.00ml 三份进行标
定。这种方法俗称 “称大样”,可以减小称量误差。 如果基准物质的摩尔质量较大,或被标定溶液的浓度较大,其称样质量
-的基本单元:
4.6 滴定分析的计算

3.求待测组分 的质量分数及质量浓度 求待测组分A的质量分数及质量浓度 求待测组分
设测定时称取试样的质量为ms (g) 设测定时称取试样的质量为 则待测组分的质量分数为
mA wA = ms
c BV B M A wA = ms
量取试液的体积为Vs (L) 量取试液的体积为 待测组分的质量浓度为
mA cBVB M A ρA= = Vs Vs
基本单元的确定
2HCl + Na2CO3 2NaCl + H2O + CO2↑
反应中盐酸给出一个质子,碳酸钠接受2 反应中盐酸给出一个质子,碳酸钠接受2个 1 质子,因此分别选取 选取HCl和 Na2CO3 作为 质子,因此分别选取 和 2 基本单元。 基本单元。由于反应中盐酸给出的质子数必 定等于碳酸钠接受的质子数, 定等于碳酸钠接受的质子数,因此根据质子 转移数选取基本单元后, 转移数选取基本单元后,反应到达化学计量 点时: 点时: 1 n(HCl) = n( Na2CO3)
解: 反应过程如下
2Fe2++MnO2(s)+4H+ 2Fe3++Mn2++2H2O Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O
由反应式可知
1 2+)-n( 1 K Cr O ) n( MnO2)=n(Fe - 2 6 2 2 7 1 c( 6 K2Cr2O7) =6c(K2Cr2O7)
例1:
溶液500.00mL,需用 2C2O4 · 2H2O 需用Na 溶液 需用 多少克? 多少克 已知Na 解: 已知 2C2O4 · 2H2O的Mr=170.0 则 的
第三节 滴定分析的计算

T
3、物质的量浓度和滴定度之间的换算关系
T
T
A
a C M 10 t
T T
3
二、滴定分析的计算 (一)计算公式 4、被测物质的含量的关系 ①被测物质的含量用质量分数表示时,mA表示样 品中被测物质的质量,单位为g;ms为样品的取样量, mA 单位为g:
A
②被测物质的含量用百分含量表示时:
(三)滴定分析解题的步骤 1、首先要弄清楚题目中已知什么,求什么。 2、根据滴定反应列出比例关系 n=CV nA = a/t ·Nt 3、根据题意应用两个公式,即: n = m/ M 选择的基本原则是:若题目中已知或要求的涉及物 质的浓度,则选用公式:n=CV;若涉及质量,则选用 公式:n=m/M。 a 4、分别将nA和nT代入关系式:
m T V m m
A T / A A s s
A
T
m T V A% 100% 100% m m
T / A T s s
二、滴定分析的计算 (二)应用实例 1、估算消耗滴定液的体积
精密称取0.1500g草酸(H2C2O4· 2H2O)溶于适量 的 水中,用浓度为0.1000mol/L的NaOH滴定液滴 定至终点,问大约消耗多少毫升NaOH滴定液?
A s
3 s
m a C V M 10 m t m
A s
m T V m m
A T / A A s s
T
4、物质的量浓度和滴定度之间的关系:
T
T
A
a C M 10 t
T T
3
练
习
例:用0.02718 mol· L-1的高锰酸钾标准溶液测 定铁含量,其浓度用滴定度表示为: TFe/KMnO4 = 0.007590g· mL-1 消耗KMnO4溶液20.00ml,求该样品中铁的含量 是多少? 解 : 滴 定 度 即 表 示 : 1mL KMnO4 标 准 溶 液 相 当 于 0.007590g Fe,测定时,根据滴定所消耗的标准 溶液体积,可方便地确定试样中铁的含量:
第六节 滴定分析中的计算
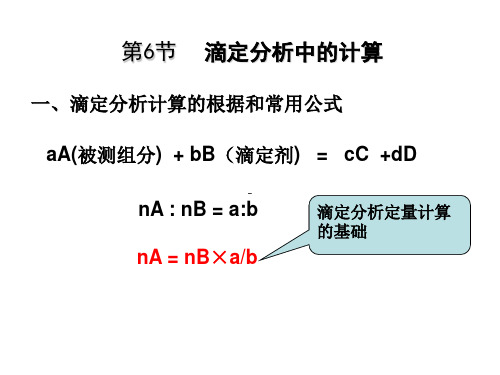
(三)物质的量浓度与滴定度间的换算
滴定度是指每毫升标准溶液所含溶质的质量,即:
TB / A mA / VB
B为标准溶液的化学式 mA:g VB:mL A为被测物质的化学式
cB 1.00103 nB b TB / A / M A nA a
10 TB / A b cB MA a
滴定分析定量计算 的基础
设体积为VA的被滴定物质的溶液其浓度为cA, 在化学计量点时用去浓度为cB 的滴定剂体积为VB 。 则:
cA×VA = cB×VB×a/b 或 mA/MA =(a/b) cB×VB V:L m:g M:g.mol-1
c:mol.L-1
通常在滴定时,体积以mL为单位来计量,运算时 要化为L,即 mA/ MA= (cB×VB/1000)×a/b
(二) 标定溶液浓度的有关计算
基本公式
mA / M A (a / b)cBVB
例3 用Na2B4O7· 2O标定HCl溶液的浓度,称取 10H 0.4806g硼砂,滴定至终点时消耗HCl溶液25.20mL, 计算HCl溶液的浓度。 解:Na2B4O7+2HCl +5H2O = 4H3BO3 +2NaCl nNa2B4O7=(1/2)nHCl (m/M)Na2B4O7=(1/2)(cV)HCl cHCl=0.1000 mol.L-1
CaC2O4 + H2SO4
CaSO4 + H2C2O4
10CO2 +2MnSO4+K2SO4 + 8H2O
5H2C2O4+2KMnO4+3H2SO4
2KMnO4
5H2C2O4
5CaC2O4
5Ca2+
滴定分析的计算

.6 滴定分析的计算4.6.1 原料药含量测定结果计算原料药含量一般用百分含量(g/g)来表示。
例如:对氨基水杨酸钠含量测定取样品约0.4g,精密称定,用水18ml和盐酸溶液(1→2)15ml溶解,用亚硝酸钠标准液(L)滴定,每1ml的亚硝酸钠标准液(L)相当于的无水对氨基水杨酸钠。
假设取样量0.4326g,亚硝酸钠标准液浓度为L,终点时消耗,计算其含量(干燥失重%)。
实验测得的量含量=───────×100%供试品量已知,实验测得的量=VFT 供试品的量=W/N标准为终点时消耗标准液的体积(ml)其中V标准W 为称样量F 为浓度因数T 为滴定度N 为稀释倍数稀释倍数的意义为:第一次取样量为最后测定用供试品量的倍数。
原料药中一般为1。
原料药含量计算公式V标准×F×T×N V标准×C实际×T×N含量=────────×100%= ──────────×100%W W×C理论一般原料药含量是以干品计算,则原料药含量计算公式为:V标准×C实际×T×N含量=─────────────────×100%W×C理论×(1-干燥失重百分数)×××1则对氨基水杨酸钠含量=─────────────×100%=%。
××(1-%)4.6.2 液体制剂的含量测定结果计算液体制剂含量一般以相当于标示量的百分数表示。
标示量对固体制剂,即每一个单元制剂中所含药品的规定量;对液体制剂,最常用的表示方法为:每1ml中含有药物的规定量,或者本制剂的规定浓度。
例如:氯化钾注射液,规格为10ml:1g,它的标示量为0.1g或10%。
其含量测定方法;精密量取本品10ml,置100ml量瓶中,加水至刻度,摇匀,精密量取10ml,加水40ml,加糊精溶液(1→50)5ml,与指示剂5~8滴,用硝酸银标准液(L)滴定即得。
滴定分析中的计算

滴定分析中的计算
3. 估计消耗标准溶液的体 【例积3-7】
称取0.3000 g草酸(H2C2O4·2H2O)溶于适量水后,用KOH溶液 (0.2 mol·L-1)滴定至终点,问大约消耗此溶液多少毫升?
解:该滴定反应为 有关各物质之间的量的关系为 所以
即大约消耗KOH溶液24 mL。
滴定分析中的计算
解:该滴定反应式为 有关各物质之间的量的关系为
即试样中Na2CO3的百分含量为94.47%。
滴定分析中的计算
【例3-10】
称取CaCO3试样0.2501 g,用0.2602 mol·L-1的盐酸标准溶液 25.00 mL溶液,回滴过量的酸用去0.2450 mol·L-1的NaOH标准溶液 6.50 mL,求试样中CaCO3的百分含量。
解:已知cK2Cr2O7=0.02 mol·L-1,VK2Cr2O7=500.00 mL,则
滴定分析中的计算
【例3-6】
标定0.10 mol·L-1的NaOH溶液时,希望滴定时用去NaOH滴定液 20~25 mL,应称取邻苯二甲酸氢钾基准物质多少克?
解:该标定反应式为
有关各物质之间的量的关系为
即应称取邻苯二甲酸氢钾基准物质0.41~0.51 g。
滴定分析中的计算
二、 滴定分析计算示例 1. 计算被测溶液浓度 【例3-3】
用0.1043 mol·L-1的H2SO4标准溶液滴定25.00 mL NaOH溶液时, 用去硫酸溶液 24.21 mL,计算该NaOH溶液的浓度。
解: 该滴定反应式为
有关各物质之间的量的关系为
所以
滴定分析中的计算
【例3-4】
4. 物质的量浓度和滴定度的相互换算
滴定度是每毫升标准溶液相当于待测物质的质量。标准溶液 与被测物质反应为
滴定分析计算

cBVB = cAVA
(2-3)
若被测物质为固体物质, 到
达化学计量点时, 由式(2-1)和式
(2-3) 可得到:
cBVB
mA MA
mA cBVBM A
(2-4)
滴定分析在实际操作时, 体积 常以毫升为计量单位, 若将体积 化为以升为单位, 则上式可改为:
mA
cB
VB 1000
M A或mA
cBVBM A
C
1000
mBA
MA
mA
cBVB M A 1000
若试样质量为ms, 则被测组分的质量
分数为
wA
cBVB M A 1000 ms
例6:
欲测定大理石中CaCO3含量, 称取大理石试样0.1557g, 溶解后 向试液中加入过量的(NH4)2C2O4, 使Ca2+成CaC2O4沉淀析出, 过滤、 洗涤, 将沉淀溶于稀H2SO4, 此溶 液中的C2O42-需用15.00mL 0.04000mol/L KMnO4标准溶液 滴定, 求大理石中CaCO3的含量。
解: 反应式为
H2C2O4 + 2 NaOH Na2C2O4 + 2H2O
根据等物质的量反应规则
n(NaOH) = n(
1 2
H2C2O4)
因1
Mr 126.08
M ( 2 H2C2O4 ·2H2O ) 2 2 63.04
故 w(H2C2O4
·2H2O)
c(NaOH) V
(NaOH) M (1 2
n(
1 2
I
2
)
n(S2O32-
)
n(
1 6
K
2Cr2O7
)
又知:
滴定分析的计算讲解

例2 为了标定Na2S2O3溶液,精密称取K2Cr2O7
2.4530g,溶解后配成500mL溶液,量取此K2Cr2O7溶
液25.00mL,加H2SO4及过量KI, 再用Na2S2O3待标液
滴定析出的I2, 用去26.12mL, 求Na2S2O3的浓度。
解:反应过程如下: Cr2O72- + 6I- + 14H+ → 2Cr3+ + 3I2 + 7H2O I2 + 2S2O32→ 2I- + S4O626S2O32-
滴定分析法的计算
一、滴定分析计算的依据 对于任一滴定反应 tT +aA → P T为滴定剂,A为待测物质,P为生成物。 1.方法一:按反应的计量关系
t a t n 或 T nT nA a nA
C A VA a CT VT t
对固体物质
mA
a CTVT M A t
例1 测定工业纯碱Na2CO3的含量,称取0.2560克试样,
1Cr2O72- 3I2
C Na2 S2O3VNa2 S2O3 6CK 2Cr2O7 VK 2Cr2O7 6C K 2Cr2O7 VK 2Cr2O7 VNa2 S2O3 2.4530 6 294.19 25 0.5 0.0958 m ol/ L 26.12
C Na2 S2O3
称取0.1500gNa2C2O4基准物,溶解后在强酸性溶液中
用KMnO4溶液滴定,用去20.00mL,计算
C(1/5KMnO4)及高锰酸钾对铁的滴定度。
n(1/2Na2C2O4)=n(1/5KMnO4)
2MnO 5C2O 16H 2Mn 10CO2 8H 2O
4
滴定分析中的计算

滴定分析中的计算一、滴定分析计算的依据设标准溶液(滴定剂)中的溶质B与被滴定物质(被测组分)A之间的化学反应为:aA + bB = cC + dD反应定量完成后达到计量点时,b mol的B物质恰与a mol的A物质完全作用,生成了c mol的C物质和d mol的D物质。
完全反应反应前和反应后物质的量相等。
溶液稀释前后,其中溶质的物质的量不会改变C浓V浓=C稀V稀二、滴定分析法计算实例1.标准溶液的配制(直接法)、稀释与增浓的计算基本公式:例一已知浓盐酸的密度为1.19g.mL-1,其中HCl含量约为37%。
计算:(1) 每升浓盐酸中所含HCl的物质的量和浓盐酸的浓度。
(2) 欲配制浓度为0.10mol. L-1的稀盐酸5000mL,需量取上述浓盐酸多少毫升?已知:M HCl=36.46 g.mol-1C 浓⨯V 浓=C 稀⨯V 稀12⨯ V 浓=0.10⨯5000V 浓=41,67ml例2:现有HCl 液(0.09760mol.L -1)4800mL, 欲使其浓度为0.1000mol.L -1,问应加入HCl 液(0.5000mol.L -1)多少?(C 原⨯4800)+0.5000⨯V 加=0.1000⨯(4800+V 加)V 加=28.8ml2. 标定溶液浓度的有关计算基本公式:例1:用Na2CO3标定用25mL 左右滴定液,问应称取基准Na2CO3多少克?已知: M (Na2CO3)=106.02/2=53.01g.mol-12HCl + Na2CO3 = 2 NaCl +CO2 +H2OC HCl⨯V/1000=m/M(Na2CO3)称取邻苯二甲酸氢钾(KHP)基准物质0.4925克,标定NaOH溶液,终点时用去NaOH溶液23.50mL,求NaOH溶液的浓度。
M例2:要求在标定时用去0.10 mol.L-1 NaOH溶液20~25mL,问应称取基准试剂邻苯二甲酸氢钾(KHP)多少克?,如果改用草酸(H2C2O4.2H2O)作基准物质,又应称取多少克?从计算结果能看出什么结论?已知:M(KHP)=204.22 g.mol-1,M(H2C2O4.2H2O)=126.07 /2=63.035g.mol-1解:以邻苯二甲酸氢钾(KHP)为基准物质,其滴定反应为:KHP + NaOH = KNaP + H2O即C NaOH⨯V/1000=m/M(KHP)M= C NaOH⨯V ⨯M(KHP)/1000=0.10⨯20⨯204.22=0.408 V=20 m KHP=0.10 ⨯20⨯204.22 /1000=0.40gV=25 m KHP=0.10 ⨯25⨯204.22/1000 =0.50g因此,以邻苯二甲酸氢钾(KHP)的称量范围为0.40~0.50g若改用草酸(H2C2O4.2H2O)为基准物质,此时的滴定反应为:H2C2O4 + 2NaOH = Na2C2O4 + 2H2O即V=20 m H2C2O4.2H2O =.10 ⨯20⨯126.07/2000=0.13gV=25 m H2C2O4.2H2O =0.10 ⨯25⨯126.07/21000=0.16g因此,草酸(H2C2O4.2H2O)的称量范围为0. 13~0.16g结论由于邻苯二甲酸氢钾(KHP)的摩尔质量较大,草酸(H2C2O4.2H2O)的摩尔质量较小,且又是二元酸,所以在标定同一浓度的NaOH溶液时,后者的称量范围要小得多。
第3章滴定分析概论2 分析计算及质子平衡式

(m / M ) K2Cr2O7
6 0.4903 0.2500 cNa2S2O3 294.18 24.95103 0.1002mol / L
已知在酸性溶液中,KMnO4与Fe2+反应时, 1.00ml KMnO4溶液相当于0.1117g Fe,而 10.00ml KHC2O4∙H2C2O4溶液在酸性介质中 恰好和2.00ml上述KMnO4溶液完全反应, 问需要多少毫升0.2000mol/L NaOH溶液才
[Na+] = [Cl又称作 标签浓度;
平衡浓度指溶液中实际存在的微观浓 度。
分析浓度等于各型体平衡浓度之和。
• 溶液中某型体的平衡浓度在溶质总浓
度中所占的分数。
i [i]/ c
注:分布分数是宏观可以测定的量(分 析浓度)和微观真实的量(平衡浓度) 之间的桥梁,类似于物质的量的概念。
• 某型体的分布系数决定于酸碱或者配 合物的性质、溶液的酸度或游离配体 的浓度,与总浓度无关。
i [i]/ c
能定量说明溶液中各型体的分布情况 由分布系数可求得溶液中各种型体的
平衡浓度 计算滴定分析中的副反应系数 考察滴定反应的完全程度 预计分步滴定的可能性
质量平衡(Mass balance) 电核平衡 质子平衡
一、滴定分析计算的依据 二、滴定分析法的有关计算
计算的依据为“等物质的量规则”。 该规则的内容为:当标准溶液与被测
物质刚好反应完全时,参与反应的被 测物质与标准溶液的基本单元的物质 的量相等。
数学表达式为:
tT bB cC dD
nT : nB = t : b
nT
V = 500.0ml
wB
滴定分析法

6m(KIO3 ) c( Na 2S2O3 ) M (KIO3 )V ( Na 2S2O3 )
22
例5
1 2 2 c (S2 O3 ) V (S2O3 ) M (K 2Cr2O 7 ) = 6 ms 1 0.2000mol L1 0.02500L 294.2g mol 1 = 6 0.5000g
= 49.03%
24
3. 间接滴定法
例: 测人体血液中的含钙量,先取2.00 mL血液样品,稀释后用(NH4)2C2O4溶 液处理,使Ca2+生成CaC2O4 沉淀,将 沉淀过滤洗涤后溶解于强酸中,然后用 0.0100 mol· -1 的KMnO4标准溶液滴定, L 用去1.20 mL。试计算c(Ca2+)。
例2 配制1L的0.1mol · -1的NaOH溶液,需称固 L 体NaOH多少克?{M(NaOH)= 40 g · -1} mol
16
例3
准确称取8.495g AgNO3固体,定量转移到 500mL的容量瓶中,求c(AgNO3)。 已知{M(AgNO3)= 169.9 g · -1} mol
量方程
差;
3
2HCl+Na2CO3=2NaCl+H2CO3
滴定管 滴定剂 化学计量点(sp) Stoichiometric point 滴定终点(ep) End point 终点误差 (Et )
被滴定溶液
4
二. 滴定分析的方法
第四节 滴定分析中的计算

0.1000 0.0999 0.1018 c NaOH ( 真 实) 0.0999 c NaOH ( 真 实) c NaOH ( 真 实) 0.1017mol . L
例1:
要加多少毫升纯水到1.000103 mL 0.2500 mol.L-1 HCl溶液中,才能 使稀释后的标准溶液对CaCO3的滴 定度THCl/CaCO =0.01001 g.mL-1 ? 已知:M CaCO3=100.09g.mol-1
3
解:HCl与的CaCO3反应为 CaCO3 + 2H+ = Ca2+ + H2O + CO2 即 b/a =2 稀释后HCl的标准溶液的浓度为:
解: 2HCl + Na2CO3 = 2 NaCl + CO2 + H2O
1 n Na 2CO3 nHCl , 故 2 M Na 2CO3 1 m Na 2CO3 C HCl VHCl 2 1000 M Na 2CO3 1 THCl / Na 2CO3 C HCl 2 1000 1 106.0 1 0.2000 0.01060g .mL 2 1000
1 nNa2CO3 nHCl 2 M Na2CO3 1 1 106 .0 mNa2CO3 C HClVHCl 0.2 25 0.2 g 2 1000 2 1000
例2:
用分析天平称量时一般按±10%为允许的称 量范围,称量范围为0.2 ±0.2×10%=0.2 ±0.02g, 即0.18~0.22g。
nCaCO3 5 nKMnO4 2
5 C KMnO 4VKMnO 4 2 5 5 15.00 mCaCO3 C KMnO 4VKMnO 4 M CaCO3 0.04000 100.09 0.1501g 2 2 1000 0.1501 CaCO3 % 100% 96.43% 0.1557 nCaCO3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
➢ 等物质的量反应规则
在滴定分析中,为了便于计算分析结果,规定了标准滴 定溶液和待测物质选取基本单元的原则:酸碱反应以给出或接 受一个H+的特定组合作为基本单元;氧化还原反应以给出或 接受一个电子的特定组合作为基本单元,EDTA配位反应和卤 化银沉淀反应通常以参与反应物质的分子或离子作为基本单元。
0.101 1 3 0 5 5.0 30
0.0053g8/m 0L
➢ T与C之间的换算 1.标准滴定溶液的浓度
例 T NaOH /HCl =0.004420g/mL的HCl溶液,相当于物 质的量浓度c(HCl)为多少?换算成应为多少?已知
M(Na2CO3)=106.0g/mol
解: 根据滴定度的定义有:
cA
T
103 MB
c ( H C l) T N a O H /H C l 1 0 0 0 0 .0 0 4 4 2 0 1 0 0 0 0 .1 1 0 5 m o l/L M ( N a O H ) 4 0 .0 0 1
T N a 2 C O 3 /H C l c (H C l) M (2 1 N 0 0 a 0 2 C O 3 ) 0 .1 1 0 5 5 1 3 0 .0 0 0 0 0 .0 0 5 8 5 7 g /m L
c( 1 A)M( 1 B)
TB/ A
ZA
ZB
1000
或
c( 1 A) TB/ A 1000
ZA
M( 1 B)
ZB
➢ T与C之间的换算 1.标准滴定溶液的浓度
例 计算(HCl)=0.1015mol/L的HCl溶液对Na2CO3 的滴定度。
解: 根据滴定度的定义有:
cA
T
10 3 MB
T N2C a3 O /H Ccl(H C1l)-3 0 •(1 2N2C a3)O
1
n( B)
c( 1 B) ZB
ZB
VB
mB VBM(Z1B
B)
➢ 直接配制法
1.标准滴定溶液的浓度
例3-6 欲将c(Na2S2O3)=0.2100 mol/L,250.0mL 的Na2S2O3溶液稀释成c(Na2S2O3)=0.1000 mol/L, 需加水多少毫升?
解: 设需加水体积为V mL,根据溶液稀释前后其溶质的物质的
解: 滴定反应式为 H2SO4 + Na2CO3 = Na2SO4 + CO2↑+ H2O
w H 2S4O c(1/2H 2S4O )m V sH 2S1 4O M 0 (1/0 2N 0 2C a3)O 100
w H 2S4 O 0 .2
0 12 .3 80 2 1 /2 1.0 1 60 907 10 0 0 .20 009
➢ T与C之间的换算 1.标准滴定溶液的浓度
滴定度
指每毫升标准滴定溶液相当于被测物质的质量(g或mg)。 以TB/S表示,单位g/mL。
TB/S=mB/VS mB是待测物质的质量,VS是标准滴定溶液的体积。例如 TFe/K2Cr2O7=0.005585g/mL,表示每毫升K2Cr2O7标准滴定溶液 可以与0.005585g Fe2+反应。
2.待测组分含量
滴定分析中,可得到三个测量数据,即称取试样的质量
ms(g)、标准滴定溶液的浓度(mol/L)、滴定至终点时的标 准滴定溶液消耗体积VA(mL)。若设测得试样中待测组分B的质 量为mB(g),则待测组分B的质量分数wB(数值以%表示)为
w B(m B/m S)100
根据等物质的量规则,得
化学分析检验技术
课程主讲人:白立军
滴定分析的计算
标准滴定溶液的浓度 待测组分含量
等物质的量反应规则
在滴定反应中,参加反应的两种物质之间其物质的量
相等。即组分A物质的量nA和组分B物质的量nB相等。此规 则称为等物质的量反应规则,这是滴定分析定量计算的基
础。
nA nB
滴定分析计算的依据
a A bB cC dD nB:nAb:a
解: 按题意滴定反应为 2NaOH + H2C2O4 = Na2C2O4 +2H2O
根据质子转移数选NaOH为基本单元,则H2C2O4的基本单元
为1/2 H2C2O4, c(NaOH )
1000mH 2C2O4 2 H 2O
M (1/ 2H2C2O4 2H2O) V (NaOH )
c(NaOH ) 1000 0.2002 mol / L 0.1113mol/ L 1/ 2126.1 28.52
答:该NaOH溶液的物质的量浓度为0.1113mol/L 。
➢ 标定法
1.标准滴定溶液的浓度
Hale Waihona Puke 例 3-8 配制0.1mol/LHCl溶液用基准试剂Na2CO3 标定其浓度,试计算Na2CO3的称量范围。
解: 按题意滴定反应为 2HCl+ Na2CO3= 2NaCl+ CO2↑+H2O
根据反应式得
n(1/2N2C a3O )n(H)Cl
1
1
wB
c( ZA
A)VAM(ZB mS1000
B)
100
2.待测组分含量
例 用c(1/2 H2SO4)=0.2020 mol/L的硫酸标准滴定溶液测
定Na2CO3试样的含量时,称取0.2009g Na2CO3试样,消 耗18.32mL硫酸标准滴定溶液,求试样中Na2CO3的质量分 数。已知M(Na2CO3)=106.0g/mol。
M(1m /2NN2aC2a3O CO 3)c(H1C )V0(lH 00C ) lm N 2 C a 3O c (H)V C (H)lM C (1 /2 N l2 C a 3 )/O 100
m 1 0 .1 ( 3 /1 0 ) 0 5 .0 0 g 3 0 0 0 .1 g6
m 2 0 .1 ( 4 /1 0 ) 0 5 .0 0 3 g 0 0 0 .2 g1
被解放的 你们我 们 ——纪念英剧《Skins》 乍看《Skins》时,觉得他们的 故事与 自己的 生活并 不在一 个层面 ,从头 到尾充 斥 着彻夜狂 欢,触 手可及 的大麻 ,无厘 头的交 欢,英 式不羁 夹杂迷 幻味的 自我反 省 ,那些狂 妄的年 轻人们 不断向 前走, 盼望着 哪天长 大,能 把那些 黑暗消 化。 说 到黑暗这个词,我不知道能不能完 全贴切 地用作 高三的 标签, 那对于 我们而 言 是段怎样 的日子 呢?算 不上痛 心疾首 ,也不 至于是 暗无天 日,顶 多只能 说是压 抑 、劳 碌、迷茫、挫败。背负父母和老师的希 冀,每 日三点 一线的 生活, 书桌上 永 远是做不 完的堆 积如山 的题集 和试卷 ,天未 亮时再 三地自 我斗争 才能爬 起床, 夜 幕深沉时 才能关上光线微蒙的台灯入睡,白 天上课 必自备 各种提 神神器 ,咖啡 、 清凉油、薄荷茶、醒脑喷雾……才能 不至于 一不留 神在课 桌上驰 骋自己 的美梦 。 那时候的我 们,每天看着墙上惊人锐减的数字,总 觉得时 间不够 用;每 天听着 老 师们的“ 悉心教 导”, 总觉得 自己不 够强; 每天吃 着万年 不变的 方便面 和饼干 , 总觉得效率不够 高……夜不能眠的时候,被泪水浸 湿的黑 暗里, 我们的 大脑里 究 竟是思维 和灵感 的火花 还是燃 烧殆尽 的灰烬 呢?被 断网的 电脑, 被没收 的
c(N aO H )0.1m ol/L,表示每升溶液中含有氢氧化钠4.0g,
基本单元是氢氧化钠分子。
c
12H2SO4
1.00
0mol/L,表示每升溶液中含有硫酸49.04g,基
本单元是硫酸分子的二分之一。
c16K2Cr2O70.100mol/L ,表示在酸性介质中,每升溶液含有重 铬酸钾4.903g,基本单元是重铬酸钾分子的六分之一。
滴定分析计算常用公式
nA nB
cAVA cBVB
cAVA
mB MB
B
mB V
cAVA M B V
(g/L )
B
mB m
cAVA M B m
100%
➢ 直接配制法
1.标准滴定溶液的浓度
准确称取质量为mB(g)的基准物质B,配成 体积为VB(L)的标准滴定溶液,已知基准物质B 的摩尔质量为MB(g/mol),则该标准滴定溶液的 浓度为:
.6
2
谢谢
量相等的原则得 0.2100×250.0=0.1000×( 250.0 + V ) V = 275 .0mL 答:需加水275 .0mL。
➢ 标定法
1.标准滴定溶液的浓度
若以基准物质B标定浓度为cA的标准滴定溶 液,设所称取的基准物质的质量为mB(g),摩尔 质量为M(B),滴定时消耗待标定标准滴定溶液
的体积为VA(mL),根据等物质的量关系
n
1 ZB
B
n
1 ZA
A
则
mB M( 1
B)
c( 1 ZA
A) VA 1000
ZB
1 c(
ZA
A)
1000mB
M( 1 ZB
B)
VA
➢ 标定法
1.标准滴定溶液的浓度
例 3-7 称取基准物草酸(H2C2O4·2H2O)0.2002g溶于水中, 用NaOH溶液滴定,消耗了NaOH溶液28.52mL,计算 NaOH溶液的浓度。M(H2 C2O4·2H2O)=126.1g/mol.。
