建立阿司匹林肠溶片剂的质量标准
阿司匹林肠溶片成品内控标准
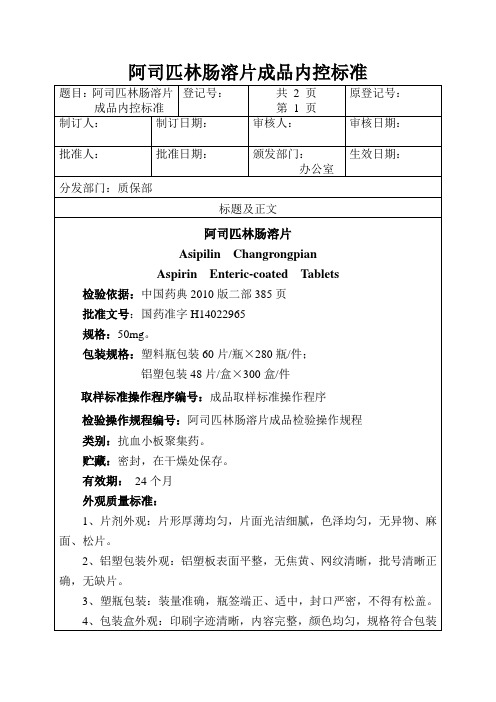
题目:阿司匹林肠溶片
成品内控标准
登记号:
共2页
第1页
原登记号:
制订人:
制订日期:
审核人:
审核日期:
批准人:
批准日生效日期:
分发部门:质保部
标题及正文
阿司匹林肠溶片
Aspirin Enteric-coated Tablets
检验依据:中国药典2010版二部385页
定性和定量的限度要求
标准项目
中国药典2010版
合格品标准
内控标准
性状
肠溶包衣片,除去包衣后显白色
肠溶包衣片,除去包衣后显白色
鉴别
1、2呈正反应
1、2呈正反应
重量差异
±7.5%
±7.5%
游离水杨酸
≤1.5%
≤1.5%
释放度
≥70%
≥70%
片剂脆碎度
<1%
<0.8%
微生物限度
符合规定
符合规定
含量
93..0%~107.0%
批准文号:国药准字H14022965
规格:50mg。
包装规格:塑料瓶包装60片/瓶×280瓶/件;
铝塑包装48片/盒×300盒/件
取样标准操作程序编号:成品取样标准操作程序
检验操作规程编号:阿司匹林肠溶片成品检验操作规程
类别:抗血小板聚集药。
贮藏:密封,在干燥处保存。
有效期:24个月
外观质量标准:
1、片剂外观:片形厚薄均匀,片面光洁细腻,色泽均匀,无异物、麻面、松片。
2、铝塑包装外观:铝塑板表面平整,无焦黄、网纹清晰,批号清晰正确,无缺片。
3、塑瓶包装:装量准确,瓶签端正、适中,封口严密,不得有松盖。
QC-TS-042-01 阿司匹林质量标准
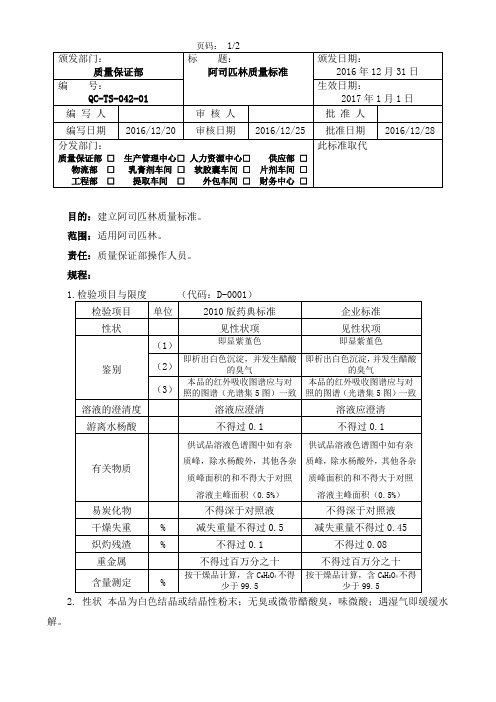
目的:建立阿司匹林质量标准。
范围:适用阿司匹林。
责任:质量保证部操作人员。
规程:
2. 性状本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在氯仿或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
3.类别解热镇痛非甾体抗炎药,抗血小板聚集药。
4.贮藏密封,在干燥处保存。
4.制剂
4.1阿司匹林片
4.2阿司匹林肠溶片
4.3阿司匹林肠溶胶囊
4.4 阿司匹林泡腾片
4.5阿司匹林栓
5.原辅料、包装材料取样标准操作规程:QC-OS-205-01
6.阿司匹林检验标准操作规程:QC-OS-054-01
7.贮存期:二年
8.变更记载及原因:。
浅析阿司匹林及其制剂质量标准的制定

注 : 尸 < 0 . 0 5
2 . 4 不同批次药 片的溶出度
分别 抽取 了 3 批不 同批次 的药 片 ,分别 测定其 性状 、成 分 、溶 出度 等 ,发 现 各 组 的性 状 、溶 出度 等 方 面 均符 合 质 量标 准 ] ,期间没 有 明显 差异 ( 尸> 0 . 0 5) 。
O 引言
阿 司 匹林 在 1 8 9 9年 问世 ,是一 种镇 痛解 热 药 ,据相 关 研 究 证 实 阿司 匹林 是 拥 有广 泛 适应 症 、疗 效 高 、不 良反 应 少 及具有 较高 的性价 比 Ⅲ,是 一种抗 血小板 的基 础药 ; 可用
耐酸要求 口 】 。说 明随 着包衣 厚度 的增加 ,药片 在肠 内的释放 度逐 渐降低 ,故 包衣 的质 量应 维持 在 4 0—4 5 %,符合 肠 内 耐酸要 求 。
2 . 3 硬度和压力 的影响
压片制作 中压力 大小 以及硬度 都会对 药片 的释放 度有影 响【 4 ] 。通 过 改 变 压力 ,使 硬 度 保 持 在 7 ~ 1 0 k g / c m 时 ,药 片 在两 种 介 质 中的 释放 度 维持 稳 定 ,符 合标 准 规 定 。而 当 硬度 上升到 1 3 k g / c m 时 ,药 片 的溶 出度 在盐 酸 中符 合 限度 , 而在磷 酸缓 冲液 中则 是小 于限度 ,其 间的差异 具有 统计学 意 义( P < 0 . 0 5 ) ; 所 以在制 作过 程当 中应 该将硬 度控 制在 7 一 l 0 k g / c m2之 间。详见 表 2 。 表 2 不 同硬度 的药 片释放 度 ( %)
1 材料与方法
1 . 1 材 料 药 材选 用 : 阿 司 匹林 ( 山东 新华 制药 ) 、微 晶纤 维 素 以 及 交 联 羧 甲基 纤 维 素 钠 ( F MC公 司 ) 、硬 脂 酸 ( 湖 州 展 望 药业 )以及 柠 檬酸 等 。器 械选 用 : S O T A X溶 出仪 、色 谱仪
阿司匹林原料药与肠溶片的质量分析实验报告

阿司匹林原料药与肠溶片的质量分析实验目的:1、掌握阿司匹林原料药及肠溶片的鉴别和含量测定的原理与操作。
2、熟悉阿司匹林原料药及肠溶片特殊杂质检查的原理与方法.3、了解阿司匹林肠溶片释放度和片剂项下有关的各项规定。
实验原理:阿司匹林为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
在乙醇中易溶,在氯仿或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠溶液或碳酸钠溶液中溶解,但同时分解。
根据阿司匹林结构中含有酯键和羧基,阿司匹林中存在有其他酸类物质(制片时加入的稳定剂枸橼酸或者酒石酸;阿司匹林水解产生的水杨酸和醋酸),先用氢氧化钠滴定液将阿司匹林的羧基及其他酸类物质的羧基完全中和,再用返滴定法定量,加入过量定量的氢氧化钠滴定液,加热使酯键水解,再用硫酸滴定液返滴定剩余的氢氧化钠,以求出阿司匹林的含量。
实验仪器及试剂:高效液相色谱仪、溶出度测定仪、分析天平;水浴锅、锥形瓶、量瓶、滴定管;阿司匹林原料药、阿司匹林肠溶片、水杨酸;三氯化铁试液、碳酸钠试液、稀硫酸;中性乙醇、酚酞指示液、氢氧化钠滴定液;磷酸钠、冰醋酸、甲醇、四氢呋喃.实验内容:(1)鉴别:取本品约0.1g,加水10ml ,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
实验结果,出现紫堇色,证明本品符合要求.(2)检查游离水杨酸:取本品5片,研细,用乙醇30ml 分次研磨,并移入100ml 量瓶中,充分振摇,用水稀释至刻度,摇匀。
立即滤过、精密量取续滤液2ml ,置50ml 纳氏比色管中,用水稀释至50ml,立即加新制的稀硫酸铁铵溶液(取1mol/L 盐酸溶液1ml ,加硫酸铁铵指示2ml 后,在加水适量使成100ml )3ml 摇匀,30s 内如显色,与对照液(精密量取0.01%水杨酸溶液4.5ml 加乙醇3ml 、0.05%酒石酸溶液1ml,用水稀释至50ml ,再加上述新制的稀硫酸铁铵溶液3ml ,摇匀)比较,不得更深。
(1。
复方阿司匹林片质量标准

复方阿司匹林片质量标准复方阿司匹林片,是一种含有阿司匹林、咖啡因和对乙酰氨基酚等成分的药品,常用于缓解头痛、发热和轻度疼痛。
而要保证复方阿司匹林片的质量,制定一系列的标准十分重要。
本文将围绕复方阿司匹林片的质量标准展开讨论。
一、产品的命名1.1 产品的通用名称为复方阿司匹林片,商标名称为生产企业注册商标。
1.2 产品的剂型为片剂,包括整片和分散片两种形式。
1.3 产品规格应标注清楚有效成分的含量,如阿司匹林的含量、咖啡因和对乙酰氨基酚等。
二、质量标准2.1 药品的外观应为白色或类白色片剂,无明显的异物、损伤或变形。
2.2 药品的含量应符合规定,注意有效成分的含量和比例要符合药典规定。
2.3 药品的溶出度标准应符合规定,保证其在人体内的溶解速度和吸收速度符合要求。
2.4 药品的含有微生物数量应符合规定,保证产品的微生物指标符合卫生标准。
三、理化指标3.1 药品的外观:复方阿司匹林片为白色或类白色片剂,无明显的异物、损伤或变形。
3.2 药品的含量测定:含量测定应按中国药典规范进行,确保有效成分的含量符合药典规定。
3.3 药品的溶出度测定:通过体外溶出度测定,保证其在人体内的溶解速度和吸收速度符合要求。
3.4 药品的微生物限度测定:保证产品的微生物指标符合卫生标准。
四、杂质和不溶物4.1 杂质和不溶物的含量应符合规定,药品中的杂质和不溶物应低于特定的限量要求,确保产品的纯度。
4.2 有机挥发性杂质的含量应符合规定,保证产品不含有害的有机挥发性杂质。
五、稳定性5.1 药品的稳定性测试:应进行各项稳定性测试,包括光、热、湿热等方面的稳定性,保证产品在特定条件下的稳定性符合要求。
六、包装6.1 包装应符合相关规定,确保产品的包装符合卫生标准,不影响产品的质量。
6.2 包装材料应符合规定,保证产品包装材料的安全性和稳定性。
七、贮存7.1 药品的储存条件:应符合规定的储存条件,避免受潮、受热、受光等影响,保证产品品质在贮存期内符合要求。
阿司匹林片的质量标准

阿司匹林片的质量标准阿司匹林片是一种常见的非处方药,常用于缓解头痛、发热、关节疼痛等症状。
然而,由于市场上阿司匹林片的品种繁多,质量参差不齐,消费者在购买时往往难以判断其质量的好坏。
因此,制定阿司匹林片的质量标准显得尤为重要。
首先,阿司匹林片的质量标准应包括药品的成分含量。
阿司匹林的主要成分是乙酰水杨酸,其含量应在一定范围内,过低则药效不显著,过高则可能对人体造成伤害。
因此,质量标准应规定乙酰水杨酸的含量范围,并要求生产商在药品包装上标注清晰。
其次,阿司匹林片的外观和包装也是质量标准的重要内容。
合格的阿司匹林片应该呈白色或淡黄色,无异物,表面光滑,无破损。
药品包装应该密封完好,标识清晰,生产日期、有效期等信息应当醒目显示,以便消费者了解。
此外,阿司匹林片的质量标准还应包括药品的稳定性和纯度。
阿司匹林是一种易氧化的药物,稳定性较差,因此在贮存和运输过程中容易发生质量变化,导致药效下降。
质量标准应规定药品的保存条件和有效期限,以确保药品在正常条件下能够保持稳定的药效。
同时,质量标准还应规定阿司匹林片的纯度,包括杂质含量、水分含量等指标,以保证药品的纯净度。
最后,阿司匹林片的质量标准还应包括生产工艺和质量控制要求。
生产商应当按照国家药品生产质量管理规范进行生产,确保药品符合GMP要求。
同时,质量标准还应规定对阿司匹林片进行质量控制的方法和程序,包括原料药的采购、生产过程中的监控、成品药的检验等环节,以确保产品质量的稳定性和可靠性。
综上所述,阿司匹林片的质量标准是保障药品质量和消费者用药安全的重要保障。
只有严格制定和执行质量标准,才能有效地规范市场行为,保障消费者的合法权益,促进药品行业的健康发展。
因此,相关部门和企业应高度重视阿司匹林片的质量标准,加强监管和质量控制,为消费者提供更加安全、可靠的阿司匹林产品。
阿司匹林肠溶片标准操作规程

阿司匹林肠溶片检验标准操作规程1. 目的建立阿司匹林肠溶片检验标准操作规程,规范阿司匹林肠溶片检验操作。
2. 范围适用于阿司匹林肠溶片的检验。
3. 依据《中国药典》2010版二部4. 职责4.1起草:QC 审核:QA 批准人:质量负责人。
4.2QC实施本规程。
4.3 QA监督本规程的实施。
5.内容本品含阿司匹林(C9H8O4)应为标示量的93.0-107.0%。
5.1性状本品为肠溶包衣片,除去包衣后显白色。
5.2鉴别5.2.1仪器及试液一般实验仪器和高效液相色谱仪。
三氯化铁试液:三氯化铁9g,加水使溶解成100ml,即得。
5.2.2分析步骤5.2.2.1取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴,观察现象,溶液显紫堇色。
5.2.2.2在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.3检查5.3.1游离水杨酸5.3.1.1 仪器及试液一般实验仪器、十万分之一天平和高效液相色谱仪。
1%冰醋酸甲醇溶液:取1ml冰醋酸加甲醇稀释至100ml,即得。
5.3.1.2 分析步骤除检测波长改为303nm外,照含量测定项下的色谱条件试验。
精密称取细粉适量(约相当于阿司匹林0.1g),置100ml量瓶中,用1%冰醋酸甲醇溶液振摇溶解,并稀释至刻度,摇匀,用有机相滤膜(孔径:0.45μ)滤过,立即精密量取续滤液10μl,注入液相色谱仪,记录色谱图;另取水杨酸对照品约15mg,精密称定,置50ml量瓶中,用1%冰醋酸甲醇溶液溶解,并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸甲醇溶液稀释至刻度,摇匀,同法测定。
按外标法以峰面积计算,含水杨酸不得过阿司匹林标示量的1.5%。
含量% = A样×W对/50×5/100×平均片重A对×W样/100×0.1×100% ………………公式①式中A样----样品的峰面积W对----水杨酸对照品称样量A对----水杨酸对照品的峰面积W样----样品的称样量0.1----标示量5.3.2释放度5.3.2.1试液及仪器一般实验仪器、十万分之一天平、高效液相色谱仪和ZRC-8L智能溶出度测试仪。
阿司匹林维c肠溶片质量标准

阿司匹林维c肠溶片质量标准
阿司匹林维c肠溶片质量标准,一般应包括以下方面:
1.原料药的质量:阿司匹林和维生素C应符合药典标准,其中阿司
匹林应无菌、无热原、无异常毒性,纯度高,且符合药典规定的各项杂质检查。
2.制剂的质量:片剂应完整、光滑、无裂缝,颜色均匀一致,具有
适宜的硬度、脆碎度和崩解时限等物理特性。
此外,还应符合药典中有关片剂的重量差异、含量均匀度、溶出度等项指标的要求。
3.适应症和用法:阿司匹林维C肠溶片的适应症和用法应符合药品
说明书和医生处方的要求。
4.安全性:阿司匹林维C肠溶片应无明显不良反应,无严重肝肾功
能不全者慎用。
5.有效性:阿司匹林维C肠溶片应具有明显的镇痛、解热、消炎等
作用,且对普通感冒或流行性感冒引起的发热有明显的疗效。
6.稳定性:阿司匹林维C肠溶片在贮存期间应稳定,无明显的分解
和变质现象。
7.药物相互作用:阿司匹林维C肠溶片不应与其他药物发生明显的
相互作用。
总之,阿司匹林维C肠溶片的质量标准应包括原料药的质量、制剂的质量、适应症和用法、安全性、有效性、稳定性和药物相互作用等方面。
在购买和使用时,应注意查看药品说明书和医生处方,确保药品
的质量和使用安全。
阿司匹林肠溶片

阿司匹林肠溶片的质量检查姓名: @@@@@@@@@班级: @@@@@@@@@2学号:@@@@@@阿司匹林肠溶片质量标准[摘要] 目的:掌握阿司匹林肠溶片质量检查的方法步骤。
方法:通过两步滴定法、紫外分光光度法、薄层色谱法及高效液相色谱这四种方法来建立阿司匹林肠溶片的质量标准。
[关键词]两步滴定法紫外分光光度法薄层色谱法高效液相色谱法乙酰水杨酸[1](Asprin),俗名阿司匹林,又称醋柳酸。
分子量为180.16,白色针状或板状结晶或结晶性粉末,无臭,微带酸味。
mp:135-138度,在干燥空气中稳定,遇潮则缓慢水解成水杨酸和醋酸,微溶于水,溶于乙醇,乙醚,氯仿,也溶于碱溶液,同时分解。
可由水杨酸和醋酸作用制得。
具有解热镇痛及溶血作用。
为了探究复方乙酰水杨酸片的质量标准,我分别通过两步滴定法,紫外分光光度法,薄层色谱法及高效液相色谱法进行了考察,并对方法学的部分内容进行了验证。
分子结构式为:C9H8O4 分子相对质量:180.16<B 分子结构式:1仪器与试剂1.1试剂阿司匹林肠溶片;阿司匹林对照品;水杨酸对照品;95%乙醇(分析纯,天津市富宇精细化工有限公司,批号:090403);酚酞试剂;硫酸(分析纯,乌鲁木齐天岳化学试剂有限公司,批号:070128);中性乙醇(自制);甲醇(分析纯,天津市光复科技有限公司,批号:090112);0.1mol/L氢氧化钠溶液(自制);冰醋酸(分析纯,天津市富宇精细化工有限公司,批号:081213);1.2仪器容量瓶;高效液相仪器(苏制05000111号);滤纸有机膜(上海兴亚净化材料厂,规格Ø50mm,孔径 0.22μm,批号:080905);针头滤品(孔径 0.22μm,规格Ø13mm,上海兴亚净化材料厂,批号:080805);紫外分光光度仪(上海棱光技术有限公司,沪制00000208);石英比色皿(宜兴市晶科光学仪器有限公司);硅胶板(规格50*150mm,厚度 0.20-0.25mm,青岛海洋化工厂分厂,批号:080902);展开槽;紫外线分析仪(ZF-I型三用紫外分析仪,上海顾材电光仪器厂,批号:031230);电子天平(BS110S Max110g d=0.1㎎,北京赛多利斯天平有限公司,量制京字00000249号);2【鉴别】(1)取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴.即显紫堇色。
阿司匹林肠溶片标准操作规程

阿司匹林肠溶片检验标准操作规程1. 目的建立阿司匹林肠溶片检验标准操作规程,规范阿司匹林肠溶片检验操作。
2. 范围适用于阿司匹林肠溶片的检验。
3. 依据《中国药典》2010版二部4. 职责4.1起草:QC 审核:QA 批准人:质量负责人。
4.2QC实施本规程。
4.3 QA监督本规程的实施。
5.内容本品含阿司匹林(C9H8O4)应为标示量的93.0-107.0%。
5.1性状本品为肠溶包衣片,除去包衣后显白色。
5.2鉴别5.2.1仪器及试液一般实验仪器和高效液相色谱仪。
三氯化铁试液:三氯化铁9g,加水使溶解成100ml,即得。
5.2.2分析步骤5.2.2.1取本品的细粉适量(约相当于阿司匹林0.1g),加水10ml,煮沸,放冷,加三氯化铁试液1滴,观察现象,溶液显紫堇色。
5.2.2.2在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
5.3检查5.3.1游离水杨酸5.3.1.1 仪器及试液一般实验仪器、十万分之一天平和高效液相色谱仪。
1%冰醋酸甲醇溶液:取1ml冰醋酸加甲醇稀释至100ml,即得。
5.3.1.2 分析步骤除检测波长改为303nm外,照含量测定项下的色谱条件试验。
精密称取细粉适量(约相当于阿司匹林0.1g),置100ml量瓶中,用1%冰醋酸甲醇溶液振摇溶解,并稀释至刻度,摇匀,用有机相滤膜(孔径:0.45μ)滤过,立即精密量取续滤液10μl,注入液相色谱仪,记录色谱图;另取水杨酸对照品约15mg,精密称定,置50ml量瓶中,用1%冰醋酸甲醇溶液溶解,并稀释至刻度,摇匀,精密量取5ml,置100ml量瓶中,用1%冰醋酸甲醇溶液稀释至刻度,摇匀,同法测定。
按外标法以峰面积计算,含水杨酸不得过阿司匹林标示量的1.5%。
含量% = A样×W对/50×5/100×平均片重A对×W样/100×0.1×100% ………………公式①式中A样----样品的峰面积W对----水杨酸对照品称样量A对----水杨酸对照品的峰面积W样----样品的称样量0.1----标示量5.3.2释放度5.3.2.1试液及仪器一般实验仪器、十万分之一天平、高效液相色谱仪和ZRC-8L智能溶出度测试仪。
阿司匹林的质量标准

石河子大学小学期制实验结课论文建立不同种类阿司匹林的质量标准姓名:班级:学号:指导老师:日期:建立不同种类阿司匹林片剂的质量标准王维卢海利胡宇飞张明周(石河子大学药学院07级二班832000 )【摘要】目的:建立不同种类阿司匹林片剂的质量标准方法:用两步滴定法、紫外分光光度法、高效液相色谱法测定阿司匹林的含量。
结果结论【关键词】两步滴定;紫外分光光度法;HPLC;阿司匹林;含量测定;阿司匹林是临床上常用的解热、镇痛药物,为非甾体类抗炎药,临床可用于抗血栓也可用于治疗不稳定性心绞痛的病症。
本实验采用两步滴定法、紫外可见分光光度法、高效液相色谱法测定阿司匹林的含量该方法简便、准确、重复性好、回收率高、适用于该制剂的质量控制1仪器与试剂UV-S53型紫外分光光度仪( 上海校光技术有公司);BS124S电子分析天平(北京塞多利斯仪器系统有限公司);HP1100 高效液相色谱仪;阿司匹林片(山东新华制药有限公司,070528);试药阿司匹林对照品;硫酸液(自制,0.05mol/L);氢氧化钠液(自制,0.1mol/L)乙腈为色谱纯,其他试剂均为分析纯。
2 方法与结果2.1阿司匹林片的外观性状检查本品应为白色片状;片剂表面应色泽均匀、光洁,无杂斑,无异物。
2.2杂质检查用目视比色法测定:取相当于乙酰水杨酸0.1g的样品,精密称定,置具塞三角瓶中,加氯仿20ml。
超声处理15min,滤过,蒸干,残渣用乙醇溶解,并定至5ml。
过滤,滤液作为供试品溶液。
取5ml乙醇液,置50mL纳氏比色管中,用水稀释至50ml,加新制的稀硫酸铁铵溶液(取1 mol/L盐酸1 Ml,加硫酸铁铵溶液2ml后,再加水适量使成100 mL)1ml,摇匀,在30s内显色,与对照液(精密称取水杨酸0.1g加水溶解后加冰醋酸1ml摇匀,加水成100ml,精密量取1ml,加醇5ml,加水稀释至50ml,再加新制的稀硫酸铁铵溶液1ml)比较颜色,不得更深。
建立阿司匹林肠溶片剂的质量标准

建立阿司匹林片剂的质量标准[摘要] 目的:1.探讨阿司匹林的快速鉴别方法;2.建立HPLC法检查阿司匹林及阿司匹林片中的游离水杨酸;3.建立紫外分光光度法检查阿司匹林中游离水杨酸;4.采用两步滴定法测定阿司匹林的含量。
方法:1.以十八烷基键合硅胶为填充剂,甲醇-水-冰醋酸(8:4:1)为流动相,检测波长302nm;2.采用薄层色谱法(TLC)快速鉴别阿司匹林;3.采用分光光度法在适当的波长处测量游离的水杨酸;4.采用滴定法测定阿司匹林的含量。
结果:1.选用的方法反映机制明确,所用试剂常用,易配;2.水杨酸在0.126~5.05mg/L(R^2=0.9979)的浓度范围内线性关系良好;阿司匹林中水杨酸的含量也符合药典规定;3.水杨酸的溶液在536nm处有最大吸收,且阿司匹林中水杨酸的含量也符合药典规定;4.供试品中阿司匹林的标示量%为17.84%。
结论:这几种方法简单、快速、省时、灵敏,适用于阿司匹林的快速鉴定、游离水杨酸检查、含量测定。
[关键词]:阿司匹林;快速鉴定;游离水杨酸;含量测定阿司匹林(Aspirin C9H804 80.16),又名2-(乙酰氧基)苯甲酸或乙酰水杨酸,是一非甾体抗类解热镇痛、抗炎、抗风湿药物,收载于(中国药典2010年版)二部。
阿司匹林在干燥空气中稳定,遇潮会缓缓水解为水杨酸和醋酸。
水解的游离水杨酸对人体有毒性,其分子中所含的酚羟基易被氧化,在空气中生成有色的醌,使成品变色。
所收载的鉴别方法麻烦、费时,在检查游离水杨酸时,中国药典一直沿用对溶液与供试品溶液颜色相近时易造成判断误差。
为提高药品抽验工作效率,更好地控制药品质量,我们小组经过讨论后,针对市售药物阿司匹林肠溶片,确定以下几种实验方法进行快速鉴定阿司匹林、HPLC 检查阿司匹林[1]中的游离水杨酸和阿司匹林的含量测定,取得了较满意的结果。
1 仪器与药品1.1 仪器高效液相色谱仪、UV-2501紫外分光光度计(日本岛津)、50mL碱式滴定管、50mL 酸式滴定管、锥形瓶、研钵、称量瓶、分析天平、水浴锅1.2 药品硅胶GF254板(快检专用板)、正己烷、乙酸乙酯、冰醋酸、阿司匹林肠溶片(片剂一瓶)、冰醋酸(分析纯)、无水乙醇(分析纯)、甲醇(优级纯)、超纯水(自制)、水杨酸(分析纯)酒石酸溶液(分析纯)盐酸(分析纯)稀硫酸铁铵溶液、乙醇、酚酞指示液、氢氧化钠滴定液(0.1mol/L)、硫酸滴定液(0.05mol/L)。
模块六 全检技术——阿司匹林肠溶片的质量检验

任务四
阿司匹林肠溶片的质量检验
(4) 再精密加氢氧化钠滴定液(0.1mol/L)40 ml,置水浴上加热15分 钟并时时振摇,迅速放冷至室温,用硫酸滴定液(0.05mol/L)滴定,并将 滴定的结果用空白试验校正。 每1ml氢氧化钠滴定液(0.1mol/L)相当于18.02mg C9H8O4。 检验过程中及时做好原始记录。 (三)数据处理与检验报告 按规定要求进行数据处理。
实训时间(分钟) 20 20 10 20 30 200 不单独计时 另计 不单独计时 300 在释放度检查第⑥步时完成此项,约20分钟 必要时安排 在释放度检查第⑤步时完成此项,约90分钟。酸碱滴定法 实训总时间 按规定的方法进行。学生应根据检验内容合理安排检验顺 序 备 注
备齐任务用玻璃仪器,除另有规定外,清洗干净,备用 分组分工按用量制备,稀硫酸铁铵溶液应临用新配
任务四
阿司匹林肠溶片的质量检验
(3)释放度
① 依据第一法(转篮法)准备溶出仪。
② 以0.1mol/L盐酸溶液750ml为溶剂,用1000ml量筒分别量取750ml 该溶剂倒入6个溶出杯内,固定在溶出仪水槽的6个孔中,设定仪器转速为 每分钟100转。 ③ 取供检验阿司匹林肠溶片6片,每一转篮中分别装入1片,将转篮 安在篮杆上。 ④ 取0.8μm的微孔滤膜,浸湿后,安装在滤器内,备过滤用。取干 燥、干净的10ml注射器,将取样针装在注射器上,备取样用。
任务四
4.含量测定
阿司匹林肠溶片的质量检验
(1) 取本品10片,精密称定,研细,用中性乙醇70ml,分数次研磨, 并移入100ml 量瓶中,充分振摇,再用水适量洗涤乳钵数次,洗液合并于 100ml 量瓶中,再用水稀释至刻度,摇匀。 (2) 滤过,精密量取滤液10ml两份,分别置锥形瓶中,加中性乙醇 (对酚酞指示液显中性)20ml,振摇,使阿司匹林溶解。 (3) 加酚酞指示液3 滴,滴加氢氧化钠滴定液(0.1mol/L)至溶液显 粉红色。
中国阿司匹林原料制剂质量控制指标

中国阿司匹林原料制剂质量控制指标1经对阿司匹林制剂处方工艺进行分析,发现部分企业处方中使用了硬脂酸镁等高价金属离子。
据文献报道,高价金属离子对阿司匹林稳定性有影响,因此选择高价金属离子与阿司匹林稳定性研究。
2在2009年国家评价抽验阿司匹林肠溶片质量分析过程中发现,阿司匹林肠溶片中的游离水杨酸与水分有一定的关联,但相关性不明显,因此为进一步考察和确认水活度与游离水杨酸之间是否存在相关性,进行了水活度与游离水杨酸相关性研究。
3由于阿司匹林肠溶片及阿司匹林片多为塑料瓶包装,每瓶规格多为100片,开瓶后需一个多月才能服用完毕,因此进行了开瓶稳定性研究。
4由于阿司匹林肠溶片有多种包装材料,为考察不同的包装材料对阿司匹林肠溶片稳定性的影响,选择包装材料与药品稳定性相关性研究。
5为准确评价国产阿司匹林肠溶片与德国拜耳生产的阿司匹林肠溶片的内在质量,及考察近两年国产阿司匹林肠溶片在处方工艺和质量方面否有所提高,选择溶出度与溶出曲线研究。
6为建立阿司匹林肠溶胶囊的近红外光谱模型,完善阿司匹林肠溶片及阿司匹林片快速筛查方法,选择近红外光谱定性模型建立及验证研究。
7针对部分样品在中国药典2010年版执行前生产,其游离水杨酸检查采用目视比色法,方法易受辅料干扰,结果不易判断,故对此部分样品的游离水杨酸测定选用中国药典2010年二部HPLC法进行测定,以准确评价此部分产品质量。
8高价金属离子与阿司匹林稳定性研究按照处方工艺,在阿司匹林原料药中加入相当于阿司匹林1倍量和3倍量的硬脂酸镁(Mg*),在25℃条件下,分别放置5d、10d和20d,采用中国药典2010年版二部中阿司匹林游离水杨酸的检查方法,考察加了Mg2+的阿司匹林中游离水杨酸的量变。
9水活度与游离水杨酸相关性研究取本品10片(粒)研细成粉末,采用novasinaAWsprint水分活度测定仪对所有阿司匹林样品水活度进行测定,测定温度为25℃。
同时分析样品水活度与游离水杨酸含量的相关性。
阿司匹林肠溶片标准

阿司匹林肠溶片标准
阿司匹林肠溶片的规格主要有25mg、50mg、75mg、100mg、300mg。
该药的主要成分为阿司匹林,为肠溶包衣片,除去包衣后显白色,主要用于抗血栓。
药物规格以及用药剂量的确定需要遵医嘱,避免自行服用药物,以免发生严重的不良反应。
阿司匹林肠溶片的规格比较多,如有25mg×100片/瓶;50mg×48片/盒;100mg×30片/盒等。
该药主要用于预防一过性脑缺血发作、心肌梗死、心房颤动、动静脉瘘或其他手术后的血栓形成,也可用于治疗不稳定型心绞痛。
该药可以扩张血管、增加血流量,通过出汗的方式退热,同时还可抑制前列腺素达到止痛作用;此外,该药可以抑制血小板凝集,从而达到预防血栓形成的作用。
需要注意的是,阿司匹林肠溶片并不是适合所有人,对于有活动性溃疡病或其他原因引起的消化道出血禁用。
血友病或血小板减少症禁用。
有阿司匹林或其他非甾体抗炎药过敏史者,尤其是出现哮喘、神经血管性水肿或休克者禁用。
因此,阿司匹林肠溶片的应用需要严格遵医嘱进行。
以上内容仅供参考,如需更多信息,建议查阅相关文献或咨询专业医生。
阿司匹林质量标准

阿司匹林C9H8O4180。
16本品为2—(乙酰氧基)苯甲酸。
含C9H8O4.不得少于99.5%。
【性状】本品为白色结晶或结晶性粉末;无臭或微带醋酸臭,味微酸;遇湿气即缓缓水解。
本品在乙醇中易溶,在三氯甲烷或乙醚中溶解,在水或无水乙醚中微溶;在氢氧化钠试液或碳酸钠试液中溶解,但同时分解.【鉴别】(1)取本品约0。
1g加水l0ml,煮沸,放冷,加三氯化铁试液1滴,即显紫堇色。
(2)取本品约0。
5g,加碳酸钠试液l0ml,煮沸2分钟后,放冷,加过量的稀硫酸,即析出白色沉淀,并发生醋酸的臭气.(3)本品的红外光吸收图谱应与对照的图谱一致。
【检查】溶液的澄清度取本品0。
50g,加微温至约45℃的碳酸钠试液l0ml溶解后,溶液应澄清。
游离水杨酸取本品0。
l0g,加乙醇lml溶解后,加冷水适量使成50ml,立即加新制的稀硫酸铁铵溶液[取盐酸溶液(9→100)lml,加硫酸铁铵指示液2ml后,再加水适量使成100ml]1ml,摇匀,30秒钟内如显色,与对照液(精密称取水杨酸0。
1g,加水溶解后,加冰醋酸lml,摇匀,再加水使成1000ml,摇匀,精密量取lml,加乙醇lml、水48m1与上述新制的稀硫酸铁镀溶液lml,摇匀)比较,不得更深(0.1%).易炭化物取本品0。
5g,依法检查(附录61页),与对照液(取比色用氯化钻液0.25m1、比色用重铬酸钾液0.25m1、比色用硫酸铜液0.40ml,加水使成5ml)比较,不得更深.4。
操作方法 4.1取内径、色泽一致的具塞比色管两支,编号为甲管、乙管。
4.2甲管中加该药品项下规定的对照溶液5ml. 4。
3乙管中加无色的硫酸[含H2SO4应为94.5%~95。
5%(g/g)]5ml。
4.4取规定量的供试品(如为固体,应先研成细粉)分次缓缓加入乙管中,振摇使溶解. 4。
5除另有规定外,静置15分钟,将甲乙两管同置白色衬板前,平视观察,比较颜色深浅。
江西普丽尔药业有限公司—易炭化物检查操作规程第2 页共2页 5.注意事项 5.1比色管应干燥、洁净,如乙管中加硫酸后,在加入供试品之前已显色,应重新洗涤比色管,干燥后再使用. 5。
阿司匹林肠溶片药物利用评价标准的建立与应用

阿司匹林肠溶片药物利用评价标准的建立与应用林妹妹;章靓;郑彩云;陈焰;高燕灵;陈世财;张进华【期刊名称】《药物流行病学杂志》【年(卷),期】2024(33)5【摘要】目的建立阿司匹林肠溶片药物利用评价(DUE)标准,为临床合理应用阿司匹林肠溶片提供参考。
方法参考阿司匹林肠溶片药品说明书、相关指南、专家共识和文献,并通过德尔菲法,在用药指征、用药过程和用药结果3个方面建立阿司匹林肠溶片DUE标准。
采用回顾性研究方法,对福建医科大学附属福清市医院2021年1月—2022年6月使用阿司匹林肠溶片的住院患者病历进行用药合理性评价。
结果共纳入1071份病历,完全符合评价标准的有683例,用药合理率为63.77%。
不合理用药情况主要为适应证不适宜(6.26%)、超说明书用药未备案(28.48%)、用药禁忌(1.03%)、用法用量不适宜(1.68%)、有潜在临床意义的药物相互作用(0.65%)和其他不适宜(2.71%)。
结论本研究建立的阿司匹林肠溶片DUE标准有较强的科学性、实用性和可行性。
该院阿司匹林肠溶片用药不合理率较高,应制订相应的干预措施,保证临床用药安全。
【总页数】11页(P489-499)【作者】林妹妹;章靓;郑彩云;陈焰;高燕灵;陈世财;张进华【作者单位】福建医科大学附属福清市医院药剂科;福建中医药大学附属人民医院药学部;首都医科大学附属北京潞河医院药学部;福建省妇幼保健院药剂科【正文语种】中文【中图分类】R54【相关文献】1.替雷利珠单抗药物利用评价标准的建立与应用2.注射用盐酸兰地洛尔药物利用评价标准的建立与应用3.注射用纤溶酶药物利用评价标准的建立与应用4.阿加曲班药物利用评价标准的建立与应用5.罗沙司他药物利用评价标准的建立与应用因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
建立阿司匹林片剂的质量标准[摘要] 目的:1.探讨阿司匹林的快速鉴别方法;2.建立HPLC法检查阿司匹林及阿司匹林片中的游离水杨酸;3.建立紫外分光光度法检查阿司匹林中游离水杨酸;4.采用两步滴定法测定阿司匹林的含量。
方法:1.以十八烷基键合硅胶为填充剂,甲醇-水-冰醋酸(8:4:1)为流动相,检测波长302nm;2.采用薄层色谱法(TLC)快速鉴别阿司匹林;3.采用分光光度法在适当的波长处测量游离的水杨酸;4.采用滴定法测定阿司匹林的含量。
结果:1.选用的方法反映机制明确,所用试剂常用,易配;2.水杨酸在0.126~5.05mg/L(R^2=0.9979)的浓度范围内线性关系良好;阿司匹林中水杨酸的含量也符合药典规定;3.水杨酸的溶液在536nm处有最大吸收,且阿司匹林中水杨酸的含量也符合药典规定;4.供试品中阿司匹林的标示量%为17.84%。
结论:这几种方法简单、快速、省时、灵敏,适用于阿司匹林的快速鉴定、游离水杨酸检查、含量测定。
[关键词]:阿司匹林;快速鉴定;游离水杨酸;含量测定阿司匹林(Aspirin C9H804 80.16),又名2-(乙酰氧基)苯甲酸或乙酰水杨酸,是一非甾体抗类解热镇痛、抗炎、抗风湿药物,收载于(中国药典2010年版)二部。
阿司匹林在干燥空气中稳定,遇潮会缓缓水解为水杨酸和醋酸。
水解的游离水杨酸对人体有毒性,其分子中所含的酚羟基易被氧化,在空气中生成有色的醌,使成品变色。
所收载的鉴别方法麻烦、费时,在检查游离水杨酸时,中国药典一直沿用对溶液与供试品溶液颜色相近时易造成判断误差。
为提高药品抽验工作效率,更好地控制药品质量,我们小组经过讨论后,针对市售药物阿司匹林肠溶片,确定以下几种实验方法进行快速鉴定阿司匹林、HPLC 检查阿司匹林[1]中的游离水杨酸和阿司匹林的含量测定,取得了较满意的结果。
1 仪器与药品1.1 仪器高效液相色谱仪、UV-2501紫外分光光度计(日本岛津)、50mL碱式滴定管、50mL 酸式滴定管、锥形瓶、研钵、称量瓶、分析天平、水浴锅1.2 药品硅胶GF254板(快检专用板)、正己烷、乙酸乙酯、冰醋酸、阿司匹林肠溶片(片剂一瓶)、冰醋酸(分析纯)、无水乙醇(分析纯)、甲醇(优级纯)、超纯水(自制)、水杨酸(分析纯)酒石酸溶液(分析纯)盐酸(分析纯)稀硫酸铁铵溶液、乙醇、酚酞指示液、氢氧化钠滴定液(0.1mol/L)、硫酸滴定液(0.05mol/L)。
2 实验步骤2.1 阿司匹林快速鉴定 (薄层色谱)2.1.1 供试品溶液的制备取本品细粉适量(约相当于阿司匹林25mg)另取本品细粉适量(约相当于阿司匹林300mg),加乙醇5mL,振摇溶解,静置,取上清液,即得。
2.1.2 参比物溶液的制备取阿司匹林肠溶片2片,研细,加乙醇3mL溶解,静置,取上清液即得。
2.1.3 薄层色谱鉴别取参比物溶液和供试品溶液各2µL,点样于硅胶GF254板(快检专用板),将正己烷-乙酸乙酯-冰乙酸(15:5:1)混合液8~10mL倒入层析缸中,将点样完毕的薄层板放入,待展开前沿至距原点8cm处,将板取出,待展开剂挥尽,置于254nm紫外光下观察,所得结果如右图1:结果判定:供试品为阿司匹林且供图1试品中显主斑点的Rƒ=0.647。
1.样品1(25mg) 2.样品2(0.3g)3.阿司匹林对照品2.2 游离水杨酸的检查方法1 (HPLC法[2])2.2.1 溶液的配制2.2.1.1 水杨酸对照品溶液精密称取水杨酸对照品(10.02mg,置100mL量瓶中,加冰醋酸-甲醇(1:10)溶液使溶解并稀释至刻度,摇匀,为浓溶液。
精密吸取此液5.0mL,置50mL量瓶中,加冰醋酸-甲醇(1:10)溶液稀释至刻度,摇匀,备用。
2.2.1.2 阿司匹林对照品溶液精密称取阿司匹林对照品99.98mg,置于100mL量瓶中,加冰醋酸-甲醇(1:10)溶液使溶解并稀释至刻度,摇匀,备用。
2.2.1.3 水杨酸与阿司匹林混合溶液精密吸取上述水杨酸对照品的浓溶液5.0mL,置50mL量瓶中,用上述阿司匹林对照品溶液稀释至刻度,摇匀,备用。
2.2.2 色谱条件与系统适用性试验流动相:甲醇—水—冰醋酸(8:4:1)(PH约为2.8);检测波长为302nm;流速:0.8mL·min-1;柱温:室温。
水杨酸及阿司匹林的高效液相分离图谱及保留时间确定分别取冰醋酸-甲醇(1:10)溶液、水杨酸对照品溶液、阿司匹林对照品溶液、水杨酸与阿司匹林混合溶液、阿司匹林原料、阿司匹林片供试品溶液(即各检查有力水杨酸项下的供试品溶液)各20µL,分别注入液相色谱仪,记录色谱图,如下图2显示。
a b c d e图2高效液相色谱图a.冰醋酸-甲醇(1:10);b.水杨酸;c.阿司匹林;d.水杨酸与阿司匹林;e.阿司匹林肠溶片结果表明,阿司匹林与水杨酸分离良好,溶液不干扰测定。
测得理论板数按水杨酸峰计算为2087.850,水杨酸与阿司匹林的分离度为 2.489,拖尾因子为0.880,均符合要求[3]。
2.2.3水杨酸最低检出量试验精密吸取水杨酸对照品的浓溶液3.0mL,置100mL量瓶中,用冰醋酸-甲醇(1:10)溶液稀释至刻度,摇匀,取20µL注入液相色谱仪,记录色谱图,便水杨酸峰高为仪器响应噪声的10,测得水杨酸的最低检出量为3.03ng。
2.2.4 水杨酸的线性试验精密吸取水杨酸对照品的浓溶液5.0mL,置100mL量瓶中,用冰醋酸-甲醇(1:10)溶液稀释至刻度,摇匀。
精密吸取0.25、0.5、1.0、2,0、3.0、5.0、10.0mL分别置10买了量瓶中,各加冰醋酸-甲醇(1:10)溶液稀释至刻度(最后的10.0mL瓶除外),摇匀,作为标准溶液。
各取20µL依次注入液相色谱仪,照检查游离水杨酸项下的方法测定,记录色谱图,如表1所示:表1游离水杨酸的浓度测定浓度mg/Ml 0.126 0.252 0.505 1.01 1.515 2.525 5.05峰面积5333 10405 22210 48716 71073 119970 222258 以浓度为横坐标,峰面积为纵坐标,根据下图3进行回归处理的图4图3S=44397x+1764.3(R^2=0.9979,n=7)浓度范围内线性关系良好。
图42.2.5 精密度试验取检查游离水杨酸项下的对照品溶液,照检查游离水杨酸项下的方法,重复进样6次,得水杨酸一组峰积分面积,如下图5:图5计算相对标准差为:RSD=1.1%(n=6)。
2.2.6 片剂测定法(检查游离水杨酸)精密称取本品的细粉适量(约相当于阿司匹林0.1g),置100mL量瓶中,加冰醋酸-甲醇(1:10)溶液适量振摇使溶解并稀释至刻度,摇匀,经0.45um有机系的微孔滤膜滤过,续滤液作为供试品溶液,立即取20µL注入液相色谱仪,记录色谱图;另精密称取水杨酸对照品适量,加冰醋酸-甲醇(1:10)溶液溶解并制成每1mL中含3ug的溶液,同法测定。
即得。
检查阿司匹林片中游离水杨酸的含量(每批测定3次)并与中国药典2010版二部收载的阿司匹林片项下检查游离水杨酸法比较,结果见表2:表2 阿司匹林肠溶片中游离水杨酸含量测定结果,n=3 批号09101207 HPLC% 药典法药典规定值1 2 3 20.3223.6326.94不符合规定不符合规定不符合规定≤0.3%≤0.3%≤0.3%方法2 (分光光度法[4])2.2.1 检测波长的选择称取水杨酸约50mg,置于100mg量瓶中,加水至刻度,取水杨酸溶液4.5mL,置于50mL量瓶中,加乙醇9mL,0.05%酒石酸溶液3mL,加新制的稀硫酸铁铵溶液(取1mol/L盐酸溶液1mL,加硫酸铁铵溶液2mL后,再加水适量使成100mL)9mL,加水至刻度,作为对照品溶液。
用UV –2501紫外分光光度计480 ~600nm 的波长处进行扫描,选取吸光度较大的一段如下图6:图6最大吸光系数测量由表可知最大吸收波长为536nm。
2.2.2 对照品溶液吸收度及稳定性测定精密称取水杨酸50.00mg各6份,分别置于100mL量瓶中,用1法操作,在536nm的波长处根据不同时间分别测定对照品的吸收度,所测吸光度如表3:表3 对照品溶液吸收度t/min 0 5 10 20 40空白0.000 0.000 0.000 0.000 0.000对照品1 0.273 0.269 0.268 0.269 0.268对照品2 0.287 0.287 0.287 0.288 0.286对照品3 0.279 0.278 0.279 0.279 0.280对照品4 0.278 0.279 0.279 0.279 0.278对照品5 0.287 0.285 0.286 0.287 0.288 2.2.3 样品溶液吸收度及稳定性的测定取样品20片,研细,用乙醇30ml分次研磨,并移入100mL量瓶中,充分振摇,用水稀释至刻度,摇匀,立即过滤。
精密量取滤液2mL置50mL量瓶中,立即加新制的稀硫酸铁铵溶液3mL,加水至刻度,摇匀。
在536nm波长处根据不同时间分别测定样品溶液的吸收度,所测供试品吸光度如表4:表4 供试品吸光度t/min 0 5 10 20 40 空白0.000 0.000 0.000 0.000 0.000 供试品0.044 0.044 0.045 0.046 0.044 有上述结果可知,游离水杨酸为0.765%;药典规定游离水杨酸的限度为1.5%,则阿司匹林肠溶片中的游离水杨酸含量符合药典规定要求。
2.3 阿司匹林含量测定(两步滴定)2.3.1原理:第一步:中和各种游离酸阿司匹林水杨酸:醋酸:枸橼酸:第二步:水解和测定(定量过量)(剩余)2.3.2 方法取本品10片,精密称定,研细,精密称取细粉适量(约相当于阿司匹林0.1g),置锥形瓶中,加中性乙醇(对酚酞指示液显中性)20mL,振摇,使阿司匹林溶解,加酚酞指示液3滴,滴加氢氧化钠滴定液(0.1mol/L)至溶液显粉红色。
再精密加氢氧化钠滴定液(0.1mol/L)40mL,置水浴上加热15分钟并时时振摇,迅速放冷至室温,用硫酸滴定液(0.05mol/L)滴定,并将滴定的结果用空白试验校正。
每1mL氢氧化钠滴定液(0.1mol/L)相当于18.02mg的C9H8O4。
2.3.3 实验结果及其处理表5 所用药品真实浓度NaOH 标定浓度 0.09946mol/LH 2SO4标定浓度 0.0265mol/L表6 所称量量阿司匹林片规格平均片重平均称取细粉滴定度 T 25mg/片0.078285g 0.3058g 17.951mg/mL表7所用 H2SO4量空白组实验组66.00mL 64.19mL由于为0()%=100%V V F T W W -⨯⨯⨯⨯⨯标示量标示量,因此标示量%=17.84%, 即阿司匹林的标示量%为17.84%。
