2021年蛋白表达纯化实验步骤
蛋白质的分离纯化

蛋白质的分离纯化蛋白质是生命体中最基本的分子之一,它在细胞内发挥着重要的功能。
由于蛋白质的复杂性和多样性,研究人员通常需要从复杂的混合物中分离和纯化蛋白质。
蛋白质的分离纯化是生物化学和生物技术领域中非常重要的一项工作,它为我们深入研究蛋白质的结构和功能提供了必要的条件。
蛋白质的分离纯化可以通过多种不同的方法实现,这些方法包括离心法、凝胶过滤法、电泳法、层析法等。
在选择合适的方法时,研究人员需要考虑到蛋白质的特性以及实验的要求。
离心法是最常用的分离方法之一,在离心过程中,通过调整离心力和离心时间,可以实现不同密度的蛋白质的分层。
这种方法适用于分离大分子量的蛋白质。
凝胶过滤法是利用孔径不同的凝胶将蛋白质分离开来。
通常使用的凝胶有琼脂糖凝胶和聚丙烯酰胺凝胶,这些凝胶具有不同的孔径,可以根据蛋白质的分子量选择合适的凝胶进行分离。
电泳法是基于蛋白质的电荷和分子量差异而进行分离的方法。
最常用的电泳方法是SDS-PAGE电泳,通过使用SDS(十二烷基硫酸钠)对蛋白质进行解性和蛋白质间的形成复合物,使得蛋白质在电泳过程中仅仅受到电场力的影响,从而实现蛋白质的分离。
层析法是一种利用物质在载体上的分配和吸附性质进行分离的方法。
常见的层析方法有凝胶层析、亲和层析、离子交换层析等。
凝胶层析是通过利用载体颗粒的孔径进行分离,亲和层析是将特定配体固定在载体上,与目标蛋白质结合,从而实现分离,而离子交换层析是利用载体表面电荷与目标蛋白质的电荷相互作用进行分离。
在进行蛋白质的分离纯化时,需要注意以下几个关键步骤。
首先是样品制备,通常样品要经过细胞破碎、蛋白质提取等步骤,使得目标蛋白质从复杂的混合物中提取出来。
其次是样品的处理,包括去除杂质、调整蛋白质的溶液环境等。
然后是选择合适的分离方法,根据蛋白质的特性和实验要求来确定最适合的方法。
最后是纯化过程中的监测和分析,通过使用各种蛋白质分析方法,如SDS-PAGE、Western blot等,来确定目标蛋白质的纯化程度和鉴定其存在。
2021年Trizol法提取RNA实验步骤及原理(新手详细注释版)

无水乙(RNa se-free)、(RNase-free) RNase 酶非常稳定, 是导致的条件可但限制因Trizol 法使用步骤欧阳光明(2021.03.07)一・分离纯化的基本原理硏究基因的表达和调控时常常要从组织和细胞中分离和纯化 RNA O RNA 质量的高低常常影响cDNA 库,RT-PCR 和Northern Blot 等 分子生物学实验的成贩。
Trizol 是一种新型总RNA 抽提试剂,内含异 硫氟酸肌等物质,能迅速破碎细胞,抑制细胞释放出的核酸酶。
二.用户需自备的试剂和材料Glycogen (可能需要)、1.5ml Eppendorf 管三.准备工作高压蒸气灭菌方法和蛋白抑制剂都不能是RN“se 完全失活。
它广泛存 在于人的皮肤上,因此,在与RNA 制备有关的分子生物学实验时,必 须戴手套。
RNase 的又一污染源杲取液器,根据取液器制造商的要求对取液器逬 行处理。
一般情况下采用用DEPC (焦炭酸二磷脂,一种RNase 抑制剂) 配制的70%乙醇擦洗取液器的内部和外部,基本达到要求。
取RNase- free 的物品时必须戴手套。
X 料制品的处理尽可能使用无菌,一次性塑料制品,已标明RNase-Free 的塑料制品,如没有开封使用过通常没有必要再次处理。
对于国产塑料制水欧阳光明*创编水欧阳光明*创编2021.03.07品,原则上都必须处理方可使用。
处理步骤如下:1)在玻璃烧杯中注入去离子水,加入DEPC使DEPC的终浓度为0.1 %o 注意:DEPC为剧毒物,活性很强,小心在通风柜中使用。
2)处理的塑料制品放入一个可以高温灭菌的容器中,注入DEPC水溶液,使塑料制品的所有部分都浸泡到溶液中。
3)在通风柜中室温处理过夜。
4)将DEPC水溶液小心倒到废液瓶中,用铝箔封住含已DEPC水处理过的塑料制品的烧杯,高温高压蒸气灭菌至少30分钟。
5)烘箱用合适的温度烘拷至干燥。
置于干净处备用。
蛋白质的提取与分离纯化——生化实验设计讲解课件

声波法
⑶化学及生物化学方法
6
2021/6/16
玻璃匀浆机
7
2021/6/16
b、细胞器的分离
细胞器的分离一般采用差速离心法。细 胞经过破碎后,在适当介质中进行差速 离心。
8
2021/6/16
三、蛋白质粗提取
从破碎材料或细胞器提出的蛋白质是不纯的, 需进一步纯化。纯化包括将蛋白质与非蛋白质 分开,将各种不同的蛋白质分开。选择提取条 件时,就要考虑尽量除去非蛋白质。一般总是 有其它物质伴随混入提取液中。但有些杂质 (如脂肪)以事先除去为宜。先除去便于以后 操作。常用有机溶剂提取除去。
间被一个长而富有弹性的螺旋结构相连,每个末端
有两个Ca2+ 结构域,每个结构域可以结合一个Ca2+ ,
这样,一个钙调蛋白可以结合4个Ca2+ ,钙调蛋白与
Ca2+ 结合后的构型相当稳定 。
11
2021/6/16
值得注意的是,在洗脱时,会有少许配基与蛋白 质一同被洗脱下来,因此常在其后加一凝胶层析 以除去小分子的配基。
巯基化合物均有干扰作用。此外,不同蛋白质因酪氨酸、 色氨酸含量不同而使显色强度稍有不同。
15
2021/6/16
16
2021/6/16
结束语
若有不当之处,请指正,谢谢!
五、分析鉴定
A、定性分析
SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量:是在聚 丙烯酰胺凝胶系统中引进SDS(十二烷基磺酸钠), SDS能断裂 分子内和分子间氢键,破坏蛋白质的二级和三级结构,强还原剂 能使半胱氨酸之间的二硫键断裂,蛋白质在一定浓度的含有强还 原剂的SDS溶液中,与SDS分子按比例结合,形成带负电荷的 SDS-蛋白质复合物,这种复合物由于结合大量的SDS,使蛋白质 丧失了原有的电荷状态形成仅保持原有分子大小为特征的负离子 团块,从而降低或消除了各种蛋白质分子之间天然的电荷差异, 由于SDS与蛋白质的结合是按重量成比例的,因此在进行电泳·时, 蛋白质分子的迁移速度取决于分子大小。
211232365_AAV9衣壳蛋白VP的原核表达、纯化及多克隆抗体制备

doi:10.3969/j.issn.1000-484X.2023.04.028·论著/免疫学技术与方法·AAV9衣壳蛋白VP的原核表达、纯化及多克隆抗体制备①张浩李舒月张雄洲谈恒星杨建林曹春雨吕亚丰(三峡大学医学院,肿瘤微环境与免疫治疗湖北省重点实验室,宜昌 443000)中图分类号R392-33 文献标志码 A 文章编号1000-484X(2023)04-0833-05[摘要]目的:表达腺相关病毒(AAV)9型衣壳蛋白VP,制备抗VP蛋白的多克隆抗体。
方法:使用PCR技术从AAV9病毒包装质粒中扩增AAV9衣壳蛋白VP,同源重组法构建衣壳蛋白表达质粒pET30a-AAV9-VP。
质粒转化表达菌E.coli BL21(DE3)后,IPTG诱导目的蛋白VP表达,亲和层析法纯化VP蛋白,将纯化后的蛋白免疫日本大耳白兔,3次免疫后获得针对VP蛋白的兔多克隆抗体。
以Western blot和细胞免疫荧光法检测抗体的应用,ELISA检测所得抗体的效价。
结果:成功构建pET30a-AAV9-VP表达质粒,在大肠杆菌BL21中,IPTG可诱导VP蛋白表达。
亲和层析法纯化获得高纯度的VP蛋白。
该蛋白在日本大耳兔体内能够诱导产生多克隆抗体,ELISA检测抗血清效价达到1∶512 000。
结论:成功原核表达和纯化AAV9衣壳蛋白VP并制备了兔多克隆抗体。
制备的抗AAV9 VP抗体能够特异性识别和结合AAV衣壳蛋白,并可有效用于Western blot和细胞免疫荧光分析,为后续深入研究AAV9在基因治疗中的作用及AAV9载体开发提供了研究基础。
[关键词]原核蛋白纯化;腺相关病毒9;多克隆抗体Prokaryotic expression,purification and polyclonal antibody preparation of AAV9 capsid protein VPZHANG Hao, LI Shuyue, ZHANG Xiongzhou, TAN Hengxing, YANG Jianlin, CAO Chunyu, LYU Yafeng. Three Gorges University Medical College, Hubei Key Laboratory of Tumor Microenvironment and Immunotherapy, Yichang 443000, China[Abstract]Objective:To express the recombinant proteins of adeno-associated virus (AAV)9 capsid VP and prepare the polyclonal antibodies against VP. Methods:AAV9 capsid protein VP coding sequence was amplified from AAV9 plasmid by PCR,and capsid protein expression plasmid pET30a-AAV9-VP was constructed by homologous recombination. After transforming it into E.coli BL21 (DE3), IPTG was used to induce expression of VP, and the VP was purified by Ni-NTA resin affinity chromatography,the purified protein was used as antigen to immunize Japanese white rabbits to prepare polyclonal antibodies. The rabbit polyclonal antibody against VP protein was obtained after three times of immunization. Specificity of anti-sera was detected by Western blot and cell immunofluorescence, ELISA was used to detect titer of anti-VP antibody. Results:The pET30a-AAV9-VP expression plasmid was successfully constructed. IPTG can induce the expression of VP in E.coli BL21 bacteria. Ni-NTA resin affinity chromatography can effectively purify VP protein, and the VP can induce polyclones effectively in Japanese white rabbits, the antibody titer detected by ELISA was reaches 1∶512 000. Conclusion:Successful expression and purification of AAV9 capsid protein VP and preparation of rabbit polyclonal antibodies. The AAV9 VP antibody can specifically recognize and bind to the AAV capsid protein and can be effec‐tively used for Western blot and immunofluorescence analysis. It provides a research foundation for development of AAV9 vector and the in-depth study of the role of AAV9 in gene therapy.[Key words]Prokaryotic expression;Adeno-associated virus 9;Polyclonal antibody①本文为国家自然科学基金项目(81772833);肿瘤微环境与免疫治疗湖北省重点实验室(三峡大学)基金项目(2021KZL01)。
2021年广东省新高考生物试卷(含答案)

2021年广东省新高考生物试卷(含答案)2021年广东省新高考生物试卷一、选择题:本题共16题,共40分。
第1~12题,每题2分;第13~16题,每题4分。
在每题给出的四个选项中,只有一项是符合题目要求的。
1.(2分)我国新冠疫情防控已取得了举世瞩目的成绩,但全球疫情形势仍然严峻。
为更有效地保护人民身体健康,我国政府正在大力实施全民免费接种新冠疫苗计划。
下列叙述正确的是:①通过理化方法灭活病原体制成的疫苗安全可靠;②接种后抗原会迅速在机体的内环境中大量增殖;③接种后可以促进T细胞增殖分化产生体液免疫;④二次接种可提高机体对相应病原的免疫防卫功能。
答案为B。
2.(2分)“葛(葛藤)之覃兮,施与中谷(山谷),集于灌木,其鸣喈喈”(节选自《诗经•葛覃》)。
这是关于生物群落的描述。
答案为B。
3.(2分)近年来我国生态文明建设卓有成效,粤港澳大湾区的生态环境也在持续改善。
研究人员对该地区的水鸟进行研究,记录到146种水鸟,其中有国家级保护鸟类14种,近海与海岸带湿地、城市水域都是水鸟的主要栖息地。
该调查结果直接体现了生物多样性中的物种多样性和生态系统多样性。
答案为C。
4.(2分)研究表明,激活某种蛋白激酶PKR,可诱导被病毒感染的细胞发生凋亡。
下列叙述正确的是:D.PKR激活剂可作为潜在的抗病毒药物加以研究。
5.(2分)DNA双螺旋结构模型的提出是二十世纪自然科学的伟大成就之一。
为该模型构建提供主要依据的是富兰克林等拍摄的DNA分子X射线衍射图谱。
答案为B。
6.(2分)如图示某S形增长种群的出生率和死亡率与种群数量的关系。
当种群达到环境容纳量(K值)时,其对应的种群数量是c。
7.(2分)金霉素(一种抗生素)可抑制tRNA与mRNA 的结合,该作用直接影响的过程是蛋白质合成。
1.DNA复制、转录和翻译是生物体内三种基本的遗传信息传递过程。
在DNA复制过程中,DNA双链解旋后,以每个单链为模板合成新的互补单链,最终形成两个完全一样的DNA分子。
蛋白纯化层析系统操作规程

蛋白纯化层析系统操作规程一、实验前准备1.确认所需操作的蛋白样品、层析柱类型和材料的完整性和准备情况。
2.检查实验设备和仪器是否正常工作,如层析仪、洗脱缓冲液储备罐、洗脱梯度系统等。
3.预先准备所需的实验试剂和缓冲液,确保其浓度和pH值符合实验要求。
二、层析柱装填和平衡1.将所需的层析柱装填到层析系统中,确保柱床填充均匀且无明显空隙。
2.选择适当的洗脱缓冲液和梯度溶液,根据目标蛋白的特性调整pH值和盐浓度。
3.设置洗脱缓冲液的流量和梯度溶液的梯度程序。
三、样品准备和负载1.根据实验要求,选择适当的样品预处理方法,如离心、过滤、冻干等。
2.根据目标蛋白的亲和特性和pH效果,调整样品pH值并添加必要的盐。
3.将样品加入到层析柱中,确保样品均匀覆盖柱床,并避免气泡。
四、洗脱和收集1.开始运行层析仪,以洗脱缓冲液的流量洗脱样品。
2.监控样品的吸收曲线,调整洗脱缓冲液的pH值和盐浓度,以实现目标蛋白的洗脱。
3.相关实验过程中,及时收集和保存洗脱图峰的分馏物,便于后续分析。
五、柱的再平衡和清洗1.在洗脱完毕后,用适当的缓冲液进行柱的再平衡,以去除残留的洗脱缓冲液和杂质。
2.清洗柱子时,确保缓冲液的流量和浓度符合实验要求,并充分冲洗层析柱。
六、实验后清洗和消毒1.关闭层析仪和其他设备,清除样品和实验废液。
2.将使用过的层析柱经过清洗和消毒处理,准备下一次实验使用。
3.清洗操作台面和其他实验器材,确保实验环境清洁。
七、实验记录和数据分析1.记录重要的实验操作、观察和结果,包括样品负载量、洗脱曲线等。
2.对实验数据进行统计和分析,计算目标蛋白的纯化效率和纯度。
3.分析实验结果,并做出合理解释。
以上是蛋白纯化层析系统操作规程的一般步骤和要点,实验人员在进行实验前,应详细了解实验的要求和步骤,并根据实际情况进行相应的调整和优化。
此外,在实验过程中,要注意安全操作,遵守实验室规章制度,确保实验的顺利进行。
蛋白表达纯化实验步骤之欧阳道创编

蛋白表达纯化实验步骤(待改进)1、取适当相应蛋白高表达的动物组织提total-RNA。
2、设计蛋白表达引物。
引物要去除信号肽,要加上适当的酶切位点和保护碱基。
3、RT-PCR,KOD酶扩增获取目的基因c DNA.4、双酶切,将cDNA.克隆入PET28/32等表达载体。
5、转化到DH5α感受态细菌中扩增,提质粒。
6、将质粒转化入表达菌株,挑菌检测并保种。
表达菌株如Bl21(DE3)、Rosetta gami(DE3)、Bl21 codon(DE3)等。
7、蛋白的诱导表达。
1)将表达菌株在3ml LB培养基中摇至OD=0.6左右,加入IPTG,浓度梯度从25μM到1m M。
37度诱导过夜(一般3h以上即有大量表达)。
2)SDS-PAGE电泳检测目的蛋白的表达。
注:目的蛋白包涵体表达量一般会达到菌体蛋白的50%以上,在胶上可以看到明显的粗大的条带。
3)将有表达的菌株10%甘油保种,保存1ml左右就足够了,并记录IPTG浓度范围。
甘油是用0.22μm过滤除菌的,储存浓度一般是30%-60%,使用时自己计算用量。
4)用上述IPTG浓度范围的最低值诱导10ml表达菌,18度,低转速(140-180rpm),诱导过夜作为包涵体检测样品。
注意:1.如果表达的蛋白对菌体有毒性,可以在加IPTG之前的培养基中加入1%的葡萄糖用来抑制本底表达。
葡萄糖会随着细菌的繁殖消耗殆尽,不会影响后面的表达。
2.保种可以取一部分分成50μl一管,每次用一管,避免反复冻融。
8、包涵体检测。
方案见附件29、如有上清表达,则扩大摇菌。
1)取保种的表达菌株先摇10ml,37度,300rpm摇至OD>=1.5,约5h左右,视菌种的活性而异,也可过夜摇菌。
2)将上一步中的8ml加入300ml培养基中37度,250rpm 摇至OD= 1.0左右(约2.5h~3h),然后加IPTG(浓度同包涵体检测中使用的浓度。
)注:菌液浓度要适当的浓一些,否则第二天收集不到足够的菌体,因为低温低转速细菌生长非常缓慢。
凝胶过滤层析纯化蛋白的步骤

凝胶过滤层析纯化蛋白的步骤凝胶过滤层析(Gel filtration chromatography)是一种常用的蛋白纯化方法,可以根据蛋白的分子大小以及形状,将不同分子量的蛋白分离和纯化。
下面将详细介绍凝胶过滤层析纯化蛋白的步骤,并探讨其中一些关键的因素。
1.实验准备:准备所需的层析柱、缓冲液、样品和标准品。
选择合适的层析柱是非常重要的,根据需要选择合适的分离范围和流速。
2.柱填充:将经过活化、平衡的凝胶填充到柱中。
凝胶通常是由多孔的聚合物材料制成,如琼脂糖或聚丙烯酰胺。
选择适当的凝胶类型和粒径主要根据目标蛋白的分子大小来决定。
常见的凝胶类型有Sephadex,Sephacryl和Superdex等。
3.前处理样品:前处理样品通常包括去除杂质和减少非特异性结合。
通过串联多个柱,可以实现前处理样品,如亲和柱或离子交换柱。
4.平衡柱子:使用适当的缓冲液洗涤和平衡填充的柱子,以提前去除杂质和干扰物。
5.样品加载:将待纯化的样品加载到填充好的层析柱中。
样品应根据需要进行浓缩和稀释,使其适合填充层析柱。
6.层析运行:选择恰当的流速和缓冲液来进行层析运行。
在层析过程中,缓冲液会逐渐在凝胶中通过,较大分子的蛋白会随着缓冲液流动而快速通过,而较小分子的蛋白则会受到凝胶孔径限制而在凝胶中滞留更长时间。
这样就实现了蛋白的分离和纯化。
7.收集洗脱分数:根据纯化目标的大小和形状,选择适当的分数收集。
较大分子的蛋白会在前期的分数中被洗脱,而较小分子的蛋白会在后期的分数中被洗脱。
8.分析和纯化评价:通过检测分析,如SDS-或Western blot等技术,评估样品纯度和目标蛋白的丰度。
如果需要更高的纯度,可进行进一步的步骤,如再层析或其他纯化方法。
在凝胶过滤层析纯化蛋白的过程中-选择适当的缓冲液:缓冲液的pH值和离子强度应根据目标蛋白的理化性质进行优化,以保持蛋白稳定性和纯化效果。
-选择合适的流速:流速的选择应根据柱子的尺寸和样品的需求进行调整。
化学生物专业实习报告5篇

化学生物专业实习报告(2)化学生物专业实习报告(2)精选5篇(一)实习报告(2)实习单位:化学生物研究所实习日期:20XX年X月X日至20XX年X月X日实习地点:XX市XX区XX路XX号一、实习简介化学生物研究所是一家专注于化学生物学研究的机构,致力于利用化学方法研究生物学系统中的各种生物分子的结构、功能和相互作用,以及相关的生物过程和生物学程序。
本次实习主要了解和参与了该研究所的一项关于药物筛选的项目。
二、实习内容1. 熟悉实验室设备和操作规程。
在实习开始前,负责老师向我介绍了实验室的各个设备以及安全操作规程。
我了解到了实验室的安全措施和实验室设备的使用方法。
2. 参与实验项目的进行。
本次实习主要参与了一项关于药物筛选的项目。
该项目旨在通过对大量药物分子进行筛选,筛选出对特定靶点具有高选择性和活性的化合物,用于开发新型治疗药物。
我参与了实验室的分子库筛选工作,通过使用高通量筛选技术,对不同药物分子与靶点之间的相互作用进行评估和筛选。
3. 数据分析和文献查阅。
在实习过程中,我还参与了对实验数据的分析。
通过对实验结果的统计学分析和比较,评估了不同药物分子对于靶点的活性和选择性。
同时,也进行了相关的文献查阅,了解了该项目在同行领域的研究进展和相关成果。
4. 实验室管理和实验记录。
在实习期间,我了解到了实验室的管理和实验记录的重要性,并参与了实验记录和数据统计。
三、实习收获1. 系统了解了化学生物学研究的基本原理和方法。
通过实习,我深入了解了化学生物学研究的基本原理和方法。
学习了目前常用的药物筛选技术和分析方法,对化学生物学领域的研究有了更加全面的认识。
2. 增强了实验操作技能。
在实习中,我熟悉了实验室的常用设备,并掌握了一些重要的实验操作技巧。
通过反复实践,提高了实验的准确性和效率。
3. 学习了团队合作和沟通能力。
在实习中,我与实验室的其他成员共同合作,进行领域内的学术讨论和实验方案的设计,提高了团队合作和沟通能力。
蛋白表达纯化实验步骤

蛋白表达纯化实验步骤蛋白表达纯化实验步骤(待改进)1、取适当相应蛋白高表达的动物组织提total-RNA。
2、设计蛋白表达引物。
引物要去除信号肽,要加上适当的酶切位点和保护碱基。
3、RT-PCR,KOD酶扩增获取目的基因 c DNA.4、双酶切,将cDNA.克隆入PET28/32等表达载体。
5、转化到DH5α感受态细菌中扩增,提质粒。
6、将质粒转化入表达菌株,挑菌检测并保种。
表达菌株如Bl21(DE3)、Rosetta gami(DE3)、Bl21 codon(DE3)等。
7、蛋白的诱导表达。
1)将表达菌株在3ml LB培养基中摇至OD=0.6左右,加入IPTG,浓度梯度从25μM到1m M。
37度诱导过夜(一般3h以上即有大量表达)。
2)SDS-PAGE电泳检测目的蛋白的表达。
注:目的蛋白包涵体表达量一般会达到菌体蛋白的50%以上,在胶上可以看到明显的粗大的条带。
动等原因,要及时调整。
溶液由浑浊变清透,由粘稠变不粘稠表明裂解完成(后面3000转离心时,如果沉淀少说明裂解的好)。
5.超声波破碎仪工作30分min要休息5min(即关闭总电源开关)。
注意:1.如果纯化的蛋白较易被蛋白酶降解,在超声裂解之前要加蛋白酶抑制剂(PMSF),PMSF工作浓度为1%。
2.如不能判断是否裂解完全,就按上述条件裂解60分钟,60分钟足够裂解。
8、取得上清1)将破碎好的溶液收集到50ml离心管中。
10000rpm,15min,4°离心。
沉淀为包涵体、细胞碎片和未破碎的细胞。
轻轻的将上清倒出,尽量不要倒出沉淀。
(此时可以测量一下pH值,pH值最好在7.5左右。
平衡buffer的pH是7.8左右,裂解后上清就会在7.5左右。
)9、纯化上清---摸洗脱条件。
1)镍柱处理。
将1ml镍柱吸入空层析管中,待其中的液体流完后加入平衡缓冲液3ml。
2)将10ml上清加到已经平衡过的NI柱上,并将过柱的样品重复上样3次。
(若是流速慢可以在柱子下面加一个针头,或者用1ml 的枪将胶体吹散。
猪流行性腹泻病毒(PEDV)DR13株N蛋白和M蛋白的分离纯化

猪流行性腹泻病毒(PEDV)DR13株N蛋白和M蛋白的分离纯化谢春芳1,胡忠俊2,于瑞嵩1,董世娟1,陈冰清1,李震"(#上海市农业科学院畜牧兽医研究所,上海市农业遗传育种重点实验室动物遗传工程研究室,上海201106;2安徽农业大学动物科技学院,安徽合肥230036)摘要:本研究使用Ver。
细胞复苏繁殖猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)DR13株,并通过蔗糖梯度超速离心、SDS-PAGE电泳纯化PEDV DR13株的N蛋白和M蛋白。
结果PEDV DR13株具有致Ver。
细胞病变能力,TCID50为10$12/mL;获得的PEDV DR13株N蛋白和M蛋白的质量浓度分别为119.3"g/mL和66"g/mL,为后续研究奠定了基础°关键词:猪流行性腹泻病毒(PEDV);N蛋白;M蛋白;纯化猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)可感染各年龄段猪而引发严重腹泻、脱水,甚至死亡,1#3日龄患猪的死亡率可达100%,成年患猪体重下降、消瘦,给养猪业造成巨大的经济损失山。
PEDV属甲型冠状病毒,即a冠状病毒,是有包膜的单股正链RNA病毒,全长约28kb,至少有7个开放阅读框(ORF1a、ORFlN、ORF2、ORF3、ORFR、ORF5和ORF6)。
ORF1a和ORFlb编码复制酶聚蛋白,该蛋白能被蛋白酶裂解为16个非结构蛋白(nsp1〜nsp16);ORF3编码1种辅助蛋白,ORF2、ORFR、ORF5和ORF6分别编码纤突蛋白S、包膜蛋白E、膜蛋白M和核衣壳蛋白N等R种结构蛋白PEDV N蛋白是病毒的核衣壳蛋白,相对分子质量为55000〜58000,是PEDV的主要结构蛋白,能包裹病毒RNA形成螺旋核糖核蛋白;该蛋白还参与病毒的转录,抑制宿主细胞生长,激活宿主内质网应激,抑制宿主&干扰素的产生以及宿主干扰素刺激基因(Interfere onstimulateing gene,ISG)的表达。
猪圆环病毒3型Cap蛋白的原核表达

·研究论文·Chinese Journal of Animal Infectious Diseases中国动物传染病学报摘 要:为获得具有良好抗原性的猪圆环病毒3型(PCV3)Cap 重组蛋白,根据本实验室已测序获得的1株全基因组序列设计特异性引物,以阳性病料中提取的病毒DNA 基因组为模板,通过PCR 方法扩增得到PCV3的去核定位信号的Cap 蛋白基因,将目的片段插入到pCold TF 载体中构建pCold TF-dPCV3-Cap 重组质粒,然后将其转化至表达宿主菌BL21(DE3)中,通过优化表达和纯化条件,最终获得纯度较高的Cap 重组蛋白。
SDS-PAGE 分析表明,该蛋白能够在上清液中大量表达,并且在IPTG 终浓度为1 mmol/mL 、16℃诱导20 h 的条件下表达量最高;Western blot 结果证实通过磁珠纯化后的目的蛋白与PCV3阳性血清能够发生特异性反应。
因此,重组Cap 蛋白具有良好的反应原性和特异性,可以作为研制PCV3多表位基因工程疫苗和血清抗体诊断方法的候选靶抗原。
关键词:猪圆环病毒3型;原核表达;Cap 蛋白中图分类号: S852.659.2文献标志码:A文章编号:1674-6422(2021)05-0059-05Prokaryotic Expression and Antigenic Analysis of Cap Protein of Porcine Circovirus Type 3W ANG Shuaiyong, W ANG Qi, ZHU Shiqiang, Y AO Y un, YU Lingxue, LIU Xiaomin, SHAN Tongling,ZHENG Hao, ZHOU Yanjun, TONG Wu, LI Guoxin, GAO Fei, TONG Guangzhi, YU Hai(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241,China)收稿日期:2019-04-19基金项目:上海市自然科学基金青年项目(16ZR1444000);中央级公益性科研院所基本科研业务费项目(2019JB05);中国农业科学院创新工程“猪病毒性繁殖障碍综合症团队”项目作者简介:王帅勇,男,硕士研究生,预防兽医学专业通信作者:猪圆环病毒3型Cap 蛋白的原核表达王帅勇,汪 琪,朱世强,姚 云,虞凌雪,刘晓敏,单同领,郑 浩,周艳君,童 武,李国新,高 飞,童光志,于 海(中国农业科学院上海兽医研究所,上海200241)2021,29(5): 59-63Abstract: According to the complete genomic sequence of Porcine circovirus type 3 (PCV3) that was isolated in our laboratory, a pair of specifi c PCR primers were designed and the nuclear localization signal-defected capsid protein gene was amplifi ed by PCR for prokaryotic expression. The PCR product was inserted into the pCold TF vector to construct the recombinant plasmid pCold TF-dPCV3-Cap, which was then transformed into expression host strain BL21(DE3) with IPTG induction. The expressed fusion protein was analyzed by SDS-PAGE. The results showed that the recombinant Cap protein was expressed and released into the supernatants in soluble form. The optical conditions for the Cap protein expression were determined to be 16℃, 1 mmol/mL IPTG and induction for 24 h. The Cap protein was purifi ed by using magnetic beads and antigenic analysis was carried out by Western blot. The results demonstrated that the Cap protein obtained had good antigenicity and specifi city.Key words: Porcine circovirus type 3; prokaryotic expression; Cap protein· 60 ·中国动物传染病学报2021年10月猪圆环病毒(Porcine circovirus,PCV)属于圆环病毒科圆环病毒属,是一种单股环状DNA病毒。
类弹性蛋白多肽-红色荧光蛋白融合蛋白的表达纯化及细胞相容性

第22卷第1期北华大学学报(自然科学版)Vol.22No.12021年1月JOURNAL OF BEIHUA UNIVERSITY(Natural Science)Jan.2021文章编号:1009-4822(2021)01-0042-05DOI :10.11713/j.issn.1009-4822.2021.01.008类弹性蛋白多肽-红色荧光蛋白融合蛋白的表达纯化及细胞相容性刘㊀宁,崔梅英,王明月,杨泽斌,王㊀浩,毛㊀禹,方楷漪,夏㊀薇,关新刚(北华大学医学技术学院,吉林吉林㊀132013)摘要:目的㊀构建携带红色荧光蛋白(mCherry)标签的类弹性蛋白(ELP)原核表达载体,并表达纯化ELP-mCherry 融合蛋白,探讨ELP-mCherry 融合蛋白与细胞的相容性.方法㊀对利用限制性内切酶Xba I 和Xho I 对mCherry 质粒和pET28a-ELP 载体同时进行双酶切,将酶切产物回收㊁连接并转化DH5α大肠杆菌感受态细胞,构建重组质粒pET28a-ELP-mCherry;将重组质粒转化到BL21(DE3)大肠杆菌感受态细胞中,诱导表达ELP-mCherry 融合蛋白;利用可逆转变循环(ITC)法对ELP-mCherry 融合蛋白进行纯化;通过MTT 法探讨ELP-mCherry 融合蛋白与人胚肾上皮细胞HEK293T 和小鼠胚胎成纤维细胞NIH3T3的细胞相容性.结果㊀DNA 测序结果显示成功构建了ELP-mCherry 原核表达载体;利用BL21(DE3)大肠杆菌表达系统成功表达ELP-mCherry 融合蛋白,通过ITC 法纯化得到了高纯度融合蛋白.MTT 结果表明:在所有ELP-mCherry 蛋白测试浓度下,HEK293T 和NIH3T3细胞存活率接近或超过100%.结论㊀成功构建ELP-mCherry 原核表达载体,成功表达并纯化得到高纯度的ELP-mCherry 融合蛋白,ELP-mCherry 融合蛋白在HEK293T 和NIH3T3细胞中具有良好的细胞相容性.关键词:类弹性蛋白多肽;红色荧光蛋白;原核表达;蛋白纯化;细胞相容性中图分类号:Q943.2文献标志码:A收稿日期:2020-03-08基金项目:吉林省科技发展计划项目(20180101213JC);吉林省人才开发资金项目(201858);吉林省教育厅科学技术研究项目(JJKH20200033KJ);吉林省卫生计生青年科技骨干培养计划项目(2017Q040);吉林市科技创新发展计划项目(201831729);北华大学青年科研创新团队项目.作者简介:刘㊀宁(1996 ),女,硕士研究生,主要从事检验诊断新技术研究,E-mail:842832918@;通信作者:夏㊀薇(1964 ),女,博士,教授,硕士生导师,主要从事检验诊断新技术研究,E-mail:xiawei4016@.Prokaryotic Expression ,Purification and Cell Compatibility ofELP-mCherry Fusion ProteinLIU Ning,CUI Meiying,WANG Mingyue,YANG Zebin,WANG Hao,MAO Yu,FANG Kaiyi,XIA Wei,GUAN Xingang(School of Medical Technology ,Beihua University ,Jilin 132013,China )Abstract :Objective To construct elastin-like protein (ELP)prokaryotic expression vector with red fluorescent protein (mCherry)tag,to purify the ELP-mCherry fusion protein and investigate the biocompatibility of ELP-mCherry protein on cells.Method mCherry plasmids and pET28a-ELP plasmids were double digested by restriction endonucleases Xba I and Xho I,which were used to construct pET28a-ELP-mCherry plasmid.The recombinant plasmids were transformed into BL21(DE3)E.coli competent cells to express ELP-mCherry fusion protein.ELP-mCherry fusion was purified by reversible transformation cycle method (ITC).The biocompatibility of ELP-mCherry protein was evaluated on human renal epithelial cells and mouse embryonic fibroblasts by MTT method.Results DNA sequencing result indicated the successful construction of ELP-mCherry plasmid,and ELP-mCherry fusion protein was acquired and purified by using BL21(DE3)E.coli system via ITC method.MTT results showed that HEK293T and NIH3T3treated with ELP-mCherry fusion protein under all tested concentration has a cell viability of100%or more.Conclusion We successfully constructed ELP-mCherry prokaryotic expression vector,and got the high purity ELP-mCherry fusion protein,ELP-mCherry protein had good cell compatibility on HEK293T and NIH3T3.Key words:elastin-like polypeptide;mCherry;prokaryotic expression;protein purification;cell compatibility㊀㊀类弹性蛋白样多肽(elastin-like polypeptide, ELP)是一种由基因工程设计合成的非免疫原性且无热原性的具有良好生物相容性的蛋白质聚合物[1-2],ELP主要是由五肽重复序列单元构成,即Val-Pro-Gly-Xaa-Gly(VPGXG),其中Xaa是除脯氨酸以外的任一种氨基酸[3-5].ELP具有可逆相变循环(Inverse transitioncycling,ITC)的特性,即温度低于其相变温度,ELP多肽以高度可溶的形式存在于水溶液中;若温度高于其相变温度,ELP开始聚集,形成不溶物聚集体,且该过程可逆[6].由于ELP具有的这种特殊性质,在大肠杆菌中高产量表达的ELP蛋白可以利用可逆相变的特性进行快速纯化[7].红色荧光蛋白(mCherry)是SHANER 等[8]将发色基团mRFP进行位点突变得到的一种单体红色荧光蛋白[9],mCherry的荧光强度高且稳定性好[10].KALIMUTHU等[11]将含有mCherry基因的慢病毒颗粒转染人间充质干细胞,表达红色荧光mCherry基因,用生物发光成像法追踪间充质干细胞在荷瘤小鼠中的迁移.在本研究中,基于ELP蛋白的独特优势及mCherry的荧光成像特性,我们构建了ELP-mCherry原核表达载体,表达纯化了ELP-mCherry 融合蛋白,探讨了其与人肾上皮细胞HEK293T和小鼠胚胎成纤维细胞NIH3T3细胞的相容性,为设计开发新型的荧光示踪组织工程材料奠定了基础. 1㊀材料与方法1.1㊀细胞、主要仪器和试剂pET28a-ELP和pEGFP-N1-mCherry质粒(Origene 公司,美国);限制性内切酶Xba I与Xho I(生工生物工程(上海)有限公司);大肠杆菌BL21菌株为本实验室保存菌株;HEK293T细胞㊁NIH3T3细胞复苏自本实验室冻存细胞;胰蛋白胨㊁酵母提取物㊁卡那霉素㊁异丙基-β-D-硫代半乳糖苷(IPTG)(生工生物工程(上海)有限公司);多功能酶标仪Tecan Spark(上海帝肯公司);PCR仪㊁核酸电泳以及SDS-PAGE电泳所使用的电泳仪与电泳槽(Bio-Rad公司,美国).1.2㊀ELP-mCherry原核表达载体的构建及鉴定根据GenBank中mCherry基因的核苷酸序列设计包含mCherry基因编码框的引物(生工生物工程(上海)有限公司),并在引物两端分别添加Xba I和Xho I酶切位点.以pEGFP-N1-mCherry为模板通过PCR扩增获得mCherry片段,凝胶回收mCherry片段.mCherry片段和pET28a-ELP质粒分别用1μL限制性内切酶Xba I和Xho I酶切,回收目的片段,利用T4DNA连接酶在4ħ连接过夜,将连接产物转化到DH5α感受态细胞,接种于含有卡那霉素的LB平板上过夜培养.从平板培养基中挑取单个菌落,170r/min摇床过夜,提取质粒后用Xba I限制性内切酶进行单酶切验证,再用Xba I和Xho I进行双酶切及1%琼脂糖凝胶电泳检测(Bio-rad),并将构建的重组质粒送至生工生物工程(上海)股份有限公司进行测序分析.1.3㊀ELP-mCherry融合蛋白的原核表达将构建的pET28a-ELP-mCherry质粒转化到大肠杆菌感受态细胞(BL21)中,过夜培养后挑取单克隆菌落,接种于20mL含有卡那霉素的LB培养基中,37ħ㊁170r/min摇菌过夜;第2天按1ʒ50接种于1L含有卡那霉素的LB培养基中,当OD600达到0.6时,加入IPTG(终浓度1mmol/L),37ħ条件下培养6h诱导蛋白表达;离心收集菌体,PBS重悬菌体沉淀后加入苯甲基磺酰氟(PMSF,终浓度1mol/L),应用超声破碎菌体,离心收集上清和沉淀,通过SDS-PAGE电泳分析蛋白的表达情况. 1.4㊀ELP-mCherry融合蛋白的纯化利用ITC法快速纯化ELP-mCherry融合蛋白,将裂解液上清用NaOH调节pH至9.0,4ħ振荡过夜;第2天将裂解液上清在4ħ下,5000r/min离心90min,去除不溶性蛋白沉淀;将分离的上清恢复至室温后,置于37ħ摇床,250r/min震荡3h,在3h 内分3次加入NaCl至终浓度为1mol/L,37ħ离心收集沉淀,PBS重悬沉淀.以上过程重复两个循环,通过SDS-PAGE电泳分析蛋白的纯化情况.1.5㊀ELP-mCherry融合蛋白的细胞相容性用MTT法检测ELP-mCherry融合蛋白对HEK293T细胞和NIH3T3细胞增殖能力的影响.将对数生长期的HEK293T细胞和NIH3T3细胞以5000个/孔接种于96孔板中,置入37ħ㊁5%CO2培养箱中培养24h;第2天每孔中加入终浓度25㊁34第1期刘㊀宁,等:类弹性蛋白多肽-红色荧光蛋白融合蛋白的表达纯化及细胞相容性50㊁100㊁200㊁300μg /mL 的ELP-mCherry 融合蛋白,每个ELP-mCherry 融合蛋白浓度做5个平行孔.培养48h 后每孔加入20μL 的MTT,37ħ孵育4h 后,每孔再加入150μL 二甲基亚砜(DMSO),沉淀充分溶解后在酶标仪(TECAN M200)上测定OD 490时每孔的吸光度值.2㊀结㊀㊀果2.1㊀ELP-mCherry 原核表达载体的构建将从mCherry 质粒中获得的PCR 产物与pET28a-ELP 质粒分别用限制性内切酶Xba I 和Xho I 双酶切后,酶切产物经0.8%琼脂糖凝胶分离,将目的片段凝胶回收后连接,连接产物转化到Kana 平板,获得阳性克隆.提取质粒通过酶切进行验证,双酶切产生的片段与预期大小一致,提示pET28a-ELP-mCherry 重组质粒初步构建成功.见图1.DNA 测序结果显示mCherry 基因被成功插入表达载体中,没有发生碱基突变和移位,表明pET28a-ELP-mCherry 重组质粒构建成功.见图2.M.DL 5000DNA marker;1.Xba I 单酶切结果;2.Xba I 和Xho I 双酶切结果.图1pET28a-ELP-mCherry 重组质粒的酶切鉴定Fig.1Identification of pET28a-ELP-mCherry㊀㊀recombinant plasmid by enzymedigestion图2pET28a-ELP-mCherry 重组质粒的测序结果Fig.2Sequencing result of pET28a-ELP-mCherry recombinant plasmid2.2㊀ELP-mCherry 融合蛋白的原核表达将pET28a-ELP-mCherry 表达载体转入大肠杆菌感受态细胞(BL21)中,诱导ELP-mCherry 重组蛋白表达,SDS-PAGE 电泳结果显示:在细胞裂解液的上清在分子量30kDa 左右出现明显的蛋白条带,与ELP-mCherry 融合蛋白的预计分子量相符,说明ELP-mCherry 融合蛋白存在于细胞裂解液上清中,然后再利用ITC 法进行快速纯化.见图3.M.蛋白分子量标准;1.菌体细胞裂解液上清;2.菌体细胞裂解液沉淀.图3ELP-mCherry 重组蛋白的原核表达Fig.3Prokaryotic expression of ELP-mCherryrecombinant protein2.3㊀ELP-mCherry 融合蛋白的纯化利用ITC 法纯化ELP-mCherry 融合蛋白,裂解液上清通过两轮ITC 循环的结果显示:电泳条带纯化后的ELP-mCherry 融合蛋白在30kDa 位置显示单一条带,未出现明显的蛋白杂带,且蛋白分子量与ELP-mCherry 融合蛋白相符.因此,可以确定纯化蛋白为ELP-mCherry 蛋白.见图4.M.蛋白分子量标准;1.纯化后的ELP-mCherry 融合蛋白.图4ELP-mCherry 融合蛋白纯化Fig.4Purification of ELP-mCherry fusion protein2.4㊀ELP-mCherry 融合蛋白细胞相容性分析将不同浓度ELP-mCherry 融合蛋白(25㊁50㊁100㊁200㊁300μg /mL)分别处理HEK293T 细胞及NIH3T3细胞48h 后,通过MTT 法检测细胞的存活率.处理48h 后,HEK293T 细胞的存活率在各个浓44北华大学学报(自然科学版)第22卷度下都超过100%,NIH3T3细胞在测试所有浓度下也接近100%,这些结果说明ELP-mCherry 融合蛋白在两种细胞中都具有良好的细胞相容性.见图5.图5ELP-mCherry 融合蛋白的细胞相容性Fig.5Cell compatibility of ELP-mCherry fusion protein3㊀结㊀㊀论利用传统亲和层析法(麦芽糖结合蛋白MBP㊁谷胱甘肽S-转移酶GST㊁多聚组氨酸标签His㊁多聚精氨酸Arg)可以快速获得高纯度的目的蛋白,然而纯化介质成本较高,因此,迫切需要开发一种成本低廉的高纯度蛋白量产方法[12-13].1999年,MEYER 等[14]首次将ELP 与其他蛋白融合表达时发现了其可逆温度相变转换的特性,从此开创了一种新的蛋白纯化方法,称为 ELP 化 ,即将目的蛋白基因与ELP 基因的N 末端或C 末端融合而获得融合蛋白的方法.由于类弹性蛋白多肽类衍生蛋白具有可逆温度相变(低温溶解,高温聚集)特性,应用ITC 法对ELPs 蛋白进行纯化只需要加盐㊁升温(蛋白聚集)㊁离心(收集蛋白沉淀)㊁蛋白复溶几个步骤即可完成,多数情况下只需要2~3轮ITC 纯化即可获得高纯度的目的蛋白,无需昂贵的亲和层析介质,极大地降低了蛋白的生产成本,有利于进行大规模的蛋白质生产.近年来 ELP 化 法在重组蛋白纯化㊁改善目的蛋白半衰期㊁提升蛋白产量㊁作为蛋白的递送载体等方面获得了广泛应用[15-18].例如,MOKTAN 等[19]将细胞穿膜肽和促凋亡肽分别融合在ELP 基因的N 末端和C 末端,通过大肠杆菌表达系统制备了一种新型的蛋白抗肿瘤药物SynB1-ELP-KLAK,结果显示融合蛋白具有显著抑制肿瘤细胞增殖的能力.PHAN 等[20]将两种禽流感H 5N 1抗原与ELP 融合后在转基因烟草中进行融合蛋白表达,并利用ITC 方法成功获得了融合蛋白,结果显示ELP 化方法在烟草表达系统中能够显著提高目的蛋白产量.FLOSS 等[21]将anti-HIV-1单克隆抗体2F5与ELP 融合后在中国仓鼠卵巢细胞(CHO)也获得了成功表达,结果显示单克隆抗体与ELP 融合并未影响2F5与抗原的结合活性,显示ELP 化法在哺乳动物表达系统中的有效性.本研究结果显示:通过构建ELP-mCherry 融合蛋白的表达载体,并将其转入大肠杆菌中进行融合蛋白表达,应用ITC 法对融合蛋白进行纯化,得到纯度较高的ELP-mCherry 融合蛋白.鉴于ELP 蛋白在细胞中极佳的细胞相容性,我们随后检测了ELP-mCherry 融合蛋白在HEK293T 细胞和NIH3T3细胞中的细胞相容性,结果显示融合蛋白在两种细胞的存活率超过或接近100%,提示引入mCherry 并未降低ELP 的细胞相容性,为接下来的组织工程应用奠定了良好的材料基础.mCherry 红色荧光蛋白的最大激发波长为587nm [22-24],具有结构稳定㊁表达量高㊁测定简便等优点,因此,被广泛用来对组织细胞定位进行示踪.将ELP 与mCherry 制备成ELP-mCherry 融合蛋白,既可以利用ELP 的可逆温度相变转换特性纯化的融合蛋白,又可以利用mCherry 高度稳定的红色荧光追踪其分布[25],因此,可作为理想的集示踪与支架功能于一身的生物材料用于皮肤损伤愈合㊁组织修复等工程应用.综上所述,本研究成功构建pET28a-ELP-mCherry 表达载体,表达并纯化ELP-mCherry 融合蛋白,ELP-mCherry 融合蛋白对HEK293T 细胞和NIH3T3细胞具有良好的细胞相容性,此研究为开发新型的组织工程示踪材料奠定了基础.参考文献:[1]MECO E,LAMPE K J.Impact of elastin-like proteintemperature transition on PEG-ELP hybrid hydrogel pro-perties[J].Biomacromolecules,2019,20(5):1914-1925.[2]MULLERPATAN A,CHANDRA D,KANE E,et al.Purification of proteins using peptide-ELP based affinityprecipitation[J].Biotechnol,2020,309:9-67.[3]GONZALEZ V J,GIROTTI A,MUNOZ R,et al.Self-54第1期刘㊀宁,等:类弹性蛋白多肽-红色荧光蛋白融合蛋白的表达纯化及细胞相容性assembling ELR-based nanoparticles as smart drug-delivery systems modulating cellular growth via Akt[J].Bioma-cromolecules,2019,20(5):1996-2007.[4]TA D T,VANELLA R,NASH M A.Bioorthogonal elastin-like polypeptide scaffolds for immunoassay enhancement[J]. Acs Appl Mater Interfaces,2018,10(36):30147-30154.[5]SREEKUMAR P G,LI Z,WANG W,et al.Intra-vitreal alphaB crystallin fused to elastin-like polypeptide pro-vides neuroprotection in a mouse model of age-related macular degeneration[J].J Control Release,2018,283: 94-104.[6]SARANGTHEM V,CHO E A,YI A,et al.Application of bld-1-embedded elastin-like polypeptides in tumor targe-ting[J].Sci Rep,2018,8(1):3892.[7]HUANG Kaizong,GAO Mengyue,FAN Lin,et al.IR820 covalently linked with self-assembled polypeptide for photothermal therapy applications in cancer[J].Biomater Sci,2018,6(11):2925-2931.[8]SHANER N C,CAMPBELL R E,STEINBACH P A,et al.Improved monomeric red,orange and yellow fluore-scent proteins derived from Discosoma sp.red fluorescent protein[J].Nat Biotechnol,2004,22(12):1567-1572.[9]王文旭,郁飞.红色荧光蛋白融合表达载体的构建和蛋白质细胞内定位研究[J].江苏农业科学,2019,47 (8):52-55.[10]陈英,王培娟,张文,等.mCherry红色荧光标记乳酸菌的融合表达系统构建及应用[J].生物工程学报,2019,35(3):492-504.[11]KALIMUTHU S,ZHU L,OH J M,et al.Migration ofmesenchymal stem cells to tumor xenograft models andin vitro drug delivery by doxorubicin[J].Int J Med Sci,2018,15(10):1051-1061.[12]ZHU D,WANG H,TRINH P,et al.Elastin-like protein-hyaluronic acid(ELP-HA)hydrogels with decoupledmechanical and biochemical cues for cartilage regene-ration[J].Biomaterials,2017,127:132-140. [13]LUO T,DAVID D A,DUNSHEE L C,et al.Thermo-responsive elastin-b-collagen-like peptide bioconjugatenanovesicles for targeted drug delivery to collagen-con-taining matrices[J].Biomacromolecules,2017,18(8):2539-2551.[14]MEYER D E,CHILKOTI A.Purification of recombinantproteins by fusion with thermally-responsive polypept-ides[J].Nature Biotechnology,1999,17(11):1112-1115.[15]MONFORT D A,KORIA P.Recombinant elastin-basednanoparticles for targeted gene therapy[J].Gene Ther,2017,24(10):610-620.[16]KOUHI A,YAO Z,ZHENG L,et al.Generation of a mon-oclonal antibody to detect elastin-like polypeptides[J].Biomacromolecules,2019,20(8):2942-2952. [17]ATEFYEKTA S,PIHL M,LINDSAY C,et al.Antibio-film elastin-like polypeptide coatings:functionality,stability,and selectivity[J].Acta Biomater,2019,83:245-256.[18]关新刚,苏维恒,于欣,等.Tat-GFP融合蛋白的表达纯化及其穿膜活性[J].吉林大学学报(医学版),2014,40(4):725-728.[19]MOKTAN S,RAUCHER D.Anticancer activity of proa-poptotic peptides is highly improved by thermal targetingusing elastin-like polypeptides[J].International Journalof Peptide Research and Therapeutics,2012,18(3):227-237.[20]PHAN H T,CONRAD U.Membrane-based inversetransition cycling:an improved means for purifying plant-derived recombinant protein-elastin-like polypeptide fus-ions[J].International Journal of Molecular Sciences,2011,12(5):2808-2821.[21]FLOSS D M,SACK M,STADLMANN,et al.Biochemicaland functional characterization of anti-HIV antibody-ELP fusion proteins from transgenic plants[J].PlantBiotechnology Journal,2008,6(4):379-391. [22]陈孙霞,王晓庆,徐晓恩,等.共培养体系中高红色荧光蛋白(RFP)标记结肠癌细胞的检测技术[J].复旦学报(医学版),2014,41(5):602-609. [23]金权鑫,许嘉珍,魏枫,等.MuSK-mCherry融合荧光蛋白的构建及对重症肌无力患者MuSK抗体的检测[J].中国免疫学杂志,2014,30(10):1369-1373. [24]赵俊丽,王东阳,南天惠,等.红色荧光蛋白遗传标记腺病毒衣壳蛋白pⅨ的实验研究[J].陕西师范大学学报(自然科学版),2011,39(6):60-63. [25]樊晋宇,崔宗强,张先恩.红色荧光蛋白的光谱多样性及体外分子进化[J].生物化学与生物物理进展,2008,35(10):1112-1120.ʌ责任编辑:陈丽华ɔ64北华大学学报(自然科学版)第22卷。
2021年分生实验报告质粒DNA的提取纯化与鉴定

试验四质粒DNA提取, 纯化与判定DNA体外重组技术【试验原理】是在分子水平上, 依据大家需要以人工方法取得感爱好目基因, 在体外与载体DNA分子重组, 然后将重组分子转入受体细胞, 并筛选出能表示重组DNA活细胞, 加以纯化、扩增, 成为克隆。
【试验步骤】1.分离或合成感爱好目基因及载体---分2.构建、改造作为载体DNA------------切3.目基因与载体DNA在体外重组--------接4.重组DNA引入受体细胞----------------转5.阳性重组子筛选、判定、扩增-------筛【注意事项】目基因取得:1.从染色体DNA中直接分离2.人工合成3.由mRNA逆转录合成cDNA4.从基因组文库中筛选目基因5.PCR取得载体选择:1.能在宿主细胞中独立复制, 并能携带重组DNA片段一同扩增;2.有适宜限制性酶切位点便于进行克隆;3.有一定筛选标识, 易于识别和筛选;4.载体分子应尽可能小, 可插入较大外源DNA而不影响复制;5.表示型载体应配置与宿主细胞相适应开启子、前导序列、增强子等调控元件;6.生物安全性好。
质粒DNA提取【试验原理】质粒是细胞质中独立于染色体之外能自主复制遗传单位。
基因工程中质粒通常是指细菌质粒, 它能够伴随细菌细胞分裂将自己遗传特征稳定遗传给后代细胞。
质粒中除了复制、转录等相关必需序列外, 有部分DNA区段对于细菌来说并非必需序列, 经过体外操作以目基因替换这些非必需区段, 这种改造质粒就成为外源基因载体。
根据质粒载体用途和其外源DNA遗传信息能否表示可分为中间克隆载体(如pMD18-T)和表示载体(如pET-X、 pBI121等)。
克隆载体所连接DNA片段通常没有开启子, 所以不能转录, 关键用于目片段大量制备。
表示载体根据宿主不一样有多种多样原核表示载体(如大肠杆菌)和真核表示载体(如酵母、动物和植物), 目基因在载体上有完整开启子和终止子调控, 能够在宿主细胞中转录并翻译成蛋白。
白背飞虱VAMP7和Vti1a蛋白的原核表达、抗体制备及应用

47卷第1期
张潇婉等:白背飞虱VAMP7和Vtila蛋白的原核表达、抗体制备及应用
・57・
行BP重组反应,最后得到PUC57-VAMP7和 PUC57-Vtila的入门载体。对重组载体进行基因测 序,测序正确后,选择含有目的基因的中间载体 ,利 用 Gateway LR Clonase Enzyme Mix 试剂盒,将其 与原核表达载体PET30a进行LR重组反应。最终 得到含有目的基因的原核表达载体PET30aVAMP7 和 PET30a-Vt订肌 1. 2.3原核诱导表达
2021
1材料与方法
1.1材料 1.1.1白背飞虱
实验室保存种群,饲养于水稻品种'黄金晴'幼 苗上,置于光照培养箱内(光期16 h,温度为28C; 暗期8 h,温度为25C),为保证白背飞虱营养充足, 每周更换一次水稻苗。 1.1.2菌株和载体
大肠杆菌 Escherichia coli BL21 (DE3)购自全 式金公司,入门载体PUC57和原核表达载体 PET30a 购自 Invitrogen 公司(美国)。 1.1.3 试验试剂
运过程。前期研究发现这两种蛋白分别与南方水稻黑条矮缩病毒Southern rice black-streaked dwarf virus (SRBSDV)的主要外层衣壳蛋白PIO存在显著互作,推测可能协助病毒粒体在介体白背飞虱内的转运和扩散。为
了进一步利用血清学技术研究VAMP7和Vtila在传毒过程中的功能,本研究克隆了白背飞虱编码这两种蛋白的
取成虫白背飞虱,提取其总RNA,后反转录成 cDNA,利用 Xba I VA-F/ BamH I VA-R 和 Xba I Vt-F/BamH I Vt-R引物对分别扩增VAMP7和 Wla基因。利用cDNA为模板,对目的基因进行 PCR扩增,后经聚丙烯酰胺凝胶电泳检测,回收纯 化目的条带。利用 Gateway BP Clonase Enzyme Mix试剂盒,将入门克隆载体PUC57与回收产物进
生物技术综合实验
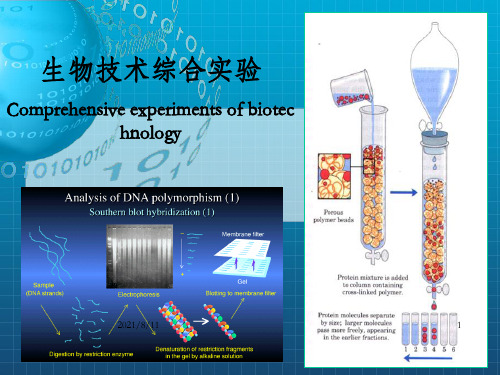
课程简介
现代生物技术综合性实验是以分子生物学为基础的基因克隆 重组技术和生物化学的蛋白质分离、纯化技术为核心的教学, 它是现代生物技术的核心。
主要内容:包括实验理论和实验技术 实验技术-生物技术综合实验,它是集目的基因的制备、克
隆、表达和蛋白质的分离纯化及其活性测定等实验方法和技 术为一体的一门综合性实验课。
chaotropic nature. As with other procedures involving RNA, gloves should be worn at all times to avoid cont
amination
of
samples
with
ribonucleases.
This method describes preparation from small quantities (~ 50mg) of tissue. Appropriate scaling of the volu mes involved can be performed to accomodate larger quantities.
目的:通过本门课程的学习,使学生掌握现代生物工程的上、
下游实验技术,对以基因克隆重组技术为主线的生物实验技
术有一个较全面的了解。
3
教学要求
通过教学,要求学生掌握分子生物学与基因工程的基本理论,巩固所学的理论知识; 使学生了解科研工作的基本思路,学会如何设计实验,如何分析实验,培养分析问题和
解决问题的能力; 培养和训练学生的基本实验技能,培养学生的独立工作能力和创造能力。 掌握基因重组的基本过程,如:核酸DNA、RNA和质粒DNA提取、酶切、连接、转化及
脱氧胆酸钠(DOC)是阴离子去污剂
重组抗菌肽HIPPAP的表达、纯化及抗菌功能鉴定

580Chin J Lab Diagn, A pril,2021,Vol 25,No. 4g in g[J]. Anal C h e m,2019,91 (20) : 12909.[4]M arleen H endriks, Lizzy B rew ster, Ferdinand W it,e t al. Cardiovascular disease prevention in rural Nigeria in the context of a community based health insurance schem e: Q U ality Improvement Cardiovascular care K w ara-I (Q U IC K-I)[J]. BMC Public H ealth, 2011,11:186.[5]中国国务院新闻办公室.《中国的医疗卫生事业》白皮书发布[J].中国信息界(e医疗),2013,18(3):1000.[6] 王莹,朱惠娟,曾勇.冠心病的基因组学研究现状[J].中国医学科学院学报,2015,37(4) :475.[7] 曹全胜,胡敏,黄伟.盐酸异丙肾上腺素及注射液的有关物质研究[J].药物分析杂志,2012,32(5):838.[8]Rahman K. Studies on free radicals, antioxidants, and co-factors[J].C lin Interv A g in g,2007,2(2) :219.(收稿日期:2019 —12 —26)文章编号:1007 —4287(2021)04 —0580 —03重组抗菌肽HIP/P A P的表达、纯化及抗菌功能鉴定杨怀玺,陈林,苏妍卓,王雪峰,丁大勇*(吉林大学中日联谊医院胃肠结直肠外科,吉林长春130033)随着肠道免疫功能研究的深人,肠道黏膜分泌的一系列具有抗菌作用的短肽受到了高度重视。
(2021年整理)IPTG诱导表达蛋白步骤

(完整版)IPTG诱导表达蛋白步骤编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整版)IPTG诱导表达蛋白步骤)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整版)IPTG诱导表达蛋白步骤的全部内容。
(完整版)IPTG诱导表达蛋白步骤编辑整理:张嬗雒老师尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布到文库,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是我们任然希望(完整版)IPTG诱导表达蛋白步骤这篇文档能够给您的工作和学习带来便利。
同时我们也真诚的希望收到您的建议和反馈到下面的留言区,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请下载收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为 <(完整版)IPTG诱导表达蛋白步骤〉这篇文档的全部内容.IPTG诱导表达蛋白步骤15—11—3配固体培养基和液体培养基,灭菌。
配BindingBuffer和脱盐液各500ml。
在400ml体积时调节溶液pH值至7。
4,定容后转到试剂瓶中。
溶液使用前要抽滤(滤除溶液内的气泡和不溶性杂质)。
倒板:(5个灭菌的培养皿)①微波加热溶解固体培养基(每次加热30s待有沸腾的迹象时,减少加热的时间)。
②超净台操作,以1˸1000的比例(1ml培养基~1μl抗生素)向培养基中加入Kan+(50mg/ml),摇匀。
③倒板。
④培养皿放置在超净台上凝固,凝固后将培养皿倒着放入培养箱中15—11—4热转化:(将质粒导入大肠杆菌中)①提前将大肠杆菌(冰上融化)和质粒拿出来融化,混合(冰上操作)后冰上放置30min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白表达纯化实验步骤(待改进)欧阳光明(2021.03.07)1、取适当相应蛋白高表达的动物组织提total-RNA。
2、设计蛋白表达引物。
引物要去除信号肽,要加上适当的酶切位点和保护碱基。
3、RT-PCR,KOD酶扩增获取目的基因c DNA.4、双酶切,将cDNA.克隆入PET28/32等表达载体。
5、转化到DH5α感受态细菌中扩增,提质粒。
6、将质粒转化入表达菌株,挑菌检测并保种。
表达菌株如Bl21(DE3)、Rosetta gami(DE3)、Bl21 codon(DE3)等。
7、蛋白的诱导表达。
1)将表达菌株在3ml LB培养基中摇至OD=0.6左右,加入IPTG,浓度梯度从25μM到1m M。
37度诱导过夜(一般3h以上即有大量表达)。
2)SDS-PAGE电泳检测目的蛋白的表达。
注:目的蛋白包涵体表达量一般会达到菌体蛋白的50%以上,在胶上可以看到明显的粗大的条带。
3)将有表达的菌株10%甘油保种,保存1ml左右就足够了,并记录IPTG浓度范围。
甘油是用0.22μm过滤除菌的,储存浓度一般是30%-60%,使用时自己计算用量。
4)用上述IPTG浓度范围的最低值诱导10ml表达菌,18度,低转速(140-180rpm),诱导过夜作为包涵体检测样品。
注意:1.如果表达的蛋白对菌体有毒性,可以在加IPTG之前的培养基中加入1%的葡萄糖用来抑制本底表达。
葡萄糖会随着细菌的繁殖消耗殆尽,不会影响后面的表达。
2.保种可以取一部分分成50μl一管,每次用一管,避免反复冻融。
8、包涵体检测。
方案见附件29、如有上清表达,则扩大摇菌。
1)取保种的表达菌株先摇10ml,37度,300rpm摇至OD>=1.5,约5h左右,视菌种的活性而异,也可过夜摇菌。
2)将上一步中的8ml加入300ml培养基中37度,250rpm摇至OD= 1.0左右(约2.5h~3h),然后加IPTG(浓度同包涵体检测中使用的浓度。
)注:菌液浓度要适当的浓一些,否则第二天收集不到足够的菌体,因为低温低转速细菌生长非常缓慢。
拿起锥形瓶对光摇动,看到有大量云雾状菌体即可。
另一方法是,将手指放在瓶底晃动,看不清手指为宜,不过此法宜受气泡影响。
3)过夜摇菌,使用包涵体检测的温度(18°左右),转速140rpm左右。
4)将菌液6000rpm,4min,4度离心收集菌体。
加入20mM PBS,洗一遍后用平衡缓冲液重悬。
每250ml菌液用30 ml到50ml 平衡缓冲液,视菌液的浓度而定。
可用4支50ml的离心管同时离心,但是,离心管要重复使用,用完后洗净保存。
10、超声波裂解。
1)用6mm变幅杆,35%功率,3.5s工作,7s休息,50min即可。
注意:1.要冰浴。
2.要随时观察裂解情况以防意外。
3.要将探头探入到溶液中下部,尽量不要打出大量气泡。
一般溶液量比较大的时候不会出现大量气泡。
4.正常声音为:孜孜声,尖锐刺耳的声音表明探头位置不对或者功率太大或者探头松动等原因,要及时调整。
溶液由浑浊变清透,由粘稠变不粘稠表明裂解完成(后面3000转离心时,如果沉淀少说明裂解的好)。
5.超声波破碎仪工作30分min要休息5min(即关闭总电源开关)。
注意:1.如果纯化的蛋白较易被蛋白酶降解,在超声裂解之前要加蛋白酶抑制剂(PMSF),PMSF工作浓度为1%。
2.如不能判断是否裂解完全,就按上述条件裂解60分钟,60分钟足够裂解。
11、取得上清1)将破碎好的溶液收集到50ml离心管中。
10000rpm,15min,4°离心。
沉淀为包涵体、细胞碎片和未破碎的细胞。
轻轻的将上清倒出,尽量不要倒出沉淀。
(此时可以测量一下pH值,pH值最好在7.5左右。
平衡buffer的pH是7.8左右,裂解后上清就会在7.5左右。
)12、纯化上清---摸洗脱条件。
1)镍柱处理。
将1ml镍柱吸入空层析管中,待其中的液体流完后加入平衡缓冲液3ml。
2)将10ml上清加到已经平衡过的NI柱上,并将过柱的样品重复上样3次。
(若是流速慢可以在柱子下面加一个针头,或者用1ml的枪将胶体吹散。
)取20μl过柱后的样品,以备跑胶。
3)分别加20mM、40mM、60mM、80 mM的咪唑梯度来洗脱杂蛋白。
每个梯度分别的上样量为4ml、2ml、2ml、2ml。
每个次上样的液体分前面1ml和后面1ml分别收集入EP管中,以备跑胶。
注意:理论上是要将收集的溶液测量280nm处的吸光度,直到吸光度为零时再进行下一个梯度的洗脱。
实际上测不到零,怎么都会有一点的,上面说的量已经做够洗脱了。
4)加Elution Buffer 将目的蛋白洗脱。
上样量为4.5ml(将前面的0.5ml 单独接入EP管,再将后面的4ml接入另外两个EP管),留跑胶样品。
5)加MES将NI柱重生。
MES加10ml,流完后再加10ml Miliq H2O。
流完后保存于2倍体积的20%乙醇中,镍柱至少能重复利用6次。
(尿素可能对NI柱有损伤。
)注意:所有溶液使用前都要确定其pH是否正确,pH对挂柱及洗脱影响较大。
镍柱所用溶液MES的ph=5.0,其余Equilibration Buffer pH=7.8 ,上清pH=7.5 ,Wash Buffer pH=7.0 ,Elution BufferpH=7.2。
13、跑胶验证。
1)跑2块0.75mm的PAGE胶,把所有的样品都加上去,注意两块胶的浓分离比要相同两块胶才会比较一致。
2)跑胶顺序:负对照、正对照、上清、过柱样品、W1、W2、W3、W4、W5、W6、W7、W8、W9、E1、E2、MES3)300V快速压胶5min左右,160V分离样品50min左右。
(也可以300V,30min,只是图没有160V好看。
)4)考马斯亮蓝染色。
一般染色2h即可。
5)脱色。
先用脱色剂1脱15min,再用脱色剂2脱过夜。
14、纯化上清---收集目的蛋白1)将重生的镍柱再次平衡(即加Equilibration Buffer 3ml)。
2)重复步骤12中的操作,只是wash时只用步骤12中摸好的咪唑浓度洗。
15、跑胶验证。
同步骤13这次胶图要跑的漂亮一点(用160V),保存好。
16、透析。
1)配制2L透析液(配方见附件1),并放于-20度冰箱预冷但不要结冰。
2)透析袋(剪10cm即可)用透析袋处理液煮沸10min,用MILIQ H2O充分洗净。
3)用透析夹将透析袋夹住(将透析袋折叠一下会夹的更牢),将洗脱的蛋白样品加入其中,置入提前预冷的500ml透析液(20mM PBS+50 mM NaCl)中。
冰浴下轻微磁力搅拌20min后置入4°冰箱1.5h后换液。
透析3次即可。
注意:用广口瓶装透析液,将广口瓶置于装有冰的2L大烧杯中。
冰浴以防活性降低。
17、浓缩。
1)将透析好的样品连同透析袋一起放在白色盒子中,用预冷的聚乙二醇2000固体包埋。
2)30min后将吸水后呈浆糊状的聚乙二醇去除,加入新的固体聚乙二醇。
3)每隔10min观察一次,一旦出现浑浊立即停止浓缩。
4)透析袋用完后,洗净,保存于20%乙醇中4°存放。
注意:浓缩过度后会有白色小颗粒或絮状晶体出现,由于透析袋使溶液成薄层状,透明度较高,不易发现小颗粒或絮状沉淀,要看仔细。
如果看不到,可根据自己估计的蛋白量留1-2ml体积。
用透析液将透析袋表面的聚乙二醇洗掉,吸取其中的溶液分装后-20度保存。
18、超滤法浓缩、透析蛋白。
使用超滤法就可省去16、17两步。
1)将4ml Elution 得到的蛋白溶液加入超滤管中。
2)配平。
3)7400g,30min,4°离心,结束时4ml变为1ml左右。
浓缩4倍。
可根据需要选择不同的离心时间,以达到不同的浓缩倍数。
可以几次的Elution液一起浓缩。
4)加入需要的蛋白储存液至4ml,离心。
重复操作可以使Elution液逐渐换为所需的蛋白储存液。
蛋白储存液一般用20mM PBS+*mM NaCl或适当浓度和pH的tris-HCl溶液。
如果蛋白有沉淀达不到预定浓度可以添加适当的甘油(1%-5%即可)助溶。
5)收集。
将溶液从超滤管中收集到EP管中,标记好储存液的成分,蛋白名称,蛋白浓度(测量后),制备日期。
注:超滤管的使用方法见附件419、蛋白浓度测定。
见附件320、蛋白活性测试。
转染细胞测量荧光。
21、抗原处理。
蛋白与弗氏佐剂混合成油包水状。
22、注射兔子。
选择合适的注射方式和合适的免疫程序。
23、收集免疫血清。
提取抗体。
24、抗体效价评定。
附件1所需溶液配方:1)20 mM PBS: 20 mM sodium phosphate, 300 mM NaCl pH 7.4试剂名称NaH2PO4-2H2O Na2HPO4-12H2O NaCl用量(g)1L 0.5928 5.802192 17.5322)Equilibration Buffer(平衡缓冲液): PBS with 10 mM 咪唑pH 7.43)Wash Buffer(清洗缓冲液): PBS with 25 mM/50 mM/75 mM 咪唑pH 7.44)Elution Buffer(洗脱缓冲液): PBS with 250 mM 咪唑pH 7.45)MES(再生缓冲液): 20 mM 2-(N-morpholine)-ethanesulfonic acid, 0.1 M sodiumchloride; pH 5.0。
即0.3904g MES+0.5844g NaCl.6)透析袋处理液: 2%(w/v)碳酸氢钠和1 mmol/L (pH8.0) EDTA7)透析液:20mM PBS+50 mM NaCl(2.92g)试剂名称NaH2PO4-2H2O Na2HPO4-12H2O NaCl用量(g)1L 0.5928 5.802192 2.92gTIPS:1—4的溶液可以一起配制。
先配10ml 8M的咪唑。
再配1L的PBS,用500ml水将试剂溶解,取两个50ml和一个150ml分别加到两个100ml瓶子和一个500ml瓶子中,作为Wash Buffer、Elution Buffer和Equilibration Buffer,再向其分别加入适当体积的8M咪唑。
最后,定容。
Wash Buffer、Elution Buffer各配了100ml,Equilibration Buffer配了300ml。
PBS配了500ml。
附件2包涵体检测1.摇10ml菌,加0.5%葡萄糖和相应抗性。
培养至OD600=0.5后离心加入新的培养基和相应浓度的IPTG低温(16-25度)诱导过夜(也可不离心,在原来LB中直接加IPTG)。
在离心前取500μl菌液作为负对照,诱导完成后取500微升作为正对照。
