简并引物设计过程及原则
引物设计原则范文

引物设计原则范文
1.简洁明了:引物应尽可能简洁明了,能够清晰地传达信息。
避免使
用过于复杂或难以理解的语言,以免引起读者的困惑或误解。
2.适度引人:引物应能够引起读者的兴趣和注意力,激发他们进一步
阅读的欲望。
可以使用一些有趣的事实、引人入胜的故事或问题来吸引读
者的注意。
3.与正文相衔接:引物应与正文内容相衔接,能够为读者提供背景信
息或引出正文的主题。
引物应选择与正文内容紧密相关的内容,以便为读
者提供更好的阅读体验。
4.突出重点:引物应能够突出正文的重点和核心观点,引导读者进入
主题。
可以通过使用精确、有力的语言来强调正文的重要部分,使读者在
阅读引物后能够快速理解正文的主旨。
5.鼓舞情感:引物可以通过触动读者的情感,引起共鸣,增加读者的
参与感和亲和力。
可以使用一些感人或激动人心的言辞来引起读者的共鸣,激发他们的情感反应。
6.惊喜感:引物可以使用一些出人意料的信息或观点,带给读者一种
惊喜感。
展示新颖、不寻常或意想不到的内容,能够提高读者对引物内容
的关注度和兴趣。
实例图解简并引物设计 共25页

碱M
基B
代 码
D N
碱基 代码 A, G Y G, T S A, C W G, C, T V A, G, T H A, G, C, T
碱基 C, T G, C A, T A, G, C A, C, T
3. 质量评估
•(1)参数评估
将初步得到的引物序列,粘贴入Oligo Calc 的文本框内, 按下“Calculate”按钮,得到引物的相关参数,如:长 度、GC 含量、Tm 值等信息。
马铃薯Y 病毒(Potato virus Y,PVY)是侵染马铃薯、
烟草、辣椒等茄科作物并造成严重危害的病毒之一,广 泛分布全球各马铃薯种植区。RT-PCR 技术具有高度的特 异性和灵敏性等特点,已经成为 PVY 检测最常见的方法。 但由于PVY 株系分化严重,不断有新的重组株系产生, 单一的特异性引物无法适应PVY 不同株系的检测需求, 需要设计一对简并引物以能够满足生产上的检测需求。
八、详细图解
1. 序列准备: •(1)GenBank 下载PVY 全基因组序列; •(2)由于基因序列比较大,且数量多,推荐用MAFFT 多重序列比对; •(3)扩增片段区域选择,CP 基因长度及位置如下图所示:
• 先将光标定位在第一条序列任意位置,然后在左下角"Site"处直接输 入 CP 基 因 上 游 分 界 点 位 置 ( 8391 ) 后 回 车 。 接 着 点 击 “Speicaes/Abbrv”和8391 那一列的交界点时按下键盘上“Shift” 不放,移动光标到“1”那一列,此时点击鼠标右键“Delete”删除 冗余序列。
• PS : 是 否 位 于 密
码子的第3 位,可
以
通
过
“ Tranlated
引物设计的详细步骤

引物设计的详细步骤详细步骤如下:步骤一:了解引物设计的基本原理引物设计是指为特定的DNA序列设计一对合适的引物,以便在PCR反应中扩增目标DNA序列。
引物是PCR反应的关键组成部分,引物的选择和设计对于PCR扩增的成功率和特异性非常重要。
因此,了解引物设计的基本原理对于有效设计合适的引物至关重要。
步骤二:确定PCR反应的目标序列在设计引物之前,我们需要确定PCR反应的目标序列,即我们需要扩增的DNA区域。
这个目标序列可以是已知的基因序列,也可以是未知的区域。
确定目标序列后,我们可以继续设计引物。
步骤三:确定引物的一些基本参数在设计引物之前,我们需要确定一些基本的参数,以便帮助我们选择合适的引物。
这些参数包括引物的长度、GC含量、Tm值以及避免二聚体形成等。
引物长度:通常来说,引物的长度应在18-25个核苷酸之间。
过长的引物可能导致不特异的扩增产物的形成,而过短的引物则可能导致低扩增效率。
GC含量:引物的GC含量对于引物的稳定性和特异性有影响。
在正常情况下,引物的GC含量应在40%-60%之间。
Tm值:引物的Tm值是指引物在PCR反应中的解离温度。
Tm值过低可能导致非特异的扩增产物的形成,而Tm值过高则可能导致低扩增效率。
避免二聚体形成:在设计引物时,我们还需要考虑引物之间的互补性以及避免引物形成二聚体。
引物之间的互补性可能导致引物形成二聚体,从而降低PCR反应的效率和特异性。
步骤四:选择合适的引物设计工具目前有很多在线引物设计工具可供选择,例如NCBI Primer-BLAST、OligoAnalyzer等。
这些工具可以根据输入的目标序列帮助我们快速选择合适的引物。
此外,还可以使用一些商业引物设计软件,如Primer Premier等。
步骤五:进行引物特异性分析设计好引物后,我们需要进行引物特异性分析,确保引物只扩增目标序列而不扩增其他非特异性产物。
这可以通过BLAST或其他相似性工具来完成。
特异性分析的目的是排除可能存在的非特异性扩增产物,以确保PCR反应的准确性和特异性。
引物设计的原理与程序

引物设计的原理与程序引物设计是一项用于DNA或RNA扩增的关键技术,它在分子生物学和遗传学的研究中起着重要作用。
引物设计的原理是通过合成、设计一对互补序列的引物,在PCR(聚合酶链式反应)等技术中,使其能够高度特异地结合到目标DNA/RNA的特定区域,从而引导扩增反应的发生。
为了实现引物的高精确性和特异性,人们依据一些特定的规则和算法来设计引物,其中最常用的是吉布斯自由能最小化法和龙格-库塔法(Runge-Kutta algorithm)等。
引物设计程序可以粗略地分为以下几个步骤:1.目标序列选择:首先,根据实验需求和研究目的选择一个适当的目标序列,该序列通常来自于已知序列数据库或文献报道。
2.引物长度和Tm值的设定:确定所需的引物长度以及Tm值(熔解温度),Tm值通常在50-60℃之间。
引物长度的选择可以考虑到特定的实验条件,如扩增反应中的嵌合效应和引物的特异性。
3.引物序列设计:根据目标序列,设计一对能够互补结合到目标DNA/RNA特定片段的引物。
引物的设计一般应满足以下几个条件:a.引物长度一般为18-25个核苷酸,长度相似,所取的GC含量相似;b.引物之间的互补碱基序列长度差异不大,理想情况下应相同,差异尽量不超过2个碱基;c.引物的GC含量应在40%-60%之间,根据需要可以适量调整;d.引物不能含有重复序列、空白区域、内部多聚物等;e. 引物的3'端应尽可能避免GCgc和ATat碱基对的设计。
4. 引物的特异性分析:在引物设计过程中,需要进行特异性分析,确保引物与非目标序列无法结合。
利用生物信息学工具,如BLAST(Basic Local Alignment Search Tool)可以进行引物与已知序列数据库的比对,评估引物的特异性。
需要注意的是,引物设计的复杂性和准确性会受到许多因素的影响,如目标序列的长度、目标序列中的GC含量、所选择的引物长度和Tm值等。
因此,在引物设计过程中需要结合多个因素综合考虑,进行合理的设计。
引物设计——精选推荐

引物设计⼀、模板序列确定注意:1.找到同源基因的蛋⽩氨基酸序列,⽐对,找到⾼度同源区域,再回到cDNA序列设计引物,核苷酸序列同源性⾼,就⽤核苷酸,否则⽤氨基酸,设计简并引物。
⼀般在mRNA序列的中间偏下游即靠3'端的部分序列设计引物(习惯问题)。
⼀般认为,如果蛋⽩的序列⼀致性为25-30%,则可认为序列同源。
2.简并引物的设计最好还是使⽤CDS序列来做⽐对,然后根据保守区设计简并引物,CDS两端的⾮翻译区在物种间变化太⼤,不适合设计引物。
把获得各个物种的CDS做成fasta格式的,序列最好处理成纯序列格式的不含其它任何字符。
然后⽤⽐对软件⽐对⼀下,如mega,DNAman或者是vectorNTI ⾥的⽐对⼯具都可以做⽐对。
在⽐对结果⾥找到⾮常保守的区域就可以设计简并引物了。
设计的简并引物可以根据经验公式⾃个算Tm值。
不⽤计较打分的问题。
因为你只能在保守区设计引物。
引物的3'端最好位于最保守的区域。
⼀般是寻找该基因的ORF框即编码区域作为该引物的保守序列。
你可以⽤软件查找ORF框,找⼀个⽐较长的位置在序列中下游的区域设计引物。
⼆、引物设计的原则⾸先引物要跟模板紧密结合,其次引物与引物之间不能有稳定的⼆聚体或发夹结构存在,再次引物不能在别的⾮⽬的位点引起DNA聚合反应(即错配)。
围绕这⼏条基本原则,设计引物需要考虑诸多因素,如引物长度(primerlength)、产物长度(product length)、序列Tm值(melting temperature)、ΔG值(internal stability)、引物⼆聚体及发夹结构(duplexformation and hairpin)、错误引发位点(false priming site)、引物及产物GC含量(composition),有时还要对引物进⾏修饰,如增加限制酶切点,引进突变等。
以使⽤Oligo 软件分析设计引物为例,笔者总结出以下的要点:1.引物的长度⼀般为15-30bp,常⽤的是18-27bp,但不能⼤于38,因为过长会导致其延伸温度⼤于74℃,即Taq 酶的最适温度。
引物设计具体步骤

引物设计一、引物设计简介引物设计是以一小段单链DNA或RNA,作为DNA复制的起始点,在核酸合成反应时,作为每个多核苷酸链进行延伸的起点而起作用的多核苷酸链。
我们根据根据蛋白的基因序列及所选取的目的片段,设计引物。
二、引物设计的一般原则(一)抗原性:引物设计在完整的Domain区域或者抗原表位集中区域;(二)PCR产物长度:PCR产物长度不应过长,最佳长度为500bp左右。
;(三)长度:15-30bp,其有效长度[Ln=2(G+C)+(A+T)]一般不大于38,否则PCR 的最适延伸温度会超过Taq酶的最佳作用温度(74℃),从而降低产物的特异性;(四)GC含量:应在40%-60%之间,PCR扩增中的复性温度一般是较低Tm 值引物的Tm值减去5℃;(五)碱基分布的随机性:应避免连续出现4个以上的单一碱基。
尤其是不应在其3’端出现超过3个的连续G或C,否则会使引物在G+C富集序列区错误引发;(六)互补、错配、二级结构:引物自身不能含有自身互补序列,否则会形成发夹样二级结构。
两个引物之间不应有多于4个互补或同源碱基,不然会形成引物二聚体,尤应避免3’端的互补重叠;(七)引物的3’端很大程度上影响Taq酶的延伸效应,应尽量避免3’端发生错配。
而且尽可能地避免选用T,尤应避免连续出现2个以上的T;(八)特异性:与非特异扩增序列的同源性应小于70%,或少于连续8个的互补碱基。
三、常用软件DNAman5,Primer Preimer5,DNAStar/EditSeq、Snapgene四、信息检索常用数据库(一)uniprot(二)ncbi五、引物设计流程以蛋白Actin Beta的Met1-Phe375为例,说明引物设计具体流程:(一)根据蛋白名称或uniprot等信息,点开uniprot数据库;(二)在uniprot数据库中最左侧的菜单栏中,点击“sequence”,找到氨基酸序列;注:若此蛋白有多个isoform,一般以isoform1的序列为准设计引物(三)在“sequence databases”中找到这个蛋白对应的NM号;注:每一个isoform对应唯一一个NM号(四)点击NM号,进入NCBI数据库,找到对应的CD S序列,图中棕色部分即为此蛋白的碱基序列,根据研究需要,截取对应片段长度,如氨基酸片段为1-375,则碱基序列为1-1125;(五)打开Primer Preimer5引物设计软件,输入选取的碱基序列,点击“Primer”示anti-sense;再点击“Edit Primers”进行编辑;(七)当信息栏显示的发夹结构、二聚体、错配等信息为“None”时,初步认为此引物为最佳选择;(八)进入NCBI数据库,点击“BLAST”,选择“Primer-BLAST”,再次分析确认此引物是否为最佳引物。
分子生物学实验技术-简并引物设计

Oligo 被认
为 是 引物 设计功能最 强大的软件, 特别是它的 Tm值预测 能力。
在线引物设计的站点
Primer3 Very popular primer design tool for designing primers for PCR, hybridization. Primerfinder Easy to use, free, online primer design program MethPrimer A free online program for designing primers for methylation specific PCR (MSP) and bisulfite sequencing PCR. Primo Primo online is a friendly PCR primer design tool. It reduces PCR noise by lowering the probability of random primering. Batch mode allows designing for multiple sequences. Users can also calculate the melting temperature using the nearest neighbor model.
分子生物学实验技术
化文平
一、引物设计的原则
1.引物长度(15-30bp) 典型的引物18bp到24bp。引物需要足够长,保证序列独 特性,并降低序列存在于非目的序列位点的可能性。但是 长度大于24核苷的引物并不意味着更高的特异性。较长的 序列可能会与错误配对序列杂交,降低了特异性,而且比 短序列杂交慢,从而降低了产量。 2.引物GC含量 选择GC含量为40%到60%,可使Tm值最好接近72℃。 3.引物5‘端 设计5'端和中间区为G或C的引物。这会增加引物的稳定 性和引物同目的序列杂交的稳定性。
PCR引物设计原理及原则

PCR引物设计原理及原则PCR引物设计是指在聚合酶链反应(PCR)中使用的引物的设计过程。
PCR引物起到了在PCR扩增过程中特异性识别和引导DNA复制反应的作用。
因此,PCR引物的设计直接影响PCR反应的成功与否。
以下是PCR引物设计的原理及原则。
一、PCR引物设计的原理1.引物长度:引物的长度通常为18-25个碱基对。
引物过短可能导致非特异性引物结合,引物过长可能导致反应条件不佳。
较长引物(20-25个碱基对)通常用于扩增目标DNA较长的片段,而较短引物(18-20个碱基对)通常用于扩增较短的目标DNA片段。
2.引物序列:引物的序列应与目标DNA序列互补,以确保引物与模板DNA的特异性结合。
引物序列应尽量避免重复序列或序列中的碱基。
此外,引物序列的催化部位(3'端)应该具有高度的特异性与模板DNA序列匹配,以确保PCR反应的特异性。
3.引物的Tm值:引物的Tm值是指反应温度下引物和目标DNA序列的熔解温度。
引物的Tm值应相似,通常在56-64℃之间,以保证引物与目标DNA序列结合的特异性和稳定性。
4.引物的GC含量:引物的GC含量对PCR反应的效率和特异性有重要影响。
引物的GC含量应控制在40-60%之间,过高或过低的GC含量可能导致引物结合能力不佳。
二、PCR引物设计的原则1.引物特异性:引物应与目标DNA序列的特异区域互补,以确保特异性扩增。
在设计引物时,应避免引物与非目标序列互补或有任何交叉杂交现象。
2.引物长度:引物长度通常为18-25个碱基对,过短或过长的引物可能导致PCR反应效果不佳。
3.引物序列中避免重复序列:引物序列中避免过多的重复序列,以免引发非特异性引物结合。
4.引物催化部位特异性:引物的催化部位(3'端)应具有高度的特异性与模板DNA序列匹配,以确保PCR反应的特异性。
5.引物的Tm值匹配:引物的Tm值应相似,通常在56-64℃之间,以确保引物在反应温度下与模板DNA序列结合的稳定性。
引物设计步骤与要点

引物设计步骤与要点引物(primer)是在 DNA 或 RNA 聚合酶链式反应(PCR)或逆转录聚合酶链式反应(RT-PCR)中使用的短的 DNA 或 RNA 片段。
引物通过与目标序列的互补配对,为 PCR 或 RT-PCR 提供起始点,使得复制过程能够在目标序列上进行。
引物的设计是 PCR 或 RT-PCR 的关键步骤,影响其特异性和效率。
下面将介绍引物设计的步骤与要点。
引物设计的步骤如下:1.确定目标序列:首先要明确所需扩增的目标DNA或RNA序列。
例如,目标序列可以是特定基因的编码区域,或者是需要检测的病原体的DNA片段。
2. 引物长度:引物的长度通常在 18-30 bp 之间。
长度较长的引物可能会导致非特异性扩增,而较短的引物可能会导致不够稳定,产生非特异性扩增产物。
在设计引物时,应注意避免引物间或引物与模板间的互相互补性。
3.GC含量:引物的GC含量应在40-60%之间。
GC含量过高可能导致引物之间的二聚体形成,而GC含量过低可能导致引物的稳定性不足。
4.特异性:引物应与目标序列的特定部分互补配对,以确保特异性扩增。
在设计引物时,通常选择序列中的保守区域作为互补匹配的区域,以确保其在各物种或基因型中的适用性。
此外,可以通过使用在线工具,如NCBIBLAST,对引物进行特异性检测,以避免与非目标序列互补匹配。
5. 引物之间的互补配对:在 PCR 扩增中,引物通常成对使用,所以引物之间不应存在互补配对,以避免二聚体形成。
另外,引物对之间的距离应合适,通常在 100-300 bp 之间。
6.引物的末端设计:引物的末端设计直接影响PCR的效率和特异性。
在设计引物时,应注意避免末端的一些特定的串扰序列,如GGGG、CCCC、AAAA、TTTT等。
此外,引物的末端可以添加一些特定的序列,如引物标记和引物序列的识别序列,以便进一步的实验操作。
引物设计的要点如下:1.使用专业软件或在线工具进行辅助设计:可以使用一些专业的引物设计软件或在线工具来辅助引物的设计。
引物设计的原理和程序
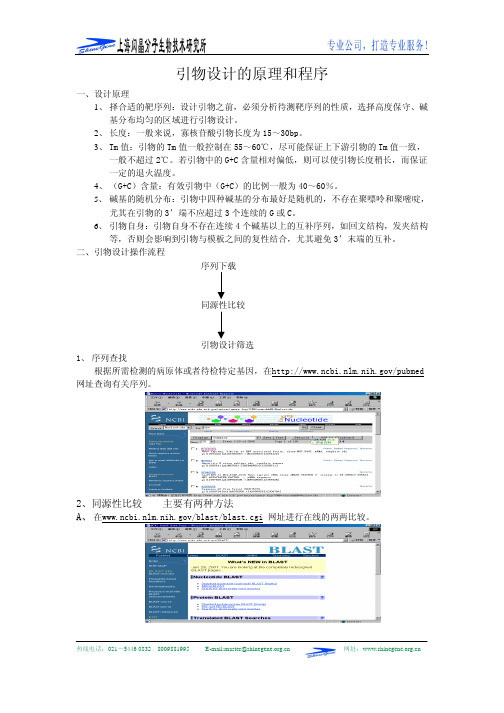
引物设计的原理和程序一、设计原理1、择合适的靶序列:设计引物之前,必须分析待测靶序列的性质,选择高度保守、碱基分布均匀的区域进行引物设计。
2、长度:一般来说,寡核苷酸引物长度为15~30bp。
3、Tm值:引物的Tm值一般控制在55~60℃,尽可能保证上下游引物的Tm值一致,一般不超过2℃。
若引物中的G+C含量相对偏低,则可以使引物长度稍长,而保证一定的退火温度。
4、(G+C)含量:有效引物中(G+C)的比例一般为40~60%。
5、碱基的随机分布:引物中四种碱基的分布最好是随机的,不存在聚嘌呤和聚嘧啶,尤其在引物的3’端不应超过3个连续的G或C。
6、引物自身:引物自身不存在连续4个碱基以上的互补序列,如回文结构,发夹结构等,否则会影响到引物与模板之间的复性结合,尤其避免3’末端的互补。
二、引物设计操作流程序列下载引物设计筛选1、 序列查找根据所需检测的病原体或者待检特定基因,在/pubmed 网址查询有关序列。
2、同源性比较 主要有两种方法A、在/blast/blast.cgi 网址进行在线的两两比较。
B、采用OMIGA, PCGENE 等软件进行两两或多序列比较。
1、打开OMIGA 软件,导入(import)下载存盘的纯文本序列文件:2、选择待比较的多条序列,右键点击“align sequences”命令;3、等待计算机处理,直至状态显示排列结束,点击“alignment”显示结果;4、“alignment”结果,相同碱基以同色标记三、引物设计与筛选 Primer Premier 5.0软件为例,进行引物设计和筛选的操作示范1、 打开软件,调入序列2、选择路径,选择序列文件名,加入右框3、序列文件显示如图,点击“primer”;4、按照引物设计的原理,设定引物的各种参数,点击“确定”进行引物搜寻5、等待引物搜寻,显示结束后,点击“确定”,进入下一页;6、按照搜寻结果显示,逐条分析,在主窗口中检查该引物对的二级结构情况,依次筛选。
【优选】简并引物的设计资料

0 支持简并引物的设计 在线设计:CODEHOP 尽量选择简并度低的氨基酸区域为引物设计区。 如甲硫氨酸和色氨酸均只有一个密码子。 0 支持简并引物的设计 充分注意物种对于密码子的偏好性,选择该物种使用频率高的密码子,以降低引物的简并性。
0对支所持找简到• 并的引序尽物列的进量设行计多选序列择比对简并度低的氨基酸区域为引物设计区。如甲硫氨 对所找到的序酸列进和行多色序列氨比对酸均只有一个密码子。尽可能不用含有亮氨酸、 精氨酸、丝氨酸的肽段。 0 支持简并引物的设计
在线设计:CODEHOP 0 支持简并引物的设计
• 充分注意物种对于密码子的偏好性,选择该物种使用频率 引物不要终止于简并碱基,对于大多数氨基酸残基来说,意味着引物3’末端不要位于密码子的第三位。
• 利用软件设计引物
Primer 5.0 支持简并引物的设计 在线设计:CODEHOP
GeneFisher2
• 对引物的修饰
降低简并度的方法:
通过密码子偏好选择合适的碱基
通过用次黄嘌呤代替简并度高的碱基
简并引物设计原则
将搜索到的同一基因的不同氨基酸序列进行多序列比对 由于大多数氨基酸的遗传密码不止一种,因此,由氨基酸序列反推DNA 序列时,就遇到部分碱基的不确定性。 GeneFisher2
设计简并引物至少需要上下游各有一个保 守区域,且两个保守区域相距50~400个氨 基酸为宜,使得PCR产物在150~1200bp之间 ,最重要的是每一个保守区域至少有6个氨 基酸。
• 利用软件设计引物
Primer 5.0 支持简并引物的设计 在线设计:CODEHOP
GeneFisher2
引物设计知识点

引物设计知识点引物设计是在分子生物学中一项核心技术,它在DNA扩增、测序和基因组研究等领域起着至关重要的作用。
本文将从引物设计的原则、流程和常见问题等方面进行论述。
一、引物设计的原则引物设计的目标是选择具有高特异性、高敏感性和高扩增效率的引物,以确保准确复制目标序列。
引物设计的原则主要包括以下几个方面:1. 特异性:引物应与目标序列特异性结合,避免与非靶序列发生扩增。
可通过生物信息学工具分析引物与非靶序列的互补性,以选择具有最佳特异性的引物。
2. 长度和GC含量:一般而言,引物长度应在18-25个碱基对之间。
较短的引物有助于提高扩增效率,但也增加了非特异性扩增的风险。
同时,引物的GC含量也需要注意,通常应在40%-60%之间,以保证稳定的引物结构和适当的熔解温度。
3. 无自相互结合和互相结合:引物之间不应有自相互结合和互相结合的可能,以防止引物产生二聚体或多聚体,干扰扩增反应。
特别要注意避免引物的3'端或中间部分存在互补碱基序列。
4. 无剪切酶切位点和多态性:引物不应包含引物或合成的DNA中可能存在剪切酶切位点,以免影响进一步的分析。
此外,引物应尽量避免包含多态性位点,以避免导致PCR产物的杂合性。
二、引物设计的流程引物设计的流程主要包括以下几个步骤:1. 目标序列选择:确定需要扩增或分析的目标序列,根据目标序列长度和特点来确定引物设计的策略。
2. 引物设计:根据引物设计的原则,利用生物信息学工具如Primer3、OligoAnalyzer等设计合适的引物。
选择引物时,还需要考虑引物之间的配对效率和双引物间的差异性。
3. 引物评估:使用比对工具分析引物与相关基因组序列的特异性,并预测引物的性能参数如熔解温度、互补性分析等。
4. 引物合成:将设计好的引物提交给合成服务提供商进行合成,确保引物质量的稳定和纯度的高。
5. 引物实验验证:通过PCR扩增实验,验证引物的特异性与扩增效率,并对扩增产物进行进一步分析。
引物设计流程

2010级动科2班杨教童2220103282101511.引物设计的原理和步骤PCR引物设计的目的是为了找到一对合适的寡核苷酸片段,其中在扩增的DNA片断5'端的引物对应于有意链DNA序列,3'端的引物对应于无意链DNA序列,使其能有效地扩增模板DNA序列。
因此,引物的优劣直接关系到PCR的特异性与成功与否。
要设计引物首先要找到DNA序列的保守区。
同时应预测将要扩增的片段单链是否形成二级结构。
如这个区域单链能形成二级结构,就要避开它。
如这一段不能形成二级结构,那就可以在这一区域设计引物。
现在可以在这一保守区域里设计一对引物。
一般引物长度为15~30碱基,扩增片段长度为100~600碱基对。
1.引物设计的原则(1)碱基组成:GC含量应在40%-60%(45%-55% )之间,4中碱基在引物中分配均匀。
没有多聚嘌呤或多聚嘧啶序列,如AAAAA等,没有二核苷酸重复序列,如GCGCGC等;(2)引物长度:引物中与模板互补的区应为18-25个核苷酸长度,上下引物长度差别不能大于3bp,如上游引物为19bp,下游引物为24bp等。
(3)重复或自身互补序列:形成发夹结构,会阻止引物和模板之间的复性。
(4)上下引物的互补性:一个引物的3'末端序列不允许结合到另一个引物的任何位点上,因为PCR中引物浓度较高,会形成引物二聚体。
当一个PCR有多对引物时,注意检查任何一个3'末端都不能和其他任何引物互补。
(5)解链温度(Tm 值):计算出来的两个引物的Tm 值相差不能大于5 ℃,扩增产物的Tm 值与引物的Tm 值相差不能大于10 ℃;引物的Tm 值一般为50-70℃。
这些特性保证了扩增产物在每一个PCR 循环可有效变性。
(6)3’末端3’末端的性质非常关键。
如果可能的话,每个引物的3’末端碱基为G或C;最好不要A,或AA等多聚A;(7)5’端序列添加限制性酶切位点:2.用Primer Premier 5.0 软件设计两对引物(1)在网页上找到要制作引物的一段序列,最好在1000左右,比如:ORIGIN1 atgaatccaa atcaaaagat aataacaatt ggttctgttt ctctcatcat tgccacaata61 tgtttcctta tgcaaattgc tatcctagta actactgtaa cattacattt caagcagcat121 gactacaact cccccgcaaa caaccaagca atgctgtgta aaccaacaat aatagaaaga181 aacacaacag agattgtgta tttgaccaac accaccatag agaaagaaat atgccccaaa241 ctagtagaat atagaaactg gtcaaagccg caatgtaaca ttacagggtt tgcacctttt 301 tccaaggaca attcaattcg gctttctgct ggtggggaca tctgggtgac aagagaacct361 tatgtgtcat gcgatcctga caagtgttat caatttgccc ttgggcaggg aacaacatta421 aacaacggac attcaaataa cactgtacat gataggaccc cttatcgaac cctattgatg481 aatgaattgg gtgttccatt tcatttagga accaggcaag tgtgcatggc atggtccagc 541 tcaagttgtc acgatggaaa agcatggctg catgtttgta taactgggga tgatagcaat 601 gcaacagcta gcttcattta caatgggagg cttgtagata gtattggttc atggtccaaa 661 aatatactca gaacccagga gtcggaatgc gtctgtatca atggaacctg tacagtagta721 atgactgatg ggagcgcttc aggaaaagct gatactaaaa tactattcgt tgaggagggg781 aagatcgttc atgttagcac attgtcagga agtgctcagc atgttgagga gtgctcctgt 841 tatccacgat ttcctggtgt cagatgtgtc tgcagagaca actggaaagg ctccaatagg901 cccatcgtag atataaatgt aaagaattat agcattgttt ccagttatgt atgctcagga961 cttgttggag acacacccag aaaaggcgac agcgtcagca gtagttattg cctagatcct1021 aacaatgaga aaggtggtca tggggtgaaa ggctgggcct ttgatgatgg aaatgacgtg1081 tggatgggaa ggacaatcaa cgagacgtta cgcttaggtt atgaaacctt caaagtcatt1141 gaaggctggt ccaaagctaa ctccaaatta cagacaaata gacaagtcat agttgaaaag1201 ggcgacaggt ccggttattc tggtattttc tccgttgaag gcaaaagctg catcaatcgg 1261 tgcttttatg tggagttgat aaggggaagg aaagaggaaa ctaaagtctg gtggacctca1321 aacagtattg ttgtgttttg tggcacctca ggtacatatg gaacaggctc atggcctgat 1381 ggagcggata tcaatctcat gcctatataa(2)将序列粘贴到制作区域(3)点击Primer后点击Search开始搜索引物,如:上述设计得如下一对引物5’CCTAAGCGTAACGTCTCGT3’TGGGAG GCTTGTAGATAGT优点:转化率为80%,产物长度比较长,为495bp.能够很到限度的利用所选序列的,在5’端没有A或者多聚A结构,引物的Tm值的差距小于5,GC含量在45%到55%之间。
简并引物设计

简并引物设计PCR(聚合酶链反应)是一种基础而重要的技术,在生物学、医学、检测等领域都有着广泛的应用。
然而,PCR技术在实际应用过程中,常常会遇到一些问题,例如引物设计不合理、多重特异性等。
简并引物设计便是为了解决这些问题而产生的技术。
本文将介绍简并引物设计的原理、方法、优缺点及应用。
一、简并引物设计的原理简并引物是一种含有多个碱基的引物,其中每个碱基的位置都可以存在多种可能性。
简并引物的设计原理是根据目标序列的多态性,将可能出现的碱基变异情况考虑在内,从而设计出能够特异性扩增目标序列的引物。
二、简并引物设计的方法简并引物设计可以通过人工设计或计算机辅助设计完成。
1. 人工设计人工设计简并引物需要根据目标序列的多态性情况,逐个考虑每个碱基的变异情况,然后选择合适的碱基组合作为简并引物的设计。
例如,对于一段序列“ATGCTAGC”,在第三个碱基位置上存在两种可能性“A”和“T”,在第七个碱基位置上存在三种可能性“A”、“C”和“G”,则可以设计出两个简并引物:ATGCTAGC和ATGCTAGN。
2. 计算机辅助设计计算机辅助设计可以通过在线工具或软件完成,例如Primer3、Primer-BLAST等。
这些工具可以根据用户输入的目标序列信息和扩增条件,自动生成合适的简并引物设计方案。
三、简并引物设计的优缺点简并引物设计相比于传统引物设计有以下优点:1. 提高特异性简并引物设计可以考虑到目标序列的多态性,从而提高扩增的特异性。
特别是对于高度变异的序列,简并引物设计可以有效地避免非特异性扩增。
2. 减少设计时间传统引物设计需要逐个考虑每个碱基的变异情况,而简并引物设计可以通过在线工具或软件自动生成设计方案,大大减少了设计时间。
3. 降低成本简并引物设计可以减少试验重复次数和材料浪费,从而降低实验成本。
简并引物设计的缺点包括:1. 扩增效率可能降低由于简并引物设计需要考虑目标序列的多态性,因此引物长度可能会增加,扩增效率可能会降低。
PCR和简并引物设计

PCR和简并引物设计PCR(聚合酶链反应)是一种广泛应用于分子生物学领域的技术,它可以通过体外复制DNA片段,从而能够快速、高效地扩增目标DNA序列。
PCR的成功扩增依赖于精确的引物设计,其中简并引物设计是其中一种常用的方法。
本文将对PCR和简并引物设计进行详细的介绍。
PCR的原理和步骤可以概括为三个主要步骤:变性、退火和延伸。
在变性步骤中,PCR反应体系中的DNA双链被加热,使其变性成单链。
接下来,在退火步骤中,引物与单链DNA互相结合,形成DNA引物-模板DNA 复合物。
最后,在延伸步骤中,通过DNA聚合酶的作用,从引物的3'端开始合成新的DNA链。
PCR反应可以通过反复进行这三个步骤来进行多轮扩增,从而快速地产生大量目标DNA片段。
引物在PCR反应中起着至关重要的作用,引物的设计需要满足以下几个要求。
首先,引物的序列应与目标DNA序列互补,并且引物之间没有序列重复。
其次,引物的长度应适当,通常为18-30个碱基对。
引物的长度过长或过短都会影响扩增效率。
最后,引物的GC含量应在40-60%之间,这样可以提高引物与模板DNA的互补性。
相对于常规引物,简并引物设计是一种更加灵活和高效的方法。
简并引物设计的基本思想是在引物的特定位置上引入简并碱基(简并位点)。
简并碱基是可以用多种碱基取代的碱基,它可以与多种目标序列互补,从而提高引物与目标序列的互补性。
简并引物的设计通常需要考虑以下几个因素。
首先,需要确定哪些位置引入简并位点。
一般来说,简并位点通常选择在引物的3'端或其周围,因为3'端是引物与模板DNA结合的起始点,而简并位点可以提高引物的互补性。
其次,需要确定哪些碱基可以在简并位点上使用。
简并碱基通常是由两个或多个非互补的碱基组成,例如,简并位点可以是R(代表A或G)、Y(代表C或T)或M(代表A或C)等。
选择简并碱基时需要考虑目标DNA序列的GC含量和序列特点,以确保引物与目标序列的互补性。
引物设计的原理和程序

引物设计的原理和程序引物设计是在分子生物学领域中非常重要的一项技术,用于在DNA或RNA序列中选择特定的区域进行放大、克隆或检测。
引物设计的目标是选择具有高度特异性和高效性的引物,以确保所需的目标序列可以准确地被扩增或检测到。
以下是引物设计的原理和程序的详细说明。
1.特异性:引物应该在目标区域具有高度特异性,即只与目标序列配对,并排除与非目标序列的配对。
这可以通过确保引物序列在目标区域的起始位置和长度与目标序列相匹配来实现。
2.合成效率:引物应该具有高合成效率,以确保引物在PCR或其他实验过程中可以被充分放大或扩增。
合成效率可以通过一些计算方法如GC 含量、引物长度和翻转重复等特征进行评估。
3.避免互补配对:引物设计时应避免两个引物之间或引物与DNA模板之间形成互补配对。
互补配对可能会导致引物之间的二聚体形成或降低引物与目标区域的结合能力。
引物设计通常分为两个主要步骤:目标序列选择和引物设计。
1.目标序列选择:选择目标序列是引物设计的第一步。
目标序列通常是想要扩增或检测的DNA或RNA片段。
这可以是已知序列的基因、intergenic区域、病毒或细菌的片段等。
目标序列的选择需要考虑研究的目的以及实验的具体要求。
2.引物设计:引物设计是根据目标序列选择适当的引物。
引物设计可以通过多种计算机程序或在线工具来实现。
a.引物长度选择:引物长度通常在18到30个碱基对之间,具体长度的选择取决于目标序列的特点和实验需求。
较长的引物可以提供更好的特异性,但可能会降低扩增效率。
b.GC含量计算:GC含量是引物设计中的一个重要参数,通常在40%到60%之间。
GC含量高的引物可以提供更好的热稳定性和特异性,但过高或过低的GC含量都可能影响引物的性能。
c.特异性评估:引物的特异性可以通过与非目标序列进行比对来评估。
在引物设计过程中,首先应排除与非目标序列存在高度相似度的区域,然后检查目标序列中引物能否与其他非目标序列配对。
PCR和简并引物设计

PCR和简并引物设计PCR(聚合酶链反应)是一种在分子生物学和遗传学研究中广泛使用的技术。
它通过扩增DNA特定区域的序列,从而产生大量的DNA复制体。
PCR的核心组成部分是引物(primers),它们是能与待扩增序列的起始点匹配的短DNA片段。
对于PCR的成功与否,引物的设计起到了关键作用。
本文将重点讨论PCR和简并引物设计的原理和方法。
PCR的步骤包括解旋(denaturing)、退火(annealing)和扩增(extension)。
在解旋阶段,样品中的DNA被加热至高温,使其双链结构解开,生成两根单链的DNA模板。
然后在退火阶段,温度被降低,使引物能够与模板上的特定序列进行互补配对,从而定位引物的位置。
最后,在扩增阶段,通过DNA聚合酶的作用,引物延伸成为新的DNA链,产生大量的特定序列。
引物的设计是PCR的关键步骤之一、它们需要满足以下几个条件:合适的长度、特异性、错配最少、避免形成二聚体或自身扩增以及合适的Tm(退火温度)。
首先,引物应该在15-30个碱基长的范围内,通常为18-25个碱基。
太短的引物可能与多个位点杂交,而太长的引物可能会降低特异性和扩增效率。
其次,引物应该是特异性的,即只与待扩增序列的特定区域互补配对。
为了确保特异性,通常需要使用序列比对软件来挑选最好的引物。
比对软件可以帮助我们检查引物是否与其他地方的基因组序列有互补性。
引物的错配最少,也就是引物与待扩增序列最好是完全互补配对。
因为即使有一个碱基错配,也可能导致错误的扩增产物的形成。
可以通过比对引物和目标序列的碱基来评估匹配的情况,以确定引物设计是否合理。
引物应该避免形成二聚体或自身扩增。
二聚体是指引物之间通过互补配对形成的二级结构。
如果引物形成二聚体,它们会被聚合酶识别为模板,导致错误的扩增产物生成。
自身扩增是指引物上的5'端和3'端通过互补配对形成环状结构。
自身扩增也会引起非特异性扩增。
为了避免这些情况的发生,引物的序列应该被合理设计。
混合简并引物

混合简并引物1. 简介混合简并引物是一种在分子生物学研究中广泛应用的技术,用于扩增特定DNA序列。
通过使用多个引物的混合,可以提高扩增反应的特异性和灵敏度,从而增加目标序列的检测准确性和成功率。
本文将介绍混合简并引物的原理、设计方法和应用领域。
2. 原理混合简并引物的设计基于引物的碱基序列和碱基对的配对规则。
在DNA扩增反应中,引物与目标DNA序列的两个互补部分结合,形成一个稳定的双链结构。
引物的碱基序列决定了扩增反应的特异性和选择性。
通过引入简并位点,即允许多个碱基在同一位点出现,可以增加引物的变异性,从而提高目标序列的扩增准确性。
混合简并引物的设计过程包括以下步骤:1.确定目标DNA序列:根据研究需要,确定待扩增的目标DNA序列。
2.引物设计:根据目标DNA序列,设计一组简并引物,其中包含多个简并位点。
简并位点可以使用IUPAC碱基代码表示,例如R表示A或G,S表示C或G。
3.引物评估:使用计算工具或软件评估引物的特异性和选择性。
确保引物与目标DNA序列的互补部分匹配,并避免与非目标序列的互补部分匹配。
4.引物合成:将设计好的引物合成,并进行质量检测。
3. 设计方法混合简并引物的设计方法可以根据目标DNA序列的长度和复杂性进行调整。
以下是常用的设计方法:1.单简并位点设计:适用于目标DNA序列较短且没有复杂结构的情况。
在引物的特定位点引入一个简并位点,例如使用Y表示C或T。
这种方法简单快捷,但对于复杂的目标序列可能不够灵活。
2.多简并位点设计:适用于目标DNA序列较长或具有复杂结构的情况。
在引物的多个位点引入简并位点,可以使用多个不同的IUPAC码。
例如,可以使用R、Y、S等表示不同的碱基组合。
这种方法可以增加引物的变异性,提高扩增反应的特异性。
3.引物长度调整:根据目标DNA序列的长度和复杂性,调整引物的长度。
较长的引物可以提高特异性,但也增加了非特异性扩增的风险。
4. 应用领域混合简并引物在分子生物学研究中有广泛的应用,包括:1.基因突变检测:通过扩增目标基因的特定区域,可以检测和鉴定基因突变。
引物设计的详细步骤

引物设计的详细步骤引物设计步骤如下:1.目标序列选择:根据研究目的选择需要扩增或检测的目标DNA序列。
这个目标序列可能是基因的特定区域、启动子区域、外显子、cDNA序列等。
选择一个合适的目标序列对于引物设计至关重要,因为它将决定引物的特异性和扩增产物的大小。
一般而言,目标序列具有良好的保守性和特异性。
2.引物长度和Tm计算:引物通常是15-30个核苷酸长度。
引物长度的选择取决于目标序列的特点以及所使用的实验条件。
合适的引物长度应该综合考虑引物的特异性和扩增效率。
引物的熔解温度(Tm)是指DNA链的两个链断裂开所需要的温度,它是引物设计中一个重要的参数。
Tm可以通过计算引物的碱基组成、盐度和引物浓度等因素来估计,通常约为55-65℃。
3. 引物特异性检查:使用生物信息学工具,如BLAST(Basic Local Alignment Search Tool)或NCBI(National Center forBiotechnology Information)数据库来检查所设计引物的特异性。
确保引物不会扩增与目标序列不匹配的区域,避免非特异性扩增和假阳性结果。
4.引物序列设计:根据目标序列和引物长度选择合适的引物序列。
引物设计的要求包括:GC含量约为40-60%、避免重复序列和目标序列内部的局部重复、避免碱基偏差和突变等。
此外,引物的碱基组成应该是均匀的,避免多个连续G或C碱基的存在。
6.引物的合成:将设计好的引物交给合成公司进行合成,通常采用化学合成方法。
引物的质量控制非常重要,合成的引物应进行质控检测,如毛细管电泳或质谱分析。
推荐文献:2. Untergasser A, et al. (2024) Primer3--new capabilities and interfaces. Nucleic Acids Res. 40(15): e115.。
引物设计是分子生物学研究中必不可少的技术之一、通过遵循上述步骤和参考推荐文献,可以设计出特异性高、效率好的引物,为后续实验的顺利进行提供支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
简并引物设计过程及原则
简并引物常用于从已知蛋白到相关核酸分子的研究及用于一组引物扩增一类分子。
简并引物设计过程
(1)利用NCBI搜索不同物种中同一目的基因的蛋白质或cDNA编码的氨基酸序列因为密码子的关系,不同的核苷酸序列可能表达的氨基酸序列是相同的,所以氨基酸序列才是真正保守的。
首先利用NCBI的Entrez检索系统,查找到一条相关序列即可。
随后利用这一序列使用BLASTP(通过蛋白查蛋白),在整个NR数据库中查找与之相似的氨基酸序列。
(2)对所有的序列进行多序列比对将搜索到的同一基因的不同氨基酸序列进行多序列比对,可选工具有Clustal W/X, 也可在线分析。
所有序列的共有部分将会显示出来。
“*”表示保守,“:”表示次保守。
(3)确定合适的保守区域设计简并引物至少需要上下游各有一个保守区域,且两个保守区域相距50~400个氨基酸残基为宜,使得PCR产物在150~1200bp之间,最重要的是每一个保守区域至少有6个氨基酸的保守区,因为每条引物至少18bp左右。
若比对结果保守性不是很强很可能找不到6个氨基酸序列的保守区,这时可以根据物种的亲缘关系,选择亲缘关系近的物种进行二次比对,若保守性仍达不到要求,则需进行三次比对,总之,究竟要选多少序列来比对,要根据前一次的结果反复调整。
最终目的就是有两个6个氨基酸且两者间距离合适的保守区域。
(4)利用软件设计引物当得到保守区域后,就可以利用专业的软件来设计引物了,其中Primer 5.0 支持简并引物的设计,将参与多序列比对的序列中的任一条导入Primer 5.0 中,将其翻译成核苷酸序列,该序列群可用一条有简并性的核苷酸链来表示(其中R=A/G,Y=C/T,M=A/C, K=G/T, S=C/G, W=A/C/T, B=C/G/T,V=A/C/G, D=A/G/T, N=A/C/G/T, 该具有简并性的核苷酸链必然包含上一步中找到的氨基酸保守区域的对应部分,在Primer 5.0 中修改参数,令其在两个距离合适的保守的nt 区域内寻找引物对,总之要保证上下游引物都落在该简并链的保守区域内,结果会有数对,分数越高越好。
(5)对引物的修饰若得到的引物为:
5-NAGSGNGCDTTANCABK-3
则简并度=4×2×4×3×4×3×2=2304,很明显该条引物的简并度很高不利于PCR,可以通过次黄嘌呤代替N(因为次黄嘌呤可以很好的和4种
碱基配对)和根据物种密码子偏好这两种方法来降低简并度。
这样设计出来的简并引物对,适用于比对的氨基酸序列所属物种及与这些物种分类地位相同的其他物种。
简并引物设计原则
从蛋白到核酸,请注意:
1) 尽量选择简并度低的氨基酸区域为引物设计区,如蛋氨酸和色氨酸仅有一个密码子。
2) 充分注意物种对密码子的偏好性,选择该物种使用频率高的密码子,以降低引物的简并性。
3) 引物不要终止于简并碱基,对大多数氨基酸残基来说,意味着引物的3末端不要位于密码子的第三位。
4) 在简并度低的位置,可用次黄嘌呤(dI)代替简并碱基。
以上几点遵循的总的原则为:尽量降低引物的简并度,尤其在3末端或近3末端。
