电子云图
电子云与原子轨道(共9张PPT)
分布情况,自旋方向。
第9页,共9页。
一起的情形.
第3页,共9页。
d
能 级 的 原 子 轨 道
d能级的原子轨道有5个.
第4页,共9页。
二、研究原子结构
1s22s22p63s23p63d64s2
1且、自每旋个方C原向子_轨__道__上__不最。同多能N 容—纳泡___利_2个原电理O 子, 2电d结1当 11电当2P上电21P1从当以Ps当电从结ssss、 能 、 、 、能能能子构电子电的子元电下电子元构2222pS举级举当2222级级级排 示 子排 子 电 排 素 子 是 子 排 素 示ssssd、例的例电的的的2222布意排 布排子布周排表排布周意P2222f说原说子能原原3pppp、式图布 图布数图期布示布式期图个6666明子明排级子子3333d::在 (在。(表在铁在:表:原ssss能洪轨洪在分轨轨2222能能同 轨同轨中同原同能中能子级3333特道特同别道道直直一 道一道查一子一直查直pppp轨分规有规一有6666是是观观能 表能表出能的能观出观3333道别则则能51纺纺dddd地地级 示级示铜级级地铜地3个、P6666有: : 级种锤 锤4444反反的式的式的的的反的反.3xssss多时不,形形、2222P映映不 )不)外不不映外映少有同y的的5核核同 同围同同核围核,、P个什化,,每每Z外内轨 轨电轨轨外电内7轨么学合个个个电的道 道子道道电子的道规用在轨PP子质时 时排时时子排质,律语一能能道的子, ,布,,的布子每?。起级级,能数总 总,总总能,数个的有有每层和是 是它是是层它和轨情33个、核首是、是核___个个道___形轨能外先否能否外___原原上.___道级的单符级符的子子___最___最和电独合和合电轨轨___多多___各子占构各构子道道___能能__能层一造能造层_,,容它它___容级数个原级原数___纳们们___纳轨理理___几相相___的道。。___个互互电___(___电垂垂子___即子直直, ,,数分?,,而 而而分分为占其且 且且别别2不个自自 自自以以同,旋旋 旋旋PP的且方方 方方xx轨,,自PP向向 向向道yy旋怎,,___PP)___方样ZZ___,表表___向?___而示示___相。 。。且..反自。旋方向相同。
电子云图像

電子雲
♦ 由于原子内电子的运动以电子在空间出现的机 率表示,图形上以点状的密疏表示电子在核外 空间中出现机率的高低,此点状图称为电子云 图,如下图1s电子云图:
1s电子云图
2
原子軌域的大小
♦ 理论上,原子内的电子活动空间可以延伸至无 限远,因此无法定义原子轨域的大小。实际上 ,较广为接受的原子轨域大小的定义是由原子 核往外延伸至电子总出现机率为90%的空间范 围。
♦ 原子轨域主壳层n值愈大,能量愈高,其电子 在核外空间的主要活动范围离原子核愈远。
10
原子轨域的副壳层
♦ n主壳层又分为n个副壳层,副壳层依序以s、 p、d、f、…等符号表示。
♦ n = 1的主壳层,只有一种副壳层,以1s表示 ,又称为1s原子轨域,简称1s轨域。
♦ n = 2的主壳层则有二种副壳层,以2s及2p表 示,又称为2s及2p轨域。
♦ 包立不相容原則比較簡單的定義為,每一個原 子軌域最多只能容納兩個自轉方向相反的電子 。
♦ 填入兩個電子的軌域,淨電子自轉磁量為0,此 為自然法則。
28
一個軌域能填入三個電子?
♦ 當然不行,因為違反自然法則,理由如下: 1. 電子自轉只有順時針及反時針方向兩種,沒 有其他可能的自轉方式。 2. 電子自轉方向相反才能配對於同一軌域,配 對電子淨磁量為0。 [此現象可以兩塊長條磁鐵為例說明,兩塊長 條磁鐵需相反極才能互相吸引配對。]
♦ 有些教材定义电子总出现机率95%的空间范围 为原子轨域大小,而电子总出现机率95%的空 间范围则大于90%的空间范围。
3
氫原子1s軌域
♦ 氢原子的所有轨域均可以数学函数表示,这些 数学函数称为氢原子轨域波函数。
氢原子1s轨域波函数 Ψ1s
结构化学2-3

表达出来,选用一个合适的等值曲面。 它可定性反映波函数在三维空间的大小、 正负、分布和节面情况。 原子轨道轮廓图是原子轨道空间分布图简化的实用图形。
原子轨道轮廓图
+
-
+
-
+
-
+
+-
+
3d轨道
原子轨道轮廓图
+
+
-
-
+-
+
+
-
-
+
+
+ -
-
+
+
-
★ 原子轨道等值线图
分也是归一的,所以径向分布函数可写为:D(r) r 2 R(r) 2
Dnl(r)的来历
波函数归一化
nlm (r, ,) 2 d R2 (r)r2dr 2( )sind () 2d 1
r0
0
0
半径为 r,厚度为 dr 的球壳中的概率 2 d 2 r2 sin d ddr 0 0
3d yz (1/36 2 ) Z / a0 3/ 2 2e / 2sin2sin
3
2
2
3dx2y2 (1/ 36 2 ) Z / a0 3/ 2 2e / 2sin2cos 2
3dxy (1/36 2 ) Z / a0 3/ 2 2e / 2sin2 sin2
2.3 波函数和电子 云的图形
nlm (r, , ) Rnl (r)Ylm( , )
径向函数 球谐函数
波函数(Ψ,原子轨道)和电子云( |Ψ|2在空间的分布) 是三维空间坐标的函数,将它们用图形表示出来,使抽象 的数学表达式成为具体的图象,对于了解原子的结构和性 质,了解原子化合为分子的过程都具有重要的意义。
人教课标版 电子云及电子排布式归纳PPT

3. 原子轨道的特点
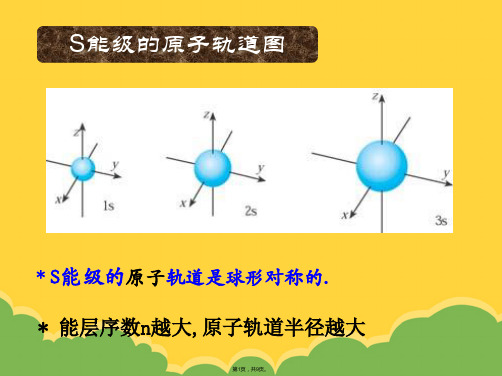
s能级的原子轨道图
s能级的原子轨道是球形对称的(原子核位于球 心),能层序数n越大(电子能量越大, 1s<2s<3s......),原子轨道半径越大。
P能级的原子轨道
z
z
y
y
y
x
x
x
P能级的原子轨道是纺锤形的,每个p能级有3个原
子轨道,它们相互垂直,分别以px、py、pZ表示。p电 子原子轨道的平均半径随n增大而增大。在同一能
11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗14、许多年轻人在学习音乐时学会了爱。——莱杰
15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东
如: 24Cr:1s22s22p63s23p63d54s1 29Cu:1s22s22p63s23p63d104s1
洪特规则:半充满、全充满更稳定
学生阅读见课本P7-8
1、什么是能量最低原理? 2、什么是基态原子、激发态原子?
它们如何转化? 3、什么是光谱?光谱分析?
归纳总结
四、能量最低原理、基态与激发态、光谱
——洪特规则
题型二、核外电子排布:电子排布式、轨道表示式
结构示意图
电子排布 电子排布图(轨道
式
表示式)
铁
原 子
1s22s22p63s23 p63d64s2
请你通过比较、归纳,分别说出3种不同化学用语所 能反映的粒子结构信息。
电子云与原子轨道++课件-2024学年高二下学期化学人教版(2019)选择性必修2

环节二:认识电子云 (3)d电子云轮廓形状
环节二:认识电子云 (4)f 电子云轮廓形状
环节三:再识原子轨道
4、原子轨道: 量子力学把电子在原子核外的一种空间运动状态称为一个原子轨道。 常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。
s能级的原子轨道有1个
p能级的原子轨道有3个
环节三:再识原子轨道
(2)形状相同的原子轨道能量的高低:
1s<2s<3s<4s<5s…… (3)同一能层内形状相同而伸展方向不同的原子轨道 的能量相等,如npx、npy和npz轨道的能量相等。
课堂评价
题组1 认识理解电子云
1.下列说法正确的是( C )
A. 电子云呈球形,表示电子绕原子核做圆周运动 B. 电子云图中的小黑点密度大,说明该原子核外空间电子数目多 C.ns 能级的电子云轮廓图可表示为 D.3d3表示能级有3个轨道
注意:
的概率密度分布图
1.小黑点越密,表示概率密度越大
2.小点不代表电子,也不代表电子实际出现的次数。
环节二:认识电子云 3.电子云轮廓图:
电子云图难绘制
电子云轮廓图
z
将出现概率 P= 90% 的空间圈出来
x
y
氢原子的1s电子云轮廓绘制过程
绘制电子云轮廓图的目的:表示电子云轮廓的形状,对核外电子 的空间运动状态有一个形象化的简便描述。
环节二:认识电子云 (2)p电子云轮廓形状 ——哑铃形
注意:
px、py、pz的电子云轮廓图
①p电子云轮廓图是哑铃形的,每个p能级有3个相互垂直的电子云,分别以px、py、pz
表示,右下角标x、y、z分别是P电子云在直角坐标系的取向。
②在同一能层中px、py、pz的能量相同。同一能级中的轨道能量相等,称为简并轨道 ③ p电子轮廓图的平均半径随能层的增大而增大。
第六节 波函数的电子云图形

z
+
θ
r
-
z
(1) S轨道 S轨道 (2) P轨道 P轨道
+
x
Pz
Px
Py
d 3 z2r 2 ~ 3 cos2 θ − 1
3 cos
2
θ −1
d zx ~ sin θ cos θ cos ϕ
ϕ = 0, π
sin θ cos θ
氢原子d 氢原子d-轨道( l = 2 )角度分布
d yz ~ sin θ cos θ sin ϕ
作法:以原子核所处的位置为坐标原点,在每一个方向( 、 ) 作法:以原子核所处的位置为坐标原点,在每一个方向(θ、φ) 引一条直线,直线的长度等于Ylm (θ、 φ )绝对值的大小,所有 绝对值的大小, 引一条直线,直线的长度等于 、 这些直线的端点在空间构成一个曲面即为角度分布图, 这些直线的端点在空间构成一个曲面即为角度分布图,再适当地 标出正负号。 标出正负号。
作图 3 按Ypz = cosθ,Y是θ的函数与ϕ无关,可计算出不同θ值的Y值。 4π
θ Y θ Y
0 1.000 120 -0.500
15 0.9660 135 -0.7070
30
45
60 0.500 180
90 0
0.8660 0.7070 150 165
-0.8660 -0.9660 -1.000
0.6 0.3 0 0.24 0.16 0.08 0 0.24 0.16 0.08 0 0.16 0.08 0 0.12 0.08 0.04 0 0.12 0.08 0.04 0 0
1s
2s
2p
3s
3p
3d
5 10 15 20 24ຫໍສະໝຸດ r/a0三、角度分布图
波函数和电子云的图形表示结构化学课件

§1-6 波函数和电子云的图形表示
③ 图:1-7.6(a)
④径向节面数:n l 1
§1-6 波函数和电子云的图形表示
2.
径向密度函数图
R2 n,l
r
~
r
(1) 物理意义:在距核r处电子出现的径向几率密度。
(2) 图:1-7.6(b)
(3) 特点:n s 态的电子在核附近有相当大的几率密度,其
余各态的电子在核附近的几率密度为零。
3.径向分布函数 D r ~ r
前面R2(r)描述的是几率密度随r的分布情况,要真正了解 电子的分布情况,要关心电子分布的几率---电子在半径为r处 ,厚度为dr的球壳内电子出现的几率。
2n,l,m(r,,) 电子在(r, , )处出现的几率密度
dr2sindrdd 三维空间中的微体积元
2n,l,m(r,,)d 电子在微体积元d中出现的几率
角度分布图Yl,m ,与 n 无关,所以只要l , m 相同,图形形
状就相似。如:2px,3px,4px ,但 npx,npy,npz 图形方
重要意义。但是 , 2 是关于 r , , 的函数,作图需要四 维空间,比较困难。因此,我们把 分离为径向部分和角
度部分。
§1-6 波函数和电子云的图形表示
原子轨道和电子云有多种图形,为了搞清这些图形是怎么画 出来的,相互之间是什么关系,应当区分两个问题: 1. 作图对象
2. 作图方法 作图对象主要包括: (1) 复函数还是实函数? (2) 波函数(即轨道)还是电子云? (3) 完全图形还是部分图形?
例:p z 定函数: Y 1,0 1,0 02 6cos2 1 4 3 cos
p z 的 Yl,m , 是 cos 的函数(和 无关),故其轨道是关
2-2-2 原子轨道和电子云的图形

4. 等值线、轨道界面
电子云的等值线图形
例1. 讨论氦离子He+2s态波函数的节面位置和 形状.
1
2s
1 4
Z3
2a03
2 2
Zr a0
e
Zr a0
2s
A 2
Zr a0
e
Zr a0
要使2s=0
应有:
2 2rБайду номын сангаас 0 a0
氢原子3pz电子云界面图
原子轨道界面与电子云界面是同一界面, 原子轨道界 面值的绝对值等于电子云界面值的平方根, 原子轨道界面 图的不同部分可能有正负之分, 由波函数决定.
轨道节面分为两种: 角度节面(平面或锥面)有l个;
径向节面(球面)有n-l -1个. 共有n-1个节面.
通常所说的原子轨道图形,应当是轨道界面图.
规律:
① 在r=0处(核处) s型函数在核处有最大值 p型函数在核处为0
② 节面 (n-l-1)个 ns 有n-1个节面 np 有n-2个节面 Rn, l,有n-l-1个节面
③ 最大值分布 ns n,最大值离核越近 np n,最大值离核越近
R(r)与R2(r)的最大值离核越近 意味着电子主要出现在核附近
这说明r=a0处在单位球壳厚度内找到电子的几率 比任何其它地方单位球壳内电子出现的几率要大
② 极大值个数:
0.6
0.3
1s
0
径向分布函数有n-l个极大值,00..2146
有n-l-1个节面
0.08 0
2s
0.24
③ 主峰-最大值出现的位置
0.16 0.08
2p
ns n,主峰离核越远
0 0.16
ns n,主峰离核越远
高中化学选择性必修二 第1章第1节 构造原理与电子排布式 电子云与原子轨道课件下学期(共31张)

3
5
7
电子云与原子轨道
原子轨道 不同能层的能级、原子轨道及电子云轮廓图
能层 能级
K
1s
2s L
2p
3s
M 3p
3d
原子轨道数
1 1 3 1 3 5
电子云轮廓图的性质与取向
原子轨道名称
形状
取向
1s
球形
2s
ቤተ መጻሕፍቲ ባይዱ
球形
2px、2py、2pz 3s
哑铃形 球形
相互垂直
3px、3py、3pz ……
哑铃形 ……
相互垂直 ……
源于光谱学事实
构造原理与电子排布式
电子排布式 书写原则
➢ 按照构造原理将电子依次填充到能量逐渐升高的能级中
➢ 一般情况下,能层低的能级要写在左边,而不是按照构造原理顺序写
26Fe
1s22s22p63s23p63d64s2,
➢ 基态铬、铜的核外电子排布不符合构造原理 Cr基态原子的电子排布式: 1s22s22p63s23p63d54s1 Cu基态原子的电子排布式 1s22s22p63s23p63d104s1
思考与讨论
2、电子排布式可以简化,如Na的电子排布式可简化为[Ne]3s1, (1) 上述方括号的意义是什么? (2) 仿照Na的简化电子排布式,写出O、Si、Cu的简化电子排布式 方括号:内层电子达到稀有气体元素原子结构的部分以相应稀有气 体的元素符号外加方括号的形式表示
O [He] 2s22p4 Si [Ne]3s23p2 Cu [Ar] 3d10 4s1
构造原理与电子排布式
电子排布式
书写原则
➢ 按照构造原理将电子依次填充到能量逐渐升高的能级中 各能级的能量高低顺序
1.3.1 电子云图——课件

核外电子运动状态的图形描述—电子云图电子云图具有波粒二象性的电子并不象宏观物体那样,沿着固定的轨道运动。
我们不可能同时准确地测定核外某电子在某一瞬间所处的位置和运动速度,但是我们能用统计的方法去讨论该电子在核外空间某一区域内出现机会的多少。
概率是指电子在空间某一区域中出现次数的多少。
电子衍射实验中,衍射环纹的亮环处电子出现的机会多,即概率大,而暗环处电子出现的机会较少,即概率较小。
概率密度是指电子在单位体积内出现的概率。
概率与概率密度之间的关系为概率(W)= 概率密度 体积(V )当然这只有在概率密度相等的前提下才成立的。
波函数ψ(r,θ,ϕ)没有明确的物理意义,但∣ψ(r,θ,ϕ)∣2 的物理意义却十分明确。
它表示空间一点P(r,θ,ϕ)处单位体积内电子出现的概率。
所以W=|ψ|2⨯V假想对核外1s电子每个瞬间的运动状态,进行摄影。
将这样千百万张照片重叠,则得到如图所示的统计效果,形象地称之为电子云图。
r |ψ|2图中黑点密集的地方,概率密度大;黑点稀疏的地方,概率密度小。
左图的坐标表示|ψ|2的值随r (与核的距离)变化情况,其趋势与电子云图中黑点的疏密一致。
所以说电子云图是概率密度|ψ|2的形象化说明,也可以说电子云图是|ψ|2的图象。
处于不同运动状态的电子,它们的波函数ψ各不相同,其|ψ|2也当然各不相同,电子云图当然也不一样。
下图给出了各种状态的电子云的分布形状。
s电子云是球形的p电子云有3种,分别沿着某一坐标轴的方向上呈无柄的哑铃形状d电子云有5种,其空间分布情况如下将核外空间中电子出现概率密度相等的点用曲面连结起来,这样的曲面叫做等概率密度面。
1s 电子的等概率密度面是一系的同心球面,球面上标的数值是概率密度的相对大小。
画出一个等密度面,使电子在该球面以内出现的概率占了绝大部分,例如占95%,就得到界面图。
1s 电子的界面图当然是一球面。
谢谢。
电子云图像

♦ 填入兩個電子的軌域,淨電子自轉磁量為0,此 為自然法則。
28
一個軌域能填入三個電子?
♦ 當然不行,因為違反自然法則,理由如下: 1. 電子自轉只有順時針及反時針方向兩種,沒 有其他可能的自轉方式。 2. 電子自轉方向相反才能配對於同一軌域,配 對電子淨磁量為0。 [此現象可以兩塊長條磁鐵為例說明,兩塊長 條磁鐵需相反極才能互相吸引配對。]
电子出现最大机率半径 n = 1: 1 ao (1s) n = 2: 4 ao (2p) n = 3: 9 ao (3d) n = 4: 16 ao (4f)
氢原子的电子能量能阶化
19
氢原子轨域距离函数图
20
氫原子軌域距離機率圖
21
原子軌域殼層及軌域數目
主殼層n 1 2
3
4
…
副殼層 s s p s p d s p d f …
♦ 原子最低能量的電子組態,稱為基態電子組 態。
♦ 原子之基態電子組態需遵循遞建原則(aufbau principle) 、包立不相容原則(Pauli exclusion principle) 、及洪德定則(Hund’s rule)。
26
遞建原則(aufbau principle)
♦ 在不考慮原子核內中子數目,元素原子的建構 方式為依序在原子核內加入一個質子,同時在 核外加入一個電子形成,稱為遞建原則(aufbau principle) 。
Cr: [Ar]4s13d5 (而不是[Ar]4s23d4) Cu: [Ar]4s13d10 (而不是[Ar]4s23d9)
原因: ♦ 4s與3d軌域能量差很小,4s軌域能量僅略低 於3d軌域。 ♦ 當過渡金屬原子的3d及4s軌域電子均達到半 滿或全滿時,能量較低。
原子轨道和电子云图形

f轨道有七个能级,包括fx^3、fy^3、 fz^3、fxz、fyz、fxyz和fx^2y^2z^2。
02
电子云的图形
电子云的定义
01 电子云概念
电子云是描述电子在原子核外空间分布情况的图形,反 映电子运动的概率分布。
电子云形状 02
电子云图形呈现为弥散的云雾状,形状与s、p、d等轨 பைடு நூலகம்类型相关。
电子云意义 03
电子云图形有助于理解电子在原子中的运动和分布规律, 对研究化学反应和物质性质具有重要意义。
电子云的形状
s轨道电子云
s轨道电子云呈球形对称分布, 电子云密度均匀。
p轨道电子云
p轨道电子云呈哑铃形,电子 云密度在轨道两端较高。
d轨道电子云
d轨道电子云形状较复杂,包 括花瓣形、哑铃交叉形等,电
02
原子轨道图形
原子轨道图形是描述电子 云空间分布的图像,反映 电子在核外空间出现概率 的大小。
03
原子轨道类型
原子轨道分为s轨道、p轨 道、d轨道和f轨道等类型, 每种轨道具有不同的形状 和能量。
原子轨道的形状
s轨道
s轨道的形状是球形,电子在s轨道中运动时,其出现概率 呈球形对称。
p轨道
p轨道的形状是双哑铃形,电子在p轨道中运动时,其出现 概率呈双哑铃形对称。
理解反应机理
原子轨道和电子云图形有助于 理解化学反应的机理和过程。
预测反应结果
通过原子轨道和电子云的分析, 可以预测化学反应的可能结果。
设计新反应
基于原子轨道和电子云的知识, 可以设计新的化学反应,开发
新材料和药物。
对推动科学发展的意义
促进理论发展
01
原子轨道和电子云理论的发展,推动了量子力学理论的深入和完善。
§1-6波函数和电子云的图形表示-结构化学课件

(2) 图: 1-7.6(b) (3) 特点: n s 态的电子在核附近有相当大的几率密度,其 余各态的电子在核附近的几率密度为零。 3.径向分布函数 D r ~ r 前面R2(r)描述的是几率密度随r的分布情况,要真正了解 电子的分布情况,要关心电子分布的几率---电子在半径为r处 ,厚度为dr的球壳内电子出现的几率。
l 1 时, Yl ,m ,
Yl ,m , 的图形在空间有五个伸展方向。 l 2 时,
§1-6
波函数和电子云的图形表示
Y ,
2
2.电子云角度分布图
(1)由于Yl ,m , 总小于1,电子云的角度分布图形与原子 轨道的角度分布图形类似,只是变得“狭窄”一些。
2
:电子在空间某点的几率密度
2
电子云:电子在空间的几率密度分布
将 及
用图形表示出来,使抽象的数学表达形象直观,
2
对了解原子的结构和性质以及原子结合成分子的过程具有 重要意义。但是 , 度部分。 是关于 r , , 的函数,作图需要四 维空间,比较困难。因此,我们把 分离为径向部分和角
R n s n , 0 , 0 n , l 0 , 0 0 ① S轨道的角度分布图 与角度无关,任一方向的剖面图均为一个圆。
§1-6
波函数和电子云的图形表示
② P轨道角度分布图 作图方法: 根据Y函数的实函数形式,选定 或 为 0 、 4 、 2 等一些特殊角度作为剖面,然后在这些剖面上作Y随 或 变化的图。 步骤:定函数,定投影平面,定节面,定极值,列数据表, 然后在某投影平面上作波函数的角度分布图。 例:p z
图1-7.1(b)
§1-6
波函数的电子云图形

波函数将确定性和概率结合在一起,描述了微观粒子的性 质。通过波函数,我们可以了解电子等微观粒子的某些确 定性质,同时也可以计算它们出现的概率。
测量与观察
测量过程对波函数的影响
当对微观粒子进行测量时,其波函数 会瞬间坍缩,表现出粒子性。这意味 着观测结果具有不确定性,取决于观 测的方式和时间。
分子结构
分子构型确定
电子云图形可以提供分子构型的直观表示,帮助确定分子的 几何结构和空间排列,对于理解分子性质和行为至关重要。
分子模拟与计算化学
电子云图形在分子模拟和计算化学中发挥着重要作用,通过 模拟分子的电子结构和相互作用,可以预测分子的性质和行 为,为实验研究和应用提供指导。
05 电子云图形的未来发展
波函数的电子云图形
contents
目录
• 引言 • 波函数的性质 • 电子云图形的形成原理 • 电子云图形的应用 • 电子云图形的未来发展
01 引言
波函数的概念
波函数是一种数学函数,用于描述微 观粒子(如电子)在空间中的概率分 布。它提供了粒子在特定时刻的位置 、动量和自旋等状态的信息。
波函数通常用复数形式表示,其模的 平方表示粒子在该位置出现的概率。
交叉学科研究
结合其他学科领域的知识和技术, 如化学、生物学等,开展交叉学 科研究,为新,如发展新型电子 显微镜、高能粒子加速器等设备, 提高对电子云图形的观测精度和
范围。
THANKS FOR WATCHING
感谢您的观看
粒子性
描述电子的粒子行为
波函数不仅可以描述电子在空间中的分布概率,还可以描 述电子的粒子行为。当电子被观测到时,它的波函数会瞬 间坍缩,表现出粒子性。
揭示微观粒子的离散性
电子云图教案

电子云图教案教案标题:电子云图教案教案目标:1. 了解电子云图的概念和作用;2. 掌握绘制电子云图的方法;3. 理解电子云图与原子结构的关系;4. 培养学生观察和分析实验数据的能力。
教学重点:1. 电子云图的概念和作用;2. 绘制电子云图的方法。
教学难点:1. 理解电子云图与原子结构的关系;2. 培养学生观察和分析实验数据的能力。
教学准备:1. PowerPoint演示文稿;2. 实验器材:模型原子、电子云图绘制工具、实验记录表;3. 学生实验报告模板。
教学过程:Step 1: 导入1. 利用一张图片或实物模型向学生展示一个原子的结构,并提问学生对原子结构的认识。
2. 引导学生思考:原子的组成部分有哪些?电子在原子中的分布情况如何?Step 2: 理论讲解1. 使用PowerPoint演示文稿向学生介绍电子云图的概念和作用,解释电子云图是描述电子在原子中分布的模型。
2. 解释电子云图的绘制方法,包括确定主量子数、角量子数和磁量子数,以及根据这些量子数确定电子的位置和能级。
Step 3: 实验操作1. 将实验器材分发给学生,让他们根据所学的方法,绘制一个简单的电子云图。
2. 学生按照实验记录表的要求,观察并记录绘制过程中的观察结果和实验数据。
Step 4: 实验数据分析1. 学生根据实验数据,分析电子云图中不同颜色区域的含义和代表的电子分布情况。
2. 引导学生思考:电子云图中哪些区域代表电子密度大?哪些区域代表电子密度小?Step 5: 讨论与总结1. 学生就实验数据分析的结果展开讨论,让他们归纳出电子云图与原子结构的关系。
2. 教师进行总结,强调电子云图是描述电子在原子中分布的模型,电子云图中密度大的区域代表电子分布概率高。
Step 6: 练习与应用1. 学生根据所学的方法,绘制其他原子的电子云图。
2. 学生根据电子云图,预测原子的化学性质和反应能力。
教学延伸:1. 学生可以通过模拟软件或在线实验平台进一步探索电子云图的应用和原子结构的相关知识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验:用MATLAB 绘制电子云图
一.实验要求
使用MATLAB 绘制氢原子430ψ态的电子云图,用灰度图表示。
二.实验目的
(1)将氢原子核外电子分布形象化,加深对电子云概念的理解。
(2)锻炼自己发现问题、解决问题的能力。
(3)熟悉MATLAB 的绘图。
三.实验过程
(1)计算分布几率
考虑到系数对分布规律没有影响,因此,对于径向波函数,直接考虑其正比关系即可。
043023
043a Zr
e a Zr a Z R -⎪⎪⎭⎫ ⎝⎛⎪⎪⎭
⎫ ⎝⎛∝ 另外,查表得到球谐函数。
3222330)332(741)cos 3cos 5(741),(r
y x z z Y --=-=πθθπϕθ 由此得到
23430230430
)cos 3cos 5(10⎪⎪⎪⎭⎫ ⎝⎛-⎪⎪⎭⎫ ⎝⎛⎪⎪⎭⎫ ⎝⎛∝-θθa r e a r a P 即
2222224302
22)332(z y x e y x z z P ++---∝
(2)实验代码
clear;
num= 500;Time = 50;
level = 255;set = 3000;
x = linspace(-30,30,Time);
y = linspace(-35,35,num);
z = linspace(-35,35,num);
Filename = ['D:\430.gif'];
for t = 1:Time
for m = 1:num
for n = 1:num
g430(m,n) =
z(m)^2*(2*z(m)^2-3*x(t)^2-3*y(n)^2)^2*exp(-1/2*sqrt((x(t)^2+y(n)^2+z( m)^2)));
end
end
g430a = level*ones(length(z),length(y))-g430/set*level;
image(y,z,g430a);colormap(gray(level));
f = getframe(gcf);
imind = frame2im(f);
[imind,cm] = rgb2ind(imind,256);
if t == 1
imwrite(imind,cm,Filename,'gif','Loopcount',inf,'DelayTime',0.1);
else
imwrite(imind,cm,Filename,'gif','WriteMode','append','DelayTim e',0.1);
end
if mod(t,5) == 0
imwrite(imind,cm,strcat('D:\',num2str(t/5),'.jpg'));
end
end
(3)实验结果
从X=-30至X=30,间隔为5进行取样,得到如下图片,动态图附邮件附件中。
