广东省中考化学总复习 专题三 工艺流程练习
2022年中考化学:工艺流程专项训练(3)(Word版含答案)

工艺流程图专项训练(三)1、铝和铝合金是一类重要的金属材料、工业上用铝土矿(含有Al2O3 和SiO2,不考虑其它杂质)制取金属铝的基本流程如下:已知:①SiO2 是一种难溶于水,也不与盐酸、硫酸反应的物质.②铝盐与氨水反应,生成氢氧化铝沉淀和铵盐.请回答下列问题:(1)滤液I 的溶质有(写化学式)。
(2)该流程中涉及到的基本化学反应类型有和分解反应。
(3)写出滤液II 中溶质的一种用途。
2、硫酸钙转化为K2SO4和CaCl2·6H 2O 的工艺流程如图:(1)蒸氨过程中涉及的反应类型(填编号)。
A.复分解反应B.化合反应C.分解反应D.置换反应(2)操作Ⅲ制取CaCl2·6H 2O 晶体,包含一系列操作:蒸发浓缩、、过滤、洗涤、干燥。
(3)可循环利用的物质除了NH3 外,还有(填化学式)。
3、下图为某化工厂用废硫酸制备K2SO4 的流程如下:(1)生产上将CaCO3 研成粉末的目的是。
(2)上述流程中,可循环使用的物质是。
(填写化学式)(3)洗涤反应③所得晶体不用水而用饱和K2SO4 溶液的目的是。
4、海水是一种取之不尽、用之不竭的资源宝库.请围绕科学利用海水资源,填写空格:用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。
将此粗盐提纯的部分实验方案如下:(1)加入过量氢氧化钠溶液的目的是。
(2)过滤后得到的沉淀成分有:氢氧化镁、碳酸钙、。
(3)请设计实验,能通过清晰可见的现象,准确控制在少量滤液样品中加入稀盐酸,至恰好完全反应:。
5、高纯碳酸钙广泛应用医药、生活生产中。
如图是由工业副产品氯化钙(含有氯化亚铁和氯化镁)制取高纯碳酸钙的工艺流程图。
有关资料:①氯化铵受热会分解;②在室温下,氯化铵的溶解度随氯化钙的质量分数的变化关系如图如示;回答下列问题:(1)工艺流程中操作1 的名称是;(2)向工业氯化钙溶液中加入氧化钙,氧化钙与水发生反应的基本反应类型是,所需氧化钙为粉末状,其目的是。
中考化学复习课件:_专题三_工业流程图题

污染环境(合理均可 ) 和防止__________ 。
题型 4
化工实验(废液)
[解题指引]这类实验题主要包括污水处理工业、金属回收工 业、新产品的制取等,综合性很强,常常通过物质的制备,混合 物的分离、提纯,物质的回收利用,流程设计是否合理等方面设 计试题。这类综合实验题,通过认真分析,可以化解为几个相对 独立又相互联系的小实验、小操作来进行解答。由各个小实验确
题型 2
石灰石工业
3.(2011 年广东肇庆)氯化钙是多用途的干燥剂和建筑防冻
剂。实验室里用石灰石和盐酸制备二氧化碳的含酸废液(含有
MgCl2、FeCl3 等)通过以下途径制得无水氯化钙。
过滤 (1)操作Ⅰ的名称为____ ,操作Ⅱ的名称为 ________________ 冷却结晶 (或结晶) 。
2 2 高温、高压 3
(5)将沸点不同的气体分离开来,常采用液化分离法。如控
制温度在-183 ℃时,可将空气中 N2 与 O2 分离。根据下表中物
质的沸点判断,要将产物 NH3 与 N2、H2 分离开来,最适宜的温 - 33.35 ℃。 度应该控制在 ______ 物质 沸点/℃
H2 -252
N2 -195.8
题型 1
海水资源的利用
1.(2012 年广东肇庆)某食盐样品中含有少量沙土、氯化钙 和氯化镁。以下是除去食盐样品中沙土、氯化钙和氯化镁的实验 流程。
根据流程图回答: (1)操作Ⅰ的名称是______ 过滤 ,加入的试剂 A 是
碳酸钙(或 CaCO3) 。 碳酸钠(或 Na2CO3) ,沉淀是___________________ __________________
题型 2 空气资源——合成氨工艺流程 [例 3](2012 年广东佛山)合成氨是人类科学技术上的一项重 大突破,对社会发展与进步做出了巨大贡献。合成氨的工艺流程 图如下:
广东省九年级化学总复习专题三 工艺流程

班级:____________ 姓名:____________专题三 工艺流程类型1 物质制备1.氧化锌软膏可用于急性或亚急性皮炎、湿疹、痱子及轻度、小面积的皮肤溃疡,其有效成分氧化锌(ZnO)是一种白色固体。
一种工业生产药用高纯氧化锌的流程如图:(1)“酸溶”的目的是将锌块转化为可溶于水的__________(填名称)。
(2)由草酸铵推测草酸的化学式为____________。
“沉淀”过程中发生反应的化学方程式为______________________________________________________。
(3)溶液X 结晶所得化肥是该工艺中有价值的副产品,证明它是铵态氮肥的方法是:取少量样品,先放入________(填仪器名称)中,然后再与________(填化学式)混合、研磨,能闻到氨味。
(4)“操作B ”是高温灼烧,该过程除生成氧化锌外,还会生成两种常见的气体氧化物,则草酸锌分解的化学方程式为________________________________________。
2.(2019烟台)我国煤炭资源丰富。
某实验室设计的利用水煤浆(由煤和水混合而成)制备氢气的生产工艺如流程一所示。
【流程一】制备氢气。
(1)气化器中发生的主要反应有:Ⅰ.H 2O +C=====高温 CO +H 2;Ⅱ.CO +H 2O=====高温CO 2+H 2,其中属于置换反应的是______(填“Ⅰ”或“Ⅱ”)。
(2)重整器的作用是________________________________。
重整器中发生反应的化学方程式是__________________________。
(3)该流程中可以循环使用的物质是________________。
【流程二】为充分利用流程一产生的高纯度CO 2,该实验室又设计了如流程二所示的两种工艺分别制备尿素和乙二醇。
(4)在高温、高压下,CO 2和NH 3可以合成尿素[CO(NH 2)2],同时生成水,该反应的化学方程式为____________________________________________________。
2024年中考化学专题复习课件:专题三-工艺流程题(共35张PPT)教育精品

_2__N__H_4_N__O__3_+__C_a__(_O_H__)_2_=__C_a_(_N__O__3_)_2_+__2_H__2_O__+__2_N__H__3_↑_。
专题演练
命题点3: 3.(2017·北京) 超细碳酸钙可用于生产钙片、牙膏等产品。 利用碳化法生产超细碳酸钙的主要流程示意如下:
CD A.吸收塔、制碱塔中发生反应属于氧化还原反应 B.制碱釜中的反应物Na2SO3作氧化剂 C.氧化塔中发生的反应属于氧化还原反应 D.氧化塔中的反应物CaSO3作还原剂 (4)生产流程中生成的_______________可循环利用,节约成本
NaOH(或烧碱溶液) 。
专题演练 8.(2017·成都)轧制钢材的主要流程如下图:
重难点突破
【思路点拔】 (1)碱式碳酸铜的俗称铜绿,过滤中要用到的玻 璃仪器:烧杯、漏斗和玻璃棒;(2)铜绿和稀硫酸反应生成硫 酸铜和水还有二氧化碳,氧化铁和稀硫酸反应生成硫酸铁和 水,硫酸过量;(3)方法Ⅰ中产生二氧化硫,二氧化硫是有毒 气体会污染空气;方法Ⅱ通入空气是铜、稀硫酸和氧气反应 生成硫酸铜和水,方法Ⅱ环保;冷却饱和溶液得到硫酸铜晶 体先浓缩得到饱和溶液再冷却饱和溶液即可。
重难点突破
举一反三 (2016·湘潭)某兴趣小组的同学从实验收集到一桶含有FeSO4 、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体, 设计了如下操作方案,结合方案回答下列问题:
重难点突破
举一反三 (1)固体A中含有____F_e_____和____C__u____,无色气体X为 ____H__2____(均填化学式)。 (2)步骤①中反应的化学方程式为_F_e_+__C__u_S__O_4_=__F_e_S__O__4+___C_u_, 该反应属于四种基本类型中的___置__换_____反应。 (3)操作a的名称为___过__滤_____,在该操作中用到了玻璃棒其作 用为__引___流____。
广东省中考化学复习第二部分专题提升专题三工艺流程图题试题
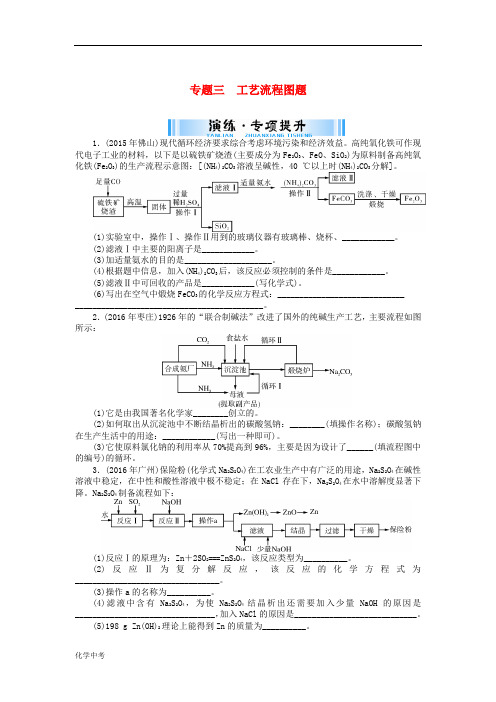
专题三工艺流程图题1.(2015年佛山)现代循环经济要求综合考虑环境污染和经济效益。
高纯氧化铁可作现代电子工业的材料,以下是以硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解]。
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、____________。
(2)滤液Ⅰ中主要的阳离子是____________。
(3)加适量氨水的目的是____________________。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是____________。
(5)滤液Ⅱ中可回收的产品是____________(写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式:________________________________________________________________________。
2.(2016年枣庄)1926年的“联合制碱法”改进了国外的纯碱生产工艺,主要流程如图所示:(1)它是由我国著名化学家________创立的。
(2)如何取出从沉淀池中不断结晶析出的碳酸氢钠:________(填操作名称);碳酸氢钠在生产生活中的用途:____________(写出一种即可)。
(3)它使原料氯化钠的利用率从70%提高到96%,主要是因为设计了______(填流程图中的编号)的循环。
3.(2016年广州)保险粉(化学式Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在NaCl存在下,Na2S2O4在水中溶解度显著下降。
Na2S2O4制备流程如下:(1)反应Ⅰ的原理为:Zn+2SO2===ZnS2O4,该反应类型为__________。
(2)反应Ⅱ为复分解反应,该反应的化学方程式为_________________________________。
广东省中考化学总复习专题3工艺流程优化训练

专题三工艺流程类型1 物质制备1.(南宁)碳酸钡是一种重要的化工产品,某厂用含二氧化硅杂质的碳酸钡原料生产碳酸钡产品,采用了以下的工艺流程:(1)为节约成本,过程中的生成物可直接应用于流程的是________________,加入过量的盐酸的目的是____________________________________。
(2)向氯化钡溶液中加入过量的氢氧化钾并通入二氧化碳,其中一种产物是碳酸钡,写出该反应的化学方程式:____________________________________________。
(3)溶液A中溶质的成分,可能的组合有________________________________。
(4)操作3包括的两个操作是____________________。
2.(南通)实验室以MnO2为原料制备少量高纯MnCO3的流程如下:已知:①反应Ⅰ的化学方程式:MnO2+SO2=== MnSO4;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100 ℃时开始分解。
(1)反应Ⅰ属于基本反应类型中的____________反应。
(2)流程中“操作”的名称为____________,所需要的主要玻璃仪器有_______________________________________________________________________。
(3)反应Ⅱ的化学方程式为_____________________________________________,该反应需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有______________(填化学式)。
(4)验证MnCO3粗产品表面附着有Na2SO4杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的______________(填化学式)溶液,有白色沉淀产生。
(5)为获得高纯MnCO3,需选择“低温”干燥的原因是_______________________________________________________________。
广东省中考化学复习 专题三 工业流程图题课件

根据流程图回答:
(1)操作Ⅰ的名称是__过__滤__,加入的试剂 A 是
__碳__酸__钠__(或___N_a_2_C_O__3)_,沉淀是__碳__酸__钙__(或___C_a_C__O_3_) __。 (2)写出 NaOH 与杂质反应的化学方程式: __2_N_a_O_H__+__M__g_C_l_2=_=_=__M_g_(_O__H_)_2↓_+__2_N__a_C_l______________; (3)加入试剂 B 的目的是__除__去__N__a_O_H__和__N__a_2C__O_3_______; (4)蒸发结晶时用到玻璃棒的作用是: ___搅__拌__,__防__止__局__部__过__热__导__致__液__体__飞__溅____________。
过程中,_电___能转化为__化__学__能。海水本身就是含有 MgCl2 的溶 液 , 它 与 通 过 步 骤 ① 、 ② 得 到 的 MgCl2 溶 液 有 何 不 同 : _后__者__是__经__过__富__集__和__分__离__后__的__溶__液__(_或__海__水__中__含__有__氯__化__钠__等__多__种_____ _溶__质__,__氯__化__镁__的__浓__度__很__低__)________________________________。
答案:(1)> MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2 (2)过滤 NaOH (3)CaCl2
•1、纪律是集体的面貌,集体的声音,集体的动作,集体的表情,集体的信念。 •2、知之者不如好之者,好之者不如乐之者。 •3、反思自我时展示了勇气,自我反思是一切思想的源泉。 •4、在教师手里操着幼年人的命运,便操着民族和人类的命运。一年之计,莫如树谷;十年之计,莫如树木;终身之计,莫如树人。 •5、诚实比一切智谋更好,而且它是智谋的基本条件。 •6、做老师的只要有一次向学生撒谎撒漏了底,就可能使他的全部教育成果从此为之失败。2022年1月2022/1/252022/1/252022/1/251/25/2022 •7、凡为教者必期于达到不须教。对人以诚信,人不欺我;对事以诚信,事无不成。2022/1/252022/1/25January 25, 2022 •8、教育者,非为已往,非为现在,而专为将来。2022/1/252022/1/252022/1/252022/1/25
广东2019年中考化学备考复习课件 专题训练03专题三 化学工艺流程题(类型3)

过滤 。为了提高废弃固体的反应速率,除 (1)操作I是________ 将固体粉碎、提高温度外,还可以采取的具体措施有______ 通入 _____________ 足量的氯气 (写一条)。
考点解读
解析:( )铁能与硫酸铁反应,生成硫酸亚铁,铁和 ( 2)写出4 FeS 2在空气中灼烧的化学方程式:_________ 高温 硫酸铜反应生成硫酸亚铁和铜,所以固体 D中含有铁和 4FeS2+11O2 2Fe2O3+8SO2 。 ____________________________ 铜,加入 y 后得到硫酸亚铁溶液和铜,所以试剂 y的作用 H SO 、 CuSO 、 Fe (SO ( 3 )溶液 C 中的溶质有 ____________________________ 2 4 4 2 4)3 解析:(2)二硫化亚铁和氧气在点燃的条件下生成氧 是:将铁、铜分离出来。 (用化学式表示)。 化铁和二氧化硫 将铁、铜分离出来 ( 4)试剂3 y)固体 的作用是 ____________________________ 。 解析:( B含有氧化铜、氧化铁,氧化铁和硫酸 反应生成硫酸铁,氧化铜和硫酸反应生成硫酸铜,所以 溶液C中的溶质有H2SO4、CuSO4、Fe2(SO4)3。
考点解读
(2)溶解步骤中同时发生的三个化学方程式为 Fe 2O3+3H2SO4 == Fe2(SO4)3+3H2O Fe+Fe2(SO4)3 === 3FeSO4、 __________________________ 、 _________________________ Fe+H2SO4 == FeSO4+H2↑ 。 (3)将所得FeSO4溶液在氮气环境中蒸发浓缩、降温结晶 _______、 过滤,得到FeSO4晶体,其中氮气的作用是____________ 防止硫酸 __________________ 。 亚铁被氧化 (4)政府倡导垃圾分类,其好处是_________ 保护环境 (写一点)。
(广东专版)中考化学总复习 第七部分 专题三 物质制备的工艺流程题型名师精编课件

广东优秀试题精选检测
1.(2016·广东省)甲班学生做完实验室制取氧气和还原 金属氧化物的实验后,剩余物质倒入同一废液缸里。乙 班课外兴趣小组同学进行了如图所示的探究。请回答:
广东优秀试题精选检测
(1)步骤①的操作名称是__过__滤__,所用到的玻璃仪器有 漏斗、玻璃棒和_烧__杯___。 (2)由步骤②实验现象推知,甲班同学制取氧气所用的 固体反应物是_K_C__lO__3(写化学式)。 (3)由步骤④所得溶液加入氢氧化钠可得红棕色沉;_6_N_a_O__H___2_F_e_(O__H_)2_+_3_N_a_2_SO_。4 (4)由步骤③产生的气体判断固体A中一定含有___碳____ (写名称);综合步骤③④现象推理,固体A中还可能含 有的物质是__F_e_2_O_3_、__M__n_O_2_(__或__“__F_e_、___M__n_O_2_”__或__“__F_e_、_ _F_e_2_O_3_、__M__n_O__2_”__)__(写至少两种物质的化学式)。 (5)根据上述实验和分析判断固体C是__M__n_O__2 _(写化 学式)。
6.(2017·青岛市)某混合气体中含有CO、CO2、SO2三种气体。 某兴趣小组对此进行了探究。
【查阅资料】
Ⅰ.SO2 能使品红溶液褪色;易与高锰酸钾溶液反应而被吸收; 能与氢氧化钠溶液反应;能使澄清的石灰水变浑浊。
Ⅱ.CO 和CO2均不能使品红溶液褪色,也不与高锰酸钾溶液反应。
Ⅲ.CO 与CuO 反应的化学方程式为:CO+CuO
(3)写出溶液B中加入熟石灰发生反应的化学方程式: ____M__g_C__l_+_C_a__(O__H__)2______M__g__(O__H__)2_↓_+_C__a_C__l2_______________。
【金牌中考】2019届中考化学:专题(3)工艺流程题ppt课件(含答案)

专题演练 命题点4: 4.(2017·雅安)钛和钛合金被认为是 21 世纪的重要金属材 料, 他们具有很多优良的性能, 如熔点高, 密度小, 可 塑性好等。以钛铁矿 (主要成分为 FeTiO3 , 同时含有少量 的 Fe2O3 、FeO等) 为原料制 TiO2 , 再由 TiO2 制金属 Ti 的工艺流程如下:
(3)两种方法比较,符合绿色化学要求的是方法____ Ⅱ ;方法Ⅱ
的化学方程式为:
O2 2H2O,操作 实验步骤 2Cu +2H2SO4+______= 2CuSO4 +______ 蒸发 ,降温结晶。 为:______
重难点突破
【思路点拔】 (1)碱式碳酸铜的俗称铜绿,过滤中要用到的玻 璃仪器:烧杯、漏斗和玻璃棒;(2)铜绿和稀硫酸反应生成硫
专题演练 命题点5: 6.(2016·德州)CO2是造成温室效应的主要气体,而工业上却 可用CO2来制备甲醛等物质,“碳捕捉技术”是指通过一定的
方法,将工业生产中产生的CO2分离出来并加以利用——如可
利用NaOH溶液来“捕捉”CO2,其过程如图所示(部分条件及 物质未标出)。
专题演练
请根据有关信息回答问题:
,请你把它写出来(用物质前的序号表示),第一种:
③①② 。 ③②① ;第二种:__________ ②③① ;第三种:__________ __________
(2)步骤Ⅳ的实验操作是__________ 蒸发结晶 。 (3)工业上电解饱和氯化钠溶液可制得烧碱,同时还有氯气和
Байду номын сангаас氢气生成。该反应的化学方程式为
重难点突破
(2015·广东)现有工厂丢弃的废铜屑(铜屑表面呈绿色,其中混 有少量生锈铁屑)。课外活动小组同学欲利用其制取胆矾,他 们设计了下面的两种制取流程。
广东中考化学专题复习 二轮 专题三工艺流程

专题三工艺流程工艺流程题一般以“生产工艺”或“实验操作流程”为情境,将化工生产过程中的主要生产阶段以生产流程呈现出来,并根据生产流程中有关的化学知识步步设问,形成与化工生产紧密联系的化工工艺试题。
中考中的工艺流程题主要是物质的制备和除杂。
工艺流程题常考的知识点有:物质成分的分析(推断某物质),化学反应原理(物质的除杂、化学方程式的书写等),操作步骤的名称及操作所需要的仪器等,绿色化学(物质的循环利用、废物处理、能量的充分利用等),工艺流程的评价等。
因此解答化学工艺流程题,除了必须要掌握物质的性质和物质之间相互作用的基本知识及分离、提纯物质的基本技能外,还要学会从题干中获取有用信息,了解生产的产品。
关注流程图中的出线、进线(均表示物料流向或操作流程)、可逆线(表示物质循环使用)和核心化学反应(如下所示)。
1.物质成分的分析(推断流程图中的某种物质等)(1)分析流程中的每一步骤,从几个方面解流程:①反应物是什么;②发生了什么反应;③图中有没有物质没有写上去或是省略了;④该反应造成了什么后果,对制造产品有什么作用。
(2)要判断所加的试剂,可以从加入试剂的目的、反应的产物入手进行分析。
(3)推断流程图中某一步中的物质,从上一步操作中反应物可能发生的反应入手进行分析,同时需注意所加试剂是否有剩余。
2.化学方程式的书写(1)根据流程图书写某步中发生反应的化学方程式:根据所学知识判断其可能发生的反应,然后写出反应物、产物,并进行配平。
(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物);若从已知信息中找出的反应物和生成物不满足质量守恒定律,可以在反应物或生成物中加上水,然后进行配平,还应注意反应条件的有关信息;若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
3.混合物分离、提纯的操作及所需仪器的判断(1)固体和液体混合物的分离:过滤。
其所需的仪器有铁架台、漏斗、烧杯、玻璃棒、滤纸。
中考化学二轮专题复习---题型三工艺流程图题

工业上以石灰石(含有SiO2.Fe2O3等杂质)为原料,生产氯化钙的流程如图所示。
______________________、_______________________________
_____________________。
______________。
(2)反应器中发生反应的化学方程式是SO2 + 2X + I2=== H2SO4 (5)成品纸张在保存过程中应避免与酸接触,若遇到稀盐酸,则可能发生反应的化学方程式为____________________________
4. (2021广东黑白卷)碳酸镁是常用的化工原料,某工厂用镁矿 石(主要成分为MgCO3,杂质不溶于酸且不与酸反应)为原料制 取氧化镁。反应的具体流程如图所示,据此回答相关问题:
(1)操作1的名称是_过__滤____。
(2)向镁矿石中加入过量稀硫酸的目的是_使__镁__矿__石__中__的__碳__酸__镁__完_
分离提纯类 1. 同学们完成实验后留下的废液中含有Cu(NO3)2.NaCl、KNO3 和K2SO4四种物质,在老师的指导下,化学小组的同学设计如 图1的流程回收KNO3晶体。请回答:
图1
(1)步骤①的目的是除去Cu(NO3)2, 则X的化学式为__K_O__H_, 发生 反应的化学方程式为___C_u_(_N__O_3_)2_+__2_K__O_H__=_=_=__C_u_(_O_H__)_2↓__+___ _2_K_N__O_3_。
图1
图2
2. (2021宜宾)氯化钠既是一种重要的调味品,又是重要的化工原 料。工业上以粗盐(主要成分为NaCl,含有少量 MgCl2.CaCl2.Na2SO4和泥沙)为原料制备较纯的NaCl晶体的流 程如下图。
广东省中考化学总复习专题三工艺流程练习

专题三工艺流程工艺流程题一般以“生产工艺”或“实验操作流程”为情境,将化工生产过程中的主要生产阶段以生产流程呈现出来,并根据生产流程中有关的化学知识步步设问,形成与化工生产紧密联系的化工工艺试题。
中考中的工艺流程题主要是物质的制备和除杂。
工艺流程题常考的知识点有:物质成分的分析(推断某物质),化学反应原理(物质的除杂、化学方程式的书写等),操作步骤的名称及操作所需要的仪器等,绿色化学(物质的循环利用、废物处理、能量的充分利用等),工艺流程的评价等。
因此解答化学工艺流程题,除了必须要掌握物质的性质和物质之间相互作用的基本知识及分离、提纯物质的基本技能外,还要学会从题干中获取有用信息,了解生产的产品。
关注流程图中的出线、进线(均表示物料流向或操作流程)、可逆线(表示物质循环使用)和核心化学反应(如下所示)。
1.物质成分的分析(推断流程图中的某种物质等)(1)分析流程中的每一步骤,从几个方面解流程:①反应物是什么;②发生了什么反应;③图中有没有物质没有写上去或是省略了;④该反应造成了什么后果,对制造产品有什么作用。
(2)要判断所加的试剂,可以从加入试剂的目的、反应的产物入手进行分析。
(3)推断流程图中某一步中的物质,从上一步操作中反应物可能发生的反应入手进行分析,同时需注意所加试剂是否有剩余。
2.化学方程式的书写(1)根据流程图书写某步中发生反应的化学方程式:根据所学知识判断其可能发生的反应,然后写出反应物、产物,并进行配平。
(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物);若从已知信息中找出的反应物和生成物不满足质量守恒定律,可以在反应物或生成物中加上水,然后进行配平,还应注意反应条件的有关信息;若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
3.混合物分离、提纯的操作及所需仪器的判断(1)固体和液体混合物的分离:过滤。
其所需的仪器有铁架台、漏斗、烧杯、玻璃棒、滤纸。
广东省中考化学工艺流程题归纳

(2018广东)(8分)孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。
现以孔雀石为原料制取胆矾(CuSO4•5H2O)的部分工艺流程如图。
请回答:(1)滤渣b的化学式为。
(2)溶液c中的溶质有(写化学式):H2SO4、、。
(3)盐溶液d的颜色为;实验室蒸发溶液时用到的玻璃仪器有(写1种)(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=CaCO3↓+2X,X的名称为;孔雀石与稀硫酸反应生成气体a的化学方程式为。
(2017广东)(9分)某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程见如图:资料1:垃圾焚烧产生的烟气中含有SO2等有害气体.资料2:FeSO4容易被空气中的O2氧化.回答下列问题:(1)石灰浆吸收SO2(性质与CO2相似)的化学反应方程式为.(2)溶解步骤中同时发生的三个化学反应方程式为Fe+Fe2(SO4)3=3FeSO4 、____________________________________________________________(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、____ 、过滤,得到FeSO4晶体,其中氮气的作用是.(4)政府倡导垃圾分类,其好处是(写一点):.(2016广东)(9分)甲班学生做完实验室制备氧气和还原金属氧化物的实验后,剩余物质倒入同一废液缸里。
乙班课外兴趣小组同学进行了如图所示的探究。
(二氧化锰在常温下不和酸反应)请回答:(1)步骤①的操作名称是,所用到的玻璃仪器有漏斗、玻璃棒和。
(2)由步骤②实验现象推知,甲班同学制取氧气所用的固体反应物是(写化学式)。
(3)由步骤④所得溶液加入氢氧化钠可得红棕色沉淀,该反应的化学方程式为。
(4)由步骤③产生的气体判断固体A中一定含有(写名称);综合步骤③④现象推理,固体A中还可能含有的物质是(写至少两种物质的化学式)。
2024年中考化学总复习 特色专题专训 题型三 工艺流程图题 (含解析)

题型三工艺流程图题基础作业1.铝是一种重要金属,从铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)中冶炼Al的工业生产流程如图所示:(1)操作Ⅰ的名称是。
(2)溶液A中含有的阳离子为Al3+、Fe3+和 (填离子符号)。
(3)电解氧化铝时还会生成一种气体,该反应的化学方程式为。
(4)溶液C中含有Na2CO3,则该生产流程中可循环使用的物质除NaOH外,还有、。
2.某化学活动小组在实验室以MnO2固体为原料制取少量MnCO3,基本流程如下:已知:MnSO4可溶于水;MnCO3难溶于水且在100 ℃时开始分解。
(1)操作a的名称为。
(2)反应①中生成物只有MnSO4,该反应的化学方程式为。
(3)产品MnCO3(Ⅱ)比MnCO3(Ⅰ)更纯净,原因是产品MnCO3(Ⅰ)经过洗涤、烘干以后,除去了表面附着的和。
(4)烘干MnCO3时需要控制的条件是。
3.某同学以金泥(含有Au、CuS、ZnS等)为原料制备Au和Cu的流程如图所示:已知:①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将Cu、Zn转化为氧化物,并完全分离出ZnO烟尘。
(1)“预处理”中会产生SO2,若SO2直接排放,会导致。
(2)“过程Ⅱ”产生的固体a中,除CuO外一定还有的物质是。
(3)“过程Ⅲ”分离Au的操作是 ,加入过量稀硫酸的目的是。
(4)“系列进程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为 ,该反应属于 (填写基本反应类型)。
(5)ZnO烟尘可用NaOH溶液吸收,该反应生成偏锌酸钠(Na2ZnO2)和H2O的化学方程式为。
4.硫酸锌可制备各种含锌材料,在防腐、医学上有很多应用。
菱锌矿的主要成分是ZnCO3,还含有少量的二氧化硅和氧化铁。
以菱锌矿为原料制备ZnSO4·7H2O的工艺流程如下图所示。
(二氧化硅难溶于水,也不与稀硫酸反应)ZnSO4·7H2O回答下列问题:(1)菱锌矿属于 (选填“纯净物”或“混合物”)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
广东省中考化学总复习专题三工艺流程练习工艺流程题一般以“生产工艺”或“实验操作流程”为情境,将化工生产过程中的主要生产阶段以生产流程呈现出来,并根据生产流程中有关的化学知识步步设问,形成与化工生产紧密联系的化工工艺试题。
中考中的工艺流程题主要是物质的制备和除杂。
工艺流程题常考的知识点有:物质成分的分析(推断某物质),化学反应原理(物质的除杂、化学方程式的书写等),操作步骤的名称及操作所需要的仪器等,绿色化学(物质的循环利用、废物处理、能量的充分利用等),工艺流程的评价等。
因此解答化学工艺流程题,除了必须要掌握物质的性质和物质之间相互作用的基本知识及分离、提纯物质的基本技能外,还要学会从题干中获取有用信息,了解生产的产品。
关注流程图中的出线、进线(均表示物料流向或操作流程)、可逆线(表示物质循环使用)和核心化学反应(如下所示)。
1.物质成分的分析(推断流程图中的某种物质等)(1)分析流程中的每一步骤,从几个方面解流程:①反应物是什么;②发生了什么反应;③图中有没有物质没有写上去或是省略了;④该反应造成了什么后果,对制造产品有什么作用。
(2)要判断所加的试剂,可以从加入试剂的目的、反应的产物入手进行分析。
(3)推断流程图中某一步中的物质,从上一步操作中反应物可能发生的反应入手进行分析,同时需注意所加试剂是否有剩余。
2.化学方程式的书写(1)根据流程图书写某步中发生反应的化学方程式:根据所学知识判断其可能发生的反应,然后写出反应物、产物,并进行配平。
(2)陌生化学方程式的书写:根据箭头方向,箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物);若从已知信息中找出的反应物和生成物不满足质量守恒定律,可以在反应物或生成物中加上水,然后进行配平,还应注意反应条件的有关信息;若在空气中煅烧或通入空气则还需考虑空气中的氧气是否参与反应。
3.混合物分离、提纯的操作及所需仪器的判断(1)固体和液体混合物的分离:过滤。
其所需的仪器有铁架台、漏斗、烧杯、玻璃棒、滤纸。
(2)从物质的溶液中得到该物质的晶体常用的方法:①蒸发结晶(具体操作见粗盐的提纯)。
②降温结晶,操作过程为蒸发浓缩→冷却结晶→过滤→洗涤→干燥。
4.判断能够回收利用或可循环使用的物质(1)回收利用的物质:若流程图中的原料在生产中以副产物的形式产生,则可将其进行回收利用。
(2)循环使用的物质:步骤中一步的产物是另一步的原料,根据上图中箭头方向(可逆线)即可判断出可循环使用的物质。
5.工艺流程的评价(1)设计方案的科学性:能否达到实验目的,杂质是否完全除去、是否引入新的杂质等。
(2)安全性和简便性:尽量选用较温和的反应条件,避免高温、高压条件。
(3)对环境的影响:是否符合绿色化学理念。
(4)节约性:原料利用率要尽量高。
注:绿色化学又称环境友好化学,它的主要特点是:①充分利用资源和能源,采用无毒、无害的原料;②在无毒、无害的条件下进行反应,以减少废物向环境排放;③提高原子的利用率,力图使所有作为原料的原子都被产品所消纳,实现“零排放”;④生产出有利于环境保护、社区安全和人体健康的环境友好的产品。
类型一物质制备(实验室模拟、工业生产等) (xx、xx、xx、xx考)例1 (xx南通)实验室以MnO2为原料制备少量高纯MnCO3的流程如下:已知:①反应Ⅰ的化学方程式:MnO2+SO2=== MnSO4;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100 ℃时开始分解。
(1)反应Ⅰ属于基本反应类型中的__________反应。
(2)流程中“操作”的名称为__________,所需要的主要玻璃仪器有______________。
(3)反应Ⅱ的化学方程式为_________________________。
反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有____________________(填化学式)。
(4)验证MnCO3粗产品表面附着有Na2SO4杂质:取样品少许,向其中加入水,搅拌、过滤,向滤液中加入适量的____________________(填化学式)溶液,有白色沉淀产生。
(5)为获得高纯MnCO3,需选择“低温”干燥的原因是___________________________。
例2 (xx广州)氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。
已知CuCl难溶于水和乙醇,在潮湿空气中易变质。
CuCl的制备流程如下:(1)“滤液1”中除了Na+、SO2-4外,还存在较多的离子是__________(写离子符号)。
(2)“反应”中发生的化学变化是2CuCl2+Na2SO3=== 2CuCl↓+2NaCl+SO3,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为__________________________。
(3)“操作a”的名称是__________,流程中可以循环利用的物质(水除外)是__________(写化学式)。
(4)可用“水洗”的原因是______________________________,“醇洗”的目的是_________________________________。
(5)160 g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是______________________________。
例3 (xx陕西改编)我国每年报废的手机超过1亿部。
废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,化学兴趣小组为回收其中的铜,设计并进行了如下实验:已知:Cu+H2O2+H2SO4=== CuSO4+2H2O;不考虑金、银发生类似反应。
(1)将电路板粉碎成粉末的目的是__________________________。
(2)步骤①所得滤液中的溶质除硫酸外,还有____________________________。
(3)步骤②中的实验现象:固体部分溶解,__________________。
(4)步骤④中反应的化学方程式是_____________________________。
(5)对废旧手机中的金属加以回收的意义是___________________(写一条)。
例4 (xx广东)现有工厂丢弃的废铜屑(铜屑表面呈绿色,其中混有少量生锈铁屑)。
课外活动小组同学欲利用其制取胆矾,他们设计了下面的两种制取流程。
已知:Cu+Fe2(SO4)3=== 2FeSO4+CuSO4。
请回答:(1)铜屑表面呈绿色的物质的化学式是Cu2(OH)2CO3,俗称________;操作①所用到的玻璃仪器有:烧杯、玻璃棒和________。
(2)溶液A的溶质有____________(只写一种);铁锈与稀硫酸反应的化学方程式为_______________________________________。
(3)两种方法比较,符合绿色化学要求的是方法__________;方法Ⅱ的化学反应方程式为:2Cu+2H2SO4+________=== 2CuSO4+________;操作②的实验步骤为:________、降温结晶。
类型二分离提纯 (xx、xx、xx考)例5 (xx德州改编)CO2是造成温室效应的主要气体,而工业上却可用CO2来制备甲醛等物质,“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来并加以利用——如可利用NaOH溶液来“捕捉”CO2,其过程如图所示(部分条件及物质未标出)。
请根据有关信息回答问题:(1)用NaOH溶液“捕捉”CO2的化学方程式是________________________________。
(2)“反应分离”环节中,分离物质所采用的基本操作是__________。
(3)此化学工艺流程中没有涉及到的基本反应类型是________________。
(4)整个过程中,可以循环利用的物质是__________和__________。
例6 (xx兰州改编)粗盐中MgCl2、CaCl2等杂质,提纯粗盐的工艺流程如图所示:回答下列问题:(1)氢氧化钠有强烈的腐蚀性,如果不慎沾到皮肤上,要用大量的水冲洗,再涂上__________。
(2)步骤①中发生反应的化学方程式为________________________________,步骤②加入过量的碳酸钠溶液的作用是________________________。
(3)操作a的名称是__________。
(4)步骤④中,要用玻璃棒不断搅拌,其目的是________________________________。
类型三环保相关 (xx、xx、xx考)例7 (xx广东)某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如下图:资料1: 垃级焚烧产生的烟气中含有SO2等有害气体。
资料2:FeSO4容易被空气中的O2氧化。
回答下列问题:(1)石灰浆吸收SO2(性质与CO2相似)的化学反应方程式为_______________________。
(2)溶解步骤中同时发生的三个化学反应方程式为:Fe+Fe2(SO4)3=== 3FeSO4、_________________________、__________________________。
(3)将所得FeSO4溶液在氮气环境中蒸发浓缩、__________、过滤,得到FeSO4晶体,其中氮气的作用是___________________________________。
(4)政府倡导垃圾分类,其好处是__________________________(写一点)。
注:领跑化学xx版课时作业P50第10题与该题基本一样。
例8 某烟气脱硫的工艺不仅能消除SO2,还能将其转化为石膏(CaSO4·2H2O)等产品,实现“变废为宝”。
主要物质转化关系如图1所示:图1图2(1)设备1中,通过喷淋水脱去烟气中的SO2,该反应的化学方程式为__________________________,若将烟气直接排放到空气中,可能会导致的环境问题是__________。
(2)设备2中,加入CaCO3的目的是_______________________________。
(3)设备3中反应的化学方程式是_______________________________。
(4)有一工厂为防治SO2的污染,另外设计了一种治污方法,不仅吸收了二氧化硫,同时也得到了硫酸等工业产品,该工艺流程如图2所示。
①Fe2(SO4)3吸收SO2的化学方程式是:Fe2(SO4)3+2__________+SO2=== 2FeSO4+2H2SO4。
②该流程中可循环利用的物质是__________________。
专题三工艺流程例1 (1)化合(2)过滤漏斗、玻璃棒、烧杯(3)MnSO4+2NaHCO3=== Na2SO4+MnCO3↓+CO2↑+H2O Mn(OH)2(4)BaCl2(5)MnCO3的分解温度为100 ℃,为防止MnCO3高温分解,影响高纯MnCO3的纯度例2 (1)Cu2+、Cl-(2)SO3+H2O=== H2SO4(3)过滤NaCl (4)能够除去可溶性杂质可以除去水,防止在后续步骤中CuCl变质(5)99.5【解析】(5)160 g CuSO4中铜元素质量为160 g×64160×100%=64 g,反应过程中硫酸铜的铜元素完全转化到了氯化亚铜中,因此足量NaCl经上述制备流程,可生成的CuCl最多为64 g÷(64×100%)=99.5 g。
